Sabit hacimde gerçekleşen sürece ne denir? termodinamik nedir
Çevrenin etkisi altında bir durumdan diğerine geçiş sırasında bir termodinamik sistemin durumundaki değişikliklere termodinamik süreç denir.
Bir gazın kütlesi boyunca her bir parametresinin aynı değere sahip olduğu duruma denge durumu denir.
Termodinamik süreçler denge ve denge dışı olabilir.
Bir denge süreci, denge durumlarından geçen bir süreçtir, yani. gaz parametreleri (özgül hacim, basınç ve sıcaklık) hacmin tüm noktalarında aynı olduğunda. Denge süreçleri sonsuz yavaş ilerler ve sonsuz sayıda denge durumundan oluşur ve herhangi bir zamanda çalışan gövde ile çevreçevre ve çalışma sıvısı arasında bir denge kurulur, sıcaklık ve basınçtaki fark sonsuzdur. Herhangi bir andaki denge süreçleri, ana parametrelerin sabit değerlerine sahiptir, bu nedenle diyagramlar (PV, TS diyagramları) kullanılarak grafiksel olarak gösterilebilirler.
Gerçek süreçler dengede değildir. Gerçek süreçlerin tekdüze olmaması, her şeyden önce, dış koşulların etkisi altında sonlu hızlarda ilerledikleri ve denge durumunun çalışma gövdesinde (tüm süreç boyunca durum parametreleri) kurulacak zamana sahip olmadığı gerçeğiyle belirlenir. gazın kütlesi aynı değildir).
Termodinamik öncelikle bir gazın durumunu değiştirmenin denge durumlarını ve denge süreçlerini dikkate alır. Denge süreçleri tersinirlik özelliğine sahiptir, yani ters yön doğrudan sürecin tüm durumları aracılığıyla.
Tersinir süreçler, aynı denge durumlarının kendileri boyunca hem ileri hem de zıt yönde ilerleyen süreçlerdir. Aynı zamanda bunların sonunda sistemin kendisinde veya ortamında hiçbir değişiklik kalmaz.
İşlemlerin tersine çevrilebilirliği için ana koşullar şunlardır:
Harici tersinirlik koşulu, termal ve mekanik dengenin varlığıdır, yani. çalışma sıvısının ve ortamın sıcaklık ve basınçlarının eşitliği;
Dahili tersine çevrilebilirlik koşulu, sürtünme, difüzyon ve diğer tek taraflı olarak yönlendirilen süreçlerin olmamasıdır.
Isı makinelerinde ve aygıtlarında, işlemler kaynak ve çalışma akışkanı arasında sonlu bir sıcaklık farkıyla ilerler, bu nedenle bu tür işlemler geri döndürülemez. Karasal koşullarda tüm gerçek süreçler geri döndürülemez.
Hal değişimi süreçlerini karakterize eden termodinamikteki tüm analitik bağımlılıklar, ters süreçlere atıfta bulunur. Tersinir süreçlerden gerçek, geri döndürülemez olanlara geçiş, gerçek süreçlerin tersinir olanlardan sapmalarını hesaba katan ampirik katsayılar getirilerek gerçekleştirilir.
Termodinamik, inceleyen bilimdir termal olaylar onları maddenin moleküler yapısına bağlamadan cisimlerde meydana gelir.
Termodinamikte, kabul edilir ki vücuttaki tüm termal süreçler sadece makroskopik parametrelerle karakterize edilir- basınç, hacim ve sıcaklık. Ve tek tek moleküllere veya atomlara uygulanamayacakları için, moleküler-kinetik teorinin aksine, termodinamikte bir maddenin termal işlemlerde moleküler yapısı dikkate alınmaz.
Termodinamiğin tüm kavramları, deneyler sırasında gözlemlenen gerçeklerin bir genellemesi olarak formüle edilir. Bu nedenle, fenomenolojik (tanımlayıcı) ısı teorisi olarak adlandırılır.
termodinamik sistemler

Termodinamik, makroskopik sistemlerde meydana gelen termal süreçleri tanımlar. Bu tür sistemler çok sayıda parçacıktan - moleküllerden ve atomlardan oluşur ve bunlara termodinamik denir.
termodinamik sistem görülebilen herhangi bir nesne olarak kabul edilebilir çıplak göz veya mikroskoplar, teleskoplar ve diğer optik aletlerin yardımıyla. Ana şey, sistemin uzaydaki boyutlarının ve varlığının zamanının, parametrelerini ölçmeyi mümkün kılmasıdır - sıcaklık, basınç, kütle, kimyasal bileşim tek tek moleküllerin etkilerine cevap vermeyen cihazlar (basınç göstergeleri, termometreler, vb.) kullanan elemanlar vb.
Kimyagerler için bir termodinamik sistem, süreçte birbirleriyle etkileşime giren kimyasalların bir karışımıdır. Kimyasal reaksiyon. Astrofizikçiler böyle bir sistemi arayacak göksel vücut. bir araba motorunda yakıt ve hava karışımı Toprak, vücudumuz, bir yazı kalemi, bir defter, bir takım tezgahı vb. de termodinamik sistemlerdir.
Her termodinamik sistem, çevreden sınırlarla ayrılır. Gerçek olabilirler - bir test tüpünün cam duvarları kimyasal, motordaki silindir gövdesi vb. Ve koşullu olabilirler, örneğin atmosferde bir bulut oluşumunu incelediklerinde.
Böyle bir sistem ile değiştirilmezse dış ortam ne enerji ne de madde denir yalıtılmış veya kapalı .
Sistem dış ortamla enerji alışverişi yapıyor ancak madde alışverişi yapmıyorsa buna denir. kapalı .
sistemi aç çevre ile enerji ve madde alışverişi yapar.
termodinamik denge

Bu kavram aynı zamanda termodinamiğe deneysel sonuçların genelleştirilmesi olarak dahil edilmiştir.
termodinamik denge sistem izole edilirse, tüm makroskopik niceliklerinin - sıcaklık, basınç, hacim ve entropi - zamanla değişmediği böyle bir sistem durumu olarak adlandırılır. Tüm harici parametreler sabit kalırsa, herhangi bir kapalı termodinamik sistem kendiliğinden böyle bir duruma geçebilir.
Termodinamik dengedeki bir sistemin en basit örneği sıcak çaylı bir termostur. İçindeki sıcaklık, sıvının herhangi bir noktasında aynıdır. Her ne kadar bir termos sadece yaklaşık olarak izole edilmiş bir sistem olarak adlandırılabilir.
Herhangi bir kapalı termodinamik sistem, dış parametreler değişmezse kendiliğinden termodinamik dengeye girme eğilimindedir.
termodinamik süreç

Makroskopik parametrelerden en az biri değişirse, sistemin olduğunu söylerler. termodinamik süreç . Böyle bir süreç, harici parametreler değişirse veya sistem enerji almaya veya iletmeye başlarsa meydana gelebilir. Sonuç olarak, başka bir duruma geçer.
Bir termostaki çay örneğini düşünün. Çayın içine bir buz parçası batırıp termosu kapatırsak, hemen sıvının farklı kısımlarında sıcaklık farkı olacaktır. Termostaki sıvı, sıcaklıkları eşitleme eğiliminde olacaktır. Sıcaklığın yüksek olduğu yerlerden, sıcaklığın daha düşük olduğu yerlere ısı aktarılacaktır. Yani termodinamik bir süreç oluşacaktır. Sonunda termostaki çayın sıcaklığı tekrar aynı olacaktır. Ama zaten ilkinden farklı olacak ilk sıcaklık s. Sistemin durumu, sıcaklığı değiştiği için değişti.
Termodinamik süreç, sıcak bir günde kumsalda ısıtılan kumun gece soğumasıyla gerçekleşir. Sabaha, sıcaklığı düşer. Ancak güneş doğar doğmaz ısıtma işlemi yeniden başlayacaktır.
İçsel enerji

Termodinamiğin temel kavramlarından biri, içsel enerji .
Tüm makroskopik cisimler, vücudu oluşturan tüm parçacıkların (atomlar ve moleküller) kinetik ve potansiyel enerjilerinin toplamı olan iç enerjiye sahiptir. Bu parçacıklar sadece birbirleriyle etkileşime girer ve çevrenin parçacıkları ile etkileşime girmez. İç enerji kinetik ve potansiyel enerji parçacıklar ve vücudun konumuna bağlı değildir.
U = E k + E p
İç enerji sıcaklıkla değişir. Moleküler kinetik teori bunu madde parçacıklarının hareket hızını değiştirerek açıklar. Vücudun sıcaklığı yükselirse, parçacıkların hareket hızı artar, aralarındaki mesafe artar. Sonuç olarak, kinetik ve potansiyel enerjileri artar. Sıcaklık düştüğünde, ters işlem gerçekleşir.
Termodinamik için daha önemli olan miktar değildir. içsel enerji, ama onun değişimi. Ve iç enerjiyi ısı transferi işlemini kullanarak veya yaparak değiştirebilirsiniz. mekanik iş.
Mekanik işle iç enerjideki değişim

Benjamin Rumford
Bir cismin iç enerjisi, üzerinde mekanik iş yapılarak değiştirilebilir. Vücut üzerinde iş yapılırsa, mekanik enerji iç enerjiye dönüştürülür. Ve iş vücut tarafından yapılırsa, iç enerjisi mekanik enerjiye dönüştürülür.
neredeyse geç XIX yüzyılda, ısıyı vücuttan vücuda aktaran ağırlıksız bir madde - kalori olduğuna inanılıyordu. Vücuda ne kadar fazla kalori akarsa, o kadar sıcak olur ve bunun tersi de geçerlidir.
Bununla birlikte, 1798'de Anglo-Amerikan bilim adamı Kont Benjamin Rumford, kalori teorisinden şüphe etmeye başladı. Bunun nedeni, sondaj sırasında silah namlularının ısınmasıydı. Isınmanın nedeninin, matkabın namluya sürtünmesi sırasında yapılan mekanik iş olduğunu öne sürdü.
Ve Rumfourd bir deney yaptı. Sürtünme kuvvetini arttırmak için kör bir matkap aldılar ve namlunun kendisi bir su fıçısına yerleştirildi. Sondajın üçüncü saatinin sonunda namludaki su kaynamaya başladı. Bu, üzerinde mekanik çalışma yapıldığında namlunun ısı aldığı anlamına geliyordu.
Isı transferi
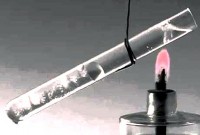
ısı transferi aranan fiziksel süreç termal enerjinin (ısı) bir vücuttan diğerine doğrudan temas veya ayırıcı bir bölme yoluyla aktarılması. Kural olarak, ısı daha sıcak bir vücuttan daha soğuk olana aktarılır. Bu süreç, sistem bir termodinamik denge durumuna geldiğinde sona erer.
Bir cismin ısı transferi sırasında aldığı veya verdiği enerjiye ne denir ısı miktarı .
Isı transferi yöntemine göre, ısı transferi 3 tipe ayrılabilir: termal iletkenlik, konvansiyonel, termal radyasyon.
Termal iletkenlik

Vücut veya vücut bölümleri arasında sıcaklık farkı varsa, bunlar arasında bir ısı transferi işlemi gerçekleşir. termal iletkenlik İç enerjinin daha fazla ısıtılmış bir cisimden (veya onun bir kısmından) daha az ısıtılmış bir cisme (veya onun bir kısmına) aktarılması süreci olarak adlandırılır.
Örneğin, bir çelik çubuğun bir ucunu ateşe vermek, bir süre sonra diğer ucunun da ısındığını hissedeceğiz.
Bir ucu sıcak olan bir cam çubuğu, kendimizi yakmadan diğer ucundan kolayca tutuyoruz. Ancak aynı deneyi bir demir çubukla yapmaya çalışırsak başarısız oluruz.
Farklı maddeler ısıyı farklı iletir. Her birinin kendi termal iletkenlik katsayısı, veya iletkenlik 1 saniyede 1 m2 alana sahip 1 m kalınlığındaki bir numuneden geçen ısı miktarına sayısal olarak eşittir. Sıcaklık birimi olarak 1 K alınmıştır.
Metaller ısıyı en iyi iletir. Bu onların günlük hayatta kullandığımız, metal tencere veya tavalarda yemek pişirdiğimiz özelliğidir. Ancak kulpları ısınmamalıdır. Bu nedenle, zayıf termal iletkenliğe sahip malzemelerden yapılırlar.
Sıvıların ısıl iletkenliği daha azdır. Ve gazların ısıl iletkenliği zayıftır.
Hayvan kürkü de zayıf bir ısı iletkenidir. Bu sayede sıcak havalarda aşırı ısınmazlar ve soğuk havalarda donmazlar.
ortak düşünce
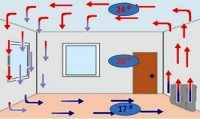
Geleneksel olarak, ısı jetler ve gaz veya sıvı akışları ile aktarılır. Katılarda bir konvansiyon yoktur.
Bir sıvıda bir konvansiyon nasıl ortaya çıkar? Ateşe bir su ısıtıcısı koyduğumuzda, sıvının alt tabakası ısınır, yoğunluğu azalır, yukarı doğru hareket eder. Yerini daha soğuk bir su tabakası alır. Bir süre sonra da ısınacak ve daha soğuk bir tabaka ile yer değiştirecektir. Vb.
Benzer bir süreç gazlarda meydana gelir. Isıtma pillerinin odanın dibine yerleştirilmesi tesadüf değildir. Sonuçta, ısıtılmış hava her zaman odanın üstüne çıkar. Ve alt, soğuk olan, tam tersine düşer. Daha sonra da ısınır ve tekrar yükselir, bu sırada üst tabaka soğur ve batar.
Sözleşme doğaldır ve mecburidir.
Doğal konvansiyon atmosferde sürekli gerçekleşir. Bunun bir sonucu olarak, sıcak hava kütlelerinin sürekli yukarı ve soğuk hava kütlelerinin aşağı doğru hareketleri vardır. Sonuç rüzgar, bulutlar ve diğer doğal olaylardır.
Doğal sözleşme yeterli olmadığında, zorunlu sözleşmeyi kullanırım. Örneğin, fan kanatları yardımıyla bir odada sıcak hava akar.
termal radyasyon

Güneş dünyayı ısıtır. Herhangi bir ısı transferi veya konvansiyon söz konusu değildir. Peki vücutlar neden ısınır?
Gerçek şu ki, Güneş bir termal radyasyon kaynağıdır.
termal radyasyon - bu Elektromanyetik radyasyon vücudun iç enerjisi tarafından üretilir. Etrafımızdaki tüm bedenler yayılıyor Termal enerji. Bu, bir masa lambasından gelen görünür ışık veya görünmez ultraviyole, kızılötesi veya gama ışınları kaynakları olabilir.
Ancak bedenler sadece ısı yaymaz. Onu da tüketirler. Bazıları daha büyük ölçüde, diğerleri daha az ölçüde. Ayrıca karanlık cisimler, aydınlık cisimlere göre hem daha hızlı ısınır hem de daha hızlı soğur. Sıcak havalarda, koyu renkli giysilere göre daha az ısı emdiği için açık renkli giysiler giymeye çalışırız. Güneşte koyu renkli bir araba, yanında duran açık renkli bir arabadan çok daha hızlı ısınır.
Maddelerin bu ısıyı farklı şekillerde emmesi ve yayması özelliği, gece görüş sistemleri, füze güdüm sistemleri vb. oluşturulmasında kullanılır.
Dış ortamın çalışma sıvısı (gaz, buhar) üzerindeki etkisinin bir sonucu olarak, örneğin sıkıştırma, genleşme, ısıtma vb. Durum parametreleri değişir.
Çalışan vücudun durumunun parametrelerindeki herhangi bir değişikliğe denir termodinamik süreç.
Yukarıda belirtildiği gibi, çalışma sıvısının denge ve denge dışı durumları vardır. Bir sistemin sürekli bir dizi denge durumundan geçtiği termodinamik sürece denir. denge. Çalışma sıvısının denge durumu için ana koşul, kütlesi boyunca sıcaklık ve basıncın eşitliğidir. Denge süreçleri tersine çevrilebilir.
Denge dışı süreçler sonlu bir hızla ilerleyen gerçek süreçler olarak adlandırılırken, sıkıştırma için harcanan iş bir denge sürecinden (sürtünme kuvvetleri, atalet, vb. nedeniyle) daha büyük olacaktır.
Denge dışı süreçler geri döndürülemez.
Termodinamik süreçleri incelerken kullanılırlar grafik görüntüler, özellikle, r ve J koordinat sisteminde, rJ diyagramı olarak adlandırılır.
Mutlak basınçlar r, ordinat ekseni boyunca çizilir ve apsis ekseni boyunca belirli gaz hacimleri çizilir. Bilinen r ve J değerleri için denge durumu bir nokta ile temsil edilir.
Şekil 1, keyfi bir denge sürecini göstermektedir. Gaz ilk durum 1'den son durum 2'ye geçtiğinde, basınçta bir azalma ve özgül hacimde bir artış olur. Bu, doğrudan bir süreç olarak kabul edilen bir genişleme sürecidir. Sıkıştırma işlemi (2. noktadan 1. noktaya) ters olarak kabul edilir.
Bu bölümdeki tüm konular:
TERMODİNAMİK VE SORUNLARI
Enerji alışverişi süreçleri, çevreleyen dünyanın herhangi bir fenomeninde gerçekleşir. Bu nedenle termodinamik, ısı ve işin karşılıklı dönüşümünün bilimi olarak, enerji alanlarını incelemek için yöntemler sağlar.
ÇALIŞMA ORGANININ DEVLETLERİ
Bir termodinamik sistem, birbirleriyle ve çevreleyen gövdelerle mekanik ve termal etkileşim içinde olan bir dizi malzeme gövdesidir. termodi
VE GERÇEK GAZLAR
Gerçek gazlar düşük basınçlar ideale yakındır, çünkü bu durumda moleküller arası etkileşim kuvvetleri ve moleküllerin hacmi ihmal edilebilir. Bu özellikle oksijen, hava için geçerlidir.
GAZ KARIŞIMLARI
Uygulamada, kural olarak, çalışma sıvısı olarak herhangi bir homojen gaz değil, bir gaz karışımı kullanılır: hava, yanma ürünleri Çeşitli türler yakıtlar, doğal gazlar vb.
DOĞRU VE ORTALAMA ISI KAPASİTESİ
Isı kapasiteleri kütle, hacim, molar olabilir. 1 kg gazın ısı kapasitesine kütle denir: c harfi ile gösterilir ve J / (kg. K) cinsinden ölçülür. Şunlar
İDEAL BİR GAZIN ISI KAPASİTELERİ
Yukarıda bahsedildiği gibi, aynı miktarda sağlanan ısıya sahip gazın sıcaklığı, termodinamik sürecin doğasına bağlı olarak farklı şekilde değişir. Anlamı,
Atomikliğe bağlı olarak molar ısı kapasiteleri ve k katsayısı değerleri
Gaz mсJ mav mсJ mav k
GAZ KARIŞIMLARININ ISI KAPASİTESİ
Bir gaz karışımının yanı sıra tek tek gazların ısı kapasitesi 1 kg, 1 m3 veya 1 kmol olarak ifade edilebilir. Karışım kütle kesirleriyle verilirse, kütle ısı kapasitesi
VE İÇ ENERJİ
İş sadece gazın hacmi değiştiğinde yapılır. Gaz genleşirse, iş dış kuvvetlere karşı yapılır; sıkıştırıldığında, aksine, gaz iş alır
SICAKLIK
Isı, bir cismin en küçük parçacıklarının bir hareket şeklidir. Bir gövdeden diğerine ısı transferi, ya aralarındaki doğrudan temas yoluyla gerçekleştirilir (termal iletkenlik,
TERMODİNAMİĞİN BİRİNCİ YASASI
Termodinamiğin birinci yasası, özel durum termal süreçlerle ilgili olarak enerjinin korunumu ve dönüşümünün evrensel yasası. Birinci yasanın formülasyonu
GAZLARDA TERMODİNAMİK SÜREÇLER
Çalışma akışkanının (gaz) durumundaki herhangi bir değişiklik, genellikle ana parametrelerinde bir değişiklik ile karakterize edilir: r, J, T. Gazın durumu iki şekilde değişir:
GAZ ENTROPİSİ
Çalışmada tüm süreçler denge ve tersinir olarak kabul edilmiştir. Termodinamik süreçleri inceleme prosedürünü düşünmeden önce, beşinci parametreyi tanıtıyoruz.
İZOKORİK SÜREÇ
Sabit bir belirli hacimde meydana gelen bir sürece izokorik denir. Hesaplamalarda özellikle izokorik süreç kullanılır. teorik döngüler karbüratörlü motorlar
İZOBAR SÜRECİ
Şu anda gerçekleşen süreç sabit basınç, izobarik olarak adlandırılır. Böyle bir termodinamik süreç, pistonu sürtünmesiz hareket eden bir silindirde gerçekleşebilir.
GAZ ENTALPİSİ
Kazan tesislerinin, buhar türbinlerinin hesaplanması ile tarımsal ürünlerin kurutulması ve soğutulması ile ilgili işlemlerde, çalışma sıvısının durumunun parametresi (ha
İZOTERMAL SÜREÇ
Şu anda gerçekleşen süreç Sabit sıcaklıkçalışma sıvısına izotermal denir. Örneğin, pistonlu bir makinenin silindirinde, çalışmaya ısı olarak q verilirse mümkündür.
ADYABATİK SÜREÇ
Adyabatik bir süreç, gaz ve çevre arasında ısı alışverişi olmadan gerçekleştirilen bir süreçtir (q = 0). Bu işlemin pratik kullanımı buhar memelerindedir.
POLİTROPİK SÜREÇ
Tüm gerçek ısı motorlarında (motorlar içten yanma- içten yanmalı motorlar, kompresörler, gaz türbini üniteleri vb.) çalışma sıvısının (gazın) sıkıştırılması, yakıtın yanması, genleşme süreçleri
Politropik süreçlerin analiz sonuçları
Grup Politropik indeksteki değişim limitleri İç enerjideki değişim Isı temini (kaldırma) Ilık
DAİRESEL SÜREÇLER
Gazın bir dizi farklı durumdan geçtikten sonra orijinal durumuna geri döndüğü kapalı bir sürece denir. döngüsel süreç(Çevrim). Bu tanımı açıklayalım.
DOĞRUDAN TERSİNİBİLİR CARNO DÖNGÜSÜ
1824'te S. Carnot, adını verdiği bir döngü önerdi. Doğrudan tersinir (yani sadece denge, tersinir süreçlerden oluşan) Carnot çevrimi ideal bir çevrimdir.
TERS DÖNÜŞTÜRÜLEBİLİR CARNO DÖNGÜSÜ
Bu döngü mükemmel döngü soğutma makineleri. Ters Carnot döngüsünün görüntüsü Şekil 10'da gösterilmektedir. Döngü, doğrudan döngü ile aynı süreçlerden oluşur, ancak durum p
TERMODİNAMİĞİN İKİNCİ YASASI
Termodinamiğin birinci yasası, iki tür enerji aktarımı olarak ısı ve işin denkliğini belirler. Ancak bu yasa, ısının dönüşümünün koşulları hakkında hiçbir şey söylemez ve
KOMPRESÖRLER
İçten yanmalı motorlar (ICE), sıvı veya gaz halindeki yakıtların yanma ürünlerinin çalışma sıvısı olarak kullanıldığı, yanan termal pistonlu makineler olarak adlandırılır.
İÇTEN YANMALI MOTORLAR
Analiz için ICE operasyonu ve çalışan bir silindir üzerindeki ana göstergelerin (gösterge gücü, mekanik verim) belirlenmesi, bir gösterge vb. kullanılarak bir gösterge şeması kaydedilir.
GAZ TÜRBİN TESİSİ ÇEVRİMLERİ
Gaz türbini üniteleri (GTU'lar), ICE'lere göre önemli bir avantaja sahiptir - GTU'larda karşılıklı mekanizmaların olmaması, onları yüksek hızda inşa etmeyi mümkün kılar
PİSTONLU KOMPRESÖRLER
Basınçlı hava, teknolojik işlemlerde, özellikle dökme malzemelerin taşınması için pnömatik mekanizmaların, çekiçlerin, vibratörlerin, pnömatik vinçlerin sürülmesi için yaygın olarak kullanılmaktadır.
SU BUHARI
Çalışma akışkanı olarak su buharı, termik ve nükleer santrallerdeki ana ısı motorları olan buhar türbinlerinde yaygın olarak kullanılmaktadır. Kalitede
RV- VE Ts-SU BUHARI ŞEMASI
Buharlaştırma, buharlaştırma veya kaynatma yoluyla gerçekleştirilebilir. Buharlaşmaya, yalnızca sıvının yüzeyinden meydana gelen buharlaşma denir. Bu süreç yaklaşık
Hs-SU BUHARI ŞEMASI
Mühendislik uygulamalarında, su buharlı termodinamik işlemler hs diyagramı kullanılarak hesaplanır. Bu şema SSCB'de 100.0 MPa basınca ve 1000 sıcaklığa kadar inşa edilmiştir.
SU VE SU BUHARI PARAMETRELERİ
Çalışmalarda, genel olarak 0 0С ve herhangi bir basınçta, suyun entalpi h0, iç enerjisi u0, entropi s0'ın sıfıra eşit olduğu kabul edilir. resimde
SU BUHARI İÇİN CARNO DÖNGÜSÜ
Bir buharlı güç santralinin en mükemmel ideal çevrimi, yukarıda belirtildiği gibi, ısıl verimi belirli bir sıcaklık aralığında maksimum olan ve onu aşmayan doğrudan tersinir Carnot çevrimidir.
SIRALAMA DÖNGÜSÜ
Buhar santrallerinin ana ideal çevrimi Rankine çevrimidir. Şekil 24, Rankine döngüsüne göre çalışan bir buharlı güç santralinin şematik diyagramını göstermektedir ve Şekil 25, rJ- ve Ts-di'yi göstermektedir.
SIRALAMA DÖNGÜSÜ
Termal ifadenin incelenmesi çevrim verimliliği Farklı başlangıç (buhar türbini girişinde) ve son (kondenser girişinde) buhar parametrelerindeki Rankine, başlangıçta şu sonuca varmamızı sağlar:
NEMLİ HAVA
Çalışma sıvısı olarak atmosferik hava, çeşitli malzemelerin kurutulması, ısıtılması, soğutulması, klima ünitelerinde vb. atmosferik hava ortak
NEMLİ HAVA
Dalton yasasına göre, bir gaz karışımının basıncı, bileşenlerinin kısmi basınçlarının toplamına eşittir: pnl.v. = pс.v. + pv.p., (128) &nbs
HD-CHART NEMLİ HAVA
Bu tablo, nemli havanın parametrelerini en basit ve hızlı bir şekilde belirlemenizi sağlar. Hd diyagramında (Şekil 27, a), nem içeriği d (g / kg kuru hava) apsis ekseni boyunca çizilir,
TEMEL KAVRAMLAR VE TANIMLAR
Termal iletkenliğin temel kavramlarından biri sıcaklık alanıdır. Sıcaklık, çalışma sıvısının veya ortamın termal durumunu karakterize eden ana parametrelerden biridir. Toplama
FOURIER HUKUKU
Fourier yasası, sıcaklık alanı ile ısı iletimi yoluyla içindeki ısı yayılımının yoğunluğu arasında nicel bir ilişki kurar. Fourier yasasına göre, ve
SABİT MODDA
Tek katmanlı düz duvarın termal iletkenliği. Bu durum için ısı yayılım şeması Şekil 30'da gösterilmektedir. Isının buharla sınırlanmış bir duvarda yayılmasına izin verin
KONVEKTİF ISI TRANSFERİ
Pratikte, bir sıvı (gaz) ve bir yüzey arasındaki konvektif ısı transferini hesaplamak çoğu zaman gereklidir. sağlam vücut veya içinden aktığı kanal (boru). eğer pr
SIVI KAYNAKLADIĞINDA
Sıvı kaynama sırasında ısı transferine bir değişiklik eşlik eder. toplama durumuçalışan vücut. Bu fenomenin kendine has özellikleri vardır ve enerji için büyük pratik öneme sahiptir.
VE RADYASYON YASALARI
Radyasyonla ısı transferi, elektromanyetik dalgalar (fotonlar) şeklinde ısı transferi sürecidir. Bu tür ısı transferi üç aşamada gerçekleştirilir: vücudun iç enerjisi.
RADYASYONLA ISI TRANSFERİ
Radyasyon yasalarını bilmek, cisimler arasında radyan ısı transferi için hesaplama formülleri elde etmeyi mümkün kılar. Emisivitenin belirlenmesinde özellikle formül (155) kullanılır.
ISI TRANSFERİ. ISI DEĞİŞTİRİCİLERİNİN HESAPLANMASI İÇİN TEMEL BİLGİLER
Isı transferi sürecinin termal iletkenliğe, konvektif ısı transferine ve radyasyonla ısı transferine bölünmesi, çalışması için uygundur. Gerçekte, karmaşık bir ısı değişimi vardır,
DÜZ DUVAR ÜZERİNDEN ISI TRANSFERİ
Termal iletkenlik katsayısı l olan bir malzemeden yapılmış d kalınlığında tek katmanlı bir düz duvarın (Şekil 37), bir tarafı tl1 sıcaklığındaki sıcak bir sıvı ile yıkanmasına izin verin.
SİLİNDİRİK DUVAR ÜZERİNDEN ISI TRANSFERİ
Uygulamada, ısı değişim cihazlarının en yaygın elemanı bir borudur. Silindirik bir duvardan (borudan) ısı transfer sürecinin bir diyagramı Şekil 38'de gösterilmektedir.
ISI YALITIMI
Isı transferinin pratik problemlerini çözerken, ya ısıtma ortamından ısıtılmış olana ısı transferinin yoğunluğunu arttırmak ya da tersine bu süreci yavaşlatmak gerekir. yoğun
ISI DEĞİŞTİRİCİLERİ
Isı eşanjörleri (ısı eşanjörleri), bir ısıtma soğutucusundan (daha yüksek sıcaklığa sahip) ısıyı ısıtılmış bir ısıya aktarmak için tasarlanmış cihazlardır.
ENERJİ YAKIT
Enerji yakıtları, ısı üretmek için teknik cihazlarda yakıldığında ekonomik olarak mümkün olan yanıcı maddelerdir. yakıt olarak
GELENEKSEL YAKIT KAVRAMI
Bir yakıtın kalorifik değeri, normal koşullar altında katı, sıvı veya gaz halindeki bir yakıtın tam yanması sırasında ne kadar ısı (kilojul cinsinden) açığa çıktığını gösterir.
ANA YAKIT BİLEŞENLERİ
Yakıtın yanıcı kısmının ana bileşeni karbondur. Karbonun yanma ısısı 33.650 kJ/kg'dır. Yanıcı yakıt kütlesindeki karbon içeriği: antrasit içinde - 87 ... %93
YAKIT TÜRLERİ
Odun. Yakıt olarak odun kullanımı sınırlıdır. Yakacak odunun kalorifik değeri büyük ölçüde nem ile belirlenir. Ahşapta ne kadar fazla nem varsa, o kadar az
YAKIT YANMA SÜRECİNİN ÖZÜ
Yanma hızına bağlı olarak normal yanma ve patlayıcı yanma ayırt edilir. Yanma hızı, alev yayılma hızıdır. Normal yanma sırasında yayılma hızı
KOMPLE YAKIT YANMASI İÇİN
Yakıtın bileşimi biliniyorsa, bileşenlerinden herhangi birinin tam yanması için gereken hava miktarı C + O2 = CO2 ifadesinden belirlenebilir. E
YANMA ÜRÜNLERİNİN HACİM VE BİLEŞİMİ
Isı mühendisliği birimlerinin doğru hesaplanması ve seçimi için oluşan yanma ürünlerinin miktarını bilmek gerekir. Kural olarak, yanma ürünlerinin miktarı 1 kg TV'ye atıfta bulunur.
Farklı sıcaklıklarda yanma ve hava bileşenlerinin entalpilerinin sayısal değerleri
Sıcaklık, K НСО2, kJ/m3 НN2, kJ/m3 НО2, kJ/m3
REFERANS ENDEKSİ
Alekseev G. N. Genel ısı mühendisliği - M .: Yüksek Lisans, 1980. Andryushchenko AI Termik santral döngülerinin termodinamiğinin temelleri - M., Yüksek okul. Ar
ENERJİ VE OTOMASYON ENSTİTÜSÜ
Isı Mühendisliği Bölümü
ve enerji sistemleri

TEKNİK TERMODİNAMİK
Magnitogorsk
| GİRİİŞ ................................................. ................................................................. ................................ | |
| Konu1. Termodinamiğin konusu ve yöntemi .................................................. .. .................................. | |
| Termodinamik sistem ................................................................ .................................................................. | |
| Devletin termodinamik parametreleri .................................................. ................................ ...... | |
| Devlet denklemi ............................................... ................................................................................ ......... | |
| Termodinamik süreç ................................................................ .................................................................. | |
| Gazların ısı kapasitesi ................................................................ ................................................................................ ................ | |
| Konu 2. Karışımlar ideal gazlar.................................................................................... | |
| Termodinamiğin birinci yasasının analitik ifadesi .................................................. .... | |
| Konu 3. İç enerji ................................................................ .................................................................. | |
| Uzatma işlemi ................................................................ ................................................................................ ......... | |
| Sıcaklık................................................. ................................................ . ................ | |
| Entalpi ................................................................ ................................................ . ......... | |
| Entropi................................................. ................................................ . ......... | |
| Konu 4. İkinci Yasanın Genel Metni ................................................................. ................................................ | |
| Doğrudan Carnot Döngüsü ................................................................. ................................................................................ ................ | |
| Ters Carnot çevrimi ................................................................. ................................................................................ ......... | |
| Denge dışı süreçlerde entropi değişimi ................................................. .... | |
| Konu 5. İdeal gazların termodinamik süreçleri kapalı sistemler Ey......... | |
| Ekserji ................................................................ ................... ................................................................ ......... ............. | |
| Konu 6. Gerçek gazların termodinamik süreçleri .................................................. .... ..... | |
| Gerçek gazların hal denklemi ................................................................ ................................................ | |
| Konu 7. Akış için termodinamiğin birinci yasasının denklemi ................................................. ........... | |
| Yakınsak meme çıkışı ................................................................. ................................................................ | |
| Nozullarda ve difüzörlerde gaz akışının ana düzenlilikleri ................................................. ......... | |
| Son kullanma sürecinin hesaplanması h-s diyagramlar ................................................ | |
| Gazların ve buharların kısılması ................................................................. ................................................. | |
| Konu 8. Termik santral çevrimlerinin termodinamik verimliliği .......... | |
| döngüler pistonlu motorlar içten yanma ............................................... | |
| Gaz türbini tesislerinin çevrimleri .................................................. .................................................................. | |
| Buhar türbini tesislerinin çevrimleri .................................................. .................................................. | |
| Carnot ve Rankine çevrimleri doymuş buhar. Isı geri kazanımı ................................................ | |
| Kızgın buharda Rankine çevrimi .................................................. .................................. | |
| Çevrimin ısıl verimi ................................................................. ................................................................................ ................ | |
| Isı temini ................................................................ ................................................................................ ................. ..... |
Konu 9. teorik süreççok kademeli kompresör
. Yürütmek için kontrol soruları ara sertifika(sınav) disipline hakim olmanın sonuçlarına göre:
- Termodinamiğin birinci yasasının özü ve formülasyonları.
- Termodinamiğin birinci yasasının analitik ifadesi.
- Rastgele bir termodinamik süreç için faydalı işi ve genişleme (sıkıştırma) işini P - V diyagramında gösterin.
- Hal fonksiyonu olarak iç enerji ve entalpi, bunların ısı kapasitesi ile bağlantısı.
- Toplam ısı kapasitesi denir.
- Özgül ısı kapasitesi - kütle, hacim ve molar, tanımları ve boyutları.
- Hangi ısı kapasitesi daha büyük - izobarik veya izokorik ve neden.
- Temel termodinamik süreçler, bunların P–V ve T–S diyagramlarında gösterimi.
- Temel termodinamik süreçler için parametrelerin ilişkisi.
- Adyabatik sürecin 0 ve 0 fonksiyonlarını kullanarak hesaplanması.
- Tersinir ve tersinmez süreçler, tersinmezliğin ana nedenleridir.
- T - S diyagramına tersinir ve tersinmez adyabatik genişleme ve büzülme sürecini çizin.
- Termodinamiğin ikinci yasasının özü ve formülasyonları.
- Tersinir ve tersinmez süreçler için termodinamiğin ikinci yasasının analitik ifadesi.
- Devletin bir fonksiyonu olarak entropi, fiziksel anlam entropi.
- Termodinamik çevrim denir.
- Doğrudan ve ters termodinamik çevrimler.
- Doğrudan ve ters çevrimin verimliliği nasıl değerlendirilir.
- Bir ısı makinesinin ve bir soğutma ünitesinin şematik diyagramı.
- Direkt Carnot çevrimi, ısıl verimi, durum diyagramlarındaki görüntüsü.
- Gerçek gazlar, Van-der-Waals durum denklemi.
- Normal ve anormal madde için faz P-T diyagramı.
- Buharlaşmaya harcanan ısıyı T-S diyagramında gösteriniz.
- Su buharı - doymuş (kuru ve ıslak) ve aşırı ısıtılmış - tanımlar.
- Su buharı durum diyagramları P - V, T - S, h - S.
- kritik ve üçlü nokta.
- Durum diyagramlarında su buharının termodinamik süreçleri.
28. Çalışma sıvısının akışı için termodinamiğin birinci yasasının denklemi.
30.Bir kanal profili nasıl tanımlanır.
31. Süpersonik hız elde etmek için hangi nozül gereklidir.
32. Hangi sürece kısma denir.
33. Kısma işlemini h - s diyagramında gösterin.
34. Kısma sürecinde çalışma sıvısının parametrelerinin nasıl değiştiği.
35. Bir kompresördeki (izotermal, adyabatik, politropik) üç sıkıştırma işleminden hangisi en faydalıdır ve neden?
36. Çok kademeli sıkıştırma, tek kademeli kompresöre kıyasla avantajları.
37. İçten yanmalı motorların çevrimleri, karşılaştırılması.
38. Gaz türbini tesislerinin çevrimleri, karşılaştırılması.
39. Gaz türbini tesislerinin verimliliğini artırma yöntemleri.
40. Su buharı için Carnot çevrimi.
41. Bir buhar türbini tesisinin şematik diyagramı.
42. Rankine çevrimi doymuş buhar, termal verimliliği.
43. Kızgın buharla Rankine çevrimi, ısıl verimi.
44. Gerçek Rankine çevrimi, mutlak iç verimliliğin tanımı.
45. İlk ve son buhar parametrelerinin ısıl verim üzerindeki etkisi.
46. Ara buhar yeniden ısıtmalı bir buhar türbini tesisinin şeması ve döngüsü.
47. Yeniden ısıtmalı bir çevrimin ısıl veriminin formülünü yazın.
48. Hangi döngüye rejeneratif denir.
49. Rejeneratif ekstraksiyonlu bir buhar türbini tesisinin şeması ve çevrimi.
50. Rejeneratif çevrimin ısıl veriminin formülünü yazın.
51. Bölgesel ısıtmanın termodinamik temelleri.
52. Isı kullanım faktörü (KIT).
53. Nükleer santrallerin döngüleri, atom enerjisinin kullanımına ilişkin beklentiler.
54. İkili çevrimler (buhar - buhar ve buhar - gaz).
55. İkili tesisatların ısıl veriminin hesaplanması.
56. Termal enerjinin elektrik enerjisine makinesiz (doğrudan) dönüşümü.
57. MHD jeneratörlü bir tesisatın şeması, çevrimi ve ısıl verimi.
58. Soğutma üniteleri - gaz ve buhar sıkıştırma.
59. Isı pompası denilen şey, etkinliğinin nasıl değerlendirileceği.
60. Kimyasal sistemler için termodinamiğin birinci ve ikinci yasaları
TEMA 1
Termodinamiğin konusu ve yöntemi
TermodinamikMakroskopik sistemlerde meydana gelen ve termal etkilerin eşlik ettiği çeşitli süreçlerde enerji dönüşüm yasalarını inceler. Makroskopik bir sistem, aşağıdakilerden oluşan herhangi bir maddi nesnedir. Büyük bir sayı parçacıklar. Makroskopik sistemlerin boyutları, moleküllerin ve atomların boyutlarından ölçülemeyecek kadar büyüktür.
Çalışmanın amaçlarına bağlı olarak, teknik veya kimyasal termodinamiği, biyolojik sistemlerin termodinamiğini vb. dikkate alırlar. Teknik termodinamik termal ve karşılıklı dönüşüm kalıplarını inceler mekanik enerji ve bu dönüşümlere dahil olan cisimlerin özellikleri.. Temelde, tüm ısı motorlarının yanı sıra her türlü teknolojik ekipmanın hesaplanması ve tasarımı gerçekleştirilir.
Sadece makroskopik sistemler göz önüne alındığında, termodinamik, çok sayıda sürekli hareket eden ve etkileşime giren mikroyapısal parçacıkların (moleküller, atomlar, iyonlar) varlığından dolayı maddenin hareketinin termal formunun modellerini inceler.
Fiziksel özellikler makroskopik sistemler istatistiksel termodinamik yöntemlerle incelenir. İstatistiksel yöntem, olasılık teorisinin ve bu sistemlerin yapısının belirli modellerinin kullanımına dayanır ve istatistiksel fiziğin içeriğidir. Termodinamik yöntem, maddenin yapısı hakkında model fikirlerin dahil edilmesini gerektirmez ve fenomenolojik(yani, "fenomeni" - bir bütün olarak fenomeni) dikkate alır.
Bu durumda, termodinamiğin tüm ana sonuçları, termodinamiğin yalnızca iki temel ampirik yasasını kullanarak tümdengelim yoluyla elde edilebilir.
Gelecekte, termodinamik yönteme dayalı olarak, netlik için maddenin yapısı hakkında moleküler-kinetik fikirleri kullanacağız.
termodinamik sistem
termodinamik sistem birbirleriyle ve sistemi çevreleyen dış cisimlerle mekanik ve termal etkileşim içinde olan bir dizi malzeme gövdesidir.("dış ortam").
Sistemin seçimi keyfidir ve çözülmekte olan problemin koşulları tarafından belirlenir. Sisteme dahil olmayan cisimlere denir. çevre. Sistem ortamdan ayrılmıştır kontrol yüzeyi(kabuk). Bu nedenle, örneğin, en basit sistem için - bir pistonun altındaki bir silindire yerleştirilmiş bir gaz, dış ortam çevreleyen havadır ve silindir duvarları ve piston kontrol yüzeyleri olarak işlev görür.
Bir termodinamik sistemin mekanik ve termal etkileşimleri, kontrol yüzeyleri aracılığıyla gerçekleştirilir. Sistemin kendisi veya sistem üzerinde mekanik etkileşim sırasında iş yapılır. (Genel durumda sistem, etkisi altında sistemin iş yapacağı elektrik, manyetik ve diğer kuvvetlerden de etkilenebilir. Bu tür işler termodinamik çerçevesinde de dikkate alınabilir, ancak biz onları daha fazla dikkate almayın). Örneğimizde, mekanik iş pistonu hareket ettirerek gerçekleştirilir ve buna hacimde bir değişiklik eşlik eder. Termal etkileşim, sistemin bireysel gövdeleri ve sistem ile çevre arasındaki ısı transferinden oluşur. İncelenen örnekte, gaza silindirin duvarlarından ısı verilebilir.
En genel durumda sistem çevre ve madde ile değiş tokuş yapabilir (kütle transferi etkileşimi). Böyle bir sistem denir açık. Türbinlerde ve boru hatlarında gaz veya buhar akışları - örnekler açık sistemler. Madde sistemin sınırlarından geçmiyorsa buna kapalı denir. Aşağıda aksi belirtilmedikçe kapalı sistemleri ele alacağız.
Çevresiyle ısı alışverişi yapamayan termodinamik sisteme denir. ısı yalıtımlı veya adyabatik. Adyabatik sisteme bir örnek, duvarları ideal ısı yalıtımı ile kaplanmış bir kaptaki gazdır ve bu, kap içinde bulunan gaz ile çevreleyen gövdeler arasındaki ısı alışverişini hariç tutar. Böyle bir yalıtım kabuğuna adyabatik denir. Çevresiyle madde ve enerji alışverişi yapmayan sisteme denir. yalıtılmış(veya kapalı).
En basit termodinamik sistem, ısı ve işin karşılıklı dönüşümünü gerçekleştiren bir çalışma sıvısıdır. Örneğin içten yanmalı bir motorda, çalışma sıvısı, hava ve benzin buharlarından oluşan bir karbüratörde hazırlanan yanıcı bir karışımdır.
Termodinamik durum parametreleri
Her sistemin özellikleri, genellikle termodinamik parametreler olarak adlandırılan bir dizi nicelik ile karakterize edilir. Fiziğin seyrinden bilinen moleküler-kinetik kavramları kullanarak, ortadan kaybolacak kadar küçük boyutlara sahip moleküller topluluğu olarak ideal bir gaz hakkında, rastgele termal hareket halinde olan ve yalnızca çarpışmalar sırasında birbirleriyle etkileşime giren moleküller topluluğu olarak bunlardan bazılarını ele alalım.
Baskı yapmakçalışma sıvısının moleküllerinin yüzeyle etkileşimi nedeniyle ve vücut yüzeyinin birim alanı başına normalden ikinciye etki eden kuvvete sayısal olarak eşittir. Moleküler kinetik teoriye göre, gaz basıncı bağıntı ile belirlenir.
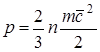 , (1.1)
, (1.1)
burada F kuvvettir; f-yüzeyi; n- birim hacim başına molekül sayısı;
t molekülün kütlesidir; 2'den beri-RMS hızı ileri hareket moleküller.
AT uluslararası sistem birim (SI) basınç paskal olarak ifade edilir (1 Pa \u003d 1 N / m 2). Bu birim küçük olduğu için 1 kPa = 1000 Pa ve 1 MPa = 10 6 Pa kullanılması daha uygundur.
Basınç, basınç göstergeleri, barometreler ve vakum göstergeleri kullanılarak ölçülür.
Sıvı ve yaylı basınç göstergeleri toplam veya mutlak basınç arasındaki fark olan gösterge basıncını ölçmek Rölçülen ortam ve atmosfer basıncı p atm, yani ![]()
Atmosferin altındaki basınçları ölçen cihazlara vakum ölçerler denir; okumaları vakum (veya vakum) değerini verir:
![]() ,
yani fazlalık atmosferik basınç mutlak üzerinde.
,
yani fazlalık atmosferik basınç mutlak üzerinde.
Durum parametresinin mutlak basınç olduğuna dikkat edin. Termodinamik denklemlere giren budur.
sıcaklık vücudun ısınma derecesini karakterize eden fiziksel bir miktar olarak adlandırılır. Sıcaklık kavramı şu ifadeden çıkar: iki sistem termal temas halindeyse, sıcaklıkları eşit değilse birbirleriyle ısı alışverişi yapacaklardır, ancak sıcaklıkları eşitse, ısı alışverişi olmayacaktır.
Moleküler kinetik kavramlar açısından sıcaklık bir ölçüdür. Moleküllerin termal hareketinin yoğunluğu. Sayısal değeri, maddenin moleküllerinin ortalama kinetik enerjisinin değeri ile ilgilidir:
SI sisteminde sıcaklık birimi kelvindir (K); uygulamada, Santigrat derecesi (°C) yaygın olarak kullanılır. mutlak arasındaki oran T ve santigrat ben sıcaklıklar forma sahiptir
![]() .
.
Endüstriyel ve laboratuvar koşullarında sıcaklık, sıvı termometreler, pirometreler, termokupllar ve diğer aletler kullanılarak ölçülür.
belirli hacim v - bir maddenin birim kütlesi başına hacimdir. Homojen bir kütle ise M hacim kaplar v, o zaman tanım gereği
v= V/M.
SI sisteminde özgül hacmin birimi 1 m3/kg'dır. Bir maddenin özgül hacmi ile yoğunluğu arasında açık bir ilişki vardır:
Aynı durumlarda sistemleri karakterize eden nicelikleri karşılaştırmak için “normal fiziksel koşullar” kavramı tanıtılır:
p\u003d 760 mm Hg \u003d 101.325 kPa; T=273,15 K.
Teknolojinin çeşitli dallarında ve Farklı ülkeler verilenlerden biraz farklı, örneğin “teknik” ( p\u003d 735.6 mm Hg \u003d 98 kPa, t=15˚C) veya kompresör performansını değerlendirmek için normal koşullar ( p=101.325 kPa, t=20˚С), vb.
Tüm termodinamik parametreler zaman içinde sabit ve sistemin tüm noktalarında aynı ise, sistemin bu durumuna denir.denge.
Sistemdeki farklı noktalar arasında sıcaklık, basınç ve diğer parametrelerde farklılıklar varsa,dengesizlik. Böyle bir sistemde, parametrelerin gradyanlarının etkisi altında, onu bir denge durumuna döndürme eğiliminde olan ısı, maddeler ve diğerleri akışları ortaya çıkar. Tecrübe gösteriyor ki yalıtılmış sistem zamanla her zaman bir denge durumuna gelir ve asla kendiliğinden bu durumdan çıkamaz. Klasik termodinamikte sadece denge sistemleri dikkate alınır.
durum denklemi
Bir denge termodinamik sistemi için durum parametreleri arasında fonksiyonel bir ilişki vardır. Devlet denklemi. Deneyimler, gazlar, buharlar veya sıvılar olan en basit sistemlerin özgül hacmi, sıcaklığı ve basıncının birbiriyle ilişkili olduğunu göstermektedir. termal denklem durumları görüntüle ![]() .
.
Durum denklemine başka bir form verilebilir: ![]()
Bu denklemler, sistemin durumunu belirleyen üç ana parametreden herhangi ikisinin bağımsız olduğunu göstermektedir.
Problemleri termodinamik yöntemlerle çözmek için mutlaka hal denklemini bilmek gerekir. Ancak, termodinamik çerçevesinde elde edilemez ve deneysel olarak veya istatistiksel fizik yöntemleriyle bulunması gerekir. Durum denkleminin özel şekli, maddenin bireysel özelliklerine bağlıdır.
İdeal gazlar için durum denklemi
Denklemler (1.1) ve (1.2) şu anlama gelir: .
1 kg gaz düşünün. içerdiği düşünüldüğünde N moleküller ve bu nedenle, elde ederiz: ![]() .
.
Sabit değer nk, 1 kg gaza atıfta bulunulur, harfle gösterilir R ve Çağrı yap Gaz sabiti. Bu yüzden
Veya . (1.3)
Ortaya çıkan bağıntı Clapeyron denklemidir.
(1.3) ile çarpma M, keyfi bir gaz kütlesi için durum denklemini elde ederiz M:
Gaz sabitini 1 kmol gaza, yani kütlesi kilogram olarak moleküler kütle μ'ye sayısal olarak eşit olan gaz miktarına atıfta bulunursak, Clapeyron denklemine evrensel bir form verilebilir. (1.4) koymak M=μ ve V=V μ, bir mol için Clapeyron - Mendeleev denklemini elde ederiz:
Burada, bir kilomol gazın hacmi ve evrensel gaz sabitidir.
Avogadro yasasına (1811) göre, tüm ideal gazlar için aynı koşullar altında aynı olan 1 kmol'ün hacmi, normal fiziksel koşullar altında 22.4136 m3'tür, dolayısıyla
1 kg gazın gaz sabiti dir.
Gerçek gazların durum denklemi
gerçek gazlarda içinde idealden farkı, moleküller arası etkileşimlerin önemli kuvvetleridir (moleküller önemli bir mesafedeyken çekici kuvvetler ve birbirlerine yeterince yakın olduklarında itici kuvvetler) ve moleküllerin içsel hacmi ihmal edilemez.
Moleküller arası itici kuvvetlerin varlığı, moleküllerin birbirlerine ancak belirli bir minimum mesafeye kadar yaklaşabilmelerine yol açar. Bu nedenle, moleküllerin hareketi için serbest hacmin eşit olacağını varsayabiliriz. , nerede b bir gazın sıkıştırılabileceği en küçük hacimdir. Buna göre, moleküllerin ortalama serbest yolu azalır ve birim zamanda duvardaki çarpma sayısı azalır ve sonuç olarak ideal gaza göre basınç artar. , yani
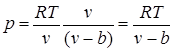 .
.
Çekici kuvvetler, dış basınçla aynı yönde hareket eder ve moleküler (veya iç) basınca neden olur. Bir gazın herhangi iki küçük parçasının moleküler çekim kuvveti, bu parçaların her birindeki molekül sayısının çarpımı, yani yoğunluğun karesi ile orantılıdır, dolayısıyla moleküler basınç, gazın karesiyle ters orantılıdır. gazın özgül hacmi: rmol= bir/ v 2, nerede a - gazın doğasına bağlı olarak orantılılık katsayısı.
Bundan van der Waals denklemini (1873) elde ederiz:
![]() ,
,
genel olarak belirli hacimler ve gerçek bir gazın nispeten düşük basınçlarında, van der Waals denklemi pratik olarak ideal bir gaz için Clapeyron durum denklemine dönüşür, çünkü miktar a/v 2
(karşılaştırıldığında p) ve b(karşılaştırıldığında v)önemsiz hale gelir.
Niteliksel olarak, van der Waals denklemi gerçek bir gazın özelliklerini oldukça iyi tanımlar, ancak sayısal hesaplamaların sonuçları her zaman deneysel verilerle uyuşmaz. Bazı durumlarda, bu sapmalar, gerçek gaz moleküllerinin iki, üç veya daha fazla molekülden oluşan ayrı gruplar halinde birleşme eğilimi ile açıklanır. İlişki, moleküllerin dış elektrik alanının asimetrisi nedeniyle oluşur. Ortaya çıkan kompleksler, bağımsız kararsız parçacıklar gibi davranır. Çarpışmalar sırasında parçalanırlar, sonra diğer moleküller vb. ile yeniden birleşirler. Sıcaklık arttıkça, komplekslerin konsantrasyonu Büyük bir sayı moleküller hızla azalırken, tek moleküllerin oranı artar. Polar su buharı molekülleri daha büyük bir birleşme eğilimi gösterir.
termodinamik süreç
Bir termodinamik sistemin durumundaki zamanla oluşan değişime denir. termodinamik süreç. Böylece, piston silindir içinde hareket ettiğinde, hacmi ve onunla birlikte içerideki gazın basıncı ve sıcaklığı değişecek, gazın genleşmesi veya sıkıştırılması işlemi gerçekleşecektir.
Daha önce de belirtildiği gibi, denge durumundan çıkarılan ve ortamın sabit parametrelerinde kendi haline bırakılan sistem, bir süre sonra tekrar bu parametrelere karşılık gelen bir denge durumuna gelecektir. Sistemin bir denge durumuna böyle kendiliğinden (dış etki olmaksızın) dönüşü
aranan gevşeme ve sistemin dengeye döndüğü zaman aralığına denir. rahatlama vakti. İçin farklı süreçler farklıdır: eğer bir gazda her zaman bir denge basıncı oluşturmak gerekiyorsa, o zaman aynı gazın hacmindeki sıcaklığı eşitlemek için on tane gerekir; dakika ve ısıtılmış katının hacminde - bazen birkaç saat.
Termodinamik süreç denirdenge, Sistemin tüm parametreleri, seyri sırasında ilgili gevşeme sürecine kıyasla oldukça yavaş değişirse. Bu durumda sistem aslında her zaman çevre ile denge halindedir ve bu da sürecin adını belirler.
Sürecin dengede olması için sistem parametrelerinin değişim hızı, aşağıdaki ilişkiyi sağlamalıdır.
nerede ANCAK- incelenen süreçte en hızlı değişen parametre; İle birlikte rel - gevşeme sürecinde bu parametrenin değişim oranı; τ rel - dinlenme zamanı.
Örneğin, bir silindirde bir gazın sıkıştırılması sürecini düşünün. Pistonun bir konumdan diğerine yer değiştirme süresi gevşeme süresini önemli ölçüde aşarsa, pistonu hareket ettirme sürecinde, silindirin tüm hacmi boyunca basınç ve sıcaklığın eşitlenmesi için zamana sahip olacaktır.
Bu hizalama, moleküllerin sürekli çarpışması ile sağlanır, bunun sonucunda pistondan gaza sağlanan enerji aralarında oldukça hızlı ve eşit bir şekilde dağıtılır. Pistonun müteakip yer değiştirmeleri benzer bir şekilde meydana gelecekse, sistemin her andaki durumu pratik olarak dengede olacaktır. Böylece, denge süreci, sürekli bir dizi ardışık denge durumundan oluşur, bu nedenle, her noktasında termodinamik sistemin durumu, verilen çalışma sıvısının durum denklemi ile tanımlanabilir. Bu nedenle araştırmalarında klasik termodinamik sadece denge süreçleriyle çalışır. Çoğu durumda sorunun çözümünü önemli ölçüde basitleştirmeye izin veren gerçek süreçlerin uygun bir idealleştirilmesidir. Bu idealleştirme oldukça haklıdır, çünkü (1.8) koşulu pratikte oldukça sık karşılanır. Gazlarda mekanik bozulmalar ses hızında yayıldığından, pistonun hızı ses hızından çok daha az ise gazın ve silindirin sıkıştırılması işlemi dengede olacaktır.
Şartı karşılamayan işlemler, dengesizlikle devam edin, yani. vardırdengesizlik. Örneğin, ortam sıcaklığını hızla artırırsa, silindirdeki gaz yavaş yavaş duvarlarından geçerek yeni çevresel parametrelere karşılık gelen bir denge durumuna rahatlayarak ısınacaktır. Gevşeme sürecinde gaz çevre ile dengede değildir ve hal denklemi ile karakterize edilemez. farklı noktalar gaz hacminin sıcaklığı farklı değerlere sahiptir.
Gazların ısı kapasitesi
Durumunda sonsuz küçük bir değişiklik olan bir cismin aldığı ısı miktarının, bununla ilişkili vücut sıcaklığındaki değişime oranına denir. ısı kapasitesi Bu süreçte bedenler:
Genellikle, ısı kapasitesi, bir maddenin miktarının bir birimine atıfta bulunur ve seçilen birime bağlı olarak, ayırt ederler:
özgül kütle ısı kapasitesic , 1 kg gaz olarak anılır,
J/(kgK);
özgül hacimsel ısı kapasitesic, normal fiziksel koşullar altında 1 m3 hacimde bulunan gaz miktarına atıfta bulunulur, J / (m3 ·K);
özgül molar ısı kapasitesi , bir kilomol, J / (kmol K) olarak adlandırılır.
Arasındaki ilişki özgül ısı kapasiteleri bariz ilişkilerle kurulur: ;
İşte normal koşullar altında gazın yoğunluğu.
Sağlanan aynı miktarda ısı ile vücut sıcaklığındaki değişiklik, gerçekleşen işlemin doğasına bağlıdır, bu nedenle ısı kapasitesi işlemin bir fonksiyonudur. Bu, işleme bağlı olarak aynı çalışma sıvısının 1 K ısıtılması için farklı miktarda ısı gerektirdiği anlamına gelir. Sayısal olarak, c'nin değeri +∞ ile -∞ arasında değişir.
Termodinamik hesaplamalarda aşağıdakiler büyük önem taşır:
sabit basınçta ısı kapasitesi
sabit basınçta işlem sırasında vücuda verilen ısı miktarının vücut sıcaklığındaki değişime oranına eşittir dT
sabit hacimde ısı kapasitesi
, (1.5)
ısı miktarının oranına eşit , sürecinde vücuda getirilen sabit hacim, vücut sıcaklığındaki bir değişikliğe .
Denge süreçlerinin gerçekleştiği kapalı sistemler için termodinamiğin birinci yasasına göre ![]() , ve
, ve
Bir izokorik süreç için ( v=const) bu denklem şu şekli alır ![]() , ve (1.5)'i dikkate alarak, şunu elde ederiz:
, ve (1.5)'i dikkate alarak, şunu elde ederiz:
![]() ,
,
yani, bir cismin sabit hacimdeki ısı kapasitesi, iç enerjisinin sıcaklığa göre kısmi türevine eşittir ve artan sıcaklıkla izokorik bir süreçte iç enerjinin büyüme oranını karakterize eder.
İdeal bir gaz için
Bir izobarik süreç için, Denklem (2.16) ve (2.14)'ten elde ederiz.
Bu denklem ısı kapasiteleri arasındaki ilişkiyi gösterir. p ile ve Özgeçmiş. İdeal bir gaz için, büyük ölçüde basitleştirilmiştir. Gerçekten de, ideal bir gazın iç enerjisi yalnızca sıcaklığı ile belirlenir ve hacme bağlı değildir, bu nedenle ve ayrıca durum denkleminden de çıkar. ![]() , nerede
, nerede
Bu oran denir Mayer denklemi ve teknik termodinamikteki ana ideal gazlardan biridir.
Süreç içerisinde v\u003d const gaza verilen ısı, işlem sırasında yalnızca iç enerjisini değiştirmeye gider R= sabit ısı hem iç enerjiyi artırmak hem de dış kuvvetlere karşı iş yapmak için harcanır. Bu yüzden p ile daha fazla Özgeçmiş bu işin boyutu.
Gerçek gazlar için, genişledikleri zamandan beri (en p= const) iş sadece dış kuvvetlere karşı değil, aynı zamanda ek ısı tüketimine neden olan moleküller arasında hareket eden çekim kuvvetlerine karşı da yapılır.
Genellikle ısı kapasiteleri deneysel olarak belirlenir, ancak birçok madde için yöntemlerle hesaplanabilir. istatistiksel fizik.
Klasik ısı kapasitesi teorisinin sonuçları, oda sıcaklıkları bölgesindeki deneysel verilerle iyi bir uyum içindedir (Tablo 2.1), ancak deney, sıcaklıktan bağımsızlığa ilişkin ana sonucu doğrulamamaktadır. Tutarsızlıklar, özellikle düşük ve yeterli bölgede önemli yüksek sıcaklıklar, moleküllerin kuantum davranışı ile ilgilidir ve şu şekilde açıklamalar bulur: kuantum teorisiısı kapasitesi.
Bazı gazların ideal gaz halinde t= 0°C'deki ısı kapasitesi
Bu teori, her şeyden önce, düşük ve yüksek sıcaklıklar bölgesinde serbestlik derecesi üzerinde enerjinin düzgün dağılımına ilişkin teoremin adaletsizliğini ortaya koymaktadır. Gaz sıcaklığı azaldıkça, molekülün serbestlik derecesi sayısı donar. Böylece, iki atomlu bir molekül için dönme serbestlik dereceleri “donar” ve beş yerine üç serbestlik derecesine sahiptir ve sonuç olarak daha düşük iç enerji ve ısı kapasitesi vardır. Sıcaklıktaki bir artışla, çok atomlu moleküller, molekül atomlarının titreşim hareketinin meydana gelmesi nedeniyle iç serbestlik derecelerini uyarır (molekül bir osilatör haline gelir). Bu, iç enerjide ve dolayısıyla artan sıcaklıkla ısı kapasitesinde bir artışa yol açar.
Gerçek bir gazın ısı kapasitesi, ancak çok zayıf bir şekilde basınca bağlıdır.
Gerçek bir gazın ısı kapasitesi sıcaklığa bağlı olduğundan, termodinamik gerçek ve ortalama ısı kapasiteleri arasında ayrım yapar.
Ortalama ısı kapasitesi İle birlikte evlenmek sıcaklık aralığında bu işlem t1önceki t2, gaza verilen ısı miktarının, son ve ilk sıcaklıklar arasındaki farka oranıdır:
![]()
İfade
belirli bir sıcaklıkta veya sözde ısı kapasitesini belirler gerçek ısı kapasitesi. * 'den şunu takip eder:
 .
.
Pratik hesaplamalar için, tüm maddelerin ısı kapasiteleri tablolaştırılmıştır ve tabloların hacmini azaltmak için, 0 ila sıcaklık aralığı için ortalama ısı kapasiteleri verilmiştir. t.
DERS 2
İdeal gazların karışımları
İdeal gazlar için yukarıda elde edilen tüm bağımlılıklar, gaz sabiti, molekül ağırlığı ve karışımın ısı kapasitesi bunlara ikame edilirse, karışımları için de geçerlidir.
Dalton Yasası. Mühendislik uygulamalarında, genellikle, özellikleri ideal gazlara benzeyen ve birbirleriyle kimyasal olarak reaksiyona girmeyen çeşitli gazların ayrı bileşenlerinin mekanik bir karışımı olan gaz halindeki maddelerle uğraşmak gerekir. Bunlar sözde gaz karışımları. Örnekler, içten yanmalı motorlarda, fırınlarda ve buhar kazanlarında yakıt yanma ürünleri, kurutma tesislerinde nemli hava vb.
Bir gaz karışımının davranışını belirleyen ana yasa Dalton yasasıdır: İdeal gaz karışımının toplam basıncı, tüm bileşenlerinin kısmi basınçlarının toplamına eşittir:
Kısmi basıncı pi- aynı sıcaklıkta karışımın tüm hacmini tek başına işgal eden bir gazın sahip olacağı basınç.
Karışım hazırlama yöntemleri. Gaz karışımının bileşimi kütle, hacim veya mol fraksiyonları ile belirlenebilir.
kütle kesri tek bir bileşenin kütle oranıdır Mi, karışımın kütlesine M:
olduğu ve olduğu açıktır.
Kütle kesirleri genellikle yüzde olarak verilir. Örneğin kuru hava için; .
Volumetrik kesir, azaltılmış gaz V hacminin karışımın toplam hacmine oranıdır. V: .
verilen basıncı ve sıcaklığı, karışımın basınç ve sıcaklığına eşit olsaydı, bir gazın bileşeninin kaplayacağı hacimdir.
Azaltılmış hacmi hesaplamak için iki durum denklemi yazıyoruz i-inci bileşen:
![]() ; (2.1)
; (2.1)
![]() .
.
İlk denklem, karışımdaki gaz bileşeninin kısmi basıncı pi ve karışımın tam hacmini ve ikinci denklemi kaplar - bileşenin basıncı ve sıcaklığı, karışımda olduğu gibi eşit olduğunda, indirgenmiş duruma, R ve T. Denklemlerden şu sonucu alır:
Karışımın tüm bileşenleri için (2.2) bağıntısını toplayarak, Dalton yasasını hesaba katarak, nereden geldiğini elde ederiz. Hacim kesirleri de genellikle yüzde olarak verilir. Hava için, .
Bazen karışımın bileşimini mol fraksiyonlarında belirtmek daha uygundur. mol kesri mol sayısının oranı denir Ni karışımın toplam mol sayısı dikkate alınan bileşenin N.
Gaz karışımının oluşmasına izin verin N1 ilk bileşenin molleri, N2 ikinci bileşenin mol sayısı, vb. Karışımın mol sayısı ve bileşenin mol fraksiyonu şuna eşit olacaktır. .
Avogadro yasasına göre, aynı anda herhangi bir gazın bir molünün hacmi R ve T,özellikle, karışımın sıcaklığında ve basıncında, ideal gaz halinde bunlar aynıdır. Bu nedenle, herhangi bir bileşenin azaltılmış hacmi, bir mol hacminin, bu bileşenin mol sayısıyla, yani karışımın hacmiyle - formülle hesaplanabilir. O zamanlar ![]() ve sonuç olarak, karışım gazlarının mol fraksiyonlarına göre ataması, hacim fraksiyonlarına göre atamaya eşittir.
ve sonuç olarak, karışım gazlarının mol fraksiyonlarına göre ataması, hacim fraksiyonlarına göre atamaya eşittir.
Bir gaz karışımının gaz sabiti. Karışımın tüm bileşenleri için denklemleri (2.1) toplayarak elde ederiz. 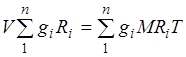 . düşünürsek yazabiliriz
. düşünürsek yazabiliriz
![]() , (2.3)
, (2.3)
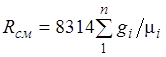 . (2.4)
. (2.4)
Denklem (2.3), ideal gazların bir karışımının da Clapeyron denklemine uyduğunu ima eder. Çünkü ![]() (2.4)'ten, [J/(kg-K)] karışımının gaz sabitinin şu şekilde olduğu sonucu çıkar.
(2.4)'ten, [J/(kg-K)] karışımının gaz sabitinin şu şekilde olduğu sonucu çıkar.
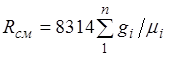 (2.5)
(2.5)
Karışımın görünen moleküler ağırlığı. Karışımın gaz sabitini resmi olarak ifade edelim. R, karışımın görünen oküler kütlesini tanıtarak: ![]() (2.6)
(2.6)
(2.5) ve (2.6) bağıntılarının sağ taraflarını karşılaştırarak buluruz:
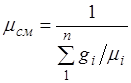 .
.
Kütle kesirlerinin tanımından şu sonuç çıkar:
Bu oranı tüm bileşenler için toplayarak ve bunu dikkate alarak, karışımın görünen moleküler ağırlığı ve kütlesi için hacim kesirleriyle verilen bir ifade elde ederiz:
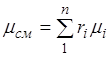 . (2.7)
. (2.7)
Hacim ve kütle kesirleri arasındaki oran.(2.7)'yi dikkate alarak, şunu elde ederiz: 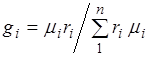 .
.
Çünkü 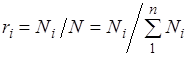 , sonra
, sonra
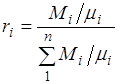
Bu formülün payını ve paydasını M karışımının kütlesine bölerek elde ederiz.
 .
.
Termodinamiğin birinci yasasının analitik ifadesi
Termodinamiğin birinci yasası, termal olaylara uygulanan enerjinin korunumu ve dönüşümünün evrensel yasasının özel bir halidir. Einstein denklemine göre kütle ve enerjinin tek bir korunumu ve dönüşüm yasasını dikkate almak gerekir. Bununla birlikte, teknik termodinamikte, kütle kusurunun sıfıra eşit olduğu çok düşük nesne hızlarıyla uğraşıyoruz ve bu nedenle enerjinin korunumu yasası bağımsız olarak düşünülebilir.
Enerjinin korunumu ve dönüşümü yasası, büyük miktarda deneysel verinin genelleştirilmesi temelinde elde edilen ve tüm doğal olaylara uygulanabilen temel bir doğa yasasıdır. Enerjinin kaybolmadığını ve tekrar ortaya çıkmadığını, sadece bir biçimden diğerine geçtiğini ve bir türün enerjisindeki azalmanın başka bir türe eşdeğer miktarda enerji verdiğini savunuyor.
Yurttaşımız M. V. Lomonosov (1711 - 1765), maddenin ve enerjinin korunumu ilkesini doğrulayan ilk bilim adamları arasındaydı.
Hacimli bir çalışma gövdesine izin verin V ve ağırlık M, bir sıcaklığa sahip olmak T ve basınç R, Dışarıdan sonsuz miktarda ısı iletilir. Isı kaynağının bir sonucu olarak, vücut tarafından ısıtılır. dT ve hacim artar dV.
Vücut sıcaklığındaki bir artış, parçacıklarının kinetik enerjisindeki bir artışı gösterir. Vücut hacmindeki bir artış, parçacıkların potansiyel enerjisinde bir değişikliğe yol açar. Sonuç olarak, vücudun iç enerjisi artar. dÜ.Çalışma akışkanı, üzerine basınç uygulayan bir ortam tarafından çevrelendiğinden, genleştiğinde dış basınç kuvvetlerine karşı mekanik iş yapar. Sistemde başka bir değişiklik olmadığından, enerjinin korunumu yasasına göre
![]() (2.8)
(2.8)
yani sisteme verilen ısı, iç enerjisini arttırmaya ve dış iş yapmaya gider.
Ortaya çıkan denklem, termodinamiğin birinci yasasının matematiksel bir ifadesidir. Bu oranın üç teriminden her biri pozitif, negatif veya sıfır olabilir. Bazı özel durumları ele alalım.
1. - Sistem ile ortam arasında ısı alışverişi yoktur yani sisteme ısı verilmemekte ve sistemden uzaklaştırılmamaktadır. Isı alışverişi olmayan sürece denir adyabatik. Bunun için denklem (2.8) şu şekli alır:
Bu nedenle sistem tarafından yapılan genişleme işi Adyabatik süreç, verilen sistemin iç enerjisindeki azalmaya eşittir. Çalışma akışkanının adyabatik sıkıştırılması ile dışarıdan yapılan iş tamamen sistemin iç enerjisini artırmaya gider.
2. - Vücudun hacmi değişmezken, dV=0 . Böyle bir sürece denir izokorik, onun için
yani sabit bir hacimde sisteme verilen ısı miktarı, bu sistemin iç enerjisindeki artışa eşittir.
3. dU=0– sistemin iç enerjisi değişmez ve
şunlar. Sisteme verilen ısı, buna eşdeğer dış işe dönüştürülür.
1 kg çalışma sıvısı içeren bir sistem için
![]() . (2.9)
. (2.9)
Bazı işlemler için (2.8) ve (2.9) denklemlerini entegre ederek, termodinamiğin birinci yasasının ifadesini şu şekilde elde ederiz: integral formu:
![]() ; .
; .
İçsel enerji
Sistemin iç enerjisi şunları içerir:
parçacıkların öteleme, dönme ve titreşim hareketinin kinetik enerjisi;
parçacık etkileşiminin potansiyel enerjisi;
enerji elektron kabukları atomlar;
intranükleer enerji.
Çoğu ısı ve güç işleminde, son iki bileşen değişmeden kalır. Bu nedenle, gelecekte altındaiçsel enerji öteleme, dönme ve dönme enerjisi de dahil olmak üzere moleküllerin ve atomların kaotik hareketinin enerjisini anlayacağız. salınım hareketleri hem moleküler hem de molekül içi, ayrıca moleküller arasındaki etkileşim kuvvetlerinin potansiyel enerjisi.
Kinetik enerji moleküller sıcaklığın bir fonksiyonudur, potansiyel enerjinin değeri moleküller arasındaki ortalama mesafeye ve dolayısıyla gazın kapladığı hacme bağlıdır. V, yani bir fonksiyondur v.Öyleyse iç enerji U, vücudun durumunun bir fonksiyonudur.
İçin Kompleks sistem bireysel parçaların enerjilerinin toplamı ile belirlenir, yani toplamsallık özelliğine sahiptir. Değer u=U/M, aranan belirli iç enerji (J/kg), bir maddenin birim kütlesinin iç enerjisidir.
Aşağıda, kısaca, miktara atıfta bulunacağız. ve sadece iç enerji. İç enerji vücudun durumunun bir fonksiyonu olduğundan, bu durumu belirleyen herhangi iki bağımsız parametrenin bir fonksiyonu olarak temsil edilebilir:
; ; .
Termodinamik süreçteki değişimi, sürecin doğasına bağlı değildir ve yalnızca vücudun ilk ve son durumları tarafından belirlenir:
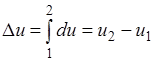 ;
;
İlk durumda iç enerjinin değeri ve - son durumda. Matematiksel olarak bu, iç enerjide sonsuz küçük bir değişim olduğu anlamına gelir. du var toplam diferansiyel ve; İç enerjiyi belirli hacim ve sıcaklığın bir fonksiyonu olarak ifade edersek, o zaman
Moleküller arasında etkileşim kuvvetlerinin olmadığı ideal bir gazın iç enerjisi, gaz hacmine veya basıncına bağlı değildir, a sadece sıcaklığı ile belirlenir, bu nedenle ideal bir gazın iç enerjisinin sıcaklığa göre türevi toplam türevdir:
Teknik termodinamiğin problemleri için önemli olan iç enerjinin mutlak değeri değil, onun çeşitli şekillerdeki değişimidir. termodinamik süreçler. Bu nedenle, iç enerjinin kaynağı keyfi olarak seçilebilir. Örneğin, su için uluslararası anlaşmaya göre, iç enerjinin değeri 0,01 ° C sıcaklıkta ve 610.8 Pa basınçta sıfır olarak ve ideal gazlar için - basınçtan bağımsız olarak 0 ° C'de alınır.
Genişletme çalışması
Termodinamikte olduğu kadar mekanikte de iş, çalışma gövdesine etki eden kuvvetin ürünü ve hareket yolu ile belirlenir.
Kütlesi olan bir gaz düşünün M ve hacim V, yüzey F ile elastik bir kabuk içine alınır.
 |
Gaza belirli bir miktar ısı verilirse, dış basınca karşı iş yaparken genleşir. R,çevre tarafından ona uygulandı. Gaz, kabuğun her bir elemanına etki eder. dF eşit bir kuvvetle pdf ve normal boyunca yüzeye belirli bir mesafede hareket ettirmek dn, taahhüt eder temel iş pdfdn. Sonsuz küçük bir işlem sırasında yapılan toplam iş, bu ifadenin tüm yüzey üzerinde integrali alınarak elde edilebilir. F kabuklar: ![]() .
.
Hacmin değiştiği şekilden de anlaşılacağı dV yüzey üzerinde bir integral olarak ifade edilir: ![]() ,
Sonuç olarak
,
Sonuç olarak
Hacimdeki sonlu bir değişiklikle, dış basınç kuvvetlerine karşı yapılan işe denir. genişletme çalışması, eşittir
(3.1)'den şu sonuç çıkar ve dV her zaman var özdeş işaretler:
eğer dV>0, o zaman ve > 0, yani genişleme sırasında cismin işi pozitiftir, cismin kendisi işi yapar;
eğer dV<0, sonra ve<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
Genişleme işini, çalışma gövdesinin kütlesinin 1 kg'ına atfederek elde ederiz.
l = L/M; .
1 kg gaz içeren bir sistem tarafından gerçekleştirilen belirli işi temsil eden değer şuna eşittir:
Genel olarak R değişken ise, entegrasyon ancak basınç değişimi yasası bilindiğinde mümkündür. p = p(v).
(3.1) - (3.2) formülleri sadece çalışma akışkanının basıncının ortamın basıncına eşit olduğu denge süreçleri için geçerlidir.
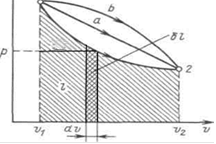
Termodinamikte denge süreçleri yaygın olarak kullanılmaktadır. p,v- apsis ekseninin belirli hacim ve ordinat ekseninin basınç olduğu bir diyagram. Bir termodinamik sistemin durumu iki parametre tarafından belirlendiğinden, p,v Diyagramda bir nokta ile temsil edilir. Şekildeki nokta 1 sistemin ilk durumuna karşılık gelir, nokta 2 - final ve çizgi 12 - çalışma sıvısını genişletme süreci v1önceki v2. Hacimdeki sonsuz küçük bir değişiklikle, gölgeli dikey şeridin alanı; bu nedenle sürecin çalışması 12 süreç eğrisi, apsis ekseni ve uç koordinatlarla sınırlanan alanla gösterilir.
Böylece, hacmi değiştirme işi, p,v diyagramında (Şekil 3.1) proses eğrisinin altında kalan alana eşittir.
Şekil 3.1 - İşin grafiksel gösterimi p, v- koordinatlar
Durumdan / duruma sistem geçişinin her yolu 2 (örneğin, 12, 1a2 veya 1b2) genişletme çalışmasına karşılık gelir. iş termodinamik sürecin doğasına bağlıdır, ve sistemin sadece ilk ve son durumlarının bir fonksiyonu değildir. Öte yandan, entegrasyon yoluna bağlıdır ve bu nedenle, temel iş tam bir diferansiyel değildir.
İş her zaman uzaydaki makroskopik cisimlerin hareketi ile, örneğin bir pistonun hareketi, bir kabuğun deformasyonu ile ilişkilidir, bu nedenle bir vücuttan diğerine düzenli (makrofiziksel) bir enerji transferi biçimini karakterize eder ve bir ölçüsüdür. aktarılan enerji. Değer, hacimdeki artışla orantılı olduğundan, termal enerjiyi mekanik enerjiye dönüştürmek için tasarlanmış çalışma gövdeleri olarak hacimlerini önemli ölçüde artırma yeteneğine sahip olanları seçmeniz önerilir. Bu kaliteye sıvıların gazları ve buharları sahiptir. Bu nedenle, örneğin, termik santrallerde, su buharı bir çalışma ortamı olarak hizmet eder ve içten yanmalı motorlarda, belirli bir yakıtın gaz halindeki yanma ürünleri.
Sıcaklık
Enerji transferinin makrofiziksel biçimine ek olarak, sistem ve çevre arasında moleküler düzeyde gerçekleştirilen bir mikrofizik, yani bir tür enerji alışverişi de vardır. Bu durumda sisteme iş yapılmadan enerji aktarılabilir. Mikrofiziksel yollarla aktarılan enerji miktarının ölçüsü, sıcaklık.
Isı, cisimler arasında doğrudan temas yoluyla (ısı iletimi, konveksiyon) veya belli bir mesafeden (ışıma yoluyla) aktarılabilir ve her durumda bu işlem ancak cisimler arasında bir sıcaklık farkı varsa mümkündür.
Aşağıda gösterileceği gibi, temel ısı miktarı ve ayrıca L iç enerji diferansiyelinin aksine toplam diferansiyel değildir dÜ. Bu matematiksel sembolizmin arkasında, içsel enerji, ısı ve iş kavramları arasındaki farkın derin fiziksel anlamı gizlidir.
İçsel enerji- sistemin kendisinin bir özelliğidir, sistemin durumunu karakterize eder. Sıcaklık ve iş- bunlar mekanik ve termal süreçlerin enerji özellikleridir.etkileşimler çevre ile sistemler. Belirli bir süreçte sisteme aktarılan veya sistem tarafından sınırları boyunca verilen enerji miktarlarını karakterize ederler.
entalpi
Termodinamikte, sistemin iç enerjisinin toplamı önemli bir rol oynar. sen ve sistem basıncının ürünleri R hacmine V, aranan entalpi ve belirtilen H:
İçinde yer alan miktarlar devletin işlevleri olduğundan, o zaman entalpi bir durum fonksiyonudur. Tıpkı iç enerji, iş ve ısı gibi joule (J) ile ölçülür.
![]() ,
,
aranan özgül entalpi(h = H/M), 1 kg madde içeren bir sistemin entalpisini temsil eder ve J/kg olarak ölçülür.
Entalpi bir durum fonksiyonu olduğundan, herhangi iki durum parametresinin bir fonksiyonu olarak temsil edilebilir:
![]() ;
; ![]() ;
; ![]() ,
,
ve değer gün toplam diferansiyeldir.
Herhangi bir süreçteki entalpi değişimi, yalnızca vücudun ilk ve son durumları tarafından belirlenir ve sürecin doğasına bağlı değildir.
Aşağıdaki örneği kullanarak entalpinin fiziksel anlamını bulalım. Silindir içindeki gaz ve toplam ağırlığı olan bir yükü olan bir pistonu içeren genişletilmiş bir sistemi ele alalım. G.
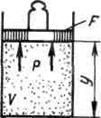 |
Bu sistemin enerjisi, gazın iç enerjisinin ve pistonun dış kuvvetler alanındaki yük ile potansiyel enerjisinin toplamıdır: . Denge halinde (G=pF) bu fonksiyon gaz parametreleri cinsinden ifade edilebilir: . Bunu anladık, yani entalpi, genişletilmiş bir sistemin enerjisi olarak yorumlanabilir.






