Vücudun iç enerjisi nasıl ve ne zaman değişir. İç enerjiyi değiştirmenin yolları
Değişikliği nasıl hesaplayabileceğinizi öğrenin içsel enerjiısı transferi sırasında. Bunu mümkün olduğu kadar doğru yapmak için, ısı değişimi sırasında açıklanamayan ısı kayıplarını en aza indirmek gerekir. Bu nedenle, ne zaman bilimsel araştırmaısı transferi, kullanımı ısı transferi sürecinde vücut tarafından verilen veya alınan ısıyı doğru bir şekilde belirlemenizi sağlayan bir kalorimetrede (Şekil 6.1) gerçekleştirilir.
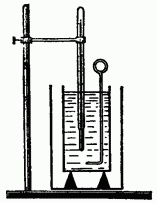
Kalorimetre iki kaptan oluşur: dış ve iç. İç kap iyi bir ısı iletkeninden (pirinç, bakır) yapılmıştır, çünkü sıcaklığı içine dökülen sıvı ile aynı olmalıdır.
Dış kap, iç kabı konveksiyon ve radyasyon yoluyla ısı kaybından korur. Bu nedenle genellikle beyaz boya ile boyanır veya parlak kalaydan yapılır.
İç kabı iletim yoluyla ısı kaybından korumak için ahşap desteklere yerleştirilir (ahşap zayıf ısı iletkenliğine sahiptir). İç kaba bir karıştırıcı (kapla aynı malzemeden) ve bir termometre yerleştirin.
Isı değişimi aşağıdaki gibi gerçekleştirilir. Teraziler yardımıyla kalorimetrenin iç kabının ve karıştırıcının kütlesi belirlenir ve daha sonra içine dökülen sıvının, örneğin suyun kütlesi belirlenir. Bundan sonra, vücudun kütlesi ölçülür, bilinen bir sıcaklığa ısıtılır ve fark edilir. başlangıç sıcaklığı sıvı, ısıtılan gövdeyi kalorimetreye indirin. Sıvının son sıcaklığını ölçerek, ısı transferi sürecinde vücudun ne kadar ısı yaydığını hesaplamak mümkündür.
Bu tür deneylerin yardımıyla, bir cismin iç enerjisindeki değişimin, kütlesi ve vücut sıcaklığındaki değişimle doğru orantılı olduğunu tespit etmek kolaydır.
![]()
burada c orantı katsayısıdır. Isı transferi sırasında iç enerjideki değişim ısı miktarı ile tahmin edildiğinden,
Vücudun ilk sıcaklığı genellikle son sıcaklık olarak belirtilir, daha sonra vücudun ısıtılması durumunda ve soğutma durumunda
Deneyler, maddenin türüne bağlı olduğunu göstermektedir. dış koşullar, maddenin toplam halinden. Bu bağımlılıklar (6.1) ve (6.2) formüllerinde c katsayısı ile ifade edilir.
Isıtma veya soğutma sırasında vücudun iç enerjisindeki değişimin maddenin türüne ve dış koşullara bağımlılığını karakterize eden c değerine denir. özısı maddeler. Bir maddenin özgül ısı kapasitesi, bir maddenin birim kütlesini birim sıcaklıkta ısıtmak için gereken ısı miktarı ile ölçülür:
![]()
Birimi türetiyoruz özısı SI'da:
SI'da, özgül ısı birimi, 1 K başına 1 kg kütleyi ısıtmak için 1 J enerji harcanan böyle bir maddenin özgül ısısıdır. Sıcaklıktaki küçük değişiklikler için özgül ısı kapasitesi sabit kabul edilebilir. Problemleri çözmek için tablolardan alınır.
Bir cismin ısınması için gerekli olan veya soğutulması sırasında açığa çıkan ısı miktarını belirlerken, bazen cismin ısı kapasitesinin (C cismi) kullanıldığı akılda tutulmalıdır - bu, cismi birim başına ısıtmak için gerekli ısı miktarı ile ölçülen bir değerdir. sıcaklık. Sonuç olarak,
Vücudun tek tek bölümleri farklı maddelerden yapıldığında, hesaplamalarda tüm vücudun ısı kapasitesini kullanmak özellikle uygundur. SI'da, bir cismin ısı kapasitesi birimi alınır (Bunu formül (6.3) kullanarak gösterin.)
Ayrıca, bir gazın özgül ısı kapasitesinin, ısıtıldığı işlemin doğasına bağlı olduğunu da not ediyoruz. Örneğin, bir gazın özgül ısı kapasitesi sabit basınçözgül ısı kapasitesinden daha büyük sabit hacimçünkü ilk durumda sadece gazın iç enerjisini arttırmak değil, aynı zamanda genişleme sürecinde gazın dış cisimler üzerinde yaptığı işi gerçekleştirmek için enerji harcamak da gereklidir (§ 5.10). İkinci durumda, gaza verilen ısı sadece iç enerjisini arttırmaya gider.
içsel enerji vücudu oluşturan tüm parçacıkların kinetik enerjilerinin toplamıdır ve potansiyel enerjiler Bu parçacıklar arasındaki etkileşimler. Bu, elektronların çekirdeklerle etkileşim enerjisini ve etkileşim enerjisini içerir. oluşturan parçalarçekirdekler.
İç enerji sıcaklığına bağlıdır. Sıcaklık, bir maddenin parçacıklarının ortalama kinetik enerjisini karakterize eder. Sıcaklık değiştiğinde tanecikler arasındaki mesafe değişir, dolayısıyla aralarındaki etkileşim enerjisi de değişir.
İç enerji, bir madde bir kümelenme durumundan diğerine geçtiğinde de değişir. Bir maddenin sıcaklığındaki veya kümelenme durumundaki bir değişiklikle ilgili işlemlere denir. termal. Termal süreçlere vücudun iç enerjisindeki bir değişiklik eşlik eder.
kimyasal reaksiyonlar, nükleer reaksiyonlar ayrıca vücudun iç enerjisinde bir değişiklik eşlik eder, tk. reaksiyonlarda yer alan parçacıkların etkileşim enerjisi değişir. Elektronların bir kabuktan diğerine geçişi sırasında atomlar enerji yaydığında veya emdiğinde iç enerji değişir.
Biri iç enerjiyi değiştirmenin yolları dır-dir İş. Böylece, iki cismin sürtünmesi sırasında sıcaklıkları artar, yani. iç enerjileri artar. Örneğin, metallerin işlenmesinde - delme, tornalama, frezeleme.
Sıcaklıkları farklı iki cisim temas ettiğinde, cisimden enerji transferi gerçekleşir. Yüksek sıcaklık düşük sıcaklığa sahip bir vücuda. Enerjiyi bir vücuttan diğerine daha düşük bir sıcaklıkta aktarma işlemine denir. ısı transferi.
Böylece, doğada vücudun iç enerjisinin değiştiği iki süreç vardır:
a) dönüşüm mekanik enerji iç ve tersi için; iş yapılırken;
b) ısı transferi; hiçbir iş yapılmazken.
Sıcak ve soğuk suyu karıştırırsanız, deneyimle ortaya çıkan ısı miktarının ne kadar olduğunu görebilirsiniz. sıcak su, ve soğuk suyun aldığı ısı miktarı birbirine eşittir. Deneyimler, cisimler arasında ısı alışverişi olursa, tüm ısıtma cisimlerinin iç enerjisinin, soğutma cisimlerinin iç enerjisinin azalması kadar arttığını göstermektedir. Böylece, enerji bir cisimden diğerine geçer, ancak tüm cisimlerin toplam enerjisi değişmeden kalır. BT enerjinin korunumu ve dönüşümü yasası.
Doğada meydana gelen tüm olaylarda enerji ortaya çıkmaz ve yok olmaz. Değeri korunurken yalnızca bir türden diğerine değişir.
Örneğin belirli bir hızda uçan kurşun bir mermi bir engele çarpar ve ısınır.
Veya bir kar bulutundan düşen bir buz parçası yere yakın erir.
Veya bir su ısıtıcısı gazlı ocakta ısıtılır, suyun bir kısmı buharlaşır.
Enerjinin korunumu yasası, bilim ve teknolojinin tüm alanlarındaki hesaplamaların bilimsel temelidir. Tamamen iç enerjinin mekanik enerjiye dönüştürülemeyeceği akılda tutulmalıdır.
İç enerji iki şekilde değiştirilebilir.
Bir cisme iş yapılırsa, iç enerjisi artar.
Vücudun iç enerjisi(E veya U olarak gösterilir) bir molekülün moleküler etkileşimlerinin ve termal hareketlerinin enerjilerinin toplamıdır. İç enerji, sistemin durumunun tek değerli bir fonksiyonudur. Bu, bir sistem kendisini belirli bir durumda bulduğunda, iç enerjisinin, sistemin geçmişine bakılmaksızın bu durumun doğasında bulunan değeri üstlendiği anlamına gelir. Sonuç olarak, bir durumdan diğerine geçiş sırasında iç enerjideki değişiklik, geçişin yapıldığı yoldan bağımsız olarak, her zaman son ve ilk durumlardaki değerleri arasındaki farka eşit olacaktır.
Bir cismin iç enerjisi doğrudan ölçülemez. Sadece iç enerjideki değişim belirlenebilir:
Bu formül, termodinamiğin birinci yasasının matematiksel bir ifadesidir.
Yarı statik süreçler için aşağıdaki ilişki geçerlidir:
Kelvin cinsinden ölçülen sıcaklık
Joule/kelvin cinsinden ölçülen entropi
Paskal cinsinden ölçülen basınç
Sistemlerdeki parçacık sayısı
Yakıtın yanma ısısı. koşullu yakıt Yakıtı yakmak için gereken hava miktarı.
Bir yakıtın kalitesi, kalorifik değeri ile değerlendirilir. Endeks, katı ve sıvı yakıtları karakterize etmek için kullanılır. özısı bir birim kütlenin (kJ / kg) tam yanması sırasında açığa çıkan ısı miktarı olan yanma. İçin gazlı türler yakıt, birim hacmin (kJ / m3) yanması sırasında açığa çıkan ısı miktarı olan hacimsel yanma ısısının bir göstergesi kullanılır. Ek olarak, bazı durumlarda gaz halindeki yakıt, bir mol gazın (kJ / mol) tamamen yanması sırasında açığa çıkan ısı miktarı ile tahmin edilir.
Yanma ısısı sadece teorik olarak değil, aynı zamanda belirli miktarda yakıtın kalorimetre adı verilen özel cihazlarda yakılmasıyla ampirik olarak da belirlenir. Yanma ısısı, kolorimetredeki su sıcaklığındaki artışla tahmin edilir. Bu yöntemle elde edilen sonuçlar, yakıtın elementel bileşiminden hesaplanan değerlere yakındır.
Soru 14Isıtma ve soğutma sırasında iç enerjideki değişim. Hacim değişikliği ile gaz işi.
Vücudun iç enerjisi bağlıdır moleküllerinin ortalama kinetik enerjisine bağlıdır ve bu enerji de sıcaklığa bağlıdır. Dolayısıyla vücut ısısını değiştirerek iç enerjisini de değiştiririz.Bir cisim ısıtıldığında iç enerjisi artar, soğuduğunda ise azalır.
Vücudun iç enerjisi iş yapmadan değiştirilebilir. Örneğin, ocakta bir çaydanlık su ısıtılarak veya bir bardak sıcak çayın içine bir kaşık indirilerek artırılabilir. Ateşin yakıldığı şömine, güneşle aydınlatılan evin çatısı vb. ısıtılır.Bütün bu durumlarda vücutların sıcaklığındaki artış, iç enerjilerinde bir artış anlamına gelir, ancak bu artış iş yapmadan gerçekleşir. .
İç enerjideki değişim cismin iş yapmamasına ısı transferi denir. Isı transferi farklı sıcaklıklara sahip cisimler (veya aynı cismin parçaları) arasında gerçekleşir.
Örneğin, soğuk bir kaşık sıcak su ile temas ettiğinde ısı transferi nasıl gerçekleşir? İlk olarak, ortalama hız ve kinetik enerji moleküller sıcak su kaşığın yapıldığı metal parçacıkların ortalama hızını ve kinetik enerjisini aşıyor. Ancak kaşığın suyla temas ettiği yerlerde, sıcak su molekülleri kinetik enerjilerinin bir kısmını kaşığın parçacıklarına aktarmaya başlar ve daha hızlı hareket etmeye başlarlar. Bu durumda su moleküllerinin kinetik enerjisi azalır ve kaşık parçacıklarının kinetik enerjisi artar. Enerji ile birlikte sıcaklık da değişir: su yavaş yavaş soğur ve kaşık ısınır. Sıcaklıklarındaki değişiklik, hem su hem de kaşık için aynı olana kadar gerçekleşir.
Isı değişimi sırasında bir vücuttan diğerine aktarılan iç enerjinin bir kısmı bir harfle gösterilir ve ısı miktarı olarak adlandırılır.
Q, ısı miktarıdır.
Isı miktarı sıcaklık ile karıştırılmamalıdır. Sıcaklık derece olarak ölçülür ve ısı miktarı (diğer enerjiler gibi) joule cinsinden ölçülür.
Organların teması üzerine farklı sıcaklıklar daha sıcak bir vücut biraz ısı verir ve daha soğuk bir vücut onu alır.
İzobarik gaz genleşmesinde çalışın. Ana biri termodinamik süreçler, çoğu ısı motorunda yer alan, işin performansı ile gazın genleşmesi işlemidir. Bir gazın izobarik genleşmesi sırasında yapılan işi belirlemek kolaydır.
Gazın V1 hacminden V2 hacmine izobarik genişlemesi sırasında piston silindir içinde l mesafesinde hareket ederse (Şekil 106), o zaman gaz tarafından gerçekleştirilen A "işine eşittir.
p gaz basıncı olduğunda, hacmindeki değişikliktir.
İsteğe bağlı bir gaz genleşme süreci ile çalışın. Hacim V1'den hacim V2'ye keyfi bir gaz genleşme süreci, bir dizi alternatif izobarik ve izokorik süreç olarak temsil edilebilir.
İzotermal gaz genleşmesiyle çalışın. İzoterm ve izobar bölümleri altındaki şekillerin alanlarını karşılaştırarak, izobarik genleşme durumunda, gazın aynı başlangıç gaz basıncı değerinde V1 hacminden V2 hacmine genişlemesine daha fazla çalışma eşlik ettiği sonucuna varabiliriz.
Gaz sıkıştırma ile çalışın. Gaz genişlediğinde, gaz basınç kuvvet vektörünün yönü yer değiştirme vektörünün yönü ile çakışır, bu nedenle gaz tarafından gerçekleştirilen A işi pozitiftir (A" > 0) ve dış kuvvetlerin A işi negatiftir: A \u003d -A "< 0.
Gaz sıkıştırırken dış kuvvet vektörünün yönü hareket yönü ile çakışır, bu nedenle dış kuvvetlerin A işi pozitiftir (A > 0) ve A "gaz tarafından gerçekleştirilen A işi negatiftir (A"< 0).
Adyabatik süreç. İzobarik, izokorik ve izotermal süreçler adyabatik süreçler genellikle termodinamikte düşünülür.
Adyabatik süreçÇevredeki cisimlerle ısı alışverişi olmadığında, yani Q = 0 koşulu altında termodinamik bir sistemde meydana gelen bir süreçtir.
Soru 15 Vücudun denge koşulları. Güç anı. Denge türleri.
Doğa ve insan bilimlerinde bir dizi ilgili fenomenin dengesi veya dengesi.
Bu sistem üzerindeki tüm etkiler başkaları tarafından telafi edilirse veya tamamen yoksa, bir sistem denge durumunda kabul edilir. Benzer bir kavram istikrardır. Denge, kararlı, kararsız veya kayıtsız olabilir.
Tipik denge örnekleri:
1. Mekanik denge olarak da bilinen statik denge, - üzerine etki eden kuvvetlerin ve momentlerin toplamının sıfıra eşit olduğu, durgun veya düzgün hareket eden bir cismin durumu.
2. Kimyasal denge - bulunduğu konum Kimyasal reaksiyon ters reaksiyon ile aynı ölçüde ilerler ve sonuç olarak her bileşenin miktarında bir değişiklik olmaz.
3. Gerekliliği anlaşılarak ve bazı durumlarda bu dengeyi yapay olarak koruyarak sürdürülen insanların ve hayvanların fiziksel dengesi [kaynak belirtilmemiştir 948 gün].
4. Termodinamik denge - iç süreçlerinin makroskopik parametrelerde (sıcaklık ve basınç gibi) değişikliklere yol açmadığı sistemin durumu.
R cebirsel toplamın sıfıra eşitliği kuvvetlerin anları ayrıca vücudun mutlaka dinlenmede olduğu anlamına gelmez. Birkaç milyar yıl boyunca, Dünya'nın kendi ekseni etrafındaki dönüşü sabit bir periyotla devam eder, çünkü Dünya'ya diğer cisimlerden etki eden kuvvetlerin momentlerinin cebirsel toplamı çok küçüktür. Aynı nedenle, dönen bisiklet tekerleği sabit bir frekansta dönmeye devam eder ve sadece dış kuvvetler bu rotasyonu durdurun.
Denge türleri. Pratikte, sadece cisimler için denge koşulunun yerine getirilmesiyle değil, aynı zamanda dengenin stabilite olarak adlandırılan niteliksel özelliğiyle de önemli bir rol oynar. Üç tür vücut dengesi vardır: kararlı, kararsız ve kayıtsız. Küçük dış etkilerden sonra vücut orijinal denge durumuna geri dönerse, dengeye kararlı denir. Bu, cismin başlangıç konumundan herhangi bir yönde hafif bir yer değiştirmesiyle, cisme etki eden kuvvetlerin bileşkesi sıfırdan farklı olursa ve denge konumuna yönlendirilirse olur. Kararlı dengede, örneğin, girintinin dibinde bir top bulunur.
Bir cismin dengesi için genel koşul. İki sonucu birleştirerek, bir cismin dengesi için genel bir koşul formüle edebiliriz: Bir cisim, kendisine uygulanan tüm kuvvetlerin vektörlerinin geometrik toplamı ve bu kuvvetlerin ekseni etrafındaki momentlerinin cebirsel toplamı ise dengededir. rotasyon sıfıra eşittir.
Soru 16Buharlaşma ve yoğunlaşma. Buharlaşma. Kaynayan sıvı. Kaynayan sıvının basınca bağımlılığı.
Buharlaşma - değiştirmek için sıvıları düşürme özelliği toplama durumu ve buhara dönüşür. Sadece damlayan bir sıvının yüzeyinde meydana gelen buharlaşmaya buharlaşma denir. Bir sıvının tüm hacmi boyunca buharlaşmaya kaynama denir; basınca bağlı olarak belirli bir sıcaklıkta gerçekleşir. Bir sıvının belirli bir sıcaklıkta kaynadığı basınca basınç denir. doymuş buharlar pnp, değeri sıvının türüne ve sıcaklığına bağlıdır.
buharlaşma bir maddenin hareket ettiği süreçtir sıvı hal gaza (buhar) dönüştürür. Buharlaştırma işlemi, yoğuşma işleminin tersidir (buhardan sıvı hale geçiş. Buharlaşma (buharlaşma), bir maddenin yoğun (katı veya sıvı) fazdan gaz (buhar) haline geçişi; faz geçişi ilk tür.
yoğunlaşma - buharlaşmanın tersi bir süreçtir. Yoğunlaşma sırasında buhar molekülleri sıvıya geri döner. Kapalı bir kapta, sıvıdan çıkan moleküllerin sayısı buhardan sıvıya dönen moleküllerin sayısına eşit olduğunda, yani buharlaşma ve yoğunlaşma aynıdır. Böyle bir sisteme iki fazlı sistem denir. Sıvısı ile dengede olan buhara doymuş buhar denir. Bir sıvının birim yüzey alanından bir saniyede yayılan molekül sayısı, sıvının sıcaklığına bağlıdır. Buhardan sıvıya dönen moleküllerin sayısı, buhar moleküllerinin konsantrasyonuna ve ortalama sürat buharın sıcaklığı tarafından belirlenen termal hareketleri.
Kaynamak- bir sıvı içinde buharlaşma süreci (bir maddenin sıvıdan sıvıya geçişi) gaz hali), faz ayırma sınırlarının görünümü ile. Kaynama noktası atmosferik basınç genellikle kimyasal olarak saf bir maddenin ana fizikokimyasal özelliklerinden biri olarak verilir.
Kaynama türüne göre ayırt edilir:
1. büyük hacimde serbest konveksiyonla kaynatma;
2. Zorlanmış konveksiyon altında kaynama;
3. hem de ilişki olarak ortalama sıcaklık sıvı ila doyma sıcaklığı:
4. doyma sıcaklığına kadar soğutulmuş bir sıvının kaynatılması (yüzey kaynaması);
5. doyma sıcaklığına kadar ısıtılmış bir sıvının kaynatılması
kabarcık
Kaynamak , buharın periyodik olarak ortaya çıkan ve büyüyen kabarcıklar şeklinde oluştuğu kaynama çekirdekli kaynama olarak adlandırılır. Bir sıvıda yavaş çekirdekli kaynama ile (daha doğrusu, bir kural olarak, duvarlarda veya kabın dibinde), buharla dolu kabarcıklar ortaya çıkar. Baloncukların içindeki sıvının yoğun buharlaşması nedeniyle büyürler, yüzerler ve buhar, sıvının üzerindeki buhar fazına salınır. Bu durumda, duvara yakın katmanda sıvı hafif aşırı ısınma durumu, yani sıcaklığı nominal kaynama noktasını aşıyor. Normal şartlar altında bu fark küçüktür (bir derece mertebesinde).
Film
Isı akışı belirli bir kritik değere yükseldiğinde, bireysel kabarcıklar birleşerek, kap duvarının yakınında sürekli bir buhar tabakası oluşturarak sıvı hacmini periyodik olarak keser. Bu moda film modu denir.
©2015-2017 sitesi
Tüm hakları yazarlarına aittir. Bu site yazarlık iddiasında bulunmaz, ancak ücretsiz kullanım sağlar.






