Katı hal molekülleri arasındaki mesafe. Maddenin toplam halleri. başka bir kümelenme durumu
Tam metin araması:
Fizik->Laboratuvar çalışması
Daha önce kurabiye yaptıysanız ve mutfak kapınızı açık bıraktıysanız, kokunun evin her tarafına yayıldığını muhtemelen biliyorsunuzdur. Kurabiyelerin pişirildiği mutfakta en güçlüsüdür, yemek odası veya oturma odasında biraz daha az ve en azından üst kattaki yatak odasında. Ve köşe yatak odasında kapı kapalıysa, kurabiye kokusu daha da zayıftır.
Rastgele moleküler harekete ne sebep olur?
Moleküller, yüksek konsantrasyonlu bir alandan düşük konsantrasyonlu bir alana hareket ettiğinde. difüzyon hızını etkiler. Borularda suda çözünen katı tuz kristalleri hazneye doğru yayılır. Tatlı su akışı, rezervuardaki tuzlu suyun yerini aldı. Tuz bu su akışında depolandı.
Süreçlerin incelenmesi elektrik devresiİle birlikte paralel bağlantı farklı oranlarda endüktif ve kapasitif elemanlar içeren alıcılar...tam>>
Fizik->Laboratuvar çalışması
Seri olarak içeren tek fazlı sinüzoidal voltaj devresinin elektrik parametreleri üzerindeki bobin endüktansının etkisinin araştırılması ... tamamen>>
Doğada maddeler bulunur
Suda çözündüğünde, helyum havadan daha yüksek bir difüzyona sahiptir. 
Sistemin enerjisi arttığında ve katı halin rijit yapısı bozulduğunda sıvılar oluşur. Sıvılarda moleküller birbiri ardına hareket edebilir ve diğer moleküllerle çarpışabilir; bununla birlikte, katılar gibi birbirlerine nispeten yakın kalırlar. Genellikle sıvılarda moleküller arası kuvvetler molekülleri bir arada tutar ve hızla parçalanır. Sıvının sıcaklığı arttıkça, tek tek moleküllerin hareket sayısı artar.
Ana Sayfa > Soyut >Fizik
1 Bakım………………………………………………………..2
2 Ana gövde
2.1 Sıvının yapısı. Sıvı moleküllerin hareketi………3
2.2 Sıvıdaki basınç………………………………………….4
2.3 Arşimet Yasası ……………………………………………….5
2.4 Buharlaşma………………………………………………………6
Sonuç olarak, sıvılar kaplarının şeklini almak için "akabilir", ancak moleküller zaten birbirine yakın olduğu için kolayca sıkıştırılamazlar. Bu nedenle sıvıların şekli belirsiz ama hacmi belirlidir. Aşağıdaki animasyon örneğinde, sıvı suyun birbirinden serbestçe hareket edebilen, ancak birbirlerine belirli bir mesafede nispeten yakın kalan moleküllerden oluştuğunu görüyoruz.

Gazlar, bir sistemdeki enerji, moleküller arasındaki tüm çekici kuvvetleri aştığında oluşur. Bu nedenle, gaz molekülleri, zaman zaman birbirleriyle çarpışmaları dışında, birbirleriyle çok az etkileşirler. Gaz halindeyken, moleküller hızlı hareket eder ve uzun mesafelere yayılarak herhangi bir yönde serbestçe hareket eder. Gazın sıcaklığı arttıkça, tek tek moleküllerin hareket sayısı artar. Gazlar kaplarını doldurmak için genişler ve düşük yoğunluğa sahiptir.
2.5 Kaynama……………………………………………………….7
2.6 Sıvının yüzey gerilimi………………………….8
2.7 Sıvı filmler……………………………………………9
2.8 Islatma ve ıslatmama……………………………….….10
2.9 Kılcal olaylar…………………………………………..12
2.10 Elektrik sıvılarda…………………………..13
3 Sonuç……………………………………………………..14
Orantılılık katsayısı k, bir maddenin elektrokimyasal eşdeğeri olarak adlandırılır. Elektrolitten tek bir elektrik yükünün geçişi sırasında salınan maddenin kütlesine sayısal olarak eşittir ve maddenin kimyasal yapısına bağlıdır.
Tek tek moleküller geniş ölçüde ayrıldığından ve gaz halinde kolayca hareket edebildiğinden, gazlar kolayca sıkıştırılır ve belirsiz bir şekle sahiptir. Katılar, sıvılar ve gazlar, gezegenimizde var olan en yaygın madde halleridir. Bu üç durumdaki su moleküllerinin moleküler hareketindeki farklılıklara dikkat edin.
Kaynaklar……………………………………………………16
1. Giriş
AT Gündelik Yaşam genellikle maddenin üç fazlı hali ile karşılaşırız - katı, sıvı ve gaz. Gazların ve katı kristal cisimlerin yapısı hakkında oldukça net bir fikrimiz var. Bir gaz, birbirinden bağımsız olarak her yöne rastgele hareket eden bir molekül topluluğudur. Katı bir cisimde, tüm moleküller, belirli denge konumları etrafında sadece küçük salınımlar yaparak karşılıklı düzenlerini uzun süre korurlar.

Plazma sıcak, iyonize gazlardır. Plazma, son derece yüksek enerji koşulları altında oluşur, o kadar yüksek ki moleküller parçalanır ve sadece serbest atomlar bulunur. Daha da çarpıcı olanı, plazmaların o kadar çok enerjisi vardır ki, dış elektronlar aslında tek tek atomlardan sıyrılır, böylece yüksek enerjili yüklü iyonlardan oluşan bir gaz oluşturur. Plazmalarda atomlar yüklü iyonlar halinde bulunduğundan, plazmalar maddenin dördüncü hali olan gazlardan farklı davranır.
Bu yazıda, maddenin sıvı halinin daha ayrıntılı bir değerlendirmesine odaklanacağım. Ana özellik Bu kümelenme durumu, gazlar ve kristaller arasında bir ara konum işgal eden sıvı halin, bu iki durumun bazı özelliklerini birleştirmesidir. Özellikle sıvılar için olduğu kadar kristal gövdeler için de belirli bir hacmin varlığı karakteristiktir ve aynı zamanda gaz gibi bir sıvı içinde bulunduğu kabın şeklini alır. Çoğu insan sıvıların kendilerine ait bir şekli olmadığını düşünme eğilimindedir. Ama bu doğru değil. Herhangi bir sıvının doğal şekli bir küredir. Genellikle yerçekimi sıvının bu şekli almasını engeller, sıvı ya yüzeyde ince bir tabaka halinde yayılır ya da içine dökülürse kap şeklini alır.
Plazma basitçe yukarıya bakarak görüntülenebilir; Güneşimiz gibi yıldızlarda bulunan yüksek enerji koşulları, tek tek atomları bir plazma durumuna zorlar. Belirsiz bir şekle sahip olun ve kaplarını doldurmak için genişleyin.
Gördüğümüz gibi, enerjideki bir artış daha fazla moleküler hareketle sonuçlanır. Tersine, enerjide bir azalma daha az moleküler hareketle sonuçlanır. Sonuç olarak, kinetik bir tahmin moleküler teori Maddenin enerjisini düşürmeye devam edersek, tüm moleküler hareketin durduğu bir noktaya ulaşacağımızdır. Moleküler hareketin durduğu sıcaklığa mutlak sıfır denir ve -15 santigrat derece olarak hesaplanır. Bilim adamları maddeleri yakın sıcaklıklara soğuturken tamamen sıfır, asla mutlak sıfıra ulaşmadılar.
Sıvıların ara konumu, sıvı halinin özellikleri bakımından özellikle karmaşık olmasından kaynaklanmaktadır. Sıvılar, en azından Arşimet zamanından, yani 2200 yıl öncesinden beri bilimsel çalışmanın konusu olmasına rağmen, sıvıların davranışlarının analizi hala uygulamalı bilimin en zor alanlarından biridir. Şimdiye kadar, tamamen eksiksiz ve genel kabul görmüş bir sıvı teorisi yoktur.
Maddeyi mutlak sıfırda gözlemlemenin zorluğu, maddeyi "görmek" için ışığın alması ve ışığın kendisinin enerjiyi maddeye aktararak sıcaklığı yükseltmesidir. Bu zorluklara rağmen, bilim adamları yakın zamanda maddenin yalnızca mutlak sıfıra çok yakın sıcaklıklarda var olan beşinci bir durumunu gözlemlediler.
Bose-Einstein yoğuşmaları, ilk kez B-E yoğuşmalarında gözlemlenen, maddenin beşinci durumunu temsil eder, mutlak sıfıra çok yakın sıcaklıklara soğutulmuş gaz halindeki aşırı sıvı sıvılardır. Bu garip durumda, kondensin tüm atomları aynı kuantum mekanik duruma ulaşır ve sürtünme olmaksızın birbirlerine karşı akabilirler.
2 .Ana bölüm.
Bir maddenin sıvı halinin temel özelliklerini ve düzenliliklerini anlamak için aşağıdaki hususları dikkate almak gerekir:
2.1 Sıvının yapısı. Sıvı moleküllerin hareketi.
Akışkan, akabilen bir şeydir.
Sözde kısa menzilli düzen, sıvı parçacıkların düzenlenmesinde gözlenir. Bu, herhangi bir parçacığa göre en yakın komşularının konumunun sıralandığı anlamına gelir. Bununla birlikte, belirli bir parçacıktan uzaklaştıkça, diğer parçacıkların ona göre dizilişi gitgide daha az düzenli hale gelir ve oldukça hızlı bir şekilde parçacıkların dizilişindeki düzen tamamen ortadan kalkar. Sıvı moleküller, gaz molekülleri kadar serbest olmasa da katı moleküllerden çok daha serbest hareket eder. Sıvının her bir molekülü, bir süreliğine, komşularından uzaklaşmadan burada ve orada hareket eder. Ancak zaman zaman sıvı bir molekül çevresinden ayrılır ve başka bir yere gider, yeni bir ortama girer, yine bir süre için salınımlara benzer hareketler yapar. Sıvı hal teorisindeki bir takım problemlerin geliştirilmesinde önemli başarı, Sovyet bilim adamı Ya. I. Frenkel'e aittir. Frenkel'e göre sıvılarda termal hareket aşağıdaki karaktere sahiptir. Her molekül bir süre belirli bir denge pozisyonu etrafında salınır. Molekül zaman zaman denge yerini değiştirir, yeni bir konuma atlar, bir öncekinden moleküllerin büyüklük sırasına göre bir mesafe ayrılır. Yani moleküller sıvının içinde sadece yavaş hareket eder, zamanın bir bölümünde belirli yerlere yakın kalırlar.Bu nedenle sıvı moleküllerin hareketi katı ve gazdaki hareketlerin bir karışımı gibidir: bir yerdeki salınım hareketi değiştirilir bir yerden başka bir yere serbest geçişle.
Daha az yaygın olan birkaç başka madde durumu da ya tarif edilmiş ya da fiilen gözlemlenmiştir. Bu durumlardan bazıları sıvı kristalleri, fermiyonik kondensatları, süperakışkanları, süper katıları ve uygun şekilde adlandırılan garip maddeyi içerir. Bu modül için kaynaklarımızın Aşama bölümünde bu aşamalar hakkında daha fazla bilgi edinin.
Maddenin bir halinin başka bir hale dönüşmesine ne denir faz geçişi. Su diğerlerinden farklı davranır kimyasal bileşikler. Hemen hemen tüm maddelerde atomlar ve moleküller soğudukça birbirine yaklaşır. Ancak su, en yüksek yoğunluğuna dört santigrat derecede ulaşır, çünkü su molekülleri en yakın o sıcaklıkta toplanır. Birçok tatlı su gölünün en derin noktası dört santigrat derecedir çünkü ağır su dibe çöker.
2.2 Bir sıvıdaki basınç
Günlük deneyim bize sıvıların bir yüzey üzerinde bilinen kuvvetlerle hareket ettiğini öğretir. katılar onlarla temas halinde. Bu kuvvetlere sıvı basıncı kuvvetleri denir.
Açık bir su musluğunun ağzını parmakla kapatarak, sıvının basıncının kuvvetini parmakta hissediyoruz. Çok derinlere dalan bir yüzücünün kulaklarında yaşadığı ağrı, kulak zarına gelen su basıncı kuvvetlerinden kaynaklanır. Derin deniz termometreleri, suyun basıncının onları ezmemesi için çok güçlü olmalıdır.
Bir kap şeklini alır ve tamamen doldurur
Ancak şaşırtıcı bir şekilde, buzun katı fazına ulaşmak için su molekülleri tekrar daha ileri hareket eder. Bu fenomene su anomalisi denir. Buz daha hafiftir ve yüzeyde yüzer. Bu, kısmen buzla kaplı kutup enlemlerinde geniş okyanus alanlarında görülebilir. Bu anomalinin nedeni, su molekülünün olağandışı özelliklerinde yatmaktadır. Oksijen atomu ve iki hidrojen atomu asimetrik olarak düzenlenmiştir. Bu, bir negatif ve bir pozitif ucu olan bir molekül olan bir dipol oluşturur. Sıcaklığa bağlı olarak, bu dipoller, örneğin bir buz kristali oluşumu sırasında yüklerine göre agregalar halinde sıralanır.
Bir sıvıdaki basınç, hacmindeki bir değişiklikten kaynaklanır - sıkıştırma. Hacimdeki bir değişiklikle ilgili olarak, sıvıların esnekliği vardır. Bir akışkandaki elastik kuvvetler basınç kuvvetleridir. Bu nedenle, bir akışkan, kendisiyle temas halinde olan cisimlere basınç kuvvetleri ile etki ediyorsa, bu onun sıkıştırıldığı anlamına gelir. Sıkıştırma sırasında bir maddenin yoğunluğu arttığından, sıvıların yoğunluk değişimine göre esnekliğe sahip oldukları söylenebilir.
Suyun dipol doğası iklim için kritik bir faktördür. Su dipolleri küçük mıknatıslar gibi birbirine yapışma eğiliminde olduğundan, su ısınmaya veya soğumaya yavaş tepki verir. Aslında su, tüm sıvıların en yüksek ısı kapasitesine sahiptir ve katılar amonyak hariç. Bu, suyun kaynamadan önce çok fazla ısı emebileceği anlamına gelir. Günlük hayatımızın bu kadar büyük bir bölümünü oluşturan suyun hem donma hem de kaynama noktaları gerçekten de oldukça sıra dışıdır.
Su molekülü simetrik olsaydı, su eksi 110 santigrat derecede erir ve eksi 80 derecede kaynar. İklim ataleti, her şeyden önce suyun yüksek ısı kapasitesinin sonucudur. Su, iklimi sadece sıvı ve katı halde etkilemez. Ayrıca, diğer maddelerin iklim üzerindeki etkisini arttırır. Örneğin, sıcaklık daha fazla yükselirse yüksek seviyeler karbondioksit, su buharı içeriği de artar çünkü daha sıcak bir atmosfer daha fazla su buharını sürdürülebilir şekilde tutabilir.
Bir sıvıdaki basınç, sıvıya yerleştirilen herhangi bir yüzeye diktir. h derinliğindeki sıvıdaki basınç, yüzeydeki basıncın toplamına ve derinlikle orantılı bir değere eşittir:
Sıvıların statik basıncı, pratik olarak yoğunluklarından daha az olmayan bir şekilde iletebilmeleri nedeniyle, mukavemet kazancı sağlayan cihazlarda kullanılabilirler: hidrolik pres.
Dipol molekülü nedeniyle su, kızılötesi radyasyonu çok verimli bir şekilde emer. Sonuç olarak, bu, başlangıçta karbondioksitin neden olduğu sızıntıyı kabaca iki katına çıkarır. Suyun bir diğer önemli özelliği, yoğunluğunu önemli ölçüde değiştiren tuzları çözme yeteneğidir. Okyanusun ortalama tuzluluğu binde 7 kısımdır. Bu mineralizasyon ile su, en yüksek yoğunluk eksi 8 santigrat derece, orta tuzluluktaki deniz suyunun donma noktasının altındadır. Bu, aslında, eksi 9 santigrat derecedir.
Bu nedenle, yüzey soğutması konveksiyonun buz oluşturmasına neden olabilir. Bu yoğunluk özelliği, iklim sisteminin en önemli unsurlarından biri olan konveksiyonun motorudur; soğuk, tuzlu su ağırdır ve çok derinlere iner.
2.3.Arşimet Yasası
Basınç kuvvetleri, bir sıvıya daldırılmış katı bir cismin yüzeyine etki eder. Basınç derinlikle arttığından, sıvının altındaki yukarı yönlü basınç kuvvetleri, üstteki aşağı yönlü kuvvetlerden daha büyüktür ve basınç kuvvetlerinin bileşkesinin yukarı doğru olmasını bekleyebiliriz. Bir sıvıya batırılmış bir cisme uygulanan basınç kuvvetine sıvının destek kuvveti denir.
Deniz yüzeyinde akan su ile değiştirilir. 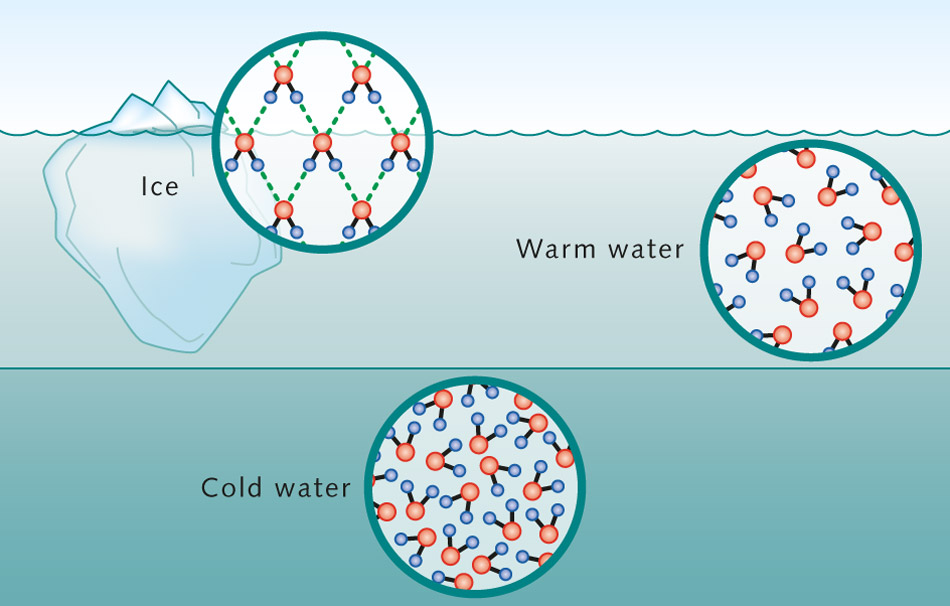
Böylece diğer maddelerden farklı davranır. Buz daha az yoğundur ve yüzeyde yüzer. temiz su dört derecelik en yüksek yoğunluğa sahiptir ve dibe çöker. Daha sonra ılık su ile kaplanır. Tuzlu su farklı özelliklere sahiptir.
Durumu başka bir duruma topla
Eski vitray pencereler yukarıdakinden daha kalındır. Yüzyıllardır cam yavaşça akıyor, turistlere dünyanın dört bir yanındaki turistler tarafından öğretiliyor. Sonuçta, camlar çok viskoz olsa da temelde sıvıdır. American Journal of Physics'in Mayıs sayısında yayınlanmasından bu yana, bu iddia artık çürütüldü. Cam yüzyıllardır üretilmesine rağmen halen tam teori, bu da nihayet camın gelişimini açıklıyor. Her şeyden önce cam fabrikaları, deneme yanılma yoluyla mükemmelleştirilmiş deneyim ve yöntemler kullanır.
Bir sıvıya daldırılan bir cisim kendi haline bırakılırsa, destek kuvvetinin cisme etki eden yerçekimi kuvvetinden daha az olup olmamasına bağlı olarak, cisim batar, dengede kalır veya sıvının yüzeyine yüzer. ondan veya ondan büyüktür.
Arşimet yasası, yer değiştiren sıvının ağırlığına eşit bir yukarı kaldırma kuvvetinin bir sıvı içindeki bir cisme etki ettiğini belirtir. Bir sıvıya batırılan bir cisim, kaldırma kuvvetine (Arşimet kuvveti denir) maruz kalır.
Bilim adamları, sadece birkaç on yıldır gözlüklerin özellikleriyle ilgileniyorlar. Kontrol edilecek deformasyon yok karmaşık tarih Brezilyalı fizikçi Edgar Dutra Zanotto, kilise pencerelerinden aşağı inerken eski ve yeni gözlüklerin davranışlarını inceledi. farklı sıcaklıklar. Elde ettiği sonuç: Orta çağ gözlükleri son 800 yılda kaçmış olabilir, bu da kiliselerin bu süre zarfında sürekli olarak 400 santigrat dereceye kadar ısıtıldığını düşündürür. Oda sıcaklığında camlar milyonlarca yıl dayanmıştır. Bu nedenle müzelerdeki en eski vazolar bile deformasyon göstermez.
Bu zar zor keşfedilen malzeme olan cam, "amorf" durumundaki diğer katı malzemelerin çoğundan farklıdır. Atomlar, kristal gibi düzenli bir kafes içinde düzenlenmemiştir. Aksine, kaotik üç boyutlu bir ağ oluştururlar. Bu sözde camsı durum, bir sıvı, kuvars kumu ve tuzların sıcak ve sıcak bir karışımı olduğunda meydana gelir. alkali metaller erime noktasının çok altında hızla soğur. Camdan farklı olarak, çoğu sıvının molekülleri erime noktasında kendiliğinden bir kristal kafes halinde düzenlenir.
ρ sıvının (gazın) yoğunluğudur, ivmedir serbest düşüş, a V- batık cismin hacmi (veya cismin hacminin yüzeyin altındaki kısmı).
Bir sıvıya batırılmış bir vücut bir tartıdan asılırsa, tartı vücudun havadaki ağırlığı ile yer değiştiren sıvının ağırlığı arasındaki farkı gösterir. Bu nedenle, Arşimet yasasına bazen şu formül verilir: Bir sıvıya daldırılan bir cisim, ağırlığınca, yerini değiştirdiği sıvının ağırlığı kadar kaybeder.
Böyle bir deneysel gerçeği not etmek ilginçtir ki, daha büyük bir sıvının içinde olmak spesifik yer çekimi, Arşimet yasasına göre sıvı ağırlığını "kaybeder" ve doğal, küresel şeklini alır.
2.4 Buharlaşma
Yüzey tabakasında ve sıvının yüzeyine yakın yerlerde, yüzeyin varlığını sağlayan ve moleküllerin sıvının hacmini terk etmesine izin vermeyen kuvvetler etki eder. Termal hareket nedeniyle, moleküllerin bir kısmı, molekülleri sıvı içinde tutan ve sıvıyı terk eden kuvvetlerin üstesinden gelmek için yeterince yüksek hızlara sahiptir. Bu olaya buharlaşma denir. Herhangi bir sıcaklıkta gözlenir, ancak artan sıcaklıkla yoğunluğu artar.
Sıvıyı terk eden moleküller sıvının yüzeyine yakın boşluktan çıkarılırsa, sonunda tüm sıvı buharlaşacaktır. Sıvıyı terk eden moleküller uzaklaştırılmazsa buhar oluştururlar. Sıvının yüzeyine yakın bölgeye düşen buhar molekülleri, çekim kuvvetleri tarafından sıvının içine çekilir. Bu işleme yoğuşma denir.
Böylece moleküller uzaklaştırılmazsa buharlaşma hızı zamanla azalır. Buhar yoğunluğunun daha da artmasıyla, belirli bir zamanda sıvıdan ayrılan moleküllerin sayısının aynı anda sıvıya dönen moleküllerin sayısına eşit olacağı bir duruma ulaşılır. Bir dinamik denge durumu gelir. Bir sıvı ile dinamik denge durumundaki buhara doymuş denir.
Artan sıcaklık, yoğunluk ve basınç ile doymuş buhar arttırmak. Sıcaklık ne kadar yüksek olursa, sıvı moleküllerinin sayısı o kadar fazla buharlaşmaya yetecek enerjiye sahiptir ve yoğuşmanın buharlaşmaya eşit olması için buhar yoğunluğunun o kadar büyük olması gerekir.
2.5 Kaynatma
Bir sıvı, basıncı olan bir sıcaklığa ısıtıldığında doymuş buharlar dış basınca eşit olduğunda, sıvı ile sıvısı arasında bir denge kurulur. doymuş buhar. Sıvıya ek bir ısı miktarı iletildiğinde, karşılık gelen sıvı kütlesi hemen buhara dönüştürülür. Bu işleme kaynatma denir.
Kaynama, bir sıvının sadece yüzeyinden değil, tüm hacmi boyunca ortaya çıkan buhar kabarcıklarının içinde meydana gelen yoğun buharlaşmasıdır. Sıvıdan buhara geçmek için moleküller, onları sıvı içinde tutan çekici kuvvetlerin üstesinden gelmek için gereken enerjiyi elde etmelidir. Örneğin, 100 ° C sıcaklıkta ve deniz seviyesindeki atmosferik basınca karşılık gelen bir basınçta 1 g suyu buharlaştırmak için, 1880'i sıvıdan molekülleri ayırmak için 2258 J harcamak ve geri kalanı gitmek gerekir. atmosfer basıncının kuvvetlerine karşı sistemin kapladığı hacmi artırmak için çalışmak (100 °C ve normal basınçta 1 gr su buharı 1.673 cm3 hacim kaplarken, aynı koşullar altında 1 gr su sadece 1.04 cm'dir) 3).
Kaynama noktası, buhar basıncının dış basınca eşit olduğu sıcaklıktır. Basınç arttıkça kaynama noktası yükselir ve basınç azaldıkça azalır.
Bir sıvının sütununun yüksekliği ile basıncındaki değişiklik nedeniyle, sıvıda farklı seviyelerde kaynama, kesinlikle farklı sıcaklıklarda gerçekleşir. Sadece kaynayan bir sıvının yüzeyinin üzerindeki doymuş buhar belirli bir sıcaklığa sahiptir. Sıcaklığı sadece dış basınçla belirlenir. Kaynama noktasından bahsederken kastedilen bu sıcaklıktır.
Çeşitli sıvıların kaynama noktaları birbirinden çok farklıdır ve bu, teknolojide, örneğin petrol ürünlerinin damıtılmasında yaygın olarak kullanılmaktadır.
Belirli bir miktardaki sıvıyı, doymuş buhar basıncına eşit bir dış basınçta izotermal olarak buhara dönüştürmek için verilmesi gereken ısı miktarına buharlaşma gizli ısısı denir. Genellikle bu değer bir gram veya bir mol ile ilgilidir. Bir mol sıvının izotermal buharlaşması için gereken ısı miktarına molar denir. gizli ısı buharlaşma. Bu değer moleküler ağırlığa bölünürse, özgül buharlaşma gizli ısısı elde edilir.
2.6 Sıvının yüzey gerilimi
Bir sıvının yüzeyini minimuma indirme özelliğine yüzey gerilimi denir. Yüzey gerilimi, yüzey tabakası moleküllerinin sıvı içindeki moleküllere çekilmesinden kaynaklanan bir sıvı üzerindeki moleküler basınç olgusudur. Bir sıvının yüzeyinde moleküller simetrik olmayan kuvvetler yaşarlar. Sıvının içindeki molekül üzerinde, ortalama olarak, çekim kuvveti, kohezyon, ortalama olarak her taraftan eşit olarak etki eder. Sıvının yüzeyi arttırılırsa, moleküller tutma kuvvetlerinin etkisine karşı hareket edecektir. Böylece sıvının yüzeyini kısaltma eğiliminde olan kuvvet, yüzeydeki dış çekme kuvvetinin tersi yönde etki eder. Bu kuvvete yüzey gerilimi kuvveti denir ve aşağıdaki formülle hesaplanır:
 - yüzey gerilimi katsayısı
- yüzey gerilimi katsayısı
 (
( )
)
 - sıvı yüzeyinin sınırının uzunluğu
- sıvı yüzeyinin sınırının uzunluğu
Kolayca buharlaşan sıvıların (eter, alkol) uçucu olmayan sıvılardan (cıva) daha düşük yüzey gerilimine sahip olduğuna dikkat edin. Sıvı hidrojenin ve özellikle sıvı helyumun yüzey gerilimi çok düşüktür. Sıvı metaller için yüzey gerilimi aksine çok büyük. Sıvıların yüzey gerilimindeki fark, farklı moleküllerin kohezyon kuvvetlerindeki farkla açıklanır.
Bir sıvının yüzey geriliminin ölçümleri, yüzey geriliminin yalnızca sıvının doğasına değil, aynı zamanda sıcaklığına da bağlı olduğunu gösterir: artan sıcaklıkla sıvının yoğunluklarındaki fark azalır ve dolayısıyla yüzey gerilimi katsayısı azalır. azalır - .
Yüzey gerilimi nedeniyle, herhangi bir sıvı hacmi, yüzey alanını küçültme eğilimindedir, böylece potansiyel enerjiyi azaltır. Yüzey gerilimi, dalgaların su üzerindeki hareketinden sorumlu olan elastik kuvvetlerden biridir. Çıkıntılarda, yüzey yerçekimi ve yüzey gerilimi, su parçacıklarını aşağı doğru çekerek yüzeyi tekrar pürüzsüz hale getirme eğilimindedir.
2.7 Sıvı filmler
Herkes sabunlu sudan köpüğü çıkarmanın ne kadar kolay olduğunu bilir. Köpük, en ince sıvı filmiyle sınırlanmış bir dizi hava kabarcığıdır. Köpük oluşturan sıvıdan kolaylıkla ayrı bir film elde edilebilir.
Bu filmler çok ilginç. Son derece ince olabilirler: en ince kısımlarda kalınlıkları milimetrenin yüz binde birini geçmez. İnce olmalarına rağmen, bazen çok kararlıdırlar. Sabun filmi gerilebilir ve deforme olabilir ve sabun filmini bozmadan bir su akışı içinden akabilir.
Filmlerin kararlılığı nasıl açıklanabilir? Bir filmin oluşumu için vazgeçilmez bir koşul, içinde çözünen maddelerin saf bir sıvıya eklenmesi, ayrıca yüzey gerilimini büyük ölçüde azaltanların eklenmesidir.
Doğada ve teknolojide, genellikle tek tek filmlerle değil, bir film koleksiyonuyla - köpükle tanışırız. Küçük akarsuların sakin suya düştüğü akarsularda, bol köpük oluşumu sıklıkla görebilirsiniz. Bu durumda, suyun köpürme kabiliyeti, bitki köklerinden salınan özel bir organik maddenin suda bulunmasıyla ilişkilidir. İnşaat ekipmanlarında köpük gibi hücresel yapıya sahip malzemeler kullanılmaktadır. Bu tür malzemeler ucuzdur, hafiftir, ısıyı ve sesi iyi iletmez ve yeterince güçlüdür. İmalatları için, yapı malzemelerinin oluşturulduğu çözeltilere köpürmeyi teşvik eden maddeler eklenir.
2.8 Islatma
Cam bir tabağa yerleştirilen küçük cıva damlacıkları küresel bir şekil alır. Bu, sıvının yüzeyini küçültme eğiliminde olan moleküler kuvvetlerin sonucudur. Bir katının yüzeyine yerleştirilen cıva her zaman yuvarlak damlacıklar oluşturmaz. Çinko levhanın üzerine yayılır ve damlanın toplam yüzeyi şüphesiz artacaktır.
Bir anilin damlası da ancak cam kabın duvarına değmediği zaman küreseldir. Duvara dokunur dokunmaz hemen cama yapışır, cam boyunca uzanır ve geniş bir ortak yüzey elde eder.
Bu, bir katı ile temas durumunda, sıvı moleküllerin katı moleküllere yapışma kuvvetlerinin önemli bir rol oynamaya başlamasıyla açıklanmaktadır. Bir sıvının davranışı hangisinin daha büyük olduğuna bağlı olacaktır: sıvı moleküller arasındaki yapışma veya sıvı bir molekülün katı bir moleküle yapışması. Cıva ve cam durumunda, cıva ve cam molekülleri arasındaki kohezyon kuvvetleri, cıva molekülleri arasındaki kohezyon kuvvetlerine kıyasla küçüktür ve cıva bir damlada toplanır. Böyle bir sıvı denir ıslanmaz sağlam. Cıva ve çinko durumunda, sıvının molekülleri ile katı arasındaki kohezyon kuvvetleri, sıvının molekülleri arasındaki kohezyon kuvvetlerini aşar ve sıvı katının üzerine yayılır. Bu durumda sıvı denir. ıslatma sağlam.
Bundan, bir sıvının yüzeyinden bahsederken, yalnızca sıvının havada sınırlandığı yüzey değil, aynı zamanda diğer sıvılar veya katı bir cisim üzerinde sınırlanan yüzey de akılda tutulmalıdır.
Sıvının kabın duvarlarını ıslatıp ıslatmadığına bağlı olarak, sıvının katı duvar ve gaz ile temas noktasındaki yüzeyinin şekli şu veya bu şekildedir. Islanmama durumunda kenardaki sıvı yüzeyinin şekli yuvarlak, dışbükeydir. Islanma durumunda kenardaki sıvı içbükey bir şekil alır.
2.9 Kılcal olaylar.
Hayatta çoğu zaman birçok küçük kanalla (kağıt, iplik, deri, çeşitli yapı malzemeleri, toprak, ahşap) delinmiş bedenlerle uğraşırız. Su veya diğer sıvılarla temas eden bu tür cisimler genellikle onları emer. Bu, elleri kuruturken bir havlunun hareketinin, bir gaz lambasındaki fitilin hareketinin vb. temelidir. Benzer olaylar dar cam tüplerde de gözlemlenebilir. Dar tüplere kılcal veya saç denir.
Böyle bir boru bir ucu geniş bir kaba geniş bir kaba daldırıldığında, aşağıdakiler meydana gelir: sıvı borunun duvarlarını ıslatırsa, o zaman kaptaki sıvı seviyesinin üzerine çıkar ve dahası, daha yüksek, tüp ne kadar darsa; sıvı duvarları ıslatmazsa, aksine, tüpteki sıvı seviyesi geniş bir kaptakinden daha düşük ayarlanır. Dar tüplerde veya boşluklarda sıvı seviyesinin yüksekliğindeki değişikliğe denir. kılcallık. Geniş anlamda, kılcal fenomen, yüzey geriliminin varlığından dolayı tüm fenomenler olarak anlaşılır.
Kılcal borularda sıvı yükselme yüksekliği, borudaki kanalın yarıçapına, yüzey gerilimine ve sıvının yoğunluğuna bağlıdır. Kapiler ve geniş kaptaki sıvı arasında, hidrostatik basınç gh kılcal basıncı dengeleyecek şekilde böyle bir seviye farkı h oluşturulur:
nerede sıvının yüzey gerilimidir
R, kılcal yarıçaptır.
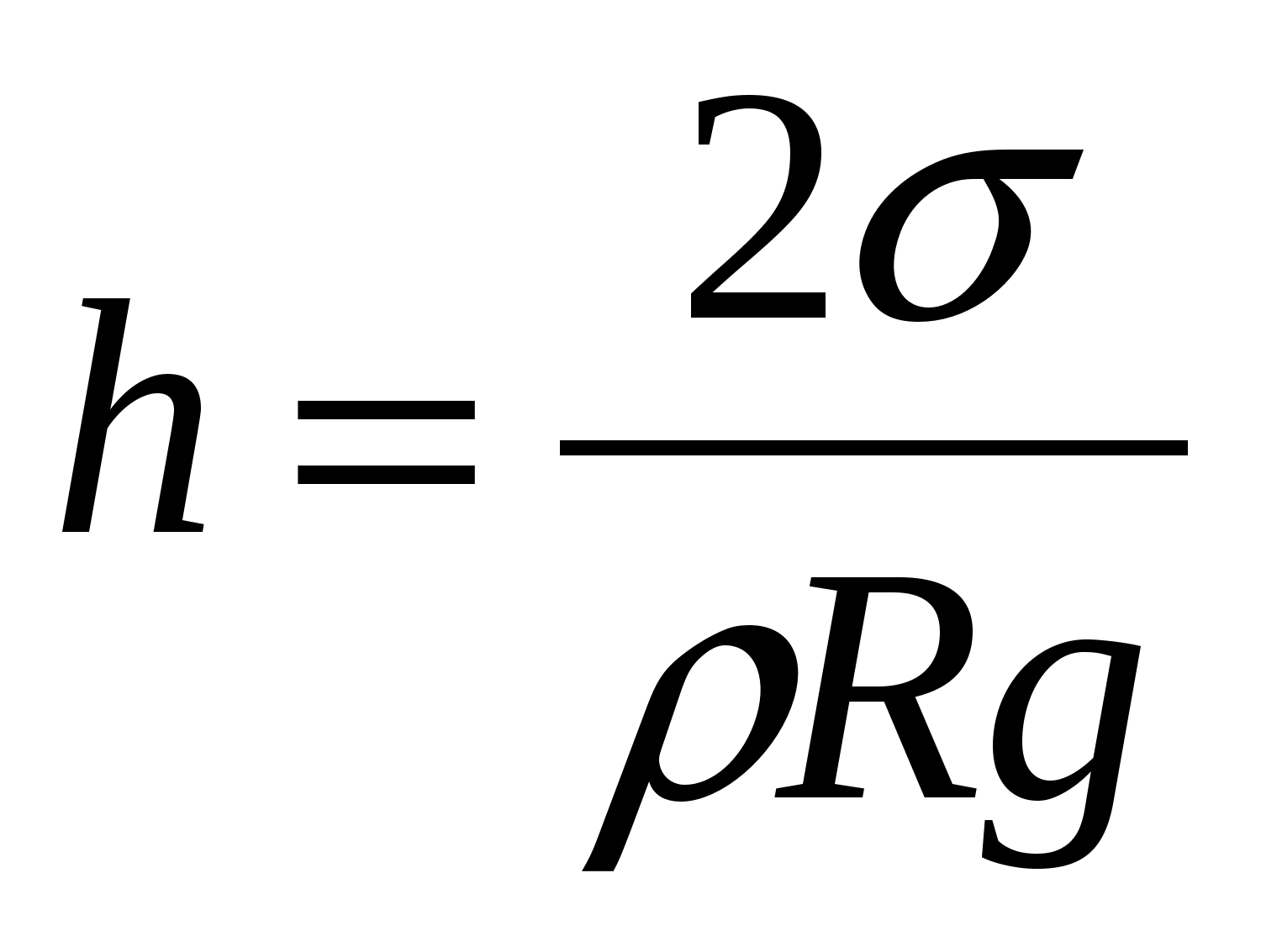
Bir kılcal damardaki sıvının yükselme yüksekliği, yüzey gerilimi ile orantılıdır ve kılcal kanalın yarıçapı ve sıvının yoğunluğu ile ters orantılıdır (Jurin yasası).
2.10 Sıvılarda elektrik akımı.
Saf sıvılar elektrik akımını iletmezler, yani dielektriklerdir, çünkü sıvı moleküllerinin her biri nötrdür ve bir elektrik alanında hareket etmez.
Elektriği ileten sıvılara elektrolit denir. Sıvılarda elektrik akımı, tuz iyonlarının yönlendirilmiş hareketinin bir sonucu olarak oluşur. Elektrolitten bir akım geçtiğinde elektrotlar üzerinde bir maddenin salınması olgusuna elektroliz denir. Negatif yüklü bir elektrotta katot parçacıkların (atomlar, moleküller, katyonlar) ve pozitif yüklü bir elektrotta elektrokimyasal bir azalma var - anot parçacıkların (atomlar, moleküller, anyonlar) elektrokimyasal oksidasyonu vardır. 1832'de Faraday, elektrotta salınan maddenin M kütlesinin, elektrolitten geçen Q elektrik yükü ile doğru orantılı olduğunu buldu:
t kadar elektrolitten geçirilirse DC mevcut I ile
Orantılılık katsayısı k, bir maddenin elektrokimyasal eşdeğeri olarak adlandırılır. Elektrolitten tek bir elektrik yükünün geçişi sırasında salınan maddenin kütlesine sayısal olarak eşittir ve maddenin kimyasal yapısına bağlıdır.
Faraday'ın ikinci yasası şöyle der:Çeşitli maddelerin elektrokimyasal eşdeğerleri, kimyasal eşdeğerleri olarak kabul edilir. Bir iyonun kimyasal eşdeğeri, iyonun mol kütlesi A'nın değerlik z'ye oranıdır. Bu nedenle, elektrokimyasal eşdeğer:
![]() ,
,
F, Faraday sabitidir
Elektroliz olgusu modern endüstride yaygın olarak kullanılmaktadır. Özellikle elektroliz, hidrojenin yanı sıra sodyum hidroksit, klor, organoklor bileşikleri, manganez dioksit ve hidrojen peroksitin endüstriyel üretimi için yöntemlerden biridir. Cevherlerden çok sayıda metal çıkarılır ve elektroliz (elektro ekstraksiyon, elektro arıtma) kullanılarak işlenir. Elektroliz atıksu arıtımı için kullanılır (elektrokoagülasyon, elektroekstraksiyon, elektroflotasyon işlemleri).
3. Sonuç
Bu nedenle, bir sıvı, katı ve gaz halleri arasında bir ara madde halidir. Bu, sıvıların hem katı hem de gaz hallerinin özelliklerine sahip olmasına neden olur. Sıvı ve sıvının özelliklerini bir araya getiren maddenin halinin çarpıcı bir örneği. katı haller, endüstride ve teknolojide yaygın olarak kullanılan sıvı kristallerdir (sıvı kristal ekranlar). Bu bağlamda, bir sıvının durumunun tanımlanması, katı ve gaz hallerini tanımlamak için kullanılan matematiksel yöntemlerin sentezini gerektirir, bu da birçok fiziksel ve kimyasal fenomeni tam olarak tanımlamayı karmaşıklaştırır ve zorlaştırır.
Günümüzde sıvıların birçok özelliği endüstride ve teknolojide yaygın olarak kullanılmaktadır. Örneğin, bir sıvının tüm hacmindeki basıncı artırma özelliği, hidrolik tahrikli kaldırma makinelerinde kullanılır. Ancak maddenin sıvı hali teorisinin daha derin bir şekilde incelenmesi de gereklidir. Bu nedenle, kaynayan bir sıvının akışını incelemenin önemi, nükleer enerjinin talepleriyle, enerji santrallerinin güvenliği sorunuyla ilişkilidir.
Fizikokimyasal süreçlerin çalışmasına özel ilgi sıvı halçünkü bizim kendimiz %90 su, dünyadaki en yaygın sıvıyız. Ve hayvandaki tüm hayati süreçler ve bitki örtüsü bir sıvıda, yani suda meydana gelir. Bu nedenle, maddenin bu halinin incelenmesi tüm insanlar için önemlidir ve önemlidir.
Kaynakça:
IV. Savelyev "Genel Fizik Kursu"
C.E. Swartz "Sıradan Olayların Olağanüstü Fiziği"
İlköğretim fizik ders kitabı, Akademisyen G.S. Landsberg
T.I. Trofimov "Fizik Kursu"
BEN VE. Perelman "Eğlenceli Fizik"
Katılarda moleküllerin düzenlenmesi. Katılarda, moleküller arasındaki mesafeler moleküllerin boyutuna eşittir, bu nedenle katılar şekillerini korur. Moleküller, kristal kafes adı verilen belirli bir sırayla düzenlenir, bu nedenle normal koşullar altında katılar hacimlerini korurlar.
"Maddenin 3 hali" sunumundan resim 5 konuyla ilgili fizik derslerine " termal olaylar»Boyutlar: 960 x 720 piksel, format: jpg. Ücretsiz resim indirmek için fizik dersi, resme sağ tıklayın ve "Resmi Farklı Kaydet..."e tıklayın. Derste resimleri göstermek için, bir zip arşivindeki tüm resimlerle birlikte “3 State of Matter.ppt” sunumunu ücretsiz olarak indirebilirsiniz. Arşivin boyutu 2714 KB'dir.
Sunuyu indirtermal olaylar
"Doğada yayılma" - Gıda endüstrisinde sebze ve meyveleri muhafaza ederken yaygın olarak kullanılır. Çelik eritirken. Difüzyona bir örnek, gazların veya sıvıların karıştırılmasıdır. difüzyon nedir? Nefeste difüzyon. Difüzyon olgusu doğada önemli tezahürlere sahiptir, bilimde ve üretimde kullanılmaktadır.
"Maddenin toplu hallerinin değişimi" - Maddenin toplu dönüşümleri. Özısı buharlaşma. Kaynama sıcaklığı. Kaynamak. Suyun toplam hallerindeki değişimlerin sıcaklık grafiği. Erime ve kristalleşme sıcaklığı. buharlaşma koşulları. toplu dönüşümler. Buharlaşma. Isı miktarının hesaplanması. Erime ve katılaşma süreci.
"Maddenin 3 Durumu" - Bulmacayı çözün. kristalizasyon. Katılarda moleküllerin düzenlenmesi. İşlem örnekleri. devletler. Madde. Gazların özellikleri. Buharlaşma. Bulmaca için sorular. Sıvıların özellikleri. Sıvılarda moleküllerin düzenlenmesi. Buz. Katı cisimlerin özellikleri. Yoğunlaşma. Hareketin karakteri ve parçacıkların etkileşimi.
"Maddelerin difüzyonu" - Kokulu yapraklar. Koyu renk. Atasözleri Milet Thales'i. Herakleitos. Sorunları çözüyoruz. Bilim insanları Antik Yunan. Teknoloji ve doğada yayılma. Biyoloji sevenler için görevler. Difüzyon. Difüzyon fenomeni. Demokritos. gözlemler Gazlarda difüzyon.
"Çözünme sırasında termal olaylar" - D.I. Mendeleyev. Bilgilendirme. Potasyum permanganatın suda çözünmesi. ekzotermik süreç. Oda arkadaşını kontrol et. Fizik ve kimya yasaları hakkında daha fazla bilgi edinmenizde başarılar dileriz. difüzyon hızı. Termal hareket denir. Moleküllerin karşılıklı penetrasyonu. Çözümlerin değeri. Pratik görevler.
"Moleküllerin Etkileşimi" - İki parça demir çiviyi birbirine bağlamak mümkün müdür? Çekim, parçacıkları bir arada tutar. Seçenek I Doğal karışımlar şunları içermez: a) kil; b) çimento; c) toprak. gaz halindeki maddeler. Seçenek II Yapay bir karışım: a) kil; b) çimento; c) toprak. Gaz molekülleri arasındaki mesafe daha fazla boyut moleküllerin kendileri.
Konuda toplam 23 sunum






