Doymuş buhar denilen şey. Petrol ve gazın büyük ansiklopedisi
Yazının başlığında sorulan soruya cevap vermeden önce buharın ne olduğunu öğrenelim. Çoğu insanın bu kelimeyle sahip olduğu görüntüler: kaynayan bir su ısıtıcısı veya tencere, bir buhar odası, sıcak bir içecek ve daha birçok benzer resim. Öyle ya da böyle, fikrimizde yüzeyinin üzerinde yükselen bir sıvı ve gaz halinde bir madde var. Bir buhar örneği vermeniz istenirse, su buharı, alkol buharları, eter, benzin, aseton hemen hatırlayacaksınız.

Gaz halleri için başka bir kelime var - gaz. Burada genellikle oksijen, hidrojen, azot ve diğer gazları karşılık gelen sıvılarla ilişkilendirmeden düşünürüz. içinde de bulundukları iyi bilinmektedir. sıvı hal. İlk bakışta farklar, buharın doğal sıvılara tekabül etmesi ve gazların bilerek sıvılaştırılması gerektiği gerçeğinde yatmaktadır. Ancak, bu tamamen doğru değil. Üstelik buhar kelimesi ile ortaya çıkan görüntüler buhar değildir. Daha kesin bir cevap vermek için buharın nasıl oluşturulduğuna bakalım.
Buhar gazdan nasıl farklıdır?
Bir maddenin kümelenme durumu, sıcaklığa, daha doğrusu moleküllerinin etkileşime girdiği enerji ile termal kaotik hareketlerinin enerjisi arasındaki orana göre belirlenir. Yaklaşık olarak, eğer etkileşim enerjisi çok daha büyükse - katı hal, eğer termal hareketin enerjisi çok daha büyükse - gaz halinde, eğer enerjiler karşılaştırılabilir ise - sıvı.

Bir molekülün sıvıdan ayrılabilmesi ve buhar oluşumuna katılması için termal enerjinin değerinin etkileşim enerjisinden daha büyük olması gerektiği ortaya çıktı. Bu nasıl olabilir? Moleküllerin ortalama termal hareket hızı, sıcaklığa bağlı olarak belirli bir değere eşittir. Bununla birlikte, moleküllerin bireysel hızları farklıdır: çoğu ortalama değere yakın hızlara sahiptir, ancak bazılarının hızları ortalamadan daha büyük, bazılarının daha az hızları vardır.
Daha hızlı moleküller olabilir Termal enerji etkileşim enerjisinden daha büyük, bu da sıvının yüzeyine çarptıktan sonra ondan ayrılarak buhar oluşturabilecekleri anlamına gelir. Bu tür buharlaşma denir buharlaşma. Aynı hız dağılımı nedeniyle, zıt bir süreç vardır - yoğunlaşma: buhardaki moleküller sıvıya geçer. Bu arada, genellikle buhar kelimesiyle ortaya çıkan görüntüler buhar değil, tam tersi işlemin sonucudur - yoğuşma. Çifti göremezsiniz.

Buhar, belirli koşullar altında sıvı hale gelebilir, ancak bunun için sıcaklığının belirli bir değeri geçmemesi gerekir. Bu değere kritik sıcaklık denir. Buhar ve gaz, bulundukları sıcaklıkta farklılık gösteren gaz halleridir. Sıcaklık kritik değeri aşmıyorsa - buhar, aşıyorsa - gaz. Sıcaklığı sabit tutar ve hacmi azaltırsanız, buhar sıvılaşır, gaz sıvılaşmaz.
Doymuş ve doymamış buhar nedir
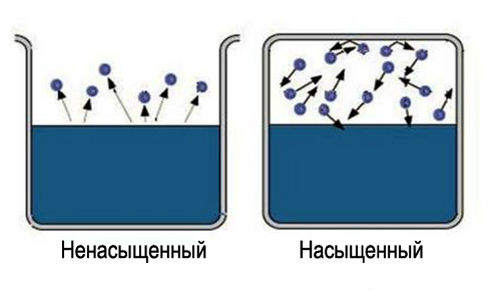
"Doymuş" kelimesi belirli bilgileri taşır, geniş bir alanı doyurmak zordur. Yani almak için doymuş buhar, gerekli sıvının bulunduğu alanı sınırlayın. Bu durumda sıcaklık, verilen madde için kritik olandan daha düşük olmalıdır. Artık buharlaşan moleküller sıvının bulunduğu boşlukta kalır. İlk başta, moleküllerin çoğu geçişi sıvıdan meydana gelirken, buhar yoğunluğu artacaktır. Bu da neden olacak daha fazla moleküllerin sıvıya ters geçişleri, bu da yoğunlaşma sürecinin hızını artıracaktır.
Son olarak, bir fazdan diğerine geçen ortalama molekül sayısının eşit olacağı bir durum belirlenir. Böyle bir duruma denir dinamik denge. Bu durum, buharlaşma ve yoğuşma oranlarının büyüklüğünde ve yönünde aynı değişiklik ile karakterize edilir. Bu durum doymuş buhara karşılık gelir. Dinamik denge durumuna ulaşılmazsa, bu doymamış bir buhara karşılık gelir.
Her zaman en basit modeliyle bir nesnenin çalışmasına başlarlar. Moleküler kinetik teoride bu ideal bir gazdır. Buradaki ana basitleştirmeler, moleküllerin içsel hacminin ve etkileşimlerinin enerjisinin ihmal edilmesidir. Bu modelin tatmin edici bir şekilde tanımladığı ortaya çıktı doymamış buhar. Ayrıca, ne kadar az doygunsa, kullanımı o kadar meşru olur. İdeal bir gaz bir gazdır; ne buhar ne de sıvı haline gelemez. Bu nedenle doymuş buhar için böyle bir model yeterli değildir.
Doymuş ve doymamış buhar arasındaki temel farklar
- Doymuş, verilen nesnenin bazı parametrelerin olası en büyük değerine sahip olduğu anlamına gelir. bir çift için öyle yoğunluk ve basınç. Doymamış buhar için bu parametreler daha küçük değerlere sahiptir. Buhar doygunluktan ne kadar uzaksa, bu değerler o kadar küçük olur. Bir açıklama: referans sıcaklığı sabit olmalıdır.
- Doymamış buhar için, boyle-mariotte yasası: Gazın sıcaklığı ve kütlesi sabitse, hacimdeki artış veya azalma, basıncın aynı miktarda azalmasına veya artmasına neden olur, basınç ve hacim ters orantılıdır. Maksimum yoğunluk ve basınçtan Sabit sıcaklık doymuş buhar hacminden bağımsızlıkları takip eder, doymuş buhar basıncı ve hacminin birbirinden bağımsız olduğu ortaya çıkar.
- Doymamış buhar için yoğunluk sıcaklığa bağlı değildir, ve hacim korunursa, yoğunluk değeri de değişmez. Doymuş buhar için, hacmi korurken, sıcaklık değişirse yoğunluk değişir. Bu durumda ilişki doğrudandır. Sıcaklık artarsa yoğunluk da artar, sıcaklık azalırsa yoğunluk da değişir.
- Hacim sabitse, doymamış buhar Charles yasasına göre davranır: sıcaklık arttıkça basınç da aynı faktörle artar. Böyle bir ilişkiye doğrusal denir. Doymuş buhar için, sıcaklık arttıkça basınç, doymamış buhara göre daha hızlı artar. Bağımlılık üsteldir.
Özetle, karşılaştırılan nesnelerin özelliklerinde önemli farklılıklar olduğunu görebiliriz. Ana fark, doymuş haldeki buharın sıvısından ayrı düşünülememesidir. Çoğu gaz yasasının uygulanamadığı iki bileşenli bir sistemdir.
Buharlaşma - bu, yalnızca gazlı bir ortama veya vakuma bitişik bir sıvının serbest yüzeyinden meydana gelen buharlaşmadır.
Moleküllerin termal hareketinin kinetik enerjisinin eşit olmayan dağılımı, herhangi bir sıcaklıkta bir sıvı veya katının bazı moleküllerinin kinetik enerjisinin, moleküllerin geri kalanıyla olan bağlantılarının potansiyel enerjisini aşabileceği gerçeğine yol açar.
buharlaşma Moleküllerin sıvı veya katı yüzeyinden dışarı atılması işlemidir. kinetik enerji Bu, moleküllerin etkileşiminin potansiyel enerjisini aşar. Buharlaşmaya sıvının soğuması eşlik eder.
Buharlaşma sürecini moleküler-kinetik teori açısından ele alalım. Sıvıyı terk etmek için moleküllerin kinetik enerjilerini azaltarak iş yapmaları gerekir. Bir sıvının yüzey tabakasında rastgele hareket eden molekülleri arasında sıvıdan dışarı uçma eğiliminde olan moleküller her zaman olacaktır. Böyle bir molekül ötesine geçtiğinde yüzey katmanı, sonra molekülü sıvıya geri çeken bir kuvvet ortaya çıkar. Bu nedenle, kinetik enerjinin moleküler kuvvetlerin karşı etkisinin üstesinden gelmek için gereken işten daha büyük olduğu sıvıdan yalnızca bu moleküller uçar.
Buharlaşma hızı şunlara bağlıdır:
a) sıvının türü hakkında;
b) serbest yüzeyinin alanı üzerinde. Bu alan ne kadar büyük olursa, sıvı o kadar hızlı buharlaşır.
c) Bir sıvının yüzeyindeki buhar yoğunluğu ne kadar düşükse, buharlaşma hızı o kadar fazladır. Bu nedenle yüzeyden buhar (rüzgar) pompalamak buharlaşmasını hızlandıracaktır.
d) Artan sıcaklıkla sıvının buharlaşma hızı artar.
buharlaşma bir maddenin sıvı halden gaz hale geçmesidir.
yoğunlaşma - maddenin transferidir gaz hali sıvı hale gelir.
Buharlaşma sırasında içsel enerji madde artar ve yoğunlaştığında - azalır.
Buharlaşma ısısı – sabit bir sıcaklıkta bir sıvıyı buhara dönüştürmek için gereken ısı Q miktarıdır.
Özısı buharlaşma L, sabit bir sıcaklıkta birim sıvı kütlesini buhara dönüştürmek için gereken ısı miktarı ile ölçülür.
Doymuş ve doymamış buhar. Bir sıvının kapalı bir kapta sabit bir sıcaklıkta buharlaşması, gaz halindeki buharlaşan maddenin moleküllerinin konsantrasyonunda kademeli bir artışa yol açar. Buharlaşma sürecinin başlamasından bir süre sonra, gaz halindeki bir maddenin konsantrasyonu, birim zamanda sıvıya dönen moleküllerin sayısının sıvının yüzeyinden ayrılan moleküllerin sayısına eşit olduğu bir değere ulaşır. aynı zamanda. Maddenin buharlaşma ve yoğunlaşma süreçleri arasında dinamik bir denge kurulur.
Makale, buharın ne olduğunu, ne tür olduğunu ve endüstride ve günlük hayatta nasıl kullanıldığını anlatıyor.
Fizik
Çevredeki dünyanın yapısını ve bazı süreçlerini bulmaya yardımcı olan ana bilimlerden biri fiziktir. Her saniye etrafımızda birçok ilginç tepki oluyor. Birçoğuna uzun zamandır alıştık ve onlara dikkat etmiyoruz. Ayrıca, içinde Gündelik Yaşamçok az insan Güneş'in yanmasının doğasını veya iklim üzerinde büyük etkisi olan su buharının oluşumunu düşünür. Ve yukarıda açıklanan süreçler oldukça iyi çalışılmış olmasına rağmen, yine de buharın ne olduğu sorusunu ele alacağız. Bu arada, sadece çeşitli maddelerin kaynatılması veya diğer reaksiyonlarının bir sonucu olarak değil, her şeyden önce oluşabilir.
Tanım
Buhar, maddenin bu fazının bu maddenin diğer toplu halleriyle dengede olması şartıyla, bir maddenin gaz halidir. Buharın ortaya çıktığı işlemin kendisine genellikle buharlaşma denir ve tersine işleme yoğuşma denir. Artık buharın ne olduğunu biliyoruz. Bu arada, genellikle “buhar” denilince, insanlar hemen hemen her zaman sıradan sudan elde edilen buharı kastederler, ancak yukarıda belirtildiği gibi birçok madde bu yığılma halini alabilir.
Ek olarak, iki ana türü ayırt etmek gelenekseldir: doymuş ve doymamış. Ancak bu tanımlar yalnızca kimyasal olarak saf maddeler için geçerlidir. Onları daha ayrıntılı olarak analiz edelim.
Doymamış buhar nedir?

Bu yüzden, oluştuğu akışkanla ilgili olarak dinamik denilen bir dengeye ulaşamadığında buna diyorlar. Genellikle böyle bir tanım yanlış olan termodinamik ile karıştırılır. Doymamış buharın basıncını doymuş ile karşılaştırırsanız, her zaman daha düşük bir değere sahip olacaktır.
Bir sıvının yüzeyinde doymamış buhar göründüğünde, oluşum süreci daha hızlı ilerler ve tersine işleme üstün gelir (daha önce de söylediğimiz gibi buna yoğuşma denir). Ve sonuç olarak, sıvı yavaş yavaş azalır.
Şimdi ne olduğuna bakalım
doymuş buhar

Doymuş buhar, elde edildiği sıvı ile dinamik dengeye ulaşabildiğinde denir. Basitçe söylemek gerekirse, bu durumda buharlaşma yoğuşmaya eşittir ve doymamış buhardaki durumun aksine sıvı miktarı değişmeden kalabilir. Artık buharın ne olduğunu ve çeşitlerini biliyoruz.
Örneğin, sıvısı ile dengede olan bir buharı sıkıştırırsanız, bu denge yavaş yavaş kaybolacak ve gaz halindeki maddenin yoğunluğundaki bir değişiklik nedeniyle dinamik denge yeniden sağlanana kadar yoğunlaşma daha güçlü hale gelecektir. Yeniden.
Sıvının türüne bağlı olarak, buharla dinamik denge, yoğunluğunun farklı değerlerinde kendini gösterir. Bunun nedeni, tüm maddelerin farklı bir moleküller arası çekim kuvvetine sahip olmasıdır.
su buharı

Yine de, çoğu zaman insanlar bu kelimeyi herkesin bildiği gaz halindeki su hali olarak anlarlar. Ansiklopediye bakarsanız, buharın ana tanımlayıcı özelliklerini bulabilirsiniz: renk, koku yokluğu ve aslında sudan elde edilmesi.
İster yemek pişirmek için kaynar su olsun, ister yağmurdan sonra sıcak kaldırımdan nemin buharlaşması olsun, hepimiz bunu defalarca fark etmişizdir. Ama bunu düşünür ve sanayi ve teknolojik devrim dönemlerini hatırlarsanız, açıkça ortaya çıkıyor. büyük önem bir insanın hayatında buhar vardır. Bu fenomenin fiziği, orijinal sıvı formundan on kat daha büyük bir hacim kaplayacak şekildedir. Bir zamanlar teknolojinin gelişimine ivme kazandıran bu gözlemdi.
Her şey, bu tür motorlara sahip araçlar olarak adlandırılan ilk ve biraz sonra "kendinden tahrikli" arabalarla başladı. Ancak bu tür arabalar çok uzun süre çalışma koşullarına getirildi, düşük hıza ve kötü yol tutuşuna sahipti. Her şey sadece buharlı lokomotiflerin icadıyla değişti.
Ayrıca su da iyi bir ısı taşıyıcıdır ve birçok soğutma sisteminde kullanılır ve eğer devreleri kapalı değilse sonuç olarak buhar da ortaya çıkar. Zamanımızda, bazen özel olarak gaz haline getirilir, ancak ilkel motorlarda değil, elektrik jeneratörlerinin türbinlerinin buharla döndüğü nükleer santrallerde.
Buharlaşan su da iklimde büyük önem taşır. Sıcaklığın çok daha düşük olduğu bir yüksekliğe yükselen buhar yoğunlaşır ve yağmur şeklinde yeryüzüne düşer. Kar neredeyse aynı.
Sonunda, bir çift için diyet ve sadece sağlıklı yiyecekler pişiriyorlar.
Doğru koşullar altında, buhar yeryüzünün yüzeyinde bir sis oluşturur.
Artık buharın ne olduğunu ve nasıl olduğunu biliyoruz.
Konu 2. FAZ GEÇİŞLERİ.
Faz geçişi ( faz dönüşümü) bir maddenin bir fazdan diğerine dış koşullarda (örneğin, sıcaklık, basınç, manyetik ve elektrik alanları, vb.) fiziksel özellikler ve madde parametreleri.
Sıcaklık, basınç veya başka bir değerin değeri fiziksel miktar faz geçişinin meydana geldiği noktaya geçiş noktası denir. İki tür faz geçişi vardır.
BİRİNCİ TÜRÜN FAZ GEÇİŞLERİ
Birinci türden bir faz geçişi sırasında, bu tür termodinamik
yoğunluk, bileşenlerin konsantrasyonu gibi bir maddenin özellikleri, belirli hacim, depolanan iç enerji miktarı, yani. geçiş ısısı olarak adlandırılan belirli bir miktarda ısı salınır veya emilir. Ayrıca bu, bu miktarlardaki zamanla değil, sıcaklık, basınç vb.'deki ani değişimi ifade eder. Birinci dereceden faz geçişlerinin en yaygın örnekleri şunlardır:
- erime ve kristalleşme
- buharlaşma ve yoğunlaşma
- süblimasyon ve desüblimasyon
İKİNCİ TÜRÜN FAZ GEÇİŞLERİ
İkinci dereceden bir faz geçişi sırasında yoğunluk ve iç enerji değişmez, böylece çıplak gözçok faz geçişi görünmez olabilir. Sıçrama, sıcaklık ve basınca göre türevleriyle deneyimlenir: ısı kapasitesi, termal genleşme katsayısı, çeşitli duyarlılıklar, vb. ikinci türden faz geçişlerine, enerjinin (ısı) salınması veya emilmesi ile değil, maddenin yapısının simetrisindeki bir değişiklik eşlik eder. İkinci dereceden faz geçişlerinin en yaygın örnekleri şunlardır:
- sistemin kritik bir noktadan geçişi
- paramanyetik-ferromanyetik geçiş
- metallerin ve alaşımların süperiletkenlik durumuna geçişi
- sıvı helyumun süperakışkan bir duruma geçişi
- amorf malzemelerin camsı bir duruma geçişi
Modern fizik ayrıca üçüncü veya daha yüksek dereceden faz geçişlerine sahip sistemleri de araştırır. Son zamanlarda geniş kullanım kuantum faz geçişi kavramını aldı, yani. faz geçişi, klasik termal dalgalanmalar tarafından değil, hatta var olan kuantum olanlar tarafından kontrol edilir. tamamen sıfır Nernst teoremi nedeniyle klasik faz geçişinin gerçekleştirilemediği sıcaklıklar.
Birinci dereceden faz geçişleriyle ilişkili, bizi ilgilendiren fenomenleri daha ayrıntılı olarak ele alalım.
BUHARLAMA, YOĞUŞMA, KAYNAMA.
Doymuş ve doymamış çiftler.
Belirli koşullar altında herhangi bir madde, çeşitli kümelenme durumlarında olabilir - katı, sıvı ve gaz halinde. Bir kümelenme durumundan ikinciye geçişler, birinci türden faz geçişleridir.
buharlaşma ve yoğunlaşma bir maddenin sıvı ve gaz fazları arasındaki faz geçişleridir.
Herşey gerçek gazlar(oksijen, nitrojen, hidrojen vb.) belirli koşullar altında sıvı hale dönüşebilmektedir. Bununla birlikte, böyle bir dönüşüm yalnızca belirli bir sıcaklığın altındaki sıcaklıklarda meydana gelebilir. Kritik sıcaklık T cr. Örneğin, su için kritik sıcaklık 647.3 K, nitrojen için 126 K, oksijen için 154.3 K'dır. Oda sıcaklığında (≈ 300 K), su hem sıvı hem de gaz halinde olabilirken, nitrojen ve oksijen sadece sıvı halde bulunur. gazların formu.
buharlaşma ile sıvıdan gaza faz geçişi olarak adlandırılır. Moleküler kinetik teori açısından buharlaşma, en hızlı moleküllerin bir sıvının yüzeyinden uçtuğu ve kinetik enerjisinin sıvı moleküllerin geri kalanıyla olan bağlantılarının enerjisini aştığı bir süreçtir. Bu, kalan moleküllerin ortalama kinetik enerjisinde bir azalmaya, yani sıvının soğumasına (çevredeki cisimlerden enerji beslemesi yoksa) yol açar.
yoğunlaşma buharlaşmanın tersi bir süreçtir. Yoğunlaşma sırasında buhar molekülleri sıvıya geri döner.
Kapalı bir kapta, bir sıvı ve buharı bir durumda olabilir. dinamik denge sıvıdan çıkan moleküllerin sayısı buhardan sıvıya dönen moleküllerin sayısına eşit olduğunda, yani buharlaşma ve yoğuşma hızları aynı olduğunda. Böyle bir sistem denir iki fazlı . Sıvısı ile dengede olan buhara denir. zengin.
Bir sıvının birim yüzey alanından bir saniyede yayılan molekül sayısı, sıvının sıcaklığına bağlıdır. Buhardan sıvıya dönen moleküllerin sayısı, buhar moleküllerinin konsantrasyonuna ve ortalama sürat buharın sıcaklığı tarafından belirlenen termal hareketleri. Bundan, belirli bir madde için, bir sıvının ve onun buharının dengesindeki buhar moleküllerinin konsantrasyonu, denge sıcaklıkları tarafından belirlenir. Artan sıcaklıkla buharlaşma ve yoğuşma süreçleri arasında dinamik bir dengenin kurulması, daha yüksek buhar molekülü konsantrasyonlarında gerçekleşir. Bir gazın (buharın) basıncı, konsantrasyonu ve sıcaklığı ile belirlendiğinden, şu sonuca varabiliriz: baskı yapmak doymuş buhar p 0 belirli bir maddenin yalnızca sıcaklığına bağlıdır ve hacme bağlı değildir. Bu nedenle, düzlemdeki gerçek gazların izotermleri ( p, V) iki fazlı bir sisteme karşılık gelen yatay bölümler içerir (Şekil 3.4.1).
Sıcaklık arttıkça, doygun buhar basıncı ve yoğunluğu artarken, termal genleşme nedeniyle sıvının yoğunluğu azalır. Kritik sıcaklığa eşit bir sıcaklıkta T Belirli bir madde için kr, buhar ve sıvı yoğunlukları aynı olur. saat T > T kr, sıvı ile doymuş buharı arasındaki fiziksel farklar ortadan kalkar.
Doymamış buharı izotermal olarak sıkıştırırsak T < T cr, daha sonra doymuş buharın basıncına eşit olana kadar basıncı artacaktır. Hacmin daha da azalmasıyla, kabın dibinde bir sıvı oluşur ve sıvı ile doymuş buharı arasında dinamik bir denge kurulur. Hacim azaldıkça, buharın artan bir kısmı yoğunlaşır ve basıncı değişmeden kalır (izotermdeki yatay bölüm). Tüm buhar bir sıvıya dönüştüğünde, sıvının düşük sıkıştırılabilirliği nedeniyle hacimde daha fazla azalma ile basınç keskin bir şekilde artar.
İki fazlı bölgeyi atlayarak gaz halinden sıvı hale geçmek mümkündür. Bunun için kritik noktayı atlayarak işlemi tamamlamanız gerekir. K. Bu türden olası işlemlerden biri, Şekil 1'de kesikli bir çizgi ile gösterilmiştir. ABC.
AT atmosferik hava su buharı her zaman bazı yerlerde bulunur kısmi basıncı p genellikle doygunluk buhar basıncından daha az olan p 0 . Davranış p / p Yüzde olarak ifade edilen 0 denir bağıl nem hava.
| |
Doymamış buhar teorik olarak durum denklemi kullanılarak tanımlanabilir. Ideal gaz gerçek gazlar için olağan kısıtlamalar altında: buhar basıncı çok yüksek olmamalıdır (pratik olarak p≤ (10 6 –10 7) Pa) ve sıcaklığı her madde için tanımlanan bir değerden daha yüksek. İdeal bir gazın yasaları, her bir sıcaklık için T baskı yapmak p 0 doymuş buhar ile belirlenir denge eğrisip 0 (T) belirli bir madde için.
Baskı yapmak p 0 doymuş buhar, artan sıcaklıkla çok hızlı artar T. Bağımlılık p 0 (T) ideal gaz yasalarından elde edilemez. Sabit bir molekül konsantrasyonunda bir gazın basıncı, sıcaklıkla doğru orantılı olarak artar. Doymuş buharda, sıcaklık arttıkça sadece moleküler hareketin ortalama kinetik enerjisi değil, aynı zamanda konsantrasyonları da artar. Bu nedenle, artan sıcaklıkla doymuş buharın basıncı, sabit bir molekül konsantrasyonunda ideal bir gazın basıncından daha hızlı artar.
Buharlaşma sadece yüzeyden değil, aynı zamanda sıvının kütlesinde de meydana gelebilir. Sıvılar her zaman küçük gaz kabarcıkları içerir. Bir sıvının doygun buhar basıncı, dış basınca (yani, kabarcıklardaki gazın basıncına) eşit veya daha büyükse, sıvı kabarcıklara buharlaşacaktır. Buharla dolu kabarcıklar genişler ve yüzeye çıkar. Bu süreç denir kaynamak . Böylece, bir sıvının kaynaması, basıncının olduğu bir sıcaklıkta başlar. doymuş buharlar dış basınca eşit olur.
Özellikle normalin altında atmosferik basınç su 100°C'de kaynar. Bu, bu sıcaklıkta suyun doymuş buhar basıncının 1 atm olduğu anlamına gelir. Dağlara tırmanırken atmosfer basıncı düşer ve bu nedenle suyun kaynama noktası düşer (her 300 metre yükseklik için yaklaşık 1 °C). 7 km yükseklikte, basınç yaklaşık 0,4 atm'dir ve kaynama noktası 70 °C'ye düşer.
Hermetik olarak kapatılmış bir kapta sıvı kaynamaz, çünkü her sıcaklık değerinde sıvı ile doymuş buharı arasında bir denge kurulur. Denge eğrisi boyunca p 0 (T) çeşitli basınçlarda bir sıvının kaynama noktasını belirlemek mümkündür.
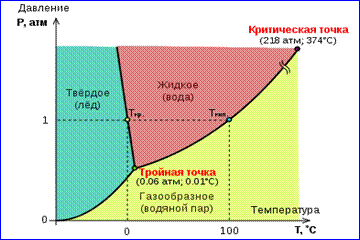
Şekil 1'de gösterilen gerçek gaz izotermlerinin resmi, buharlaşma ve yoğunlaşma işlemlerini, yani bir maddenin gaz ve sıvı fazları arasındaki faz geçişini açıklar. Aslında bu resim eksiktir, çünkü herhangi bir madde gaz ve sıvıdan katı hale geçebilir. Belirli bir sıcaklıkta T Aynı maddenin iki fazı arasındaki termodinamik denge ancak sistemdeki belirli bir basınçta mümkündür. Denge basıncının sıcaklığa bağımlılığı denir. faz denge eğrisi . Bir örnek denge eğrisidir p 0 (T) doymuş buhar ve sıvı. Belirli bir maddenin farklı fazları arasındaki denge eğrileri düzlemde çizilirse ( p, T), daha sonra bu düzlemi, maddenin homojen bir şekilde var olduğu ayrı bölgelere ayırırlar. toplama durumu- katı, sıvı veya gaz (Şekil 2). Koordinat sisteminde gösterilir ( p, T) denge eğrileri denir faz diyagramı .
0 eğrisi T katı ve gaz fazları arasındaki dengeye karşılık gelen, denir süblimasyon eğrisi. eğri TK sıvı ve buhar arasındaki dengeye denir buharlaşma eğrisi, kopuyor kritik nokta K. eğri ÇB arasındaki denge sağlam ve buna sıvı denir erime eğrisi.
Denge eğrileri bir noktada birleşir T her üç fazın da dengede bir arada bulunabileceği. Bu nokta denir üçlü nokta.
Birçok madde için basınç püçlü noktada tr 1 atm ≈ 10 5 Pa'dan azdır. Bu tür maddeler atmosfer basıncında ısıtıldığında erir. Örneğin, üçlü nokta suyun (Şekil 3) koordinatları var T tr = 273.16 K, p tr \u003d 6.02 10 2 Pa ve Kelvin'in mutlak sıcaklık ölçeğini kalibre etmek için referans olarak kullanılır.
 Ancak böyle olanlar da var 3 fazlı su diyagramı
Ancak böyle olanlar da var 3 fazlı su diyagramı
olan maddeler p tr
1 atm'yi aşıyor. İçin böylece
karbondioksit (CO 2) basıncı
p tr = 5.11 atm ve sıcaklık
T tr = 216,5 K. Bu nedenle, atmosferde
basınç, katı karbondioksit olabilir
sadece düşük sıcaklıklarda ve sıvı halde bulunur. p= 1 atm hiç yok. Katı halde karbon dioksit, 173 K veya -80 °C sıcaklıkta atmosfer basıncında buharıyla dengededir. Bu, asla erimeyen, sadece buharlaşan (yücelten) yaygın olarak kullanılan bir "kuru buzdur".






