Bir sıvının kaynama noktasının altında buharlaşma meydana gelir. Çözeltiler, saf çözücülerden daha yüksek bir sıcaklıkta kaynar. Teorik ve gerçek soğutma çevrimi
KAYNAK, buhar kabarcıklarının doğuşu, büyümesi, hareketi ve etkileşimi de dahil olmak üzere bir sıvı içinde buharlaşma süreci; 1. tür dengesiz faz geçişi.
Kaynamaya, durumu sıvı-buhar denge çizgisinin (binodal 1, şekil) üzerindeki bölgeye düşen bir sıvının aşırı ısınması veya denge çizgisi üzerindeki değerinin altındaki basıncın düşmesi neden olur. Faz diyagramında, kaynama işlemi, bir yandan binodal (denge kaynama sıcaklığının basınca bağlı olması) ile sınırlanan yarı kararlı (aşırı ısınmış) durum bölgesi içindeki bir yörünge veya bir nokta ile tanımlanır. , spinodal (sıvının termodinamik stabilitesinin sınırı). Atmosferik basınçta denge kaynama noktası genellikle kimyasal olarak saf bir maddenin ana fizikokimyasal özelliklerinden biri olarak verilir. Bir sıvı gerildiğinde, kaynamaya benzer bir kavitasyon olgusu gözlenir.
Bir yarı denge balonundaki buhar basıncı pp p, sıvı basıncı p l ve arayüzey gerilimi σ ile dengelenir ve basınçla ilişkilidir. doymuş buhar denklem ile aynı Kelvin sıcaklığında yatay bir yüzey üzerinde. Laplace yasasına göre balonun kritik yarıçapı şuna eşittir:
R cr = 2σ/(r p −r w),
ve R için< R кp пузырьки схлопываются, при R >R kp - büyümek.
Homojen bir saflaştırılmış sıvının hacminde buhar kabarcıklarının doğma süreci, sıvının yoğunluğundaki termodinamik dalgalanmalardan dolayı meydana gelir. Bu süreç, sıvının yüksek derecede aşırı ısınmasında gelişir. Ham sıvının hacminde ve katı faz ile sınırlarda (kabın duvarlarının yakınında), genellikle (veya geçici olarak ortaya çıkan) kabarcıkların tercihli doğum bölgeleri vardır - her ikisi de dalgalı (zayıf ıslanmış) olabilen kaynama merkezleri alanlar, hafif kaynayan bir bileşenin artan konsantrasyon bölgeleri, ekzotermik reaksiyon bölgeleri vb.) ve sıvıda zaten mevcut olan hazır (çözünmemiş gaz kabarcıkları, bir katının eksik ıslanmasıyla mikro çatlaklarda gaz veya buhar kabarcıkları) yüzey). Gelişmiş kaynama ile buhar ısıtılan yüzeyde mikrodepresyonlar (gözenekler) tarafından tutulduğunda kaynama merkezleri yenilenir.
Endüstriyel aparatlarda, kaynama genellikle hazır merkezler tarafından sağlanır ve denge kaynama noktasının üzerindeki aşırı ısınma azdır (10 K'den düşük atmosfer basıncında). Patlayıcı işlemlerde yüksek ısı salma gücünde, sıvının elde edilebilir aşırı ısınması çok daha yüksektir ve dalgalanma kabarcık üretim rejimleri gerçekleştirilir.
Hacimsel ve yüzey (duvar) kaynama arasında ayrım yapın. Yüzey kaynatmada, ana buhar kabarcıkları kaynağı, ısıtılan yüzeye bitişik sıvı tabakadır. Sıvı hacmi, binodal üzerindeki denge sıcaklığının altında bir sıcaklığa sahipse (aşırı soğutma ile kaynama denir), o zaman ısıtılan yüzeyin yakınında oluşan ve göç sırasında sıvının soğuk katmanlarına düşen buhar kabarcıkları çöker. Sıvı tüm hacminde aşırı ısındığında (veya basınç düşürüldüğünde) toplu kaynama meydana gelir. Bu durumda, sıvının tüm hacminde buhar kabarcıkları doğar.
Kaynama sırasında kabarcıkların büyümesi, bir bütün olarak sistem üzerinde mekanik (hidrodinamik) bir etkiye sahiptir. Özellikle, aşırı ısıtılmış bir sıvının kapalı bir hacminde, buhar içeriği arttıkça basınç artar. Katı duvarlarla (örneğin borularda) sınırlı kaynayan sıvının ses altı akışlarında, aşağı akıştaki buhar içeriğindeki bir artışa, basınçtaki bir azalma eşlik eder. Buhar kabarcıkları büyüyüp çöktüğünde akustik dalgalar yayarlar - kaynama sesi oluşur. Bir sıvı yeterince hızlı bir şekilde aşırı ısındığında (patlayıcı kaynama modu) meydana gelen kaynama sırasında basınçtaki hızlı artış, yapıların tahrip olmasıyla birlikte buhar patlamasına yol açabilir. Yerçekimi alanında yüzen buhar kabarcıkları, sıvının karıştırılmasına katkıda bulunan ek konvektif akışlara neden olur ve yüzey kaynaması, sıvının duvara yakın tabakasının türbülanslı hareketine neden olur.
Yüzey çekirdekli kaynamada, ısıtıcı sıcaklığındaki artışla, kaynama krizi oluşana kadar yüzeyden ısı çıkışı artar. Kaynama krizi, ısıtılmış yüzeydeki kabarcıkların yerini bir buhar tabakası aldığında, çekirdekli kaynamanın film kaynamasına geçişinin bir sonucudur. Kaynama krizi, ısı gidermede bozulmaya yol açar ve bir dizi enerji cihazı için tehlikelidir.
Kaynatma işlemlerinin günlük yaşamda, bilimde ve teknolojide kullanımı çeşitlidir. Yüzey kaynatma, yoğun yüzey soğutma - ısı giderme için yaygın olarak kullanılır (örneğin, nükleer reaktörlerde, Jet Motorları, elektronik ekipmanın elemanlarını soğuturken). Tuzdan arındırma tesislerinde buharlaşma yüzeyini artırmak için, termik santrallerde buhar kazanlarında, izlerin görüntülenmesi için kabarcık odalarında kaynatma kullanılır. temel parçacıklar, soğutmada, arıtma işlemlerinde, çeşitli kimyasal teknolojilerde, gıda endüstrisinde vb.
Yanıyor: Skripov V.P. Yarı kararlı sıvı. M., 1972; Prisnyakov VF Kaynatma. K., 1988; Labuntsov D.A. Fiziksel temeller enerji. M., 2000.
Her maddenin belirli sıcaklık ve dış basınç değerlerinde kaynadığı iyi bilinmektedir.
Kaynama, sıvının yüzeyinden dışarıya doğru kırılan buhar kabarcıklarının hızlı oluşumu ve büyümesi ile birlikte bir sıvının buharlaşması sürecidir.
Kaynama işleminin gerçekleştiği koşulları göz önünde bulundurun.
Sıvı içinde bir noktada düşük yoğunluklu bir bölge oluşursa, sıvı içinde bir buhar kabarcığı oluşabilir. Prensip olarak, böyle bir bölge oluşabilir, çünkü termal hareketlerin kaotik doğası nedeniyle, hacimdeki parçacıkların ortalama düzgün dağılımından rastgele sapmalar sadece mümkün değil, aynı zamanda kaçınılmazdır. Daha önce de belirtildiği gibi, ortalamadan bu tür sapmalara dalgalanmalar denir. Buhardaki kabarcıklar dalgalanma sırasına göre oluşur. Ancak, aşağıdakiler akılda tutulmalıdır.
Kritik sıcaklıktan uzak bir sıcaklıktaki bir buharın yoğunluğu, bir sıvının yoğunluğundan binlerce kat daha azdır. Bu nedenle, bir kabarcığın oluşması için çok önemli bir dalgalanma gereklidir: Kazara parçacıkların yoğunluğunun hacmin geri kalanından binlerce kat daha az olduğu bir bölge oluşmalıdır! Böyle bir dalgalanma olasılığının çok küçük olduğu açıktır. Ayrıca, önemli bir hacmi kapsaması olası değildir. Vakaların büyük çoğunluğunda, kabarcıklar oluşursa çok küçüktür. Ancak bu durumda, büyüme için koşullara sahip değiller. Sonuçta, bir balon bir gemidir. doymuş buhar(çünkü kap kapalıdır) ve kabın duvarları, balonu çevreleyen sıvının içbükey yüzeyidir. Yüzeyin eğriliği nedeniyle, eğriliğin merkezine doğru yönlendirilmiş bir kuvvet vardır. Bu kuvvet balonu ezecektir çünkü küçük baloncuk boyutlarında çok büyüktür.
Bu koşullar altında, bir sıvıdaki buhar kabarcıklarının gerçekte hiç oluşamayacağı, yani kaynamanın da imkansız olduğu anlamına gelir. Bununla birlikte, sıvının kendisinde veya içinde bulunduğu kabın duvarlarında çözünmüş veya emilmiş (adsorbe edilmiş) hava (veya başka bir gaz) varsa, durum önemli ölçüde değişir. Bu durumda, sıvı ısıtıldığında gaz kabarcıkları oluşur ve bunların oluşumu sıvının yoğunluğundaki dalgalanmalarla ilişkili değildir. Bu nedenle, başlangıçta çok küçük olmaları gerekmez ve yüzeyin eğriliği ile ilişkili basıncın onları ezmesi gerekmez.
Bu nedenle gaz kabarcıkları, buharlaşma (kaynama) fenomeninde, toz parçacıklarının veya iyonların yoğuşma fenomeninde, yani çekirdeklerin rolünde oynadığı rolün aynısını oynar.
Öyleyse, bir nedenden ötürü sıvıda bir gaz kabarcığı oluşmasına izin verin. Oluştuktan sonra hemen çevreleyen sıvının doymuş buharı ile doldurulur ve onunla dengede olacaktır. Kabarcık içindeki buhar basıncı, açıkça sıvının sıcaklığı tarafından belirlenir. Sıvının sıcaklığı, balonun içindeki doymuş buharın basıncı, sıvının üzerindeki dış basınçtan daha az olacak şekilde olduğu sürece, balon büyüyemez, çünkü şimdi bile onu ezmeye çalışan Kuvvetlerde bir eksiklik yoktur. Kabarcıktaki sıvının yüzeyinin eğriliği ile ilişkili hala bir kuvvet vardır. Ayrıca kabarcık, üzerindeki sıvı kolonunun hidrostatik basıncından etkilenir. Son olarak, tüm sıvının altında bulunduğu balona bir dış basınç etki eder ve ana rolü oynayan bu basınçtır. Kalan iki kuvvet, yalnızca dış basınçla balonun ezilmesini kolaylaştırır.
Ancak sıvının sıcaklığı, doymuş buharının esnekliğinin dış basınca eşit olduğu bir değere ulaştığında, balonun içindeki buhar basıncı da dış basınca eşit olacaktır (eğer hidrostatik basıncı hesaba katmazsak). ve yüzey eğriliğinin neden olduğu basınç). Daha sonra, sıcaklıktaki en ufak bir artış, balonun içindeki buhar basıncının dış basıncı aşması için yeterlidir: Bu basınç farkının etkisi altında, balon hızla şişmeye başlayacak ve sonunda yüzerek patlayacaktır;
Bu, kaynama sırasında sıvının yalnızca sıvının yüzeyinden değil, aynı zamanda sıvının içindeki kabarcıkların yüzeyinden de buharlaştığı anlamına gelir. Sıvının kaynaması için sıcaklığını elastikiyetin mümkün olduğu bir değere getirmesi gerekir. doymuş buharlar bu sıvının dış basıncına eşittir (daha doğrusu, biraz daha fazla).
Dış basınç ne kadar düşük olursa, sıvının kaynama noktasının o kadar düşük olduğu açıktır. Bu iyi açıklıyor bilinen gerçek yani yüksek irtifalarda atmosfer basıncı düşük, sıvılar deniz seviyesinden daha düşük sıcaklıklarda kaynar. Bir sıvının kaynama noktasını ölçerek barometrik basıncı ve dolayısıyla deniz seviyesinden yüksekliği belirleyebilirsiniz. Karşılık gelen cihaza hipotermometre denir.
Normal olarak (yani, 1 atm'lik bir dış basınçta) 100 ° C'de kaynayan su (bu sıcaklıkta doymuş su buharının esnekliği 1 atm'dir), yoğun hava pompalaması ve yüzeyinin üzerindeki buharlar, üzerindeki dış basıncı yeterince azaltır.
Bir sıvının kaynama noktasının dış basınca bağımlılığını belirlemek kolaydır. Nitekim biz yukarıda
bir sıvının doymuş buharlarının esnekliğinin sıcaklığa bağımlılığını belirleyen formül (105.6):
(Clapeyron-Clausius formülü). Kaynama sırasında, dış basınç sıvının doymuş buharının esnekliğine tam olarak eşit olduğundan, Clausius-Clapeyron denklemini tersine çevirirsek, sıvının kaynama noktasının sıcaklığa bağımlılığını elde edeceğimiz açıktır. dış basınç. Bu nedenle, bu bağımlılık şöyle görünür:
![]()
Sıvı aşırı ısınma. Yukarıda söylenenlerden, kaynama olgusunun ancak sıvı içinde gaz kabarcıkları oluşabiliyorsa meydana gelebileceği ve bunun için sıvının içinde çözünmüş gazları içermesi gerektiği açıktır. Denilebilir ki, yoğuşma ancak yoğuşma merkezlerinin (toz parçacıkları, iyonlar) varlığında mümkün olduğu gibi, kaynama, yani yoğun buharlaşma, gaz kabarcıkları olan buharlaşma merkezlerinin varlığını gerektirir. (Yalnızca çekirdeklerin varlığında meydana gelen faz geçişlerine denir. faz geçişleri birinci tür.)
Yoğunlaşma merkezlerinin yokluğunda, gördüğümüz gibi aşırı doymuş buhar elde etmek mümkündür. Aynı şekilde, sıvı içinde kabarcıklar oluşturabilen çözünmüş gazların yokluğunda, aşırı ısıtılmış bir sıvı, yani sıcaklığı belirli bir dış basınçta kaynama noktasından daha yüksek olan, ancak yine de ısı veren bir sıvı elde edilebilir. kaynatmak değil.
Sıvının aşırı ısınma olasılığı, sıvının kavisli yüzey altında maruz kaldığı ek basınçla ilişkilidir. Gerçekten de, balonu çevreleyen sıvının küresel yüzeyi büzülme eğilimindedir. Ortaya çıkan basınç
balonun merkezine doğru yönlendirilir, yani balonu ezen dış basınca eklenir. Ve küçük baloncuk boyutlarında çok önemli bir değere ulaşır. Bu nedenle, ısıtılacak sıvı ve içinde bulunduğu kabın duvarları çözünmüş gazlardan dikkatlice temizlenirse, sıvı içinde kabarcıkların oluşması o kadar zordur ki, kaynamadan çok daha yüksek bir sıcaklığa kadar ısıtılabilir. kaynama noktası. Daha kesin olarak, sıvı, esnekliğin sağlandığı bir sıcaklığa kadar aşırı ısıtılabilir.
Kabarcıklardaki doymuş buharın miktarı, dış basınç artı en küçük kabarcıkların yüzeyinin eğriliğinin neden olduğu basıncı aşmaz.
Gördüğümüz gibi, düşük sıcaklıklarda buhar kabarcıklarının oluşumu, olasılığı çok küçük olan büyük yoğunluk dalgalanmaları gerektirdiğinden pratik olarak imkansızdır. Ancak sıcaklık arttıkça sıvı ve buharın yoğunlukları arasındaki fark azalır (kritik sıcaklıkta tamamen kaybolur). Bu nedenle, kabarcık oluşumu için gerekli yoğunluk dalgalanmaları giderek daha az önemli hale gelir. Buna göre, olasılıkları artar. Yeterli olduğunda Yüksek sıcaklık(yüksek, kritik sıcaklığa yakın anlamına gelir) kabarcıklar, gaz kabarcıkları şeklinde çekirdek yokluğunda bile oluşabilir ve büyüyebilir. Bu, bu durumda bir sıvının kaynatılmasının da mümkün olduğu, ancak yalnızca aşırı ısıtıldığı anlamına gelir. Ve sıvı ne kadar derinlemesine temizlenirse, o kadar güçlü aşırı ısınabilir.
Ne zaman aşırı ısıtılmış sıvı yine de sonunda kaynar, sonra çok şiddetli bir şekilde kaynama meydana gelir, bir patlamayı andırır. Bu durumda, sıvı belirli bir basınçta normal kaynama noktasına hızla soğutulur.
Sıvının aşırı ısınması ve ardından gelen şiddetli kaynama, sıvının bulunduğu kap için büyük bir tehlikedir. Bu nedenle aşırı ısınmayı önlemek için özel önlemler alınır. Bunu yapmak için, ısıtıldığında bol miktarda havanın serbest bırakıldığı sıvıya gözenekli gövdeler yerleştirilir. Bu tür gövdeler, seramik borulardır (örneğin, pişirilmemiş porselen) veya kılcal boruların süsleridir.
Sıvının gözle görülür şekilde aşırı ısınmasını garanti eden kabarcıkların boyutunu belirlemek zor değildir. Su için böyle bir değerlendirme yapalım. Bu durumda, normal dış basınçta suyun 0,1 derece aşırı ısınmasına izin verildiğini varsayacağız.
Kızgınlığın bu değeri geçmemesi için kabarcıkların boyutu ne olmalıdır?
Bunu yapmak için, sıcaklık 100'den 100'e yükseldiğinde buhar basıncının ne kadar artacağını belirlemek gerekir.Bu, su buharı basıncının sıcaklığa bağımlılık eğrisi kullanılarak yapılabilir. Bu eğriden, sıcaklıktaki 0.1°'lik bir değişikliğin buhar basıncında . Bu nedenle, aşırı ısınmanın 0,1°'yi geçmemesi için, kabarcıkların ortalama yarıçapının
![]()
Kabarcıkların maruz kaldığı hidrostatik basıncın sıvının aşırı ısınması üzerindeki etkisini de tahmin edelim.
Sıvı yüzeyinin altındaki bir derinlikte, bir gaz kabarcığı basınçla karşılaşır.
Dış basınca (kabuğun yüzeyinin eğriliğinden kaynaklanan basınca ek olarak) eklenir ve bu miktarda balonun yüzmesi için içindeki buhar basıncının arttırılması gerekir. Aynı eğriden, kaynama noktasındaki suyun sıcaklığının, yüzeyin altındaki derinlikle ne kadar değiştiği bulunabilir. Örneğin, bkz.
Bu, kaynama noktasındaki bir artışa karşılık gelir.
Kaynar suyun sıcaklığı, gördüğümüz gibi, iyi tanımlanmış bir değer değildir. Az önce ele aldığımız nedenlerden dolayı, küçük sınırlar içinde dalgalanmaktadır. Kaynayan suyun kendisi değil, üzerindeki su buharı oldukça belirli bir sıcaklığa sahiptir, çünkü sıvının içinde ne olursa olsun, yüzeyinde patlayan kabarcıklardan çıkan buharın oldukça belirli bir sıcaklığı vardır - esnekliğin oluştuğu sıcaklık. doymuş buhar miktarı dış basınca eşittir. Bu nedenle, termometreleri kalibre ederken kaynar suya değil, üzerindeki buharlara yerleştirilirler.
kabarcık odası. Bulut odasında, gördüğümüz gibi, buharın aşırı doygunluğu ve aşırı doymuş buharın iyonlar üzerinde yoğunlaşması yoğunlaşma merkezleri olarak kullanılır. Benzer şekilde ve aynı amaçlar için, yani hızlı parçacıkları tespit etmek için, bir sıvının aşırı ısınması ve ardından içinde kabarcıkların oluşması olgusu da kullanılabilir. Bu ilke, son zamanlarda araştırma alanında yaygınlaşan sözde kabarcık odasının çalışmasının temelidir. nükleer Fizik ve yüksek enerjili parçacık fiziği.
Kabarcık odası, bir ısıtıcı kullanılarak aşırı ısıtılabilen bir sıvı içeren bir kaptır. Bu kap, sıvının üzerinde artan bir basınç oluşturmanıza ve bu basıncı hızla ortadan kaldırmanıza izin veren bir cihaza bağlıdır. Önce sıvıyı ısıtır ve dış basınçla sıkıştırırsanız ve ardından dış basıncı kaldırırsanız, sıvı elbette aşırı ısınır, ancak deney için yeterli süre boyunca (birkaç on saniye), kaynamaz . Bu anda hızlı bir parçacık odaya uçarsa, sıvıya girerken enerjisinin bir kısmını kaybeder ve bu da esas olarak ısıya dönüştürülür. Sıvı aşırı ısındığından, bu ek ısı, partikül yolunda yoğun kabarcık oluşumu için yeterlidir. Ortaya çıkan kabarcıklar, hızla büyüdükleri boyutlara büyürler.
görünür hale gelir, böylece kabarcıklar zinciri - parçacığın izi - fotoğraflanabilir.
Gevşek buharla doldurulmuş bir bulut odası bir parçacıktan nüfuz edebiliyorsa, yoğun bir madde - sıvı ile dolu bir kabarcık odasında, parçacık, bu parçacığın özelliklerinin çalışılmasını kolaylaştıran, odayı terk etmeden sonuna kadar geçer. Bu, kabarcık odasının önemli avantajlarından biridir.
Ayrıntılar Kategori: Moleküler-kinetik teori Yayınlanma tarihi 09.11.2014 21:08 Görüntüleme: 8345Sıvı halde, bir madde belirli bir sıcaklık aralığında var olabilir. Bu aralığın alt değerinin altındaki bir sıcaklıkta sıvı katı hale dönüşür. Ve sıcaklık değeri aralığın üst sınırını aşarsa, sıvı içeri geçer. gaz hali.
Bütün bunları su örneğinde gözlemleyebiliriz. Sıvı haldeyken onu nehirlerde, göllerde, denizlerde, okyanuslarda, muslukta görürüz. Katı hal su buzdur. Normal atmosfer basıncında sıcaklığı 0 o C'ye düştüğünde ona dönüşür. Sıcaklık 100 o C'ye yükseldiğinde ise su kaynar ve gaz hali olan buhara dönüşür.
Bir maddenin buhara dönüşme işlemine ne denir buharlaşma. Buhardan sıvıya geçmenin tersi işlemi yoğunlaşma .
Buharlaşma iki durumda gerçekleşir: buharlaşma sırasında ve kaynama sırasında.
buharlaşma
Buharlaşma, bir maddenin maddeden geçişinin faz sürecidir. sıvı hal gaz veya buhar halinde, meydana gelen sıvının yüzeyinde .
Erimede olduğu gibi, buharlaşma sırasında ısı bir madde tarafından emilir. Sıvının parçacıklarının (moleküller veya atomlar) yapışkan kuvvetlerinin üstesinden gelmek için harcanır. Kinetik enerji en yüksek hıza sahip moleküller potansiyel enerji diğer sıvı moleküllerle etkileşimler. Bu nedenle, komşu parçacıkların çekiciliğinin üstesinden gelirler ve sıvının yüzeyinden uçarlar. Kalan parçacıkların ortalama enerjisi küçülür ve sıvı dışarıdan ısıtılmazsa yavaş yavaş soğur.
Parçacıklar herhangi bir sıcaklıkta hareket halinde olduklarından buharlaşma da meydana gelir. herhangi bir sıcaklıkta. Su birikintilerinin soğuk havalarda bile yağmurdan sonra kuruduğunu biliyoruz.
Ancak buharlaşma hızı birçok faktöre bağlıdır. En önemlilerinden biri - madde sıcaklığı. Ne kadar yüksek olursa, parçacıkların hızı ve enerjileri o kadar yüksek olur ve sayıları birim zamanda sıvıdan o kadar fazla çıkar.
Aynı miktarda su ile 2 bardak doldurun. Birini güneşte diğerini gölgede bırakıyoruz. Bir süre sonra birinci bardakta ikinciye göre daha az su olduğunu göreceğiz. Güneş ışınları tarafından ısıtıldı ve daha hızlı buharlaştı. Yağmurdan sonraki su birikintileri de yaz aylarında ilkbahar veya sonbaharda olduğundan çok daha hızlı kurur. Aşırı sıcakta, rezervuarların yüzeylerinden suyun hızlı buharlaşması meydana gelir. Göletler ve göller kuruyor, sığ nehirlerin yatakları kuruyor. Sıcaklık ne kadar yüksek olursa çevre, buharlaşma oranı o kadar yüksek.
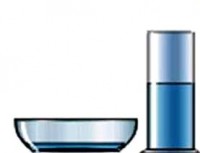
Aynı hacimde, geniş bir tabaktaki sıvı, bardağa dökülen sıvıdan çok daha hızlı buharlaşacaktır. Demek oluyor buharlaşma hızı, buharlaşmanın yüzey alanına bağlıdır . Bu alan ne kadar büyük olursa, birim zamanda sıvıdan çıkan molekül sayısı o kadar fazla olur.
aynı ile dış koşullar buharlaşma hızı maddenin cinsine bağlıdır . Cam şişeleri aynı hacimde su ve alkolle doldurun. Bir süre sonra sudan daha az alkol kaldığını göreceğiz. Daha hızlı buharlaşır. Bunun nedeni, alkol moleküllerinin birbirleriyle su moleküllerinden daha zayıf etkileşime girmesidir.
buharlaşma hızını etkiler ve rüzgar varlığı . Yıkandıktan sonra rüzgarla savrulan eşyaların çok daha hızlı kuruduğunu biliyoruz. Saç kurutma makinesindeki sıcak hava jeti saçlarımızı çabucak kurutabilir.
Rüzgar sıvıdan dışarı akan molekülleri alıp götürür ve geri dönmezler. Yerlerini sıvıdan ayrılan yeni moleküller alır. Bu nedenle, sıvının kendisinde daha az olurlar. Bu nedenle daha hızlı buharlaşır.
süblimasyon

Buharlaşma gerçekleşir katılar Ey. Donmuş, buzla kaplı çarşafların soğukta nasıl yavaş yavaş kuruduğunu görüyoruz. Buz buhara dönüşür. Buharlaşmanın ürettiği keskin kokuyu alıyoruz Katı madde naftalin.
Bazı maddelerin hiç sıvı fazı yoktur. Örneğin, elementel iyotben 2 - mor metalik parlaklığa sahip siyah-gri kristaller olan basit bir madde, normal koşullar altında hemen gaz halinde iyodine dönüşür - keskin kokulu mor buhar. Eczanelerden aldığımız sıvı iyot sıvı hali değil, iyotun alkoldeki çözeltisidir.
Katıların geçiş süreci sıvı aşamayı atlayarak gaz halinde bir duruma denir süblimasyon, veya süblimasyon .
Kaynamak

Kaynamak Bu aynı zamanda sıvının buhara dönüşme sürecidir. Ancak kaynama sırasında buharlaşma sadece sıvının yüzeyinde değil, tüm hacminde gerçekleşir. Ayrıca, bu süreç buharlaşma sırasında olduğundan çok daha yoğundur.
Ateşe bir su ısıtıcısı koyun. Suda her zaman çözünmüş hava bulunduğundan, ısıtıldığında su ısıtıcısının dibinde ve duvarlarında kabarcıklar oluşur. Bu kabarcıklar hava ve doymuş su buharı içerir. Önce çaydanlığın duvarlarında görünürler. İçlerindeki buhar miktarı artar ve büyüklükleri artar. Daha sonra Arşimet'in kaldırma kuvvetinin etkisi altında duvarlardan ayrılacak, yükselecek ve suyun yüzeyinde patlayacaklardır. Su sıcaklığı 100 ° C'ye ulaştığında, tüm su hacmi boyunca kabarcıklar oluşacaktır.
Buharlaşma herhangi bir sıcaklıkta meydana gelir ve kaynama sadece belirli bir sıcaklıkta meydana gelir. kaynama noktası .
Her maddenin kendi kaynama noktası vardır. Basınç miktarına bağlıdır.
Normal atmosfer basıncında, su 100 o C sıcaklıkta, alkol - 78 o C'de, demir - 2750 o C'de kaynar. Ve oksijenin kaynama noktası eksi 183 o C'dir.
Basınç azaldıkça kaynama noktası düşer. Atmosfer basıncının daha düşük olduğu dağlarda, su 100 o C'den daha düşük bir sıcaklıkta kaynar. Deniz seviyesinden ne kadar yüksekse, kaynama noktası o kadar düşük olur. Ve basıncın arttığı bir düdüklü tencerede su 100 o C'nin üzerinde bir sıcaklıkta kaynar.
Doymuş ve doymamış buhar
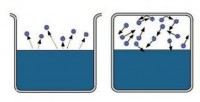
Bir madde aynı anda hem sıvı (veya katı) hem de gaz halinde bulunabiliyorsa, bu duruma gaz hali denir. feribot . Buhar, buharlaşma sırasında bir sıvı veya katıdan kaçan moleküllerden oluşur.
Sıvıyı kabın içine dökün ve bir kapakla sıkıca kapatın. Bir süre sonra buharlaşması nedeniyle sıvı miktarı azalacaktır. Sıvıyı terk eden moleküller, yüzeyinin üzerinde buhar şeklinde yoğunlaşacaktır. Ancak buhar yoğunluğu oldukça yükseldiğinde, bazıları tekrar sıvıya dönmeye başlayacaktır. Ve bu tür moleküller giderek daha fazla olacak. Son olarak, sıvıyı terk eden moleküllerin sayısı ile sıvıya dönen moleküllerin sayısının eşit olacağı bir an gelecek. Bu durumda diyorlar ki sıvı, buharı ile dinamik dengededir. . Bu çift denir zengin .
Buharlaşma sırasında sıvıdan geri dönenden daha fazla molekül uçarsa, bu tür buhar doymamış . doymamış buhar buharlaşan sıvı açık bir kapta olduğunda oluşur. Onu terk eden moleküller uzayda dağılır. Hepsi sıvıya geri dönmez.
Buhar yoğunlaşması

Bir maddenin gaz halinden sıvı hale geçmesine ters geçiş denir. yoğunlaşma. Yoğuşma sırasında buhar moleküllerinin bir kısmı sıvıya geri döner.
Buhar, belirli bir sıcaklık ve basınç kombinasyonunda sıvıya (yoğunlaşmaya) dönüşmeye başlar. Bu kombinasyon denir kritik nokta . Maksimum sıcaklık , altında yoğunlaşmanın başladığı denir kritik sıcaklık. Kritik sıcaklığın üzerinde gaz asla sıvıya dönüşmez.
AT kritik nokta sıvı-buhar arayüzü bulanık. kaybolur yüzey gerilimi sıvı, sıvının yoğunlukları ve doymuş buharı eşitlenir.
Dinamik dengede, sıvıdan ayrılan ve sıvıya dönen molekül sayısı eşit olduğunda, buharlaşma ve yoğunlaşma süreçleri dengelenir.
Su buharlaştığında molekülleri oluşur. su buharı , hava veya diğer gazlarla karıştırılır. Bu buharın havadaki doymuş hale geldiği, soğuyunca yoğuşmaya başladığı ve su damlacıklarına dönüştüğü sıcaklığa denir. çiğ noktası .

Havada çok miktarda su buharı olduğunda neminin arttığı söylenir.
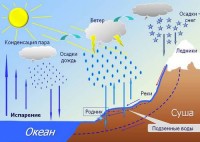
Doğada buharlaşma ve yoğunlaşmayı çok sık gözlemleriz. Sabah sisi, bulutlar, yağmur - tüm bunlar bu fenomenlerin sonucudur. İTİBAREN yeryüzüısıtıldığında nem buharlaşır. Ortaya çıkan buharın molekülleri yükselir. Yolda serin yapraklar veya çimen bıçaklarıyla karşılaşan buhar, üzerlerinde çiy damlaları şeklinde yoğunlaşır. Biraz daha yüksek, yüzey katmanlarında sis olur. Düşük sıcaklıklarda atmosferde yüksek, soğutulmuş buhar, su damlacıklarından veya buz kristallerinden oluşan bulutlara dönüşür. Daha sonra bu bulutlardan yeryüzüne yağmur veya dolu yağacaktır.
Ancak yoğuşma sırasında sadece en küçük katı veya sıvı parçacıklar havada olduğunda su damlacıkları oluşur. yoğunlaşma çekirdekleri . Yanma, püskürtme, toz parçacıkları, okyanus üzerindeki deniz tuzu, bunların sonucunda oluşan parçacıklar olabilir. kimyasal reaksiyonlar atmosferde vb.
desüblimasyon

Bazen bir madde, sıvı aşamasını atlayarak gaz halinden hemen katı hale geçebilir. Böyle bir sürece denir desüblimasyon .
Soğuk havalarda bardaklarda görülen buz desenleri desüblimasyona bir örnektir. Donlar sırasında, toprak kırağı ile kaplanır - su buharının havadan dönüştüğü ince buz kristalleri.
Raoult yasasından iki önemli sonuç çıkar:
1) Çözeltiler, saf bir çözücüden daha yüksek bir sıcaklıkta kaynar;
2) Çözeltiler, saf bir çözücüden daha düşük bir sıcaklıkta donar.
Onları daha ayrıntılı olarak ele alalım.
Kaynama, sıvının hacmi boyunca gaz kabarcıklarının oluştuğu, bir sıvının gaz haline veya buhara dönüştüğü fiziksel süreçtir.
Bir sıvı, basıncı olduğunda kaynardoymuş buhar dış basınca eşit olur. Dış basınç (örneğin, atmosferik) değişmezse vesıvı bireysel ve kimyasal olarak saf bir maddedir, daha sonra açık ısıtılmış bir kapta kaynaması, sıvı faz tamamen kaybolana kadar sabit bir sıcaklıkta gerçekleşir.
Böylece, 101.325 kPa'lık bir atmosfer basıncında, arıtılmış (damıtılmış) suyun kaynama noktası 100 o C veya 373.16K'dır.
Uçucu olmayan bir madde H 2 O içinde çözülürse, doymuş buharının basıncı azalacaktır. Elde edilen çözeltinin kaynaması için, onu 373.16K'dan daha yüksek bir sıcaklığa ısıtmak gerekir, çünkü yalnızca bu koşullar altında çözücünün doymuş buharının basıncı tekrar atmosferik hale gelir.
Donma veya kristalleşmebir sıvının bir katıya dönüşmesinin eşlik ettiği fiziksel bir olgudur. Ayrıca, sıvının tüm hacminde kristal yapılar oluşur.
Donma işlemi, sıvı üzerindeki doymuş buhar basıncı, katı kristalleri üzerindeki doymuş buhar basıncına eşit olduğunda başlar.
Dış (atmosferik) basınç sabit kalırsa vesıvı yabancı safsızlıklar içermez, daha sonra kristalizasyon işlemi sırasında soğutulmuş sıvının sıcaklığı, sıvı faz tamamen katı hale gelene kadar sabit kalacaktır.
101.325 kPa'lık bir atmosfer basıncında, damıtılmış su 0°C'de (273.16K) donar. Doymuş su buharının buz ve sıvı üzerindeki basıncı bu durumda 613.3 Pa'dır.
Sulu bir çözelti için, çözücünün 0 ° C'de doymuş buhar basıncı 613.3 Pa'dan az olacaktır, ancak buz üzerinde değişmeden kalır. Böyle bir çözeltiye indirilen buz, üzerindeki aşırı miktarda buharın yoğunlaşması nedeniyle hızla erir.
Doymuş buharın sıvı ve katı fazlar üzerindeki basıncını yeniden eşitlemek ve kristalleşme sürecini başlatmak, ancak sıcaklığın düşürülmesiyle mümkündür.
Ampirik olarak, kaynama noktasında bir artış olduğu bulundu ( t balya ) ve donma noktasının düşürülmesi çözüm ( t milletvekili ) saf bir çözücü ile karşılaştırıldığında, çözünenin molar konsantrasyonu ile doğru orantılıdır. Matematiksel olarak, bu aşağıdaki gibi yazılabilir:
t b.p. p-ra –t kip. p-calf \u003d t kip. =em
t r-tel -t yardımcısı. p-ra \u003d t milletvekili. =Km
neredem– molal konsantrasyonçözünen;EveK, sırasıyla, ebulliyoskopik (lat.ebbulio- kaynama) ve kriyoskopik (Yunanca "cryos" - soğuk) sabitleri, değerleri yalnızca doğaya bağlıdırçözücü (Tablo 7).
Tablo 7 Bazı çözücülerin ebullioskopik E ve kriyoskopik K sabitleri (derece/mol)
Ebullioskopik ve kriyoskopik sabitler çözücü kaç derece yükseldiğini gösterir kaynama noktası ve donma noktası Bir mol elektrolit olmayan maddenin bir kilogram çözücü içinde çözülmesiyle elde edilen çözelti ( m = 1 mol/kg).
E ve K değerlerini belirlemek için önce deneysel olarak Dt kip'i belirleyin. ve Dt milletvekili. yüksek oranda seyreltik çözeltiler (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
neredeRevrensel gaz sabitidir;Tçözücünün kaynama noktasıdır; çözücünün buharlaşma özgül ısısıdır.
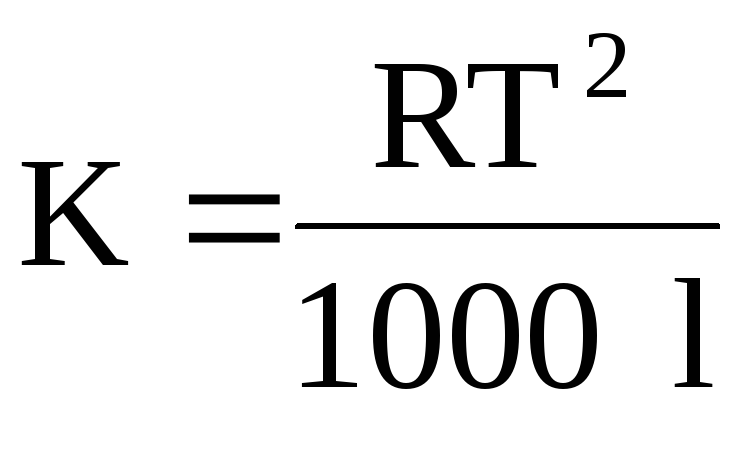
neredeT- erime sıcaklığıçözümmüşteri;ben- özgül füzyon ısısıçözücü.
Böylece, farklı doğaya sahip, ancak aynı molar konsantrasyona sahip maddelerin çözeltileri aynı anda kaynar ve donarsıcaklık.
Önemli bir farka dikkat çekilmelidir.saf bir çözücüden çözelti. İkincisi kaynar ve sabit bir şekilde donarsasıcaklık, daha sonraçözümler bunu aralıkta yaparsıcaklıklar, yani kaynama sürecinde sıcaklık her zaman yükselir ve donduğunda azalır. Bunun nedeni, sıvı fazdan uzaklaştırmabuhar veya katı kristaller şeklinde çözücü, çözeltinin molar konsantrasyonunda bir artışa yol açar, tk. kaynama ve donma sürecinde çözünen madde sıvı fazda (tamamen kaynama veya donma işlemine kadar) değişmeden kalır ve sıvı çözücünün kütlesi azalır.
Pratik ölçümlerde donma veya kaynama noktası çözüm, içindeki ilk katı kristallerin ortaya çıkma anı sabittir (çünkü t milletvekili ) veya gaz kabarcıkları (için t balya ).
Çözeltilerin donma noktasını düşürme özelliği, soğutucu olarak kullanılmalarına izin verir.
Bu nedenle, bazı organik ve inorganik maddelerin çözeltileri, çeşitli iklim koşullarında çalıştıklarında içten yanmalı motorların soğutulması için antifriz olarak kullanılır.
eski sürüme geçmek donma sıcaklığı çözümler canlı organizmalar için büyük önem taşımaktadır. Böylece hücrelerindeki sıvı, çeşitli inorganik ve organik maddelerin bir çözeltisidir. Onundonma sıcaklığı 0'ın altında hakkında C (273.16) K ), böylece hücreler aşırı soğutma koşulları altında ölmezler.
Bu fenomen sayesinde bitkiler kışın korunur. Ayrıca, hücre sıvısındaki maddelerin konsantrasyonu ne kadar yüksek olursa, bitkinin tolere edebileceği dış sıcaklıklar o kadar düşük olur.
Aynı zamanda, soğutulmuş hücrelerde çözeltinin donma noktasını düşürmek için, daha yüksek moleküler ağırlıklı bileşiklerin düşük moleküler ağırlıklı bileşiklere (örneğin, karbonhidratlardan glikoza) hidroliz işlemi yoğunlaştırılır.






