Su buharına doymuş ise denir. Doymuş ve doymamış buhar
Doymuş buhar, bir sıvı veya katı ile dengede olan bir buhardır. Bir maddenin doygun buhar basıncı, doğasına ve sıcaklığına bağlıdır.
Sıvı ve buhar arasındaki denge dinamiktir: aralarında sürekli bir parçacık alışverişi (atomlar, moleküller) vardır ve arayüz birimleri aracılığıyla birim zaman başına, geri döndüklerinde buhara kaçan çok sayıda parçacık uçar.
Doymuş buhar basıncı artan sıcaklıkla artar. Nicel olarak, bu bağımlılık Clausius-Clapeyron denklemi ile ifade edilir.
burada Р doymuş buharın basıncıdır; T mutlak sıcaklıktır;
ΔН, buharlaşmanın molar ısısıdır; R evrensel gaz sabitidir.
Bu denklemi entegre ederek, ΔН=f(T) varsayarak, şunu elde ederiz:
lnP = - + const(2)
ln = - ( - ). (3)
Denklem (2), lnP – koordinatlarında doğrusal bir bağımlılığa karşılık gelir. Düz çizginin eğiminin tanjantı ile, ΔН = -Rtgα olduğu için buharlaşma ısısı ΔН belirlenebilir, burada α, düz çizgi ve apsis ekseni tarafından oluşturulan açıdır. İntegrasyon sabitinin değeri, basıncın ifade edildiği boyuta bağlıdır ve elde edilen düz çizgi üzerindeki herhangi bir lnP değerinden bulunabilir.
Gibbs faz kuralına göre, bir denge sıvı-buhar sistemi bir serbestlik derecesine sahiptir. Bu, bir maddenin doygun buhar basıncının yalnızca sıcaklığa bağlı olduğu anlamına gelir. Bu çalışmada bağımsız değişken deneyci tarafından belirlenen dış basınç, bağımlı değişken ise kaynama noktasıdır.
Amaç- doymuş buhar basıncını ölçmek için dinamik yöntemle tanışın, belirli bir madde için doymuş buhar basıncının sıcaklığa bağımlılığını belirleyin ve grafikten buharlaşma ısısını hesaplayın.
ÇALIŞMA PROSEDÜRÜ
Dinamik yöntem, bir sıvının farklı basınçlarda kaynama noktalarının belirlenmesine dayanır. Kaynama, doymuş buhar basıncının dış basınca eşit olduğu sıcaklıkta meydana geldiğinden, farklı basınçlardaki kaynama sıcaklıklarının ölçümleri, doyma buhar basıncının sıcaklığa bağımlılığını verir.
İşi gerçekleştirmek için kurulum şekilde gösterilmiştir.
Sıvının buharlaştığı bir çalışma kabından (1) oluşur; buharın yoğunlaştığı bir geri akış kondansatörü (2); basınç göstergesi 3; su banyosu 5 olan ısıtıcı 4, ucu pamuk yünü ile bağlanmış mantarın içinden test sıvısı ile çalışma kabına bir termometre 6 sokulur.
Kaynama noktasını doğrudan yüzeyde ölçün ve sıvının aşırı ısınmasından kaynaklanan hataları önleyin.
|

Çalışma, araştırılan sıvının üzerindeki boşlukta, Komovsky pompası 7 tarafından art arda çeşitli derecelerde seyreltme yaratıldığı ve kaynama noktalarının belirlendiği gerçeğine indirgenmiştir. Deney sırasında, valf 9 açılarak vakum azaltılır. Kap 8, boşaltılan sistemin hava ile nispeten yavaş bir şekilde doldurulmasına izin veren ek bir kaptır. Kaynamanın meydana geldiği basınç, basınç göstergesi okumasıyla belirlenir.
Musluğu kapatın, sistemi yönetici tarafından ayarlanan basınca kadar boşaltın. Sistemin sıkılığını kontrol edin. 10 dakika içinde basıncın 2,6·10 -3 atm'den fazla artmaması yeterli kabul edilir. Su musluğunu dikkatlice açarak suyu buzdolabına alın. Isıtıcıyı açın ve sıvı sıcaklığının yükselmesini izleyin. Termometrede cıva yükselmesinin durması sıvının kaynadığını gösterir. Okumaları kaydedin
termometre ve manometre. Bir musluk kullanarak, cihazı atmosferle iletişim kurun, basıncı 0,04 atm artırın. Bu durumda termometredeki cıva yükselir ve yeni basınca karşılık gelen kaynama noktasında durur. Sistemdeki basıncı barometrik basınca getirmek için işlemleri gerektiği kadar tekrarlayın.
Ölçüm sonuçlarını tabloya kaydedin:
Elde edilen verilere dayanarak: 1) araştırılan sıvının buhar basıncının sıcaklığa bağımlılığını Р – T, 0 С ve lnP – , К koordinatlarında çizin; 2) sıvının buharlaşma ısısını grafik olarak ve denklem (3)'e göre üç sıcaklık aralığı için belirleyin; 3) 1 mol maddenin buharlaşması sırasında entropi değişimini belirler.
TEST SORULARI
"Tek bileşenli bir sistemde faz dengesi" konusunda
1. Birinci ve ikinci türden faz geçişleri.
2. Fazların bir arada denge durumu.
3. Clausius-Clapeyron denklemi (türetme).
4. Sıcaklık ve basınç arasındaki hangi ilişki sıvı-buhar dengesi için tipiktir? Neden? Niye?
5. Basınç ve erime noktası arasındaki ilişki çoğu madde için en tipik olanıdır? Bu ilişki su için neden farklıdır?
6. Buharlaşma ısısı nasıl ve neden sıcaklığa bağlıdır?
7. Doymuş buhar basıncı ile sıcaklık arasındaki ilişki düz bir çizgi olarak hangi koordinatlarda ifade edilir ve bu durumda buharlaşma ısısının ortalama değeri nasıl belirlenebilir?
8. Dinamik denge ve doymuş buhar basıncı nedir?
9. Su durumunun şeması. Nasıl atmosfer basıncı suyun kaynama noktası? Neden? Niye?
10. Farklı maddeler için lnP - bağımlılıkları vardır. Bu çizgilerin eğimini ne belirler?
Konu 2. FAZ GEÇİŞLERİ.
Faz geçişi ( faz dönüşümü) bir maddenin bir fazdan diğerine, dış koşullarda (örneğin, sıcaklık, basınç, manyetik ve elektrik alanları vb.) fiziksel özellikler ve madde parametreleri.
Sıcaklık, basınç veya başka bir değerin değeri fiziksel miktar faz geçişinin meydana geldiği noktaya geçiş noktası denir. İki tür faz geçişi vardır.
BİRİNCİ TÜRÜN FAZ GEÇİŞLERİ
Birinci türden bir faz geçişi sırasında, bu tür termodinamik
yoğunluk, bileşenlerin konsantrasyonu gibi bir maddenin özellikleri, belirli hacim, depolanan iç enerji miktarı, yani. geçiş ısısı olarak adlandırılan belirli bir miktarda ısı salınır veya emilir. Ayrıca, bu miktarların zamanla değil, sıcaklık, basınç vb.'deki ani değişimi ifade eder. Birinci dereceden faz geçişlerinin en yaygın örnekleri şunlardır:
- erime ve kristalleşme
- buharlaşma ve yoğunlaşma
- süblimasyon ve desüblimasyon
İKİNCİ TÜRÜN FAZ GEÇİŞLERİ
İkinci dereceden bir faz geçişi sırasında yoğunluk ve içsel enerji değişmeyin yani çıplak gözçok faz geçişi görünmez olabilir. Sıçrama, sıcaklık ve basınca göre türevleriyle deneyimlenir: ısı kapasitesi, termal genleşme katsayısı, çeşitli duyarlılıklar, vb. ikinci türden faz geçişlerine, enerjinin (ısı) salınması veya emilmesi ile değil, maddenin yapısının simetrisindeki bir değişiklik eşlik eder. İkinci dereceden faz geçişlerinin en yaygın örnekleri şunlardır:
- sistemin kritik bir noktadan geçişi
- paramanyetik-ferromanyetik geçiş
- metallerin ve alaşımların süperiletkenlik durumuna geçişi
- sıvı helyumun süperakışkan bir duruma geçişi
- amorf malzemelerin camsı bir duruma geçişi
Modern fizik ayrıca üçüncü veya daha yüksek dereceden faz geçişlerine sahip sistemleri de araştırır. Son zamanlarda geniş kullanım kuantum faz geçişi kavramını aldı, yani. faz geçişi, klasik termal dalgalanmalar tarafından değil, hatta var olan kuantum olanlar tarafından kontrol edilir. tamamen sıfır Nernst teoremi nedeniyle klasik faz geçişinin gerçekleştirilemediği sıcaklıklar.
Birinci dereceden faz geçişleriyle ilişkili olan, bizi ilgilendiren fenomenleri daha ayrıntılı olarak ele alalım.
BUHARLAMA, YOĞUŞMA, KAYNAMA.
Doymuş ve doymamış çiftler.
Belirli koşullar altında herhangi bir madde, çeşitli kümelenme durumlarında olabilir - katı, sıvı ve gaz. birinden geçişler toplama durumu ikinciye birinci dereceden faz geçişleridir.
buharlaşma ve yoğunlaşma bir maddenin sıvı ve gaz fazları arasındaki faz geçişleridir.
Herşey gerçek gazlar(oksijen, nitrojen, hidrojen vb.) belirli koşullar altında sıvı hale dönüşebilmektedir. Bununla birlikte, böyle bir dönüşüm yalnızca belirli bir sıcaklığın altındaki sıcaklıklarda meydana gelebilir. Kritik sıcaklık T cr. Örneğin, su için kritik sıcaklık 647.3 K, nitrojen için 126 K, oksijen için 154.3 K'dır. Oda sıcaklığında (≈ 300 K), su hem sıvı hem de gaz halinde olabilir, nitrojen ve oksijen ise sadece sıvı halde bulunur. gazların formu.
buharlaşma ile sıvıdan gaza faz geçişi olarak adlandırılır. Moleküler kinetik teori açısından buharlaşma, en hızlı moleküllerin bir sıvının yüzeyinden uçarak çıktığı bir süreçtir. kinetik enerji bu, sıvının geri kalanıyla bağlanma enerjisini aşar. Bu, kalan moleküllerin ortalama kinetik enerjisinde bir azalmaya, yani sıvının soğumasına (çevredeki cisimlerden enerji kaynağı yoksa) yol açar.
yoğunlaşma buharlaşmanın tersi bir süreçtir. Yoğunlaşma sırasında buhar molekülleri sıvıya geri döner.
Kapalı bir kapta, bir sıvı ve buharı bir durumda olabilir. dinamik denge sıvıdan çıkan moleküllerin sayısı buhardan sıvıya dönen moleküllerin sayısına eşit olduğunda, yani buharlaşma ve yoğuşma hızları aynı olduğunda. Böyle bir sistem denir iki fazlı . Sıvısı ile dengede olan buhara denir. zengin.
Bir sıvının birim yüzey alanından bir saniyede yayılan molekül sayısı, sıvının sıcaklığına bağlıdır. Buhardan sıvıya dönen moleküllerin sayısı, buhar moleküllerinin konsantrasyonuna ve ortalama sürat buharın sıcaklığı tarafından belirlenen termal hareketleri. Bundan, belirli bir madde için, bir sıvının ve onun buharının dengesindeki buhar moleküllerinin konsantrasyonu, denge sıcaklıkları tarafından belirlenir. Artan sıcaklıkla buharlaşma ve yoğuşma süreçleri arasında dinamik bir dengenin kurulması, daha yüksek buhar molekülü konsantrasyonlarında gerçekleşir. Bir gazın (buharın) basıncı, konsantrasyonu ve sıcaklığı ile belirlendiğinden, şu sonuca varabiliriz: baskı yapmak doymuş buhar p 0 belirli bir maddenin yalnızca sıcaklığına bağlıdır ve hacme bağlı değildir. Bu nedenle, düzlemdeki gerçek gazların izotermleri ( p, V) iki fazlı bir sisteme karşılık gelen yatay bölümler içerir (Şekil 3.4.1).
Sıcaklık yükseldikçe, doyma buhar basıncı ve yoğunluğu artarken, termal genleşme nedeniyle sıvının yoğunluğu azalır. Kritik sıcaklığa eşit bir sıcaklıkta T Belirli bir madde için kr, buhar ve sıvı yoğunlukları aynı olur. saat T > T cr sıvı ve onun arasındaki fiziksel farklılıkları ortadan kaldırır doymuş buhar.
izotermal olarak sıkıştırılmışsa doymuş buhar de T < T cr, daha sonra doymuş buhar basıncına eşit olana kadar basıncı artacaktır. Hacmin daha da azalmasıyla, kabın dibinde bir sıvı oluşur ve sıvı ile doymuş buharı arasında dinamik bir denge kurulur. Hacim azaldıkça, buharın artan bir kısmı yoğunlaşır ve basıncı değişmeden kalır (izotermdeki yatay bölüm). Tüm buhar bir sıvıya dönüştüğünde, sıvının düşük sıkıştırılabilirliği nedeniyle hacimde daha fazla azalma ile basınç keskin bir şekilde artar.
İki fazlı bölgeyi atlayarak gaz halinden sıvı hale geçmek mümkündür. Bunun için kritik noktayı atlayarak işlemi tamamlamanız gerekir. K. Bu türden olası süreçlerden biri, Şekil 1'de kesikli bir çizgi ile gösterilmiştir. ABC.
AT atmosferik hava su buharı her zaman bir miktar kısmi basınçta bulunur p genellikle doygunluk buhar basıncından daha az olan p 0 . Davranış p / p Yüzde olarak ifade edilen 0 denir bağıl nem hava.
| |
Doymamış buhar teorik olarak durum denklemi kullanılarak tanımlanabilir. Ideal gaz gerçek gazlar için olağan kısıtlamalar altında: buhar basıncı çok yüksek olmamalıdır (pratik olarak p≤ (10 6 –10 7) Pa) ve sıcaklığı her madde için tanımlanan bir değerden daha yüksek. İdeal bir gazın yasaları, her bir sıcaklık için T baskı yapmak p 0 doymuş buhar ile belirlenir denge eğrisip 0 (T) belirli bir madde için.
Baskı yapmak p 0 doymuş buhar, artan sıcaklıkla çok hızlı artar T. Bağımlılık p 0 (T) ideal gaz yasalarından elde edilemez. Sabit bir molekül konsantrasyonunda bir gazın basıncı, sıcaklıkla doğru orantılı olarak artar. Doymuş buharda, sıcaklık arttıkça sadece moleküler hareketin ortalama kinetik enerjisi değil, aynı zamanda konsantrasyonları da artar. Bu nedenle, artan sıcaklıkla doymuş buharın basıncı, sabit bir molekül konsantrasyonunda ideal bir gazın basıncından daha hızlı artar.
Buharlaşma sadece yüzeyden değil, aynı zamanda sıvının kütlesinde de meydana gelebilir. Sıvılar her zaman küçük gaz kabarcıkları içerir. Bir sıvının doygun buhar basıncı, dış basınca (yani, kabarcıklardaki gazın basıncına) eşit veya daha büyükse, sıvı kabarcıklara buharlaşacaktır. Buharla dolu kabarcıklar genişler ve yüzeye çıkar. Bu süreç denir kaynamak . Böylece, bir sıvının kaynaması, basıncının olduğu bir sıcaklıkta başlar. doymuş buharlar dış basınca eşit olur.
Özellikle normal atmosfer basıncında su 100°C'de kaynar. Bu, bu sıcaklıkta suyun doymuş buhar basıncının 1 atm olduğu anlamına gelir. Dağlara tırmanırken atmosfer basıncı düşer ve bu nedenle suyun kaynama noktası düşer (her 300 metre yükseklik için yaklaşık 1 °C). 7 km yükseklikte, basınç yaklaşık 0,4 atm'dir ve kaynama noktası 70 °C'ye düşer.
Hermetik olarak kapatılmış bir kapta sıvı kaynamaz, çünkü her sıcaklık değerinde sıvı ile doymuş buharı arasında bir denge kurulur. Denge eğrisi boyunca p 0 (T) çeşitli basınçlarda bir sıvının kaynama noktasını belirlemek mümkündür.
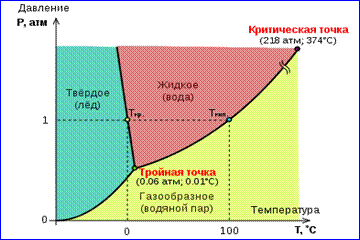
Şekil 1'de gösterilen gerçek gaz izotermlerinin resmi, buharlaşma ve yoğunlaşma işlemlerini, yani bir maddenin gaz ve sıvı fazları arasındaki faz geçişini açıklar. Aslında bu resim eksiktir, çünkü herhangi bir madde gaz ve sıvıdan sıvıya geçebilir. katı hal. Belirli bir sıcaklıkta T Aynı maddenin iki fazı arasındaki termodinamik denge ancak sistemdeki belirli bir basınçta mümkündür. Denge basıncının sıcaklığa bağımlılığı denir. faz denge eğrisi . Bir örnek denge eğrisidir p 0 (T) doymuş buhar ve sıvı. Belirli bir maddenin farklı fazları arasındaki denge eğrileri düzlemde çizilirse ( p, T), daha sonra bu düzlemi, maddenin homojen bir kümelenme durumunda - katı, sıvı veya gaz halinde bulunduğu ayrı alanlara bölerler (Şekil 2). Koordinat sisteminde gösterilir ( p, T) denge eğrileri denir faz diyagramı .
0 eğrisi T katı ve gaz fazları arasındaki dengeye karşılık gelen, denir süblimasyon eğrisi. eğri TK sıvı ve buhar arasındaki dengeye denir buharlaşma eğrisi, kritik noktada sonlanır K. eğri ÇB katı ile sıvı arasındaki dengeye denir erime eğrisi.
Denge eğrileri bir noktada birleşir T her üç fazın da dengede bir arada bulunabileceği. Bu nokta denir üçlü nokta.
Birçok madde için basınç püçlü noktada tr 1 atm ≈ 10 5 Pa'dan azdır. Bu tür maddeler atmosfer basıncında ısıtıldığında erir. Örneğin, üçlü nokta suyun (Şekil 3) koordinatları var T tr = 273.16 K, p tr \u003d 6.02 10 2 Pa ve Kelvin'in mutlak sıcaklık ölçeğini kalibre etmek için referans olarak kullanılır.
 Ancak böyle olanlar da var 3 fazlı su diyagramı
Ancak böyle olanlar da var 3 fazlı su diyagramı
olan maddeler p tr
1 atm'yi aşıyor. İçin böylece
karbondioksit (CO 2) basıncı
p tr = 5.11 atm ve sıcaklık
T tr = 216,5 K. Bu nedenle, atmosferde
basınç, katı karbondioksit olabilir
sadece düşük sıcaklıklarda bulunur ve sıvı hal de p= 1 atm hiç yok. Katı halde karbon dioksit, 173 K veya -80 °C sıcaklıkta atmosfer basıncında buharıyla dengededir. Bu, asla erimeyen, sadece buharlaşan (yücelten) yaygın olarak kullanılan bir "kuru buzdur".
Kaynattıktan sonra suyun sıcaklığı yükselmeyi durdurur ve tamamen buharlaşana kadar değişmeden kalır. Buharlaşma, kaynayan bir sıvı ile aynı sıcaklık indeksine sahip sıvı halden buhara geçiş sürecidir. Bu buharlaşmaya doymuş buhar denir. Tüm su buharlaştığında, sonraki herhangi bir ısı ilavesi sıcaklığı yükseltir. Doymuş seviyenin ötesinde ısıtılmış buhara aşırı ısıtılmış denir. Endüstride doymuş buhar genellikle ısıtma, pişirme, kurutma veya diğer uygulamalar için kullanılır. Superheated sadece türbinler için kullanılır. Farklı buhar türlerinin farklı değişim potansiyeli enerjileri vardır ve bu, tamamen farklı amaçlar için kullanımlarını haklı kılar.
Üç fiziksel durumdan biri olarak buhar
Maddenin genel moleküler ve atomik yapısını anlamak ve bu bilgiyi buza, suya ve buhara uygulamak, buharın özelliklerini daha iyi anlamanıza yardımcı olabilir. Molekül, herhangi bir elementin veya bileşiğin en küçük birimidir. Buna karşılık, hidrojen ve oksijen gibi temel elementleri tanımlayan atom adı verilen daha küçük parçacıklardan oluşur. Bu atomik elementlerin özel kombinasyonları, maddelerin bir kombinasyonunu sağlar. Bu bileşiklerden biri kimyasal formül Molekülleri 2 hidrojen atomu ve 1 oksijen atomundan oluşan H 2 O. Karbon da bol miktarda bulunur, tüm organik maddelerin önemli bir bileşenidir. Çoğu mineral üç fiziksel durumda bulunabilir ( sağlam, sıvı ve buhar) faz olarak adlandırılır.
Buhar üretim süreci
Su kaynama noktasına yaklaştıkça, bazı moleküller, dönmeden önce yüzeyin üzerindeki boşlukta sıvıdan anlık olarak ayrılmalarını sağlayan hızlara ulaşmak için yeterli kinetik enerji kazanır. Daha fazla ısıtma, daha fazla uyarıma neden olur ve sıvıyı terk etmeye istekli moleküllerin sayısı artar. Atmosfer basıncında doyma sıcaklığı 100 °C'dir. Bu basınçta kaynama noktasına sahip buhara kuru doymuş buhar denir. Buzdan suya faz geçişi gibi, buharlaşma süreci de tersine çevrilebilir (yoğunlaşma). Kritik nokta suyun sıvı halde olabileceği en yüksek sıcaklıktır. Bu noktanın üzerinde buhar bir gaz olarak kabul edilebilir. Gaz hali, moleküllerin neredeyse sınırsız hareket imkanına sahip olduğu dağınık duruma benzer.
Değişkenlerin ilişkisi
Belirli bir sıcaklıkta, sıvı su ile dengede bulunan belirli bir buhar basıncı vardır. Bu gösterge artarsa, buhar aşırı ısınır ve kuru olarak adlandırılır. Basınç ve sıcaklık arasında bir ilişki vardır: Bir değeri bilerek diğerini belirleyebilirsiniz. Buharın durumu üç değişken tarafından belirlenir: basınç, sıcaklık ve hacim. Kuru doymuş buhar, buhar ve suyun aynı anda bulunabileceği durumdur. Başka bir deyişle, bu, buharlaşma hızı yoğunlaşma hızına eşit olduğunda meydana gelir.
Doymuş buhar ve özellikleri
Doymuş buharın özelliklerini tartışırken, genellikle ideal bir gazla karşılaştırılır. Ortak bir noktaları var mı yoksa sadece bir yanlış anlama mı? İlk olarak, sabit bir sıcaklık seviyesinde yoğunluk hacme bağlı değildir. Görsel olarak, bu şu şekilde hayal edilebilir: sıcaklık göstergelerini değiştirmeden buhar tankının hacmini görsel olarak azaltmanız gerekir. Yoğunlaşan moleküllerin sayısı buharlaşanların sayısını aşacak ve buhar denge durumuna geri dönecektir. Sonuç olarak, yoğunluk sabit bir parametre olacaktır. İkincisi, basınç ve hacim gibi özellikler birbirinden bağımsızdır. Üçüncüsü, hacimsel özelliklerin değişmezliği göz önüne alındığında, sıcaklık arttığında moleküllerin yoğunluğu artar ve azaldığında azalır. Aslında, ısıtıldığında su daha hızlı buharlaşmaya başlar. Bu durumda denge bozulacak ve buhar yoğunluğu önceki konumlarına dönene kadar eski haline getirilmeyecektir. Tersine, yoğuşma sırasında doymuş buharın yoğunluğu azalacaktır. İdeal bir gazın aksine, doymuş buhar çağrılamaz. kapalı sistemçünkü sürekli su ile temas halindedir.

Isıtma alanındaki avantajlar
Doymuş buhar, sıvı su ile doğrudan temas halindeki saf buhardır. Onu mükemmel bir termal enerji kaynağı yapan birçok özelliğe sahiptir, özellikle yüksek sıcaklıklar(100 °C'nin üzerinde). Bazıları:

Çeşitli buhar türleri
Buhar, suyun gaz fazıdır. Oluşumu sırasında ısı kullanır ve daha sonra büyük miktarda ısı yayar. Bu nedenle, o
ısı motorları için bir çalışma maddesi olarak kullanılabilir. Aşağıdaki durumlar bilinmektedir: ıslak doymuş, kuru doymuş ve aşırı ısıtılmış. Isı eşanjörlerinde ısı transfer ortamı olarak aşırı ısıtılmış buhar yerine doymuş buhar tercih edilir. Borulardan atmosfere salındığında, bir kısmı yoğunlaşarak küçük su damlacıkları içeren beyaz, nemli buharlaşma bulutları oluşturur. kızgın buhar atmosferle doğrudan temas ettiğinde bile yoğuşmaya maruz kalmayacaktır. AT aşırı ısınma durumu moleküllerin hareketinin hızlanması ve daha düşük bir yoğunluğa bağlı olarak daha büyük bir ısı transferine sahip olacaktır. Nemin varlığı, kazanların veya diğer ısı değişim ekipmanlarının oturmasına, korozyona ve ömrünün kısalmasına neden olur. Bu nedenle daha fazla güç ürettiği ve aşındırıcı olmadığı için kuru buhar tercih edilir.

Kuru ve doymuş: çelişki nedir
Birçok insan "kuru" ve "zengin" terimleriyle karıştırılır. Bir şey nasıl aynı anda ikisi birden olabilir? Cevap, kullandığımız terminolojide yatmaktadır. "Kuru" terimi, nemin olmaması, yani "ıslak değil" ile ilişkilidir. "Doymuş", "ıslanmış", "ıslak", "su basmış", "çöp olmuş" vb. anlamına gelir. Bütün bunlar çelişkiyi doğrular gibi görünüyor. Ancak buhar mühendisliğinde "doymuş" teriminin farklı bir anlamı vardır ve bu bağlamda kaynamanın meydana geldiği bir durum anlamına gelir. Bu nedenle, kaynamanın meydana geldiği sıcaklık teknik olarak doyma sıcaklıkları olarak bilinir. Bu bağlamda kuru buhar nem içermez. Kaynayan bir su ısıtıcısını izlerseniz, su ısıtıcısının ağzından beyaz buhar çıktığını görebilirsiniz. Aslında, kuru renksiz buharın bir karışımıdır ve ıslak buhar Işığı yansıtan ve renkli su damlacıkları içeren Beyaz renk. Bu nedenle, "kuru doymuş buhar" terimi, buharın kurutulduğu ve aşırı ısıtılmadığı anlamına gelir. Sıvı parçacıklardan arınmış, genel gaz yasalarına uymayan gaz halindeki bir maddedir.
Sıvılar buharlaşma eğilimindedir. Masanın üzerine bir damla su, eter ve cıva damlatsaydık (bunu evde yapmayın!), Damlaların nasıl yavaş yavaş kaybolduğunu, buharlaştığını izleyebilirdik. Bazı sıvılar daha hızlı buharlaşır, diğerleri daha yavaş. Bir sıvının buharlaşma sürecine buharlaşma da denir. Buharı sıvıya dönüştürmenin tersi işlemi yoğuşmadır.
Bu iki süreç örnek faz geçişi- maddelerin bir kümelenme durumundan diğerine geçiş süreci:
- buharlaşma (sıvıdan gaz hali);
- yoğunlaşma (gaz halinden sıvı hale geçiş);
- desüblimasyon (sıvı fazı atlayarak gaz halinden katı hale geçiş);
- süblimasyon, aynı zamanda süblimleşmedir (sıvıyı atlayarak katıdan gaz haline geçiş).
Şimdi, bu arada, doğadaki süblimleşme sürecini gözlemlemek için doğru mevsim: ağaçlar ve nesneler üzerinde don ve don, bunun sonucu pencerelerde donmuş desenler.
Doymuş ve doymamış buhar nasıl oluşur?
Ama buharlaşmaya geri dönelim. Örneğin, açık bir kaba sıvı - su dökmeye ve denemeye devam edeceğiz ve ona bir basınç göstergesi bağlayacağız. Gözle görülmeyen buharlaşma kap içinde gerçekleşir. Tüm sıvı moleküller sürekli hareket halindedir. Bazıları o kadar hızlı hareket eder ki, kinetik enerjileri sıvının moleküllerini birbirine bağlayan enerjiden daha güçlüdür.
Sıvıyı terk ettikten sonra bu moleküller uzayda rastgele hareket etmeye devam eder, büyük çoğunluğu sıvı içinde dağılır - işte böyle doymamış buhar. Sadece küçük bir kısmı sıvıya geri döner.
Eğer kabı kapatırsak, buhar molekülleri giderek daha fazla hale gelecektir. Ve giderek daha fazlası sıvıya geri dönecek. Bu, buhar basıncını artıracaktır. Bu, tekneye bağlı bir manometre ile kaydedilecektir.
Bir süre sonra sıvıdan çıkan ve sıvıya dönen moleküllerin sayısı eşit olacaktır. Buhar basıncı değişmeyi durduracaktır. Sonuç olarak buhar doygunluğu sıvı-buhar sisteminin termodinamik dengesi kurulur. Yani buharlaşma ve yoğuşma eşit olacaktır.
Doymuş buhar özellikleri
Bunları açıkça göstermek için başka bir deney kullanıyoruz. Hayal etmek için hayal gücünüzün tüm gücünü kullanın. Öyleyse, iki dizden oluşan bir cıva manometresi alalım - iletişim tüpleri. Her ikisine de cıva dökülür, bir ucu açık, diğeri kapatılır ve cıvanın üzerinde biraz daha eter ve doymuş buharı bulunur. Lehimlenmemiş dizini indirir ve kaldırırsanız, lehimli olandaki cıva seviyesi de yükselir ve düşer.
Bu durumda doymuş eter buharının miktarı (hacmi) de değişecektir. Manometrenin her iki dizindeki cıva sütunlarının seviyeleri arasındaki fark, eterin doymuş buharının basıncını gösterir. Her zaman değişmeden kalacaktır.
Bu, doymuş buharın özelliğini ifade eder - basıncı kapladığı hacme bağlı değildir. Aynı sıcaklıkta çeşitli sıvıların (örneğin su ve eter) doymuş buhar basıncı farklıdır.
Ancak doymuş buharın sıcaklığı önemlidir. Sıcaklık ne kadar yüksek olursa, basınç o kadar yüksek olur. Doymuş buhar basıncı, artan sıcaklıkla doymamış buhara göre daha hızlı yükselir. Doymamış buharın sıcaklığı ve basıncı doğrusal bir ilişki ile ilişkilidir.
Bir ilginç deney daha yapılabilir. Sıvı buharı olmayan boş bir şişe alın, kapatın ve bir manometre bağlayın. Yavaş yavaş, damla damla sıvıyı şişeye besleyin. Sıvı içeri girip buharlaştıkça, belirli bir sıcaklıkta belirli bir sıvı için en yüksek olan doymuş buhar basıncı belirlenir.
Sıcaklık ve doymuş buhar hakkında daha fazla bilgi
Buharın sıcaklığı da yoğuşma oranını etkiler. Bir sıvının sıcaklığının buharlaşma oranını belirlemesi gibi - yani birim zamanda sıvının yüzeyinden kaçan molekül sayısı, yani.
Doymuş buhar sıvı ile aynı sıcaklığa sahiptir. Doymuş buharın sıcaklığı ne kadar yüksek olursa, basıncı ve yoğunluğu o kadar yüksek, sıvının yoğunluğu o kadar düşük olur. Madde için kritik sıcaklığa ulaşıldığında, sıvı ve buharın yoğunluğu aynıdır. Buharın sıcaklığı madde için kritik sıcaklığın üzerindeyse sıvı ve doymuş buhar arasındaki fiziksel farklar silinir.
Diğer gazlarla karışımlarda doygun buhar basıncının belirlenmesi
Sabit hakkında konuştuk Sabit sıcaklık doymuş buhar basıncı. Basıncı "ideal" koşullar altında belirledik: bir kap veya şişe, yalnızca bir maddenin sıvı ve buharını içerdiğinde. Bir maddenin moleküllerinin diğer gazlarla karışım halinde uzayda saçıldığı bir deneyi de düşünün.
Bunu yapmak için iki açık cam silindir alıyoruz ve bunları eterli her iki kapalı kaba yerleştiriyoruz. Her zamanki gibi, basınç göstergelerini bağlarız. Eter ile bir kap açıyoruz, bundan sonra manometre basınçtaki artışı kaydediyor. Bu basınç ile kapalı eter kabı olan silindirdeki basınç arasındaki fark, eterin doymuş buharının basıncını bulmanızı sağlar.
Basınç ve kaynama hakkında
Buharlaşma sadece sıvının yüzeyinden değil, hacminde de mümkündür - buna kaynama denir. Sıvının sıcaklığı arttıkça buhar kabarcıkları oluşur. Doymuş buhar basıncı, kabarcıklardaki gaz basıncına eşit veya daha büyük olduğunda, sıvı buharlaşarak kabarcıklara dönüşür. Ve genişler ve yüzeye çıkarlar.
Sıvılar kaynar farklı sıcaklıklar. Normal şartlar altında su 100 0 C'de kaynar. Ancak atmosfer basıncındaki bir değişiklikle kaynama noktası da değişir. Yani havanın çok seyrek olduğu ve atmosfer basıncının daha düşük olduğu dağlarda, dağlara tırmandıkça suyun kaynama noktası da düşer.
Bu arada, hermetik olarak kapatılmış bir kapta kaynama hiç mümkün değildir.
![]()
Buhar basıncı ve buharlaşma arasındaki ilişkinin bir başka örneği, havadaki su buharı içeriğinin böyle bir özelliği ile gösterilmiştir. bağıl nem hava. ilişkiyi temsil eder kısmi basıncı su buharı doymuş buhar basıncına eşittir ve aşağıdaki formülle belirlenir: φ \u003d p / p yaklaşık * 100%.
Hava sıcaklığı düştüğünde, içindeki su buharı konsantrasyonu artar, yani. daha yoğun hale gelirler. Bu sıcaklığa çiğ noktası denir.
Özetliyor
Basit örnekler kullanarak, buharlaştırma işleminin özünü ve sonuçta ortaya çıkan doymamış ve doymuş buharı analiz ettik. Çevrenizdeki tüm bu fenomenleri her gün gözlemleyebilirsiniz: örneğin, sokaklarda yağmurdan sonra kuruyan su birikintilerini veya banyoda buhardan buğulanmış bir ayna görebilirsiniz. Hatta banyoda önce buharlaşmanın nasıl gerçekleştiğini ve ardından aynada biriken nemin tekrar suya dönüştüğünü gözlemleyebilirsiniz.
Bu bilgiyi hayatınızı daha rahat hale getirmek için de kullanabilirsiniz. Örneğin, kışın birçok dairede hava çok kurudur ve bu durum refahı kötü etkiler. Daha nemli hale getirmek için modern bir nemlendirici kullanabilirsiniz. Veya eski usulde, odaya bir kap su koyun: yavaş yavaş buharlaşan su, buharlarıyla havayı doyurur.
www.site, materyalin tamamen veya kısmen kopyalanmasıyla, kaynağa bir bağlantı gereklidir.









