Hangi maddelerin sabit bir erime noktası vardır. Erime
MAKALE
"eriyen cisimler"
Gerçekleştirilen:
Prisyazhnyuk Olga 9-A
Kontrol:
Nevzorova Tatyana İgorevna
giriiş
1) Isı miktarının hesaplanması
2) Erime
3) Özgül füzyon ısısı
4) Metallerin eritilmesi
5) Suyun erime noktası ve kaynama noktası
6) erir
7) Erime hakkında ilginç
Bilginin diğer bağlamlarda kullanımı, ilgili koşullar
Maddenin ve özellikle suyun özellikleri birçok olayda rol oynar. Burada örneğin suyun meteorolojik döngüsünden ve canlı organizmaların buharlaşma-terlemesinden söz edilmelidir. Buzdağları saf sudan oluşur, bu yüzden içme suyu kaynakları olarak kabul edilirler. Ama aynı zamanda üretim temiz su Denizlerde tuzlu sudan arındırma, teorik ve teknik olarak bir zorluk teşkil etmeyen ve içme suyu az ama enerji kaynakları zengin ülkelerde sıklıkla uygulanan bir işlemdir. Tek sorun ekonomik canlılık.
Sonuç (sonuçlar)
giriiş
Toplam durum - belirli niteliksel özelliklerle karakterize edilen bir madde durumu: hacmi ve şekli koruma yeteneği veya yetersizliği, uzun menzilli ve kısa menzilli düzenin varlığı veya yokluğu ve diğerleri. Toplama durumundaki bir değişikliğe ani bir değişiklik eşlik edebilir. bedava enerji, entropi, yoğunluk ve diğer temel fiziksel özellikler.
İnternette erime ve buharlaşma yazan birçok sayfa bulacaksınız. Tabii ki, çok daha fazlası var. Ancak bazı sorular her zamanki gibi cevapsız kalıyor. Neden bazı maddeler çok düşük bir erime noktasına sahipken, diğerleri yüksek bir erime noktasına sahip?
- Erime ve buharlaşma sırasında hangi süreçler meydana gelir?
- Peki neden kumaşlar böyle farklı noktalar kaynamak?
Erime sırasında hangi işlemler gerçekleşir?
Neden bazı maddeler erimez veya kaynamaz, ancak daha erken ayrışır? . Kaynama ve buharlaşma terimleri bu sayfada aynı şekilde kullanılmaktadır. Daha fazla bilgi bu sayfada bulunabilir.
İlk adım: katı nasıl oluşturulur
Her katı küçük parçacıklardan oluşur. Parçacıklar arasında onları bir arada tutan kuvvetler vardır. Her zaman elektrostatiktirler. Parçacıkların doğası ve kuvvetlerin gücü çok fazladır. Tam koleksiyonu Ciltler sayfamda bulabilirsiniz. İşte kısa bir özet.Üç ana kümelenme durumu vardır: katı, sıvı ve gaz. Bazen plazmayı bir kümelenme durumu olarak sınıflandırmak tam olarak doğru değildir. Sıvı kristaller veya Bose-Einstein yoğuşması gibi başka kümelenme durumları da vardır.
Toplama durumundaki değişiklikler termodinamik süreçler faz geçişleri denir. Aşağıdaki çeşitler ayırt edilir: katıdan sıvıya - erime; sıvıdan gaza - buharlaşma ve kaynama; katıdan gaza - süblimleşme; gazdan sıvıya veya katıya - yoğuşma. Ayırt edici bir özellik, plazma durumuna geçişin keskin bir sınırının olmamasıdır.
İkinci adım: Bir katı, erime noktasının altında ısıtıldığında ne olur?
Bir madde ısıtılarak ısıtılırsa, en küçük parçacıklar bu enerjiyi emer. İç enerjilerinin arttığını söylüyorlar. İç enerji üç tip olabilir: titreşim enerjisi, dönme enerjisi ve elektron enerjisi. Elektron enerjisi erime ve kaynama için önemsizdir. Üzerine ulaşan elektronlar yüksek seviye enerji, orada sadece bir süre kal ve sonra orijinal seviyeye geri dön. Enerji açığa çıkar ve katıyı terk eder. Burada fosforesans ve floresans gibi olaylar meydana gelir.
Fizikteki çeşitli durumları tanımlamak için daha geniş bir termodinamik faz kavramı kullanılır. Bir fazdan diğerine geçişleri tanımlayan olaylara kritik olaylar denir.
Katı: Hacmi ve şekli koruma yeteneği ile karakterize edilen bir durum. Katı bir cismin atomları, denge durumu etrafında sadece küçük titreşimler yapar. Hem uzun menzilli hem de kısa menzilli düzen vardır.
Titreşime bakalım, olur mu? ve dönme kuvveti biraz daha yakındır. Küçük parçacıklar belirli bir şekilde hareket eder. Bu hareketler için bazı olasılıklar şimdi listelenmiştir. esneme. Bir bağla birbirine bağlanan 2 atom, bağlanma ekseni boyunca titreşir, böylece bağ periyodik olarak kısalır ve uzar. Sadece moleküller, tanecik içinde bir bağa sahip olduklarından, germe titreşimlerini gerçekleştirebilir. Eğilme titreşimi. 3 bağlı atom titreşir, böylece iki bağ arasındaki açı periyodik olarak küçülür ve büyür. En az 3 atomlu moleküller bükülme titreşimlerine neden olabilir. Daha büyük ve daha karmaşık moleküller, karmaşık karmaşık titreşimler gerçekleştirebilir. Basit bir örnek, amonyak molekülünün ters çevrilmesidir. Tüm parçacık kendi ağırlık merkezi etrafında dönebilir. Molekülün bir kısmı bir bağ etrafında dönebilir.
- Bir parçacığın merkezi konumu etrafındaki titreşimleri.
- Yani bir iyon veya molekül bir sarkaç gibi ileri geri salınım yapar.
- İlk adımdaki en küçük parçacıkların her biri bu tür titreşimleri gerçekleştirebilir.
Sıvı: Bir maddenin sıkıştırılabilirliğinin düşük olduğu, yani hacmini iyi koruduğu ancak şeklini koruyamadığı durumu. Sıvı, yerleştirildiği kabın şeklini kolaylıkla alır. Bir sıvının atomları veya molekülleri, denge durumuna yakın titreşir, diğer atomlar tarafından kilitlenir ve genellikle diğer serbest yerlere atlar. Sadece kısa menzilli düzen var.
Düşük sıcaklıklarda parçacıklar yalnızca yavaş, düşük genlikli salınımlar taşır ve yavaş döner. Katı ısıtılırsa, titreşimler ve dönmeler daha hızlı hale gelir ve titreşimlerin genliği artar. Bu nedenle, en küçük parçacıklar ısının ısısını emer ve onu hareket enerjisine dönüştürür.
Üçüncü adım: Eritme sırasında hangi işlemler gerçekleşir?
En küçük parçacıklar sınırsız miktarda ısı emebilir mi? Önceki iki paragrafta, bir katıdaki en küçük parçacıkların iki özelliğini gördük. Elektrostatik çekiciler aralarında çalışır. Belli bir bağlanma enerjisine yol açarlar. Sıcaklığa bağlı değildir. Diğer taraftan, kinetik enerji partiküllerde bulunur. Bu, sıcaklık arttıkça daha fazladır.
Gaz: İyi sıkıştırılabilirlik ile karakterize edilen, hem hacmi hem de şekli koruma yeteneğinden yoksun bir durum. Gaz, kendisine sağlanan tüm hacmi işgal etme eğilimindedir. Bir gazın atomları veya molekülleri nispeten serbest davranır, aralarındaki mesafeler boyutlarından çok daha fazladır.
Diğer durumlar: Derin soğutma üzerine, bazı maddeler (hepsi değil) süper iletken veya süper akışkan duruma geçer. Bu durumlar, elbette, ayrı termodinamik fazlar, ancak evrensel olmamaları nedeniyle, maddenin yeni toplu halleri olarak adlandırılmayı pek hak etmiyorlar. Belirli koşullar altında hem katı hem de sıvı ve hatta gazların özelliklerini sergileyen macunlar, jeller, süspansiyonlar, aerosoller vb. gibi homojen olmayan maddeler, genellikle dağılmış malzemeler olarak sınıflandırılır ve herhangi bir spesifik maddeye göre değil. toplu durumlar maddeler.
Katı bir cisim ısıtılırsa, en küçük parçacıklarının kinetik enerjisi artar. Bir noktada, bağ enerjisinden daha büyüktür. Parçacıklar arasındaki çekici kuvvetlerin artık termal dalgalanmaların neden olduğu kuvvetlere dayanacak kadar güçlü olmadığı düşünülebilir. Parçacıklar artık birbirinden bağımsız hareket eder ve bu tam olarak sıvının özelliğidir. Katı erir.
Sıvılar neden sıvıdır?
Bir sıvıda parçacıklar artık elektrostatik çekim kuvvetleri tarafından bir arada tutulmazlar. Kırmızı ok, siz yaptığınızda ne olduğunu gösterir. katı düşük basınçta ısıtılır. Bu işleme süblimasyon denir. Bunu anlamak kolaydır, çünkü argüman çizgisi basittir. Bağlanma enerjisi çok düşüktür, çekici kuvvetler parçacıkları bir arada tutamayacak kadar zayıftır, bu nedenle birbirlerinden ayrılırlar. Ancak, sadece okul kitapları hakkındaki bilgileri bilmiyorsanız, burada bir çelişki bulacak ve kendinize bir soru soracaksınız.
Erime
Pirinç. 1. Saf maddenin durumu (şema)
Pirinç. 2. Kristal bir cismin erime sıcaklığı
Pirinç. 3. Erime noktası alkali metaller
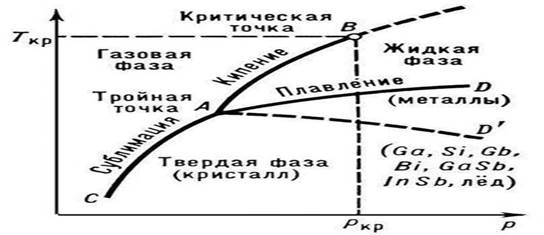
Erime - bir maddenin kristal (katı) halden sıvıya geçişi; ısının emilmesiyle oluşur (birinci dereceden faz geçişi). Saf maddelerin P.'sinin temel özellikleri, erime noktası (Tmelt) ve P. işleminin uygulanması için gerekli olan ısıdır (erime ısısı Qmelt).
Bir sıvıda, parçacıklar neredeyse her zaman birbirinden ayrılmamıştır, yine de neredeyse bir katıdaki kadar yakındırlar. Neden kendilerini gazdaymış gibi filme almıyorlar? Başka bir deyişle, katı madde neden erime sırasında hemen gaz haline geçmiyor?
Basınç önemli bir rol oynar
Bunu düşük basınçta yaparlar. Sadece yüksek basınçta sıvı hale gelirler. Katı parçacıkların doğrudan gaz haline girmesini engelleyen basınç mı? Sıvıların var olmasının nedeni basınç mı?
P.'nin sıcaklığı, p dış basıncına bağlıdır; saf bir maddenin durum diyagramında, bu bağımlılık erime eğrisi (şekil 1'de katı ve sıvı fazların bir arada bulunma eğrisi, AD veya AD ") ile gösterilir. Alaşımların ve katı çözeltilerin erimesi, bir kural, sıcaklık aralığında (sabit bir Tmelt ile ötektik hariç) Bir alaşımın P. başlangıcının ve bitişinin sıcaklığının, belirli bir basınçta bileşimine bağımlılığı, durum diyagramlarında özel çizgilerle gösterilir ( Liquidus ve solidus eğrileri, bkz. İkili sistemler) katı kristal halden izotropik sıvıya aşamalar halinde (belirli bir sıcaklık aralığında) oluşur, her aşama belirli bir yıkım aşamasını karakterize eder kristal yapı.
Şimdi baskının rolüne daha yakından bakalım. İçerideki parçacıklar komşularla çevrilidir. çevrelenmiş ve onlar tarafından cezbedilmiştir. Yüzeydeki parçacıkların birkaç komşusu vardır. Sağdaki resme bakın. Sıvının bir kısmını gösterir, ancak katılardaki oranlar temelde aynıdır.
Görüntüdeki parçacıklar küreseldir, ancak oranlar farklı şekillerdeki moleküller veya iyonlar için aynıdır. İlk önce, içindeki parçacığa bakın. Her yönden diğer parçacıklarla çevrilidir. Parçacık ve tüm komşuları arasında çekiciler vardır. Bunlar, ilk adımda ayrıntılı olarak açıklanan Coulomb kuvvetleridir. Doğal olarak hem sıvı hem de katı halde bulunurlar ve hala erimeden önceki kadar güçlüdürler. Şekilde siyah çizgilerle temsil edilmektedirler. Bir parçacık vurgulanmıştır, Coulomb kuvvetlerinden etkilenen 7 komşusu vardır.
Belirli bir sıcaklık P.'nin varlığı, doğru sıcaklığın önemli bir işaretidir. kristal yapı katı cisimler. Bu temelde, sabit bir Tm'ye sahip olmayan amorf katılardan ayırt etmek kolaydır. Amorf katılar, kademeli olarak sıvı hale geçer, artan sıcaklıkla yumuşar (bkz. Amorf hal). Saf metaller arasında en yüksek sıcaklığa (3410°C), cıva ise en düşük sıcaklığa (-38.9°C) sahiptir. Özellikle refrakter bileşikler şunları içerir: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), vb. Kural olarak, yüksek Tm, daha yüksek Qm değerleri ile karakterize edilir. İçinde bulunan safsızlıklar kristalli maddeler ah, Tm'lerini düşürün. Bu, pratikte düşük Tmelt'li alaşımlar (örneğin bakınız, Tmelt = 68 °C'ye sahip Wood alaşımı) ve soğutma karışımları elde etmek için kullanılır.
İçlerinden biri çoktan ondan uzaklaşmıştı. Daha fazla hareket ederse, ilk parçacığın ortamından tamamen ayrılacaktır. Ama yine de sıvı içindedir çünkü başka bir parçacığa yaklaşacak ve aralarında kısa bir süre için bir bağ oluşacaktır. Sıvı içindeki parçacıklar onları terk edemezler, çünkü bir komşu parçacıktan zar zor hareket ederler, bir diğeri tarafından çekilirler.
Sıvı yüzeyindeki partiküller durumunda ise durum farklıdır. Görüntü bu tür iki parçacığı göstermektedir. Sadece sıvının içinde komşuları var ve sadece onlar için Coulomb kuvvetleri. Dıştan, neredeyse hiç komşu yok. Hava veya başka bir gaz var. Bir sıvıya kıyasla çok düşük bir yoğunluğa sahiptir, bu nedenle birim hacim başına çok daha az parçacık içerir. Yüzeydeki parçacıklara daha yakından bakmanız gerektiğini göreceksiniz. Cevabın anahtarı var.
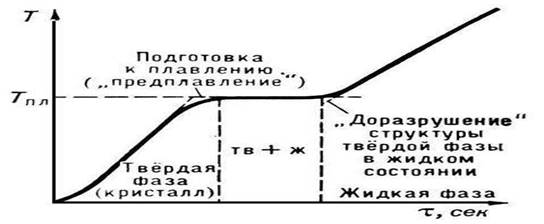
P., kristalli madde Tpl'ye ulaştığında başlar. P.'nin başlangıcından tamamlanmasına kadar, maddenin sıcaklığı, maddeye ısı transferine rağmen, sabit ve Tmelt'e eşit kalır (Şekil 2). Normal koşullar altında bir kristali T > Tmelt'e ısıtmak mümkün değildir (bkz. Aşırı Isınma), kristalizasyon sırasında eriyiğin önemli bir aşırı soğuması nispeten kolay bir şekilde elde edilir.
Daha fazla veya daha az enerjiye sahip parçacıklar
Bir sıvıdaki parçacıkların enerji dağılımı. Her zaman parçacıkların termal dalgalanmalar nedeniyle belirli bir enerjisi olduğunu söyledik ve bir sıvı damlasındaki tüm parçacıkların aynı enerjiye sahip olduğu düşünülebilir. Bazılarının enerjisi daha yüksek, bazılarının daha düşük bir enerjisi var. Parçacıkların çarpıştığı göz önüne alındığında bunu anlamak kolaydır. Çarpıştıkları hız ve yöne bağlı olarak, enerji bir parçacıktan diğerine aktarılır. Karşılaşmalar oldukça rastgele olduğundan, enerjileri yumruktan yumruklara yükselen kazananlar olduğu kadar kaybedenler de var.
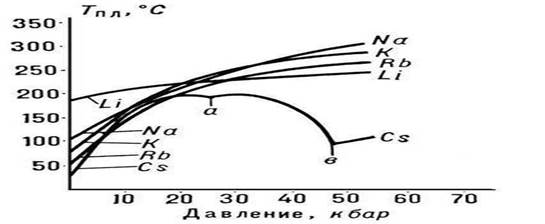
Tm'nin p basıncına bağımlılığının doğası, P'deki hacimsel değişikliklerin (DVm) yönü ile belirlenir (bkz. Clapeyron-Clausius denklemi). Çoğu durumda, bir maddenin P.'sine hacimlerinde bir artış eşlik eder (genellikle yüzde birkaç). Bu durumda, basınçtaki bir artış Tm'de bir artışa yol açar (Şekil 3). Bununla birlikte, bazı maddelerde (su, bir takım metaller ve metalitler, bkz. Şekil 1), P. sırasında hacimde bir azalma meydana gelir. Bu maddelerin P. sıcaklığı artan basınçla azalır.
Birinde parçacık enerjisi dağılımı. Her iki dağılım da biraz farklıdır. Parçacıklar buharlaşır. Alttaki kırmızı çizginin sağındaki alan. Bu nedenle, 20°C'de daha az parçacık buharlaşmak için gereken enerjiye sahiptir. hem 50 °C'de olabilir hem de bu sıcaklıkta buharlaşma daha kararlıdır. Kazananlara ne olacak? Enerjileri o kadar büyüktür ki komşularının Coulomb güçlerinin üstesinden gelebilirler. Sırf çok az komşu olduğu için, tüm komşuların çekiciliğini yenme şansları var.
Ve enerjileri çok büyük olduğu için, bu manzaraların üstesinden kısa bir süre için gelmekle kalmaz, aynı zamanda onları tekrar yakalarlar, ama sonsuza kadar. Bu birkaç yüksek enerjili parçacık, sıvı damlacıklar bırakır. Olabildiğince uzağa hareket ederler ve asla damlalarına geri dönmezler. Herkes yukarıda açıklanan fenomeni bilir.
P.'ye maddenin fiziksel özelliklerinde bir değişiklik eşlik eder: maddenin kristal yapısının bozukluğunu yansıtan entropide bir artış; ısı kapasitesinde artış elektrik direnci[istisna, bazı yarı metaller (Bi, Sb) ve yarı iletkenlerdir (Ge), sıvı hal daha yüksek elektrik iletkenliği ile. P. sırasında, kesme direnci neredeyse sıfıra düşer (enine elastik dalgalar eriyikte yayılamaz, bkz. Sıvı), sesin yayılma hızı (boyuna dalgalar), vb. azalır.
Bir damla suyun neden düştüğünü yeni öğrendiniz. Termal enerji yüzeydeki bazı parçacıklar damlacık bırakacak kadar büyüktür. Sadece buharlaşmadan bahsettiğimiz için, sıcaklığa bağlı olduğu için hızlı bir şekilde temizleyebilirsiniz. Erime noktasının hemen üzerinde, bir damla bırakmak için yeterli enerjiye sahip birkaç parçacık olacaktır. Sıcaklık ne kadar yüksek olursa, ortalama parçacık enerjisi o kadar yüksek olur ve giderek daha fazla parçacık, yüzeyden çıkmak için gereken enerjiye sahip olacaktır.
Kapalı sistemler daha fazla netlik sağlar
Sonuç olarak, damla daha hızlı buharlaşır. Aşağıdaki çizim bunu göstermektedir. Bir kez daha, günlük deneyimleri açıklayabildik. Açık sistem, madde ve enerji alışverişi için bir sistemdir. çevre. Örneğin, bir damla su sistemi aç. Karşı, kapalı sistemler ve kapalı sistemler. Desen maden suyu şişesi iyi örnek kapalı sistem. Yaklaşık üçte biri sıvı ile doludur. Gereksiz yere karmaşık bir tartışma yapmaktan kaçınmak için, maden suyu veya benzin gibi bir karışımla değil, su gibi temiz bir sıvı ile doldurulmalıdır.
Moleküler ve kinetik temsillere göre, P. aşağıdaki gibi gerçekleştirilir. Kristal bir gövdeye ısı uygulandığında, atomlarının titreşimlerinin enerjisi (salınım genliği) artar, bu da vücut sıcaklığında bir artışa yol açar ve kristalde (kristal kafesin doldurulmamış düğümleri) çeşitli kusurların oluşumuna katkıda bulunur. - boşluklar; düğümleri arasına gömülü atomlar tarafından kafesin periyodikliğinin ihlali vb., bkz. Kristallerdeki kusurlar). Moleküler kristallerde, moleküller küresel bir şekle sahip değilse, molekül eksenlerinin karşılıklı yöneliminde kısmi düzensizlik meydana gelebilir. Kusur sayısındaki kademeli bir artış ve bunların birlikteliği, ön eritme aşamasını karakterize eder. Tmelt'e ulaşıldığında, kristalde kritik bir kusur konsantrasyonu oluşur ve kristalleşme başlar; kristal kafes kolayca mobil mikroskobik bölgelere ayrılır. P. sırasında verilen ısı, vücudu ısıtmak için değil, atomlar arası bağları kırmak ve kristallerdeki uzun menzilli düzeni yok etmek için kullanılır (bkz. Uzun menzilli düzen ve kısa menzilli düzen). Öte yandan, mikroskobik bölgelerin kendisinde, atomların dizilişindeki kısa menzilli düzen, erime noktasında önemli ölçüde değişmez (çoğu durumda Tmelt'teki eriyiğin koordinasyon sayısı, kristalinkiyle aynı kalır). Bu, buharlaşma ısılarına kıyasla Qm füzyon ısılarının daha düşük değerlerini ve P sırasında maddelerin bir dizi fiziksel özelliğindeki nispeten küçük değişimi açıklar.
Piroliz işlemi doğada (yeryüzünde karın ve buzun pirolizi, derinliklerinde minerallerin mineralleşmesi vb.) ve teknolojide (metal ve alaşımların üretimi, kalıp dökümü vb.) .
Özgül füzyon ısısı
Özgül füzyon ısısı (ayrıca: füzyon entalpisi; eşdeğer bir özgül kristalleşme ısısı kavramı da vardır) - denge izobarik-izotermal bir süreçte kristal bir maddenin bir birim kütlesine verilmesi gereken ısı miktarı. katı (kristal) halden sıvıya aktarmak (bir maddenin kristalleşmesi sırasında açığa çıkan ısı miktarıyla aynı). Erime ısısı - özel durum sıcaklık faz geçişi kibarım. Özgül füzyon ısısını (J/kg) ve moları (J/mol) ayırt edin.
Özgül füzyon ısısı harfle gösterilir.
(Yunanca harf lambda) Özgül füzyon ısısını hesaplama formülü: , - özgül füzyon ısısı, - maddenin erime sırasında aldığı (veya kristalleşme sırasında açığa çıkardığı) ısı miktarı, - eriyen (kristalleşen) maddenin kütlesi .
Metallerin eritilmesi
Metalleri eritirken belirli kurallara uyulmalıdır. Kurşun ve çinkoyu eriteceklerini varsayalım. Kurşun, 327°'lik bir erime noktasına sahip olarak hızla erir; çinko ise erime noktası 419 ° 'nin üzerinde olduğu için uzun süre katı kalacaktır. Böyle bir aşırı ısınmaya yol açacak ne olacak? Yanardöner renkli bir film ile kaplanmaya başlayacak ve daha sonra yüzeyi erimeyen bir toz tabakasının altına gizlenecektir. Kurşun, aşırı ısınmadan yanmış, havadaki oksijenle birleşerek oksitlenmiştir. Bu işlem, bildiğiniz gibi, normal sıcaklıkta gerçekleşir, ancak ısıtıldığında çok daha hızlı ilerler. Böylece çinko erimeye başladığında çok az metalik kurşun kalmış olacaktır. Alaşım beklendiği gibi tamamen farklı bir bileşime sahip olacak ve atık şeklinde büyük miktarda kurşun kaybolacaktır. Açıktır ki, önce daha dirençli çinkoyu eritmeli, sonra içine kurşun koymalıyız. Aynı şey, çinko bakır veya pirinç ile alaşımlanırsa, önce çinkoyu ısıtırsa olur. Bakır eridiğinde çinko yanacaktır. Bu, her zaman önce daha yüksek bir erime noktasına sahip metali eritmeniz gerektiği anlamına gelir.
Ancak bu çılgınlıktan kaçınamaz. Uygun şekilde ısıtılmış bir alaşım uzun süre ateşte tutulursa, sıvı metalin yüzeyinde dumanların bir sonucu olarak tekrar bir film oluşur. Daha eriyebilir metalin tekrar okside dönüşeceği ve tapanın bileşiminin değişeceği açıktır; Bu, metalin gereksiz yere uzun süre aşırı ısınamayacağı anlamına gelir. Bu nedenle, metal israfını azaltmak için mümkün olan her şekilde, onu kompakt bir kütleye yerleştirerek denerler; küçük parçalar, talaş, talaşlar önce “paketlenir”, aşağı yukarı aynı boyuttaki parçalar eritilir, yeterli sıcaklıkta ısıtılır ve metal yüzey hava ile temastan korunur. Bu amaçla, usta bir boraks alabilir veya metalin yüzeyini her zaman üstte yüzecek bir kül tabakası ile kaplayabilir (daha küçük olması nedeniyle). spesifik yer çekimi) ve metal dökerken zarar vermez. Metal katılaştığında, muhtemelen genç ustaların da aşina olduğu başka bir fenomen meydana gelir. Katılaşan metalin hacmi azalır ve bu azalma iç, henüz katılaşmamış metal parçacıklar nedeniyle oluşur. Döküm yüzeyinde veya içinde, büzülme boşluğu olarak adlandırılan aşağı yukarı önemli bir huni şeklinde çöküntü oluşur. Genellikle kalıp, ürünün kendisini mümkün olduğunca korumaya çalışarak, daha sonra çıkarılan döküm yerlerinde büzülme delikleri oluşturacak şekilde yapılır. Büzülme deliklerinin dökümü bozduğu ve bazen kullanılamaz hale getirebildiği açıktır. Eritmeden sonra metal biraz aşırı ısıtılır, böylece daha ince ve daha sıcak olur ve bu nedenle kalıbın ayrıntılarını daha iyi doldurur ve daha soğuk bir kalıpla temastan erken donmaz.
Alaşımların erime noktası genellikle alaşımı oluşturan metallerin en refrakterinin erime noktasından daha düşük olduğundan, bazen bunun tersini yapmak faydalıdır: önce daha eriyebilir metali ve sonra daha refrakter olanı eritin. Bununla birlikte, buna yalnızca güçlü bir şekilde oksitlenmeyen metaller için veya bu metallerin aşırı oksidasyondan korunması şartıyla izin verilir. Sadece kalıbı değil, aynı zamanda ladin kanalını da doldurması için, şeyin kendisi için gerekenden daha fazla metal almak gerekir. Öncelikle gerekli metal miktarını hesaplamanız gerektiği açıktır.
Suyun erime ve kaynama noktası
Suyun canlı doğa için en şaşırtıcı ve mutluluk verici özelliği, "normal" koşullarda sıvı olabilme özelliğidir. Suya çok benzeyen bileşiklerin molekülleri (örneğin, H2S veya H2Se molekülleri) çok daha ağırdır, ancak aynı koşullar altında bir gaz oluşturur. Böylece su, bildiğiniz gibi, maddelerin ne zaman, nerede ve hangi özelliklerinin yakın olacağını tahmin eden periyodik tablonun yasalarıyla çelişiyor gibi görünüyor. Bizim durumumuzda, tablodan, özelliklerin hidrojen bileşikleri Aynı dikey sütunlarda bulunan elementler (hidritler olarak adlandırılır), artan atom kütlesi ile monoton olarak değişmelidir. Oksijen, bu tablonun altıncı grubunun bir elementidir. Aynı grupta kükürt S (atom ağırlığı 32), selenyum Se (atom ağırlığı 79), tellür Te (128 atom ağırlığı ile) ve pollonyum Po (209 atom ağırlığı ile) bulunur. Sonuç olarak, bu elementlerin hidritlerinin özellikleri, ağır elementlerden daha hafif elementlere geçerken monoton bir şekilde değişmelidir, yani. H2Po → H2Te → H2Se → H2S → H2O sırasında. Olan budur, ancak yalnızca ilk dört hidritle. Örneğin, elementlerin atom ağırlığı arttıkça kaynama ve erime noktaları yükselir. Şekilde, çarpılar bu hidritlerin kaynama noktalarını, daireler ise erime noktalarını göstermektedir.

Görüldüğü gibi atom ağırlığı azaldıkça sıcaklıklar oldukça lineer olarak azalmaktadır. Hidritlerin sıvı fazının varlık alanı giderek daha fazla "soğuk" hale gelir ve oksijen hidrit H2O, altıncı gruptaki komşularına benzer normal bir bileşik olsaydı, sıvı su şu aralıkta olurdu - 80 °C ila -95 °C. Daha yüksek sıcaklıklarda, H2O her zaman bir gaz olacaktır. Neyse ki biz ve dünyadaki tüm yaşam için su anormaldir, periyodik bir kalıp tanımaz, ancak kendi yasalarını takip eder.
Bu oldukça basit bir şekilde açıklanır - su moleküllerinin çoğu hidrojen bağlarıyla bağlanır. Suyu sıvı hidritler H2S, H2Se ve H2Te'den ayıran bu bağlardır. Olmasaydı, su zaten eksi 95 ° C'de kaynardı. Hidrojen bağlarının enerjisi oldukça yüksektir ve ancak çok daha yüksek seviyelerde kırılabilirler. Yüksek sıcaklık. Hatta gaz hali Büyük sayı H2O molekülleri, (H2O)2 dimerlerine birleşerek hidrojen bağlarını korur. Tamamen hidrojen bağları sadece 600 °C'lik bir su buharı sıcaklığında kaybolur.
Kaynamanın, kaynayan bir sıvının içinde buhar kabarcıklarının oluşması gerçeğinden oluştuğunu hatırlayın. Normal basınçta saf su 100 "C'de kaynar. Serbest yüzeyden ısı verilirse yüzey buharlaşma süreci hızlanır, ancak kaynamanın hacimsel buharlaşma özelliği oluşmaz. basınç, çünkü bu durumda dış basınca eşit basınçlı buhar daha düşük bir sıcaklıkta elde edilir.Üstte çok yüksek dağ basınç ve buna bağlı olarak kaynama noktası o kadar düşüktür ki su yemek pişirmek için uygun olmaz - gerekli su sıcaklığına ulaşılmaz. Yeterince yüksek bir basınçla su, kurşunu eritecek kadar ısıtılabilir (327°C) ve yine de kaynamaz.
Süper büyük erime kaynama noktalarına ek olarak (ve ikinci işlem böyle basit bir sıvı için çok fazla füzyon ısısı gerektirir), suyun varlığının aralığı anormaldir - bu sıcaklıkların farklı olduğu yüz derece - oldukça geniş bir aralık su gibi düşük moleküler ağırlıklı bir sıvı için. İzin verilen hipotermi değerlerinin sınırları ve suyun aşırı ısınması alışılmadık derecede büyüktür - dikkatli ısıtma veya soğutma ile su -40 ° C ila +200 ° C arasında sıvı kalır. Bu, suyun sıvı kalabileceği sıcaklık aralığını 240 °C'ye kadar uzatır.
Buz ısıtıldığında önce sıcaklığı yükselir, ancak su ve buz karışımı oluştuğu andan itibaren tüm buz eriyene kadar sıcaklık değişmeden kalacaktır. Bu, eriyen buza sağlanan ısının öncelikle yalnızca kristallerin yok edilmesi için harcanması gerçeğiyle açıklanır. Eriyen buzun sıcaklığı, tüm kristaller yok olana kadar değişmeden kalır (bkz. gizli füzyon ısısı).
erir
Erimeler, belirli sınırlar içindeki sıcaklıklarda maddelerin sıvı haldeki erimiş halidir. kritik nokta erime noktası ve erime noktasına daha yakın bulunur. Eriyiklerin doğası doğal olarak türe göre belirlenir. Kimyasal bağlar erimiş maddedeki elementler.
Eriyikler metalurji, cam yapımı ve diğer teknoloji alanlarında yaygın olarak kullanılmaktadır. Eriyikler genellikle karmaşık bir bileşime sahiptir ve çeşitli etkileşimli bileşenler içerir (faz diyagramına bakın).
Erimeler
1. Metalik (Metaller (adı Latin metalinden gelir - maden, maden) - yüksek termal ve elektriksel iletkenlik, pozitif sıcaklık direnci katsayısı, yüksek süneklik ve metalik parlaklık gibi karakteristik metalik özelliklere sahip bir grup element);
2. İyonik (İyon (eski Yunanca ἰόν - gidiyor) - bir atoma veya moleküle bir veya daha fazla elektronun kaybı veya eklenmesi sonucu oluşan tek atomlu veya çok atomlu elektrik yüklü bir parçacık. İyonizasyon (iyon oluşum süreci) darbe altında yüksek sıcaklıklarda meydana gelir Elektrik alanı);
3.Yarı iletken ile kovalent bağlar Atomlar arasında (Yarı iletkenler, özgül iletkenlikleri açısından, iletkenler ve dielektrikler arasında bir ara konum işgal eden ve iletkenlerden, katışkı konsantrasyonu, sıcaklık ve Çeşitli türler radyasyon. Bu malzemelerin ana özelliği, artan sıcaklıkla elektriksel iletkenlikte bir artıştır);
4. Van der Waals bağları ile organik eriyikler;
5. Yüksek polimer (Polimerler (Yunanca πολύ- - çok; μέρος - kısım) - "monomerik birimler" olarak adlandırılan çeşitli atom gruplarının tekrar tekrar tekrarlanmasıyla elde edilen, kimyasal veya koordinasyonla uzun makromoleküllere bağlanan inorganik ve organik, amorf ve kristal maddeler tahviller)
Türüne göre erir kimyasal bileşikler var:
1. Tuz;
2.Oksit;
3. Oksit-silikat (cüruf), vb.
Özel özelliklere sahip erir:
1. Ötektik
Erime hakkında ilginç
Buz taneleri ve yıldızlar.
bir parça girin saf buz sıcak bir odaya koyun ve erimesini izleyin. Monolitik ve homojen görünen buzun birçok küçük taneye - bireysel kristallere - ayrıldığı çabucak anlaşılacaktır. Buz hacminde rastgele bulunurlar. Daha az olmayan ilginç resim buzun yüzeyden eridiği zaman görülebilir.
Lambaya pürüzsüz bir buz parçası getirin ve erimeye başlayana kadar bekleyin. Erime iç tanelere dokunduğunda, orada çok ince desenler ortaya çıkmaya başlayacaktır. Güçlü bir büyüteçle altıgen kar taneleri şeklinde olduklarını görebilirsiniz. Aslında, bunlar suyla dolu erimiş çöküntülerdir. Işınlarının şekli ve yönü, buz tek kristallerinin yönüne karşılık gelir. Bu desenler, 1855'te onları keşfeden ve tanımlayan İngiliz fizikçiden sonra "Tyndall yıldızları" olarak adlandırılıyor. Kar tanelerine benzeyen "Tyndall yıldızları" aslında erimiş buzun yüzeyindeki, yaklaşık 1,5 mm büyüklüğünde, suyla dolu çöküntülerdir. Merkezlerinde, erimiş buz ve erimiş su hacimlerindeki farktan dolayı ortaya çıkan hava kabarcıkları görülür.
BİLİYOR MUSUN?
Wood'un alaşımı olarak adlandırılan ve ılık suda (+68 santigrat derece) bile kolayca eritilebilen bir metal var. Yani bir bardakta şekeri karıştırırken, bu alaşımdan yapılmış metal bir kaşık şekerden daha hızlı erir!
En refrakter madde olan tantal karbür TaCO-88, 3990°C sıcaklıkta erir.
1987'de Alman araştırmacılar, suyu sıvı halde tutarken suyu -700C'ye kadar aşırı soğutmayı başardılar.
Bazen kaldırımlardaki karları daha hızlı eritmek için tuz serpilir. Buzun erimesi, donma noktası hava sıcaklığından daha düşük olan suda bir tuz çözeltisinin oluşması nedeniyle oluşur. Çözüm kaldırımdan akıp gidiyor.
İlginç bir şekilde, tuzlu su çözeltisinin sıcaklığı saf kardan daha düşük olduğundan, ıslak kaldırımda ayaklar daha fazla soğur.
Bir çaydanlıktan iki bardağa çay dökerseniz: şekerli ve şekersiz, o zaman şekerli bir bardağa çay daha soğuk olacaktır, çünkü. şekerin çözünmesi (kristal kafesinin yok edilmesi) de enerji tüketir.
Şiddetli donlarda, buzun pürüzsüzlüğünü eski haline getirmek için pist sulanır sıcak su.. Sıcak su ince bir üst buz tabakasını eritir, çok hızlı donmaz, yayılmak için zamana sahiptir ve buz yüzeyi çok pürüzsüzdür.
Sonuç (sonuçlar)
Erime, bir maddenin maddeden geçişidir. katı hal sıvı içine.
Isıtıldığında, maddenin sıcaklığı artar ve vücudun iç enerjisi artarken parçacıkların termal hareket hızı artar.
Bir katının sıcaklığı erime noktasına ulaştığında, kristal kafes sağlam bozulmaya başlar. Böylece, katı gövdeye iletilen ısıtıcı enerjisinin ana kısmı, maddenin parçacıkları arasındaki bağları azaltmaya, yani kristal kafesin yok edilmesine harcanır. Bu durumda, parçacıklar arasındaki etkileşimin enerjisi artar.
Erimiş maddenin büyük bir kaynağı var içsel enerji katı halde olduğundan daha fazla. Füzyon ısısının geri kalan kısmı, erime sırasında vücudun hacmini değiştirmek için iş yapmak için harcanır.
Eritildiğinde, çoğunluğun hacmi kristal cisimler artar (%3-6) ve sertleşme sırasında azalır. Ancak, eridiğinde hacminin azaldığı ve katılaştığında arttığı maddeler vardır. Bunlara örneğin su ve dökme demir, silikon ve diğerleri dahildir. . Bu nedenle buz, suyun yüzeyinde yüzer ve katı dökme demir - kendi eriyiğinde.
Amorf denilen katıların (kehribar, reçine, cam) belirli bir erime noktası yoktur.
Bir maddeyi eritmek için gerekli olan ısı miktarı, maddenin öz ısısı ile maddenin kütlesinin çarpımına eşittir.
Özgül füzyon ısısı, erime hızında alınan 1 kg'lık bir maddenin katı halden sıvı hale tamamen dönüştürülmesi için ne kadar ısı gerektiğini gösterir.
Özgül füzyon ısısının SI cinsinden birimi 1J/kg'dır.
Erime işlemi sırasında kristalin sıcaklığı sabit kalır. Bu sıcaklığa erime noktası denir. Her maddenin kendi erime noktası vardır.
Belirli bir maddenin erime noktası, atmosfer basıncına bağlıdır.
kullanılmış literatür listesi
1) Elektronik ücretsiz ansiklopedi "Wikipedia" dan veriler
http://ru.wikipedia.org/wiki/Main_page
2) Site "Sınıf! Meraklılar için Fizik" http://class-fizika.narod.ru/8_11.htm
3) Site " Fiziksel özellikler su"
http://all-about-water.ru/boiling-temperature.php
4) Web sitesi "Metaller ve yapılar"
http://metaloconstruction.ru/osnovy-plavleniya-metallov/
Böyle bir şey yok sağlam vücut, ki bu sıcaklık artışına gerektiği kadar direnecektir. Er ya da geç katı bir parça sıvıya dönüşür; doğru, bazı durumlarda erime noktasına ulaşamayacağız - kimyasal ayrışma meydana gelebilir.
Sıcaklık arttıkça moleküller daha hızlı hareket eder. Son olarak, "güçlü" sallanan "moleküller arasında düzeni korumanın imkansız hale geldiği bir an gelir. Katı erir. Tungsten en yüksek erime noktasına sahiptir: 3380 ° C. Altın 1063 ° C'de, demir 1539 ° C'de erir. düşük eriyen metallerdir.Cıva, iyi bilindiği gibi, -39 ° C sıcaklıkta zaten erir Organik maddelerin yüksek erime noktaları yoktur Naftalin 80 ° C'de, toluen - -94,5 ° C'de erir.
Özellikle normal bir termometre ile ölçülen sıcaklık aralığında eriyen bir cismin erime noktasını ölçmek hiç de zor değildir. Eriyen bedeni gözlerinizle takip etmeniz hiç de gerekli değildir. Termometrenin cıva sütununa bakmak yeterlidir. Erime başlayana kadar vücut ısısı yükselir (Şekil 4.5). Erime başlar başlamaz sıcaklık artışı durur ve erime işlemi tamamlanana kadar sıcaklık değişmeden kalır.
Bir sıvının buhara dönüşmesi gibi, bir katının sıvıya dönüşmesi de ısı gerektirir. Bunun için gerekli olan ısıya denir. gizli ısı erime. Örneğin bir kilo buzu eritmek için 80 kcal gerekir.
Buz, yüksek füzyon ısısına sahip cisimlerden biridir. Örneğin buzu eritmek, aynı kurşun kütlesini eritmekten 10 kat daha fazla enerji gerektirir. Tabii ki Konuşuyoruz erimenin kendisi hakkında, burada kurşunun erimesi başlamadan önce + 327 ° C'ye ısıtılması gerektiğini söylemiyoruz. Eriyen buzun yüksek ısısı nedeniyle, karların erimesi yavaşlar. Erime ısısının 10 kat daha az olacağını hayal edin. O zaman bahar selleri her yıl akla hayale gelmeyecek felaketler getirirdi.
Bu nedenle, buzun füzyon ısısı büyüktür, ancak aynı zamanda buzla karşılaştırıldığında küçüktür. özısı 540 kcal / kg'da buharlaşma (yedi kat daha az). Ancak bu fark oldukça doğaldır. Bir sıvıyı buhara dönüştürürken molekülleri birbirinden ayırmamız gerekir ve erirken sadece moleküllerin dizilişindeki düzeni bozarak hemen hemen aynı mesafelerde bırakmamız gerekir. İkinci durumda daha az çalışmanın gerekli olduğu açıktır.
Belirli bir erime noktasının varlığı, kristalli maddelerin önemli bir özelliğidir. Bu temelde, amorf veya cam olarak adlandırılan diğer katılardan ayırt edilmeleri kolaydır. Camlar hem inorganik hem de organik maddeler arasında bulunur. Pencere camları genellikle sodyum ve kalsiyum silikatlardan yapılır; genellikle organik cam masaya yerleştirilir (ayrıca pleksiglas olarak da adlandırılır).
Amorf maddelerin kristallerin aksine belirli bir erime noktası yoktur. Cam erimez, yumuşar. Isıtıldığında, bir cam parçası önce sertten yumuşar, kolayca bükülebilir veya gerilebilir; daha yüksek bir sıcaklıkta, parça kendi yerçekiminin etkisi altında şeklini değiştirmeye başlar. Isındıkça, kalın viskoz cam kütlesi içinde bulunduğu kabın şeklini alır. Bu kütle önce bal gibi kalın, sonra ekşi krema gibi ve sonunda neredeyse su kadar düşük viskoziteli bir sıvı haline geliyor. Bütün arzumuzla, burada katının sıvıya geçişi için belirli bir sıcaklık belirtemeyiz. Bunun nedenleri, camın yapısı ile kristal cisimlerin yapısı arasındaki temel farkta yatmaktadır. Yukarıda belirtildiği gibi, atomlar amorf cisimler rastgele düzenlenmiştir. Camlar yapı olarak sıvılara benzerler.Katı camda bile moleküller rastgele düzenlenir. Bu, camın sıcaklığındaki bir artışın yalnızca moleküllerinin titreşim aralığını artırdığı ve onlara giderek daha fazla hareket özgürlüğü verdiği anlamına gelir. Bu nedenle, cam yavaş yavaş yumuşar ve moleküllerin düzenlenmesinden rastgele bir düzenlemeye geçişin özelliği olan keskin bir "katı" - "sıvı" geçiş göstermez.
Kaynama eğrisine gelince, sıvı ve buharın kararsız bir durumda da olsa yabancı bölgelerde yaşayabileceğini söyledik - buhar aşırı soğutulabilir ve kaynama eğrisinin soluna aktarılabilir, sıvı aşırı ısıtılabilir ve sağa çekilebilir. bu eğrinin.
Bir sıvı ile bir kristal durumunda benzer fenomenler mümkün mü? Buradaki analojinin eksik olduğu ortaya çıktı.
Kristali ısıtırsanız, erime noktasında erimeye başlayacaktır. Kristal aşırı ısınamaz. Tersine, sıvıyı soğutarak, belirli önlemler alınırsa, erime noktasını nispeten kolayca "kaydırmak" mümkündür. Bazı sıvılarda büyük aşırı soğutmalar elde edilebilir. Aşırı soğutması kolay, ancak kristalleştirilmesi zor sıvılar bile var. Böyle bir sıvı soğudukça daha viskoz hale gelir ve sonunda kristalleşmeden katılaşır. Böyle cam.
Ayrıca suyu yeniden soğutabilirsiniz. Sis damlacıkları şiddetli donlarda bile donmayabilir. Bir maddenin kristali, bir tohum aşırı soğutulmuş bir sıvıya atılırsa, kristalleşme hemen başlayacaktır.
Son olarak, birçok durumda gecikmeli kristalizasyon, çalkalama veya diğer işlemlerle başlatılabilir. rastgele olaylar. Örneğin, kristalli gliserolün ilk olarak taşıma sırasında elde edildiği bilinmektedir. demiryolu. Uzun süre bekledikten sonra camlar kristalleşmeye başlayabilir (teknolojide dedikleri gibi, devitrifiye veya "çökme").






