p v koordinatlarında termodinamik süreçler. Buhar kompresörü soğutma çevrimi. Adyabatik gaz süreci
Bu denklemlerin her biri iki faktör içerir. Biri, enerjinin kalitesini veya yoğunluğunu karakterize eder ( ω2- hızın karesi, H- ağırlık kaldırmak, T- sıcaklık, p−basınç) ve ikincisi vücudun belirli bir enerjiye göre miktarını veya kapasitesini ifade eder ( m – vücut kütlesi, V − belirli hacim, S – entropi). Birinci faktör yoğun bir faktör, ikincisi ise kapsamlı bir faktördür. Yani entropi, bir termodinamik sistemin termal gerilime göre kapasitesidir.
Clausius, termodinamiğin birinci ve ikinci yasalarını formüle etti.
Evrenin enerjisi sabittir.
Evrenin entropisi maksimum olma eğilimindedir.
Dolayısıyla bu, sıcaklık eşitlendiğinde evrenin ısı ölümüne yol açmalıdır. Ancak bu, entropi artış yasasının elde edildiği gerçeğiyle çelişir. yalıtılmış sistem.
TS - diyagram.
Bu diyagramda, sıcaklık ordinat ekseni boyunca çizilir ve entropi apsis ekseni boyunca çizilir.
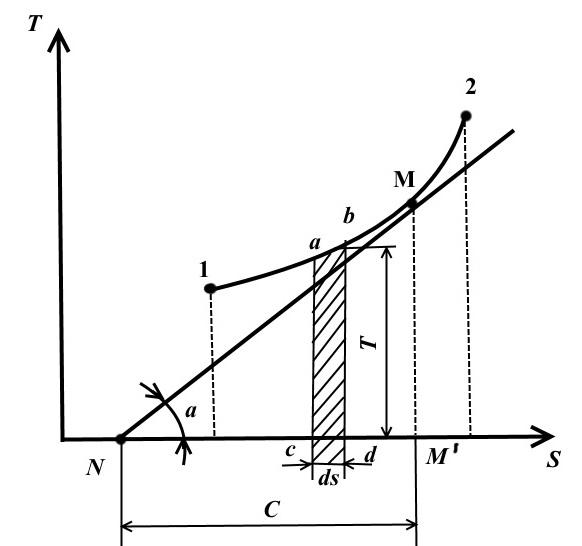
TS - diyagramındaki denge durumu, sıcaklık ve entropi değerlerine karşılık gelen koordinatlara sahip noktalarla temsil edilir.
Çalışma sıvısının durumunu ilk durum 1'den son durum 2'ye değiştirmenin tersine çevrilebilir termodinamik süreci, aşağıda gösterilmiştir. TS − Bu noktalar arasında geçen sürekli bir eğrinin diyagramı.
Meydan abdc eşittir TdS = dq , şunlar. Tersinir bir süreçte sistem tarafından alınan veya verilen temel ısı miktarını ifade eder.
1-2 eğrisinin altındaki alan
Yani, eğrinin altında kalan alan TS − diyagram, sisteme verilen veya sistemden alınan ısıyı temsil eder.
Bu yüzden TS − diyagrama termal denir.
İsteğe bağlı bir noktada çizin M eğride 1-2 bu eğriye teğet
Değer, işlemin gerçek ısı kapasitesini temsil eder.
![]()
Gaz prosesleriTS - diyagram.
izotermal süreç.
İzotermal bir süreçte T= const. Bu yüzden TS- diyagramda x eksenine paralel düz bir çizgi ile gösterilmiştir.
olduğu gerçeğini göz önünde bulundurarak dT=0 , bir izotermal süreçte ideal bir gazın entropisindeki değişimin bağımlılıkları şu şekilde olacaktır:
(sağ taraftaki terim bırakır)
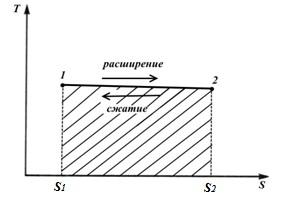
İşlem 1-2, entropinin arttığı ve bu nedenle gaza ısı verildiği ve gazın bu ısıya eşdeğer bir genleşme işi yaptığı bir işlemdir.
İşlem 2-1, sıkıştırma işine eşdeğer ısının gazdan çıkarıldığı ve entropinin azaltıldığı bir sıkıştırma işlemidir.
şekil alanı S 1 12 S 2 ısı miktarına karşılık gelir q tedarik edilen gaza ve aynı zamanda çalışma ben (izotermal süreç)
Adyabatik süreç
Adyabatik bir süreçte q=0 ve dq=0, ve sonuç olarak dS=0.
Bu nedenle, adyabatik bir süreçte S= const ve TS− diyagramda, adyabatik süreç eksene paralel düz bir çizgi ile temsil edilir T.
Çünkü adyabatik bir süreçte S= const, daha sonra adyabatik tersinir süreçlere izentropik de denir.
Adyabatik sıkıştırma sırasında, çalışma sıvısının sıcaklığı artar ve genleşme sırasında azalır. Bu nedenle süreç 1-2 bir daralma sürecidir ve süreç 2-1 bir genişleme sürecidir.
denklemden
![]() (3)
(3)
saat k= const alırız
![]()
Tersinir bir adyabatik süreç için S 1 = S 2 = const, ardından (*)
− koordinatlarda adyabatik denklem p ve V.
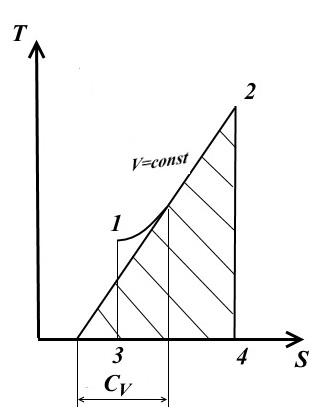
izokorik süreç
izokorik süreç için V= const, dV=0.
Sabit bir ısı kapasitesinde (Denklem (1)'den)
- görünümü TS - diyagram
Herhangi bir noktada proses eğrisine alt teğet, gerçek ısı kapasitesinin değerini belirler. C V .
Alt tanjant, yalnızca eğri aşağı doğru dışbükey ise pozitif olacaktır.
1-2 işlem eğrisinin altındaki alan TS - diyagram, sağlanan (veya 2-1 işleminde çıkarılan) ısı miktarının bir ölçeğini verir. q, değişime eşit içsel enerji sen 2 - sen 1 .
izobarik süreç
Bir izobarik süreçte basınç sabittir. p= const
Bu durumda
![]() (2)'den
(2)'den
Bu nedenle, p= const olduğu gibi V= const izobar logaritmik bir eğridir, iz sağa doğru yükselir ve aşağı doğru dışbükeydir.
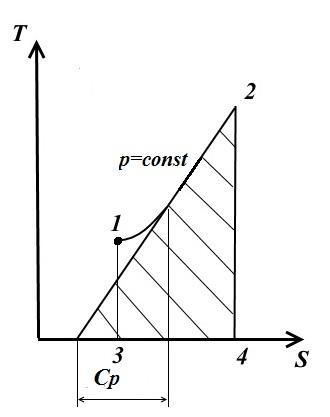
Herhangi bir noktada 1-2 eğrisine teğet, gerçek ısı kapasitesinin değerlerini verir. C p .
Eğrinin altında kalan alan ısı miktarını verir. q, gaza bildirilir p= const, entalpi değişimine eşit i 2 - i 1 .
politropik süreç
Politropik bir süreçte Bu süreçte ısı kapasitesi
![]()
Bu nedenle, gazın durumundaki son değişiklik için
![]()
politropik süreç TS - diyagram, konumu göstergeye bağlı olan bir eğri ile gösterilir n.
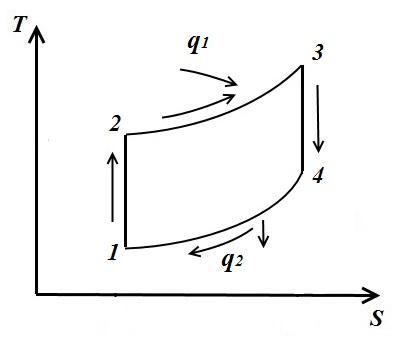
dairesel süreç. Karnot döngüsü.
içinde tasvir edelim TS - keyfi bir tersine çevrilebilir döngünün diyagramı 1 a2 b1 .

Süreç içerisinde 1 a2 çalışan vücut ısı miktarını alır q 1 , eğrinin altındaki alana sayısal olarak eşit 1 a2, ve süreçte 2- b-1 ısı miktarını verir q 2 , eğrinin altındaki alana sayısal olarak eşit 2- b-1.
Sıcaklığın bir parçası
döngüye girer ben (∆ sen=0 döngüde).
Çevrimin işi, çevrim saat yönünde geçiyorsa pozitif, saat yönünün tersine ise negatiftir (döngünün yönü pVveTS- diyagramlar aynıdır).
Isıl verim döngüsel süreç
Herhangi bir çevrimde entropi değişimi sıfırdır.
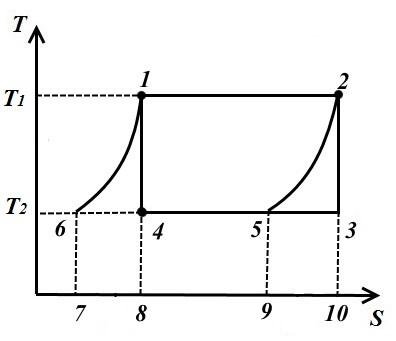
Carnot çevrimi iki izoterm ve iki adiyabattan oluşur. AT TS- diyagramda dikdörtgen olarak gösterilecektir (yatay çizgiler izotermdir, dikey çizgiler adiyabattır)
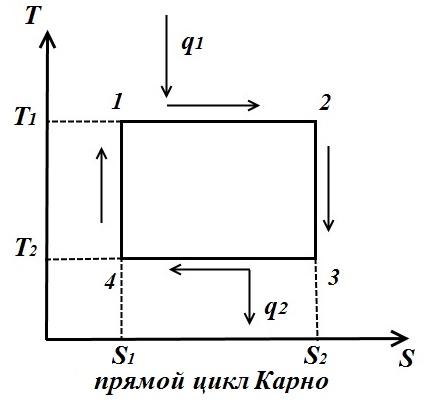
Çalışma sıvısına verilen ısı miktarı, 12 dikdörtgenin alanına sayısal olarak eşittir. S 2 S 1 :
Buzdolabına aktarılan ısı miktarı, dikdörtgenin alanına karşılık gelir 34 S 1 S 2 :
Çevrimin çalışmasına eşit ısı, çevrim alanına eşit
Isıl verim Çevrim
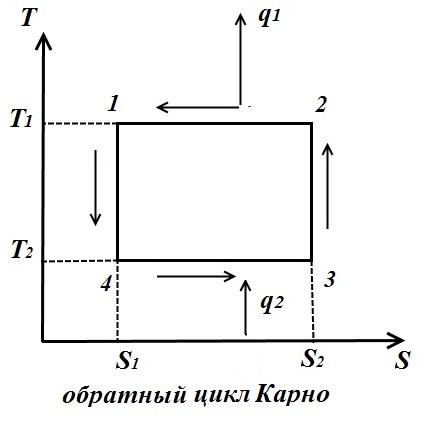
Ters çevrim için (şekil sağ)
Ters çevrim performans katsayısı
![]()
Ortalama integral sıcaklık
Keyfi bir tersine çevrilebilir çevrimde, ısı verilir ve değişken sıcaklıklarda çıkarılır. Termodinamik çalışmaları basitleştirmek için ortalama integral sıcaklık kavramı tanıtıldı.
keyfi bir politropik süreç düşünün TS- çalışma sıvısına ısının sağlandığı bir diyagram q(işlem 1-2).
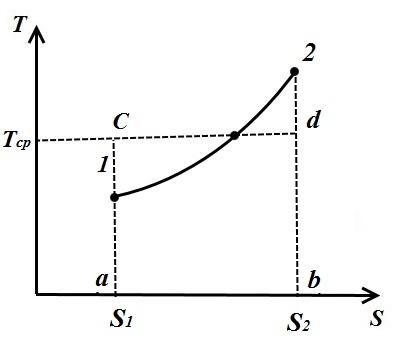
İşlem 1-2'deki çalışma sıvısının ortalama integral sıcaklığı altında, dikdörtgenin yüksekliğine eşit olan sıcaklık anlaşılmaktadır. abdc eşit alan a12 b süreç eğrisi 1-2 altında, yani.
![]()
Çünkü
ve segment
Böylece, herhangi bir işlem için ortalama tam gaz sıcaklığı, gaza verilen veya ondan alınan miktar, ısının entropideki değişime oranına eşittir.
Herhangi bir politropik işlem için
![]()
ve ortalama integral sıcaklık ((*)'den)

Bu, herhangi bir politropik işlemdeki ortalama integral sıcaklığın yalnızca başlangıç değerine bağlı olduğunu gösterir. T 1 ve son T 2 sıcaklıklar ve işlemin doğasına bağlı değildir.
Gazın sıkıştırılması ve genleşmesinin adyabatik olduğu rastgele bir çevrimde (bölüm 1-2, 3-4), bölüm 2-3'e sağlanan ısı miktarı
ve bölüm 4-1'de geri çekildi
Daha sonra termal verim Çevrim
![]() ,
,
yani termal verimlilik keyfi döngü, termal verimliliğe eşittir. İşlemlerin ortalama integral sıcaklıkları arasında gerçekleştirilen Carnot çevrimi, özetleme T 1 cp ve alarak T 2 cp sıcaklık.
Genelleştirilmiş Carnot döngüsü
Carnot çevrimi en yüksek termal verime sahiptir. bununla birlikte, belirli ek koşullar altında, verimliliğe eşit bir termal verime sahip olabilen başka çevrimler de mümkündür. Carnot döngüsü.
Şekil 1'de böyle bir döngünün bir örneğini düşünün. iki adiabat 2-3, 4-1 ve iki izoterm 1-2, 3-4'ten oluşan Carnot çevrimi 1-2-3-4'ü gösterir.
1 ve 2 noktalarından izotermle kesişene kadar 1-6 ve 2-5 arasında iki eşit uzaklıkta eğri çizin T 2 = const ve iki izoterm ve 6-1 (politroplar) ve 2-5 iki eşit mesafeli eğriden oluşan 1-2-5-6 ters çevrimini düşünün.
İşlemde 1-2 sıcaklıkta çalışma sıvısına T 1 = const sağlanan ısı miktarı
2-5 sürecinde, çalışma sıvısından şekil 9-5-2-10'un alanına eşit miktarda ısı çıkarılır.
Süreçte, çalışma sıvısından 5-6 T 2 = const uzaklaştırılan ısı miktarı
6-1 prosesinde, çalışma sıvısına verilen ısı miktarı q 6-1 , 7-6-1-8 alanına eşittir.
1-6, 2-5 eğrileri eşit uzaklıkta olduğundan, metrekare 7618 = çoğul. 952-10 bu nedenle, ısı miktarı da aynıdır.
Bu, ara ısı alıcıların ve ısı aktarıcılarının sadece 2-5 prosesinde çalışma sıvısından ısı alan ve proses 6-1'de çalışma sıvısına aynı miktarda veren ısı rejeneratörleri olduğunu göstermektedir. Böylece 1-2-5-6 geçerli dış kaynaklar, sıcaklığa sahip bir ısı transfer cihazıdır. T 1 ve sıcaklığa sahip bir soğutucu T 2 .
Bir çevrimde işe dönüştürülen ısı
Isıl verim formül tarafından belirlenir
Yani ısıl verim dikkate alınan döngü verimliliğe eşittir. Carnot döngüsü.
Döngünün bir veya daha fazla işleminde, bir veya daha fazla işlemde besleme için çalışma sıvısından ısının uzaklaştırıldığı termodinamik çevrime denir. rejeneratif döngü.
Carnot çevriminden farklı olarak, rejeneratif çevrim bir ara ısı depolama kaynağı gerektirir.
Termodinamik sıcaklık ölçeği
Çeşitli termodinamik gövdeler kullanıldığında, bu maddelerin termal genleşmesinin özellikleri nedeniyle ölçek eşit değildir.
Termodinamiğin ikinci yasası, termometrik bir cismin özelliklerine bağlı olmayan bir sıcaklık ölçeği oluşturmanıza izin verir (Kelvin tarafından önerilmiştir)
Carnot çevriminde, termal verim çalışma sıvısının özelliklerine bağlı değildir, ancak sıcak ve soğuk kaynağın sıcaklıklarının bir fonksiyonudur.
Isıl verim
Böylece, çalışma sıvısının sıcaklıklarının oranı, ısı oranı ile belirlenebilir. Carnot çevrimleri (Şekil) eşit uzaklıkta izotermler kullanılarak oluşturulursa, bu çevrimlerde aynı miktarda ısı işe dönüştürülür.

Sıcaklık izotermleri olsun T 0 ve T k eriyen buz (0 °C) ve kaynayan su (100 °C) sıcaklıklarına karşılık gelir.
Carnot döngüsünde 1234 ısı işe dönüştürülür qşeklin alanına eşit 1234 . Bu alan, eşit uzaklıkta izotermlerden oluşan bir ızgara ile 100 eşit parçaya bölünürse, elde edilen Carnot çevrimlerinin her birinde, ısı miktarı işe dönüştürülür. 0,01 q. İzotermler arasındaki sıcaklık aralığı 1 °C olacaktır.
Benzer şekilde, sıcaklık ile izotermin altında kalan bir ölçek oluşturulabilir. T 0 (0 °C).
Termodinamik ölçeğin alt noktası, termal verimliliğin elde edildiği sıcaklık olarak alınır. Karnot döngüsü =1. Göre
de T 2 =0 . Daha düşük bir sıcaklık olamaz çünkü bu durumda termodinamiğin ikinci yasasıyla çelişir.
Sonuç olarak T=0 (-273.15 ) mümkün olan en düşük sıcaklıktır ve sıcaklık ölçeğinde ilk sabit doğal nokta olarak alınabilir. Bu nedenle mutlak sıcaklık negatif değerlere sahip olamaz.
İdeal bir gaz için termodinamik sıcaklık ölçeği elde edildi.
Termodinamikte çok çeşitli süreçler incelenir. Bununla birlikte, tersine çevrilebilir olarak kabul edilen dört ana süreci ayırt ederler:
izokorik, akan sabit hacim;
izobarik, akan sabit basınç;
izotermal, akan Sabit sıcaklık(işlemin adı, Yunanca "isos" - eşit ve "terme" - sıcaklık kelimelerinin birleşiminden gelir);
adyabatik, ısı temini ve çıkarılması olmadan akan (Yunanca "adiabatos" - geçilmez).
Termodinamikte listelenen dört temel sürece ek olarak, sözde politropik süreçler (Yunanca "poli" - çok, "tropos" - bir yol). Bu işlemlerde, çalışma akışkanının tüm parametreleri aynı anda değişebilmekte ve ayrıca ısı sağlanmakta veya uzaklaştırılmaktadır. Aşağıda açıklanacağı gibi, dört temel süreç politropik sürecin özel durumlarıdır.
Termodinamik süreçlerin incelenmesi için metodoloji
Her şeyden önce, herhangi bir gaz işleminin gerçekleştiği unutulmamalıdır.
c = const denir politropik genel denklem ile pvn= yapı
n politropik indeks denir.
Termodinamik süreçleri incelemek için teknik aşağıdaki gibidir:
1. Bu işlem için denklemi kurun ve üretin grafik görüntü içinde pv ve Ts koordinat sistemleri (ikincisi aşağıda tartışılmaktadır).
2. Arasındaki oranı ayarlayın p,v ve T.
3. Tüm süreçler için ortak olan hesaplama formülüne göre iç enerjideki değişimi belirleriz ( du= c v dT).
4. Tarafından genel denklem iş, belirli bir termodinamik işlemin işini belirler.
5. Bu işlemin ısısı formülle belirlenir. q = .
izokorik süreç
1. Politropik denklem pv n= const p olarak yazılabilir v= const, bir izokorik süreç için olduğunu gösterir n değeri alır.
2. Durum denklemlerinden p 1 v = RT 1 ve p 2 v = RT 2 alıyoruz.
Uygulamada, bu süreç şu şekilde gerçekleşir: bileşen içten yanmalı motorlarda (karbüratörlü motorlarda patlama oluşumu (yakıt yanması) ve bir silindirde gazın soğutulması veya ısıtılması sırasında meydana gelen işlemler (Şekil 9, a).
5.q = senşunlar. verilen tüm ısı iç enerjiyi artırmaya gider. Katsayı, iç enerjiyi değiştirmek için kullanılan ısının payını gösterir; 1 –zısı girdisinin ne kadarının iş yapmak için kullanıldığını gösterir. izokora T-s koordinatlar (Şekil 9, b) logaritmik bir eğri ile gösterilir (bkz. 6.5).
izobarik süreç
1. Politropik denklemden pv n= const, izobarik sürecin denklemine dönüştüğü görülebilir ( R= const) ne zaman n= 0.
2. Durum denklemlerinden pv 1 = RT 1 ve pv 2 = RT 2 bizde
3. sen= v ile(T 2 - T 1). (47)
4. yani . (48)
5.dq = du + d . (49)
Verilen ısının nasıl dağıldığını belirleyelim:
z = = ,
şunlar. sağlanan tüm ısıdan.
Bu süreç ayrılmaz parça ICE döngüleri ve gaz türbinleri (Şekil 10). izobar T-s koordinatlar, izokordan daha düz olan logaritmik bir eğri ile gösterilir (çünkü p ile > v ile, bkz. 6.5).
izotermal süreç
1.T= const , pvn = const . İtibaren Devlet Denklemleri pv=RT bu süreç için takip eder n 1'e eşit olmalıdır, yani pv= inşaat izoterm p-v koordinatlar bir ikizkenar hiperbol ile gösterilir (Şekil 11, a) ve T-s koordinatlar - düz bir çizgi (Şekil 11, b).
2. p 1 v 1 = p 2 v 2 ; . (50)
3. du=0, t .ile. dT= 0.
5. q= , bu süreçte tüm ısı işe girer.
Kompresörleri sıkıştırmak için bu en avantajlı işlemdir, çünkü sıkıştırma sıcaklığı sabittir
z= 1 – z= 1.
Adyabatik süreç
Adyabatik bir süreç, çevre ile ısı alışverişi yapmayan bir süreçtir. Tüm hızlı süreçler (atış, patlama, türbinin akış kısmından buhar akışı vb.) adyabatik çok yakındır.
Bu nedenle, aşağıda, kabul edilebilir bir mühendislik hatasıyla oldukça hızlı ilerleyen gerçek termal süreçler, adyabatik süreçler (örneğin, ısı motorlarında sıkıştırma ve genleşme süreçleri) olarak kabul edilecektir.
1. dq = v dT ile + pdv; dq= 0, o zaman
v dT ile + pdv = 0. (52)
Ayırt etmek pv=R.T. Almak pdv+vdp=RdT, nerede . Alınanları değiştirelim dT(52) içinde: . Bölünür ve Al pdv= 0. Ancak, = k-1, o zaman pdv + vdp + (k– 1)pdv = 0.
pdv + vdp + kpdv – pdv= 0. p'ye böl v: . Entegre ediyoruz ve ln alıyoruz p+ln v k= const veya ln( p.v.k) = konst. AT son şekil adyabatik denklem elde edilir:
pv k = const . (53)
AT p-v adyabatik koordinatlar, izotermden daha dik giden eşit olmayan bir hiperboldür ( n=k= 1.4, şek. 12a).
2. Adyabatik denklemden p 1 v 1k = p2 v 2k. . Buradan
1 ve 2 numaralı noktalar için karakteristik denklemi yazıyoruz: p 1 v 1 =GZ 1 ve p 2 v 2 =GZ 2 ve birinciyi ikinciye bölün. Almak
Şimdi ifadeyi (54) kullanarak, ifadenin (55) yerine kullanalım:
Sıcaklıklar ve basınçlar arasındaki ilişkiyi elde etmek için, (54)'deki basınç oranı ile ifade edilen (55) yerine koyarız:
3, 4. Adyabatik süreçte, iç enerjideki değişim iş yapmak için kullanılır: O = d + du, buradan d = -du veya .
Entegrasyondan sonra, elde ederiz veya (çünkü genişleme ile)
Mayer denkleminden c p – c v = R. c p = kc v. Buradan kcv – cv = R ve .
Elde edilen değeri c yerine koyun v formül (58):
Clapeyron denkleminden ( pv=RT) yazılabilir ve p 1 alınabilir v 1 parantez dışında,
5. q= 0.
Adyabatik bir süreçte, entropi sabit kalır ( s= const), bu nedenle bu sürece bazen izentropik denir (bkz. 5.6).
katsayı z mantıklı değil.
politropik süreç
Yukarıda ele alınan tüm süreçlerin bir özelliği vardı: her birinde, miktarlardan herhangi birine bir kısıtlama getirildi ( R= sabit, t= sabit, v= sabit, dq= 0). Bu nedenle, bu işlemler gazın durumundaki özel değişiklikler olarak kabul edilebilir.
Ek olarak, bu sınırlamaların bir sonucu, giriş veya çıkış ısısının q arasında ve belli bir değer alacak şekilde dağıtılır.
Ancak bu kısıtlamaların olmadığı süreçler olabileceği ve z başka değerler alabilir. Bu tür işlemler için tek sınırlama kalıcılık olacaktır. z, yani ve ısı kapasitesinin sabitliği (çünkü, q = İle birlikte ).
İle entegre ederek n= const, politropik denklemi elde ederiz
pvn= yapı (65)
Yukarıda belirtildiği gibi, gösterge n her işlem için belirli bir değer alır.
Politropik denklem, adyabatik denklemden formda farklı olmadığından, ana parametreler arasındaki tüm ilişkiler, adyabatik sürece benzer formüllerle temsil edilir.
Aynısı, politropik sürecin çalışmasını belirlemek için ifadeler için de söylenebilir.
n1.docx
*Dinamiklerin birinci yasası.
Çalışan gövde parametreleri p, V, T, sen, i, S.
Çalışan vücudun iç enerjisi
Çalışan vücudun iç enerjisi. fiziksel anlam ve boyut.
İşlemler tersinir ve geri döndürülemez. Denge ve dengesizlik.
Entalpi. fiziksel özellikler.
Çalışma sıvısının ısı kapasitesi
izokorik gaz süreci
İzobarik gaz süreci.
İzotermal gaz süreci.
adyabatik gaz süreci.
Termodinamiğin ikinci yasası
Termodinamiğin ikinci yasasının formülasyonları.
Carnot çevrimi ve özellikleri.
Su buharı tabloları.
i – S su buharı diyagramı.
Adyabatik süreç p – V , i – S ve T – S diyagramlar.
Kompresörde çok aşamalı sıkıştırma.
yanmalı ICE döngüsü V= const
yanmalı ICE döngüsü p= const
Isı beslemeli ICE döngüsü Vvep = const
Karışık ısı beslemeli ICE döngüsü.
Bir gaz türbini tesisinin çevrimi
Buhar güç döngüsü. Rankine döngüsü.
Hava kompresörü soğutma çevrimi.
Buhar kompresörü soğutma çevrimi.
Buharlaşma süreci p – Vçizelge.
İşlem p = const su buharı. İşlem görüntüsü p – V , i – S ve T – S diyagramlar.
Buhar yeniden ısıtma.
İşlem T= const su buharı. İşlem görüntüsü p – V , i – S ve T – S diyagramlar.
Ortalama ısı kapasitesi tabloları. Tabloları kullanarak ısı tayini.
Buhar santrallerinde spesifik buhar ve ısı tüketimi
Rejenerasyonlu gaz türbini tesisi çevrimi.
Çalışma sıvısının durum denklemi.
Mayer formülü.
"Soğutma katsayısı" kavramı.
Termodinamiğin birinci yasası, ısı ve işin karşılıklı dönüşüm süreçleriyle ilgili olarak genel koruma yasasının ve enerjinin dönüşümünün özel bir durumudur. Yasa, izole bir sistemdeki tüm enerji türlerinin toplamının, sistemde meydana gelen herhangi bir işlem için sabit kaldığını belirtir:
Termodinamik bir işlemin uygulanması sırasında vücuda verilen ısı Q iç enerjisini değiştirmeye ve mekanik iş yapmaya gider:
1 kg çalışma sıvısı için
ÇALIŞAN VÜCUT PARAMETRELERİP , V , T , sen , ben , S .
Vücudu belirli bir durumda karakterize eden niceliklere denir. parametreler devletler. Çoğu zaman, vücudun durumu aşağıdaki parametrelerle belirlenir: özgül hacim, basınç, entalpi ve sıcaklık.
belirli hacim (v) cisim, kütlesinin bir biriminin hacmidir. Teknik termodinamikte kütle birimi olarak kilogram (kg) ve hacim birimi olarak metreküp (m3) alınır. Eğer bir V - vücut kütlesi tarafından işgal edilen m3 cinsinden hacim M kg cinsinden, ardından özgül hacim
Yoğunluközgül hacmin tersidir
basınç p içinde uluslararası sistem birimler (SI) paskal cinsinden ölçülür. Pascal (Pa) - 1 m2'lik bir alana sahip normal bir yüzeye eşit olarak dağılmış 1 newton (N) kuvvetin neden olduğu basınç. Böylece, SI birimlerinde pascal, metrekare başına Newton (N / m 2) olarak ölçülür.
Sıcaklıkısıtılmış vücut derecesini karakterize eder. Termodinamik sıcaklık ölçeğinde veya uluslararası pratik sıcaklık ölçeğinde ölçülür. Termodinamik sıcaklığın birimi, suyun üçlü noktasının termodinamik sıcaklığının 1/273.16'sı olan kelvindir (K).
entalpi
sen ve çalışır pv .
Neresi dl t ( dl t = - vdp ).
Değer i p , v , T , ve. Miktarın fiziksel anlamı i denklemi ile açıklanabilir dq = di - vdp, hangi süreç için p = const şöyle yazılacak:
dq p = di . (86)
Bunu nereden takip ediyor di
Herhangi bir süreçteki entalpi değişimi, yalnızca vücudun ilk ve son durumları tarafından belirlenir ve sürecin doğasına bağlı değildir.
Entropi bir durum fonksiyonudur, bu nedenle termodinamik süreçteki değişimi sadece durum parametrelerinin ilk ve son değerleri ile belirlenir. Temel termodinamik süreçlerde entropi değişimi:
izokorik olarak
izobarik olarak
izotermal olarak
adyabatik olarak
politropik olarak
ÇALIŞAN VÜCUDUN İÇ ENERJİSİ, FİZİKSEL ANLAMI VE BOYUTSALLIK.
İçsel enerji- bu, bedende veya beden sisteminde bulunan tüm enerjidir. Bu enerji toplamı olarak temsil edilebilir belirli türler Enerjiler: Moleküllerin kinetik enerjisi, translasyon enerjisi ve döner hareket moleküller ve salınım hareketi molekülün kendisindeki atomlar; elektron enerjisi; intranükleer enerji; bir molekülün çekirdeği ile elektronlar arasındaki etkileşim enerjileri; herhangi bir dış kuvvet alanındaki moleküllerin konumunun potansiyel enerjisi veya enerjisi; elektromanyetik radyasyon enerjisi.
Vücudun toplam iç enerjisi genellikle gösterilir. sen(J) ve özgül iç enerji sen (j/kg) .
İç enerji:
iç nerede kinetik enerji moleküller, iç potansiyel enerji moleküller, integrasyon sabitidir.
Teknik termodinamikte, yalnızca iç enerjinin kinetik ve potansiyel bileşenlerinin değiştiği süreçler dikkate alınır.
Durumda sonsuz küçük bir değişiklik olan herhangi bir işlem için ideal bir gazın iç enerjisindeki değişiklik (1 kg için)
Termal hesaplamalarda genellikle iç enerjideki değişimi bilmek gerekir, mutlak değerini değil; bu nedenle, referans noktası (0 K veya 0 0 C) için sonuç() alakasız.
içinde sabit bir hacimde ortalama kütle ısı kapasitesi nerede
Böylece, herhangi bir işlem için ideal bir gazın iç enerjisindeki değişim, sabit bir hacimdeki ortalama ısı kapasitesi ile gazın sıcaklık farkının ürününe eşittir.
SÜREÇLER GERİ DÖNÜŞTÜRÜLEBİLİR VE GERİ DÖNÜLMEZDİR. DENGE VE DENGESİZLİK
Bir termodinamik süreç, çalışan akışkanın çevre ile enerji etkileşiminin bir sonucu olarak meydana gelen bir cismin durumundaki ardışık bir değişikliktir.
Tersinir ve tersinmez termodinamik süreç kavramları, sistemin dengesi ile yakından ilişkilidir. Çevre ile ısı alışverişi olmayan böyle bir termodinamik sistemi ele alalım (adyabatik termodinamik sistem). Böyle bir sistemde meydana gelen termodinamik süreçler, sistem herhangi bir ek termal etki olmadan doğrudan ve ters işlemler sırasında orijinal durumuna geri dönerse, tersinir olarak adlandırılır. çevre sisteme. Ters işlem sırasında sistem orijinal durumuna geri dönemezse veya bu ısı kaynağı gerektiriyorsa, böyle bir işleme geri döndürülemez denir.
Basınç ve sıcaklıktaki her değişiklikteki süreç, ancak termodinamik sistemin bir noktasından diğerine tüm süreç boyunca basınç sabitse ve her noktadaki sıcaklık ortam sıcaklığına eşitse veya farkları sonsuz küçükse tersine çevrilebilir. .
Tersinir termodinamik süreçler ideal veya teorik durumdur. Pratikte yarı statik koşulu sağlamak zor olduğundan, tüm gerçek süreçler geri döndürülemez. Ek olarak, işlemlerin tersinmezliği, çalışma sıvısındaki iç sürtünme ve teknik ekipmandaki yüzey sürtünmesinin varlığından kaynaklanır (nozuldaki akış, piston yüzeyinin silindir duvarına sürtünmesi vb.). Sürtünmenin üstesinden gelmek için, işlem sırasında ısıya dönüştürülen bir miktar mekanik iş harcamak her zaman gereklidir.
ENTALPİ. FİZİKSEL ÖZELLİKLER
Termodinamik bir cismin entalpisi, iç enerjisinin toplamıdır. sen ve çalışır p v .
Neresi dl t - teknik çalışmada bir fark var ( dl t = - vdp ).
Ortaya çıkan denklem aynı zamanda termodinamiğin birinci yasasının entalpi ve teknik çalışma kavramlarını kullanarak ikinci formülasyonudur. 
Değer i daha önce tanıtılanlarla birlikte bir termodinamik cismin durumunun bir parametresi olarak da düşünülebilir. p , v , T , sen . Miktarın fiziksel anlamı i denklemi ile açıklanabilir ( dq = di - vdp), hangi işlem için p = const şöyle yazılacak: dq p = di .
Bunu nereden takip ediyor di
sabit basınç sürecinde bir termodinamik gövdeye sağlanan temel ısı miktarıdır.
Herhangi bir süreçteki entalpi değişimi, yalnızca vücudun ilk ve son durumları tarafından belirlenir ve ara durumlara ve sürecin doğasına bağlı değildir.
ÇALIŞMA ORTAMININ ISI KAPASİTESİ
ısı kapasitesi Herhangi bir nicel birimin sıcaklığını 1 ° C artırmak için bir cisme (gaz) verilmesi gereken ısı miktarını arayın.
Yukarıda listelenen ısı kapasitelerinin değerlerini belirlemek için bunlardan birinin değerini bilmek yeterlidir. Molar ısı kapasitesinin değerine, ardından kütle ısı kapasitesine sahip olmak en uygunudur:
ve hacimsel ısı kapasitesi:
Hacimsel ve kütle ısı kapasiteleri, bağımlılıkla birbirine bağlıdır:
normal koşullar altında gaz yoğunluğu nerede.
Bir gazın ısı kapasitesi, sıcaklığına bağlıdır. Bu temelde, bir ayırt ortalama ve gerçek ısı kapasitesi.
Eğer birq-
gaz sıcaklığı değiştiğinde, bir gaz miktarı birimine bildirilen (veya ondan alınan) ısı miktarı. t 1
önceki t 2
sonra
Temsil etmek ortalama ısı kapasitesi içinde. Sıcaklık farkı sıfıra yaklaştığında bu oranın sınırına denir. gerçek ısı kapasitesi.
İZOKORİK GAZ PROSESİ
izokorik süreç- sabit bir gaz hacminde iletişim veya ısının uzaklaştırılması süreci (
v
=
const).
Sabit bir hacimde, bir gazın basıncı, mutlak sıcaklıklarla doğru orantılı olarak değişir:
Harici iş gaz v
=
const boş ben=0.
gazın iç enerjisindeki ısı veya değişim miktarı:
izokorik süreç pv- diyagram düz bir dikey çizgi ile gösterilir - izokor. Pozitif miktarda ısı ile çizgi aşağıdan yukarıya doğru gider.
Entropi değişimi:
İZOBARİK GAZ PROSESİ.
İzobarik süreç - sabit basınçta iletişim veya ısının uzaklaştırılması süreci (R
= sabit)
İşlem eğrisine izobar denir.
Çünkü izobarik bir süreçte dp=0
daha sonra sistemde herhangi bir teknik çalışma yapılmaz ve cismin 1. durumdan 2. duruma geçmesi için gereken ısı miktarı şu şekilde belirlenir:
Böylece, izobarik bir termodinamik süreçte, vücuda verilen (çıkarılan) ısı miktarı, bu süreçteki entalpi değişimi ile orantılıdır. Bu sonuç, sistemin sürecin başında ve sonunda termodinamik dengede olması koşuluyla hem tersinir hem de tersinmez işlemler için geçerlidir.
Tersinir bir süreç için:
izobarik süreç pv –
diyagram düz bir yatay çizgi olarak görüntülenir. Sürece ısı eklendiğinde, çizgi soldan sağa doğru uzanır.

Böyle bir süreçte mekanik çalışma:
Spesifik tek kullanımlık (faydalı) harici çalışma:
İdeal bir gazın hal denkleminden, izobarik bir süreç için aşağıdaki ilişki elde edilebilir:
Bu nedenle, izobarik bir süreçte, ideal bir gazın hacmi ile orantılıdır. mutlak sıcaklık. Bir gaz genleştiğinde sıcaklığı artar, sıkıştırıldığında sıcaklığı düşer.
Bir izobarik süreçte entropi değişimi aşağıdaki gibi hesaplanabilir:
İZOTERMAL GAZ PROSESİ.
İzotermal süreç - iletişim süreci veya. sabit sıcaklıkta ısı giderme (
t
-
yapı)
İdeal bir gazın izotermal süreci için, ilk ve son parametreler arasındaki ilişki aşağıdaki formüllerle belirlenir:
Sabit sıcaklıkta, bir gazın hacmi basıncıyla ters orantılı olarak değişir.
Üzerinde pv-
ideal gaz izoterm diyagramları bir eşkenar hiperbol ile temsil edilir. İşlem eğrisinin altındaki alan, belirli bir işlemdeki mekanik işi sayısal olarak ifade eder. 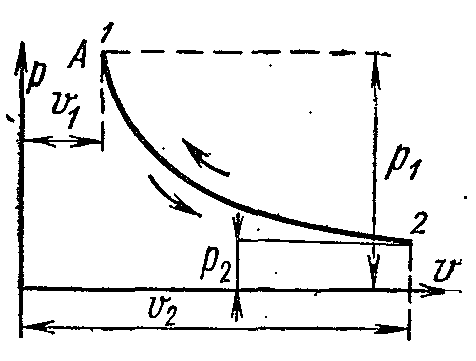
1 kg ideal gazın işi denklemlerden bulunur:
İzotermal bir süreçten beri t
= const, sonra ideal bir gaz için
İzotermal bir süreçte entropi değişimi
Aşağıdaki formülle ifade edilir:
ADYABATİK GAZ PROSESİ.
Isı verilmeden ve atılmadan ilerleyen süreç, yani. çevre ile ısı alışverişinin olmadığı duruma adyabatik, bu sürecin eğrisine adyabatik denir. İşlem koşulları: dq=0 , q=0.
Çünkü dq=0 , o zaman termodinamiğin birinci yasasına göre:
Böylece çalışan vücut tarafından gerçekleştirilir mekanik iş adyabatik bir termodinamik süreçte, vücudun iç enerjisindeki bir azalmaya eşittir, teknik çalışma ise entalpideki değişim (azalma) ile orantılıdır. Tersinir bir diyabatik süreçte, bir termodinamik cismin entropisi değişmez: S= Sabit.
Koordinat sisteminde adyabatik denklem pv – ideal bir gaz için sabit ısı kapasitesinde () diyagramlar: adyabatik üs nerede
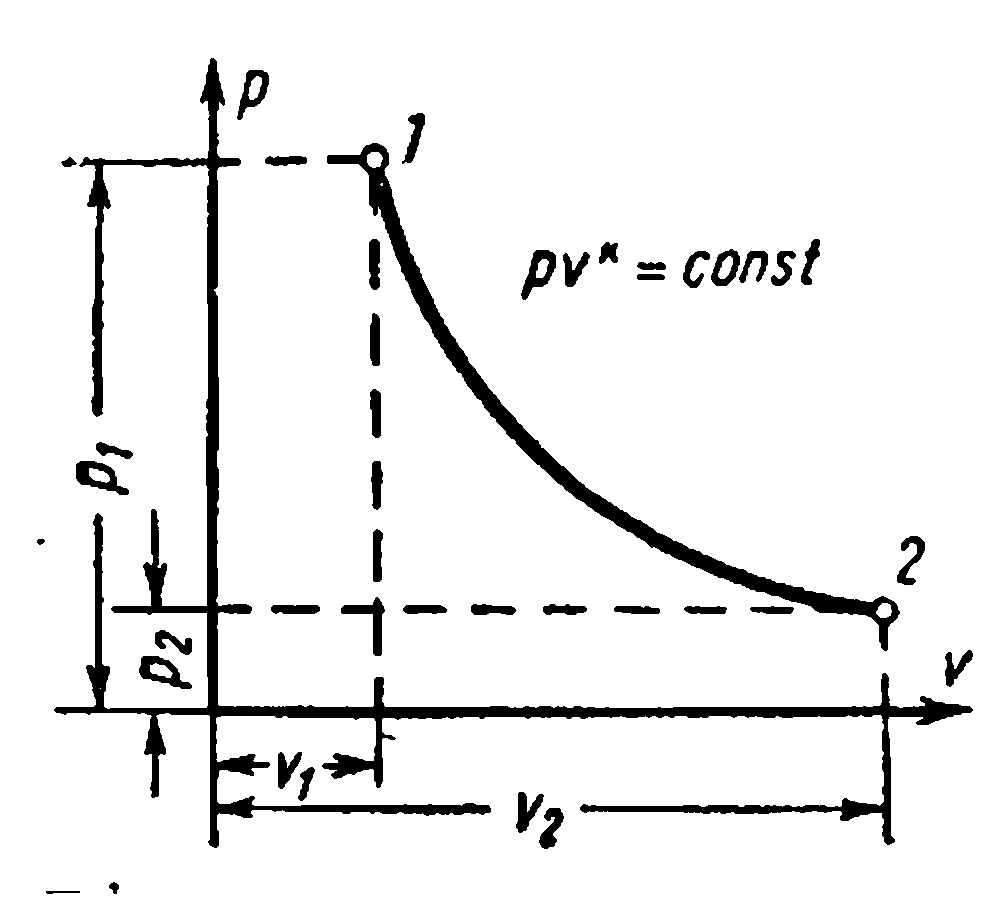
Sürecin ilk ve son parametreleri arasındaki bağımlılıklar: arasında R ve v ,
arasında T ve v
arasında R ve T
1 kg gazın işi aşağıdaki formüllerle bulunur.
Gazın iç enerjisindeki değişim ve adyabatik sürecin işi büyüklük olarak eşittir ve işaret olarak zıttır. .
Adyabatik bir süreçte ideal bir gazın iç enerjisindeki değişim de denklemle ifade edilebilir.
Termodinamiğin ikinci yasası
Termodinamiğin ikinci yasası, doğada kendiliğinden gerçekleşen termal süreçlerin akışının yönünü belirler ve ısının işe dönüşmesi için koşulları belirler. Yasa, doğadaki ısının kendiliğinden yalnızca daha sıcak olan cisimlerden daha az sıcak olana geçtiğini belirtir.
Termodinamiğin ikinci yasasına göre, herhangi bir ısı motorunda ısıyı işe dönüştürmek için iki gövdeye sahip olmak gerekir. farklı sıcaklıklar. Daha sıcak bir vücut iş için bir ısı kaynağı olacak, daha az ısıtılan bir vücut bir ısı emici olacaktır. Bu durumda ısı motorunun verimi her zaman birden az olacaktır.
Dinamiğin ikinci yasası matematiksel olarak ifade edilebilir:
Neresi dS –
sistemin entropisinin sonsuz küçük bir artışı;
dQ – sistem tarafından bir ısı kaynağından alınan sonsuz miktarda ısı;
T - ısı kaynağının mutlak sıcaklığı.
Eşitsizlik işareti, tersinmez süreçlere karşılık gelir ve tersinir olanlara eşittir. Bu nedenle, sonsuz küçük tersinir bir süreç için termodinamiğin ikinci yasasının analitik ifadesi şu şekli alır:
dQ= TdS
dan beri termodinamiğin birinci yasasına göre
dQ=dU+pdV
TdS=dU+pdV.
Carnot çevrimi ve özellikleri.
Karnot döngüsü.İki izoterm ve iki adiabattan oluşur. Bu çevrim, ideal bir ısı motorunda çalışma akışkanı tarafından iki ısı kaynağının (ısıtıcı ve buzdolabı) varlığında gerçekleştirilen kapalı bir işlemdir.

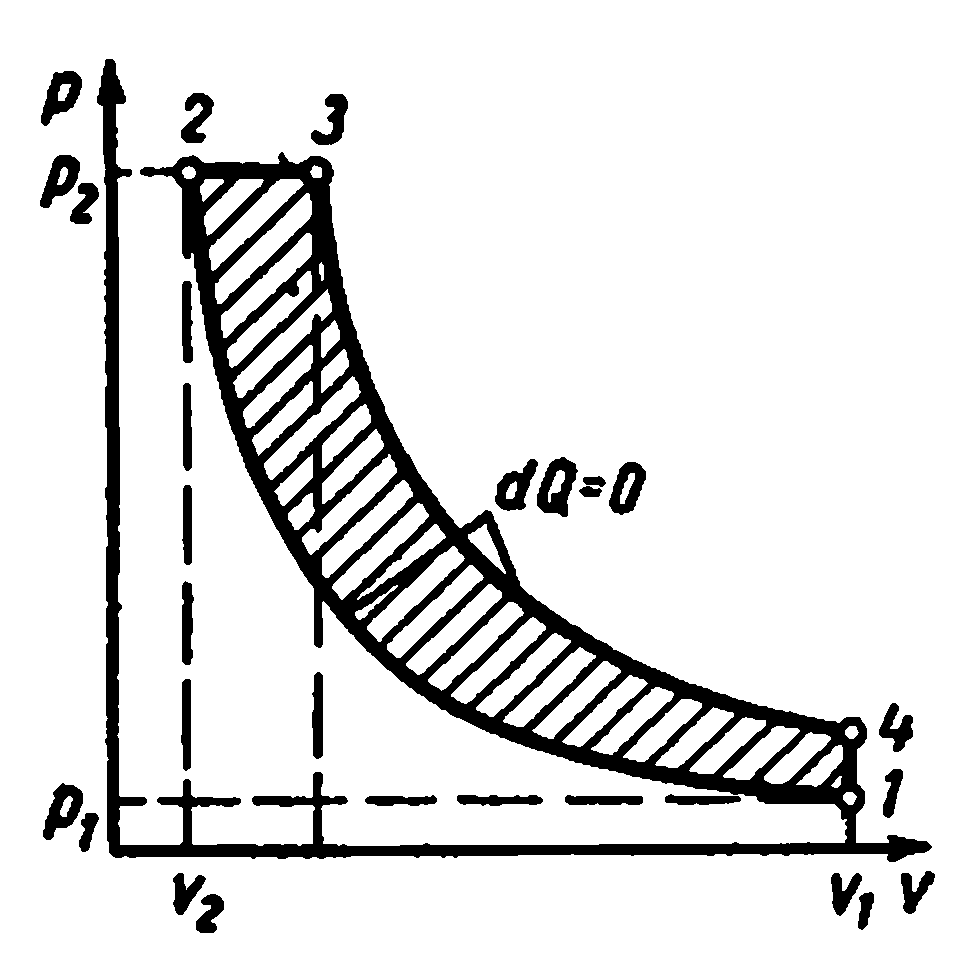
Carnot'un döngüsü pv-diyagram
1-2 ve 3-4 süreçleri izotermal, 2-3 ve 4-1 süreçleri ise adyabatiktir. Döngüdeki çalışma sıvısının ilk sıcaklığı alınır sıcaklığa eşitısıtıcıT 1 . Durum 1'den durum 2'ye izotermal genleşme sırasında, çalışma sıvısı ısıtıcıdan ısı miktarını alır.q 1 bir sıcaklıktaT 1 . Bölüm 2-3'te, çalışma sıvısı adyabatik olarak genişler. Aynı zamanda, çalışma sıvısının sıcaklığı düşerT 1 önceki T 2 ve basınç düşer itibaren p 2 önceki p 3 . 3-4 izoterm boyunca sıkıştırıldığında, ısı miktarı çalışma sıvısından buzdolabına çıkarılır.q 2 bir sıcaklıktaT 2 . Daha fazla adyabatik kasılma4-1, çalışma sıvısının sıcaklığında bir artışa yol açarT 2 önceki T 1 , ve çalışma sıvısı orijinal durumuna geri döner.
Toplam çevrim çalışmasıben c 12341 alanı ile grafiksel olarak temsil edilir.
Termal döngü verimliliği:
Carnot döngüsünün çalışması
Isıl verim Çevrim:

Döngü özellikleri:
Sıkıştırma oranı
Basınç oranı
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
Sabit basınçta ısı beslemeli bir çevrim, bir izobar ve bir izokor olmak üzere iki adiyabattan oluşur.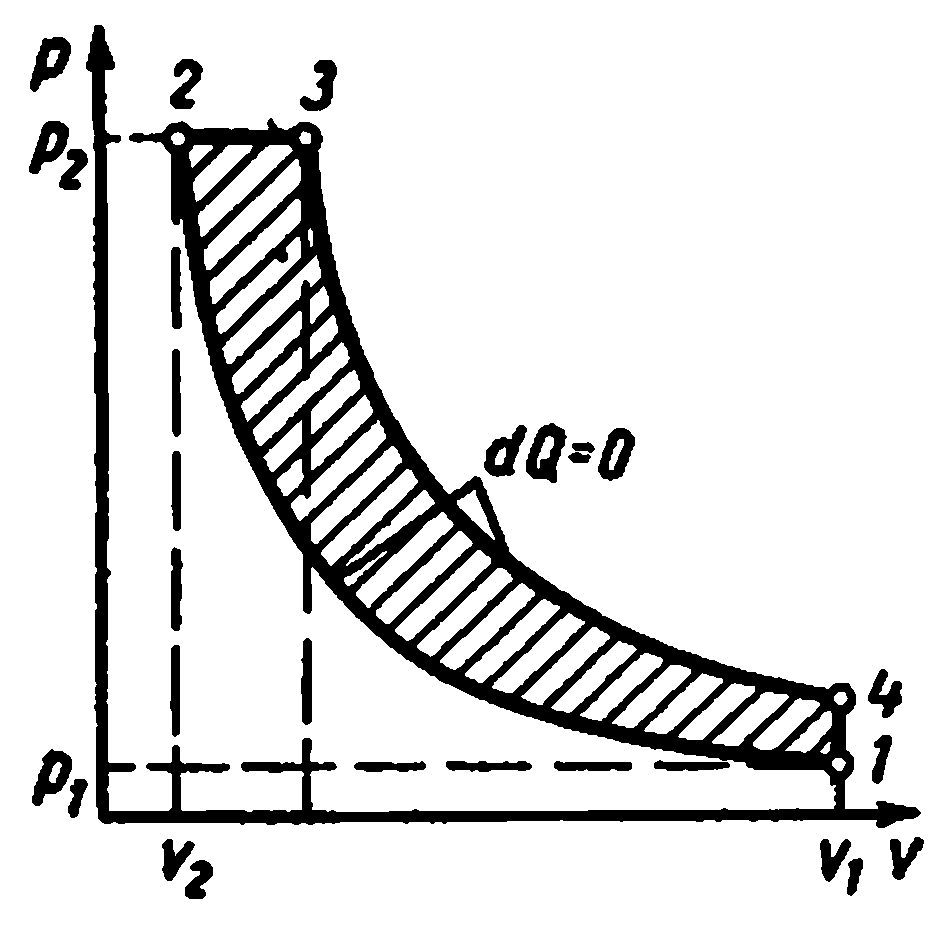
Döngü özellikleri:
Sıkıştırma oranı
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
Kombine ısı beslemeli çevrim iki adyabat, iki izokor ve bir izobardan oluşur

Döngü Özellikleri
Verilen ısı miktarı
Kaldırılan ısı miktarı
Isıl verim Çevrim
Su buharı tabloları.
kızgın buhar veya doymuş buhar, özelliklerinde önemli ölçüde farklılık gösterir. ideal gazlar. Buharların durumu için denklemler çok karmaşıktır ve hesaplamalı uygulamada kullanılmazlar. Pratik amaçlar için, deneysel ve teorik veriler temelinde derlenen tablolar ve diyagramlar kullanılır. Tablolar, aşırı ısıtılmış ve doymuş buharlar 1000 0 C sıcaklığa ve 98.0 MPa basınca kadar.
için tablolarda doymuş buhar doyma sıcaklıkları, basınçlar, değerler belirli hacimler, sıvı ve kuru buharın entalpisi ve entropisi, buharlaşma ısısı. Kızgın buhar tablolarında, çeşitli basınç ve sıcaklıklar için ana parametrelerin değerleri verilmiştir: özgül hacim, entalpi ve entropi.
i – S su buharı diyagramı.
büyük onur dır-dir diyagram, işlemlerde yer alan teknik çalışma ve ısı miktarının alanlar değil, çizgi bölümleri ile temsil edilmesidir. İnşa ederken dır-dir- çizelgeler y ekseni boyunca çizilen özgül entalpiçifti ve apsis boyunca özgül entropi. Koordinatların orijini, suyun durumu olarak alınır. üçlü nokta, nerede, .
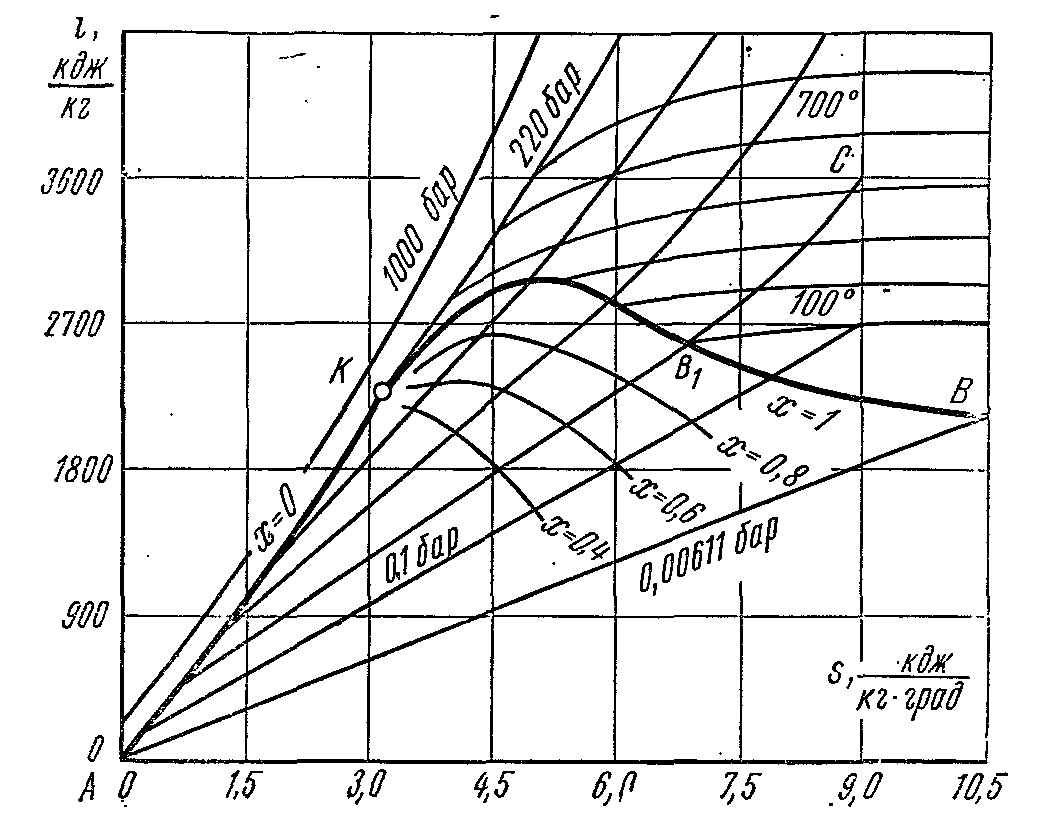
Su buharı tablolarının verilerini kullanarak, kritik K noktasında yakınlaşan sıvı ve buharın sınır eğrileri diyagramda çizilir. Sıvının sınır eğrisi orijini terk eder, çünkü bu noktada entropi ve entalpi sıfıra eşit alınır. Suyun durumu, ilgili izobarlarda noktalarla işaretlenmiştir. Bölgedeki izobar çizgileri ıslak buhar akışkan sınır eğrisinden dışarı doğru yayılan düz eğimli çizgilerdir. Bir izobarik süreçte:
Diyagramın her noktasında izobarın apsise eğimi, verilen durumun mutlak sıcaklığına sayısal olarak eşittir. Çünkü ıslak buhar alanında, izobar izoterm ile çakışır, daha sonra son denkleme göre ıslak buhar izobarı düz çizgilerdir:
Ve bu düz bir çizginin denklemi. Aşırı ısıtılmış buhar bölgesinde, izobarlar, aşağı doğru yönlendirilmiş bir dışbükeyliğe sahip bir eğriliğe sahiptir. Islak buhar alanında, kritik K noktasında birleşen sabit buhar kuruluğu (x=const) çizgilerinden oluşan bir ızgara uygulanır.
Islak buhar bölgesindeki izotermler, izobarlarla örtüşür. Aşırı ısıtılmış buhar alanında birbirlerinden ayrılırlar: izobarlar yükselir ve izotermler, dışbükeyliği yukarı doğru olan kavisli çizgilerdir. Diyagrama, izobarlara kıyasla daha dik yükselen eğriler formuna sahip bir izokor ızgarası uygulanır. Tersinir bir adyabatik süreç, dikey bir düz çizgi ile temsil edilir. Üçlü noktanın izobarının altındaki alan, buhar + buz karışımının durumlarını gösterir.
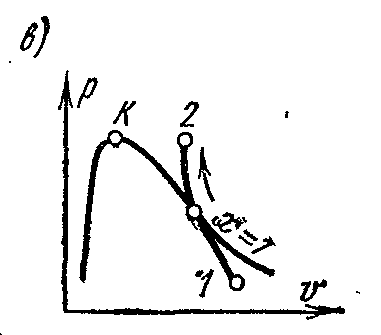
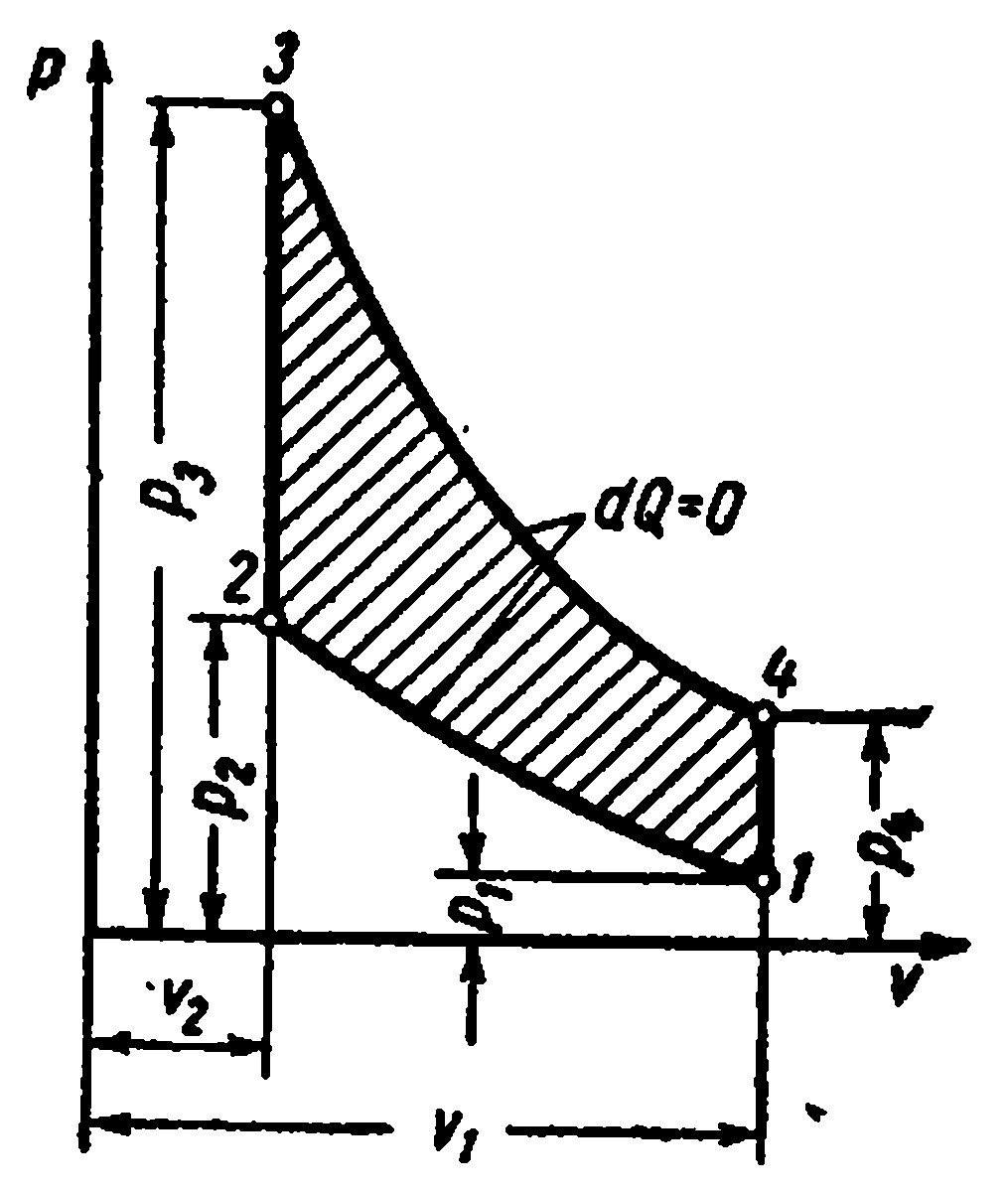
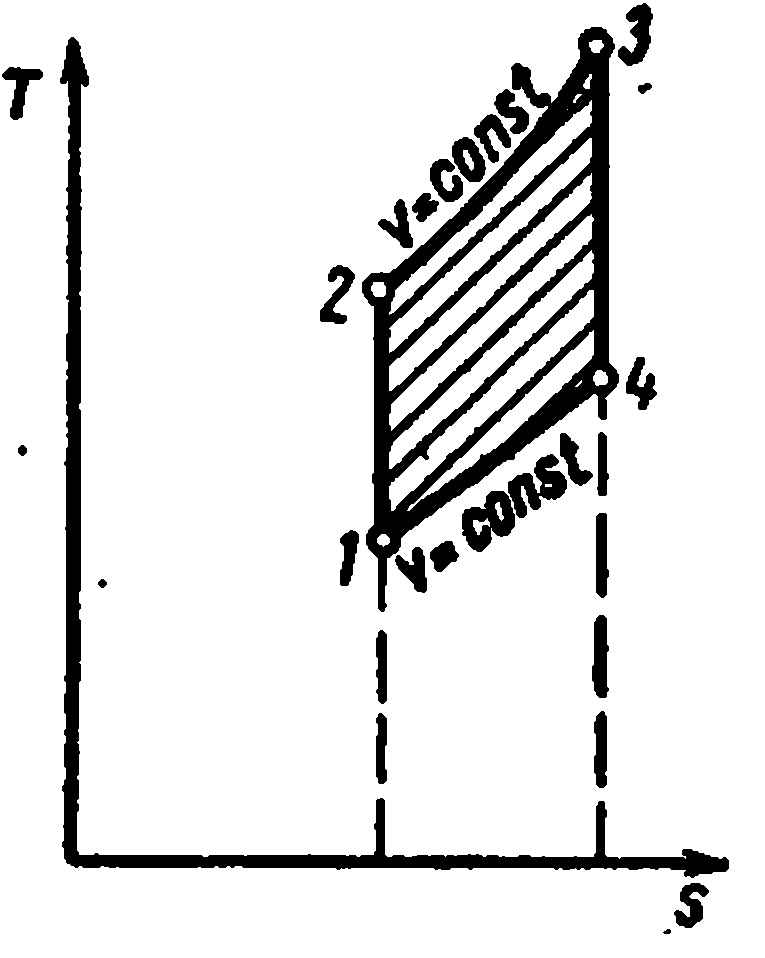
Adyabatik süreçp – V , i – S veT – S diyagramlar.
Adyabatik süreç, ısı verilmeden ve uzaklaştırılmadan gerçekleşir ve tersinir süreçte çalışan akışkanın entropisi kalır. sabit değer: s=sabit. Bu nedenle, üzerinde dır-dir
ve
Ts-
adyabatik diyagramlar dikey düz çizgilerle gösterilmiştir: şek. a ve B 

Adyabatik genleşme sırasında buharın basıncı ve sıcaklığı azalır; kızgın buhar önce kuruya sonra ıslak buhara dönüşür. Entropinin sabitlik koşullarından, eğer başlangıç ve son durumların bir parametresinin parametreleri biliniyorsa, buharın son parametrelerini belirlemek mümkündür.
Üzerinde pv- diyagramda, tersinir bir adyabatik süreç belirli bir eğri ile gösterilmektedir (Şekil c)
Adyabatik bir süreçteki belirli iş, denklemden belirlenir:
Spesifik iç enerjideki değişim:
Kompresörde çok aşamalı sıkıştırma.
Yüksek basınçlı gaz üretmek için çok kademeli kompresörler kullanılır.
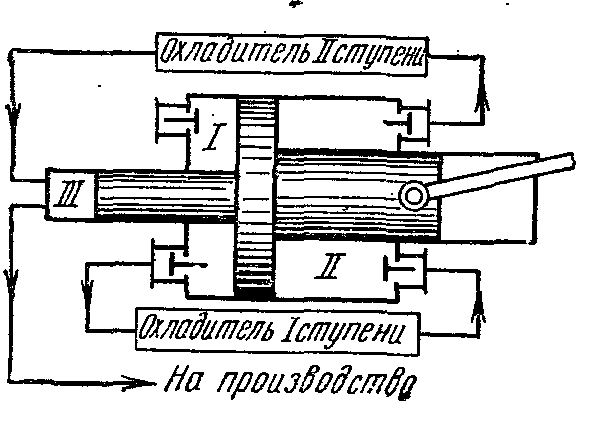
Gaz sıkıştırmasının politropik olarak, her sıkıştırmadan sonra ara soğutması ile seri olarak bağlanmış birkaç silindirde gerçekleştirildiği.
Birkaç silindirde gaz sıkıştırmanın kullanılması, her birinde basınç oranını düşürür ve hacimsel verimi artırır. kompresör. Ayrıca, her aşamadan sonra gazın ara soğutulması, silindirdeki pistonun yağlama koşullarını iyileştirir ve kompresör tahriki için enerji tüketimini azaltır.

0-1'in ilk aşamaya giden emiş hattı olduğu üç kademeli bir kompresörün ideal gösterge diyagramı;
1-2 - ilk aşamada politropik sıkıştırma işlemi; 2-a - ilk aşamadan ilk soğutucuya enjeksiyon hattı; a-3 - ikinci aşamaya giden emme hattı; 3-4 - ikinci aşamada politropik sıkıştırma işlemi; 4-c - ikinci aşamadan ikinci soğutucuya boşaltma hattı; c-5 - üçüncü aşamaya giden emme hattı; 5-6 - üçüncü aşamada politropik sıkıştırma işlemi; 6-c - üçüncü aşamadan tanka veya üretime enjeksiyon hattı. Bölüm 2-3, 4-5, birinci ve ikinci soğutucularda soğutmadan sabit basınçta işlemdeki gaz hacmindeki azalmayı gösterir. Çalışma sıvısının tüm soğutucularda soğutulması, ilk T 1'e eşit aynı sıcaklıkta gerçekleştirilir, bu nedenle 1, 3 ve 5 noktalarındaki gaz sıcaklıkları aynıdır ve 1 - 7 izoterminde bulunur.
Tüm aşamalardaki basınç oranı genellikle aynı alınır:
Tüm aşamalarda aynı basınç oranları, başlangıç sıcaklıklarının eşitliği ve politropik göstergelerin eşitliği ile ayrı kompresör aşamalarındaki son gaz sıcaklıkları birbirine eşittir:
Her aşamada veya z aşamalarında basınç artışı derecesi
Her aşamadaki basınç artışının derecesi köke eşittir. z. derece nihai basınç oranlarından
Başlangıca geri dön
Her kademeye girişte eşit gaz sıcaklıkları ve tüm silindirlerde eşit basınç oranları ile kompresörün tüm kademelerinde yapılan işin eşitliğini elde ederiz:
ikinci adımda
Üçüncü aşamada çalışın
Neresi ben 1
=l 2
=l 3
Üç kompresör aşamasında gaz sıkıştırması için harcanan joule cinsinden toplam spesifik çalışma: ben ile =3 ben 1
Aynı gaz sıkıştırma koşulları altında, gazdan ayrı aşamalarda çıkarılan ısı miktarları birbirine eşittir:
İzobarik soğutma işlemi sırasında herhangi bir soğutucuda gazdan çıkan ısı aşağıdaki formülle bulunur:

AT Ts- Şemalarda, adyabatik sıkıştırma işlemleri 1-2, 3-4, 5-6 düz çizgilerle ve soğutma işlemleri 2-3, 4-5, 6-7 eğrileri ile gösterilmektedir.
Politropik sıkıştırma işlemleri 1-2, 3-4, 5-6 eğrileri ile ve soğutuculardaki soğutma işlemleri - 2-3, 4-5, 6-7 hatları ile gösterilmiştir.
yanmalı ICE döngüsüV = const
![]()
Şekil, sabit bir hacimde hızlı yanan yakıtla çalışan bir motorun gösterge diyagramını göstermektedir. Yakıt olarak benzin, aydınlatma veya jeneratör gazı, alkoller vb.
Piston sol ölü konumdan en sağa hareket ettiğinde, yanıcı karışım emme valfinden emilir. Bu süreç emme hattı adı verilen 0-1 eğrisi ile gösterilir, çünkü termodinamik bir süreç değildir. içinde ana parametreler değişmez, sadece silindirdeki karışımın kütlesi ve hacmi değişir. Piston geri hareket ettiğinde emme valfi kapanır ve yanıcı karışım sıkıştırılır. Sıkıştırma çizgisi olarak adlandırılan eğri 1-2 ile gösterilir. 2. noktada, yanıcı karışım bir elektrik kıvılcımından tutuşur. Yanıcı karışımın yanması neredeyse anında gerçekleşir, yani. neredeyse sabit hacimde. Bu süreç eğri 2-3 ile gösterilmektedir. Yakıtın yanması sonucunda gaz sıcaklığı keskin bir şekilde yükselir ve basınç artar (nokta 3). Daha sonra yanma ürünleri genişler. Piston doğru ölü konuma hareket eder ve gazlar faydalı işler yapar. Gösterge diyagramında genişleme süreci, genişleme çizgisi adı verilen 3-4 eğrisi ile gösterilmektedir. 4. noktada egzoz valfi açılır ve silindirdeki basınç neredeyse dış basınca düşer. Pistonun sağdan sola daha fazla hareketi ile yanma ürünleri, egzoz valfi vasıtasıyla silindirden hafifçe aşan bir basınçta çıkarılır. atmosfer basıncı. 4-0 eğrisi olarak gösterilir ve egzoz hattı olarak adlandırılır. Böyle bir iş akışı, pistonun dört vuruşunda veya milin iki devrinde tamamlanır. Bu tür motorlara dört zamanlı denir.
Sabit hacimde ısı beslemeli çevrim, iki adiabat ve iki izokordan oluşur.
Döngünün özellikleri şunlardır:
- Sıkıştırma oranı
– basınç artışı derecesi
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
yanmalı ICE döngüsüp = const
Sabit hacimde ısı beslemeli çevrimlerin incelenmesi, bu çevrime göre çalışan bir motorun verimini artırmak için yüksek sıkıştırma oranlarının uygulanması gerektiğini göstermiştir. Yüksek sıkıştırmada hava o kadar yüksek bir sıcaklığa sahiptir ki, silindire verilen yakıt, ateşleyici olmadan kendiliğinden tutuşur. Hava ve yakıtın ayrı sıkıştırılması, herhangi bir sıvı ağır ve ucuz yakıtın - yağ, akaryakıt, reçineler, kömür yağlarının - kullanılmasına izin verir.
Bu avantaj, sabit basınçta kademeli olarak yakıt yanması ile çalışan motorlara sahiptir. İçlerinde, motor silindirinde hava sıkıştırılır ve sıvı yakıta kompresörden basınçlı hava püskürtülür.
Yakıtın sabit basınçta kademeli olarak yanması ile ideal motor çevrimi, yani. sabit basınçta ısı beslemeli döngü aşağıdaki gibi gerçekleştirilir.

Başlangıç parametreleri ile gaz halindeki çalışma sıvısı p 1 , v 1 , T 1 adyabatik 1-2 boyunca küçülür; daha sonra vücuda 2-3 izobar boyunca belirli bir miktarda ısı verilir. q 1 . 3. noktadan itibaren, çalışma gövdesi adyabatik 3-4 boyunca genişler. 4-1 izokoruna göre, çalışma sıvısı orijinal durumuna dönerken, ısı soğutucuya alınır. q 2 .
Döngü özellikleri:
Sıkıştırma oranı
Ön genişleme derecesi.
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
Isı beslemeli ICE döngüsüV ve p = const
Karışık ısı girdisine sahip kompresörsüz yüksek sıkıştırmalı bir motorda, sıvı yakıt, bir yakıt pompası tarafından bir yakıt enjektörü aracılığıyla silindir kapağına küçük damlacıklar şeklinde beslenir. Isıtılmış havaya giren yakıt, meme açıkken tüm süre boyunca kendiliğinden tutuşur ve yanar: önce sabit bir hacimde ve sonra sabit bir basınçta.
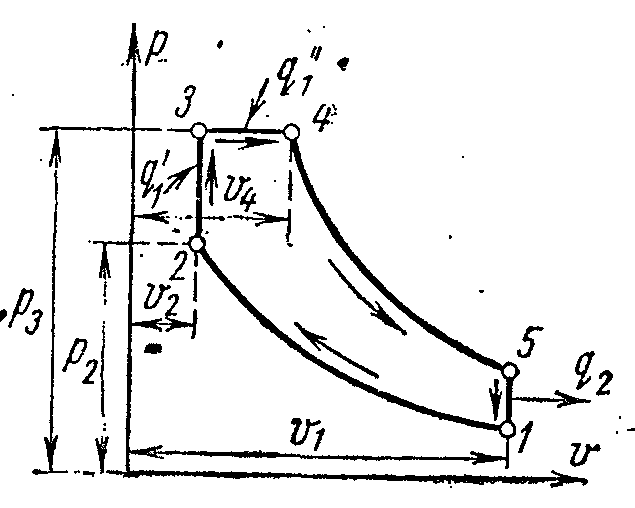

Karışık ısı girdisine sahip bir motorun ideal çevrimi aşağıdaki şekilde gösterilmiştir. pv- veTs- diyagramlar.
Başlangıç parametreleri ile çalışma gövdesi p 1 , v 1 , T 1 adyabatik 1-2 boyunca nokta 2'ye sıkıştırılır. Isının ilk fraksiyonu, izokor 2-3 boyunca çalışma sıvısına verilir. Isının ikinci kısmı, izobar 3-4 boyunca sağlanır. 4. noktadan itibaren, çalışma gövdesi adyabatik 4-5 boyunca genişler. 5-1 izokoru boyunca, çalışma sıvısı orijinal durumuna döner - 1. noktaya, ısı soğutucuya alınırken.
Döngünün özellikleri şunlardır:
Sıkıştırma oranı
– basınç artışı derecesi
Ön genişleme derecesi.
termal tanımla çevrim verimliliğiısı kapasitesi olması şartıyla c p ,
c v
ve adyabatik üs k=
c p /
c v
devamlı:
Sağlanan ısının ilk payı:
Sağlanan ısı miktarının ikinci kısmı:
Kaldırılan ısı miktarı:
Termal çevrim verimliliği
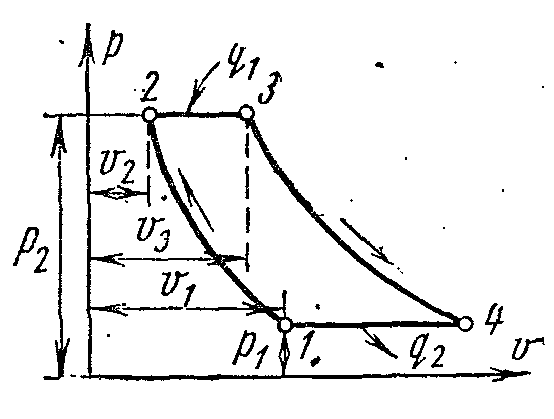
Bir gaz türbini tesisinin çevrimi
Gaz türbini tesislerinde çalışma sıvısı, sıvı veya gaz halindeki yakıtların yanma ürünleridir.

Şekil, sabit basınçta yakıt yanması ile en yaygın gaz türbini tesisi tipinin bir diyagramını göstermektedir.
Gaz türbini ile aynı şaft üzerinde bulunan kompresör K T, atmosferden havayı emer ve belirli bir basınca sıkıştırır. Basınçlı hava yanma odasına girer KS; aynı yakıt pompası TN sıvı yakıt verilir. Yanma sabit basınçta gerçekleşir. Yanma odasından gazlar nozullara girer İTİBAREN, bunlardan yüksek hızçalışma bıçaklarına girin L türbinler ve rotoru rotasyona ayarlayın. Egzoz borusundan egzoz gazları P atmosfere salınır.
Süreçte ısı temini ile gaz türbini çevrimip
=
const
.
Bir gaz türbini tesisinin ideal çevrimi pv- veTs- diyagramlarısı girişi ile p=
const.
Döngü, iki adiabat ve iki izobardan oluşur.
Çalışma sıvısından ısı, içten yanmalı bir motorda olduğu gibi izokor boyunca değil, izobar boyunca çıkarılır. Başlangıç parametreleri ile çalışma gövdesi p 1 , v 1 , T 1 adyabatik 1-2 boyunca nokta 2'ye sıkıştırılır. 2. noktadan itibaren, çalışma sıvısına belirli bir miktarda ısı verilir. q 1 izobar 2-3 boyunca. Daha sonra, çalışma sıvısı adyabatik 3-4 boyunca başlangıç basıncına genişler ve 4-1 izobar boyunca orijinal durumuna geri dönerken, belirli miktarda ısı çıkarılır. q 2 .
Çevrimin özellikleri, kompresördeki basınçlandırma derecesi ve izobarik genleşme derecesidir.
Isı girdisi miktarı:
Kaldırılan ısı miktarı:
Termal çevrim verimliliği
Buhar güç döngüsü. Rankine döngüsü.
İdeal Rankine çevrimi, bir buhar türbini tesisinde ana çevrim olarak alınır. Bu döngüde, çalışma sıvısı kondenserde tamamen yoğuşur, bunun sonucunda hacimli verimsiz bir kompresör yerine, kazana su sağlamak için küçük boyutlu ve yüksek verimli bir besleme suyu pompası kullanılır.
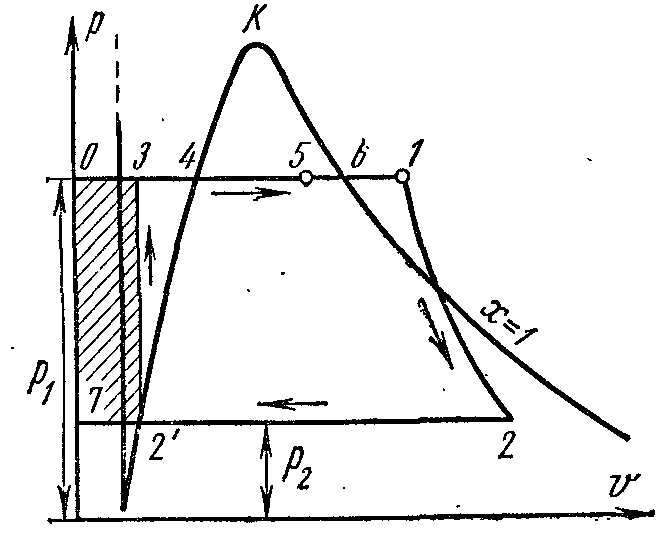
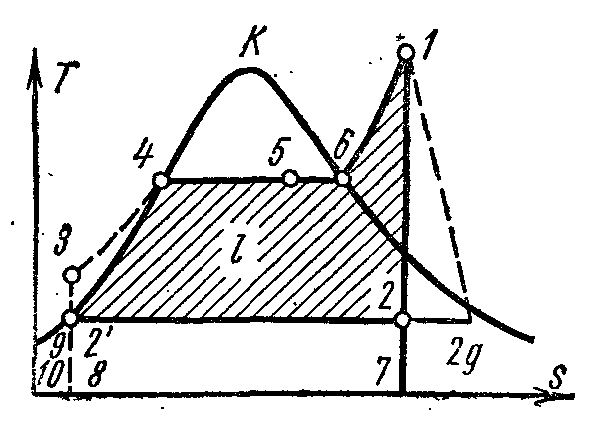
Üzerinde pv- diyagramdaki nokta 4, kazanda basınçta kaynayan suyun durumunu karakterize eder p 1 . Hat 4-5, kazanda buhar üretim sürecini göstermektedir; daha sonra buhar bir süper ısıtıcıda bir basınçta kurutulur. p 1 . Ortaya çıkan buhar, buhar motorunun silindirindeki adyabatik 1-2 boyunca bir basınca genişler. p 2 kondansatörde. 2. işlemde, buhar, basınç altında kaynayan bir sıvı durumuna tamamen yoğunlaştırılır. p 2 buharlaşma ısısını soğutma suyuna aktararak. Suyu sıkıştırma işlemi pompada gerçekleştirilir; su sıcaklığında ortaya çıkan artış ihmal edilebilir düzeydedir ve 3,0-4,0 MPa'ya kadar olan basınçlarda yapılan çalışmalarda ihmal edilmiştir. Satır 3-4, kondenserdeki sıcaklıktan kaynama noktasına kadar ısıtıldığında suyun hacmindeki değişimi gösterir. Pompanın çalışması gölgeli bir kare olarak gösterilir. 03 7. Kızdırıcının çıkışındaki 1 noktasındaki buharın entalpisi şuna eşittir: i 1 ve üzerinde Ts-diyagram tasvir pl. 9 34617109. 2. noktada kondenserin girişindeki buharın entalpisi şuna eşittir: i 2 ve üzerinde Ts-diyagram tasvir pl. 9 . Kondansatörü bir noktada terk ederken suyun entalpisi şuna eşittir: i 1 ve üzerinde Ts-diyagram tasvir pl. 9 8109. Rankine çevriminde faydalı buhar çalışması benüzerinde tasvir pv- kare diyagram. .
Rankine çevrimi, pompanın çalışmasını hesaba katarsa, içindeki suyun adyabatik sıkıştırılması süreci ile temsil edilecektir. Ts- diyagram adyabatik ve izobar 3-4, kazandaki basınçta ısıtma suyuna karşılık gelir p 1 uygun kaynama noktasına getirin.
Rankine döngüsünün termal verimliliği aşağıdaki formülle belirlenir:
Çevrimdeki özgül ısı miktarı, p=
const
3-4 (kaynama noktasına kadar ısıtma suyu), 4-6 (buharlaşma) ve 6-1 (buharın aşırı ısınması) süreçlerinde ve sürecin ilk ve son noktalarının entalpileri arasındaki farka eşittir:
Bu özgül ısı miktarı şu şekilde gösterilir: Ts-diyagram metrekare sekiz . Belirli miktarda ısının uzaklaştırılması q 2
izobar 2- boyunca kondansatörde gerçekleştirilir, bu nedenle
Isı kaldırıldı üzerinde tasvir Ts-diyagram metrekare
Rankine çevriminin termal verimliliği:
Hava Kompresörü Soğutma Döngüsü
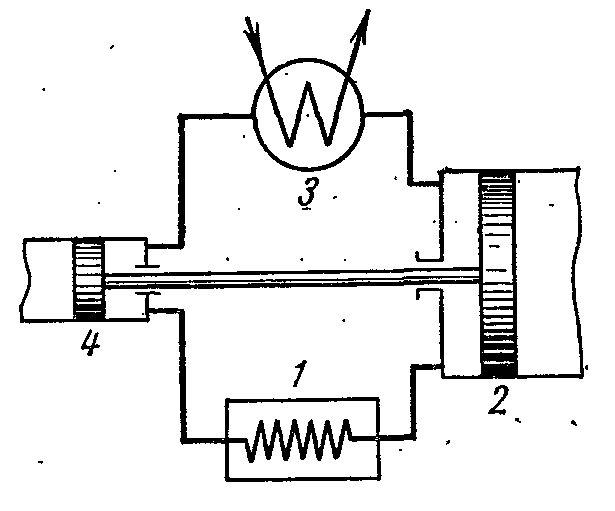
Şekil, en uygun, zararsız ve uygun maliyetli çalışma sıvısı olan çalışma sıvısı olarak havanın kullanıldığı bir hava soğutma ünitesinin şemasını göstermektedir. Hava soğutma ünitesi aşağıdaki gibi çalışır.
Odayı 1 soğutan hava kompresörde 2 sıkıştırılır, bunun sonucunda sıcaklığı yükselir. Sabit bir basınçta sıkıştırılmış hava, su ile ortam sıcaklığına soğutulduğu ısı eşanjörüne (3) enjekte edilir. Bundan sonra, sıkıştırılmış hava, genleşme silindirine veya genleştiriciye 4 girer ve burada ilk basınca genişler. Genişlerken, hava sıcaklığı -60 veya -70 0 С'ye düşer ve soğutma havası odayı soğutmak için gönderilir, burada ısıtıldığında tekrar kompresöre girer.

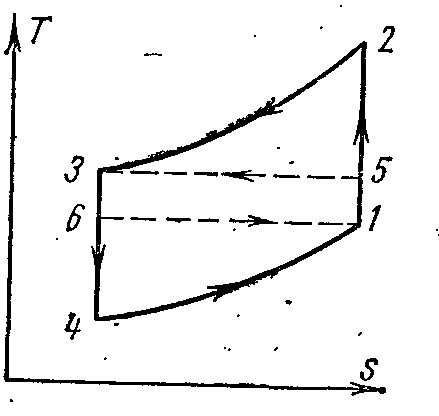
AT pv- veTs- diyagramlar:
1-2 prosesindeki hava, basınçla adyabatik olarak sıkıştırılır p 1 önceki p 2 . İzobarik işlem 2-3'te, belirli miktarda ısı havadan harici bir kaynağa çıkarılır ve sıcaklığı aşağıdan düşer. T 2 T'ye 3 . İşlem 3-4'teki adyabatik genleşme ile hava ayrıca sıcaklıktan soğutulur. T 3 T'ye 4 . Ayrıca, 4-1 izobarik işlemde, soğutulan odadan (ısı vericisi) ısı çıkarılır, bunun sonucunda hava T 4 T'ye 1 .
Döngünün uygulanması için harcanan iş, belirli ısı miktarlarındaki farka eşittir. q 1 ve q 2. Isı kapasitesinin sabit olduğunu varsayarsak:
Daha sonra çevrimin soğutma katsayısı:
=
Adyabatik süreçlerden 1-2 ve 3-4
Ve
Fakat p 2
=
p 3
, a p 1
=
p 4
sonra
Sonunda elimizde
Neresi T 1
soğutulacak odanın sıcaklığı veya kompresöre emilen havanın sıcaklığıdır.
T 2 sıkıştırılmış havanın sıcaklığıdır.
Buhar Kompresörü Soğutma Döngüsü
-20 0 C sıcaklığa kadar soğutma gövdeleri için en yaygın olanı, soğutucunun düşük kaynama noktalı sıvılar olduğu soğutma üniteleridir - amonyak, freonlar, kükürt dioksit ve diğerleri düşük basınçlarda (tercihen atmosfere yakın).
Şekil, amonyak buharı üzerinde çalışan bir kompresör ünitesinin diyagramını göstermektedir. NH 3 .
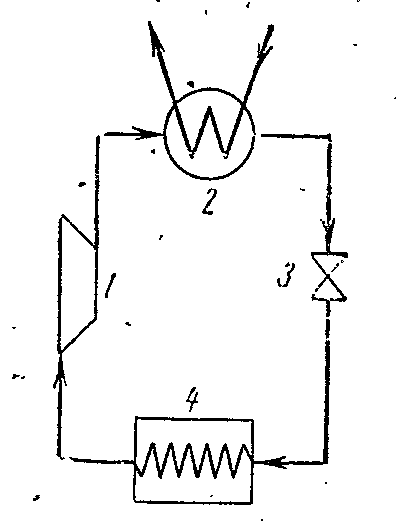

1- kompresör; 2- kapasitör; 3- gaz kelebeği; 4 - soğutmalı oda (evaporatör)
Kompresör, adyabatik 1-2 boyunca yüksek derecede kuruluk ile amonyak kuru doymuş buharı veya ıslak buharı 2. noktada aşırı ısıtılmış buhar durumuna sıkıştırır. Kompresörden buhar, tamamen sıvıya dönüştüğü kondansatöre enjekte edilir. (süreç 2-3-4). Kondansatörden sıvı amonyak, kısıldığı bir gaz kelebeği valfinden geçer ve buna sıcaklık ve basınçta bir düşüş eşlik eder. Daha sonra düşük sıcaklığa sahip sıvı amonyak soğutucuya girer, burada ısı miktarını alır (5-1 prosesinde), soğutulmuş odalarda dolaşan tuzlu suyu buharlaştırır ve soğutur. Kısıtlama işlemi, geri döndürülemez bir işlem olarak koşullu eğri diyagramı 4-5'te gösterilmektedir.
Buhar kompresörü tesisatında genleşme silindiri (genişletici) kullanılmaz ve çalışma sıvısı kontrol vanasında kısılır. Genleşme silindirinin bir bobin ile değiştirilmesi, soğutma kapasitesinde bir miktar kayba neden olan entropide bir artışa eşlik eder, ancak bu değiştirme, kurulumu büyük ölçüde basitleştirir ve buhar basıncını kolayca düzenlemeyi ve soğutucuda geri döndürülemez bir sıcaklık elde etmeyi mümkün kılar.
Döngüde harcanan belirli çalışma: =
Amonyak kompresör ünitesinin soğutma katsayısı:
Soğutucudaki amonyak buharı tarafından algılanan belirli ısı miktarı nerededir.
Kurulumun soğutma faktörü
Denklemdeki entalpi değerleri şu şekilde belirlenir: dır-dir-diyagram veya amonyak tablosuna göre.
Buharlı soğutma üniteleri, hava soğutmaya göre büyük bir avantaja sahiptir. Kompakt, ucuz ve daha yüksek COP'a sahipler.
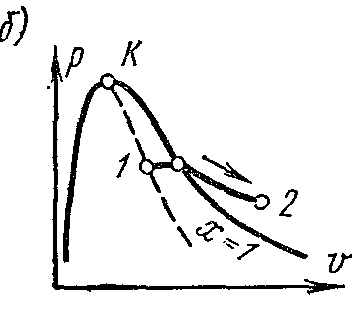
Buharlaşma sürecip – V diyagram
Evre pv- çizelge Sıvı ve buhardan oluşan bir sistemin grafiği, belirli su ve buhar hacimlerinin basınca bağımlılığının bir grafiğidir.
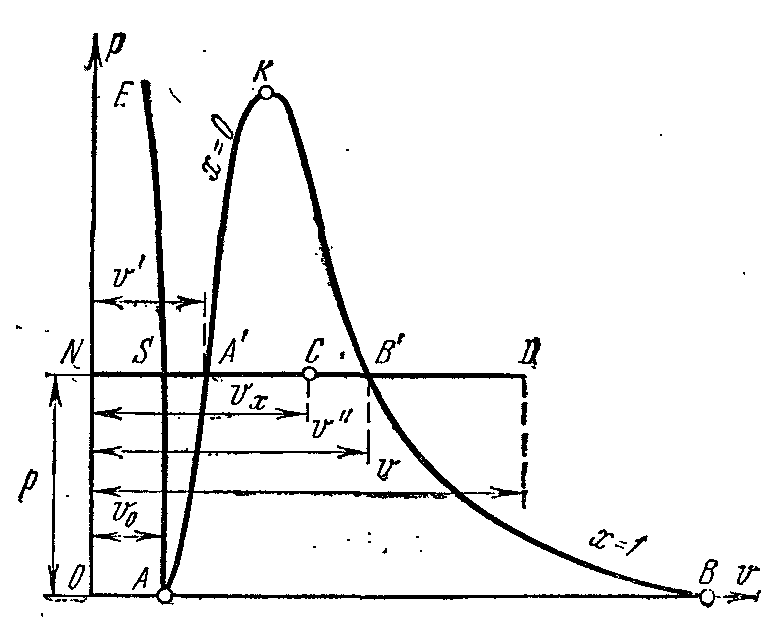
Suyu bir sıcaklıkta bırakın 0 0 İTİBAREN ve biraz baskı? belirli bir hacim kaplar v 0 (segment NS) . Bütün Eğri AE suyun özgül hacminin sıcaklıktaki basınca bağımlılığını ifade eder 0 0 İTİBAREN. Çünkü su hemen hemen sıkıştırılamaz bir maddedir, sonra bir eğridir AE y eksenine neredeyse paraleldir. Suya sabit basınçta ısı verilirse, sıcaklığı yükselir ve özgül hacmi artar. belli bir sıcaklıkta t s su kaynar ve özgül hacmi v’ noktada ANCAK' belirli bir basınçta maksimum değerine ulaşır. Basınç arttıkça kaynayan sıvının sıcaklığı artar. t s ve hacim v’ da artar. bağımlılık grafiği v’ AK akışkan sınır eğrisi olarak adlandırılır. Eğrinin özelliği kuruluk derecesidir. x=0 . Sabit basınçta daha fazla ısı verilmesi durumunda buharlaşma süreci başlayacaktır. Aynı zamanda su miktarı azalır, buhar miktarı artar. Buharlaşmanın sonunda noktada AT' buhar kuru ve doymuş olacaktır. belirli hacim kuru doymuş buhar gösterilir v’’ .
Buharlaşma işlemi sabit bir basınçta devam ederse, sıcaklığı değişmez ve işlem A’ B’ hem izobarik hem de izotermaldir. noktalarda A’ ve B’ madde tek fazlı durumdadır. Ara noktalarda madde su ve buhar karışımından oluşur. Bu cisimlerin karışımına denir. iki fazlı sistem.
Spesifik hacim grafiği v’’ basınçtan bir eğri ile temsil edilir KV, buna buhar sınır eğrisi denir.
Kuru doymuş buhara sabit basınçta ısı verilirse, sıcaklığı ve hacmi artacak ve buhar kuru doymuştan aşırı ısıtılmış duruma geçecektir (nokta D). Her iki eğri AK ve HF diyagramı üç parçaya bölün. Akışkan sınır eğrisinin solunda AK sıvı bölge, sıfır izoterminden önce bulunur. eğriler arasında AK ve HF su ve kuru buhar karışımından oluşan iki fazlı bir sistem vardır. Hakları için HF ve noktadan yukarı İle aşırı ısıtılmış buhar alanı var veya gaz hali gövde. Her iki eğri AK ve HF bir noktada birleşmek İle kritik nokta denir.
Kritik nokta bitiş noktasıdır faz geçişi sıvı - buhar, üçlü noktadan başlayarak. Üstünde kritik nokta maddenin iki fazlı halde bulunması imkansızdır. Hiçbir basınç bir gazı gaza dönüştüremez. sıvı hal kritik üzerindeki sıcaklıklarda.
Su için kritik nokta parametreleri:
t ile =374,12 0 İTİBAREN;v ile =0,003147 m 3 /kilogram;
? ile =22.115 MPa;i ile =2095,2 kJ/kg
s ile =4.424 kJ/(kgK).
İşlemp = const su buharı. İşlem görüntüsüp – V , i – S veT – S diyagramlar.
Üzerinde dır-dir- diyagram doymuş buhar bölgesindeki izobar, buhar sıvısının sınır eğrilerini kesen düz bir çizgi ile temsil edilir. Islak buhara ısı verildiğinde, kuruluk derecesi artar ve (sabit bir sıcaklıkta) kuruya ve daha fazla ısı kaynağı ile aşırı ısıtılmış buhara geçer. Kızgın buhar bölgesindeki izobar, aşağı doğru bir dışbükeyliğe sahip bir eğridir.
Üzerinde pv- diyagram izobarik süreç, ıslak buhar bölgesinde aynı zamanda bir izotermal süreci de gösteren yatay bir düz çizginin bir parçası ile temsil edilir.
Üzerinde Ts- diyagramıslak buhar bölgesinde, izobar düz bir yatay çizgi ile ve aşırı ısıtılmış buhar bölgesinde, aşağı doğru dışbükey bir eğri ile gösterilir. Hesaplama için gerekli tüm miktarların değerleri, doymuş ve aşırı ısıtılmış buhar tablolarından alınmıştır.
Buharın özgül iç enerjisindeki değişim:
Harici iş:
Verilen belirli miktarda ısı:
bu durumda ne zaman q verilen ve iki fazlı durumlar bölgesinde yer alan ikinci noktanın parametrelerini bulmak için gerekli olan ıslak buharın entalpisi için formül uygulanır:
İşlem T = const su buharı. İşlem görüntüsüp – V , i – S veT – S diyagramlar.
izotermal süreç.

Üzerinde dır-dir- diyagramıslak buhar bölgesinde, izoterm izobar ile çakışır ve düz eğimli bir çizgidir. Aşırı ısıtılmış buhar alanında, izoterm, yukarı doğru bir dışbükeyliğe sahip bir eğri ile temsil edilir.
Üzerinde pv- diyagramıslak buhar bölgesinde, izotermal süreç yatay bir düz çizgi ile temsil edilir. Doymuş buhar için bu işlem izobarik olanla çakışır. Aşırı ısınma bölgesinde, buhar basıncı düşer ve süreç, apsis eksenine dışbükey bir eğri ile gösterilir.
![]()
Üzerinde Ts- diyagram izotermal süreç yatay bir segment ile temsil edilir.
İdeal bir gazın iç enerjisinin aksine, su buharının özgül iç enerjisi, potansiyel bileşendeki bir değişikliğin sonucu olarak değişir. T=
const
İşlemdeki toplam özgül ısı miktarı:
Dış iş termodinamiğin birinci yasasından belirlenir:
Mayer formülü.
Termodinamikte özellikle önemli olan, sabit basınçta bir gazın ısı kapasiteleridir, yani. izobarik bir süreçte - ve sabit bir hacimde, yani izokorik bir süreçte. Bu ısı kapasiteleri Mayer formülü ile ilişkilidir.
Isı kapasitesi oranı
Neresi k adyabatik indekstir.
"Soğutma katsayısı" kavramı
COP boyutsuz miktar (genellikle birden fazla), işin enerji verimliliğini karakterize edersoğutma makinesi; orana eşittirsoğutma kapasitesiuygulamada birim zaman başına harcanan enerji (iş) miktarına soğutma döngüsü. Makinenin çalıştığı soğutma çevrimi tipine, ana elemanlarının mükemmelliğine göre belirlenir ve aynı makine için çalışmasının sıcaklık koşullarına bağlıdır.
Ters Carnot çevriminde çalışan ideal bir soğutma makinesinin performans katsayısı:
nerede T dk ve T Maks. sırasıyla daha düşük ve daha yüksek sıcaklık bir döngüde.
Bir hava soğutma grubunun performans katsayısı (şekil),
nerede T 1 ve T 2 sırasıyla adyabatik sıkıştırmanın başlangıç ve bitiş sıcaklıklarıdır;
T 3
ve T 4
genleştiricideki adyabatik genişlemenin başlangıç ve bitiş sıcaklıklarıdır.
p n ve T n)
formüle göre
Rejenerasyonlu bir gaz türbini tesisinin çevrimi
Yakıt yanmalı gaz türbinlerinin ısıl verimliliği p= const artan basınçla artar. Ancak büyümeyle birlikte yakıtın yanması sonunda gazların sıcaklığı da artar. T 3 sonuç olarak, soğutması zor olan türbin kanatları ve nozullar hızla tahrip olur. Gaz türbinlerinin verimliliğini artırmak için çalışma koşullarını kısmen değiştirdiler. Tesislerde ısı geri kazanımı, kompresörde çok kademeli hava sıkıştırması, çok kademeli yanma vb. Bu önemli bir etki sağladı ve tesisatlarda işin ısıya dönüştürülmesinin mükemmellik derecesini artırdı.
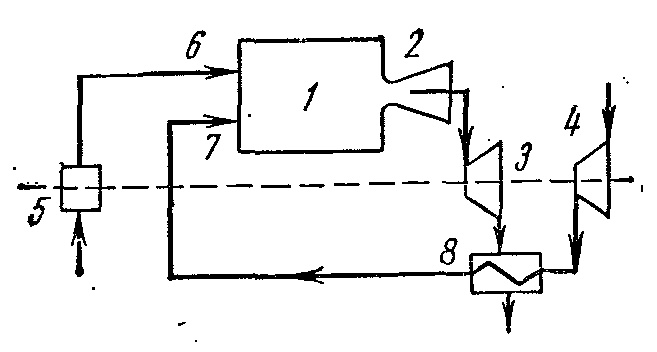
Turbo şarjdan 4 gelen sıkıştırılmış hava rejeneratöre 8 gönderilir, burada yanma odasından 1 çıkan gazlardan meme 2 yoluyla türbin 3'e sabit bir basınçta ısı alır. ve yakıt pompasından 5 gelen yakıt, meme 6 boyunca oda yanmasına 1 gönderilir.
Şemalarda böyle bir kurulumun ideal döngüsü:

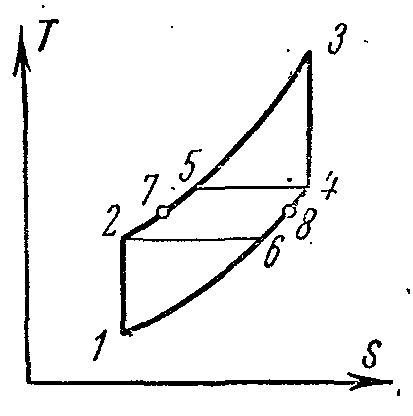
Kompresörde 1-2 adyabatik hava sıkıştırması;
Rejeneratörde 2-5 izobarik ısı beslemesi;
Yanma odasında sabit basınçta 5-3 ısı beslemesi;
3-4 türbin memelerinde yanma ürünlerinin adyabatik genleşmesi;
4-6 rejeneratördeki gazlardan izobarik ısı giderme;
6-1 Rejeneratörün çıkışındaki gazlardan ısı emiciye izobarik ısı giderme.
Rejeneratördeki gazların soğumasının, içine giren havanın sıcaklığına bağlı olduğunu varsayarsak, yani. itibaren T 4 T'ye 6 =T 2 rejenerasyon tamamlandı.
Tam rejenerasyonda çevrimin termal verimliliği, T 4
-T 6
=T 5
-T 2
yer:
nerede
Döngünün ana noktalarındaki sıcaklıklar:
çevrim verimliliği
Buhar santrallerinde spesifik buhar ve ısı tüketimi
Buhar türbini tesislerini ve içindeki bireysel elemanları hesaplarken, belirtilen belirli buhar tüketimini bilmek gerekir. d.
1 MJ başına kilogram cinsinden teorik spesifik buhar ve ısı tüketimi:
Neresi i 1
ve i 2
–entalpi, kJ/kg.
1 kWh başına kilogram cinsinden teorik spesifik buhar ve ısı tüketimi:
Buhar yeniden ısıtma
Bir buhar türbini tesisinin çalışmasına ilişkin bir çalışma, başlangıç basıncındaki artışın ve son basınçtaki düşüşün çevrimin veriminde bir artışa yol açtığını göstermektedir. Bununla birlikte, başlangıç basıncındaki bir artış, buharın nihai nem içeriğini arttırır. Genleşme artışı sonunda buharın nemini azaltmak için başlangıç sıcaklığı onun. Türbin çıkışındaki buhar kuruluğu derecesini arttırmanın yollarından biri, ikincil aşırı ısınmasıdır. İlk basınç ve sıcaklık ile kazandan gelen aşırı ısıtılmış buhar, adyabatik olarak belirli bir basınca genişlediği birkaç aşamadan oluşan ilk türbin silindirine girer. p 1 . Elde edilen buhar, sabit basınçta ikincil aşırı ısınmaya maruz kaldığı özel bir kızdırıcıya çıkarılır. Daha sonra tekrar türbine geri gönderilir ve burada buhar, kondenser basıncına genişlemeye devam eder.

Nokta 1, buharın ilk durumuna karşılık gelir; nokta 2 - ikincil aşırı ısınmadan sonra türbinden sonraki buharın son durumu. Yeniden ısıtmanın başlatılmasının bir sonucu olarak nihai kuruluk derecesi, x 2 önceki x 1 . Ek olarak, ek döngü 7-2-2 '-6-7'deki ortalama ısı kaynağı sıcaklığı daha yüksekse, buharın ikincil aşırı ısınması bir miktar ekonomik etki (% 2-3) sağlar. ortalama sıcaklık tek bir kızgınlık ile bir çevrimde ısı temini ve etki daha büyük olacaktır, ara kızgınlığın ilk ve son noktalarındaki sıcaklık ne kadar yüksekse. Kritik ve kritik üstü basınçlara yakın basınçlarda, bazen iki veya daha fazla ara aşırı ısınma kullanılır. Daha sonra çevrimin ısıl verimi
Birinci ve ikinci türbin silindirlerinde adyabatik ısı düşüşü nerede;
- kazana ve ilk kızdırıcıya verilen ısı miktarı;
İkinci kızdırıcıya sağlanan ısı miktarı.
Spesifik buhar tüketimi






