Tüm elementlerin atomunun elektronik konfigürasyonu. Atomun elektronik kabukları. Atomik Bohr Modelleri
Bir atomdaki elektronun olası durumlarının bilgisi, Klechkovsky kuralı, Pauli ilkesi ve Hund kuralı, bir atomun elektronik konfigürasyonunu düşünmeyi mümkün kılar. Bunun için elektronik formüller kullanılır.
Elektronik formül, bir atomdaki elektronun durumunu belirtir ve ana kuantum sayısı, durumunu ve harfini karakterize eder - yörünge kuantum sayısı. Elektron bulutunun şeklini belirten harfin üst sağ tarafında, belirli bir durumda kaç elektron olduğunu gösteren bir sayı yazılır.
Bir hidrojen atomu için (n \u003d 1, l \u003d 0, m \u003d 0) elektronik formül şöyle olacaktır: 1s 1. Bir sonraki element helyum He'nin her iki elektronu, aynı n, l, m değerleri ile karakterize edilir ve sadece dönüşlerde farklılık gösterir. Helyum atomunun elektronik formülü ls 2'dir. Helyum atomunun elektron kabuğu tamdır ve çok kararlıdır. Helyum asil bir gazdır.
2. periyodun elemanları için (n = 2, l = 0 veya l = 1), önce 2s durumu ve ardından ikinci enerji seviyesinin p-alt seviyesi doldurulur.
Lityum atomunun elektronik formülü: ls 2 2s 1. 2s 1 elektronu atom çekirdeğine daha az bağlıdır (Şekil 6), bu nedenle lityum atomu onu kolayca verebilir (açıkça hatırladığınız gibi, bu işleme oksidasyon denir), Li + iyonuna dönüşür.
Pirinç. 6.
1s ve 2s elektron bulutlarının çekirdekten geçen bir düzlem tarafından kesitleri
Berilyum atomunda dördüncü elektron da 2s durumunu işgal eder: ls 2 2s 2 . Berilyum atomunun iki dış elektronu kolayca ayrılır - bu durumda Be, Be2+ katyonuna oksitlenir.
Bor atomunun 2p durumunda bir elektronu vardır: ls 2 2s 2 2p 1 . Daha sonra, karbon, nitrojen, oksijen ve flor atomlarında (Hund kuralına göre) 2p alt seviyesi doldurulur, bu da asil gaz neonunda biter: ls 2 2s 2 2p 6 .
Belirli bir alt seviyedeki elektronların tek tek kuantum hücrelerini işgal ettiğini vurgulamak istersek, elektronik formülde alt seviyenin tanımı indekse eşlik eder. Örneğin, karbon atomunun elektronik formülü
![]()
3. periyodun elemanları için sırasıyla 3s durumu (n = 3, l = 0) ve 3p alt seviyesi (n = 3, l - 1) doldurulur. 3d-alt düzey (n = 3, l = 2) serbest kalır:
Bazen elektronların atomlardaki dağılımını gösteren diyagramlarda, sadece her enerji seviyesindeki elektron sayısı belirtilir, yani atomların kısaltılmış elektronik formüllerini yazarlar. kimyasal elementler, yukarıdaki tam elektronik formüllerin aksine, örneğin:
Büyük periyotların (4. ve 5.) elementlerinde, Klechkovsky kuralına göre, dış elektron katmanının ilk iki elektronu sırasıyla 4s-(n = 4, l = 0) ve 5s durumlarını (n =) işgal eder. 5, l = 0):
Her büyük periyodun üçüncü elementinden başlayarak, sonraki on elektron sırasıyla önceki 3d ve 4d alt seviyelerine girer (yan alt grupların elementleri için):
Kural olarak, önceki d-alt düzeyi dolduğunda, dış (sırasıyla 4p- ve 5p) p-alt düzeyi dolmaya başlar:
Büyük periyotların elementleri için - 6. ve eksik 7. enerji seviyeleri ve alt seviyeler, kural olarak aşağıdaki gibi elektronlarla doldurulur: ilk iki elektron dış s-alt seviyesine girer, örneğin:
sonraki elektron (La ve Ac için) - önceki d-alt düzeyine:
Ardından sonraki 14 elektron, lantanitler ve aktinitler için dışarıdan üçüncü enerji seviyesine sırasıyla 4f ve 5f alt seviyelerine girer:
Daha sonra ikinci dış enerji seviyesi (d-alt seviye) yan alt grupların elemanları için yeniden oluşmaya başlayacaktır:
Sadece d-alt düzeyi on elektronla tamamen doldurulduktan sonra dış p-alt düzeyi tekrar doldurulacaktır:
Sonuç olarak, D. I. Mendeleev tablosunun dönemlerine göre element atomlarının elektronik konfigürasyonlarını göstermenin farklı yollarını bir kez daha ele alacağız.
1. periyodun elementlerini düşünün - hidrojen ve helyum.

Atomların elektronik formülleri, elektronların enerji seviyeleri ve alt seviyeleri üzerindeki dağılımını gösterir.
Atomların grafiksel elektronik formülleri, elektronların dağılımını sadece seviyelere ve alt seviyelere göre değil, aynı zamanda kuantum hücreleri (atomik yörüngeler).

Bir helyum atomunda ilk elektron katmanı tamamlanmıştır - 2 elektronu vardır.
Hidrojen ve helyum s elementleridir; bu atomların ls-alt seviyesi elektronlarla doludur.
2. periyodun tüm elemanları için, ilk elektron katmanı doldurulur ve elektronlar 2s- ve 2p durumlarını en az enerji ilkesine (ilk S- ve sonra p) ve Pauli ve Hund kurallarına göre doldurur ( Tablo 2).
Neon atomunda ikinci elektron katmanı tamamlandı - 8 elektronu var.
Tablo 2
2. periyottaki elementlerin atomlarının elektron kabuklarının yapısı

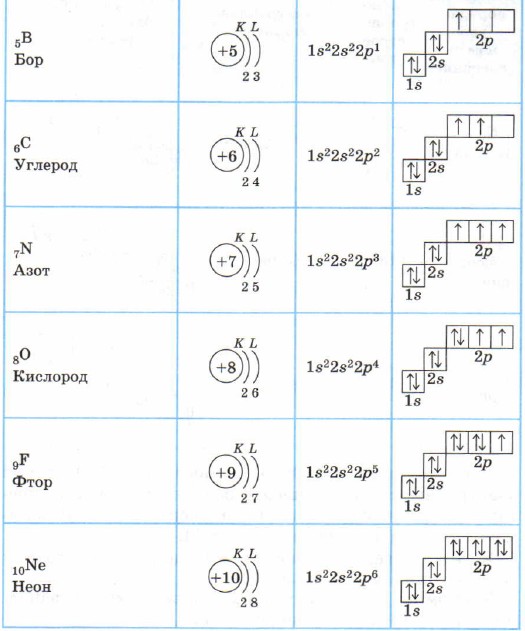
Lityum Li, berilyum Be - s-elementleri.
Bor B, karbon C, nitrojen N, oksijen O, flor F, neon Ne p elementleridir, bu atomların p-alt seviyesi elektronlarla doldurulur.
3. periyodun element atomları için, birinci ve ikinci elektron katmanları tamamlanır; bu nedenle, elektronların 3s, 3p ve 3d durumlarını işgal edebileceği üçüncü elektron katmanı doldurulur (Tablo 3).
Tablo 3
3. periyottaki elementlerin atomlarının elektron kabuklarının yapısı
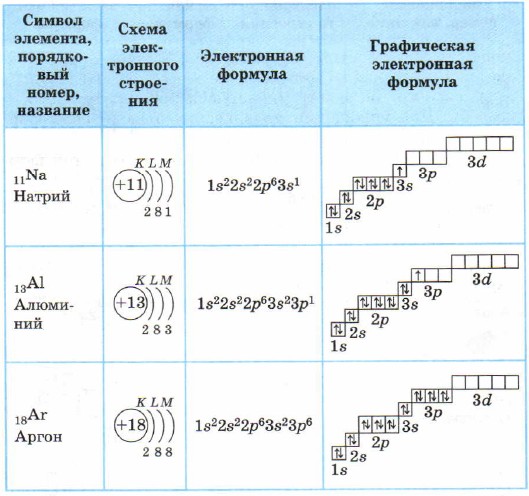
Magnezyum atomunda 3s alt seviyesi tamamlanır. Sodyum Na ve magnezyum Mg s elementleridir.
Alüminyum ve onu takip eden elementler için 3p alt seviyesi elektronlarla doldurulur.
Argon atomunda dış katmanda (üçüncü elektron katmanı) 8 elektron vardır. Dış katman olarak tamdır, ancak toplamda üçüncü elektron katmanında zaten bildiğiniz gibi 18 elektron olabilir, bu da 3. periyodun elemanlarının boş bir 3d durumuna sahip olduğu anlamına gelir.
Alüminyum Al'den argon Ar'a kadar tüm elementler p elementleridir.
s- ve p-elementleri Periyodik sistemdeki ana alt grupları oluşturur.
4. periyodun elementlerinin atomları - potasyum ve kalsiyum - dördüncü bir enerji seviyesine sahiptir, 48-alt seviye doldurulur (Tablo 4), çünkü Klechkovsky kuralına göre 3d-alt seviyeden daha az enerjiye sahiptir.
Tablo 4
4. periyodun elementlerinin atomlarının elektron kabuklarının yapısı
![]()
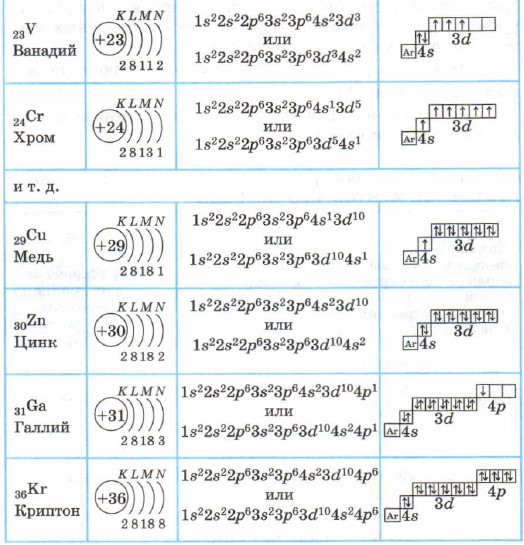
4. periyodun elementlerinin atomlarının grafik elektronik formüllerini basitleştirmek için:
Potasyum K ve kalsiyum Ca ana alt gruplarda yer alan s elementleridir. Skandiyum Sc'den çinko Zn'ye kadar olan atomlarda, 3d alt seviye elektronlarla doldurulur. Bunlar 3 boyutlu öğelerdir. İkincil alt gruplara dahildirler, ön-dış elektron katmanına sahiptirler, geçiş elementleri olarak adlandırılırlar.
Krom ve bakır atomlarının elektron kabuklarının yapısına dikkat edin. Onlarda, 4s'den 3d alt seviyesine bir elektronun "arızası" meydana gelir, bu, sonuçta ortaya çıkan 3d 5 ve 3d 10 elektronik konfigürasyonlarının daha yüksek enerji kararlılığı ile açıklanır:
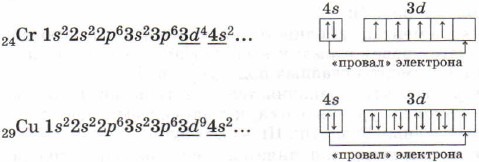
Çinko atomunda üçüncü enerji seviyesi tamamlanır, tüm alt seviyeler doldurulur - 3s, 3p ve 3d, toplamda 18 elektronları vardır.
Çinkodan sonraki elementlerde dördüncü enerji seviyesi olan 4p alt seviyesi dolmaya devam eder.
Galyum Ga'dan kripton Kr'ye kadar olan elementler p elementleridir.
Kripton atomu Kr'nin dış tabakası (dördüncü) tamdır ve 8 elektrona sahiptir. Ama sadece dördüncü elektron katmanında bildiğiniz gibi 32 elektron olabilir; kripton atomunun 4d ve 4f durumları hala boş kalır.
5. periyodun unsurları için, Klechkovsky kuralına göre alt seviyeler aşağıdaki sırayla doldurulur: 5s ⇒ 4d ⇒ 5p. Ayrıca 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag'deki elektronların “arızası” ile ilgili istisnalar da vardır.
6. ve 7. periyotlarda, f-elemanları, yani dışarıdaki üçüncü enerji seviyesinin sırasıyla 4f- ve 5f-alt seviyelerinin doldurulduğu elemanlar ortaya çıkar.
4f elementlerine lantanitler denir.
5f elementlerine aktinitler denir.
6. periyodun elementlerinin atomlarındaki elektronik alt seviyelerin doldurulma sırası: 55 Cs ve 56 Ba - bs-elemanları; 57 La ...6s 2 5d 1 - 5d eleman; 58 Ce - 71 Lu - 4f elemanları; 72 Hf - 80 Hg - 5d elementler; 81 Tl - 86 Rn - br elemanları. Ancak burada bile, enerji alt seviyelerinin doldurulma sırasının "ihlal edildiği", örneğin yarı ve tamamen doldurulmuş f-alt seviyelerinin daha büyük enerji kararlılığı ile ilişkili olan unsurlar vardır, yani. nf 7 ve nf 14 .
Atomun hangi alt seviyesinin en son elektronlarla dolu olduğuna bağlı olarak, zaten anladığınız gibi tüm elementler dörde bölünür. elektronik aile veya blok (Şekil 7):

Pirinç. 7.
Periyodik sistemin (tablo) element bloklarına bölünmesi
- s-elemanları; atomun dış seviyesinin s-alt seviyesi elektronlarla doldurulur; s-elemanları arasında hidrojen, helyum ve grup I ve II'nin ana alt gruplarının elemanları bulunur;
- p-elemanları; atomun dış seviyesinin p-alt seviyesi elektronlarla doldurulur; p-elemanları, III-VIII gruplarının ana alt gruplarının elemanlarını içerir;
- d-elemanları; atomun dış öncesi seviyesinin d-alt seviyesi elektronlarla doldurulur; d-elemanları, I-VIII gruplarının ikincil alt gruplarının elemanlarını, yani, s- ve p-elementleri arasında yer alan onyıllar arası büyük periyotların elemanlarını içerir. Bunlara geçiş elemanları da denir;
- f-elemanları; atomun üçüncü dış seviyesinin f-alt seviyesi elektronlarla doldurulur; bunlara lantanitler ve aktinitler dahildir.
§ 3'teki sorular ve görevler
- Aşağıdaki kimyasal elementlerin atomlarının elektronik yapısının, elektronik formüllerinin ve grafik elektronik formüllerinin diyagramlarını yapın:
- a) kalsiyum;
b) demir;
c) zirkonyum;
d) niyobyum;
e) hafniyum;
e) altın. - Uygun soy gazın sembolünü kullanarak 110 numaralı elementin elektronik formülünü yazın.
- Elektronun "dalması" nedir? Bu fenomenin gözlemlendiği elementlere örnekler verin, elektronik formüllerini yazın.
- Bir kimyasal elementin belirli bir elektronik aileye ait olduğu nasıl belirlenir?
- Kükürt atomunun elektronik ve grafik elektronik formüllerini karşılaştırın. Ne Ek Bilgiler son formülü içeriyor mu?
Bu derste atomun elektron kabuklarını, Bohr'un atom modellerini öğreneceksiniz. yapıyı tekrar ediyorsun atom çekirdeği, daha sonra atomun elektron kabuklarının, elektronik seviyelerin ve alt seviyelerin koşullu görüntülerinin incelenmesinde modern görüşlerin dikkate alınmasına devam edin. Bohr'un atom modellerini de dikkate alacaksınız.
Konu: Periyodik yasa ve D. I. Mendeleev'in kimyasal elementlerinin periyodik sistemi
Ders: Bir atomun elektronik kabukları. Atomik Bohr Modelleri
1. N. Bohr'un Postülaları
Atom çekirdeği protonlardan - pozitif yüklü parçacıklardan ve nötronlardan - yükü olmayan parçacıklardan oluşur. Bu dersimizde bir atomun elektron kabuğunun yapısına bakacağız.
Pirinç. 1. Atomun gezegen modeli
1913'te Danimarkalı fizikçi Niels Bohr, atomun yapı olarak yapıya benzer olduğunu öne sürdü. Güneş Sistemi. Güneş, atomun içinde olduğu kadar güneş sisteminin içinde de atomun tüm kütlesinin yoğunlaştığı devasa bir çekirdektir. Ve bu çekirdeğin etrafında, güneşin etrafındaki gezegenler gibi, elektronlar da döner. Şekil 1. Bir elektronun kütlesi, bir proton veya bir nötrondan 1832 kat daha azdır. Niels Bohr'un modeli, öğretmeni Ernest Rutherford'un modeline dayanıyordu.
Niels Bohr, bir atomdaki elektronların rastgele hareket etmediğini, belirli yörüngelerde hareket ettiğini öne sürdü. Kanıtsız kabul edilen, yani iki önerme öne sürdü.
Niels Bohr'un Postülaları.
1. Atomda elektronun enerji yaymadığı yörüngeler vardır. Bu yörüngelere sabit denir.
2. Radyasyon, yalnızca bir elektron sabit bir yörüngeden diğerine atladığında meydana gelir.
2. Atomun elektron kabuğunun yapısı
Göre kuantum teorisi Bir atomun yapısı, bir atomdaki tüm elektronlar enerji seviyeleri veya yörüngeler boyunca hareket eder. Bu seviyeler alt seviyelerden oluşur. Buna karşılık, alt seviyeler atomik orbitallerden oluşur. Bir atomun elektron kabuğunun çekirdeğin üzerinde duran bir ev olduğunu varsayarsak, böyle bir yapıyı hayal etmek kolaydır. Ev birçok kattan oluşur - seviyelerden. Her seviyenin alt seviyeleri vardır - bunlar dairelerdir. Dairelerin atomik yörüngeleri, yani odaları vardır. Bir elektronun yörüngelerdeki belirli konumunu belirleyemeyiz, ancak atomik yörüngelerde olma olasılığını belirleyebiliriz.
Seviyeler.
Bohr modelindeki elektronik yörüngeler tam sayılarla gösterilir: 1, 2, 3, 4, ... ve n'ye kadar böyle devam eder veya Latin harfleriyle alfabetik olarak K, L, M, N, O P, Q harfiyle başlar Çekirdeğe en yakın seviyeden başlayarak. Bundan sonra, bu yörüngelere seviyeler diyeceğiz.
Alt düzeyler.
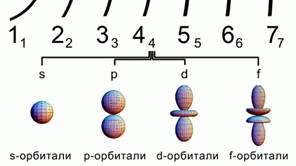
Pirinç. 2. Atomik orbitallerin şekilleri
Seviyeler sırayla alt seviyelerden oluşur. Her seviyedeki alt seviye sayısı, seviye numarasına eşittir. Alt seviyelerin adları vardır.
Her seviyenin 1. alt seviyesi S olarak adlandırılır,
Her seviyenin 2. alt düzeyine P denir,
Her seviyenin 3. alt seviyesi d olarak adlandırılır,
Her seviyenin 4. alt seviyesi f olarak adlandırılır.
Yörüngeler farklı şekillerde gelir.
s - küresel yörünge, p-orbital sekiz hacim şeklindedir. d ve f orbitalleri daha da fazladır karmaşık şekil. İncir. 2.
Tüm bu rakamlar alanı özetliyor büyük ihtimalle bir atomda elektron bulmak.
Bir atomun dalga modeli değil fiziksel model, ve yakında soyut veya matematiksel model bir atomun yapısı, içindeki elektronların düzeni.
S - elemanlar.
Bunlar dış düzeyde sadece s-elektron içeren elementlerdir.
Bunlar p - elektron ise, o zaman bu p - öğe.
Enerji seviyesi çekirdekten ne kadar uzaktaysa, o kadar fazla elektron barındırabilir, çünkü her bir sonraki enerji seviyesi daha fazla sayıda alt seviyeye sahiptir. Yani her N seviyesi n2 alt seviyeye sahip olabilir. Bu nedenle, elektronlar 2n2'yi barındırabilir. Neden n2'yi 2 ile çarptık? Çünkü her atomik orbitalde 2'den fazla elektron olamaz.
Her seviyedeki en büyük elektron sayısı Tablo 1'de verilmiştir.
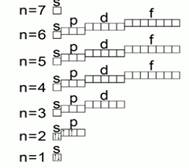
Pirinç. 3. Yörünge diyagramı
Elektronları atomik seviyelerde, alt seviyelerde ve orbitallerde nasıl yerleştireceğimizi öğrenmek için tüm bu bilgilere ihtiyacımız var.
3. Kuantum diyagramı
Elektronik seviyelerin ve alt seviyelerin koşullu bir görüntüsü vardır. Bu bir yörünge veya kuantum diyagramıdır. Böyle bir diyagramda orbitaller geleneksel olarak kareler ve elektronlar oklar olarak gösterilir. Pirinç. 3. Bir hücrede iki ok varsa, bunlar farklı yönleri gösteren oklarla gösterilecektir. Elektronların bu özelliğine spin denir.
Tüm atomik orbitalleri elektronlarla doldurduktan sonra, elementin "elektronik pasaportunu" veya elektronik formülünü yazmalısınız. Bunu yapmak için, her bir enerji seviyesini 1, 2, 3, ..., alt seviyeyi s, p, d harfleriyle belirlemeniz gerekir ...
Bir güç olarak, belirli bir alt düzeydeki elektron sayısını çıkarın.
4. Azot atomunun elektronik yapısı
Örnek 1.

Pirinç. 4. Azotun elektronik formülü
Atom numarası 7 olan kimyasal elementin elektronik formülünü yazın.
Böyle bir elementin atomunun 7 elektronu olmalıdır. Alt 1'lerden başlayarak orbitalleri elektronlarla dolduralım.
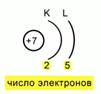
Pirinç. 5. Bir atomdaki elektronların düzeninin şeması
Aşağıdaki elektronik konfigürasyon elde edilecektir: 1s22s22p3.Fig.4.
Bundan sonra, elektronların yerini enerji seviyelerine göre belirlemeniz gerekir. Bunu yapmak için çekirdeği şematik olarak göstermeniz, yükünü belirtmeniz ve sayıyı belirlemeniz gerekir. enerji seviyeleri. Azotun sadece 2 tanesine sahip olduğunu hatırlatmama izin verin, 2 yay çiziyoruz ve bu yayların altına üzerlerinde bulunan elektronların sayısını yazıyoruz. Sonra atomda böyle bir elektronik düzenleme şeması elde ederiz. Şek.5.
5. Argon atomunun elektronik yapısı
Örnek #2.
Atom numarası 18 olan kimyasal elementin elektronik formülünü yazın.
İlk durumda olduğu gibi devam ederek elektronları atomik orbitallerde düzenleyeceğiz. 1s22s22p63s23p6. Bu argon elementidir. Şekil 6. Yunancadan "etkin değil" olarak çevrilmiştir. Herhangi bir kimyasal element ile etkileşime girmediği için bu ismi almıştır.
Tamamlanmış bir dış elektron kabuğuna sahip elementler.
Asil veya inert gazların alt grubuna dahildir. Eylemsizlikleri atomlarının yapısından kaynaklanır. Bu gazların tam bir dış enerji kabuğu vardır - ns2np6. İnert gazlar tek atomlu bir molekül oluşturur. Doğadaki diğer tüm gazların sadece iki atomlu bir molekülü vardır. Örneğin, O2, H2 Tamamlanmış bir elektron kabuğuna sahip kimyasal elementlerin kararlılığının nedeni henüz net değil. Ancak kimyacılar bunu basitçe bir doğa kanunu olarak kabul ederler. Diğer tüm elemanlar dış kabuklarını tamamlama eğiliminde olacaktır.
6. Elektron orbitallerinin tanımlarının etimolojisi
Belirli seviyelerin alt seviyelerinin neden belirli harflerle adlandırıldığını bilmek ilginç olacaktır. ingilizce alfabe. Her atom enerji yayar. Bu enerji, atomların emisyon spektrumlarında sabitlenebilir. Atomların farklı emisyon spektrumları farklı tür. Onların çizgileri farklıdır. Bu yüzden en dar keskin çizgilere s harfi deniyordu. İtibaren ingilizce kelime"top".
s - alt seviye, "keskin" satırdan sonra adlandırılır
p - alt düzey "ana" satırın adını taşır
d - alt seviye, "yaygın", "bulanık" (yaygın) satırından sonra adlandırılır
f - alt seviye, "temel" satırın adını taşır
7. İnert gazlar hakkında bazı bilgiler


Soy gazlar kimyasal eylemsizliklerinden dolayı kimyada uzun süredir bilinmiyordu. Sadece 1892'de elde edilen ilk soy gaz argonuydu. D. Rayleigh tarafından alındı. Azot ile deneyler sırasında aldı. D. Rayleigh, havadan azot elde edilirse, bu azot gazının çeşitli kimyasal deneylerde elde edilen azottan daha büyük bir kütleye sahip olacağını fark etti. Havadan 1 litre nitrojen elde edilirse kütlesi 1.2572 gr, azotlu bileşiklerin ayrışmasından nitrojen elde edilirse kütlesi 1.2505 gr olur, böyle bir fark nereden geliyor? Birçok bilim adamı, sadece bir deney yaptıklarını düşündü ve bu şekilde elde edilen havayı tartmayı bıraktı. D. Rayleigh, arkadaşı W. Ramsay ile birlikte. Birçok deney yaptılar ve havadan elde edilen nitrojen gazının bileşiminde hidrojenden 20 kat daha ağır olan başka bir gaz içerdiğini doğruladılar. Argon ilk kez bu şekilde izole edildi. XX yüzyılın 60'larına kadar, tek bir inert gaz bileşiği elde edilmedi. Şimdi, flor ve oksijen ile inert gaz bileşiklerinin yapay olarak nasıl elde edileceğini öğrendiler. Sıradan bir akkor ampulü sökerseniz, argon gazı ile karşılaşırsınız. Ama bunu yapmamalısın çünkü incinebilirsin.
Dersi özetlemek.
Bu derste atomun elektron kabuklarını, Bohr'un atom modellerini öğrendiniz. Atomun elektron kabuklarının incelenmesinde modern görüşler olarak kabul edilen atom çekirdeğinin yapısını tekrarladınız, elektronik seviyelerin ve alt seviyelerin koşullu görüntüleri. Bohr'un atom modelleri olarak kabul edildi. Çekirdeğin yapısını 11. sınıf kimya derslerinde daha ayrıntılı olarak ele alacağız.
1. Rudzitis G. E. İnorganik ve organik Kimya. 8. sınıf: ders kitabı Eğitim Kurumları: temel seviye / G.E. Rudzitis, F.G. Feldman. M.: Aydınlanma. 2011 176 s.: hasta.
2. Popel P. P. Kimya: 8. sınıf: genel eğitim kurumları için bir ders kitabı / P. P. Popel, L.S. Krivlya. - K.: Bilgi Merkezi "Akademi", 2008.-240 s.: hasta.
3. Gabrielyan OS Kimya. 9. sınıf Ders kitabı. Yayımcı: Drofa.: 2001. 224'ler.
1. Chemport. ru.
1. No. 4-6 (s. 138) Rudzitis G. E. İnorganik ve organik kimya. 8. Sınıf: eğitim kurumları için ders kitabı: temel seviye / G. E. Rudzitis, F. G. Feldman. M.: Aydınlanma. 2011 176 s.: hasta.
2. Atomların yapısından yola çıkarak kimyasal elementlerin özelliklerinin periyodikliğinin nedenini açıklayınız.
3. İnert gazların keşfinin tarihi hakkında kısa bir rapor hazırlayın.
Atom çekirdeği protonlardan - pozitif yüklü parçacıklardan ve nötronlardan - yükü olmayan parçacıklardan oluşur. Bu dersimizde bir atomun elektron kabuğunun yapısına bakacağız.
Pirinç. 1. Atomun gezegen modeli
1913'te Danimarkalı fizikçi Niels Bohr, atomun yapı olarak güneş sisteminin yapısına benzer olduğunu öne sürdü. Güneş, atomun içinde olduğu kadar güneş sisteminin içinde de atomun tüm kütlesinin yoğunlaştığı devasa bir çekirdektir. Ve bu çekirdeğin etrafında, güneşin etrafındaki gezegenler gibi, elektronlar da döner. Şekil 1. Bir elektronun kütlesi, bir proton veya bir nötrondan 1832 kat daha azdır. Niels Bohr'un modeli, öğretmeni Ernest Rutherford'un modeline dayanıyordu.
Niels Bohr, bir atomdaki elektronların rastgele hareket etmediğini, belirli yörüngelerde hareket ettiğini öne sürdü. Kanıtsız kabul edilen, yani iki önerme öne sürdü.
Niels Bohr'un Postülaları.
1. Atomda elektronun enerji yaymadığı yörüngeler vardır. Bu yörüngelere sabit denir.
2. Radyasyon, yalnızca bir elektron sabit bir yörüngeden diğerine atladığında meydana gelir.
Atom yapısının kuantum teorisine göre, bir atomdaki tüm elektronlar enerji seviyeleri veya yörüngeler boyunca hareket eder. Bu seviyeler alt seviyelerden oluşur. Sırayla, alt seviyeler atomik orbitallerden oluşur. Bir atomun elektron kabuğunun çekirdeğin üzerinde duran bir ev olduğunu varsayarsak, böyle bir yapıyı hayal etmek kolaydır. Ev birçok kattan oluşur - seviyelerden. Her seviyenin alt seviyeleri vardır - bunlar dairelerdir. Dairelerin atomik yörüngeleri vardır, yani. Odalar. Bir elektronun yörüngelerdeki belirli konumunu belirleyemeyiz, ancak atomik yörüngelerde olma olasılığını belirleyebiliriz.
Seviyeler.
Bohr modelindeki elektronik yörüngeler tamsayılarla gösterilir: 1, 2, 3, 4, ... ve bu şekilde devam edene kadar n, veya Latin harfleriyle alfabetik olarak K, L, M, N, O P, Q harfleriyle başlar. Çekirdeğe en yakın seviyeden başlayarak. Bundan sonra, bu yörüngelere seviyeler diyeceğiz.
Alt düzeyler.

Pirinç. 2. Atomik orbitallerin şekilleri
Seviyeler sırayla alt seviyelerden oluşur. Her seviyedeki alt seviye sayısı, seviye numarasına eşittir. Alt seviyelerin adları vardır.
Her seviyenin 1. alt seviyesi S olarak adlandırılır,
Her seviyenin 2. alt düzeyine P denir,
Her seviyenin 3. alt seviyesi d olarak adlandırılır,
Her seviyenin 4. alt seviyesi f olarak adlandırılır.
Yörüngeler farklı şekillerde gelir.
s-yörüngesi küreseldir, p-yörüngesi sekiz hacimli bir şekle sahiptir.d ve f-yörüngeleri daha da karmaşıktır. İncir. 2.
Bütün bu rakamlar, bir atomda elektron bulma olasılığının en yüksek olduğu bölgeyi özetlemektedir.
Bir atomun dalga modeli fiziksel bir model değil, daha ziyade bir atomun yapısının soyut veya matematiksel bir modeli, içindeki elektronların düzenidir.
S - elemanlar.
Bunlar dış düzeyde sadece s-elektron içeren elementlerdir.
Bunlar p - elektron ise, o zaman bu p - öğe.
Enerji seviyesi çekirdekten ne kadar uzaktaysa, o kadar fazla elektron barındırabilir, çünkü her bir sonraki enerji seviyesi daha fazla sayıda alt seviyeye sahiptir. Yani her n seviyede n 2 yörünge olabilir. Bu nedenle, elektronlar 2n 2'yi barındırabilir. Neden n 2'yi 2 ile çarptık? Çünkü her atomik orbitalde 2'den fazla elektron olamaz.
Her seviyedeki en büyük elektron sayısı Tablo 1'de verilmiştir.

Pirinç. 3. Yörünge diyagramı
Elektronları atomik seviyelerde, alt seviyelerde ve orbitallerde nasıl yerleştireceğimizi öğrenmek için tüm bu bilgilere ihtiyacımız var.
Elektronik seviyelerin ve alt seviyelerin koşullu bir görüntüsü vardır. Bu bir yörünge veya kuantum diyagramıdır. Böyle bir diyagramda orbitaller geleneksel olarak kareler ve elektronlar oklar olarak gösterilir. Pirinç. 3. Bir hücrede iki ok varsa, bunlar farklı yönleri gösteren oklarla gösterilecektir. Elektronların bu özelliğine denir. döndürmek.
Tüm atomik orbitalleri elektronlarla doldurduktan sonra, elementin "elektronik pasaportunu" veya elektronik formülünü yazmalısınız. Bunu yapmak için, her bir enerji seviyesini 1, 2, 3, ..., alt seviyeyi s, p, d harfleriyle belirlemeniz gerekir ...
Bir güç olarak, belirli bir alt düzeydeki elektron sayısını çıkarın.
Örnek 1.

Pirinç. 4. Azotun elektronik formülü
Atom numarası 7 olan kimyasal elementin elektronik formülünü yazın.
Böyle bir elementin atomunun 7 elektronu olmalıdır. Alt 1'lerden başlayarak orbitalleri elektronlarla dolduralım.

Pirinç. 5. Bir atomdaki elektronların düzeninin şeması
Aşağıdaki elektronik konfigürasyon elde edilecektir: 1s 2 2s 2 2p 3. Şekil.4.
Bundan sonra, elektronların yerini enerji seviyelerine göre belirlemeniz gerekir. Bunu yapmak için çekirdeği şematik olarak göstermeniz, yükünü belirtmeniz ve enerji seviyelerinin sayısını belirlemeniz gerekir. Azotun sadece 2 tanesine sahip olduğunu hatırlatmama izin verin, 2 yay çiziyoruz ve bu yayların altına üzerlerinde bulunan elektronların sayısını yazıyoruz. Sonra atomda böyle bir elektronik düzenleme şeması elde ederiz. Şek.5.
Örnek #2.
Atom numarası 18 olan kimyasal elementin elektronik formülünü yazın.
İlk durumda olduğu gibi devam ederek elektronları atomik orbitallerde düzenleyeceğiz. 1s 2 2s 2 2p 6 3s 2 3p 6 . Bu argon elementidir. Şekil 6. Yunancadan "etkin değil" olarak çevrilmiştir. Herhangi bir kimyasal element ile etkileşime girmediği için bu ismi almıştır.
Tamamlanmış bir dış elektron kabuğuna sahip elementler.
Asil veya inert gazların alt grubuna dahildir. Eylemsizlikleri atomlarının yapısından kaynaklanır. Bu gazların tam bir dış enerji kabuğu vardır - ns 2np 6.İnert gazlar tek atomlu bir molekül oluşturur. Doğadaki diğer tüm gazların sadece iki atomlu bir molekülü vardır. Örneğin, O 2 , H 2 Tamamlanmış bir elektron kabuğuna sahip kimyasal elementlerin kararlılığının nedeni henüz net değil. Ancak kimyacılar bunu basitçe bir doğa kanunu olarak kabul ederler. Diğer tüm elemanlar dış kabuklarını tamamlama eğiliminde olacaktır.
Belirli seviyelerin alt seviyelerinin neden İngiliz alfabesinin belirli harfleriyle adlandırıldığını bilmek ilginç olacaktır. Her atom enerji yayar. Bu enerji, atomların emisyon spektrumlarında sabitlenebilir. Atomların farklı emisyon spektrumları farklı bir forma sahiptir. Onların çizgileri farklıdır. Bu yüzden en dar keskin çizgilere s harfi deniyordu. İngilizce "top" kelimesinden.
s- "keskin" satırın adını taşıyan alt düzey
p- alt düzeyi, "ana" satırından sonra adlandırılır
d- alt düzey, "yaygın", "bulanık" (yaygın) satırından sonra adlandırılır
f- alt düzeyi, "temel" satırından sonra adlandırılır


Soy gazlar kimyasal eylemsizliklerinden dolayı kimyada uzun süredir bilinmiyordu. Sadece 1892'de elde edilen ilk soy gaz argonuydu. D. Rayleigh tarafından alındı. Azot ile deneyler sırasında aldı. D. Rayleigh, havadan azot elde edilirse, bu azot gazının çeşitli kimyasal deneylerde elde edilen azottan daha büyük bir kütleye sahip olacağını fark etti. Havadan 1 litre nitrojen elde edilirse kütlesi 1.2572 gr, azotlu bileşiklerin ayrışmasından nitrojen elde edilirse kütlesi 1.2505 gr olur, böyle bir fark nereden geliyor? Birçok bilim adamı, sadece bir deney yaptıklarını düşündü ve bu şekilde elde edilen havayı tartmayı bıraktı. D. Rayleigh, arkadaşı W. Ramsay ile birlikte. Birçok deney yaptılar ve havadan elde edilen nitrojen gazının bileşiminde hidrojenden 20 kat daha ağır olan başka bir gaz içerdiğini doğruladılar. Argon ilk kez bu şekilde izole edildi. XX yüzyılın 60'larına kadar, tek bir inert gaz bileşiği elde edilmedi. Şimdi, flor ve oksijen ile inert gaz bileşiklerinin yapay olarak nasıl elde edileceğini öğrendiler. Sıradan bir akkor ampulü sökerseniz, argon gazı ile karşılaşırsınız. Ama bunu yapmamalısın çünkü incinebilirsin.
Dersi özetlemek.
Bu derste atomun elektron kabuklarını, Bohr'un atom modellerini öğrendiniz. Atomun elektron kabuklarının incelenmesinde modern görüşler olarak kabul edilen atom çekirdeğinin yapısını tekrarladınız, elektronik seviyelerin ve alt seviyelerin koşullu görüntüleri. Bohr'un atom modelleri olarak kabul edildi. 11. sınıf kimya derslerine daha detaylı bakacağız.
1. Rudzitis G.E. İnorganik ve organik kimya. 8. sınıf: eğitim kurumları için ders kitabı: temel seviye / G. E. Rudzitis, F.G. Feldman. M.: Aydınlanma. 2011 176 s.: hasta.
2. Popel P.P. Kimya: 8. sınıf: genel eğitim kurumları için bir ders kitabı / P.P. Popel, L.S. Krivlya. -K.: IC "Akademi", 2008.-240 s.: hasta.
3. Gabrielyan O.S. Kimya. 9. sınıf Ders kitabı. Yayımcı: Drofa.: 2001. 224'ler.
1. No. 4-6 (s. 138) Rudzitis G.E. İnorganik ve organik kimya. 8. sınıf: eğitim kurumları için ders kitabı: temel seviye / G. E. Rudzitis, F.G. Feldman. M.: Aydınlanma. 2011 176 s.: hasta.
2. Atomların yapısından yola çıkarak kimyasal elementlerin özelliklerinin periyodikliğinin nedenini açıklayınız.
3. İnert gazların keşfinin tarihi hakkında kısa bir rapor hazırlayın.






