Entalpi hesabı. Entalpi. fiziksel özellikler
Kimyasal tepkimeler ve tepkimeler sırasındaki entalpi değişimlerini inceleyen kimya dalı. faz dönüşümleri termokimya denir. Entalpiyi belirlemek için kullanılan deneysel tekniğe kalorimetri denir.
KİMYASAL TEPKİME SIRASINDA ENTALPİ DEĞİŞİMİ
Birçok kimyasal reaksiyona entalpi değişikliği eşlik eder. Bu, reaksiyon ürünlerinin toplam entalpisinin, reaktanların toplam entalpisinden farklı olduğu anlamına gelir. Entalpideki değişim ilişki tarafından belirlenir
nerede tepkenlerin entalpisi ve ürünlerin entalpisidir. Miktar bazen reaksiyon ısısı olarak adlandırılır.
Ürünlerin entalpisi, reaktanların entalpisinden küçükse, reaksiyona ekzotermik denir (Şekil 5.4). Reaksiyon sırasında entalpideki azalma, negatif bir değere karşılık gelir. Ekzotermik reaksiyon sırasında kaybedilen enerji önce reaksiyon karışımına girer. Sonuç olarak, reaksiyon karışımının sıcaklığı yükselir. Daha sonra bu enerji çevreye aktarılır ve son olarak reaksiyon tamamen tamamlandığında reaksiyon karışımının sıcaklığı tekrar düşer.
Ürünlerin entalpisi, girenlerin entalpisinden büyükse, reaksiyona endotermik denir. Reaksiyon sırasında entalpideki artış, pozitif bir AH değerine karşılık gelir. Reaksiyon sırasında emilen enerji önce reaksiyon karışımından alınır. Sonuç olarak, reaksiyon karışımının sıcaklığı düşer. Ortam sıcaklığı artık reaksiyon karışımının sıcaklığından daha yüksek olduğundan, ısı enerjisi ortamdan reaksiyon karışımına aktarılır ve sonunda reaksiyon tamamlandığında reaksiyon karışımının sıcaklığı tekrar yükselir.
Bir maddenin oluşumunun standart entalpisi (ısı) standart koşullar altında basit maddelerden 1 mol kimyasal bileşik oluşturma reaksiyonunun termal etkisidir.: T=289 K, P=1 atm=101325 Pa.
oluşum ısıları basit maddeler sıfıra eşittir.
ν ben , ν j – stokiyometrik katsayılar reaksiyon denkleminde karşılık gelen maddelerin önünde.
Maddelerin standart yanma entalpilerine (ısıları) göre
Bir maddenin standart yanma ısısı (ısı) 1 mol kimyasal bileşiğin standart koşullar altında tamamen yanması reaksiyonunun termal etkisidir..
![]()
Daha yüksek oksitlerin (CO 2 ve H 2 O dahil) yanma ısılarının sıfır olduğu varsayılır.
Termodinamiğin ikinci yasası, kendiliğinden bir sürecin olasılığını, yönünü ve derinliğini belirler.
kendiliğinden süreç - herhangi bir dış etki olmaksızın ilerleyen ve sistemi bir denge durumuna yaklaştıran bir süreç.
Termodinamik olarak tersinir süreç - sistemde ve çevrede herhangi bir değişiklik olmaksızın ileri ve geri yönde ilerleyen bir süreç, yani. başlangıç durumundan son duruma geçiş sırasında, tüm ara durumlar dengededir.
Dengesiz ara durumların varlığında, süreç dikkate alınır.termodinamik olarak tersinmez.
Doğada, minimum enerjiye sahip sistemler kararlıdır. O zaman sadece ekzotermik süreçler kendiliğinden olmalıdır. Ama değil. Bu, sürecin kendiliğinden akışı için başka bir kriter olduğu anlamına gelir - entropi (S).
Entropi -bir sistemdeki enerji düzensizliğinin bir ölçüsü, bir kaos ölçüsü, ısı şeklinde dağılan ve işe dönüştürülmeyen enerjinin bir ölçüsü.
Termodinamiğin ikinci yasası (termodinamiğin ikinci yasası):
Süreçler kendiliğinden meydana gelir ve sistemin ve çevrenin toplam entropisinde bir artışa yol açar.
Δ S sistem + Δ S ortamlar ≥ 0 veya Δ S ≥ 0
Entropinin fiziksel anlamı:
entropi, 1 mol maddenin 1 derecede harcadığı enerji miktarıdır..
S 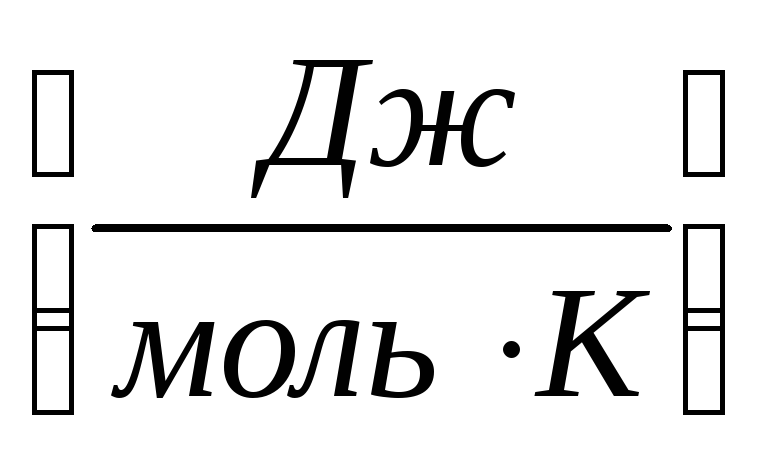
Entropi kapsamlı bir fonksiyondur. Entropi kütle ile orantılıdır, 1 mol veya 1 gram maddeyi ifade eder. Bu, sistemin entropisinin, bileşenlerinin entropilerinin toplamına eşit olduğu anlamına gelir:
S= 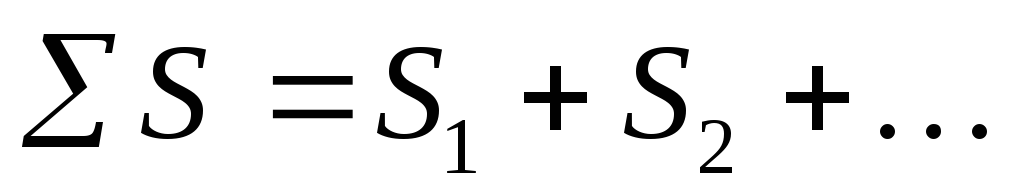
Entropi, sistemin durumunun bir fonksiyonudur. Demek oluyor  karakterize eder sistem, bir süreç değil. Değişimi yalnızca sistemin ilk ve son durumuna bağlıdır ve geçiş yoluna bağlı değildir:
karakterize eder sistem, bir süreç değil. Değişimi yalnızca sistemin ilk ve son durumuna bağlıdır ve geçiş yoluna bağlı değildir:
Bir kimyasal reaksiyon için entropi değişimi: 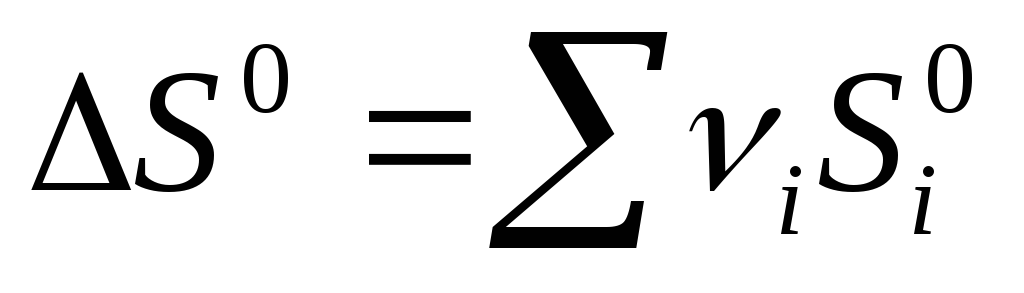 ürün
ürün 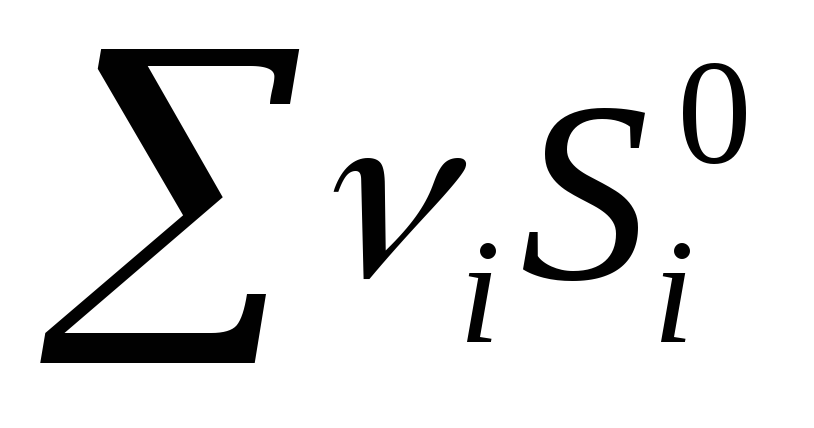 referans
referans
Entropinin olasılıksal anlamı
Herhangi bir termodinamik sistem için bir makro durum ve bir mikro durum ayırt edilir. Sistemin makro durumu, makro parametreler (T, P, V, U, vb.) ile karakterize edilir. Aynı zamanda, sistem sonsuz sayıda mikro parçacıktan oluşur. Bir mikro durum, tek tek moleküllerin dizilimi ve enerjisidir. şu an zaman.
Sistemin bir makroskopik durumu, birkaç farklı mikro durum tarafından gerçekleştirilebilir. Her mikro durum için, sistemin bu belirli mikro durumda olma olasılığı (P) vardır. Bu nedenle, termodinamikteki tüm süreçler, bir sistemin daha az olası bir durumdan daha olası bir duruma geçişini belirleyen olasılıklı veya istatistiksel bir yapıya sahiptir.
1896'da Boltzmann, entropinin logaritmik bir bağımlılık yoluyla termodinamik olasılık ile ilişkili olduğunu öne sürdü.
S = kiçindeW Boltzmann denklemi
k– Boltzmann sabiti: k= 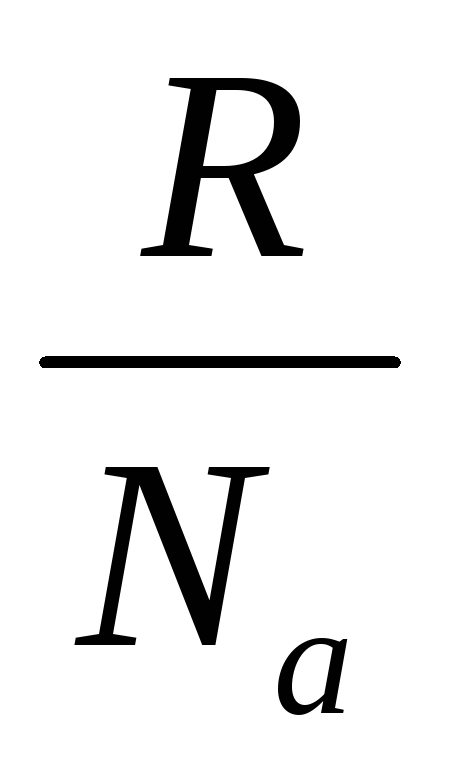 = 1.38~10 -23 J/derece;
= 1.38~10 -23 J/derece;
W, yardımı ile bu makro durumun gerçekleştirilebileceği mikro durumların sayısıdır: W=1/P;
P, sistemin bu belirli mikro durumda olma olasılığıdır.
Sistemdeki düzen artışı ile bu durumu gerçekleştirmek için kullanılabilecek mikro durum sayısı azalır ve entropi azalır.
Bir madde gaz halinden sıvı hale ve ardından kristal hale geçtiğinde entropi azalır. Boltzmann denklemine göre, entropi yalnızca tek bir durumda sıfıra eşit olabilir.
1911'de Planck, olarak bilinen postülatı formüle etti. termodinamiğin üçüncü yasası:
saf bir maddenin (kusurlar ve safsızlıklar olmadan) ideal olarak oluşturulmuş bir kristalinin mutlak sıfırda entropisi sıfırdır.
Bu yasa, mutlak değerini hesaplamayı mümkün kılan entropi için referans sıfırı belirler, çünkü
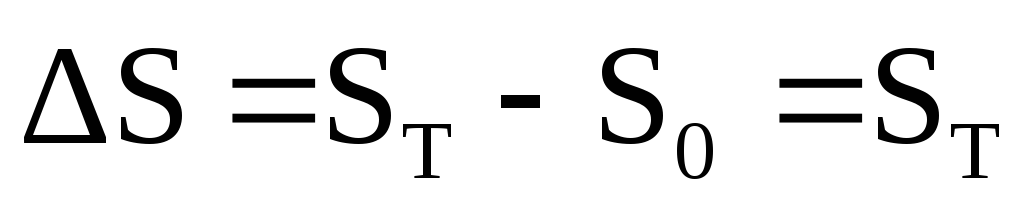
Yalıtılmış bir sistemde (U,V=const), kendiliğinden bir süreçte entropi artar. Denge durumunda, entropi maksimum ve sabittir.
Kapalı ve sistemi aç sürecin kendiliğinden akışı için kriter, azalmadır. Gibbs enerjisi ( G ).
H - entalpi
T - sıcaklık
S - entropi
Gibbs enerjisini kullanarak termodinamiğin ikinci yasası şu şekilde ifade edilebilir:
Sistemde sabit bir sıcaklık ve basınçta, yalnızca Gibbs enerjisinde azalmaya yol açan süreçler kendiliğinden ilerler. Dengede Gibbs enerjisi sıfırdır.
∆G≤0 (p, T=const)
∆G'de<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 ters yönde
∆G=0 reaksiyon dengededir.
Gibbs enerjisindeki değişim,
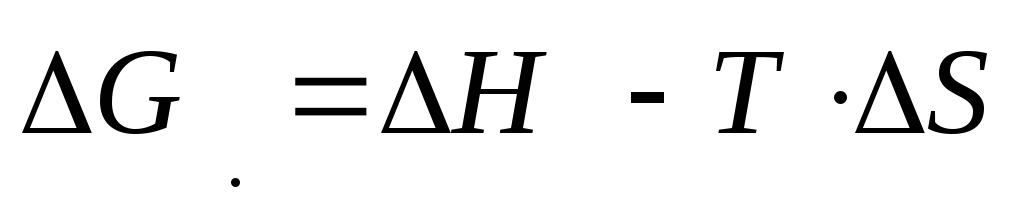
İlk terim denir entalpi faktörü, ikinci - entropi faktörü. Gibbs enerjisindeki bir azalma ve dolayısıyla sürecin kendiliğinden akışı, ∆H'deki (ısı salınımı olan süreçler) bir azalma ve entropideki bir artış (sistemde düzensizliği artan süreçler) ile kolaylaştırılır.
Gibbs standart enerjisi Kimyasal reaksiyon tablo verileri kullanılarak formülle hesaplanır:
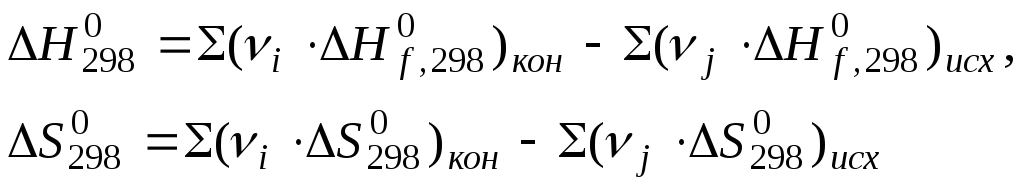
ekzergonik süreçler - Gibbs enerjisinin azaldığı ve sistemin çalıştığı kimyasal reaksiyonlar.
Endergonik süreçler - Gibbs enerjisinin arttığı ve sistem üzerinde iş yapıldığı kimyasal reaksiyonlar.
Örneğin, kandaki glikozun oksidasyonu, bir azalma eşlik ettiği için ekzergonik bir süreçtir. Gibbs enerjisi ve bu reaksiyon sonucunda vücutta çeşitli türde işler yapmak mümkündür.
Uygulama 2: Otokontrol için sorular
Kimyasal termodinamik neyi inceler?
Durum parametreleri nelerdir?
Yoğun ve kapsamlı parametreler arasındaki fark nedir?
Hangi fonksiyon durum fonksiyonu olarak adlandırılabilir?
Tanımlar verin içsel enerji, sıcaklık, iş.
Ne tür termodinamik sistemler biliyorsunuz? Fark ne?
Termodinamik süreçlerin türleri nelerdir?
Termodinamiğin birinci yasasını belirtin.
Entalpi, bir maddenin standart oluşum ısısı, bir maddenin standart yanma ısısı terimlerini tanımlayın.
Standart reaksiyon entalpisi nedir? Hangi hesaplama yöntemleri bilinmektedir?
Hess yasasını formüle edin.
Termodinamiğin ikinci yasasını belirtin. Neyi tahmin ediyor?
Termodinamik anlamda tersinir ve tersinmez süreçler.
Entropi kavramını tanımlar.
Gibbs enerjisi. Yalıtılmış ve spontane süreçlerin yönünü tahmin etmek kapalı sistemler; entalpi ve entropi faktörlerinin rolü.
Termodinamik denge koşulları.
Maddenin oluşum standart Gibbs enerjisi nedir, standart enerji Bir maddenin Gibbs biyolojik oksidasyonu, reaksiyonun standart Gibbs enerjisi?
Vücutta meydana gelen ekzergonik ve endergonik süreçler kavramını, enerji konjugasyonu ilkesini açıklar.
Uygulama 3: Deneme testi
Termodinamik çalışmaları:
a) ısı ve enerji ilişkisi;
b) kimyasal işlemlerin hızı;
c) ana kimyasal bileşik sınıflarının özellikleri;
Entropi...
b) iş yapabilme yeteneği;
c) sistemdeki düzensizliğin ölçüsü;
3) Termodinamiğin birinci yasası şunları tanımlar:
a) bir termodinamik sistemin entropisi;
b) iç enerji, ısı ve iş arasındaki ilişki;
c) maddelerin dinamik viskozitesi.
4) Süreçler, aşağıdakilerle birlikte kendiliğinden ilerler:
a) enerjide bir azalma;
b) entropide azalma;
c) entropi artışı.
5) Kapalı bir sistem şu şekilde karakterize edilir:
a) madde ve enerji alışverişi eksikliği;
b) enerji alışverişi eksikliği;
c) metabolizma eksikliği;
Yanıtlar: 1a, 2c, 3b, 4c, 5c
Uygulama 4: Durumsal görevler
Reaksiyonun Termal Etkisini Hesaplayın
entalpi
veya du + pdv = di - vdp .
dq = di - vdp
dq p = di . (86)
Herhangi bir süreçteki entalpi değişimi, yalnızca vücudun ilk ve son durumları tarafından belirlenir ve sürecin doğasına bağlı değildir.
Entropi bir durum fonksiyonudur, bu nedenle termodinamik süreçteki değişimi sadece durum parametrelerinin ilk ve son değerleri ile belirlenir. Temel termodinamik süreçlerde entropi değişimi:
izokorik olarak
izobarik olarak
visotermal
adyabatik olarak
politropik olarak
ÇALIŞAN VÜCUDUN İÇ ENERJİSİ, FİZİKSEL ANLAMI VE BOYUTSALLIK.
İçsel enerji- bu, vücutta veya beden sisteminde bulunan tüm enerjidir.Bu enerji bir toplam olarak temsil edilebilir. belirli türler Enerjiler: Moleküllerin kinetik enerjisi, translasyon enerjisi ve döner hareket moleküller ve salınım hareketi molekülün kendisindeki atomlar; elektron enerjisi; intranükleer enerji; bir molekülün çekirdeği ile elektronlar arasındaki etkileşim enerjileri; herhangi bir dış kuvvet alanındaki moleküllerin konumunun potansiyel enerjisi veya enerjisi; elektromanyetik radyasyon enerjisi.
Vücudun toplam iç enerjisi genellikle gösterilir. U (J), ve özgül iç enerji u (J/kg).
İç enerji:
iç nerede kinetik enerji Moleküllerin iç potansiyel enerjisi olan moleküller, entegrasyon sabitidir.
Teknik termodinamikte, yalnızca iç enerjinin kinetik ve potansiyel bileşenlerinin değiştiği süreçler dikkate alınır.
Durumda sonsuz küçük bir değişiklik olan herhangi bir işlem için ideal bir gazın iç enerjisindeki değişiklik (1 kg için)
Termal hesaplamalarda genellikle iç enerjideki değişimi bilmek gerekir, mutlak değerini değil; bu nedenle, referans noktası (0 K veya 0 0 C) için sonuç() alakasız.
ortalama kütle ısı kapasitesi nerede sabit hacim içinde
Böylece, herhangi bir işlem için ideal bir gazın iç enerjisindeki değişim, sabit bir hacimdeki ortalama ısı kapasitesi ile gazın sıcaklık farkının ürününe eşittir.
SÜREÇLER GERİ DÖNÜŞTÜRÜLEBİLİR VE GERİ DÖNÜLMEZDİR. DENGE VE DENGESİZLİK
Bir termodinamik süreç, çalışan akışkanın enerji ile etkileşiminin bir sonucu olarak meydana gelen bir cismin durumundaki ardışık bir değişikliktir. çevre.
Tersinir ve tersinmez termodinamik süreç kavramları, sistemin dengesi ile yakından ilişkilidir. Çevre ile ısı alışverişi olmayan böyle bir termodinamik sistemi ele alalım (adyabatik termodinamik sistem). Böyle bir sistemde meydana gelen termodinamik süreçler, çevrenin sistem üzerinde herhangi bir ek termal etkisi olmaksızın, sistem doğrudan ve ters işlemler sırasında orijinal durumuna geri dönerse, tersine çevrilebilir olarak adlandırılır. Ters işlem sırasında sistem orijinal durumuna geri dönemezse veya bu ısı kaynağı gerektiriyorsa, böyle bir işleme geri döndürülemez denir.
Basınç ve sıcaklıktaki her değişiklikle birlikte süreç, yalnızca termodinamik sistemin bir noktasından diğerine tüm süreç boyunca basınç sabitse ve her noktadaki sıcaklık ortam sıcaklığına eşitse veya aralarındaki fark sonsuz küçükse tersine çevrilebilir. .
Tersinir termodinamik süreçler ideal veya teorik durumdur. Pratikte yarı statik koşulun yerine getirilmesi zor olduğundan, tüm gerçek süreçler geri döndürülemez. Ek olarak, işlemlerin tersinmezliği, çalışma sıvısındaki iç sürtünme ve teknik ekipmandaki yüzey sürtünmesinin varlığından kaynaklanır (nozuldaki akış, piston yüzeyinin silindir duvarına sürtünmesi vb.). Sürtünmenin üstesinden gelmek için, işlem sırasında ısıya dönüşen bir miktar mekanik iş harcamak her zaman gereklidir.
ÇALIŞMA ORTAMI ISI KAPASİTESİ
ısı kapasitesi Herhangi bir nicel birimin sıcaklığını 1 ° C artırmak için bir cisme (gaz) verilmesi gereken ısı miktarını arayın.
Yukarıda listelenen ısı kapasitelerinin değerlerini belirlemek için bunlardan birinin değerini bilmek yeterlidir. Molar ısı kapasitesinin değerine, ardından kütle ısı kapasitesine sahip olmak en uygunudur:
ve hacimsel ısı kapasitesi:
Hacimsel ve kütle ısı kapasiteleri, bağımlılıkla birbirine bağlıdır:
normal koşullar altında gaz yoğunluğu nerede.
Bir gazın ısı kapasitesi, sıcaklığına bağlıdır. Bu temelde, bir ayırt ortalama ve gerçek ısı kapasitesi.
eğer q- gaz sıcaklığı değiştiğinde bir gaz miktarı birimine verilen (veya ondan alınan) ısı miktarı t1önceki t2 sonra
Temsil etmek ortalama ısı kapasitesi içinde . Sıcaklık farkı sıfıra yaklaştığında bu oranın sınırına denir. gerçek ısı kapasitesi.
İZOKORİK GAZ PROSESİ
izokorik süreç- sabit bir gaz hacminde iletişim veya ısının uzaklaştırılması süreci (v= const).
Sabit bir hacimde, bir gazın basıncı, mutlak sıcaklıklarla doğru orantılı olarak değişir:
Gazın harici çalışması v= const sıfırdır l=0.
gazın iç enerjisindeki ısı veya değişim miktarı:
izokorik süreç pv - diyagram düz bir dikey çizgi ile gösterilir - izokor. Pozitif miktarda ısı ile çizgi aşağıdan yukarıya doğru gider.
Entropi değişimi:
İZOBARİK GAZ PROSESİ.
İzobarik süreç - sabit basınçta iletişim veya ısının uzaklaştırılması süreci (R = sabit)
İşlem eğrisine izobar denir.
Çünkü izobarik bir süreçte dp=0 daha sonra sistemde herhangi bir teknik çalışma yapılmaz ve cismin 1. durumdan 2. duruma geçmesi için gereken ısı miktarı şu şekilde belirlenir:
Böylece, izobarik bir termodinamik süreçte, vücuda verilen (çıkarılan) ısı miktarı, bu süreçteki entalpi değişimi ile orantılıdır.Bu sonuç, sistemin termodinamik dengede olması koşuluyla, hem tersinir hem de tersinmez işlemler için geçerlidir. sürecin başı ve sonu.
Tersinir bir süreç için:
izobarik süreç pv- diyagram düz bir yatay çizgi olarak görüntülenir. Sürece ısı eklendiğinde, çizgi soldan sağa doğru uzanır.
Böyle bir süreçte mekanik çalışma:
Belirli tek kullanımlık (faydalı) harici çalışma:
Spesifik iç enerjideki değişim:
İdeal bir gazın hal denkleminden, izobarik bir süreç için aşağıdaki ilişki elde edilebilir:
Bu nedenle, izobarik bir süreçte, ideal bir gazın hacmi ile orantılıdır. mutlak sıcaklık. Bir gaz genleştiğinde sıcaklığı artar, sıkıştırıldığında sıcaklığı düşer.
Bir izobarik süreçte entropi değişimi aşağıdaki gibi hesaplanabilir:
ADYABATİK GAZ PROSESİ.
Isı verilmeden ve atılmadan ilerleyen süreç, yani. çevre ile ısı alışverişinin olmadığı duruma adyabatik, bu sürecin eğrisine adyabatik denir. İşlem koşulları: dq=0 , q=0.
Çünkü dq=0, o zaman termodinamiğin birinci yasasına göre:
Böylece, adyabatik bir termodinamik süreçte çalışan vücut tarafından gerçekleştirilen mekanik iş, vücudun iç enerjisindeki bir azalmaya eşittir, teknik iş ise entalpideki değişim (azalma) ile orantılıdır. Tersinir bir diyabatik süreçte, bir termodinamik cismin entropisi değişmez: S=Sabit.
Koordinat sisteminde adyabatik denklem pv- ideal bir gaz için sabit ısı kapasitesinde () diyagramlar: adyabatik üs nerede
Sürecin ilk ve son parametreleri arasındaki bağımlılıklar: arasında R ve v ,
arasında T ve v
arasında R ve T
1 kg gazın işi aşağıdaki formüllerle bulunur.
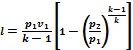
Gazın iç enerjisindeki değişim ve adyabatik sürecin işi büyüklük olarak eşittir ve işaret olarak zıttır. .
Adyabatik bir süreçte ideal bir gazın iç enerjisindeki değişim de denklemle ifade edilebilir.
Termodinamiğin ikinci yasası
Termodinamiğin ikinci yasası, doğada kendiliğinden gerçekleşen termal süreçlerin akışının yönünü belirler ve ısının işe dönüşmesi için koşulları belirler. Yasa, doğadaki ısının kendiliğinden yalnızca daha sıcak olan cisimlerden daha az sıcak olana geçtiğini belirtir.
Termodinamiğin ikinci yasasına göre, herhangi bir ısı motorunda ısıyı işe dönüştürmek için iki gövdeye sahip olmak gerekir. farklı sıcaklıklar. Daha sıcak bir vücut iş için bir ısı kaynağı olacak, daha az ısıtılan bir vücut bir ısı emici olacaktır. Bu durumda ısı motorunun verimi her zaman birden az olacaktır.
Dinamiğin ikinci yasası matematiksel olarak ifade edilebilir:
Neresi dS- sistemin entropisinin sonsuz küçük bir artışı;
dQ- sistem tarafından bir ısı kaynağından alınan sonsuz miktarda ısı;
T-ısı kaynağının mutlak sıcaklığı.
Eşitsizlik işareti, tersinmez süreçlere karşılık gelir ve tersinir olanlara eşittir. Bu nedenle, sonsuz küçük tersinir bir süreç için termodinamiğin ikinci yasasının analitik ifadesi şu şekli alır:
dan beri termodinamiğin birinci yasasına göre
dQ=dU+pdV
TdS=dU+pdV.
Carnot çevrimi ve özellikleri.
Karnot döngüsü.İki izoterm ve iki adiabattan oluşur. Bu çevrim, ideal bir ısı motorunda çalışma akışkanı tarafından iki ısı kaynağının (ısıtıcı ve buzdolabı) varlığında gerçekleştirilen kapalı bir işlemdir.
Carnot'un döngüsü pv-diyagram
1-2 ve 3-4 süreçleri izotermal, 2-3 ve 4-1 süreçleri ise adyabatiktir. Döngüdeki çalışma akışkanının ilk sıcaklığının, ısıtıcının sıcaklığına eşit olduğu varsayılır. T1. Durum 1'den durum 2'ye izotermal genleşme sırasında, çalışma sıvısı ısıtıcıdan ısı miktarını alır. 1 bir sıcaklıkta T1. Bölüm 2-3'te, çalışma sıvısı adyabatik olarak genişler. Aynı zamanda, çalışma sıvısının sıcaklığı düşer T1önceki T2 ve basınç düşer p2önceki p 3. 3-4 izoterm boyunca sıkıştırıldığında, ısı miktarı çalışma sıvısından buzdolabına çıkarılır. q2 bir sıcaklıkta T2.Daha fazla adyabatik sıkıştırma4-1, çalışma sıvısının sıcaklığında bir artışa yol açar. T2önceki T1, ve çalışma sıvısı orijinal durumuna geri döner.
Toplam çevrim çalışması ben 12341 alanı ile grafiksel olarak temsil edilir.
Termal döngü verimliliği:
Carnot döngüsünün çalışması
Isıl verim Çevrim:
Sabit hacimde ısı beslemeli çevrim, iki adiabat ve iki izokordan oluşur.
Döngü özellikleri:
Sıkıştırma oranı
Basınç oranı
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
Sabit basınçta ısı beslemeli bir çevrim, bir izobar ve bir izokor olmak üzere iki adiyabattan oluşur.
Döngü özellikleri:
Sıkıştırma oranı
Ön genişleme derecesi.
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
Kombine ısı beslemeli çevrim iki adyabat, iki izokor ve bir izobardan oluşur
Döngü Özellikleri
Verilen ısı miktarı
Kaldırılan ısı miktarı
Isıl verim Çevrim
Su buharı tabloları.
kızgın buhar veya doymuş buhar, özelliklerinde önemli ölçüde farklılık gösterir. ideal gazlar. Buharların durumu için denklemler çok karmaşıktır ve hesaplamalı uygulamada kullanılmazlar. Pratik amaçlar için, deneysel ve teorik veriler temelinde derlenen tablolar ve diyagramlar kullanılır. Tablolar, aşırı ısıtılmış ve doymuş buharlar 1000 0 C sıcaklığa ve 98.0 MPa basınca kadar.
için tablolarda doymuş buhar doyma sıcaklıkları, basınçlar, değerler belirli hacimler, sıvı ve kuru buharın entalpisi ve entropisi, buharlaşma ısısı. Kızgın buhar tablolarında, çeşitli basınç ve sıcaklıklar için ana parametrelerin değerleri verilmiştir: özgül hacim, entalpi ve entropi.
i - Su buharı diyagramı.
büyük onur dır-dir diyagram, işlemlerde yer alan teknik çalışma ve ısı miktarının alanlar değil, çizgi bölümleri ile temsil edilmesidir. İnşa ederken is-diyagramları y ekseni boyunca çizilen özgül entalpiçifti ve apsis boyunca özgül entropi. Koordinatların orijini, suyun üçlü noktadaki durumu olarak alınır, burada , .
Su buharı tablolarının verileri kullanılarak, sıvı ve buharın sınır eğrileri, yakınsayan diyagramda çizilir. kritik nokta K. Sıvının sınır eğrisi orijini terk eder, çünkü. bu noktada entropi ve entalpi sıfıra eşit alınır. Suyun durumu, ilgili izobarlarda noktalarla işaretlenmiştir. Islak buhar bölgesindeki izobar çizgileri, sıvı sınır eğrisinden dışarı doğru yayılan düz eğimli çizgilerdir. Bir izobarik süreçte:
Eğim izobarın diyagramın her noktasında apsis eksenine eğimi, verilen durumun mutlak sıcaklığına sayısal olarak eşittir. Çünkü ıslak buhar bölgesinde, izobar izoterm ile çakışır, daha sonra son denkleme göre, ıslak buhar izobarı düz çizgilerdir:
Ve bu düz bir çizginin denklemi. Aşırı ısıtılmış buhar bölgesinde, izobarlar, aşağı doğru yönlendirilmiş bir dışbükeyliğe sahip bir eğriliğe sahiptir. Islak buhar alanında, kritik K noktasında birleşen sabit buhar kuruluğu (x=const) çizgilerinden oluşan bir ızgara uygulanır.
Islak buhar bölgesindeki izotermler, izobarlarla örtüşür. Aşırı ısıtılmış buhar alanında birbirlerinden ayrılırlar: izobarlar yükselir ve izotermler, dışbükeyliği yukarı doğru olan kavisli çizgilerdir. Diyagrama, izobarlara kıyasla daha dik yükselen eğriler formuna sahip bir izokor ızgarası uygulanır. Tersinir bir adyabatik süreç, dikey bir düz çizgi ile temsil edilir. İzobarın altındaki alan üçlü nokta buhar + buz karışımının durumunu gösterir.
Adyabatik su buharı süreci. İşlem görüntüsü p–V , dır-dir ve T-S diyagramlar.
Adyabatik süreç, ısı verilmeden ve uzaklaştırılmadan gerçekleşir ve tersinir süreçte çalışan akışkanın entropisi kalır. sabit değer: s=sabit. Bu nedenle, üzerinde dır-dir ve Ts- adyabatik diyagramlar dikey düz çizgilerle gösterilmiştir: şek. a ve B
Adyabatik genleşme sırasında buharın basıncı ve sıcaklığı azalır; aşırı ısıtılmış buhar kuru hale gelir ve sonra ıslak buhar. Entropinin sabitlik koşullarından, eğer başlangıç ve son durumların bir parametresinin parametreleri biliniyorsa, buharın son parametrelerini belirlemek mümkündür.
Üzerinde pv- diyagramda, tersinir bir adyabatik süreç belirli bir eğri ile gösterilmektedir (Şekil c)
Adyabatik bir süreçteki belirli iş, denklemden belirlenir:
Spesifik iç enerjideki değişim:
Kompresörde çok aşamalı sıkıştırma.
Yüksek basınçlı gaz üretmek için çok kademeli kompresörler kullanılır.
gazın, her sıkıştırmadan sonra ara soğutması ile seri olarak bağlanmış birkaç silindirde politropik olarak sıkıştırıldığı.
Birkaç silindirde gaz sıkıştırmanın kullanılması, her birinde basınç oranını düşürür ve hacimsel verimi artırır. kompresör. Ayrıca, her aşamadan sonra gazın ara soğutulması, silindirdeki pistonun yağlama koşullarını iyileştirir ve kompresör tahriki için enerji tüketimini azaltır.
0-1'in ilk aşamaya giden emme hattı olduğu üç aşamalı bir kompresörün ideal gösterge şeması;
1-2 - ilk aşamada politropik sıkıştırma işlemi; 2-a - ilk aşamadan ilk soğutucuya enjeksiyon hattı; a-3 - ikinci aşamaya giden emme hattı; 3-4 - ikinci aşamada politropik sıkıştırma işlemi; 4-c - ikinci aşamadan ikinci soğutucuya boşaltma hattı; c-5 - üçüncü aşamaya giden emme hattı; 5-6 - üçüncü aşamada politropik sıkıştırma işlemi; 6-c - üçüncü aşamadan tanka veya üretime enjeksiyon hattı. Segmentler 2-3, 4-5, işlemdeki gaz hacmindeki bir düşüşü gösterir. sabit basınç birinci ve ikinci soğutucularda soğutmadan. Çalışma sıvısının tüm soğutucularda soğutulması, ilk T 1'e eşit aynı sıcaklıkta gerçekleştirilir, bu nedenle 1, 3 ve 5 noktalarındaki gaz sıcaklıkları aynıdır ve 1 - 7 izoterminde bulunur.
Tüm aşamalardaki basınç oranı genellikle aynı alınır:
Tüm aşamalarda aynı basınç oranları, başlangıç sıcaklıklarının eşitliği ve politropik göstergelerin eşitliği ile kompresörün ayrı aşamalarındaki son gaz sıcaklıkları birbirine eşittir: l k \u003d 3l 1
Aynı gaz sıkıştırma koşulları altında, gazdan ayrı aşamalarda çıkarılan ısı miktarları birbirine eşittir:
İzobarik soğutma işlemi sırasında herhangi bir soğutucuda gazdan çıkan ısı aşağıdaki formülle bulunur:
AT Ts-Şemalarda, adyabatik sıkıştırma işlemleri 1-2, 3-4, 5-6 düz çizgilerle ve soğutma işlemleri 2-3, 4-5, 6-7 eğrileri ile gösterilmektedir.
Politropik sıkıştırma işlemleri 1-2, 3-4, 5-6 eğrileri ile ve soğutuculardaki soğutma işlemleri - 2-3, 4-5, 6-7 hatları ile gösterilmiştir.
yanmalı ICE döngüsü V=sabit
Şekil, sabit bir hacimde hızlı yanan yakıtla çalışan bir motorun gösterge diyagramını göstermektedir. Yakıt olarak benzin, aydınlatma veya jeneratör gazı, alkoller vb.
Piston sol ölü konumdan en sağa hareket ettiğinde, yanıcı karışım emme valfinden emilir. Bu süreç emme hattı adı verilen 0-1 eğrisi ile gösterilir, çünkü termodinamik bir süreç değildir. içinde ana parametreler değişmez, sadece silindirdeki karışımın kütlesi ve hacmi değişir. Piston geri hareket ettiğinde emme valfi kapanır ve yanıcı karışım sıkıştırılır. Sıkıştırma çizgisi olarak adlandırılan eğri 1-2 ile gösterilir. 2. noktada, yanıcı karışım bir elektrik kıvılcımından tutuşur. Yanıcı karışımın yanması neredeyse anında gerçekleşir, yani. neredeyse sabit hacimde. Bu süreç eğri 2-3 ile gösterilmektedir. Yakıtın yanması sonucunda gaz sıcaklığı keskin bir şekilde yükselir ve basınç artar (nokta 3). Daha sonra yanma ürünleri genişler. Piston doğru ölü konuma hareket eder ve gazlar faydalı işler yapar. Gösterge diyagramında genişleme süreci, genişleme çizgisi adı verilen 3-4 eğrisi ile gösterilmektedir. 4. noktada egzoz valfi açılır ve silindirdeki basınç neredeyse dış basınca düşer. Pistonun sağdan sola daha fazla hareketi ile yanma ürünleri, atmosferik basınçtan biraz daha yüksek bir basınçta egzoz valfi aracılığıyla silindirden çıkarılır. 4-0 eğrisi olarak gösterilir ve egzoz hattı olarak adlandırılır. Böyle bir iş akışı, pistonun dört vuruşunda veya milin iki devrinde tamamlanır. Bu tür motorlara dört zamanlı denir.
Sabit hacimde ısı beslemeli çevrim, iki adiabat ve iki izokordan oluşur.
Döngünün özellikleri şunlardır:
- Sıkıştırma oranı
– basınç artışı derecesi
Sağlanan ısı miktarı:
Kaldırılan ısı miktarı:
Döngü çalışması
Isıl verim Çevrim:
yanmalı ICE döngüsü p=sabit
Sabit hacimde ısı beslemeli çevrimlerin incelenmesi, bu çevrime göre çalışan bir motorun verimini artırmak için yüksek sıkıştırma oranlarının uygulanması gerektiğini göstermiştir. Yüksek sıkıştırmada hava o kadar yüksek bir sıcaklığa sahiptir ki, silindire verilen yakıt, ateşleyici olmadan kendiliğinden tutuşur. Hava ve yakıtın ayrı sıkıştırılması, herhangi bir sıvı ağır ve ucuz yakıtın - yağ, akaryakıt, reçineler, kömür yağlarının - kullanılmasına izin verir.
Bu avantaj, sabit basınçta kademeli olarak yakıt yanması ile çalışan motorlara sahiptir. İçlerinde, motor silindirinde hava sıkıştırılır ve sıvı yakıta kompresörden basınçlı hava püskürtülür.
Yakıtın sabit basınçta kademeli olarak yanması ile ideal motor çevrimi, yani. sabit basınçta ısı beslemeli döngü aşağıdaki gibi gerçekleştirilir.
Başlangıç parametreleri ile gaz halindeki çalışma sıvısı p 1 , v 1 , T 1 adyabatik 1-2 boyunca küçülür; daha sonra vücuda 2-3 izobar boyunca belirli bir miktarda ısı verilir. 1. 3. noktadan itibaren, çalışma gövdesi adyabatik 3-4 boyunca genişler. 4-1 izokoruna göre, çalışma sıvısı orijinal durumuna dönerken, ısı soğutucuya alınır. q2.
Döngü özellikleri:
Isı kapasitesi oranı
nerede k adyabatik indekstir.
"Soğutma katsayısı" kavramı
Performans katsayısı, işin enerji verimliliğini karakterize eden boyutsuz (genellikle birden büyük) bir değerdir. soğutma makinesi; soğutma kapasitesinin uygulama için birim zamanda harcanan enerji (iş) miktarına oranına eşittir soğutma döngüsü. Makinenin çalıştığı soğutma çevrimi tipine, ana elemanlarının mükemmelliğine göre belirlenir ve aynı makine için çalışmasının sıcaklık koşullarına bağlıdır.
Ters Carnot çevriminde çalışan ideal bir soğutma makinesinin performans katsayısı:
nerede T dk ve Tmaks sırasıyla daha düşük ve daha yüksek sıcaklık bir döngüde.
Hava soğutucunun soğutma katsayısı (şekil),
nerede T1 ve T2 sırasıyla adyabatik sıkıştırmanın başlangıç ve bitiş sıcaklıklarıdır;
T3 ve T4 genleştiricideki adyabatik genişlemenin başlangıç ve bitiş sıcaklıklarıdır.
Buhar yeniden ısıtma
Bir buhar türbini tesisinin çalışmasına ilişkin bir çalışma, başlangıç basıncındaki artışın ve son basınçtaki düşüşün bir artışa yol açtığını göstermektedir. çevrim verimliliği. Bununla birlikte, başlangıç basıncındaki bir artış, buharın nihai nem içeriğini arttırır. Genleşme artışı sonunda buharın nemini azaltmak için başlangıç sıcaklığı onun. Türbin çıkışındaki buhar kuruluğu derecesini arttırmanın yollarından biri, ikincil aşırı ısınmasıdır. İlk basınç ve sıcaklık ile kazandan gelen aşırı ısıtılmış buhar, adyabatik olarak belirli bir basınca genişlediği birkaç aşamadan oluşan ilk türbin silindirine girer. p1. Elde edilen buhar, sabit basınçta ikincil aşırı ısınmaya maruz kaldığı özel bir kızdırıcıya çıkarılır. Daha sonra tekrar türbine geri gönderilir ve burada buhar, kondenser basıncına genişlemeye devam eder.
Nokta 1, buharın ilk durumuna karşılık gelir; nokta 2 - ikincil aşırı ısınmadan sonra türbinden sonraki buharın son durumu. Yeniden ısıtmanın başlatılmasının bir sonucu olarak nihai kuruluk derecesi, x2önceki x 1. Ek olarak, ek çevrim 7-2-2 '-6-7'deki ortalama ısı besleme sıcaklığı, bir çevrimdeki ortalama ısı besleme sıcaklığından daha yüksekse, buharın ikincil aşırı ısınması bir miktar ekonomik etki (%2-3) verir. tek aşırı ısınma ve etki daha fazla olacak, ara aşırı ısınmanın başlangıç ve bitiş noktalarındaki sıcaklık daha yüksek olacaktır. Kritik ve kritik üstü basınçlara yakın basınçlarda, bazen iki veya daha fazla ara aşırı ısınma kullanılır. Daha sonra çevrimin ısıl verimi
Birinci ve ikinci türbin silindirlerinde adyabatik ısı düşüşü nerede;
- kazana ve ilk kızdırıcıya verilen ısı miktarı;
İkinci kızdırıcıya sağlanan ısı miktarı.
Spesifik buhar tüketimi
entalpi
Bir termodinamik cismin entalpisi, u iç enerjisinin ve pv ürününün toplamıdır.
Bu bağıntıyı farklılaştırarak şunu elde ederiz: di = du + pdv + vdp ,
veya du + pdv = di - vdp .
Termodinamiğin birinci yasasına göre, dq = du + pdv, son ilişki şu şekilde yeniden yazılacaktır:
dq = di - vdp veya dq = dh + dl t ,
burada dl t teknik iş farkıdır (dl t = - vdp).
Ortaya çıkan denklem aynı zamanda termodinamiğin birinci yasasının entalpi ve teknik çalışma kavramlarını kullanarak ikinci formülasyonudur.
i değeri, daha önce tanıtılan p, v, T ve ile birlikte bir termodinamik cismin durumunun bir parametresi olarak da düşünülebilir. fiziksel anlam denklem temelinde açıklanabilirim dq = di - vdp, p =const işlemi için şu şekilde yazılacaktır:
dq p = di . (86)
Buradan di, sabit basınç sürecinde termodinamik gövdeye sağlanan temel ısı miktarıdır.
BÖLÜM 3. Termodinamik potansiyeller
§ 3.2. entalpi
Termodinamikte çalışmak. İşaretlerin termodinamik kuralı. Isı yalıtımlı gövdeler. Durum fonksiyonları.
termodinamik potansiyeller.
İzokorik ve izobarik süreçler. Isı içeriği veya entalpi.
Kapalı sistemlerin dengesi için bir kriter olarak maksimum entropinin kullanımı ilk olarak 1875-1878 termodinamik çalışmalarında J. Gibbs tarafından önerildi. pratik matematiksel hesaplama yöntemleri, mekanikten bilinen yöntemin genelleştirilmesi potansiyeller . Çalışmak ilerliyoruz.
Vücuda uygulanan dış kuvvetler üzerinde üretebilir iş kuvvet vektörü ve yer değiştirmenin skaler ürünü olarak mekaniğin genel kurallarına göre belirlenir. Termodinamikte, tüm işin sadece hacmini değiştirmeye ve dolayısıyla sadece iç enerjisini değiştirmeye gittiği durumla ilgileneceğiz (bkz. formül (2.5.8)). Yukarıda belirtildiği gibi termodinamikte vücudun toplam enerjisini - bir bütün olarak kinetik veya potansiyel enerjisini - değiştirmek için harcanan çalışma dikkate alınmaz.
Termodinamikte kabul edilir işaret kuralı , yapılan işin olumlu kabul edildiğine göre dış kuvvetler vücut üzerinde - yani, vücudun iç enerjisi arttığında. Vücut iç enerjisi nedeniyle çevre üzerinde çalışıyorsa, bu iş olumsuz olarak kabul edilir. Aynı şekilde vücudun dışarıdan aldığı ısı da pozitif, verdiği ısı ise negatiftir.
Basınç, bir yüzeyin birim alanına etki eden kuvvettir. Daha sonra küçük bir iş için δR , yüzey elemanı hareket ettirilerek gerçekleştirilir dσ kısa bir mesafe için doktor yazılabilir:
Vücudu sıkıştırırken dV < 0, так что δR > 0.
eğer vücut ısı yalıtımlı , o zaman enerjideki tüm değişiklik, üzerinde üretilen enerji ile ilişkilidir. mekanik iş. Genel durumda, işe ek olarak, vücut, ya temas eden cisimlerden doğrudan transfer yoluyla ya da vücudumuzla doğrudan temas halinde olmayan cisimlerden radyasyon alışverişi yaparak enerji alır (veya verir). İç enerjideki değişimin bu kısmına denir. ısı miktarı δQ . Böylece, vücut enerjisindeki değişim şu şekilde yazılabilir:
Yukarıda, iç enerjinin toplam diferansiyeli için (2.5.8) bağıntısı elde edilmiştir:
Başka bir deyişle, entropinin ampirik, fenomenolojik tanımının eşdeğerliği azaltılmış ısı ve kuantum mekaniksel, olasılıksal yorumu.
İlköğretim çalışmaları δR ve ısı miktarı δQ durumunda sonsuz küçük bir değişiklikle vücut tarafından elde edilen, Genel olarak değiller tam diferansiyeller . Sadece miktar δR + δQ , yani iç enerjideki değişim dU , Her zaman tam bir diferansiyel var. Başka bir deyişle, bir cismin enerjisi kesinlikle mekanik ve termal olarak bölünemez. Böyle bir bölünme ihtiyacı, yalnızca mevcut enerji miktarını değiştirmenin yollarını belirlerken ortaya çıkar. Oran sonuçta ortaya çıkan ısı ve iş miktarları tanımlanmamış sadece öncelik ve son vücut durumu ve tamamen yola bağlıdır. geçiş, yani sürecin doğası. Bu özellik en açık şekilde aynı durumda başlayan ve biten kapalı süreçlerde (döngülerde) görülür. Burada iç enerjideki değişim sıfırdır ve vücut ısı veya iş alabilir veya verebilir.
Kapalı bir çevrimdeki değişimi sıfır olan fonksiyonlar (yani, diferansiyeli tamamlamak ), arandı durum işlevleri veya potansiyeller . Bu kavramın ödünç alındığı mekanikte, tek potansiyel Hamilton fonksiyonudur - kinetik ve potansiyel enerjilerin toplamı. Mekanik olanlardan çok daha fazla termodinamik değişken olduğu için - termodinamikte daha fazla serbestlik derecesi vardır - o zaman birkaç potansiyel olabilir. Doğal olarak, termodinamikte denir termodinamik potansiyeller . İç enerji için toplam diferansiyelin formuna dayanarak, görülebilir ki sen dır-dir termodinamik potansiyel değişkenlerle ilgili S ve V .
Hesapları bir süreliğine basitleştirmek için, gerçek cisimlerin farklı tipteki parçacıklardan oluştuğu gerçeğinden uzaklaşıyoruz. O zaman iç enerjinin bağlı olduğu termodinamik değişkenler sadece dört . bu hacim V , baskı yapmak P , sıcaklık T ve entropi S . Herhangi bir çift onlardan bağımsız olacaktır (kompozisyonu hesaba katarsak, üç bağımsız değişken olacağını unutmayın). Bu nedenle, karşılık gelen iki değişkenin değerlerinde bir miktar termodinamik potansiyel bilerek ve potansiyellerin özelliklerini kullanarak, diğer iki değişkenin ve diğer tüm potansiyellerin değerlerini (kısmi türevler yoluyla) hesaplamak mümkündür. Bu gerçek, uygulamalı hesaplamalarda termodinamik potansiyelleri pratikte bulma ve kullanma metodolojisini belirler.
Örneğin, matematiksel olarak potansiyel olan bir durum fonksiyonu bulalım (dolayısıyla adı potansiyel ) değişkenlere göre S ve P . Yukarıda vücut tarafından alınan ısı miktarının sürecin koşullarına bağlı olduğu tespit edilmiştir. Pratikte, sabit hacimli işlemler ( izokorik , kapalı bir hacimde gerçekleştirilir) veya sabit basınçlı işlemler ( izobarik örneğin atmosferle iletişim kuran tesislerde gerçekleştirilir). İşlem izokorik ise, vücut mekanik iş ( dV =0 ) ve ilişkiden, alınan tüm ısının enerjiyi değiştirmeye gittiği açıktır: δQ = dU . VdP
Bundan hemen, sabit basınçta gerçekleştirilen bir işlem için R ve entropi S , alınan ısı miktarı dH tam diferansiyel var . Bu nedenle, fonksiyonun kendisi H - entalpi - değişkenlere göre istenen termodinamik potansiyeldir R ve S .
Termodinamik yöntemlerle entalpilerin ve iç enerjilerin mutlak değerlerini bulmak imkansızdır, ancak sadece değişimleri belirlenebilir. Aynı zamanda, kimyasal olarak reaksiyona giren sistemlerin termodinamik hesaplamalarında tek bir referans çerçevesi kullanmak uygundur. Bu durumda, entalpi ve iç enerji bağıntı ile ilişkili olduğundan, sadece bir entalpi için bir referans çerçevesi sunmak yeterlidir. Ek olarak, reaksiyona giren maddelerin fiziksel durumuna ve XP'nin oluşum koşullarına bağlı olan kimyasal reaksiyonların termal etkilerini karşılaştırmak ve sistematize etmek için, maddenin standart hali kavramı tanıtılmıştır. 1975 yılında Uluslararası Temel ve Uygulamalı Kimya Birliği'nin (IUPAC) termodinamik komisyonunun tavsiyesi üzerine standart durum aşağıdaki gibi tanımlanır:
“Gazlar için standart durum, 1 fiziksel atmosfer (101325 Pa) basınçta varsayımsal bir ideal gazın durumudur. Sıvılar için ve katılar standart durum, 1 fiziksel atmosfer basıncında saf bir sıvının veya sırasıyla saf kristal bir maddenin durumudur. Çözeltilerdeki maddeler için standart durum, bir molar çözeltinin (1 kg çözücüde 1 mol madde) entalpisinin sonsuz seyreltmede çözeltinin entalpisine eşit olacağı varsayımsal durum olarak alınır. Standart durumdaki maddelerin özellikleri, 0 üst simgesi ile gösterilir. (Saf madde, aynı yapısal parçacıklardan (atomlar, moleküller vb.) oluşan bir maddedir).
Bu tanım, bir gazın ve bir çözünenin varsayımsal durumlarına atıfta bulunur, çünkü gerçek koşullarda gazların durumları idealden daha fazla veya daha az ölçüde farklıdır ve çözümlerin durumları ideal çözümden farklıdır. Bu nedenle, gerçek koşullar için standart durumlarda maddelerin termodinamik özelliklerini kullanırken, bu özelliklerin gerçek olanlardan sapması için düzeltmeler yapılır. Bu sapmalar küçükse, düzeltmeler atlanabilir.
El kitaplarında termodinamik büyüklükler genellikle standart koşullar altında verilir: basınç R 0 =101325Pa ve sıcaklık T 0 =0K veya T 0 \u003d 298.15K (25 0 C). Maddelerin toplam entalpilerinin tablolarını oluştururken, bir sıcaklıkta standart durumları T 0 =0K veya T 0 = 298.15K.
maddeler, hangileri temiz kimyasal elementler en kararlı fazda koşul R 0 \u003d 101325 Pa ve entalpilerin referans noktasının sıcaklığı T 0, değeri alın entalpi sıfıra eşit: . (Örneğin, içindeki maddeler için gaz hali: O 2, N 2, H 2, Cl 2, F 2, vb., C (grafit) ve metaller (katı kristaller) için.
İçin kimyasal bileşikler (CO 2, H 2 O vb.) ve saf kimyasal elementler olan maddeler için, en kararlı durumda değil(O, N, vb.) entalpi de R 0 =101325Pa ve T 0 sıfıra eşit değil: .






