Termal entropi. Entropi. Termodinamiğin ikinci yasası. Termal ve soğutma makineleri. Carnot çevrimi ve verimliliği
Termodinamikteki ana işlemler şunlardır:
· izokorik, sabit hacimde akan;
· izobarik, akan sabit basınç;
· izotermal, meydana gelen Sabit sıcaklık;
· adyabatik ile ısı alışverişinin gerçekleştiği çevre eksik.
izokorik süreç
Sarkaç hareketi veya bilardo toplarının çarpışması gibi ters mekanik bir süreç filme alınır ve ardından tekrar oynatılırsa, görüntü oldukça inandırıcı görünecektir. Aynı zamanda, entropi artışına eşlik eden geri dönüşü olmayan süreçler, bir maytapın yanmasının, bir çivinin paslanmasının böyle bir bakış açısıyla pek olası görünmediğini söylüyor. Böylece entropi, geçmişi gelecekten ayırt etmeyi mümkün kılar.
Entropi miktarını gösteren bir cihaz mevcut değil. Aynı zamanda entropi veya değişimi hesaplanabilir. Burada bir mol metanımız varsa ve iki mol oksijenle reaksiyona girerse, bir mol karbondioksit ve iki mol su üreteceğimiz bir reaksiyon var. Bu videoda bu tepkimenin kendiliğinden olup olmadığı sorusuna cevap vermek istiyoruz. Ve son klipte, bu soruyu cevaplamak için Gibbs serbest enerjisine veya daha spesifik olarak Gibbs serbest enerjisindeki değişime başvurmamız gerektiğini öğrendik.
Bir izokorik süreçte, durum V= yapı
İdeal gaz hal denkleminden ( pV = RT)şöyle:
p/ T = R/V= sabit,
yani gaz basıncı onunla doğru orantılıdır mutlak sıcaklık:
p2 / p1 = T2/T 1 .
Bir izokorik süreçte entropideki değişim aşağıdaki formülle belirlenir:
Ve serbest enerjideki değişim, reaksiyonun entalpisindeki değişim eksi meydana geldiği sıcaklığa eşittir ve her şey entropideki değişimle çarpılır. Ve sıfırdan küçükse, kendiliğinden bir reaksiyon meydana gelir. Bunu birkaç klip önce yaptık. Yalnızca bu ürünlerin her birinin neden olduğu sıcaklığı görüntüleyebilirsiniz. 2 ayı varsa su onu 2 ile çarpacaktır. Yani bu ürünlerden üretilen ısımız var, aynısını diğer reaktanlardan da çıkarıyoruz. Bu da ekzotermik bir reaksiyonumuz olduğunu gösteriyor.
Denklemin bu tarafının daha az enerji içerdiğini - bir şekilde düşünebiliriz - bu taraftan. Çok az enerjinin serbest bırakılması gerekiyor. Bırakın da serbest bırakılacak enerji kadar yazayım. Bu yüzden ekzotermik bir reaksiyondur. Ama sorumuz şu: kendiliğinden mi? Bunun kendiliğinden olup olmadığını anlamak için deltalarımızı bulmamız gerekiyor. Deltaları bulmamıza yardımcı olması için zamanla bu moleküllerin her biri için standart molar entropiye baktık. Buradaki standart, sıfır karakteri - standart molar entropi - eklemektir ve "standart", 298 derece Kelvin anlamına gelir.
s 2 -s 1 = Δ s = Özgeçmiş ln( p2/p 1 ) = Özgeçmiş ln( T2/T 1 )
izobarik süreç
Bir izobarik süreç, sabit basınçta gerçekleşen bir süreçtir. p= yapı
İdeal bir gazın hal denkleminden şu sonuç çıkar:
V/T = R/p= yapı
Entropideki değişim şöyle olacaktır:
s 2 – s 1 = Δ s = cp ln( T 2 / T 1 ).
Aslında Kelvin derecelerinden bahsetmeme gerek yok. Bu 298 Kelvin, Kelvin'den bahsettiğimizde burada "derece" kelimesini kullanmanıza gerek yok. Yani bu 298 kelvin, yani 25 santigrat derece, yani bu oda sıcaklığı. Bu nedenle, standart sıcaklık olarak kabul edilir. Yani 1 mol metan varsa, 186 joule Kelvin entropisine sahibiz. Böylece, bu reaksiyonun entropisindeki toplam değişim, toplamdaki farktır. standart entropiürünler ve reaktanların toplam standart entropisi.
izotermal süreç
saat izotermal süreççalışma sıvısının sıcaklığı sabit kalır T= const, yani:
pV = RT= sabit
Entropideki değişim:
s 2 -s 1 = Δ s = R ln( p1/p 2 ) = R ln( V2/V 1 ).
Adyabatik süreç
Adyabatik bir süreç, çevre ile ısı alışverişi olmadan meydana gelen bir gazın durumundaki bir değişikliktir ( Q = 0).
Aynı şeyi entalpi için de yaptık. Ve bunu zaten gördüğümüz için bu sayı bu sayıya yakın ama çok daha fazla. Saf su çok daha düşüktür - bu saf suyun entropisidir. Oksijen gazından çok daha düşük entropiye sahiptir. Akışkan oluştuğundan, çok az durum vardır. Tüm sıvı, sanki şekil alıyor ve genişliyormuş gibi kabın dibine düşüyor. Başka bir deyişle, tek bir gaz, bir sıvıdan çok daha yüksek entropiye sahip olacaktır. Sadece buna bakarak, ürünlerimizin reaktanlardan daha düşük entropiye sahip olacağını görebiliriz.
Eğri Denklemi Adyabatik süreç(adyabatik) içinde p-V diyagram şöyle görünür:
pV k= yapı
Bu ifadede k denir adyabatik üs(Poisson oranı da denir).
Entropideki değişim:
Δ S = S 2 – S 1 = 0, şunlar.S 2 = S 1 .
Ve muhtemelen negatif bir sayı olacaktır. Şimdi bu birimler size mantıklı gelmeyebilir ve bunların geleneksel birimler olduğunu gerçekten biliyorsunuz. Ama hey, giderek zorlaşıyor diyebiliriz. Ve bir anlamı var, çünkü bir ton gaz var. 3 ayrı molekülümüz var, 1 burada ve 2 oksijen molekülü. Ve yine 3 moleküle gidiyoruz ama şimdi su berrak. Ve bence, entropi kaybında mantıklı. Her şeyden önce sıvının olabileceği birkaç koşul vardır.
Ama bu reaksiyonun kendiliğinden olup olmadığını öğrenelim. Bu kadar kesin olmak zorunda değiliz. Oda sıcaklığında veya 298 derece Kelvin'de olduğumuzu varsayıyoruz. Bu, 25 santigrat derece çarpı entropi değişimidir. Bu bir eksi olacak. Şimdi diyebiliriz ki, eksi 242, onu oraya koymak isteyebiliriz. Ama çok ama çok dikkatli olmalıyız. Ve zaten yazdıktan sonra her şeyi kilojul cinsinden yazmak istiyorsak, hadi kilojül cinsinden yazalım.
Faz geçişleri
Tersinir bir faz geçişinde sıcaklık sabit kalır ve ısı faz geçişi sabit basınçta H fp, yani entropideki değişiklik:
 .
.
Erime ve kaynama sırasında ısı emilir, bu nedenle bu işlemlerdeki entropi artar: S televizyon< S ve< S d. Bu durumda ortamın entropisi değer kadar azalır. S f.p. , bu nedenle, izole edilmiş bir sistemdeki tersinir bir süreç için beklendiği gibi, Evrenin entropisindeki değişim 0'dır.
Böylece, buradaki Gibbs serbest enerjimiz eksi 890 kilojul eksi 290 olacak, bunun eksi burada ve bir eksi artı artı daha olacak. Ve mantıklı - entropi Gibbs enerjisini daha pozitif hale getirecek. Ki bildiğimiz gibi burada 0'ın altına almak istediğimizde kendiliğinden savaşacak. Ama gerçek entalpinin, onun ekzotermik doğasının aşılabileceğini görelim. Bu mümkün görünüyor çünkü kesri bununla çarpıyoruz ve daha az elde ediyoruz. Bu bizim entropi değişim süremiz 298, sıcaklık eksi.
Ve bu kavram - oraya bir eksi koyar - ve artı 72 olur. Standart sıcaklıkta entropidir. Entalpinin, pozitif sıcaklık terimi çarpı entropideki değişimden çok daha negatif bir sayı olduğunu zaten görebiliriz. Yani, bu sefer kazanan. Ve bu reaksiyonda entropiyi kaybetsek de, o kadar çok enerji yayar ki kendiliğinden olur. Bu kesinlikle 0'dan küçüktür, bu nedenle kendiliğinden bir reaksiyon olacaktır. Gördüğümüz gibi, bu Gibbs serbest enerji problemleri o kadar da zor değil.
Termodinamiğin İkinci Yasası ve "Evrenin Isı Ölümü"
Clausius, termodinamiğin ikinci yasasını göz önünde bulundurarak, Evrenin kapalı bir sistem olarak entropisinin maksimum olma eğiliminde olduğu ve sonunda Evrendeki tüm makroskopik süreçlerin sona ereceği sonucuna varmıştır. Evrenin bu durumuna "termal ölüm" denir - daha fazla sürecin mümkün olmadığı küresel kaos. Öte yandan Boltzmann, Evrenin mevcut durumunun devasa bir dalgalanma olduğu görüşünü ifade etti; bu, Evrenin çoğu zaman hala bir termodinamik denge durumunda (“termal ölüm”) olduğu anlamına gelir.
Sadece bu boyutları bulmanız gerekiyor. Tüm ürünlerin oluşum sıcaklıklarına bakarız, reaktifleri çıkarırız ve tabii ki fırsatları bekleriz. Ve sonra, entropideki değişimi bulmak için aynısını yapıyoruz. Katsayılarla ürünlerin standart kütle molar entropisine bakmalı, reaktanları çıkarmalı ve sonra onu burada değiştirmeliyiz, bundan sonra esasen şunu elde ettik: bedava enerji Gibbs. Ve bu durumda olumsuz oldu. Şimdi çok daha fazla olduğumuz bir durumu hayal edebiliyoruz. Yüksek sıcaklık.
Landau'ya göre, bu çelişkiyi çözmenin anahtarı genel görelilik alanında yatmaktadır: Evren değişken bir yerçekimi alanında bir sistem olduğundan, entropi artışı yasası ona uygulanamaz.
Termodinamiğin ikinci yasası (Clausius'un formülasyonunda) evrenin kapalı bir sistem olduğu varsayımına dayandığından, bu yasanın başka tür eleştirileri de mümkündür. Modern fiziksel kavramlara göre, Evrenin sadece gözlemlenebilir kısmından bahsedebiliriz. Bu aşamada insanlık, evrenin var olduğunu kanıtlama fırsatına sahip değildir. kapalı sistem, ne de tersi.
Sonra birden işler ilginçleşiyor. Dolayısıyla, bu pozitif terim bunu aşacaktır ve muhtemelen çok, çok, çok, çok yüksek bir sıcaklığa kendiliğinden bir tepki olmayacaktır. Ve bunun hakkında farklı düşün. Ortada zaten çok miktarda ısı olduğunda veya açığa çıkan ısıyı ayıran sıcaklığı üreten reaksiyon o kadar büyük değildir veya kinetik enerji. Sıcaklık yeterince yüksek olsaydı, entropi olasılığı aşılacağı için bu reaksiyon kendiliğinden olmaz.
İnternette her şeye bakabilir ve kendiliğinden bir şeyler öğrenebilirsiniz. Bu değerlerden iki veya üçünün aynı anda değişmesiyle, gaz süreci. İdeal gaz, aşağıdaki yaklaşımların yapıldığı bir fiziksel gaz modelidir. Gerçek gazlar, oda sıcaklığında ve normal koşullarda ideal gazdan özellikleri bakımından farklılık göstermezler. atmosferik basınç. Farklar, çok düşük sıcaklıklarda ve atmosferik basınçlardan yüzlerce kat daha yüksek basınçlarda önemlidir.
entropi ölçümü
Gerçek deneylerde bir sistemin entropisini ölçmek çok zordur. Ölçüm teknikleri, entropinin termodinamik belirlenmesine dayanır ve son derece hassas kalorimetri gerektirir.
Basitlik için keşfedeceğiz mekanik sistem termodinamik durumları hacmine göre belirlenecek olan V ve basınç P. Belirli bir durumun entropisini ölçmek için önce ısı kapasitesini ölçmeliyiz. sabit hacim ve basınç (işaretli ÖZGEÇMİŞ ve C P sırasıyla) ilk durum ile istenen durum arasında başarılı bir durum kümesi için.
Bu koşullar altında, izotermal ve izobarik olmak üzere üç izomer gerçekleştirilebilir. İzolasyon yasaları, ideal gaz modelinin gereksinimlerini karşılayan gerçek gazlar için geçerlidir. Kanun ilk olarak Briton Robert Boyle ve Fransız Edme Marriot tarafından tanıtıldı. İzotermal bir işlemde, belirli bir miktarda gazın basınç ve hacminin ürünü sabit değer. P-diyagramındaki süreç grafiği, izoterm adı verilen bir eğridir.
Yasa Fransız Jacques Charles tarafından kabul edildi. Yalıtım işlemi sırasında, basıncın sıcaklığa oranı sabit kalır. P-diyagramındaki süreç grafiği, izokor adı verilen düz bir çizgidir. Animasyon, iki sabit basınç işlemini ve iki sürekli hacim işlemini içeren bir döngüyü gösterir. Dikdörtgenin yatay kenarları düz çizgilerdir - görüntüler ve dikey taraflar - düz çizgiler - isochori. Gazların izokratik bir süreçteki davranışı, şişelerin ve gaz tüplerinin doğrudan güneş ışığına maruz bırakılmasının yasaklanmasını kolayca açıklar.
Termal kapasiteler entropi ile ilgilidir S ve sıcaklık ile T formüle göre:

alt simge nerede X sabit hacim ve basıncı ifade eder. Entropi değişikliğini elde etmek için entegre edebiliriz:
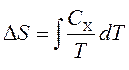
Yasa, Fransız Joseph Gauss-Lusak tarafından yayınlandı. Modifiye edilmiş süreçte, hacmin sıcaklığa oranı sabit kalır. P-diyagramındaki süreç grafiği, görüntü adı verilen düz bir çizgidir. Boyle-Marriott, Charles ve Gay-Lusak yasaları yalnızca ideal gazdır. İdeal gaz modeli, moleküllerin hacmini ve etkileşimini hesaba katmaz.
Çok düşük sıcaklıklarda, gerçek gazlar sıvılaşır ve ideal gaz yasaları artık onlar için geçerli değildir. Geri döndürülemez enerji yayılımının bir ölçüsü olarak Clausius, entropi terimini tanıttı. Entropi, sistemin durumunun bir fonksiyonudur, yani her durumda tam olarak tanımlanmış bir entropi değeri karşılaştırılabilir.
Böylece herhangi bir durumun entropi değerini elde edebiliriz ( P,V) başlangıç durumuna göre ( P 0 ,V 0). Kesin formül, ara durum seçimimize bağlıdır. Örneğin, ilk durum son durumla aynı basınca sahipse, o zaman
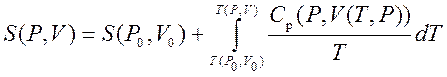 .
.
Örneğin, tersinir süreçler için değişimi aşağıdaki gibi ifade edilir. entropi değişimi farklı süreçler sistemlerde. Entropi, olasılık veya düzensizliğin bir ölçüsüdür. fiziksel sistem. İçinde bulunduğu bir sistemin kurucu unsurlarının olası konfigürasyonlarının veya düzenlemelerinin sayısını ifade eder. Genel form, şekil ve fiziksel özellikleri değişmez.
Entropideki artışın fiziksel anlamı, izole parçacıklı sistemin en küçük parçacık hareketi durumuna geçmesi gerektiğidir. Bu, parçacıkların hareketinin kaotik olduğu sistemin veya termodinamik dengenin en basit halidir. Yalıtılmış sistemlerde enerji dönüşüm süreçlerinin geri döndürülemez yönü, er ya da geç, her tür enerjinin ısıya dönüşmesine yol açar. Sistemin tüm unsurları arasında dağılmış ve eşit olarak dağıtılacaktır. Maksimum entropi, tam termodinamik denge, atomların ve moleküllerin yer değiştirmesinin durmaması, sistemin her iki parçası ve çevre arasındaki enerji alışverişinin kesintiye uğraması anlamına gelir - istatistiksel veya termodinamik kaos vardır.
Ek olarak, ilk ve son durumlar arasındaki yol herhangi bir birinci dereceden faz geçişinden geçiyorsa, gizli ısı geçişle ilgili de dikkate alınmalıdır.
Başlangıç durumunun entropisi bağımsız olarak belirlenmelidir. İdeal olarak, başlangıç durumu, sistemin bir gaz formunda var olduğu aşırı yüksek sıcaklıktaki durum olarak seçilir. Bu durumdaki entropi, klasik bir ideal gazınkine benzer ve buna ek olarak spektroskopik olarak belirlenebilen moleküler rotasyonlar ve titreşimlerden gelen katkılar.
Evren kapalıysa, sıcak bir ölümü bekliyor. Eski Yunanlılar kaostan kaynaklandığını iddia ediyor ve klasik termodinamiğin varsayımı altında oraya geri dönecek. Eğer evren sadece kaosa evrilmiş olsaydı, nasıl var olmuş ve şu andaki yapısal durumuna ulaşabilirdi?
Klasik termodinamik, kimsenin evrenin durağan doğası hakkında soru sormadığı bir çağda oluştu. O zamanlar, termodinamik yasalarının üzerindeki tek gölge Darwin'in evrim teorisinin dışına atılmıştı. Ona göre, flora ve faunanın gelişim süreci, organizasyon ve düzenin büyümesiyle birlikte sürekli bir komplikasyon ile karakterizedir. Canlı doğa termodinamik dengeye ve kaosa direnir. Açıkçası, cansız ve canlı doğanın gelişim yasaları birbiriyle çelişir.
teori laboratuvar işi
teorik bilgi
Bu çalışmada, entropi artışını belirlememizi sağlayacak olan, kalayın erime noktası olan faz geçiş sıcaklığını ölçmek gereklidir.
Tersinir süreçler için entropi d artışı S=d Q/T, ve sistemin durumdan geçişi sırasında entropi değişimi a bir duruma b
 ,
,
daha sonra, kalay ısıtma ve eritme sırasındaki entropi değişimi, erime noktasına kadar ısıtma ve kalayın erimesi sırasında entropideki değişimin toplamı olarak tanımlanır:
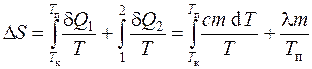 veya
veya
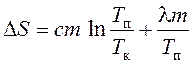 , (10)
, (10)
D nerede Q bir sıcaklıkta sisteme aktarılan sonsuz küçük miktardaki ısıdır. T;
d Q 1 ve d Q 2 - ısıtma ve eritme sırasında kalay tarafından alınan sonsuz küçük miktarlarda ısı;
T k, başlangıç (oda) sıcaklığıdır;
T n, erime noktasıdır;
l \u003d 59 10 -3 J / kg - özısı erime;
c = 0.23 10 -3 J/(kg K) – özısı,
m = 0,20 kg tenekenin kütlesidir.
Termodinamiğin ikinci yasasının bazı formülasyonları
1. Kendi haline bırakılan her sistem, ortalama olarak maksimum olasılıkla durum yönünde değişir (G. Lewis).
2. Maksimum entropiye sahip durum, aşağıdakiler için en kararlı durumdur. yalıtılmış sistem(E. Fermi).
3. Herhangi bir gerçek süreç sırasında, ona katılan sistemlerin her birini orijinal durumuna geri döndürmek için araçlar sağlamak imkansızdır (G. Lewis).
4. Her birey veya kimyasal işlem doğada, bu süreçte yer alan tüm cisimlerin entropilerinin toplamı artacak şekilde ilerler (M. Planck).
5. Daha soğuk bir cisimden daha sıcak bir cisme kendiliğinden ısı transferi imkansızdır.
6. Bilgi almak entropide bir azalmadır (G. Lewis).
7. Entropi zamanın okudur* (A. Eddington).
Kimyasal reaksiyonlarda entropi değişiklikleri
Bir mol maddenin entropisi standart durum uygun sıcaklıkta, standart molar entropi olarak adlandırılır. Standart molar entropi S "sembolü ile gösterilir ve JK-1 mol-1 boyutuna sahiptir. Tablo 5.12, 25 ° C sıcaklıkta bir dizi element ve bileşiğin standart molar entropilerini gösterir. Standart molar entropinin gazların, kural olarak, entropi ile karşılaştırıldığında çok daha büyük değerlere sahiptir. katılar. Herhangi bir sabit miktardaki maddenin entropisi aşağıdaki sırayla artar:
Katı = Sıvı = Gaz
Standart molar entropilere bazen mutlak entropiler denir. Bir bileşiğin serbest elementlerinden oluşumuna eşlik eden entropi değişiklikleri değildir. Ayrıca, serbest elemanların standart molar entropilerinin (formda basit maddeler) sıfıra eşit değildir.
Termodinamiğin üçüncü yasası, mutlak sıfır (OK) sıcaklığında ideal bir iyonik kristalin entropisinin sıfır olduğunu belirtir.
Tablo 5.12. Standart molar entropiler S°(298 K) (J/(K mol))
Standart molar entropideki değişim Kimyasal reaksiyon denklem tarafından belirlenir
Dikkate alınan örnekteki entropi değişiminin negatif olduğu belirtilmelidir. Söz konusu reaksiyonun denklemine göre, gaz halindeki reaktiflerin toplam miktarının 1.5 mol olduğunu ve gaz halindeki ürünlerin toplam miktarının sadece 1 mol olduğunu hesaba katarsak bu beklenebilir. Böylece reaksiyon sonucunda toplam gaz miktarında bir azalma meydana gelir. Aynı zamanda, yanma reaksiyonlarının ekzotermik reaksiyonlar olduğunu biliyoruz. Sonuç olarak, akışlarının sonucu enerjinin dağılmasıdır ve bu, entropide azalma değil, bir artış beklememize neden olur. Ayrıca, ilk başlatmanın neden olduğu hidrojen gazının 25°C'de yanmasının daha sonra kendiliğinden ve büyük bir yoğunlukla ilerlediği dikkate alınmalıdır. Ama bu tepkimedeki entropi değişimi bu durumda termodinamiğin ikinci yasasının gerektirdiği gibi pozitif olması gerekmez mi? Görünüşe göre - hayır ya da en azından zorunlu değil. Termodinamiğin ikinci yasası, kendiliğinden gerçekleşen bir sürecin sonucu olarak sistemin ve çevresinin toplam entropisinin artmasını gerektirir. Yukarıda hesaplanan entropi değişimi, yalnızca hidrojen gazının 25°C'de yanmasına katılan reaktanlardan ve ürünlerden oluşan dikkate alınan kimyasal sistemi karakterize eder. Ancak bu sistemin ortamı için entropi değişikliği nasıl hesaplanır?






