Si quhet një proces që ndodh në vëllim konstant? Çfarë është termodinamika
Tërësia e ndryshimeve në gjendjen e një sistemi termodinamik gjatë kalimit nga një gjendje në tjetrën nën ndikimin e mjedisit quhet proces termodinamik.
Gjendja e një gazi në të cilën secili prej parametrave të tij në të gjithë masën ka të njëjtën vlerë quhet gjendja e ekuilibrit.
Proceset termodinamike mund të jenë ekuilibër dhe jo ekuilibër.
Një proces ekuilibri është një proces që kalon nëpër gjendje ekuilibri, d.m.th. kur parametrat e gazit (vëllimi specifik, presioni dhe temperatura) janë të njëjta në të gjitha pikat e vëllimit. Proceset e ekuilibrit ecin pafundësisht ngadalë dhe përbëhen nga një numër pafundësisht i madh gjendjesh ekuilibri, dhe në çdo kohë ndërmjet trupit punues dhe mjedisi vendoset një ekuilibër, domethënë midis mjedisit dhe lëngut punues, ndryshimi në temperaturë dhe presion është pafundësisht i vogël. Proceset e ekuilibrit për çdo moment të kohës kanë vlera fikse të parametrave kryesorë, kështu që ato mund të përshkruhen grafikisht duke përdorur diagrame (PV, TS-diagrame).
Proceset reale janë jo ekuilibër. Jo uniformiteti i proceseve reale përcaktohet, para së gjithash, nga fakti se nën ndikimin e kushteve të jashtme ato vazhdojnë me shpejtësi të kufizuara dhe gjendja e ekuilibrit nuk ka kohë të vendoset në trupin punues (parametrat e gjendjes në të gjithë masa e gazit nuk është e njëjtë).
Termodinamika merr në konsideratë kryesisht gjendjet e ekuilibrit dhe proceset e ekuilibrit të ndryshimit të gjendjes së një gazi. Proceset e ekuilibrit kanë vetinë e kthyeshmërisë, e cila qëndron në faktin se ato mund të kalohen në drejtim të kundërt nëpër të gjitha gjendjet e procesit të drejtpërdrejtë.
Proceset e kthyeshme janë procese që vazhdojnë si në drejtimin përpara ashtu edhe në drejtim të kundërt përmes të njëjtave gjendje ekuilibri. Në të njëjtën kohë, në fund të tyre, nuk mbetet asnjë ndryshim në vetë sistemin ose në mjedis.
Kushtet kryesore për kthyeshmërinë e proceseve janë:
Kushti për kthyeshmërinë e jashtme është prania e ekuilibrave termike dhe mekanike, d.m.th. barazia e temperaturave dhe presioneve të lëngut punues dhe mjedisit;
Kushti i kthyeshmërisë së brendshme është mungesa e fërkimit, difuzionit dhe proceseve të tjera të drejtuara në mënyrë të njëanshme.
Në motorët dhe aparatet me nxehtësi, proceset zhvillohen në një ndryshim të kufizuar të temperaturës midis burimit dhe lëngut të punës, kështu që procese të tilla janë të pakthyeshme. Të gjitha proceset reale në kushtet tokësore janë të pakthyeshme.
Të gjitha varësitë analitike në termodinamikë, të cilat karakterizojnë proceset e ndryshimit të gjendjes, i referohen proceseve të kundërta. Kalimi nga proceset e kthyeshme në ato reale, të pakthyeshme kryhet duke futur koeficientët empirikë që marrin parasysh devijimet e proceseve reale nga ato të kthyeshme.
Termodinamika është shkenca që studion dukuritë termike që ndodhin në trupa pa i lidhur ato me strukturën molekulare të materies.
Në termodinamikë, konsiderohet se të gjitha proceset termike në trupa karakterizohen vetëm nga parametra makroskopikë- presioni, vëllimi dhe temperatura. Dhe meqenëse ato nuk mund të aplikohen në molekula ose atome individuale, atëherë, ndryshe nga teoria molekulare-kinetike, në termodinamikë struktura molekulare e një substance në proceset termike nuk merret parasysh.
Të gjitha konceptet e termodinamikës janë formuluar si një përgjithësim i fakteve të vëzhguara gjatë eksperimenteve. Për shkak të kësaj, ajo quhet teoria fenomenologjike (përshkruese) e nxehtësisë.
Sistemet termodinamike

Termodinamika përshkruan proceset termike që ndodhin në sistemet makroskopike. Sisteme të tilla përbëhen nga një numër i madh grimcash - molekula dhe atome, dhe quhen termodinamikë.
sistemi termodinamik mund të konsiderohet çdo objekt që mund të shihet sy të lirë ose me ndihmën e mikroskopëve, teleskopëve dhe instrumenteve të tjera optike. Gjëja kryesore është se dimensionet e sistemit në hapësirë dhe koha e ekzistencës së tij bëjnë të mundur matjen e parametrave të tij - temperaturën, presionin, masën, përbërje kimike elemente, etj., duke përdorur pajisje që nuk i përgjigjen efekteve të molekulave individuale (matësit e presionit, termometrat, etj.).
Për kimistët, një sistem termodinamik është një përzierje e kimikateve që ndërveprojnë me njëri-tjetrin në proces reaksion kimik. Astrofizikanët do ta quajnë një sistem të tillë trup qiellor. Një përzierje e karburantit dhe ajrit në një motor automobili, globi, trupi ynë, një stilolaps shkrimi, një fletore, një vegël makine etj. janë gjithashtu sisteme termodinamike.
Çdo sistem termodinamik është i ndarë nga mjedisi me kufij. Ato mund të jenë reale - muret e qelqit të një provëz me kimike, trupi i cilindrit në motor, etj. Dhe ato mund të jenë të kushtëzuara, kur, për shembull, ata studiojnë formimin e një reje në atmosferë.
Nëse një sistem i tillë nuk ndërrohet me mjedisi i jashtëm as energji as materie, quhet i izoluar ose mbyllur .
Nëse sistemi shkëmben energji me mjedisin e jashtëm, por nuk shkëmben materie, atëherë quhet mbyllur .
sistem i hapur shkëmben energjinë dhe lëndën me mjedisin.
Ekuilibri termodinamik

Ky koncept futet edhe në termodinamikë si përgjithësim i rezultateve eksperimentale.
Ekuilibri termodinamik quhet një gjendje e tillë e sistemit në të cilën të gjitha sasitë e tij makroskopike - temperatura, presioni, vëllimi dhe entropia - nuk ndryshojnë në kohë nëse sistemi është i izoluar. Çdo sistem i mbyllur termodinamik mund të kalojë spontanisht në një gjendje të tillë nëse të gjithë parametrat e jashtëm mbeten konstante.
Shembulli më i thjeshtë i një sistemi në ekuilibër termodinamik është një termos me çaj të nxehtë. Temperatura në të është e njëjtë në çdo pikë të lëngut. Edhe pse një termos mund të quhet një sistem i izoluar vetëm përafërsisht.
Çdo sistem termodinamik i mbyllur spontanisht tenton të shkojë në ekuilibër termodinamik nëse parametrat e jashtëm nuk ndryshojnë.
Procesi termodinamik

Nëse të paktën një nga parametrat makroskopikë ndryshon, atëherë ata thonë se sistemi është procesi termodinamik . Një proces i tillë mund të ndodhë nëse parametrat e jashtëm ndryshojnë ose sistemi fillon të marrë ose transmetojë energji. Si rezultat, ajo kalon në një gjendje tjetër.
Konsideroni shembullin e çajit në një termos. Nëse zhysim një copë akulli në çaj dhe mbyllim termosin, atëherë menjëherë do të ketë një ndryshim në temperatura në pjesë të ndryshme të lëngut. Lëngu në termos do të tentojë të barazojë temperaturat. Nga zonat me temperaturë më të lartë, nxehtësia do të transferohet atje ku temperatura është më e ulët. Kjo do të thotë, do të ndodhë një proces termodinamik. Në fund, temperatura e çajit në termos do të bëhet përsëri e njëjtë. Por tashmë do të jetë ndryshe nga e para temperatura fillestare s. Gjendja e sistemit ka ndryshuar sepse temperatura e tij ka ndryshuar.
Procesi termodinamik ndodh kur rëra e ngrohur në plazh në një ditë të nxehtë ftohet gjatë natës. Në mëngjes, temperatura e tij bie. Por sapo të lindë dielli do të nisë sërish procesi i ngrohjes.
Energjia e brendshme

Një nga konceptet kryesore të termodinamikës është energjia e brendshme .
Të gjithë trupat makroskopikë kanë energji të brendshme, e cila është shuma e energjive kinetike dhe potenciale të të gjitha grimcave (atomeve dhe molekulave) që përbëjnë trupin. Këto grimca ndërveprojnë vetëm me njëra-tjetrën dhe nuk ndërveprojnë me grimcat e mjedisit. Energjia e brendshme varet nga kinetika dhe energji potenciale grimca dhe nuk varet nga pozicioni i vetë trupit.
U = E k + E p
Energjia e brendshme ndryshon me temperaturën. Teoria kinetike molekulare e shpjegon këtë duke ndryshuar shpejtësinë e lëvizjes së grimcave të materies. Nëse temperatura e trupit rritet, atëherë shpejtësia e lëvizjes së grimcave rritet, distanca midis tyre bëhet më e madhe. Rrjedhimisht, energjia e tyre kinetike dhe potenciale rritet. Kur temperatura bie, ndodh procesi i kundërt.
Për termodinamikën, nuk është sasia ajo që është më e rëndësishme energjia e brendshme, por ndryshimi i saj. Dhe mund ta ndryshoni energjinë e brendshme duke përdorur procesin e transferimit të nxehtësisë ose duke bërë punë mekanike.
Ndryshimi i energjisë së brendshme nga puna mekanike

Benjamin Rumford
Energjia e brendshme e një trupi mund të ndryshohet duke kryer punë mekanike në të. Nëse punohet në trup, atëherë energjia mekanike shndërrohet në energji të brendshme. Dhe nëse puna kryhet nga trupi, atëherë energjia e tij e brendshme shndërrohet në energji mekanike.
Pothuajse për të fundi i XIX shekulli besohej se ekziston një substancë pa peshë - kalori, e cila transferon nxehtësinë nga trupi në trup. Sa më shumë kalori të rrjedhë në trup, aq më i ngrohtë do të jetë dhe anasjelltas.
Sidoqoftë, në 1798, shkencëtari anglo-amerikan Konti Benjamin Rumford filloi të dyshonte në teorinë e kalorive. Shkak për këtë ishte ngrohja e tytës së armës gjatë shpimit. Ai sugjeroi se shkaku i ngrohjes është puna mekanike që bëhet gjatë fërkimit të shpimit në fuçi.
Dhe Rumfoord bëri një eksperiment. Për të rritur forcën e fërkimit, ata morën një stërvitje të hapur dhe vetë fuçi u vendos në një fuçi me ujë. Nga fundi i orës së tretë të shpimit, uji në fuçi filloi të vlonte. Kjo do të thoshte se fuçi merrte nxehtësi kur u krye punë mekanike në të.
Transferim i nxehtësisë
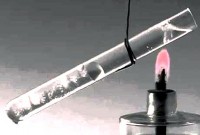
transferim i nxehtësisë thirrur procesi fizik transferimi i energjisë termike (nxehtësia) nga një trup në tjetrin ose me kontakt të drejtpërdrejtë ose përmes një ndarjeje ndarëse. Si rregull, nxehtësia transferohet nga një trup më i ngrohtë në një më të ftohtë. Ky proces përfundon kur sistemi vjen në një gjendje ekuilibri termodinamik.
Energjia që merr ose lëshon një trup gjatë transferimit të nxehtësisë quhet sasia e nxehtësisë .
Sipas metodës së transferimit të nxehtësisë, transferimi i nxehtësisë mund të ndahet në 3 lloje: përçueshmëri termike, konventë, rrezatim termik.
Përçueshmëri termike

Nëse ka një ndryshim të temperaturës midis trupave ose pjesëve të trupave, atëherë do të ndodhë një proces transferimi i nxehtësisë midis tyre. përçueshmëri termike quhet procesi i transferimit të energjisë së brendshme nga një trup më i nxehtë (ose një pjesë e tij) në një trup më pak të nxehtë (ose një pjesë të tij).
Për shembull, duke ngrohur njërin skaj të një shufre çeliku në zjarr, pas një kohe do të ndjejmë se edhe skaji tjetër i tij bëhet i ngrohtë.
Ne mbajmë lehtësisht një shufër qelqi, njëra skaj i së cilës është e nxehtë, nga ana tjetër, pa djegur veten. Por nëse përpiqemi të bëjmë të njëjtin eksperiment me një shufër hekuri, do të dështojmë.
Substanca të ndryshme e përcjellin nxehtësinë ndryshe. Secili prej tyre ka të vetin koeficienti i përçueshmërisë termike, ose përçueshmëri, numerikisht e barabartë me sasinë e nxehtësisë që kalon përmes një kampioni 1 m të trashë, me sipërfaqe 1 m 2 në 1 sekondë. 1 K merret si njësi e temperaturës.
Metalet e përcjellin më së miri nxehtësinë. Kjo është vetia e tyre që ne përdorim në jetën e përditshme, duke gatuar në tenxhere apo tigane metalike. Por dorezat e tyre nuk duhet të nxehen. Prandaj, ato janë bërë nga materiale me përçueshmëri të dobët termike.
Përçueshmëria termike e lëngjeve është më e vogël. Dhe gazrat kanë përçueshmëri të dobët termike.
Leshi i kafshëve është gjithashtu një përcjellës i dobët i nxehtësisë. Falë kësaj, ata nuk nxehen në mot të nxehtë dhe nuk ngrijnë në mot të ftohtë.
Konventa
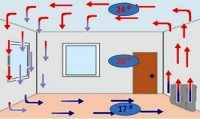
Sipas konvencionit, nxehtësia transferohet nga avionët dhe rrjedhat e gazit ose lëngut. Nuk ka konventë në trupat e ngurtë.
Si lind një konventë në një lëng? Kur vendosim një kazan me ujë në zjarr, shtresa e poshtme e lëngut nxehet, densiteti i tij ulet, lëviz lart. Vendin e saj e zë një shtresë më e ftohtë uji. Pas ca kohësh, ai gjithashtu do të nxehet dhe gjithashtu do të ndryshojë vendet me një shtresë më të ftohtë. etj.
Një proces i ngjashëm ndodh në gazrat. Nuk është rastësi që bateritë e ngrohjes vendosen në fund të dhomës. Në fund të fundit, ajri i nxehtë gjithmonë ngrihet në krye të dhomës. Dhe më i ulëti, i ftohtë, përkundrazi, bie. Pastaj nxehet dhe ngrihet përsëri, ndërsa shtresa e sipërme ftohet dhe fundoset gjatë kësaj kohe.
Konventa është e natyrshme dhe e detyruar.
Konventa natyrore po ndodh vazhdimisht në atmosferë. Si rezultat i kësaj, ka lëvizje të vazhdueshme të masave të ajrit të ngrohtë lart, dhe ato të ftohta - poshtë. Rezultati është era, retë dhe fenomene të tjera natyrore.
Kur konvencioni natyror nuk mjafton, unë përdor konventën e detyruar. Për shembull, ajri i ngrohtë rrjedh në një dhomë me ndihmën e teheve të ventilatorit.
rrezatimi termik

Dielli ngroh tokën. Nuk ka asnjë transferim të nxehtësisë ose konventë të përfshirë. Pra, pse trupat ngrohen?
Fakti është se Dielli është një burim i rrezatimit termik.
rrezatimi termik - kjo është rrezatimi elektromagnetik gjenerohet nga energjia e brendshme e trupit. Të gjithë trupat rreth nesh rrezatojnë energji termike. Kjo mund të jetë dritë e dukshme nga një llambë tavoline, ose burime të rrezeve të padukshme ultravjollcë, infra të kuqe ose gama.
Por trupat nuk rrezatojnë vetëm nxehtësi. Ata gjithashtu e konsumojnë atë. Disa në një masë më të madhe, të tjerët në një masë më të vogël. Për më tepër, trupat e errët nxehen dhe ftohen më shpejt se ato të lehta. Në mot të nxehtë përpiqemi të veshim rroba me ngjyra të çelura, sepse thithin më pak nxehtësi se rrobat me ngjyrë të errët. Një makinë me ngjyrë të errët nxehet në diell shumë më shpejt se një makinë me ngjyrë të hapur që qëndron pranë saj.
Kjo veti e substancave për të thithur dhe rrezatuar nxehtësinë në mënyra të ndryshme përdoret në krijimin e sistemeve të shikimit të natës, sistemeve të strehimit të raketave, etj.
Si rezultat i ndikimit në lëngun e punës (gazit, avullit) të mjedisit të jashtëm, për shembull, ngjeshja, zgjerimi, ngrohja, etj., ndryshojnë parametrat e gjendjes së tij.
Çdo ndryshim në parametrat e gjendjes së trupit punues quhet procesi termodinamik.
Siç u përmend më lart, ekzistojnë gjendje ekuilibri dhe joekuilibri të lëngut punues. Procesi termodinamik në të cilin një sistem kalon nëpër një seri të vazhdueshme gjendjesh ekuilibri quhet ekuilibri. Kushti kryesor për gjendjen e ekuilibrit të lëngut të punës është barazia e temperaturës dhe presionit në të gjithë masën e tij. Proceset e ekuilibrit janë të kthyeshme.
Proceset jo ekuilibër quhen procese reale që ecin me një shpejtësi të kufizuar, ndërsa puna e shpenzuar në ngjeshje do të jetë më e madhe se në një proces ekuilibri (për shkak të forcave të fërkimit, inercisë etj.).
Proceset jo-ekuilibër janë të pakthyeshme.
Gjatë studimit të proceseve termodinamike, ato përdoren imazhe grafike, në veçanti, në sistemin koordinativ r dhe J, i quajtur rJ-diagram.
Presionet absolute r vizatohen përgjatë boshtit të ordinatave dhe vëllimet specifike të gazit paraqiten përgjatë boshtit të abshisës. Për vlerat e njohura të r dhe J, gjendja e ekuilibrit përfaqësohet nga një pikë.
Figura 1 tregon një proces ekuilibri arbitrar. Kur gazi kalon nga gjendja fillestare 1 në gjendjen përfundimtare 2, ka një ulje të presionit dhe një rritje në vëllimin specifik. Ky është një proces zgjerimi që konsiderohet një proces i drejtpërdrejtë. Procesi i kompresimit (nga pika 2 në pikën 1) konsiderohet i kundërt.
Të gjitha temat në këtë seksion:
TERMODINAMIKA DHE PROBLEMET E SAJ
Proceset e shkëmbimit të energjisë ndodhin në çdo fenomen të botës përreth. Prandaj, termodinamika, si shkencë e transformimit të ndërsjellë të nxehtësisë dhe punës, ofron metoda për studimin e fushave energjetike.
GJENDJET E ORGANIT PUNE
Një sistem termodinamik është një grup trupash materiale që janë në ndërveprim mekanik dhe termik me njëri-tjetrin dhe me trupat përreth. Termodi
DHE GAZRA REAL
Gazet reale në presione të ulëta janë afër idealit, pasi në këtë rast mund të neglizhohen forcat e bashkëveprimit ndërmolekular dhe vëllimi i molekulave. Kjo vlen veçanërisht për oksigjenin, ajrin
PËRZIERJE GAZORE
Në praktikë, si rregull, nuk përdoret asnjë gaz homogjen si lëng pune, por një përzierje gazi: ajri, produktet e djegies. lloje te ndryshme karburantet, gazet natyrore etj.
KAPACITETI I VËRTETË DHE MESATAR NXEHTËSOR
Kapacitetet e nxehtësisë mund të jenë masive, vëllimore, molare. Kapaciteti termik i 1 kg gaz quhet masë: shënohet me shkronjën c dhe matet me J / (kg. K). Ato
KAPACITETET NXEHTËSORE TË NJË GAZIT IDEAL
Siç u përmend më lart, temperatura e gazit me të njëjtën sasi të nxehtësisë së furnizuar q ndryshon ndryshe në varësi të natyrës së procesit termodinamik. Do te thote,
Vlerat e kapaciteteve molare të nxehtësisë dhe koeficienti k në varësi të atomicitetit
Gaz mсJ mav mсJ mav k
KAPACITETI NXEHTËSOR I PËRZIERJEVE TË GAZIT
Kapaciteti i nxehtësisë i një përzierjeje gazi, si dhe i gazeve individuale, mund të referohet në 1 kg, 1 m3 ose 1 kmol. Nëse përzierja jepet me fraksione në masë, atëherë kapaciteti i saj i nxehtësisë në masë
DHE ENERGJIA E BRENDSHME
Puna kryhet vetëm kur vëllimi i gazit ndryshon. Nëse gazi zgjerohet, atëherë puna kryhet kundër forcave të jashtme; kur kompresohet, përkundrazi, gazi merr punë
Nxehtësia
Nxehtësia është një formë e lëvizjes së grimcave më të vogla të një trupi. Transferimi i nxehtësisë nga një trup në tjetrin kryhet ose me kontakt të drejtpërdrejtë midis tyre (përçueshmëri termike,
LIGJI I PARË I TERMODINAMIKËS
Ligji i parë i termodinamikës është rast i veçantë ligji universal i ruajtjes dhe transformimit të energjisë në lidhje me proceset termike. Formulimi i ligjit të parë
PROCESET TERMODINAMIKE NË GAZET
Çdo ndryshim në gjendjen e lëngut të punës (gazit) në rastin e përgjithshëm karakterizohet nga një ndryshim në parametrat kryesorë të tij: r, J, T. Gjendja e gazit ndryshon në dy mënyra: duke i thënë ato
ENTROPIA E GAZIT
Në studim, të gjitha proceset konsiderohen si ekuilibër dhe të kthyeshëm. Para se të shqyrtojmë procedurën për studimin e proceseve termodinamike, ne prezantojmë parametrin e pestë
PROCESI ISOKORIKE
Një proces që ndodh në një vëllim specifik konstant quhet izokorik. Procesi izokorik përdoret, në veçanti, në llogaritjet ciklet teorike motorë të karburuar
PROCESI ISOBAR
Një proces që zhvillohet me presion konstant quhet izobarik. Një proces i tillë termodinamik mund të zhvillohet në një cilindër, pistoni i të cilit lëviz pa fërkime, kështu që
ENTALPI E GAZIT
Në proceset që lidhen me llogaritjen e impianteve të kaldajave, turbinave me avull, si dhe me tharjen dhe ftohjen e produkteve bujqësore, parametri i gjendjes së lëngut punues (ha
PROCESI IZOTEMAL
Procesi që zhvillohet në temperaturë konstante lëngu i punës quhet izotermik. Është e mundur, për shembull, në cilindrin e një makine reciproke, nëse, si nxehtësi q i jepet punës.
PROCESI ADIABATIK
Një proces adiabatik është një proces që kryhet pa shkëmbim nxehtësie midis gazit dhe mjedisit (q = 0). Përdorimi praktik i këtij procesi është në grykat e avullit t
PROCESI POLITROPIK
Në të gjithë motorët me nxehtësi reale (motorët djegia e brendshme- motorët me djegie të brendshme, kompresorët, njësitë e turbinave me gaz, etj.) proceset e ngjeshjes së lëngut të punës (gazit), djegia e karburantit, zgjerimi
Rezultatet e analizës së proceseve politropike
Grupi Kufijtë e ndryshimit të indeksit politropik Ndryshimi i energjisë së brendshme Furnizimi (heqja) e nxehtësisë Ngrohtë
PROCESET RREKULLORE
Një proces i mbyllur, si rezultat i të cilit gazi, pasi kalon nëpër një sërë gjendjesh të ndryshme, kthehet në gjendjen e tij origjinale, quhet proces rrethor(cikli). Le të shpjegojmë këtë përkufizim.
CIKLI CARNO I KTHYSHËM DIREKT
Në 1824, S. Carnot propozoi një cikël, të cilit iu dha emri i tij. Një cikël i kthyeshëm i drejtpërdrejtë (d.m.th., i përbërë vetëm nga procese të ekuilibrit, të kthyeshëm) Cikli Carnot është një cikël ideal.
CIKLI I KTHYSHËM I KARNO
Ky cikël është cikli i përsosur makinat ftohëse. Imazhi i ciklit të kundërt të Carnot është paraqitur në figurën 10. Cikli përbëhet nga të njëjtat procese si cikli i drejtpërdrejtë, por gjendja p
LIGJI I DYTË I TERMODINAMIKËS
Ligji i parë i termodinamikës përcakton ekuivalencën e nxehtësisë dhe punës si dy forma të transferimit të energjisë. Megjithatë, ky ligj nuk thotë asgjë për kushtet për transformimin e nxehtësisë dhe
KOMPRESORËT
Motorët me djegie të brendshme (ICE) quhen makina reciproke termike, në të cilat produktet e djegies së lëndëve djegëse të lëngshme ose të gazta përdoren si një lëng pune, duke djegur
MOTORËT ME DJEGJE TË BRENDSHME
Për të analizuar funksionimin e motorit me djegie të brendshme dhe për të përcaktuar treguesit kryesorë (fuqia e treguesit, efikasiteti mekanik) në një cilindër pune, regjistrohet një diagram tregues duke përdorur një tregues, etj.
CIKLET E UMBËTAREVE TË TURBINAVE TË GAZIT
Njësitë e turbinave me gaz (GTU) kanë një avantazh të rëndësishëm në krahasim me motorët me djegie të brendshme - mungesa e mekanizmave reciproke në GTU bën të mundur ndërtimin e tyre me shpejtësi të lartë.
KOMPRESORË PISTONI
Ajri i kompresuar përdoret gjerësisht në proceset teknologjike, veçanërisht për drejtimin e mekanizmave pneumatikë, çekiçët, vibratorët, ngritësit pneumatikë, për transportimin e materialeve me shumicë.
AVUJT E UJIT
Avulli i ujit si lëng pune përdoret gjerësisht në turbinat me avull, të cilët janë motorët kryesorë të nxehtësisë në termocentralet dhe ato bërthamore. Në cilësi
DIAGRAM RV- DHE Ts-AVULLI I UJIT
Avullimi mund të kryhet me avullim ose zierje. Avullimi quhet avullim, që ndodh vetëm nga sipërfaqja e lëngut. Ky proces ka të bëjë me
DIAGRAM Hs-AVULLI I UJIT
Në praktikën inxhinierike, proceset termodinamike me avujt e ujit llogariten duke përdorur diagramin hs. Ky diagram është ndërtuar në BRSS deri në një presion prej 100.0 MPa dhe një temperaturë prej 1000
PARAMETRAT E UJIT DHE AVULLIT E UJIT
Në studime, përgjithësisht pranohet se në 0 0С dhe çdo presion, entalpia h0, energjia e brendshme u0, entropia s0 e ujit janë të barabarta me zero. Në foto
CIKLI CARNO PËR AVULLI I UJIT
Cikli ideal më i përsosur i një termocentrali me avull është cikli i drejtpërdrejtë i kthyeshëm Carnot, efikasiteti termik i të cilit, siç u përmend më lart, është maksimal në një interval të caktuar të temperaturës dhe nuk e kalon
CIKLI RANKIN
Cikli ideal kryesor i termocentraleve me avull është cikli Rankine. Figura 24 tregon një diagram skematik të një termocentrali me avull që funksionon sipas ciklit Rankine, dhe Figura 25 tregon rJ- dhe Ts-di
CIKLI RANKIN
Studimi i shprehjes për termike efikasiteti i ciklit Rankine në parametra të ndryshëm të avullit fillestar (në hyrjen e turbinës me avull) dhe përfundimtar (në hyrjen e kondensatorit) na lejon të konkludojmë se fillimisht
AJRI I LAGËGUR
Si lëng pune, ajri atmosferik përdoret në tharjen, ngrohjen, ftohjen e materialeve të ndryshme, në njësitë e kondicionimit etj. ajri atmosferik bashkë
AJRI I lagësht
Sipas ligjit të Daltonit, presioni i përzierjes së gazeve është i barabartë me shumën e presioneve të pjesshme të përbërësve të saj: pnl.v. = pс.v. + pv.p., (128) &nbs
AJRI I LAGËSHTAR I LAGËSHTUR HD-GRAFIK
Ky grafik ju lejon të përcaktoni më thjesht dhe shpejt parametrat e ajrit të lagësht. Në diagramin Hd (Fig. 27, a), përmbajtja e lagështisë d (g / kg ajër të thatë) është paraqitur përgjatë boshtit të abshisës,
KONCEPTE DHE PËRKUFIZIMET THEMELORE
Një nga konceptet bazë të përçueshmërisë termike është fusha e temperaturës. Temperatura është një nga parametrat kryesorë që karakterizojnë gjendjen termike të lëngut ose mediumit të punës. Agregat
LIGJI FURIER
Ligji i Furierit vendos një marrëdhënie sasiore midis fushës së temperaturës dhe intensitetit të përhapjes së nxehtësisë në të përmes përcjelljes së nxehtësisë. Sipas ligjit Furier, ve
NË MOGJIN E STACIONAR
Përçueshmëria termike e një muri të sheshtë me një shtresë. Skema e përhapjes së nxehtësisë për këtë rast është paraqitur në figurën 30. Lëreni nxehtësinë të përhapet në një mur të kufizuar nga avulli
TRANSFERIMI KONVEKTIV Nxehtësie
Në praktikë, më së shpeshti është e nevojshme të llogaritet transferimi konvektiv i nxehtësisë midis një lëngu (gazi) dhe një sipërfaqeje trup i fortë ose kanal (tub) nëpër të cilin rrjedh. Nëse pr
KUR LËNGJI VLON
Transferimi i nxehtësisë gjatë zierjes së lëngshme shoqërohet me një ndryshim gjendja e grumbullimit trupi punues. Ky fenomen ka veçori specifike dhe ka një rëndësi të madhe praktike për energjinë
DHE LIGJET E RREZATIMIT
Transferimi i nxehtësisë nga rrezatimi është procesi i transferimit të nxehtësisë në formën e valëve elektromagnetike (fotone). Ky lloj transferimi i nxehtësisë kryhet në tre faza: energjia e brendshme e trupit në fillim të
TRANSFERIMI I NXEHTËSISË NGA RREZATIMI
Njohja e ligjeve të rrezatimit bën të mundur marrjen e formulave të llogaritjes për transferimin e nxehtësisë rrezatuese midis trupave. Në veçanti, formula (155) përdoret në përcaktimin e emetimit
TRANSFERIM I NXEHTËSISË. BAZAT E LLOGARITJES TË KËMBËZUESVE TË NXEHTËSISË
Ndarja e procesit të transferimit të nxehtësisë në përçueshmëri termike, transferim konvektiv të nxehtësisë dhe transferim të nxehtësisë nga rrezatimi është i përshtatshëm për studimin e tij. Në realitet, ekziston një shkëmbim kompleks i nxehtësisë,
TRANSFERIMI I NXEHTËSISË NËPËRMJET NJË MURI TË SHFSHTË
Lëreni një mur të sheshtë me një shtresë (Fig. 37) me trashësi d i bërë nga një material koeficienti i përçueshmërisë termike l i të cilit lahet nga njëra anë nga një lëng i nxehtë me një temperaturë tl1
TRANSFERIMI I NXEHTËSISË PËRMES NJË MURI CILINDRIK
Në praktikë, elementi më i zakonshëm i pajisjeve të shkëmbimit të nxehtësisë është një tub. Një diagram i procesit të transferimit të nxehtësisë përmes një muri cilindrik (tub) është paraqitur në figurën 38.
TERMOIZOLIM
Kur zgjidhen problemet praktike të transferimit të nxehtësisë, kërkohet ose të rritet intensiteti i transferimit të nxehtësisë nga mediumi i ngrohjes në atë të nxehtë, ose, anasjelltas, të ngadalësohet ky proces. Intensi
SHKËMBËSIT E NXEHTËSISË
Shkëmbyesit e nxehtësisë (këmbyesit e nxehtësisë) janë pajisje të krijuara për të transferuar nxehtësinë nga një ftohës ngrohjeje (me një temperaturë më të lartë) në një nxehtësi të nxehtë
KARBURANT E ENERGJISË
Lëndët djegëse energjetike janë substanca të tilla të djegshme që janë ekonomikisht të realizueshme kur digjen në pajisje teknike për të prodhuar nxehtësi. si lëndë djegëse
KONCEPTI I KARBURANTIT KONVENCIONAL
Vlera kalorifike e një karburanti tregon se sa nxehtësi (në kiloxhaul) lirohet gjatë djegies së plotë të një karburanti të ngurtë, të lëngët ose të gaztë në kushte normale.
KOMPONENTET KRYESORE TË KARBURANTIT
Përbërësi kryesor i pjesës së djegshme të karburantit është karboni. Nxehtësia e djegies së karbonit është 33,650 kJ/kg. Përmbajtja e karbonit në masën e djegshme të karburantit është: në antracit - 87 ... 93%
LLOJET E KARBURANTIT
Druri. Përdorimi i drurit si lëndë djegëse është i kufizuar. Vlera kalorifike e druve të zjarrit përcaktohet kryesisht nga lagështia. Sa më shumë lagështi në dru, aq më pak
ESENCA E PROCESIT TË DJEGJES SË KARBURANTIT
Në varësi të shpejtësisë së djegies, dallohen djegia normale dhe djegia shpërthyese. Shkalla e djegies është shpejtësia e përhapjes së flakës. Gjatë djegies normale, shkalla e përhapjes
PËR DJEGJE TË PLOTË TË KARBURANTIT
Nëse dihet përbërja e lëndës djegëse, atëherë sasia e ajrit që kërkohet për djegien e plotë të ndonjërit prej përbërësve të tij mund të përcaktohet nga shprehja C + O2 = CO2. E
VËLLIMI DHE PËRBËRJA E PRODUKTEVE TË DJEGJES
Për llogaritjen dhe përzgjedhjen e saktë të njësive të inxhinierisë së nxehtësisë, është e nevojshme të dihet sasia e produkteve të djegies së formuar. Si rregull, sasia e produkteve të djegies i referohet 1 kg TV
Vlerat numerike të entalpive të produkteve përbërëse të djegies dhe ajrit në temperatura të ndryshme
Temperatura, K НСО2, kJ/m3 НN2, kJ/m3 НО2, kJ/m3
INDEKSI I REFERENCAVE
Alekseev G. N. Inxhinieri e përgjithshme e nxehtësisë. - M .: shkollë e diplomuar, 1980. Andryushchenko AI Bazat e termodinamikës së cikleve të termocentraleve - M., Shkolla e lartë. Ar
INSTITUTI I ENERGJISË DHE AUTOMATIKAVE
Departamenti i Inxhinierisë Termike
Dhe sistemet e energjisë

TERMODINAMIKA TEKNIKE
Magnitogorsk
| PREZANTIMI ................................................. ................................................. ................................ | |
| Tema 1. Tema dhe metoda e termodinamikës .............................................. .................................. | |
| Sistemi termodinamik ..................................................... ................................................. | |
| Parametrat termodinamikë të gjendjes .............................................. ...................... | |
| Ekuacioni i gjendjes ..................................................... ................................................ .......... | |
| Procesi termodinamik ..................................................... ...................................................... | |
| Kapaciteti termik i gazeve ................................................ ................................................................ .............. | |
| Tema 2. Përzierjet gazet ideale.................................................................................... | |
| Shprehja analitike e ligjit të parë të termodinamikës .......................................... .... | |
| Tema 3. Energjia e brendshme .............................................. .................................................. | |
| Funksionimi i zgjatimit ................................................ ................................................................ ......... | |
| Nxehtësia................................................ ................................................ . ............. | |
| Entalpia...................................................... ................................................ . .......... | |
| Entropia................................................ ................................................ . .......... | |
| Tema 4. Formulimi i përgjithshëm i ligjit të dytë.......................................... .......................................... | |
| Cikli i drejtpërdrejtë i Carnot ..................................................... ...................................................... ............. | |
| Cikli i kundërt i Carnot ..................................................... ................................................ .......... | |
| Ndryshimi i entropisë në proceset jo ekuilibër .......................................... .... | |
| Tema 5. Proceset termodinamike të gazeve ideale në sisteme të mbyllura Oh.......... | |
| Ekergjia ..................................................... .......................................................... .......................... | |
| Tema 6. Proceset termodinamike te gazeve reale .......................................... ........ | |
| Ekuacioni i gjendjes së gazeve reale................................................ ................................................ | |
| Tema 7. Ekuacioni i ligjit të parë të termodinamikës për rrjedhën...................................... ........... | |
| Dalja e hundës konvergjente ..................................................... ................................................. | |
| Rregullsitë kryesore të rrjedhës së gazit në grykë dhe difuzorë................................. ......... | |
| Llogaritja e procesit të skadimit me h-s diagramet ..................................... | |
| Mbytja e gazeve dhe avujve ................................................ ................................ | |
| Tema 8. Efikasiteti termodinamik i cikleve të termocentraleve .......... | |
| Ciklet motorët me piston djegia e brendshme ..................................................... | |
| Ciklet e impianteve të turbinave me gaz .............................................. .......................................... | |
| Ciklet e impianteve të turbinave me avull .......................................... .......................................... | |
| Ciklet Carnot dhe Rankine avull i ngopur. Rikuperimi i nxehtësisë ..................................... | |
| Cikli Rankine në avull të mbinxehur ................................................ ................................ | |
| Efikasiteti termik i ciklit .............................................. ................................................................ ................ | |
| Furnizimi me ngrohje ..................................................... ................................................................ ..................... |
Tema 9. Procesi teorik kompresor me shumë shkallë
. Pyetjet e kontrollit për drejtimin certifikimi i ndërmjetëm(provim) bazuar në rezultatet e zotërimit të disiplinës:
- Thelbi dhe formulimet e ligjit të parë të termodinamikës.
- Shprehje analitike e ligjit të parë të termodinamikës.
- Tregoni në diagramin P - V punën e dobishme dhe punën e zgjerimit (ngjeshjes) për një proces termodinamik arbitrar.
- Energjia e brendshme dhe entalpia si funksione të gjendjes, lidhja e tyre me kapacitetin termik.
- Ajo që quhet kapaciteti total i nxehtësisë.
- Kapaciteti specifik i nxehtësisë - masa, vëllimi dhe molari, përcaktimi dhe dimensioni i tyre.
- Cili kapacitet termik është më i madh - izobarik apo izokorik dhe pse.
- Proceset bazë termodinamike, paraqitja e tyre në diagramet P–V dhe T–S.
- Lidhja e parametrave për proceset bazë termodinamike.
- Llogaritja e procesit adiabatik duke përdorur funksionet 0 dhe 0 .
- Proceset e kthyeshme dhe të pakthyeshme, shkaqet kryesore të pakthyeshmërisë.
- Vizatoni në diagramin T - S një proces adiabatik të kthyeshëm dhe të pakthyeshëm të zgjerimit dhe tkurrjes.
- Thelbi dhe formulimet e ligjit të dytë të termodinamikës.
- Shprehje analitike e ligjit të dytë të termodinamikës për proceset e kthyeshme dhe të pakthyeshme.
- Entropia si funksion i gjendjes, kuptimi fizik entropia.
- Cili quhet cikli termodinamik.
- E drejtpërdrejtë dhe e kundërt ciklet termodinamike.
- Si të vlerësohet efikasiteti i ciklit të drejtpërdrejtë dhe të kundërt.
- diagrami i qarkut motor ngrohje dhe impianti ftohës.
- Cikli i drejtpërdrejtë Carnot, efikasiteti i tij termik, imazhi në diagramet e gjendjes.
- Gazet reale, ekuacioni i gjendjes Van-der-Waals.
- Diagrami i fazës P-T për lëndën normale dhe anormale.
- Tregoni në diagramin T-S nxehtësinë e shpenzuar për avullim.
- Avulli i ujit - i ngopur (i thatë dhe i lagësht) dhe i mbinxehur - përkufizime.
- Diagramet e gjendjes së avullit të ujit P - V, T - S, h - S.
- Kritike dhe pikë e trefishtë.
- Proceset termodinamike të avullit të ujit në diagramet e gjendjes.
28. Ekuacioni i ligjit të parë të termodinamikës për rrjedhjen e lëngut punues.
30.Si të përcaktoni një profil kanali.
31. Çfarë grykë nevojitet për të marrë shpejtësi supersonike.
32. Cili proces quhet throttling.
33. Paraqitni procesin e mbytjes në diagramin h - s.
34. Si ndryshojnë parametrat e lëngut punues në procesin e mbytjes.
35. Cili nga tre proceset e kompresimit në një kompresor (izotermik, adiabatik, politropik) është më i dobishëm dhe pse.
36. Kompresimi me shumë faza, avantazhet e tij në krahasim me një kompresor njëfazësh.
37. Ciklet e motorëve me djegie të brendshme, krahasimi i tyre.
38. Ciklet e impianteve të turbinave me gaz, krahasimi i tyre.
39. Metodat për përmirësimin e efikasitetit të impianteve të turbinave me gaz.
40. Cikli Carnot për avujt e ujit.
41. Skema skematike e një impianti turbinash me avull.
42. Cikli Rankine me avull i ngopur, efikasiteti i tij termik.
43. Cikli Rankine me avull të mbinxehur, efikasiteti termik i tij.
44. Cikli real Rankine, përcaktimi i efikasitetit të brendshëm absolut.
45. Ndikimi i parametrave fillestarë dhe përfundimtarë të avullit në rendimentin termik.
46. Skema dhe cikli i një impianti turbinash me avull me rinxehje të ndërmjetme me avull.
47. Shkruani formulën e rendimentit termik të një cikli me rinxehje.
48. Cili cikël quhet rigjenerues.
49. Skema dhe cikli i një impianti turbinash me avull me nxjerrje rigjeneruese.
50. Shkruani formulën për rendimentin termik të ciklit rigjenerues.
51. Bazat termodinamike të ngrohjes qendrore.
52. Faktori i shfrytëzimit të nxehtësisë (KIT).
53. Ciklet e centraleve bërthamore, perspektivat e përdorimit të energjisë atomike.
54. Ciklet binare (avull - avull dhe avull - gaz).
55. Llogaritja e efiçencës termike të instalimeve binare.
56. Shndërrimi pa makinë (i drejtpërdrejtë) i energjisë termike në energji elektrike.
57. Skema, cikli dhe efikasiteti termik i një instalimi me gjeneratorë MHD.
58. Njësitë ftohëse - kompresimi i gazit dhe avullit.
59. Çfarë quhet pompë nxehtësie, si të vlerësohet efektiviteti i saj.
60. Ligji i parë dhe i dytë i termodinamikës për sistemet kimike
TEMA 1
Lënda dhe metoda e termodinamikës
Termodinamikastudion ligjet e shndërrimit të energjisë në procese të ndryshme që ndodhin në sistemet makroskopike dhe të shoqëruara me efekte termike. Një sistem makroskopik është çdo objekt material që përbëhet nga një numër i madh grimcat. Madhësitë e sistemeve makroskopike janë në mënyrë të pakrahasueshme më të mëdha se madhësitë e molekulave dhe atomeve.
Në varësi të objektivave të studimit, ata marrin në konsideratë termodinamikën teknike ose kimike, termodinamikën e sistemeve biologjike etj. Termodinamika teknike studion modelet e transformimit të ndërsjellë të termike dhe energji mekanike dhe vetitë e trupave të përfshirë në këto transformime.. Mbi bazën e tij, kryhet llogaritja dhe projektimi i të gjithë motorëve të nxehtësisë, si dhe të gjitha llojet e pajisjeve teknologjike.
Duke marrë parasysh vetëm sistemet makroskopike, termodinamika studion rregullsitë e formës termike të lëvizjes së materies, për shkak të pranisë së një numri të madh të grimcave mikrostrukturore që lëvizin dhe ndërveprojnë vazhdimisht (molekula, atome, jone).
Vetitë fizike sistemet makroskopike studiohen me metoda statistikore termodinamike. Metoda statistikore bazohet në përdorimin e teorisë së probabilitetit dhe modeleve të caktuara të strukturës së këtyre sistemeve dhe është përmbajtja e fizikës statistikore. Metoda termodinamike nuk kërkon përfshirjen e ideve model për strukturën e materies dhe është fenomenologjike(d.m.th., konsideron "dukuri" - dukuritë në tërësi).
Në këtë rast, të gjitha përfundimet kryesore të termodinamikës mund të merren me deduksion, duke përdorur vetëm dy ligje themelore empirike të termodinamikës.
Në të ardhmen, bazuar në metodën termodinamike, do të përdorim idetë molekularo-kinetike për strukturën e materies për qartësi.
Sistemi termodinamik
Sistemi termodinamik është një grup trupash materiale që janë në ndërveprime mekanike dhe termike me njëri-tjetrin dhe me trupat e jashtëm që rrethojnë sistemin.("mjedis i jashtëm").
Zgjedhja e sistemit është arbitrare dhe diktohet nga kushtet e problemit që zgjidhet. Trupat që nuk përfshihen në sistem quhen mjedisi. Sistemi është i ndarë nga mjedisi sipërfaqja e kontrollit(guaskë). Kështu, për shembull, për sistemin më të thjeshtë - një gaz i mbyllur në një cilindër nën një pistoni, mjedisi i jashtëm është ajri përreth, dhe muret e cilindrit dhe pistoni shërbejnë si sipërfaqe kontrolli.
Ndërveprimet mekanike dhe termike të një sistemi termodinamik kryhen përmes sipërfaqeve të kontrollit. Gjatë ndërveprimit mekanik nga vetë sistemi ose në sistem, bëhet punë. (Në rastin e përgjithshëm sistemi mund të ndikohet edhe nga forca elektrike, magnetike dhe forca të tjera, nën ndikimin e të cilave sistemi do të kryejë punë. Këto lloj pune mund të merren parasysh edhe në kuadrin e termodinamikës, por ne do mos i konsideroni ato më tej). Në shembullin tonë, puna mekanike kryhet duke lëvizur pistonin dhe shoqërohet me një ndryshim në vëllim. Ndërveprimi termik konsiston në transferimin e nxehtësisë midis trupave individualë të sistemit dhe midis sistemit dhe mjedisit. Në shembullin në shqyrtim, nxehtësia mund të furnizohet me gazin përmes mureve të cilindrit.
Në rastin më të përgjithshëm, sistemi mund të shkëmbejë me mjedisin dhe materien (ndërveprimi i transferimit të masës). Një sistem i tillë quhet hapur. Rrjedhat e gazit ose avullit në turbina dhe tubacione - shembuj sistemet e hapura. Nëse substanca nuk kalon nëpër kufijtë e sistemit, atëherë ajo quhet e mbyllur. Në vijim, përveç rasteve kur thuhet ndryshe, ne do të konsiderojmë sistemet e mbyllura.
Një sistem termodinamik që nuk mund të shkëmbejë nxehtësi me mjedisin e tij quhet izoluar termikisht ose adiabatike. Një shembull i një sistemi adiabatik është një gaz në një enë, muret e të cilit janë të mbuluara me izolim termik ideal, i cili përjashton shkëmbimin e nxehtësisë midis gazit që përmbahet në enë dhe trupave përreth. Një guaskë e tillë izoluese quhet adiabatike. Një sistem që nuk shkëmben energji ose lëndë me mjedisin e tij quhet i izoluar(ose të mbyllura).
Sistemi më i thjeshtë termodinamik është një lëng pune që kryen transformimin e ndërsjellë të nxehtësisë dhe punës. Në një motor me djegie të brendshme, për shembull, lëngu i punës është një përzierje e djegshme e përgatitur në një karburator, e përbërë nga ajri dhe avujt e benzinës.
Parametrat e gjendjes termodinamike
Vetitë e secilit sistem karakterizohen nga një sërë sasish, të cilat zakonisht quhen parametra termodinamikë. Le të shqyrtojmë disa prej tyre, duke përdorur konceptet molekularo-kinetike të njohura nga kursi i fizikës për një gaz ideal si një koleksion molekulash që kanë përmasa jashtëzakonisht të vogla, janë në lëvizje termike të rastësishme dhe ndërveprojnë me njëra-tjetrën vetëm gjatë përplasjeve.
Presioni për shkak të bashkëveprimit të molekulave të lëngut të punës me sipërfaqen dhe numerikisht është e barabartë me forcën që vepron për njësi të sipërfaqes së trupit përgjatë normales me këtë të fundit. Në përputhje me teorinë kinetike molekulare, presioni i gazit përcaktohet nga relacioni
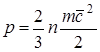 , (1.1)
, (1.1)
ku F është forca; f-sipërfaqja; n- numri i molekulave për njësi vëllimi;
tështë masa e molekulës; që nga 2- Shpejtësia RMS lëvizje përpara molekulat.
AT sistemit ndërkombëtar Presioni i njësive (SI) shprehet në paskale (1 Pa \u003d 1 N / m 2). Meqenëse kjo njësi është e vogël, është më i përshtatshëm të përdorni 1 kPa = 1000 Pa dhe 1 MPa = 10 6 Pa.
Presioni matet duke përdorur matës presioni, barometra dhe matës vakum.
Matës presioni të lëngjeve dhe sustave matni presionin e matës, i cili është diferenca midis presionit total ose absolut R presioni mesatar dhe atmosferik i matur fq atm, d.m.th. ![]()
Pajisjet për matjen e presioneve nën ato atmosferike quhen matës vakum; leximet e tyre japin vlerën e vakumit (ose vakumit):
![]() ,
dmth teprica presioni atmosferik mbi absoluten.
,
dmth teprica presioni atmosferik mbi absoluten.
Vini re se parametri i gjendjes është presioni absolut. Kjo është ajo që hyn në ekuacionet termodinamike.
temperatura quhet një sasi fizike që karakterizon shkallën e ngrohjes së trupit. Koncepti i temperaturës rrjedh nga pohimi i mëposhtëm: nëse dy sisteme janë në kontakt termik, atëherë nëse temperaturat e tyre nuk janë të barabarta, ata do të shkëmbejnë nxehtësi me njëri-tjetrin, por nëse temperaturat e tyre janë të barabarta, atëherë nuk do të ketë shkëmbim të nxehtësisë.
Nga pikëpamja e koncepteve kinetike molekulare, temperatura është një masë intensiteti i lëvizjes termike të molekulave. Vlera e saj numerike lidhet me vlerën e energjisë mesatare kinetike të molekulave të substancës:
Në sistemin SI, njësia e temperaturës është kelvin (K); në praktikë, shkalla Celsius (°C) përdoret gjerësisht. Raporti ndërmjet absolutit T dhe celsius I temperaturat kanë formën
![]() .
.
Në kushte industriale dhe laboratorike, temperatura matet duke përdorur termometra të lëngshëm, pirometra, termoçifte dhe instrumente të tjerë.
Vëllimi specifik v - është vëllimi për njësi të masës së një lënde. Nëse një trup homogjen i masës M zë vëllim v, pastaj sipas definicionit
v= V/M.
Në sistemin SI, njësia e vëllimit specifik është 1 m 3 / kg. Ekziston një lidhje e qartë midis vëllimit specifik të një substance dhe densitetit të saj:
Për të krahasuar sasitë që karakterizojnë sistemet në të njëjtat gjendje, prezantohet koncepti i "kushteve normale fizike":
fq\u003d 760 mm Hg \u003d 101,325 kPa; T=273,15 K.
Në degë të ndryshme të teknologjisë dhe vende të ndryshme prezantojnë "kushtet e tyre normale" disi të ndryshme nga ato të dhëna, për shembull, "teknike" ( fq\u003d 735,6 mm Hg \u003d 98 kPa, t=15˚C) ose kushte normale për vlerësimin e performancës së kompresorit ( fq=101.325 kPa, t=20˚С), etj.
Nëse të gjithë parametrat termodinamikë janë konstantë në kohë dhe të njëjtë në të gjitha pikat e sistemit, atëherë kjo gjendje e sistemit quhetekuilibri.
Nëse ka dallime në temperaturë, presion dhe parametra të tjerë midis pikave të ndryshme në sistem, atëherë ështëjoekuilibri. Në një sistem të tillë, nën ndikimin e gradientëve të parametrave, lindin flukse nxehtësie, substancash dhe të tjerash, duke tentuar ta kthejnë atë në një gjendje ekuilibri. Përvoja e tregon këtë sistem i izoluar me kalimin e kohës, ajo gjithmonë vjen në një gjendje ekuilibri dhe nuk mund të dalë kurrë spontanisht prej saj. Në termodinamikën klasike, merren parasysh vetëm sistemet e ekuilibrit.
Ekuacioni i gjendjes
Për një sistem termodinamik ekuilibër, ekziston një marrëdhënie funksionale midis parametrave të gjendjes, e cila quhet ekuacioni i gjendjes. Përvoja tregon se vëllimi specifik, temperatura dhe presioni i sistemeve më të thjeshta, të cilat janë gaze, avuj ose lëngje, janë të lidhura. ekuacioni termik shikoni gjendjet ![]() .
.
Ekuacionit të gjendjes mund t'i jepet një formë tjetër: ![]()
Këto ekuacione tregojnë se nga tre parametrat kryesorë që përcaktojnë gjendjen e sistemit, çdo dy janë të pavarur.
Për të zgjidhur problemet me metoda termodinamike, është absolutisht e nevojshme të dihet ekuacioni i gjendjes. Megjithatë, ai nuk mund të merret brenda kornizës së termodinamikës dhe duhet gjetur ose eksperimentalisht ose me metoda të fizikës statistikore. Forma specifike e ekuacionit të gjendjes varet nga vetitë individuale të substancës.
Ekuacioni i gjendjes për gazet ideale
Ekuacionet (1.1) dhe (1.2) nënkuptojnë se .
Konsideroni 1 kg gaz. Duke pasur parasysh se përmban N molekulat dhe, si rrjedhim, marrim: ![]() .
.
Vlera konstante nk, referuar 1 kg gaz, të shënuar me shkronjë R dhe telefononi konstante gazi. Kjo është arsyeja pse
Ose . (1.3)
Lidhja që rezulton është ekuacioni Clapeyron.
Duke shumëzuar (1.3) me M, marrim ekuacionin e gjendjes për një masë arbitrare të gazit M:
Ekuacioni i Clapeyron-it mund t'i jepet një formë universale nëse i referohemi konstantës së gazit në 1 kmole gaz, domethënë, në sasinë e gazit, masa e të cilit në kilogramë është numerikisht e barabartë me masën molekulare μ. Vendosja e (1.4) M=μ dhe V=V μ, marrim për një mol ekuacionin Clapeyron - Mendeleev:
Këtu është vëllimi i një kilomoli gazi dhe është konstanta universale e gazit.
Në përputhje me ligjin e Avogadros (1811), vëllimi prej 1 kmole, i cili është i njëjtë në të njëjtat kushte për të gjithë gazrat idealë, në kushte normale fizike është 22.4136 m 3, prandaj
Konstanta e gazit për 1 kg gaz është .
Ekuacioni i gjendjes së gazeve reale
Në gaze reale në ndryshimi nga ideali është forcat e rëndësishme të ndërveprimeve ndërmolekulare (forcat e tërheqjes kur molekulat janë në një distancë të konsiderueshme, dhe forcat refuzuese kur ato janë mjaftueshëm afër njëra-tjetrës) dhe vëllimi i brendshëm i molekulave nuk mund të neglizhohet.
Prania e forcave refuzuese ndërmolekulare çon në faktin se molekulat mund t'i afrohen njëra-tjetrës vetëm deri në një distancë minimale të caktuar. Prandaj, mund të supozojmë se vëllimi i lirë për lëvizjen e molekulave do të jetë i barabartë me , ku bështë vëllimi më i vogël në të cilin mund të kompresohet një gaz. Në përputhje me këtë, rruga mesatare e lirë e molekulave zvogëlohet dhe numri i ndikimeve në mur për njësi të kohës, dhe, për rrjedhojë, rritet presioni në krahasim me një gaz ideal në raport me , dmth.
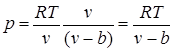 .
.
Forcat tërheqëse veprojnë në të njëjtin drejtim si presioni i jashtëm dhe shkaktojnë presion molekular (ose të brendshëm). Forca e tërheqjes molekulare të çdo dy pjesësh të vogla të një gazi është proporcionale me produktin e numrit të molekulave në secilën prej këtyre pjesëve, domethënë me katrorin e densitetit, kështu që presioni molekular është në përpjesëtim të zhdrejtë me katrorin e vëllimi specifik i gazit: rmol= a/ v 2, ku a - koeficienti i proporcionalitetit, në varësi të natyrës së gazit.
Nga kjo marrim ekuacionin van der Waals (1873):
![]() ,
,
Në liri vëllime specifike dhe presionet relativisht të ulëta të një gazi real, ekuacioni van der Waals praktikisht degjeneron në ekuacionin e gjendjes gaz ideal Clapeyron, për madhësinë a/v 2
(krahasuar me p) dhe b(krahasuar me v) bëhen të papërfillshme.
Në mënyrë cilësore, ekuacioni van der Waals përshkruan mjaft mirë vetitë e një gazi real, por rezultatet e llogaritjeve numerike jo gjithmonë përputhen me të dhënat eksperimentale. Në një numër rastesh, këto devijime shpjegohen me tendencën e molekulave reale të gazit për t'u lidhur në grupe të veçanta të përbërë nga dy, tre ose më shumë molekula. Lidhja ndodh për shkak të asimetrisë së fushës elektrike të jashtme të molekulave. Komplekset që rezultojnë sillen si grimca të pavarura të paqëndrueshme. Gjatë përplasjeve ato ndahen, pastaj rikombinohen me molekula të tjera etj. Me rritjen e temperaturës, përqendrimi i komplekseve me një numër i madh molekulat zvogëlohen me shpejtësi, ndërsa përqindja e molekulave të vetme rritet. Molekulat polare të avullit të ujit shfaqin një tendencë më të madhe për t'u shoqëruar.
Procesi termodinamik
Ndryshimi i gjendjes së një sistemi termodinamik me kohën quhet procesi termodinamik. Pra, kur pistoni lëviz në cilindër, vëllimi, e me të edhe presioni dhe temperatura e gazit brenda, do të ndryshojë, do të bëhet procesi i zgjerimit ose ngjeshjes së gazit.
Siç u përmend tashmë, sistemi, i nxjerrë nga gjendja e ekuilibrit dhe i lënë në vetvete në parametra konstante të mjedisit, pas një kohe do të vijë përsëri në një gjendje ekuilibri që korrespondon me këto parametra. Një rikthim i tillë spontan (pa ndikim të jashtëm) të sistemit në një gjendje ekuilibri
thirrur relaksim, dhe quhet intervali kohor gjatë të cilit sistemi kthehet në ekuilibër koha e relaksimit. Për procese të ndryshmeështë ndryshe: nëse kërkohet gjithmonë të vendoset një presion ekuilibri në një gaz, atëherë duhen dhjetë për të barazuar temperaturën në vëllimin e të njëjtit gaz; minuta, dhe në vëllimin e lëndës së ngurtë të ndezur - ndonjëherë disa orë.
Procesi termodinamik quhetekuilibri, nëse të gjithë parametrat e sistemit gjatë rrjedhës së tij ndryshojnë mjaft ngadalë në krahasim me procesin përkatës të relaksimit. Në këtë rast, sistemi është në të vërtetë në një gjendje ekuilibri me mjedisin gjatë gjithë kohës, gjë që përcakton emrin e procesit.
Që procesi të jetë ekuilibër, shpejtësia e ndryshimit të parametrave të sistemit duhet të plotësojë relacionin
ku POR- parametri që ndryshon më shpejt në procesin në shqyrtim; Me rel - shkalla e ndryshimit të këtij parametri në procesin e relaksimit; τ rel - koha e relaksimit.
Konsideroni, për shembull, procesin e ngjeshjes së një gazi në një cilindër. Nëse koha e zhvendosjes së pistonit nga një pozicion në tjetrin tejkalon ndjeshëm kohën e relaksimit, atëherë në procesin e lëvizjes së pistonit, presioni dhe temperatura do të kenë kohë të barazohen në të gjithë vëllimin e cilindrit.
Kjo shtrirje sigurohet nga përplasja e vazhdueshme e molekulave, si rezultat i së cilës energjia e furnizuar nga pistoni në gaz shpërndahet mjaft shpejt dhe në mënyrë të barabartë midis tyre. Nëse zhvendosjet e mëvonshme të pistonit do të ndodhin në mënyrë të ngjashme, atëherë gjendja e sistemit në çdo moment të kohës do të jetë praktikisht ekuilibër. Në këtë mënyrë, Procesi i ekuilibrit përbëhet nga një seri e vazhdueshme e gjendjeve të njëpasnjëshme të ekuilibrit, prandaj, në secilën nga pikat e tij, gjendja e sistemit termodinamik mund të përshkruhet me ekuacionin e gjendjes së lëngut të caktuar punues. Kjo është arsyeja pse termodinamika klasike në kërkimin e saj vepron vetëm me procese ekuilibri. Ato janë një idealizim i përshtatshëm i proceseve reale, duke lejuar në shumë raste të thjeshtojnë ndjeshëm zgjidhjen e problemit. Ky idealizim është mjaft i justifikuar, pasi kushti (1.8) plotësohet mjaft shpesh në praktikë. Meqenëse shqetësimet mekanike përhapen në gaze me shpejtësinë e zërit, procesi i ngjeshjes së gazit dhe cilindrit do të jetë në ekuilibër nëse shpejtësia e pistonit është shumë më e vogël se shpejtësia e zërit.
Proceset që nuk plotësojnë kushtin, vazhdoni me disbalancë, d.m.th. janëjoekuilibri. Nëse, për shembull, rrit shpejt temperaturën e ambientit, atëherë gazi në cilindër gradualisht do të ngrohet nëpër muret e tij, duke u relaksuar në një gjendje ekuilibri që korrespondon me parametrat e rinj mjedisorë. Në procesin e relaksimit, gazi nuk është në ekuilibër me mjedisin dhe nuk mund të karakterizohet nga ekuacioni i gjendjes, nëse vetëm sepse në pika të ndryshme vëllimi i temperaturës së gazit ka vlera të ndryshme.
Kapaciteti termik i gazeve
Raporti i sasisë së nxehtësisë së marrë nga një trup me një ndryshim pafundësisht të vogël në gjendjen e tij ndaj ndryshimit të temperaturës së trupit që shoqërohet me këtë quhet kapaciteti i nxehtësisë organet në këtë proces:
Zakonisht, kapaciteti i nxehtësisë i referohet një njësie të sasisë së një substance dhe, në varësi të njësisë së zgjedhur, ato dallojnë:
kapaciteti specifik i nxehtësisë në masëc , referuar 1 kg gaz,
J/(kg K);
kapaciteti vëllimor specifik i nxehtësisëc', referuar sasisë së gazit që përmban 1 m 3 vëllim në kushte normale fizike, J / (m 3 ·K);
kapaciteti specifik molar i nxehtësisë , referuar një kilomole, J / (kmol K).
Marrëdhënia ndërmjet kapacitete specifike të nxehtësisë vendoset nga marrëdhëniet e dukshme: ;
Këtu është dendësia e gazit në kushte normale.
Ndryshimi në temperaturën e trupit me të njëjtën sasi të nxehtësisë së furnizuar varet nga natyra e procesit që po ndodh, pra kapaciteti i nxehtësisë është një funksion i procesit. Kjo do të thotë që i njëjti lëng pune, në varësi të procesit, kërkon një sasi të ndryshme nxehtësie për ngrohjen e tij me 1 K. Numerikisht, vlera e c ndryshon nga +∞ në -∞.
Në llogaritjet termodinamike, sa vijon kanë rëndësi të madhe:
kapaciteti i nxehtësisë në presion konstant
e barabartë me raportin e sasisë së nxehtësisë që i jepet trupit në proces me presion konstant ndaj ndryshimit të temperaturës së trupit dT
kapaciteti i nxehtësisë në vëllim konstant
, (1.5)
e barabartë me raportin e sasisë së nxehtësisë , sjellë në trup në proces në vëllim konstant, në ndryshimin e temperaturës së trupit .
Në përputhje me ligjin e parë të termodinamikës për sistemet e mbyllura në të cilat zhvillohen proceset e ekuilibrit ![]() , dhe
, dhe
Për një proces izokorik ( v=const) ky ekuacion merr formën ![]() , dhe, duke marrë parasysh (1.5), marrim atë
, dhe, duke marrë parasysh (1.5), marrim atë
![]() ,
,
d.m.th., kapaciteti termik i një trupi në vëllim konstant është i barabartë me derivatin e pjesshëm të energjisë së tij të brendshme në lidhje me temperaturën dhe karakterizon shkallën e rritjes së energjisë së brendshme në një proces izokorik me rritjen e temperaturës.
Për një gaz ideal
Për një proces izobarik, nga barazimet (2.16) dhe (2.14) marrim
Ky ekuacion tregon lidhjen ndërmjet kapaciteteve të nxehtësisë me f dhe cv. Për një gaz ideal, thjeshtohet shumë. Në të vërtetë, energjia e brendshme e një gazi ideal përcaktohet vetëm nga temperatura e tij dhe nuk varet nga vëllimi, prandaj dhe, përveç kësaj, rrjedh nga ekuacioni i gjendjes ![]() , ku
, ku
Ky raport quhet ekuacioni Mayer dhe është një nga gazrat idealë kryesorë në termodinamikën teknike.
Në proces v\u003d nxehtësia që i jepet gazit shkon vetëm për të ndryshuar energjinë e brendshme të tij, ndërsa në proces R= Nxehtësia e vazhdueshme shpenzohet si për rritjen e energjisë së brendshme ashtu edhe për kryerjen e punës kundër forcave të jashtme. Kjo është arsyeja pse me f më shumë cv madhësia e kësaj pune.
Për gazet reale, që kur zgjerohen (në fq= konst) puna kryhet jo vetëm kundër forcave të jashtme, por edhe kundër forcave të tërheqjes që veprojnë midis molekulave, gjë që shkakton konsum shtesë të nxehtësisë.
Zakonisht, kapacitetet e nxehtësisë përcaktohen në mënyrë eksperimentale, por për shumë substanca ato mund të llogariten me metoda fizika statistikore.
Rezultatet e teorisë klasike të kapacitetit të nxehtësisë janë në përputhje të mirë me të dhënat eksperimentale në rajonin e temperaturave të dhomës (Tabela 2.1), por eksperimenti nuk konfirmon përfundimin kryesor për pavarësinë nga temperatura. Mospërputhjet, veçanërisht të rëndësishme në rajonin e ulët dhe të mjaftueshëm temperaturat e larta, janë të lidhura me sjelljen kuantike të molekulave dhe gjejnë shpjegime në terma të teoria kuantike kapaciteti i nxehtësisë.
Kapaciteti termik i disa gazeve në t= 0°C në gjendje ideale të gazit
Kjo teori vendos, para së gjithash, padrejtësinë e teoremës për shpërndarjen uniforme të energjisë mbi shkallën e lirisë në rajonin e temperaturave të ulëta dhe të larta. Ndërsa temperatura e gazit zvogëlohet, numri i shkallëve të lirisë së molekulës ngrin. Pra, për një molekulë diatomike, shkallët rrotulluese të lirisë "ngrijnë" dhe në vend të pesë, ajo ka tre shkallë lirie, dhe, rrjedhimisht, më pak energji të brendshme dhe kapacitet të nxehtësisë. Me një rritje të temperaturës, molekulat poliatomike ngacmojnë shkallët e brendshme të lirisë për shkak të shfaqjes së lëvizjes vibruese të atomeve të molekulës (molekula bëhet një oshilator). Kjo çon në një rritje të energjisë së brendshme dhe, rrjedhimisht, në kapacitetin e nxehtësisë me rritjen e temperaturës.
Kapaciteti i nxehtësisë i një gazi të vërtetë varet nga presioni, megjithatë, shumë dobët.
Meqenëse kapaciteti i nxehtësisë i një gazi real varet nga temperatura, termodinamika bën dallimin midis kapaciteteve të vërteta dhe mesatare të nxehtësisë.
Kapaciteti mesatar i nxehtësisë Me e mërkurë ky proces në diapazonin e temperaturës nga t1 përpara t2 është raporti i sasisë së nxehtësisë së furnizuar në gaz me ndryshimin midis temperaturës përfundimtare dhe fillestare:
![]()
Shprehje
përcakton kapacitetin e nxehtësisë në një temperaturë të caktuar ose të ashtuquajturat kapaciteti i vërtetë i nxehtësisë. Nga * rrjedh se
 .
.
Për llogaritjet praktike, kapacitetet e nxehtësisë së të gjitha substancave janë tabeluar, dhe për të zvogëluar volumin e tabelave, në to jepen kapacitetet mesatare të nxehtësisë për diapazonin e temperaturës nga 0 në t.
LEKTURA 2
Përzierjet e gazeve ideale
Të gjitha varësitë e marra më sipër për gazrat idealë janë gjithashtu të vlefshme për përzierjet e tyre, nëse konstanta e gazit, pesha molekulare dhe kapaciteti i nxehtësisë së përzierjes zëvendësohen në to.
Ligji i Daltonit. Në praktikën inxhinierike, shpesh duhet të merret me substanca të gazta që janë të ngjashme në vetitë me gazet ideale dhe janë një përzierje mekanike e përbërësve individualë të gazrave të ndryshëm që nuk reagojnë kimikisht me njëri-tjetrin. Këto janë të ashtuquajturat përzierjet e gazit. Shembujt përfshijnë produktet e djegies së karburantit në motorët me djegie të brendshme, furrat dhe kaldaja me avull, ajri i lagësht në impiantet e tharjes, etj.
Ligji kryesor që përcakton sjelljen e një përzierjeje gazi është ligji i Daltonit: presioni total i një përzierjeje të gazrave ideale është i barabartë me shumën e presioneve të pjesshme të të gjithë përbërësve të tij:
Presion i pjesshëm pi- presioni që do të kishte një gaz nëse i vetëm do të zinte të gjithë vëllimin e përzierjes në të njëjtën temperaturë.
Metodat për vendosjen e një përzierjeje. Përbërja e përzierjes së gazit mund të specifikohet me masë, vëllim ose fraksione mole.
Pjesa masiveështë raporti i masës së një komponenti të vetëm Mi, në masën e përzierjes M:
Është e qartë se dhe.
Fraksionet masive shpesh jepen si përqindje. Për shembull, për ajrin e thatë; .
Volumetrike fraksioni është raporti i vëllimit të reduktuar të gazit V, me vëllimin e përgjithshëm të përzierjes V: .
E dhënëështë vëllimi që një përbërës i një gazi do të zinte nëse presioni dhe temperatura e tij do të ishin të barabarta me presionin dhe temperaturën e përzierjes.
Për të llogaritur vëllimin e reduktuar, ne shkruajmë dy ekuacione të gjendjes i- Komponenti i-të:
![]() ; (2.1)
; (2.1)
![]() .
.
Ekuacioni i parë i referohet gjendjes së përbërësit të gazit në përzierje kur ka presion i pjesshëm pi dhe zë vëllimin e plotë të përzierjes, dhe ekuacioni i dytë - në gjendjen e reduktuar, kur presioni dhe temperatura e përbërësit janë të barabarta, si për përzierjen, R dhe T. Nga ekuacionet rezulton se
Duke përmbledhur relacionin (2.2) për të gjithë përbërësit e përzierjes, marrim, duke marrë parasysh ligjin e Dalton-it, prej nga . Fraksionet vëllimore jepen gjithashtu shpesh si përqindje. Për ajrin,.
Ndonjëherë është më e përshtatshme të specifikoni përbërjen e përzierjes në fraksione mole. Pjesa e nishanit quhet raporti i numrit të nishaneve Ni të komponentit në shqyrtim ndaj numrit total të moleve të përzierjes N.
Lëreni përzierjen e gazit të përbëhet nga N1 nishanet e komponentit të parë, N2 nishanet e komponentit të dytë etj. Numri i moleve të përzierjes dhe fraksioni mol i përbërësit do të jetë i barabartë me .
Në përputhje me ligjin e Avogadro-s, vëllimet e një moli të çdo gazi janë të njëjta R dhe T, në veçanti, në temperaturën dhe presionin e përzierjes, në gjendjen ideale të gazit ato janë të njëjta. Prandaj, vëllimi i reduktuar i çdo komponenti mund të llogaritet si produkt i vëllimit të një mol nga numri i moleve të këtij përbërësi, d.m.th., dhe vëllimi i përzierjes - me formulën. Pastaj ![]() , dhe, rrjedhimisht, caktimi i përzierjes së gazeve sipas fraksioneve mol është i barabartë me caktimin nga fraksionet e tij vëllimore.
, dhe, rrjedhimisht, caktimi i përzierjes së gazeve sipas fraksioneve mol është i barabartë me caktimin nga fraksionet e tij vëllimore.
Konstanta e gazit e një përzierje gazesh. Duke përmbledhur ekuacionet (2.1) për të gjithë përbërësit e përzierjes, marrim 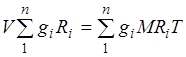 . Duke marrë parasysh, ne mund të shkruajmë
. Duke marrë parasysh, ne mund të shkruajmë
![]() , (2.3)
, (2.3)
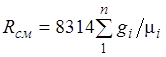 . (2.4)
. (2.4)
Ekuacioni (2.3) nënkupton që një përzierje e gazeve ideale i bindet gjithashtu ekuacionit të Clapeyron. Sepse ![]() atëherë nga (2.4) rezulton se konstanta e gazit e përzierjes [J/(kg-K)] ka formën
atëherë nga (2.4) rezulton se konstanta e gazit e përzierjes [J/(kg-K)] ka formën
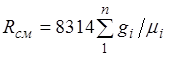 (2.5)
(2.5)
Pesha e dukshme molekulare e përzierjes. Le të shprehim zyrtarisht konstantën e gazit të përzierjes R, duke futur masën e dukshme okulare të përzierjes: ![]() (2.6)
(2.6)
Duke krahasuar anët e djathta të marrëdhënieve (2.5) dhe (2.6), gjejmë
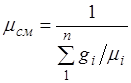 .
.
Nga përkufizimi i thyesave në masë del se
Duke përmbledhur këtë raport për të gjithë përbërësit dhe duke marrë parasysh se, ne marrim një shprehje për peshën molekulare të dukshme dhe masën e përzierjes, të dhënë nga fraksionet vëllimore:
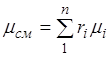 . (2.7)
. (2.7)
Raporti ndërmjet fraksioneve të vëllimit dhe masës. Duke marrë parasysh (2.7), marrim 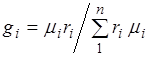 .
.
Sepse 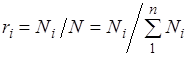 , pastaj
, pastaj
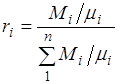
Duke pjesëtuar numëruesin dhe emëruesin e kësaj formule me masën e përzierjes M, marrim
 .
.
Shprehje analitike e ligjit të parë të termodinamikës
Ligji i parë i termodinamikës është një rast i veçantë i ligjit universal të ruajtjes dhe transformimit të energjisë siç zbatohet për fenomenet termike. Sipas ekuacionit të Ajnshtajnit është e nevojshme të merret në konsideratë një ligj i vetëm i ruajtjes dhe transformimit të masës dhe energjisë. Mirëpo, në termodinamikën teknike kemi të bëjmë me shpejtësi aq të ulëta të objekteve, saqë defekti i masës është i barabartë me zero, prandaj ligji i ruajtjes së energjisë mund të konsiderohet në mënyrë të pavarur.
Ligji i ruajtjes dhe transformimit të energjisë është një ligj themelor i natyrës, i cili merret në bazë të përgjithësimit të një sasie të madhe të të dhënave eksperimentale dhe është i zbatueshëm për të gjitha fenomenet natyrore. Ai argumenton se energjia nuk zhduket dhe nuk lind përsëri, ajo kalon vetëm nga një formë në tjetrën, dhe ulja e energjisë së një lloji jep një sasi ekuivalente energjie të një lloji tjetër.
Bashkatdhetari ynë M. V. Lomonosov (1711 - 1765) ishte ndër shkencëtarët e parë që pohoi parimin e ruajtjes së materies dhe energjisë.
Lëreni një trup pune me volum V dhe peshë M, duke pasur një temperaturë T dhe presioni R, një sasi e pafundme nxehtësie komunikohet nga jashtë. Si rezultat i furnizimit me nxehtësi, trupi nxehet nga dT dhe rritet në vëllim dV.
Një rritje në temperaturën e trupit tregon një rritje të energjisë kinetike të grimcave të saj. Një rritje në vëllimin e trupit çon në një ndryshim në energjinë potenciale të grimcave. Si rezultat, energjia e brendshme e trupit rritet me dU. Meqenëse lëngu i punës është i rrethuar nga një mjedis që ushtron presion mbi të, kur zgjerohet, ai kryen punë mekanike kundër forcave të presionit të jashtëm. Meqenëse në sistem nuk ndodhin ndryshime të tjera, atëherë, sipas ligjit të ruajtjes së energjisë
![]() (2.8)
(2.8)
d.m.th., nxehtësia që i jepet sistemit shkon për të rritur energjinë e tij të brendshme dhe për të kryer punë të jashtme.
Ekuacioni që rezulton është një shprehje matematikore e ligjit të parë të termodinamikës. Secili nga tre termat e këtij raporti mund të jetë pozitiv, negativ ose zero. Le të shqyrtojmë disa raste të veçanta.
1. - nuk ka shkëmbim nxehtësie ndërmjet sistemit dhe mjedisit, d.m.th., nxehtësia nuk i jepet sistemit dhe nuk hiqet prej tij. Procesi pa shkëmbim nxehtësie quhet adiabatike. Për të, ekuacioni (2.8) merr formën:
Prandaj, puna e zgjerimit e bërë nga sistemi në procesi adiabatik, është e barabartë me uljen e energjisë së brendshme të sistemit të caktuar. Me ngjeshjen adiabatike të lëngut të punës, puna e shpenzuar nga jashtë shkon tërësisht për të rritur energjinë e brendshme të sistemit.
2. - ndërsa vëllimi i trupit nuk ndryshon, dV=0. Një proces i tillë quhet izokorik, per atë
d.m.th., sasia e nxehtësisë që i jepet sistemit në një vëllim konstant është e barabartë me rritjen e energjisë së brendshme të këtij sistemi.
3. dU=0– energjia e brendshme e sistemit nuk ndryshon dhe
ato. Nxehtësia që i jepet sistemit shndërrohet në punë të jashtme ekuivalente me të.
Për një sistem që përmban 1 kg lëng pune
![]() . (2.9)
. (2.9)
Duke integruar ekuacionet (2.8) dhe (2.9) për disa procese, marrim shprehjen për ligjin e parë të termodinamikës në formë integrale:
![]() ; .
; .
Energjia e brendshme
Energjia e brendshme e sistemit përfshin:
energjia kinetike e lëvizjes përkthimore, rrotulluese dhe vibruese të grimcave;
energjia potenciale e ndërveprimit të grimcave;
energji predha elektronike atomet;
energjia intranukleare.
Në shumicën e proceseve të nxehtësisë dhe energjisë, dy komponentët e fundit mbeten të pandryshuar. Prandaj, në të ardhmen nënenergjia e brendshme do të kuptojmë energjinë e lëvizjes kaotike të molekulave dhe atomeve, duke përfshirë energjinë e përkthimit, rrotullimit dhe lëvizjet osciluese si molekulare ashtu edhe intramolekulare, si dhe energjinë potenciale të forcave të bashkëveprimit ndërmjet molekulave.
Energjia kinetike molekulat janë një funksion i temperaturës, vlera e energjisë potenciale varet nga distanca mesatare midis molekulave dhe, për rrjedhojë, nga vëllimi i zënë nga gazi V, dmth është një funksion v. Prandaj energjia e brendshme U është funksion i gjendjes së trupit.
Për sistem kompleks përcaktohet nga shuma e energjive të pjesëve individuale, d.m.th., ka vetinë e aditivitetit. Vlera u=U/M, thirrur të brendshme specifike energjia (J / kg), është energjia e brendshme e një njësie të masës së një lënde.
Në vijim, për shkurtim, do t'i referohemi sasisë dhe vetëm energji e brendshme. Meqenëse energjia e brendshme është një funksion i gjendjes së trupit, ajo mund të përfaqësohet si funksion i çdo dy parametri të pavarur që përcaktojnë këtë gjendje:
; ; .
Ndryshimi i tij në procesin termodinamik nuk varet nga natyra e procesit dhe përcaktohet vetëm nga gjendjet fillestare dhe përfundimtare të trupit:
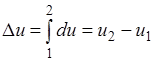 ;
;
Vlera e energjisë së brendshme në gjendjen fillestare, dhe - në fund. Matematikisht, kjo do të thotë se një ndryshim pafundësisht i vogël në energjinë e brendshme du ka diferencial total dhe; nëse e shprehim energjinë e brendshme në funksion të vëllimit dhe temperaturës specifike, atëherë
Energjia e brendshme e një gazi ideal, në të cilin nuk ka forca ndërveprimi ndërmjet molekulave, nuk varet nga vëllimi ose presioni i gazit, a përcaktohet vetëm nga temperatura e tij, kështu që derivati i energjisë së brendshme të një gazi ideal në lidhje me temperaturën është derivati total:
Për problemet e termodinamikës teknike nuk është e rëndësishme vlera absolute e energjisë së brendshme, por ndryshimi i saj në të ndryshme proceset termodinamike. Prandaj, origjina e energjisë së brendshme mund të zgjidhet në mënyrë arbitrare. Për shembull, në përputhje me marrëveshjen ndërkombëtare për ujin, vlera e energjisë së brendshme në një temperaturë prej 0.01 ° C dhe një presion prej 610.8 Pa merret si zero, dhe për gazet ideale - në 0 ° C, pavarësisht nga presioni.
Puna e zgjerimit
Puna në termodinamikë, si dhe në mekanikë, përcaktohet nga produkti i forcës që vepron në trupin e punës dhe rruga e veprimit të tij.
Konsideroni një gaz me masë M dhe vëllimi V, i mbyllur në një guaskë elastike me sipërfaqe F.
 |
Nëse gazit i jepet një sasi e caktuar nxehtësie, atëherë ai do të zgjerohet, ndërsa kryen punë kundër presionit të jashtëm R, ushtrohet mbi të nga mjedisi. Gazi vepron në çdo element të guaskës dF me një forcë të barabartë me pdf dhe duke e lëvizur atë përgjatë normales në sipërfaqe në një distancë dn, kryen punë elementare pdfdn. Puna totale e bërë gjatë një procesi pafundësisht të vogël mund të merret duke integruar këtë shprehje në të gjithë sipërfaqen F predha: ![]() .
.
Nga figura mund të shihet se vëllimi ndryshon dV i shprehur si një integral mbi sipërfaqe: ![]() ,
Rrjedhimisht
,
Rrjedhimisht
Me një ndryshim të kufizuar në vëllim, puna kundër forcave të presionit të jashtëm, quhet punë zgjerimi, është e barabartë me
Nga (3.1) rrjedh se dhe dV gjithmonë kanë shenja identike:
nëse dV>0, atëherë dhe > 0, d.m.th., gjatë zgjerimit, puna e trupit është pozitive, ndërsa trupi vetë e kryen punën;
nëse dV<0, pastaj dhe<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
Duke ia atribuar punën e zgjerimit 1 kg të masës së trupit punues, marrim
l = L/M; .
Vlera që përfaqëson punën specifike të kryer nga një sistem që përmban 1 kg gaz është e barabartë me
Që në përgjithësi Rështë një variabël, atëherë integrimi është i mundur vetëm kur dihet ligji i ndryshimit të presionit p = p(v).
Formulat (3.1) - (3.2) janë të vlefshme vetëm për proceset e ekuilibrit në të cilat presioni i lëngut punues është i barabartë me presionin e mjedisit.
Në termodinamikë, proceset e ekuilibrit përdoren gjerësisht p, v- një diagram në të cilin boshti i abshisës është vëllimi specifik, dhe boshti i ordinatave është presioni. Meqenëse gjendja e një sistemi termodinamik përcaktohet nga dy parametra, atëherë në p, v Ai përfaqësohet me një pikë në diagram. Tregoni në figurë 1 korrespondon me gjendjen fillestare të sistemit, pikë 2 - përfundimtar, dhe rreshti 12 - procesi i zgjerimit të lëngut të punës nga v1 përpara v2. Me një ndryshim pafundësisht të vogël në vëllim, zona e shiritit vertikal të hijezuar është; pra puna e procesit 12 përshkruhet nga zona e kufizuar nga kurba e procesit, boshti i abshisës dhe ordinatat ekstreme.
Në këtë mënyrë, puna e ndryshimit të vëllimit është ekuivalente me sipërfaqen nën lakoren e procesit në diagramin p, v (Figura 3.1).
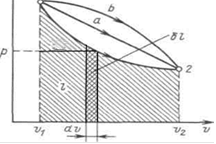
Figura 3.1 - Paraqitja grafike e punës në p, v- koordinatat
Çdo rrugë e sistemit kalon nga gjendja / në gjendje 2 (për shembull, 12, 1a2 ose 1b2) korrespondon me punën e tij të zgjerimit. puna varet nga natyra e procesit termodinamik, dhe nuk është funksion vetëm i gjendjeve fillestare dhe përfundimtare të sistemit. Nga ana tjetër, varet nga rruga e integrimit dhe, për rrjedhojë, puna elementare nuk është një diferencial total.
Puna shoqërohet gjithmonë me lëvizjen e trupave makroskopikë në hapësirë, për shembull, lëvizjen e një pistoni, deformimin e një guaskë, prandaj karakterizon një formë të rregulluar (makrofizike) të transferimit të energjisë nga një trup në tjetrin dhe është një masë e energjia e transferuar. Meqenëse vlera është proporcionale me rritjen e vëllimit, këshillohet të zgjidhni ato që kanë aftësinë të rrisin ndjeshëm vëllimin e tyre si trupa pune të krijuar për të kthyer energjinë termike në energji mekanike. Këtë cilësi e zotërojnë gazrat dhe avujt e lëngjeve. Prandaj, për shembull, në termocentralet, avulli i ujit shërben si një mjet pune, dhe në motorët me djegie të brendshme, produktet e gazta të djegies së një ose një karburanti tjetër.
Nxehtësia
Përveç formës makrofizike të transferimit të energjisë - punës, ekziston edhe një formë mikrofizike, d.m.th., një formë e shkëmbimit të energjisë që kryhet në nivelin molekular midis sistemit dhe mjedisit. Në këtë rast, energjia mund të transferohet në sistem pa bërë punë. Masa e sasisë së energjisë së transferuar me mjete mikrofizike është ngrohjes.
Nxehtësia mund të transferohet ose nëpërmjet kontaktit të drejtpërdrejtë midis trupave (përçueshmëri termike, konvekcion), ose në distancë (me rrezatim), dhe në të gjitha rastet ky proces është i mundur vetëm nëse ka një ndryshim të temperaturës midis trupave.
Siç do të tregohet më poshtë, sasia elementare e nxehtësisë, si dhe L nuk është një diferencial total, ndryshe nga diferenciali i brendshëm i energjisë dU. Pas kësaj simbolike matematikore fshihet kuptimi i thellë fizik i ndryshimit midis koncepteve të energjisë së brendshme, nxehtësisë dhe punës.
Energjia e brendshme- është veti e vetë sistemit, karakterizon gjendjen e sistemit. Ngrohtësi dhe punë- këto janë karakteristikat energjetike të proceseve mekanike dhe termikendërveprimet sistemet me mjedisin. Ato karakterizojnë sasitë e energjisë që transferohen në sistem ose jepen prej tij përmes kufijve të tij në një proces të caktuar.
Entalpia
Në termodinamikë, një rol të rëndësishëm luan shuma e energjisë së brendshme të sistemit U dhe produktet e presionit të sistemit R në vëllimin e tij V, thirrur entalpi dhe shënohet H:
Meqenëse sasitë e përfshira në të janë funksione të shtetit, atëherë entalpia është një funksion shtetëror. Ashtu si energjia e brendshme, puna dhe nxehtësia, ajo matet në joules (J).
![]() ,
,
thirrur entalpi specifike(h = H/M), paraqet entalpinë e një sistemi që përmban 1 kg substancë dhe matet në J/kg.
Meqenëse entalpia është një funksion i gjendjes, ai mund të përfaqësohet si një funksion i çdo dy parametri të gjendjes:
![]() ;
; ![]() ;
; ![]() ,
,
dhe vlera dhështë një diferencial total.
Ndryshimi i entalpisë në çdo proces përcaktohet vetëm nga gjendja fillestare dhe përfundimtare e trupit dhe nuk varet nga natyra e procesit.
Le të zbulojmë kuptimin fizik të entalpisë duke përdorur shembullin e mëposhtëm. Le të shqyrtojmë një sistem të zgjeruar duke përfshirë gazin në një cilindër dhe një pistoni me një ngarkesë me një peshë totale G.
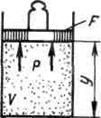 |
Energjia e këtij sistemi është shuma e energjisë së brendshme të gazit dhe energjisë potenciale të pistonit me ngarkesën në fushën e forcave të jashtme: . Në ekuilibër (G=pF) Ky funksion mund të shprehet në terma të parametrave të gazit: . Ne e marrim atë, d.m.th. entalpia mund të interpretohet si energjia e një sistemi të zgjeruar.






