Llogaritja e entalpisë. Entalpia. vetitë fizike
Dega e kimisë që merret me studimin e ndryshimeve të entalpisë gjatë reaksioneve kimike dhe transformimet fazore quhet termokimi. Teknika eksperimentale e përdorur për të përcaktuar entalpinë quhet kalorimetri.
NDRYSHIMI I ENTALPISË GJATË REAKSIONIT KIMIK
Shumë reaksione kimike shoqërohen nga një ndryshim në entalpi. Kjo do të thotë që entalpia totale e produkteve të reaksionit është e ndryshme nga entalpia totale e reaktantëve. Ndryshimi në entalpi përcaktohet nga relacioni
ku është entalpia e reaktantëve dhe është entalpia e produkteve. Sasia nganjëherë quhet nxehtësia e reaksionit.
Nëse entalpia e produkteve është më e vogël se entalpia e reaktantëve, reaksioni quhet ekzotermik (Fig. 5.4). Ulja e entalpisë gjatë reaksionit korrespondon me një vlerë negative. Energjia e humbur gjatë reaksionit ekzotermik së pari hyn në përzierjen e reaksionit. Si rezultat, temperatura e përzierjes së reaksionit rritet. Pastaj kjo energji bartet në rrethinën dhe në fund, kur reaksioni përfundon plotësisht, temperatura e përzierjes së reaksionit ulet përsëri.
Nëse entalpia e produkteve është më e madhe se entalpia e reaktantëve, reaksioni quhet endotermik. Rritja e entalpisë gjatë reaksionit korrespondon me një vlerë pozitive AH. Energjia e përthithur gjatë reaksionit fillimisht merret nga përzierja e reaksionit. Si rezultat, temperatura e përzierjes së reaksionit zvogëlohet. Meqenëse temperatura e ambientit tani është më e lartë se ajo e përzierjes së reaksionit, energjia e nxehtësisë transferohet nga mjedisi në përzierjen e reaksionit dhe përfundimisht, kur reaksioni përfundon, temperatura e përzierjes së reaksionit rritet përsëri.
Entalpia standarde (nxehtësia) e formimit të një substance është efekti termik i reaksionit të formimit të 1 mol të një përbërjeje kimike nga substanca të thjeshta në kushte standarde: T=289 K, P=1 atm=101325 Pa.
Nxehtësitë e formimit substanca të thjeshta janë të barabarta me zero.
ν i, ν j - koeficientët stekiometrikë përballë substancave përkatëse në ekuacionin e reaksionit.
Sipas entalpive (ngrohjeve) standarde të djegies së substancave
Entalpia standarde (nxehtësia) e djegies së një lënde është efekti termik i reaksionit të djegies së plotë të 1 mol të një përbërjeje kimike në kushte standarde.
![]()
Nxehtësitë e djegies së oksideve më të larta (përfshirë CO 2 dhe H 2 O) supozohen të jenë zero.
Ligji i dytë i termodinamikës përcakton mundësinë, drejtimin dhe thellësinë e një procesi spontan.
Procesi spontan - një proces që vazhdon pa asnjë ndikim të jashtëm dhe e afron sistemin me një gjendje ekuilibri.
Procesi termodinamikisht i kthyeshëm - një proces që vazhdon në drejtimet e përparme dhe të kundërta pa ndryshime në sistem dhe në mjedis, d.m.th. gjatë kalimit nga gjendja fillestare në gjendjen përfundimtare, të gjitha gjendjet e ndërmjetme janë në ekuilibër.
Në prani të gjendjeve të ndërmjetme jo ekuilibër, procesi konsiderohettermodinamikisht i pakthyeshëm.
Në natyrë, sistemet me energji minimale janë të qëndrueshme. Atëherë vetëm proceset ekzotermike duhet të jenë spontane. Por nuk është. Kjo do të thotë se ekziston një kriter tjetër për rrjedhën spontane të procesit - entropia (S).
Entropia -një masë e çrregullimit të energjisë në një sistem, një masë e kaosit, një masë e energjisë që shpërndahet në formën e nxehtësisë dhe nuk shndërrohet në punë.
Ligji i dytë i termodinamikës (ligji i dytë i termodinamikës):
Proceset ndodhin spontanisht, duke çuar në një rritje të entropisë totale të sistemit dhe mjedisit
Δ S sistem + Δ S mjedise ≥ 0 ose Δ S ≥ 0
Kuptimi fizik i entropisë:
entropia është sasia e energjisë që shpërndahet nga 1 mol substancë për 1 shkallë.
S 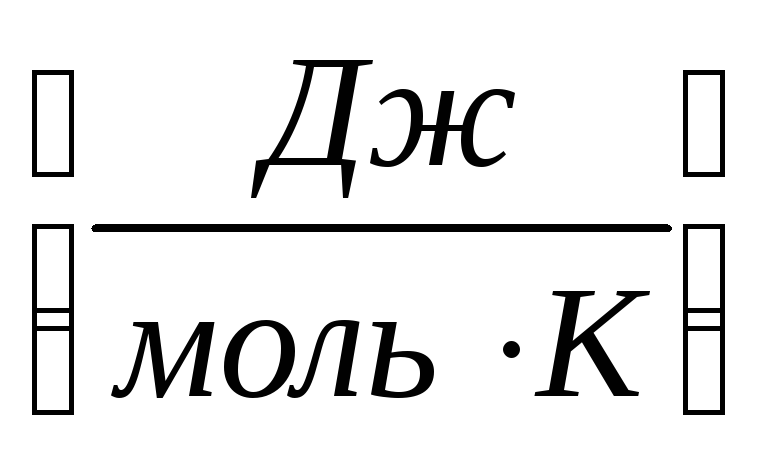
Entropia është një funksion i gjerë. Entropia është proporcionale me masën, i referohet 1 mol ose 1 gram të një substance. Kjo do të thotë që entropia e sistemit është e barabartë me shumën e entropive të pjesëve përbërëse të tij:
S= 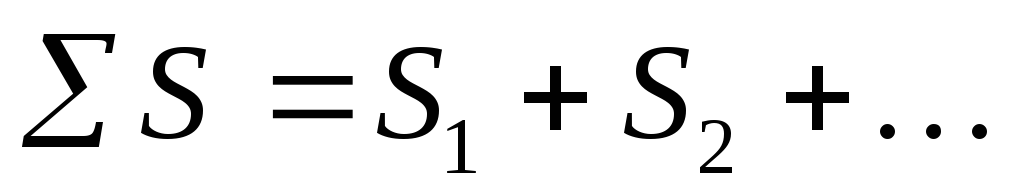
Entropia është një funksion i gjendjes së sistemit. Do të thotë se  karakterizon sistemi, jo një proces. Ndryshimi i tij varet vetëm nga gjendja fillestare dhe përfundimtare e sistemit dhe nuk varet nga rruga e tranzicionit:
karakterizon sistemi, jo një proces. Ndryshimi i tij varet vetëm nga gjendja fillestare dhe përfundimtare e sistemit dhe nuk varet nga rruga e tranzicionit:
Për një reaksion kimik, ndryshimi i entropisë është: 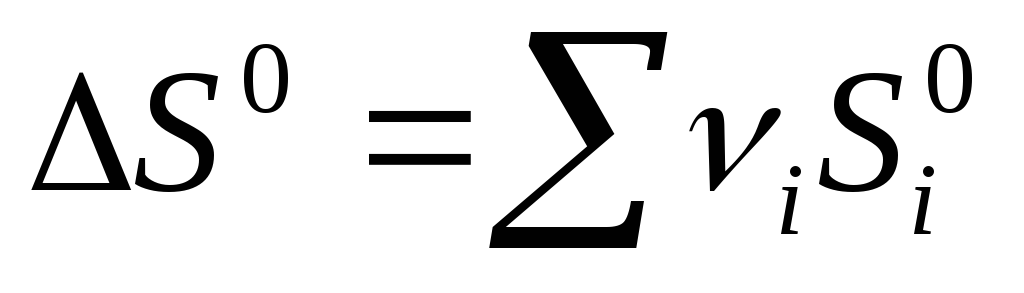 prod -
prod - 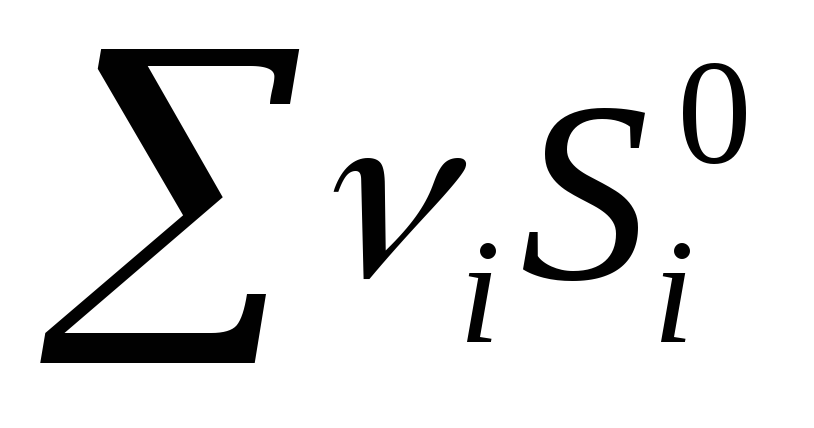 ref
ref
Kuptimi probabilistik i entropisë
Për çdo sistem termodinamik, dallohen një makrostate dhe një mikrogjendje. Makrostati i sistemit karakterizohet nga makroparametra (T, P, V, U, etj.). Në të njëjtën kohë, sistemi përbëhet nga një numër i pafund mikrogrimcash. Një mikrogjendje është rregullimi dhe energjia e molekulave individuale në ky moment koha.
Një gjendje makroskopike e sistemit mund të realizohet nga disa mikrogjendje të ndryshme. Për çdo mikrogjendje, ekziston një probabilitet (P) që sistemi të jetë në këtë mikrogjendje të veçantë. Prandaj, të gjitha proceset në termodinamikë janë të një natyre probabiliste ose statistikore, e cila përcakton kalimin e një sistemi nga një gjendje më pak e mundshme në një gjendje më të mundshme.
Boltzmann në 1896 supozoi se entropia është e lidhur me probabilitetin termodinamik nga një varësi logaritmike
S = klnW ekuacioni Boltzmann
k– Konstanta e Boltzmanit: k= 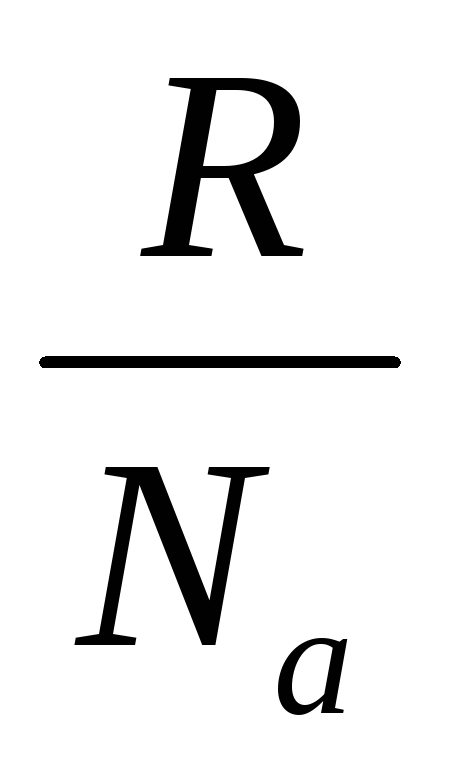 = 1,38∙10 -23 J/shkallë;
= 1,38∙10 -23 J/shkallë;
W është numri i mikrogjendjeve me ndihmën e të cilave mund të realizohet ky makrostate: W=1/Р;
P është probabiliteti që sistemi të jetë në këtë mikrogjendje të veçantë.
Me një rritje të rendit në sistem, numri i mikrostateve që mund të përdoren për të realizuar këtë gjendje zvogëlohet dhe entropia zvogëlohet.
Kur një substancë kalon nga një gjendje e gaztë në një gjendje të lëngshme dhe më pas në një gjendje kristalore, entropia zvogëlohet. Sipas ekuacionit të Boltzmann-it, entropia mund të jetë e barabartë me zero vetëm në një gjendje të vetme.
Në vitin 1911, Planck formuloi postulatin e njohur si ligji i tretë i termodinamikës:
entropia e një kristali të ndërtuar në mënyrë ideale të një substance të pastër (pa defekte dhe papastërti) në zero absolute është zero.
Ky ligj vendos referencën zero për entropinë, e cila bën të mundur llogaritjen e vlerës së saj absolute, pasi
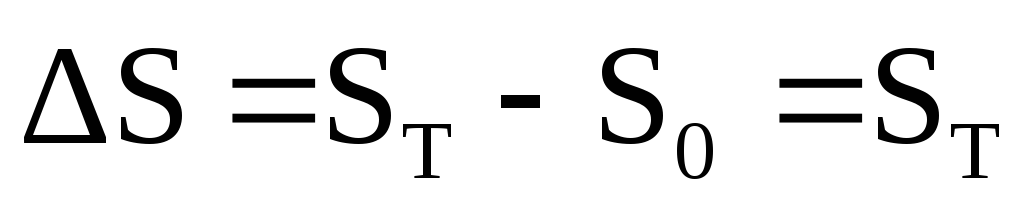
Në një sistem të izoluar (U,V=const), entropia rritet në një proces spontan. Në një gjendje ekuilibri, entropia është maksimale dhe konstante.
Në të mbyllura dhe sistem i hapur kriter për rrjedhën spontane të procesit është reduktimi Energjia e Gibbs ( G ).
H - entalpi
T - temperatura
S - entropia
Duke përdorur energjinë Gibbs, ligji i dytë i termodinamikës mund të shprehet si:
Në një temperaturë dhe presion konstant në sistem, vetëm proceset që çojnë në një ulje të energjisë së Gibbs zhvillohen në mënyrë spontane. Në ekuilibër, energjia e Gibbs-it është zero.
∆G≤0 (p, T=konst)
Në ∆G<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 në drejtim të kundërt
∆G=0 reaksioni është në ekuilibër.
Ndryshimi në energjinë Gibbs jepet nga
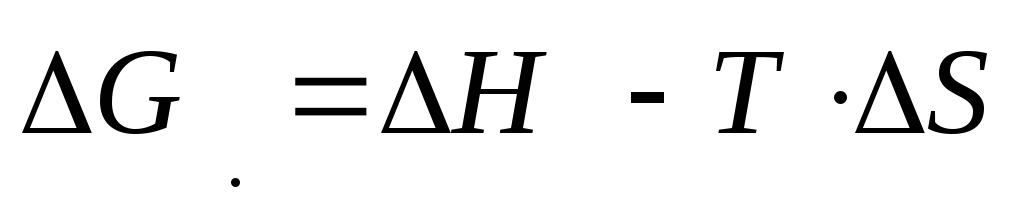
Termi i parë quhet faktori entalpi, i dyti - faktori i entropisë. Një rënie në energjinë e Gibbs-it, dhe rrjedhimisht rrjedha spontane e procesit, lehtësohet nga një ulje e ∆H (proceset me çlirimin e nxehtësisë) dhe një rritje në entropinë (proceset me një rritje të çrregullimit në sistem).
Energjia standarde e Gibbs reaksion kimik llogaritur me formulën duke përdorur të dhënat tabelare:
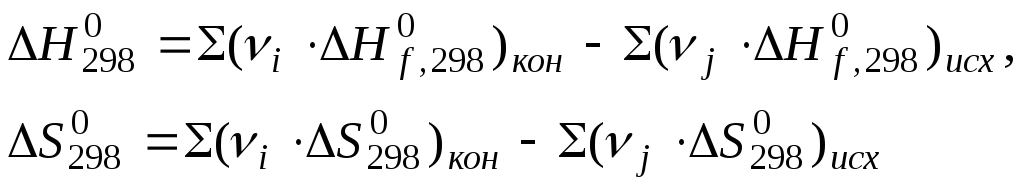
Proceset ekzergonike - reaksione kimike, si rezultat i të cilave energjia Gibbs zvogëlohet dhe sistemi funksionon.
Proceset endergonike - reaksionet kimike, si rezultat i të cilave rritet energjia e Gibbs-it dhe punohet në sistem.
Për shembull, oksidimi i glukozës në gjak është një proces ekzergonik, pasi shoqërohet me një ulje Energjia e Gibbs, dhe si rezultat i këtij reagimi, është e mundur të kryhen lloje të ndryshme të punës në trup.
Aplikimi 2: Pyetje për vetëkontroll
Çfarë studion termodinamika kimike?
Cilat janë parametrat e gjendjes?
Cili është ndryshimi midis parametrave intensivë dhe të gjerë?
Cili funksion mund të quhet funksion shtetëror?
Jepni përkufizime energjia e brendshme, ngrohtësi, punë.
Cilat lloje të sistemeve termodinamike njihni? Qfare eshte dallimi?
Cilat janë llojet e proceseve termodinamike?
Tregoni ligjin e parë të termodinamikës.
Përcaktoni termat entalpi, entalpi standarde e formimit të një lënde, entalpi standarde e djegies së një lënde.
Cila është entalpia standarde e reaksionit? Cilat metoda të llogaritjes së tij njihen?
Formuloni ligjin e Hesit.
Tregoni ligjin e dytë të termodinamikës. Çfarë parashikon?
Proceset e kthyeshme dhe të pakthyeshme në kuptimin termodinamik.
Përcaktoni konceptin e entropisë.
Energjia e Gibbs. Parashikimi i drejtimit të proceseve spontane në një të izoluar dhe sisteme të mbyllura; roli i faktorëve të entalpisë dhe entropisë.
Kushtet e ekuilibrit termodinamik.
Cila është energjia standarde e Gibbs-it e formimit të materies, energji standarde Oksidimi biologjik i një substance të Gibbsit, energjia standarde e reaksionit të Gibbs-it?
Shpjegoni konceptin e proceseve ekzergonike dhe endergonike që ndodhin në trup, parimin e konjugimit të energjisë.
Aplikimi 3: test praktik
Studimet e termodinamikës:
a) marrëdhëniet e nxehtësisë dhe energjisë;
b) shpejtësia e proceseve kimike;
c) vetitë e klasave kryesore të përbërjeve kimike;
Entropia është...
b) aftësia për të bërë punë;
c) masën e çrregullimit në sistem;
3) Ligji i parë i termodinamikës përshkruan:
a) entropia e një sistemi termodinamik;
b) marrëdhëniet ndërmjet energjisë së brendshme, nxehtësisë dhe punës;
c) viskoziteti dinamik i substancave.
4) Proceset zhvillohen në mënyrë spontane, të shoqëruara nga:
a) një rënie në energji;
b) ulje e entropisë;
c) një rritje e entropisë.
5) Një sistem i mbyllur karakterizohet nga:
a) mungesa e shkëmbimit të materies dhe energjisë;
b) mungesa e shkëmbimit të energjisë;
c) mungesa e metabolizmit;
Përgjigjet: 1a, 2c, 3b, 4c, 5c
Aplikimi 4: Detyrat situative
Llogaritni efektin termik të reaksionit
Entalpia
ose du + pdv = di - vdp .
dq = di - vdp
dq p = di . (86)
Ndryshimi i entalpisë në çdo proces përcaktohet vetëm nga gjendja fillestare dhe përfundimtare e trupit dhe nuk varet nga natyra e procesit.
Entropiaështë një funksion i gjendjes, prandaj ndryshimi i tij në procesin termodinamik përcaktohet vetëm nga vlerat fillestare dhe përfundimtare të parametrave të gjendjes. Ndryshimi i entropisë në proceset bazë termodinamike:
në izokorik
në isobarike
vizotermike
në adiabatik
në politropike
ENERGJIA E BRENDSHME E TRUPIT TË PUNËS, KUPTIMI FIZIK DHE DIMENSIONALITETI.
Energjia e brendshme- kjo është e gjithë energjia që përmban trupi ose sistemi i trupave.Kjo energji mund të paraqitet si një shumë lloje të caktuara energjitë: energjia kinetike e molekulave, duke përfshirë energjinë e përkthimit dhe lëvizje rrotulluese molekulat dhe lëvizje osciluese atomet në vetë molekulën; energjia e elektroneve; energjia intranukleare; energjitë e bashkëveprimit ndërmjet bërthamës së një molekule dhe elektroneve; energjia potenciale ose energjia e pozicionit të molekulave në çdo fushë të jashtme të forcave; energjia e rrezatimit elektromagnetik.
Energjia totale e brendshme e trupit zakonisht shënohet U (J), dhe energjinë specifike të brendshme u (J/kg).
Energjia e brendshme është:
Ku është e brendshme energjia kinetike molekulat, energjia e brendshme potenciale e molekulave, është konstanta e integrimit.
Në termodinamikën teknike, konsiderohen vetëm procese të tilla në të cilat komponentët kinetikë dhe potencialë të energjisë së brendshme ndryshojnë.
Ndryshimi në energjinë e brendshme të një gazi ideal për çdo proces me një ndryshim të pafundëm të gjendjes (për 1 kg)
Në llogaritjet termike, zakonisht kërkohet të dihet ndryshimi i energjisë së brendshme, dhe jo vlera e saj absolute; prandaj, pika e referencës (0 K ose 0 0 C) për rezultati përfundimtar() e parëndësishme.
ku është kapaciteti mesatar i masës së nxehtësisë vëllim konstant brenda
Kështu, ndryshimi në energjinë e brendshme të një gazi ideal për çdo proces është i barabartë me produktin e kapacitetit mesatar të nxehtësisë në një vëllim konstant dhe ndryshimit të temperaturës së gazit.
PROCESET JANË TË KTHYSHME DHE TË KTHYSHME. EKUILIBRI DHE JO EKUILIBRI
Një proces termodinamik është një ndryshim vijues në gjendjen e një trupi që ndodh si rezultat i ndërveprimit energjetik të lëngut të punës me mjedisi.
Konceptet e procesit termodinamik të kthyeshëm dhe të pakthyeshëm janë të lidhura ngushtë me ekuilibrin e sistemit. Le të shqyrtojmë një sistem të tillë termodinamik në të cilin nuk ka shkëmbim nxehtësie me mjedisin (sistemi termodinamik adiabatik). Proceset termodinamike që ndodhin në një sistem të tillë quhen të kthyeshëm nëse sistemi kthehet në gjendjen e tij origjinale gjatë proceseve të drejtpërdrejta dhe të kundërta pa ndonjë efekt termik shtesë të mjedisit në sistem. Nëse sistemi nuk mund të kthehet në gjendjen e tij origjinale gjatë procesit të kundërt ose kjo kërkon furnizim me nxehtësi, atëherë një proces i tillë quhet i pakthyeshëm.
Procesi me çdo ndryshim në presion dhe temperaturë mund të jetë i kthyeshëm vetëm nëse, gjatë gjithë procesit nga pika në pikë e sistemit termodinamik, presioni është konstant dhe temperatura në çdo pikë është e barabartë me temperaturën e ambientit ose ndryshimi i tyre është pafundësisht i vogël. .
proceset termodinamike të kthyeshme janë rasti ideal ose teorik. Të gjitha proceset reale janë të pakthyeshme, pasi në praktikë plotësimi i kushtit pothuajse statik është i vështirë për t'u përmbushur. Përveç kësaj, pakthyeshmëria e proceseve shkaktohet nga prania e fërkimit të brendshëm në lëngun e punës dhe fërkimi sipërfaqësor në pajisjet teknike (rrjedhja në grykë, fërkimi i sipërfaqes së pistonit kundër murit të cilindrit, etj.). Për të kapërcyer fërkimin, është gjithmonë e nevojshme të shpenzoni një sasi pune mekanike, e cila gjatë procesit shndërrohet në nxehtësi.
KAPACITETI NXEHTËSOR I MJETETIT PUNE
kapaciteti i nxehtësisë quaj sasinë e nxehtësisë që duhet t'i jepet një trupi (gaz) në mënyrë që të rritet temperatura e çdo njësie sasiore me 1 ° C.
Për të përcaktuar vlerat e kapaciteteve të nxehtësisë të listuara më sipër, mjafton të dini vlerën e njërit prej tyre. Është më e përshtatshme të kemi vlerën e kapacitetit molar të nxehtësisë, pastaj kapacitetin e nxehtësisë në masë:
dhe kapaciteti vëllimor i nxehtësisë:
Kapacitetet vëllimore dhe masive të nxehtësisë janë të ndërlidhura nga varësia:
ku është dendësia e gazit në kushte normale.
Kapaciteti termik i një gazi varet nga temperatura e tij. Mbi këtë bazë dallohet kapaciteti mesatar dhe i vërtetë i nxehtësisë.
Nëse q- sasia e nxehtësisë që i jepet një njësie të sasisë së gazit (ose e hequr prej saj) kur temperatura e gazit ndryshon nga t1 përpara t2 pastaj
përfaqëson kapaciteti mesatar i nxehtësisë brenda . Kufiri i këtij raporti, kur diferenca e temperaturës tenton në zero, quhet kapaciteti i vërtetë i nxehtësisë.
PROCESI I GAZIT ISOKORIK
Procesi izokorik- procesi i komunikimit ose heqjes së nxehtësisë në një vëllim konstant të gazit (v= konst).
Në një vëllim konstant, presioni i një gazi ndryshon në përpjesëtim të drejtë me temperaturat absolute:
Puna e jashtme e gazit në v= konstiti është zero l=0.
sasia e nxehtësisë ose ndryshimi në energjinë e brendshme të gazit:
Procesi izokorik pv - diagram shfaqet nga një vijë e drejtë vertikale - izokore. Me një sasi pozitive nxehtësie, linja shkon nga poshtë lart.
Ndryshimi i entropisë është:
PROCESI I GAZIT ISOBARIK.
Procesi izobarik - procesi i komunikimit ose heqjes së nxehtësisë në presion të vazhdueshëm (R = konst)
Kurba e procesit quhet izobar.
Sepse në një proces izobarik dp=0 atëherë nuk kryhet asnjë punë teknike në sistem dhe sasia e nxehtësisë e nevojshme për të transferuar trupin nga gjendja 1 në gjendjen 2 përcaktohet si:
Kështu, në një proces termodinamik izobarik, sasia e nxehtësisë që furnizohet (i hiqet) trupit është proporcionale me ndryshimin e entalpisë në këtë proces.Ky përfundim vlen si për proceset e kthyeshme ashtu edhe për ato të pakthyeshme, me kusht që sistemi të jetë në ekuilibër termodinamik në fillimi dhe përfundimi i procesit.
Për një proces të kthyeshëm:
procesi izobarik pv- diagrami shfaqet si një vijë e drejtë horizontale. Kur nxehtësia i shtohet procesit, linja shtrihet nga e majta në të djathtë.
Puna mekanike në një proces të tillë:
Puna e jashtme specifike e disponueshme (e dobishme):
Ndryshimi në energjinë specifike të brendshme:
Nga ekuacioni i gjendjes për një gaz ideal, marrëdhënia e mëposhtme mund të merret për një proces izobarik:
Kështu, në një proces izobarik, vëllimi i një gazi ideal është proporcional me temperaturë absolute. Kur një gaz zgjerohet, temperatura rritet, kur ngjeshet, zvogëlohet.
Ndryshimi i entropisë në një proces izobarik mund të llogaritet si më poshtë:
PROCESI I GAZIT ADIABATIK.
Procesi vazhdon pa furnizim dhe largim të nxehtësisë, d.m.th. në mungesë të shkëmbimit të nxehtësisë me mjedisin, quhet adiabatik, dhe kurba e këtij procesi quhet adiabatike. Kushtet e procesit: dq=0 , q=0.
Sepse dq=0, atëherë sipas ligjit të parë të termodinamikës:
Kështu, puna mekanike e kryer nga trupi punues në një proces termodinamik adiabatik është e barabartë me një ulje të energjisë së brendshme të trupit, ndërsa puna teknike është në përpjesëtim me ndryshimin (uljen) e entalpisë. Në një proces diabatik të kthyeshëm, entropia e një trupi termodinamik nuk ndryshon: S=Konst.
Ekuacioni adiabatik në sistemin koordinativ pv- diagramet me kapacitet të vazhdueshëm nxehtësie () për një gaz ideal: ku është eksponenti adiabatik
Varësitë ndërmjet parametrave fillestarë dhe përfundimtarë të procesit: ndërmjet R dhe v ,
ndërmjet T dhe v
ndërmjet R dhe T
Puna e 1 kg gaz gjendet me formulat e mëposhtme
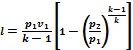
Ndryshimi i energjisë së brendshme të gazit dhe puna e procesit adiabatik janë të barabarta në madhësi dhe të kundërta në shenjë. .
Ndryshimi në energjinë e brendshme të një gazi ideal në një proces adiabatik mund të shprehet gjithashtu me ekuacion
Ligji i dytë i termodinamikës
Ligji i dytë i termodinamikës përcakton drejtimin e rrjedhës së proceseve termike spontane në natyrë dhe përcakton kushtet për shndërrimin e nxehtësisë në punë. Ligji thotë se nxehtësia në natyrë kalon spontanisht vetëm nga trupat që janë më të nxehtë në më pak të nxehtë.
Në përputhje me ligjin e dytë të termodinamikës, për të kthyer nxehtësinë në punë në çdo motor ngrohjeje, është e nevojshme të kemi dy trupa me temperatura të ndryshme. Një trup më i nxehtë do të jetë një burim nxehtësie për punë, një trup më pak i nxehtë do të jetë një lavaman nxehtësie. Në këtë rast, efikasiteti i motorit të nxehtësisë do të jetë gjithmonë më i vogël se uniteti.
Ligji i dytë i dinamikës mund të shprehet matematikisht:
Ku dS- një rritje pafundësisht e vogël e entropisë së sistemit;
dQ- një sasi e pafundme nxehtësie e marrë nga sistemi nga një burim nxehtësie;
T- temperatura absolute e burimit të nxehtësisë.
Shenja e pabarazisë korrespondon me procese të pakthyeshme dhe e barabartë me ato të kthyeshme. Prandaj, shprehja analitike për ligjin e dytë të termodinamikës për një proces të kthyeshëm pafundësisht të vogël merr formën
dhe që nga ajo kohë sipas ligjit të parë të termodinamikës
dQ=dU+pdV
TdS=dU+pdV.
Cikli Carnot dhe vetitë e tij.
Cikli Carnot. Përbëhet nga dy izoterma dhe dy adiabate. Ky cikël është një proces i mbyllur që kryhet nga lëngu i punës në një motor ngrohje ideale në prani të dy burimeve të nxehtësisë: një ngrohës dhe një frigorifer.
Cikli i Carnot pv-diagramë
Proceset 1-2 dhe 3-4 janë izotermale, ndërsa proceset 2-3 dhe 4-1 janë adiabatike. Temperatura fillestare e lëngut të punës në cikël supozohet të jetë e barabartë me temperaturën e ngrohësit T1. Gjatë zgjerimit izotermik nga gjendja 1 në gjendjen 2, lëngu i punës merr nga ngrohësi sasinë e nxehtësisë. q 1 në një temperaturë T1. Në seksionin 2-3, lëngu i punës zgjerohet në mënyrë adiabatike. Në të njëjtën kohë, temperatura e lëngut të punës zvogëlohet nga T1 përpara T2, dhe presioni bie nga p2 përpara f 3. Kur kompresohet përgjatë izotermës 3-4, sasia e nxehtësisë largohet nga lëngu i punës në frigorifer. q2 në një temperaturë T2.Shtypja e mëtejshme adiabatike4-1 çon në një rritje të temperaturës së lëngut punues nga T2 përpara T1, dhe lëngu i punës kthehet në gjendjen e tij origjinale.
Puna totale e ciklit l c paraqitet grafikisht nga një sipërfaqe prej 12341.
Efikasiteti i ciklit termik:
Puna e ciklit Carnot
Efikasiteti termik cikli:
Cikli me furnizim me nxehtësi në vëllim konstant përbëhet nga dy adiabat dhe dy izokore
Karakteristikat e ciklit:
Raporti i kompresimit
Raporti i presionit
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Një cikël me furnizim me nxehtësi në presion konstant përbëhet nga dy adiabat, një izobar dhe një izokor.
Karakteristikat e ciklit:
Raporti i kompresimit
Shkalla e parazgjerimit.
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Cikli me furnizim të kombinuar me nxehtësi përbëhet nga dy adiabat, dy izokore dhe një izobar
Karakteristikat e Ciklit
Sasia e nxehtësisë së dhënë
Sasia e nxehtësisë së hequr
Efikasiteti termik ciklit
Tavolina me avull uji.
avull i mbinxehur ose avulli i ngopur në vetitë e tyre ndryshojnë ndjeshëm nga gazet ideale. Ekuacionet për gjendjen e avujve janë shumë komplekse dhe nuk përdoren në praktikën llogaritëse. Për qëllime praktike përdoren tabela dhe diagrame, të përpiluara në bazë të të dhënave eksperimentale dhe teorike. Tabelat janë përpiluar me një shkallë të lartë saktësie për mbinxehje dhe avujt e ngopur deri në temperaturën 1000 0 C dhe presionin 98.0 MPa.
Në tabelat për avull i ngopur temperaturat e ngopjes, presionet, vlerat vëllime specifike, entalpia dhe entropia e avullit të lëngshëm dhe të thatë, nxehtësia e avullimit. Në tabelat e avullit të mbinxehur jepen vlerat e parametrave kryesorë për presione dhe temperatura të ndryshme: vëllimi specifik, entalpia dhe entropia.
i - Diagrami i avullit të ujit.
dinjitet i madh është diagrami është se puna teknike dhe sasia e nxehtësisë e përfshirë në procese përfaqësohen nga segmentet e linjës, jo nga zonat. Gjatë ndërtimit është-diagramet vizatuar përgjatë boshtit y entalpi specifikeçift, dhe përgjatë abshisës është entropia specifike. Origjina e koordinatave merret si gjendja e ujit në pikën e trefishtë, ku , .
Duke përdorur të dhënat e tabelave të avullit të ujit, kthesat kufitare të lëngut dhe avullit janë paraqitur në diagram, duke konverguar në pikë kritike K. Lakorja kufitare e lëngut e lë origjinën, sepse. në këtë pikë, entropia dhe entalpia merren të barabarta me zero. Gjendja e ujit shënohet me pika në izobaret përkatëse. Linjat izobare në rajonin e avullit të lagësht janë vija të drejta të pjerrëta që dalin nga kurba e kufirit të lëngut. Në një proces izobarik:
Pjerrësia pjerrësia e izobarit ndaj boshtit të abshisës në secilën pikë të diagramit është numerikisht e barabartë me temperaturën absolute të gjendjes së dhënë. Sepse në rajonin e avullit të lagësht, izobari përkon me izotermën, atëherë sipas ekuacionit të fundit, izobari i avullit të lagësht janë vija të drejta:
Dhe ky është ekuacioni i një vije të drejtë. Në rajonin e avullit të mbinxehur, izobaret kanë një lakim me një konveksitet të drejtuar nga poshtë. Në zonën e avullit të lagësht aplikohet një rrjet vijash me tharje konstante avulli (x=const), të cilat konvergojnë në pikën kritike K.
Izotermat në rajonin e avullit të lagësht përkojnë me izobaret. Në zonën e avullit të mbinxehur, ato ndryshojnë: izobaret ngrihen lart, dhe izotermat janë vija të lakuara me një konveksitet lart. Një rrjet izokoresh është aplikuar në diagram, të cilat kanë formën e kthesave që ngrihen më shumë në krahasim me izobaret. Një proces adiabatik i kthyeshëm përfaqësohet nga një vijë e drejtë vertikale. Zona nën izobarin pikë e trefishtë përshkruan gjendjen e një përzierjeje avulli + akull.
Procesi adiabatik i avullit të ujit. Përpunoni imazhin në p–V , i-S dhe T–S diagramet.
Procesi adiabatik zhvillohet pa furnizim dhe largim të nxehtësisë, dhe entropia e lëngut të punës në procesin e kthyeshëm mbetet vlerë konstante: s=konst. Prandaj, në është dhe Ts- Diagramet adiabatike paraqiten me vija të drejta vertikale: fig. a dhe b
Gjatë zgjerimit adiabatik, presioni dhe temperatura e avullit ulen; avulli i mbinxehur kthehet në të thatë, dhe më pas në avull i lagësht. Nga kushtet e qëndrueshmërisë së entropisë, është e mundur të përcaktohen parametrat përfundimtarë të avullit nëse dihen parametrat e gjendjes fillestare dhe një parametër të gjendjeve përfundimtare.
Në pv- në diagram, një proces adiabatik i kthyeshëm përshkruhet nga një kurbë e caktuar (Fig. c)
Puna specifike në një proces adiabatik përcaktohet nga ekuacioni:
Ndryshimi në energjinë specifike të brendshme:
Kompresimi me shumë faza në kompresor.
Kompresorët me shumë faza përdoren për të prodhuar gaz me presion të lartë
në të cilin gazi është i ngjeshur në mënyrë politropike në disa cilindra të lidhur në seri me ftohjen e tij të ndërmjetme pas çdo shtypjeje.
Përdorimi i kompresimit të gazit në disa cilindra ul raportin e presionit në secilin prej tyre dhe rrit efikasitetin vëllimor. kompresor. Përveç kësaj, ftohja e ndërmjetme e gazit pas çdo faze përmirëson kushtet e lubrifikimit të pistonit në cilindër dhe zvogëlon konsumin e energjisë për ngasjen e kompresorit.
Diagrami tregues ideal i një kompresori me tre faza, ku 0-1 është linja e thithjes në fazën e parë;
1-2 - procesi i kompresimit politropik në fazën e parë; 2-a - linja e injektimit nga faza e parë në ftohësin e parë; a-3 - linja e thithjes në fazën e dytë; 3-4 - procesi i kompresimit politropik në fazën e dytë; 4-c - linja e shkarkimit nga faza e dytë në ftohësin e dytë; c-5 - linja e thithjes në fazën e tretë; 5-6 - procesi i kompresimit politropik në fazën e tretë; 6-c - linja e injektimit nga faza e tretë në rezervuar ose në prodhim. Segmentet 2-3, 4-5 përshkruajnë një ulje të vëllimit të gazit në procesin në presion konstant nga ftohja në ftohësin e parë dhe të dytë. Ftohja e lëngut të punës në të gjithë ftohësit kryhet në të njëjtën temperaturë të barabartë me fillestarin T 1, prandaj, temperaturat e gazit në pikat 1, 3 dhe 5 janë të njëjta dhe shtrihen në izotermën 1 - 7.
Raporti i presioneve në të gjitha fazat zakonisht merret i njëjtë:
Me të njëjtat raporte presioni në të gjitha fazat, barazia e temperaturave fillestare dhe barazia e treguesve politropikë, temperaturat përfundimtare të gazit në fazat individuale të kompresorit janë të barabarta me njëra-tjetrën: l k \u003d 3l 1
Në të njëjtat kushte të kompresimit të gazit, sasitë e nxehtësisë së larguar nga gazi në faza të veçanta janë të barabarta me njëra-tjetrën:
Nxehtësia e larguar nga gazi në çdo ftohës gjatë procesit të ftohjes izobarike gjendet me formulën:
AT Ts- Në diagrame, proceset e ngjeshjes adiabatike tregohen me vija të drejta 1-2, 3-4, 5-6, dhe proceset e ftohjes me kthesat 2-3, 4-5, 6-7.
Proceset e kompresimit politropik tregohen nga kthesat 1-2, 3-4, 5-6, dhe proceset e ftohjes në ftohës - nga rreshtat 2-3, 4-5, 6-7.
Cikli i akullit me djegie në V=konst
Figura tregon një diagram tregues të një motori që funksionon me karburant me djegie të shpejtë në një vëllim konstant. Si lëndë djegëse përdoret benzina, gazi ndriçues apo gjeneratori, alkoolet etj.
Kur pistoni lëviz nga pozicioni i vdekur i majtë në ekstremin e djathtë, përzierja e djegshme thithet përmes valvulës së thithjes. Ky proces përshkruhet nga një kurbë 0-1, e quajtur linja e thithjes, nuk është një proces termodinamik, sepse. në të, parametrat kryesorë nuk ndryshojnë, por vetëm masa dhe vëllimi i përzierjes në cilindër ndryshojnë. Kur pistoni lëviz prapa, valvula e thithjes mbyllet dhe përzierja e djegshme kompresohet. Përshkruar nga kurba 1-2, e quajtur linja e kompresimit. Në pikën 2, përzierja e djegshme ndizet nga një shkëndijë elektrike. Djegia e përzierjes së djegshme ndodh pothuajse menjëherë, d.m.th. në vëllim pothuajse konstant. Ky proces përshkruhet nga kurba 2-3. Si rezultat i djegies së karburantit, temperatura e gazit rritet ndjeshëm dhe presioni rritet (pika 3). Pastaj produktet e djegies zgjerohen. Pistoni lëviz në pozicionin e duhur të vdekur dhe gazrat bëjnë punë të dobishme. Në diagramin e treguesit, procesi i zgjerimit përshkruhet nga një kurbë 3-4, e quajtur vija e zgjerimit. Në pikën 4, valvula e shkarkimit hapet dhe presioni në cilindër bie në presion pothuajse të jashtëm. Me lëvizjen e mëtejshme të pistonit nga e djathta në të majtë, produktet e djegies hiqen nga cilindri përmes valvulës së shkarkimit me një presion pak më të lartë se presioni atmosferik. Ajo përshkruhet si një kurbë 4-0 dhe quhet vija e shkarkimit. Një rrjedhë e tillë e punës përfundon në katër goditje të pistonit ose në dy rrotullime të boshtit. Motorë të tillë quhen me katër goditje.
Cikli me furnizim me nxehtësi në vëllim konstant përbëhet nga dy adiabat dhe dy izokore
Karakteristikat e ciklit janë:
- raporti i kompresimit
– shkalla e rritjes së presionit
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Cikli i akullit me djegie në p=konst
Studimi i cikleve me furnizim me nxehtësi në një vëllim konstant tregoi se për të rritur efikasitetin e një motori që funksionon sipas këtij cikli, është e nevojshme të aplikohen raporte të larta kompresimi. Ajri me kompresim të lartë ka një temperaturë kaq të lartë sa që karburanti i furnizuar në cilindër ndizet spontanisht pa ndezës. Kompresimi i veçantë i ajrit dhe karburantit lejon përdorimin e çdo karburanti të lëngshëm të rëndë dhe të lirë - naftë, naftë, rrëshirë, vajra qymyri.
Ky avantazh posedohet nga motorët që funksionojnë me djegie graduale të karburantit me presion konstant. Në to, ajri është i ngjeshur në cilindrin e motorit, dhe karburanti i lëngshëm spërkatet me ajër të ngjeshur nga kompresori.
Cikli ideal i motorit me djegie graduale të karburantit me presion konstant, d.m.th. cikli me furnizimin e nxehtësisë me presion konstant kryhet si më poshtë.
Lëngu punues i gaztë me parametra fillestarë p 1 , v 1 , T 1 tkurret përgjatë adiabatit 1-2; atëherë një sasi e caktuar nxehtësie i jepet trupit përgjatë izobarit 2-3 q 1. Nga pika 3, trupi i punës zgjerohet përgjatë adiabatit 3-4. Sipas izokorës 4-1, lëngu i punës kthehet në gjendjen e tij origjinale, ndërsa nxehtësia largohet në lavamanin e nxehtësisë. q2.
Karakteristikat e ciklit:
Raporti i kapacitetit të nxehtësisë
ku kështë indeksi adiabatik.
Koncepti i "Koeficientit të ftohjes"
Koeficienti i performancës është një vlerë pa dimension (zakonisht më e madhe se një) që karakterizon efikasitetin energjetik të punës makinë ftohëse; është e barabartë me raportin e kapacitetit ftohës me sasinë e energjisë (punës) të shpenzuar për njësi të kohës për zbatimin cikli i ftohjes. Përcaktohet nga lloji i ciklit të ftohjes sipas të cilit funksionon makina, nga përsosja e elementeve kryesore të saj dhe për të njëjtën makinë varet nga kushtet e temperaturës së funksionimit të saj.
Koeficienti i performancës së një makine frigoriferike ideale që funksionon në ciklin e kundërt Carnot:
ku T min dhe Tmax janë, përkatësisht, më të ulëta dhe temperaturë më të lartë në një cikël.
Koeficienti i ftohjes së ftohësit të ajrit (figura),
ku T1 dhe T2 janë respektivisht temperaturat e fillimit dhe të fundit të ngjeshjes adiabatike;
T3 dhe T4 janë temperaturat e fillimit dhe mbarimit të zgjerimit adiabatik në ekspander.
Ngrohje me avull
Një studim i funksionimit të një impianti turbinash me avull tregon se një rritje në presionin fillestar dhe një rënie në presionin përfundimtar çon në një rritje efikasiteti i ciklit. Megjithatë, një rritje në presionin fillestar rrit përmbajtjen përfundimtare të lagështisë së avullit. Për të reduktuar lagështinë e avullit në fund të zgjerimit rritet temperatura e fillimit e tij. Një nga mënyrat për të rritur shkallën e tharjes së avullit në daljen e turbinës është mbinxehja dytësore e saj. Avulli i mbinxehur nga kaldaja me presion dhe temperaturë fillestare hyn në cilindrin e parë të turbinës, i përbërë nga disa faza, ku zgjerohet në mënyrë adiabatike në një presion të caktuar. p1. Avulli që rezulton hiqet në një mbinxehës të veçantë, ku i nënshtrohet mbinxehjes dytësore me presion të vazhdueshëm. Më pas kthehet sërish në turbinë, ku avulli vazhdon të zgjerohet deri në presionin e kondensatorit.
Pika 1 korrespondon me gjendjen fillestare të avullit; pika 2 - gjendja përfundimtare e avullit pas turbinës pas mbinxehjes dytësore. Shkalla përfundimtare e thatësisë si rezultat i futjes së rinxehjes rritet nga x2 përpara x 1. Përveç kësaj, mbinxehja dytësore e avullit jep një efekt ekonomik (2-3%) nëse temperatura mesatare e furnizimit me nxehtësi në ciklin shtesë 7-2-2 '-6-7 është më e lartë se temperatura mesatare e furnizimit me nxehtësi në ciklin me mbinxehje e vetme, dhe efekti do të jetë më i lartë, sa më e lartë të jetë temperatura në pikat fillestare dhe fundore të mbinxehjes së ndërmjetme. Në presione afër kritikës dhe superkritike, ndonjëherë përdoren dy ose më shumë mbinxehje të ndërmjetme. Pastaj efikasiteti termik i ciklit
Ku është rënia e nxehtësisë adiabatike në cilindrat e turbinës së parë dhe të dytë;
- sasia e nxehtësisë së furnizuar në bojler dhe superngrohësin e parë;
Sasia e nxehtësisë që i jepet mbingrohësit të dytë.
Konsumi specifik i avullit
Entalpia
Entalpia e një trupi termodinamik është shuma e energjisë së brendshme u dhe produktit pv.
Duke e diferencuar këtë lidhje, marrim: di = du + pdv + vdp,
ose du + pdv = di - vdp .
Bazuar në ligjin e parë të termodinamikës, dq = du + pdv, relacioni i fundit do të rishkruhet si:
dq = di - vdp , ose dq = dh + dl t ,
ku dl t është diferenciali i punës teknike (dl t = - vdp).
Ekuacioni që rezulton është gjithashtu formulimi i dytë i ligjit të parë të termodinamikës, duke përdorur konceptet e entalpisë dhe punës teknike.
Vlera e i mund të konsiderohet gjithashtu si një parametër i gjendjes së një trupi termodinamik, së bashku me p, v, T dhe të prezantuara më parë. kuptimi fizik mund të shpjegohet në bazë të ekuacionit dq = di - vdp, i cili për procesin p =const do të shkruhet si:
dq p = di . (86)
Nga kjo rrjedh se di është sasia elementare e nxehtësisë që i jepet trupit termodinamik në procesin e presionit konstant.
KAPITULLI 3. Potencialet termodinamike
§ 3.2. Entalpia
Puna në termodinamikë. Rregulli termodinamik i shenjave. Trupa të izoluar termikisht. Funksionet e statusit.
Potencialet termodinamike.
Proceset izokorike dhe izobarike. Përmbajtja e nxehtësisë, ose entalpia.
Përdorimi i entropisë maksimale si kriter për ekuilibrin e sistemeve të mbyllura u propozua për herë të parë nga J. Gibbs në punimet e tij termodinamike të viteve 1875-1878. Për më tepër, përveç prezantimit të një shqyrtimi të rreptë logjik të gjendjes së ekuilibrit termodinamik, ai gjithashtu propozoi metodat e llogaritjeve praktike matematikore, duke përgjithësuar metodën e njohur nga mekanika potencialet . Te studiosh ne po ecim përpara.
Forcat e jashtme të aplikuara në trup mund të prodhojnë mbi të puna , i cili përcaktohet sipas rregullave të përgjithshme të mekanikës si prodhim skalar i vektorit të forcës dhe zhvendosjes. Në termodinamikë, ne do të jemi të interesuar në rastin kur e gjithë puna shkon vetëm për të ndryshuar vëllimin e saj, dhe, rrjedhimisht, vetëm për të ndryshuar energjinë e saj të brendshme (shih formulën (2.5.8)). Puna e shpenzuar për ndryshimin e energjisë totale të trupit - energjia e tij kinetike ose potenciale në tërësi - në termodinamikë, siç u përmend më lart, nuk merret parasysh.
Në termodinamikë pranohet rregulli i shenjës , sipas të cilit puna e kryer konsiderohet pozitive forcat e jashtme mbi trup - d.m.th., kur rritet energjia e brendshme e trupit. Nëse trupi punon në mjedis për shkak të energjisë së tij të brendshme, atëherë kjo punë konsiderohet negative. Në mënyrë të ngjashme, nxehtësia e marrë nga trupi nga jashtë konsiderohet pozitive, dhe nxehtësia e dhënë është negative.
Presioni është forca që vepron për njësi sipërfaqe të një sipërfaqeje. Pastaj për një sasi të vogël pune δR , kryhet duke lëvizur elementin sipërfaqësor dσ për një distancë të shkurtër dr mund të shkruhet:
Gjatë ngjeshjes së trupit dV < 0, так что δR > 0.
Nëse trupi izoluar termikisht , atëherë i gjithë ndryshimi i energjisë shoqërohet me energjinë e prodhuar në të punë mekanike. Në rastin e përgjithshëm, përveç punës, trupi merr (ose jep) energji ose nga transferimi i drejtpërdrejtë i saj nga trupat kontaktues, ose nga shkëmbimi i rrezatimit nga trupat që nuk janë drejtpërdrejt në kontakt me trupin tonë. Kjo pjesë e ndryshimit të energjisë së brendshme quhet sasia e nxehtësisë δQ . Kështu, ndryshimi në energjinë e trupit mund të shkruhet si:
Më sipër, relacioni (2.5.8) është marrë për diferencialin total të energjisë së brendshme:
Me fjalë të tjera, ekuivalenca e përkufizimit empirik, fenomenologjik të entropisë si nxehtësia e reduktuar dhe interpretimi i tij mekanik kuantik, probabilistik.
Punime elementare δR dhe sasia e nxehtësisë δQ të marra nga trupi me një ndryshim pafundësisht të vogël në gjendjen e tij, në përgjithësi nuk jane diferenciale të plota . Vetëm shuma δR + δQ , d.m.th. ndryshimi i energjisë së brendshme dU , gjithmonë ka një diferencim të plotë. Me fjalë të tjera, energjia e një trupi nuk mund të ndahet rreptësisht në mekanike dhe termike. Nevoja për një ndarje të tillë lind vetëm kur përcaktohen mënyrat për të ndryshuar sasinë e disponueshme të energjisë. Raport sasitë që rezultojnë të nxehtësisë dhe punës e pa përcaktuar vetëm fillore dhe përfundimtar gjendjen e trupit dhe varet tërësisht nga rruga. tranzicioni, d.m.th. natyra e procesit. Kjo veti shihet më qartë në procese (cikle) të mbyllura që fillojnë dhe përfundojnë në të njëjtën gjendje. Këtu, ndryshimi në energjinë e brendshme është zero, dhe trupi mund të marrë ose të lëshojë nxehtësi ose punë.
Funksionet ndryshimi i të cilëve në një cikël të mbyllur është zero (d.m.th., diferenciali i tij është i plotë ), quhen funksionet shtetërore ose potencialet . Në mekanikë, nga e cila është huazuar ky koncept, i vetmi potencial është funksioni Hamilton - shuma e energjive kinetike dhe potenciale. Meqenëse ka shumë më tepër variabla termodinamikë sesa ato mekanikë - ka më shumë shkallë lirie në termodinamikë - atëherë mund të ketë disa potenciale. Natyrisht, në termodinamikë ato quhen potencialet termodinamike . Bazuar në formën e diferencialit total për energjinë e brendshme, mund të shihet se U është potenciali termodinamik në lidhje me variablat S dhe V .
Për të thjeshtuar llogaritjet për një kohë, ne largohemi nga fakti se trupat realë përbëhen nga grimca të llojeve të ndryshme. Atëherë variablat termodinamikë nga të cilët varet energjia e brendshme do të jenë vetëm katër . Ky është vëllimi V , presion P , temperatura T dhe entropisë S . Çdo çift prej tyre do të jetë i pavarur prej tyre (vini re se nëse marrim parasysh përbërjen, atëherë do të ketë tre ndryshore të pavarura). Prandaj, duke ditur njëfarë potenciali termodinamik në vlerat e dy ndryshoreve përkatëse dhe duke përdorur vetitë e potencialeve, është e mundur të llogariten (nëpërmjet derivateve të pjesshme) vlerat e dy variablave të tjerë dhe të gjitha potencialet e tjera. Ky fakt përcakton metodologjinë për gjetjen dhe përdorimin e potencialeve termodinamike në praktikë, në llogaritjet e aplikuara.
Për shembull, le të gjejmë një funksion të gjendjes që është matematikisht potencial (prandaj emri potencial ) në lidhje me variablat S dhe P . Më sipër u konstatua se sasia e nxehtësisë së marrë nga trupi varet nga kushtet e procesit. Në praktikë, proceset me vëllim konstant ( izokorik , të kryera në një vëllim të mbyllur), ose procese me presion të vazhdueshëm ( izobarike kryhet, le të themi, në instalimet që komunikojnë me atmosferën). Nëse procesi është izokorik, atëherë trupi jo mekanike punë ( dV =0 ), dhe nga lidhja është e qartë se e gjithë nxehtësia e marrë shkon për të ndryshuar energjinë: δQ = dU . VdP
Nga kjo rrjedh menjëherë se për një proces të kryer me presion të vazhdueshëm R dhe entropisë S , sasia e nxehtësisë së marrë dH ka një diferencial të plotë . Prandaj, vetë funksioni H - entalpi - është potenciali i dëshiruar termodinamik në lidhje me variablat R dhe S .
Është e pamundur të gjesh vlerat absolute të entalpive dhe energjive të brendshme me metoda termodinamike, por vetëm ndryshimet e tyre mund të përcaktohen. Në të njëjtën kohë, në llogaritjet termodinamike të sistemeve që reagojnë kimikisht, është i përshtatshëm të përdoret një kornizë e vetme referimi. Në këtë rast, duke qenë se entalpia dhe energjia e brendshme lidhen nga relacioni , mjafton të prezantohet një kornizë referimi për vetëm një entalpi. Gjithashtu, për të krahasuar dhe sistemuar efektet termike të reaksioneve kimike, të cilat varen nga gjendja fizike e substancave reaguese dhe nga kushtet për shfaqjen e XP, është paraqitur koncepti i gjendjes standarde të materies. Me rekomandimin e komisionit për termodinamikën e Unionit Ndërkombëtar të Kimisë së Pastër dhe të Aplikuar (IUPAC) në 1975 gjendje standarde përcaktuar si më poshtë:
"Gjendja standarde për gazrat është gjendja e një gazi ideal hipotetik në një presion prej 1 atmosfere fizike (101325 Pa). Për lëngjet dhe të ngurta gjendja standarde është gjendja e një lëngu të pastër ose, përkatësisht, një substancë e pastër kristalore në një presion prej 1 atmosfere fizike. Për substancat në tretësirë, gjendja standarde merret si gjendja hipotetike në të cilën entalpia e një tretësire një molare (1 mol substancë në 1 kg tretës) do të ishte e barabartë me entalpinë e tretësirës në hollim të pafund. Vetitë e substancave në gjendje standarde shënohen me mbishkrimin 0. (Një substancë e pastër është një substancë e përbërë nga grimca strukturore identike (atome, molekula, etj.)).
Ky përkufizim i referohet gjendjeve hipotetike të një gazi dhe të një tretësie, pasi në kushte reale gjendjet e gazeve ndryshojnë në një masë më të madhe ose më të vogël nga idealja, dhe gjendjet e tretësirave ndryshojnë nga zgjidhja ideale. Prandaj, kur përdoren vetitë termodinamike të substancave në gjendje standarde për kushte reale, bëhen korrigjime për devijimin e këtyre vetive nga ato reale. Nëse këto devijime janë të vogla, atëherë korrigjimet mund të anashkalohen.
Në manuale, madhësitë termodinamike zakonisht jepen në kushte standarde: presion R 0 =101325Pa dhe temperatura T 0 =0K ose T 0 \u003d 298,15K (25 0 C). Kur krijohen tabela të entalpive totale të substancave, gjendja e tyre standarde në një temperaturë T 0 =0K ose T 0 = 298,15 mijë.
Substancat, cilat jane pastër elementet kimike në fazën më të qëndrueshme gjendje në R 0 \u003d 101325 Pa dhe temperatura e pikës së referencës së entalpive T 0, marrin vlerën entalpi e barabartë me zero: . (Për shembull, për substancat në gjendje e gaztë: O 2, N 2, H 2, Cl 2, F 2, etj., për C (grafit) dhe metale (kristale të ngurta)).
Për komponimet kimike (CO 2, H 2 O, etj.) dhe për substancat që, duke qenë elementë kimikë të pastër, jo në gjendjen më të qëndrueshme(O, N, etj.) entalpi në R 0 =101325Pa dhe T 0 jo e barabartë me zero: .






