Entropia termike. Entropia. Ligji i dytë i termodinamikës. Makina termike dhe ftohëse. Cikli Carnot dhe efikasiteti i tij
Proceset kryesore në termodinamikë janë:
· izokorik, që rrjedh me vëllim konstant;
· izobarike, që rrjedh në presion konstant;
· izotermike, që ndodh në temperaturë konstante;
· adiabatike, në të cilën shkëmbimi i nxehtësisë me mjedisi i zhdukur.
Procesi izokorik
Nëse një proces mekanik i kundërt, si lëvizja e një lavjerrës ose përplasja e topave të bilardos, filmohet dhe më pas riprodhohet, imazhi do të duket mjaft i besueshëm. Në të njëjtën kohë, proceset e pakthyeshme që shoqërojnë rritjen e entropisë thonë se djegia e një xixëllonjeje, ndryshkja e një gozhde, duket e pamundur me një pamje të tillë. Kështu, entropia bën të mundur dallimin e së kaluarës nga e ardhmja.
Një pajisje që tregon sasinë e entropisë nuk ekziston. Në të njëjtën kohë, entropia ose ndryshimi i saj mund të llogaritet. Këtu kemi këtë reaksion ku nëse kemi një mol metan dhe ai reagon me dy mol oksigjen, do të prodhojmë një mol dioksid karboni dhe dy mol ujë. Në këtë video duam t'i përgjigjemi pyetjes nëse ky reagim është spontan. Dhe në klipin e fundit mësuam se për t'iu përgjigjur kësaj pyetjeje, duhet t'i referohemi energjisë së lirë të Gibbs, ose më konkretisht, ndryshimit të energjisë së lirë të Gibbs.
Në një proces izokorik, gjendja V= konst.
Nga ekuacioni ideal i gjendjes së gazit ( fqV = RT) vijon:
fq/ T = R/V= konst,
dmth presioni i gazit është drejtpërdrejt proporcional me të temperaturë absolute:
p2 / p1 = T2/T 1 .
Ndryshimi i entropisë në një proces izokorik përcaktohet nga formula:
Dhe ndryshimi në energjinë e lirë është i barabartë me ndryshimin në entalpinë e reaksionit minus temperaturën në të cilën ndodh, dhe gjithçka shumëzohet me ndryshimin e entropisë. Dhe nëse është më pak se zero, atëherë ndodh një reagim spontan. Ne e bëmë këtë disa klipe më parë. Mund të shikoni vetëm temperaturën e shkaktuar nga secili prej këtyre produkteve. Uji do ta shumëzojë atë me 2 nëse ka 2 muaj. Pra, ne kemi nxehtësinë e gjeneruar nga këto produkte, e heqim të njëjtën nga reaktantët e tjerë. Dhe kjo sugjeron që kemi një reagim ekzotermik.
Që kjo anë e ekuacionit përmban më pak energji - mund të mendojmë disi për këtë - nga kjo anë. Pra, pak energji duhet të çlirohet. Më lejoni të shkruaj si dhe energjinë për t'u çliruar. Kjo është arsyeja pse është një reagim ekzotermik. Por pyetja jonë është: spontane? Për të zbuluar nëse kjo është spontane, duhet të gjejmë deltat tona. Dhe për të na ndihmuar të gjejmë deltat, me kalimin e kohës ne shikuam entropinë standarde molare për secilën prej këtyre molekulave. Standardi këtu është shtimi i karakterit zero - entropia standarde molare - dhe "standard" do të thotë 298 gradë Kelvin.
s 2 -s 1 = Δ s = c v n ( fq2/fq 1 ) = c v n ( T2/T 1 )
procesi izobarik
Një proces izobarik është ai që zhvillohet në presion të vazhdueshëm. fq= konst.
Nga ekuacioni i gjendjes për një gaz ideal rezulton:
V/T = R/p= konst.
Ndryshimi i entropisë do të jetë:
s 2 – s 1 = Δ s = cp n ( T 2 / T 1 ).
Në fakt, nuk kam nevojë të flas për gradët Kelvin. Kjo është 298 Kelvin, nuk keni nevojë të përdorni fjalën "gradë" këtu kur flasim për Kelvin. Pra, kjo është 298 kelvins, që është 25 gradë Celsius, pra kjo është temperatura e dhomës. Prandaj, konsiderohet temperatura standarde. Pra, nëse kemi 1 mol metan, kemi 186 xhaul entropi Kelvin. Kështu, ndryshimi total në entropinë e këtij reaksioni është diferenca në total entropia standarde produktet dhe entropinë standarde totale të reaktantëve.
Procesi izotermik
Në procesi izotermik temperatura e lëngut të punës mbetet konstante T= konst, pra:
fqV = RT= konst
Ndryshimi i entropisë është:
s 2 -s 1 = Δ s = R n( fq1/fq 2 ) = R n( V2/V 1 ).
procesi adiabatik
Një proces adiabatik është një ndryshim në gjendjen e një gazi që ndodh pa shkëmbim nxehtësie me mjedisin ( P = 0).
Ne bëmë të njëjtën gjë me entalpinë. Dhe duke qenë se tashmë e kemi parë këtë, ky numër është afër këtij numri, por është shumë më tepër. Uji i pastër është shumë më i ulët - kjo është entropia e ujit të pastër. Ka një entropi shumë më të ulët se gazi i oksigjenit. Meqenëse lëngu është formuar, ka shumë pak gjendje. I gjithë lëngu bie në fund të enës, sikur po merr formë dhe po zgjerohet. Me fjalë të tjera, një gaz i vetëm do të ketë një entropi shumë më të lartë se një lëng. Vetëm duke parë këtë, ne tashmë mund të shohim se produktet tona do të kenë entropi më të ulët se reaktantët.
Ekuacioni i kurbës procesi adiabatik(adiabatikë) në p-V diagrami duket si:
fqV k= konst.
Në këtë shprehje k quhet eksponent adiabatik(i quajtur edhe raporti i Poisson-it).
Ndryshimi i entropisë është:
Δ S = S 2 – S 1 = 0, ato.S 2 = S 1 .
Dhe ndoshta do të jetë një numër negativ. Tani këto njësi mund të mos kenë kuptim për ju, dhe ju me të vërtetë e dini se ato janë njësi konvencionale. Por mund të themi, hej, po bëhet më e vështirë. Dhe ka njëfarë kuptimi, sepse ka një ton gaz. Kemi 3 molekula të veçanta, 1 këtu dhe 2 molekula oksigjeni. Dhe përsëri shkojmë te 3 molekula, por tani uji është i pastër. Dhe ka kuptim, për mendimin tim, në humbjen e entropisë. Ekzistojnë disa kushte në të cilat lëngu, para së gjithash, mund të jetë.
Por le të zbulojmë nëse ky reagim është spontan. Nuk duhet të jemi kaq të saktë. Supozojmë se jemi në temperaturën e dhomës, ose 298 gradë Kelvin. Që është 25 gradë Celsius herë ndryshimi i entropisë. Kjo do të jetë një minus. Tani mund të themi, mirë, minus 242, mund të dëshirojmë ta vendosim atje. Por duhet të jemi shumë, shumë, shumë të kujdesshëm. Dhe nëse duam të shkruajmë gjithçka në kilojoules pasi ta kemi shkruar tashmë, le ta shkruajmë në kilojoules.
Tranzicionet fazore
Në një tranzicion fazor të kthyeshëm, temperatura mbetet konstante, dhe nxehtësia tranzicioni fazor Në presion konstant është H fp, pra ndryshimi i entropisë është:
 .
.
Gjatë shkrirjes dhe zierjes, nxehtësia thithet, kështu që entropia në këto procese rritet: S tv< S dhe< S d) Në këtë rast, entropia e mjedisit zvogëlohet me vlerë S f.p. , pra ndryshimi në entropinë e Universit është 0, siç pritej për një proces të kthyeshëm në një sistem të izoluar.
Kështu, energjia jonë e lirë e Gibbs këtu do të jetë minus 890 kiloxhaul minus 290, nga të cilat minus këtu dhe një tjetër minus plus plus. Dhe ka kuptim - entropia do ta bëjë energjinë Gibbs më pozitive. Të cilën, siç e dimë, kur duam ta marrim nën 0 këtu, do të luftojë me spontanitet. Por le të shohim nëse entalpia aktuale, natyra e saj ekzotermike, mund të tejkalohet. Duket e mundur sepse shumëzojmë thyesën me këtë dhe marrim më pak. Kjo është koha jonë e ndryshimit të entropisë 298, temperatura minus.
Dhe ky koncept bëhet - vendos një minus - dhe bëhet plus 72. Është entropi në temperaturë standarde. Tashmë mund të shohim se entalpia është një numër shumë më negativ sesa termi pozitiv i temperaturës shumëfishimi i ndryshimit në entropi. Pra, këtë herë fituesi. Dhe megjithëse ne humbim entropinë në këtë reagim, ai lëshon aq shumë energji sa do të jetë spontane. Që është padyshim më pak se 0, kështu që do të ketë një reagim spontan. Siç mund ta shohim, këto probleme të energjisë së lirë të Gibbs nuk janë aq të vështira.
Ligji i dytë i termodinamikës dhe "vdekja nga nxehtësia e universit"
Clausius, duke marrë parasysh ligjin e dytë të termodinamikës, arriti në përfundimin se entropia e Universit si një sistem i mbyllur tenton në maksimum dhe përfundimisht të gjitha proceset makroskopike në Univers do të përfundojnë. Kjo gjendje e Universit quhet "vdekje termike" - kaos global, në të cilin asnjë proces nuk është i mundur. Nga ana tjetër, Boltzmann shprehu mendimin se gjendja aktuale e Universit është një luhatje gjigante, që nënkupton se shumicën e kohës Universi është ende në një gjendje ekuilibri termodinamik (“vdekja termike”).
Ju vetëm duhet të gjeni ato dimensione. Thjesht shikojmë temperaturat e formimit të të gjitha produkteve, nxjerrim reagentët dhe sigurisht presim shanset. Dhe pastaj, për të gjetur ndryshimin në entropi, ne bëjmë të njëjtën gjë. Ne duhet të shikojmë entropinë standarde të masës molare të produkteve sipas koeficientëve, të heqim reaktantët dhe më pas thjesht ta zëvendësojmë këtu, pas së cilës në thelb morëm energji e lirë Gibbs. Dhe në këtë rast ishte negative. Tani mund të imagjinojmë një situatë ku jemi shumë më tepër temperaturë të lartë.
Sipas Landau, çelësi për zgjidhjen e kësaj kontradikte qëndron në fushën e relativitetit të përgjithshëm: meqenëse Universi është një sistem në një fushë gravitacionale të ndryshueshme, ligji i rritjes së entropisë nuk është i zbatueshëm për të.
Meqenëse ligji i dytë i termodinamikës (në formulimin e Clausius) bazohet në supozimin se universi është një sistem i mbyllur, lloje të tjera kritikash ndaj këtij ligji janë të mundshme. Në përputhje me konceptet moderne fizike, ne mund të flasim vetëm për pjesën e vëzhgueshme të Universit. Në këtë fazë, njerëzimi nuk ka mundësi të provojë se universi është sistem i mbyllur, as anasjelltas.
Pastaj papritur gjërat bëhen interesante. Kështu, ky term pozitiv do ta tejkalojë këtë dhe ndoshta jo një përgjigje spontane ndaj një temperature shumë, shumë, shumë, shumë të lartë. Dhe mendoni për këtë ndryshe. Reagimi që prodhon temperaturën që ndahet - nxehtësia e lëshuar - nuk është aq e madhe kur tashmë ka një sasi të madhe nxehtësie në mes ose energjia kinetike. Nëse temperatura do të ishte mjaft e lartë, ky reagim nuk do të ishte spontan, pasi probabiliteti i entropisë do të tejkalohej.
Mund të shikoni gjithçka në internet dhe të mësoni diçka spontanisht. Me një ndryshim të njëkohshëm në dy ose tre nga këto vlera, procesi i gazit. Një gaz ideal është një model i një gazi fizik në të cilin janë bërë përafrimet e mëposhtme. Gazrat realë nuk ndryshojnë në vetitë nga një gaz ideal në temperaturën e dhomës dhe normale presioni atmosferik. Dallimet janë të rëndësishme në temperatura dhe presione shumë të ulëta qindra herë më të larta se presionet atmosferike.
Matja e entropisë
Në eksperimentet reale është shumë e vështirë të matet entropia e një sistemi. Teknikat e matjes bazohen në përcaktimin termodinamik të entropisë dhe kërkojnë kalorimetri jashtëzakonisht të saktë.
Për thjeshtësi, ne do të shqyrtojmë sistemi mekanik, gjendjet termodinamike të së cilës do të përcaktohen nëpërmjet vëllimit të tij V dhe presioni P. Për të matur entropinë e një gjendjeje të caktuar, së pari duhet të matim kapacitetin e nxehtësisë në vëllim konstant dhe presioni (shënuar C V dhe C P përkatësisht) për një grup të suksesshëm të gjendjeve ndërmjet gjendjes fillestare dhe asaj të dëshiruar.
Në këto kushte mund të kryhen tre izomerë, izotermikë dhe izobarikë. Ligjet e izolimit zbatohen për gazrat realë që plotësojnë kërkesat e një modeli ideal gazi. Ligji u prezantua për herë të parë nga britaniku Robert Boyle dhe francezi Edme Marriot. Në një proces izotermik, produkti i presionit dhe vëllimit të një sasie të caktuar gazi është vlerë konstante. Grafiku i procesit në diagramin p është një kurbë e quajtur izotermi.
Ligji u miratua nga francezi Zhak Charles. Gjatë procesit të izolimit, raporti i presionit ndaj temperaturës mbetet konstant. Grafiku i procesit në diagramin p është një vijë e drejtë e quajtur izokore. Animacioni tregon një cikël që përfshin dy procese me presion konstant dhe dy procese të vazhdueshme të vëllimit. Anët horizontale të drejtkëndëshit janë vija të drejta - imazhe dhe anët vertikale - vija të drejta - isochori. Sjellja e gazeve në një proces isokratik shpjegon lehtësisht ndalimin e lënies së shisheve dhe cilindrave të gazit në rrezet e diellit direkte.
Kapacitetet termike lidhen me entropinë S dhe me temperaturë T sipas formulës:

ku është nënshkrimi X i referohet vëllimit dhe presionit konstant. Mund të integrohemi për të marrë ndryshimin e entropisë:
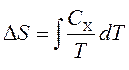
Ligji është nxjerrë nga francezi Joseph Gauss-Lusak. Në procesin e modifikuar, raporti i vëllimit ndaj temperaturës mbetet konstant. Grafiku i procesit në diagramin p është një vijë e drejtë, e cila quhet imazh. Ligjet e Boyle-Marriott, Charles dhe Gay-Lusak janë vetëm gaz ideal. Modeli ideal i gazit nuk merr parasysh vëllimin dhe ndërveprimin e molekulave.
Në temperatura shumë të ulëta, gazrat aktualë lëngëzohen dhe ligjet ideale të gazit nuk vlejnë më për to. Si masë e shpërndarjes së pakthyeshme të energjisë, Clausius prezantoi termin entropi. Entropia është një funksion i gjendjes së sistemit, domethënë, në çdo gjendje mund të krahasohet një vlerë entropie plotësisht e përcaktuar.
Kështu, ne mund të marrim vlerën e entropisë së çdo gjendje ( P,V) në lidhje me gjendjen fillestare ( P 0 ,V 0). Formula e saktë varet nga zgjedhja jonë e gjendjeve të ndërmjetme. Për shembull, nëse gjendja fillestare ka të njëjtin presion si gjendja përfundimtare, atëherë
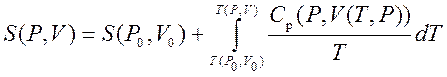 .
.
Për shembull, për proceset e kthyeshme, ndryshimi i tij shprehet si më poshtë. ndryshimi i entropisë në procese të ndryshme në sisteme. Entropia është një masë e probabilitetit ose çrregullimit në sistemi fizik. Ai shpreh numrin e konfigurimeve ose rregullimeve të mundshme të elementeve përbërës të një sistemi në të cilin ai formë e përgjithshme, forma dhe karakteristikat fizike, nuk ndryshon.
Kuptimi fizik i rritjes së entropisë është se sistemi me një grimcë të izoluar duhet të kalojë në gjendjen e rendit më të vogël të lëvizjes së grimcave. Kjo është gjendja më e thjeshtë e sistemit ose ekuilibrit termodinamik, në të cilin lëvizja e grimcave është kaotike. Drejtimi i pakthyeshëm i proceseve të konvertimit të energjisë në sistemet e izoluara herët a vonë çon në shndërrimin e të gjitha llojeve të energjisë në nxehtësi. Ai do të shpërndahet dhe shpërndahet në mënyrë të barabartë në të gjithë elementët e sistemit. Entropia maksimale do të thotë ekuilibër i plotë termodinamik, asnjë zhvendosje e atomeve dhe molekulave nuk ndalet, ndërprerje e shkëmbimit të energjisë midis dy pjesëve të sistemit dhe mjedisit - ka kaos statistikor ose termodinamik.
Përveç kësaj, nëse rruga ndërmjet gjendjes së parë dhe të fundit është përmes ndonjë tranzicioni fazor të rendit të parë, nxehtësi latente që lidhen me tranzicionin gjithashtu duhet të merren parasysh.
Entropia e gjendjes fillestare duhet të përcaktohet në mënyrë të pavarur. Në mënyrë ideale, gjendja fillestare zgjidhet si gjendja në një temperaturë jashtëzakonisht të lartë, në të cilën sistemi ekziston në formën e një gazi. Entropia në këtë gjendje është e ngjashme me atë të një gazi ideal klasik, plus kontributet nga rrotullimet dhe dridhjet molekulare, të cilat mund të përcaktohen në mënyrë spektroskopike.
Nëse universi është i mbyllur, ai pret një vdekje të nxehtë. Grekët e lashtë pretendojnë se e ka origjinën nga kaosi dhe nën supozimin e termodinamikës klasike, do të kthehet atje. Nëse universi do të kishte evoluar vetëm në kaos, si mund të kishte ardhur në ekzistencë dhe të arrinte gjendjen e tij aktuale të strukturuar?
Termodinamika klasike, e formuar në një epokë kur askush nuk e bëri pyetjen për natyrën e palëvizshme të universit. Në atë kohë, e vetmja hije mbi ligjet e termodinamikës u hodh nga teoria e evolucionit e Darvinit. Sipas saj, procesi i zhvillimit të florës dhe faunës karakterizohet nga ndërlikime të vazhdueshme, me rritjen e organizimit dhe rendit. Natyra e gjallë i reziston ekuilibrit termodinamik dhe kaosit. Natyrisht, ligjet e zhvillimit të natyrës së pajetë dhe të gjallë kundërshtojnë njëra-tjetrën.
Teoria punë laboratorike
Informacion teorik
Në këtë punë, është e nevojshme të matet temperatura e tranzicionit të fazës - pika e shkrirjes së kallajit, e cila do të na lejojë të përcaktojmë rritjen e entropisë.
Meqenëse për proceset e kthyeshme rritja e entropisë d S=d P/T, dhe ndryshimi i entropisë gjatë kalimit të sistemit nga gjendja a në një gjendje b
 ,
,
atëherë ndryshimi i entropisë gjatë ngrohjes dhe shkrirjes së kallajit përcaktohet si shuma e ndryshimit të entropisë gjatë ngrohjes deri në pikën e shkrirjes dhe gjatë shkrirjes së kallajit:
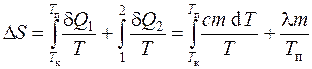 ose
ose
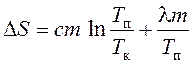 , (10)
, (10)
ku d Pështë një sasi infinite e vogël e nxehtësisë e transferuar në sistem në një temperaturë T;
d P 1 dhe d P 2 - sasi pafundësisht të vogla nxehtësie të marra nga kallaji gjatë ngrohjes dhe gjatë shkrirjes;
T k është temperatura fillestare (dhomë);
T n është temperatura e shkrirjes;
l \u003d 59 10 -3 J / kg - ngrohje specifike shkrirja;
c = 0,23 10 -3 J/(kg K) – ngrohje specifike,
m = 0,20 kg është masa e kallajit.
Disa formulime të ligjit të dytë të termodinamikës
1. Çdo sistem, i lënë në vetvete, ndryshon mesatarisht në drejtim të gjendjes me probabilitetin maksimal (G. Lewis).
2. Gjendja me entropi maksimale është gjendja më e qëndrueshme për sistem i izoluar(E. Fermi).
3. Gjatë çdo procesi real, është e pamundur të sigurohen mjete për kthimin e secilit prej sistemeve pjesëmarrëse në të në gjendjen e tij origjinale (H. Lewis).
4. Çdo individ ose procesi kimik në natyrë ecën në atë mënyrë që të rritet shuma e entropisë së të gjithë trupave që marrin pjesë në këtë proces (M. Planck).
5. Transferimi spontan i nxehtësisë nga një trup më i ftohtë në një trup më të nxehtë është i pamundur.
6. Marrja e informacionit është një ulje e entropisë (G. Lewis).
7. Entropia është shigjeta e kohës* (A. Eddington).
Ndryshimet e entropisë në reaksionet kimike
Entropia e një moli të një lënde në të gjendje standarde në temperaturën e duhur quhet entropi molare standarde. Entropia standarde molare shënohet me simbolin S "dhe ka dimensionin JK-1 mol-1. Tabela 5.12 tregon entropitë standarde molare të një numri elementësh dhe përbërjesh në një temperaturë prej 25 ° C. Vini re se entropia standarde molare i gazeve, si rregull, ka vlera shumë më të mëdha në krahasim me entropinë të ngurta. Entropia e çdo sasie fikse të lëndës rritet në sekuencën vijuese:
Ngurtë = Lëng = Gaz
Entropitë standarde molare nganjëherë quhen entropi absolute. Ato nuk janë ndryshime entropike që shoqërojnë formimin e një komponimi nga elementët e tij të lirë. Duhet të theksohet gjithashtu se entropitë molare standarde të elementeve të lirë (në formë substanca të thjeshta) nuk janë të barabarta me zero.
Ligji i tretë i termodinamikës thotë se entropia e një kristali jonik ideal në një temperaturë prej zero absolute (O K) është zero.
Tabela 5.12. Entropitë standarde molare S°(298 K) (J/(K mol))
Ndryshimi në entropinë standarde molare në reaksion kimik përcaktohet nga ekuacioni
Duhet të theksohet se ndryshimi i entropisë në shembullin e konsideruar rezulton negativ. Kjo mund të pritej nëse marrim parasysh se, sipas ekuacionit të reaksionit në shqyrtim, sasia totale e reaktantëve të gaztë është 1,5 mol, dhe sasia totale e produkteve të gazta është vetëm 1 mol. Kështu, si rezultat i reaksionit, ndodh një rënie në sasinë totale të gazeve. Në të njëjtën kohë, ne e dimë se reaksionet e djegies janë reaksione ekzotermike. Rrjedhimisht, rezultati i rrjedhjes së tyre është shpërndarja e energjisë, dhe kjo na bën të presim një rritje të entropisë dhe jo ulje të saj. Më tej, duhet pasur parasysh se djegia e gazit të hidrogjenit në 25°C, e shkaktuar nga fillimi fillestar, vijon më pas në mënyrë spontane dhe me intensitet të madh. Por a nuk duhet të jetë pozitiv ndryshimi i entropisë në këtë reaksion në këtë rast, siç kërkohet nga ligji i dytë i termodinamikës? Rezulton - jo, ose të paktën jo domosdoshmërisht. Ligji i dytë i termodinamikës kërkon që si rezultat i një procesi spontan të rritet entropia totale e sistemit dhe mjedisit të tij. Ndryshimi i entropisë i llogaritur më sipër karakterizon vetëm sistemin kimik të konsideruar, i cili përbëhet nga reaktantë dhe produkte që marrin pjesë në djegien e gazit hidrogjen në 25°C. Por si të llogaritet ndryshimi i entropisë për mjedisin e këtij sistemi?






