pikë e trefishtë
Pika korrespondon me presion i ulët, në të cilën është ende i mundur shndërrimi i një lënde nga një gjendje e ngurtë në një gjendje të lëngshme dhe anasjelltas, d.m.th., një gjendje ekuilibri midis fazave të ngurta dhe të lëngshme; në presione më të ulëta, gjendja e lëngshme nuk ekziston. Në të njëjtin vizatim, paraqitet kurba e varësisë nga presioni avull i ngopur mbi temperaturën, e cila u përmend në § 13 pjesa II (shih Fig. 11.25) dhe në § 17 (shih formulën (3.32)). Në të majtë të kësaj lakore, substanca është në temperatura që janë më të vogla se pika e vlimit, d.m.th. gjendje e lëngshme; pikat në të djathtë të kësaj lakore korrespondojnë me më shumë temperaturat e larta dhe, rrjedhimisht, shtetet avulli i pangopur. Përgjatë vetë kurbës, avulli i lëngshëm dhe i ngopur ekzistojnë njëkohësisht, d.m.th., secila pikë e kësaj lakore korrespondon me një gjendje ekuilibri midis një lëngu të vluar dhe të tij. avull i ngopur. Pika në këtë kurbë korrespondon me temperaturën më të ulët dhe presionin më të ulët në të cilin një lëng mund të ekzistojë ende në ekuilibër me avujt e tij të ngopur. Pika quhet pika e trefishtë e substancës së dhënë. Në këtë pikë, të tre fazat ose gjendjet agregate të një substance ekzistojnë njëkohësisht në ekuilibër me njëra-tjetrën: të ngurta, të lëngëta dhe të gazta (avulli i ngopur). Për çdo substancë, ka
vlerat e presionit të pikës së trefishtë dhe të temperaturës. Në presione më të ulëta, vetëm të ngurta dhe gjendje e gaztë. Kurba tregon lidhjen midis presionit dhe temperaturës së avullit të ngopur në ekuilibër me fazën e ngurtë.
Avullimi i drejtpërdrejtë i trupave të ngurtë (i quajtur "sublimim" ose sublimim) ndodh në temperatura më të ulëta se temperatura e pikës së trefishtë.
Për shumë substanca (metale, etj.) temperatura normale (15°C) është shumë më e ulët se temperatura e pikave të tyre të trefishta. Sipas lakores, këto substanca në temperaturë normale kanë një presion shumë të vogël avujt e ngopur. Natyrisht se më shumë presion avujt e ngopur mbi sipërfaqen e një trupi të ngurtë, aq më intensivisht mund të vazhdojë procesi i avullimit të këtyre trupave. Për shembull, jodi avullon lehtësisht, i cili në pikën e tij të trefishtë (114 ° C) ka një presion të ngopur avulli prej 90 mm Hg. Art. Tharja e rrobave të lagura në acar shpjegohet me faktin se uji në të fillimisht ngrin, dhe akulli që rezulton më pas avullohet, pasi në acar temperatura e akullit është më e ulët se temperatura e pikës së trefishtë të ujit dhe presioni i ujit të ngopur. avulli arrin disa milimetra merkur (në -10 ° Ky presion është i barabartë me
vini re, se ngrohje specifike sublimimi, d.m.th., nxehtësia e nevojshme për shndërrimin e një substance nga një gjendje e ngurtë drejtpërdrejt në një gjendje të gaztë, rezulton të jetë e barabartë me shumën nxehtësitë specifike të shkrirjes dhe avullimit.
Temperatura e pikës së trefishtë të ujit përdoret si temperaturë referencë e shkallës termodinamike Kelvin. Le të supozojmë se një lëng pune ideal, duke kryer një cikël ideal Carnot, merr nxehtësi në një temperaturë dhe lëshon nxehtësi në një temperaturë. Duke matur, sipas §, është e mundur të gjendet raporti i temperaturës. Për të ndërtuar një shkalla e temperaturës, është e nevojshme të jepen vlera të caktuara ("referenca"). Si temperatura referente të tilla, mund të merren temperaturat e ujit të vluar dhe të shkrirjes së akullit në kushte normale, duke marrë diferencën e tyre si 100 ° C. Më pas, nga raporti i matur dhe diferenca e zgjedhur, mund të përcaktohet e gjithë shkalla e temperaturës. Natyrisht, pikat besnike duhet të riprodhohen me saktësi shumë të lartë, pasi ato përcaktojnë madhësinë e shkallës. Prandaj, V. Thomson (Kelvin) dhe, pavarësisht nga ai, D. I. Mendeleev propozuan të krijonin një shkallë me një temperaturë referimi, e cila u zgjodh si një pikë e trefishtë e ujit me shumë saktësi (me një gabim që nuk kalon një shkallë). AT sistemit ndërkombëtar njësive sasive fizike jepet përkufizimi i mëposhtëm i një shkalle: kelvini është një njësi e temperaturës në shkallën e temperaturës termodinamike, në të cilën temperatura e pikës së trefishtë të ujit është vendosur në 273.16 ° (saktësisht).
Le të supozojmë se numri i fazave të një substance kimikisht homogjene që janë në ekuilibër me njëra-tjetrën është tre. Një shembull është një sistem i përbërë nga një fazë e ngurtë, një lëng dhe avulli i tij. Për ekuilibër, duhet të plotësohen tre kushte:
j 1 (P,T) =j 2 (P,T),
j 2 (P,T) =j 3 (P,T), (2)
j 3 (P,T) =j 1 (P,T).
E para është gjendja e ekuilibrit midis lëngut dhe avullit të tij; e dyta - midis fazës së lëngshme dhe të ngurtë; e treta është midis fazës së ngurtë dhe avullit. Këto tre kushte nuk janë të pavarura. Secila prej tyre është pasojë e dy të tjerave. Ekuacioni i parë i sistemit (2) përshkruan në aeroplani T-R kurba e ekuilibrit ndërmjet gazit dhe lëngut, d.m.th. kurba e avullimit 1-2 në fig. 2. E dyta përshkruan lakoren e ekuilibrit të fazave të ngurta dhe të lëngëta 2-3. Quhet kurba e shkrirjes. Kurba e shkrirjes kryqëzohet me kurbën e avullimit në pikën A, e quajtur pika e trefishtë. Lakorja e sublimimit 3-1 duhet të kalojë edhe në pikën e trefishtë, d.m.th. kurba e ekuilibrit ndërmjet fazave të ngurta dhe të gazta. Kjo rrjedh drejtpërdrejt nga ekuacioni i tretë i sistemit (2).
Kështu, të tri fazat mund të jenë në ekuilibër me njëra-tjetrën në një pikë, përkatësisht pikën e trefishtë, d.m.th. në temperatura dhe presione të përcaktuara mirë.
Fig.2 Diagrami i gjendjes së tri fazave të materies
Për ujin, pika e trefishtë qëndron afërsisht 0,008 0 C mbi pikën e shkrirjes në normale presioni atmosferik. Presioni në pikën e trefishtë është rreth 4.58 mm. rt. Art. Pika e trefishtë e ujit është pika kryesore e referencës në ndërtimin e shkallës absolute termodinamike të temperaturës Kelvin, si dhe praktike. shkallë ndërkombëtare Temperaturat Celsius.
Kurbat e avullimit, shkrirjes dhe sublimimit e ndajnë rrafshin T-P në tre rajone (Fig. 2). Pikat e zonës 1 korrespondojnë me të gaztë, zona 2 - e lëngshme, zona 3 - gjendje e ngurtë substancave. Plani T-P me tre kthesat e ekuilibrit të treguar quhet diagrami i gjendjes.
Diagrami i gjendjes ju lejon të gjykoni se çfarë do të ndodhë transformimet fazore në një proces apo në një tjetër. Supozoni, për shembull, se ngrohja kryhet në presion konstant. Në diagramin e gjendjes, një proces i tillë përfaqësohet nga një vijë horizontale. Nëse kjo vijë e drejtë kalon mbi pikën e trefishtë, atëherë në pikën B (Fig. 2) ajo pret kurbën e shkrirjes dhe në pikën C e pret kurbën e avullimit. Pra, kur nxehet të ngurta fillimisht shkrihet dhe më pas lëngu avullon.
Në rastin e katër fazave, ekuilibri kërkon përmbushjen e gjashtë ekuacioneve të tipit (2), nga të cilat, megjithatë, vetëm tre janë të pavarura. Gjeometrikisht, problemi reduktohet në gjetjen e një pike të përbashkët të kryqëzimit të kurbave të ekuilibrit trefazor. Por të tre kthesat kryqëzohen, në përgjithësi, në tre, dhe jo në një pikë. Kryqëzimi në një pikë është një rast i jashtëzakonshëm, i cili praktikisht mund të injorohet. Fizikisht, kjo do të thotë se katër dhe më shumë Fazat e një substance kimikisht homogjene nuk mund të jenë në ekuilibër me njëra-tjetrën në asnjë presion dhe temperaturë. Numri maksimal i fazave në ekuilibër me njëra-tjetrën nuk mund të kalojë tre.
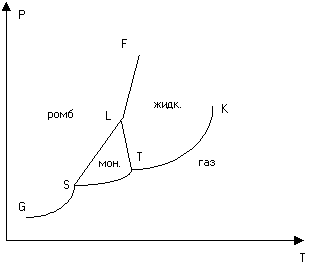
Oriz. 3. Diagrami i gjendjes së squfurit
Nëse numri i fazave në të cilat një substancë kimikisht homogjene mund të vendoset në të gjitha temperaturat dhe presionet e mundshme tejkalon tre, atëherë rrafshi T-P ndahet në një numër rajonesh (Fig. 3). Çdo pikë e rrafshit T-P, nëse nuk shtrihet në kufirin e rajonit, përshkruan një gjendje njëfazore të materies. Rajonet kufizohen me njëri-tjetrin përgjatë kthesave, secila prej të cilave është një kurbë ekuilibri e dy fazave përkatëse. Çdo pikë e shtrirë në lakoren e ekuilibrit përshkruan një gjendje dyfazore të materies, dhe në këtë gjendje fazat mund të përfaqësohen në çfarëdo përmasash. Lakoret e ekuilibrit fazor mund të kryqëzohen në treshe në pika të veçanta. Këto janë pika të trefishta në të cilat tre faza ngjitur janë në ekuilibër.
Si shembull, në fig. 3 është një diagram i thjeshtuar i gjendjes së squfurit. Squfuri mund të ekzistojë në dy modifikime kristalore - monoklinike dhe rombike. Në përputhje me këtë, në diagramin e gjendjes janë tre pika të trefishta S, T dhe L. Rajoni i modifikimit monoklinik është i kufizuar nga trekëndëshi STL. Rajoni i modifikimit rombik shtrihet mbi kurbën GSLF.
PYETJE TESTI
1. Përcaktoni fazën e materies dhe transformimin fazor.
2. Formuloni kushtet e ekuilibrit për disa faza.
3. Si ndërtohet diagrami i gjendjeve fazore të një lënde? Merrni parasysh diagramin fazor për procesin e avullimit-kondensimit dhe diagramin e gjendjes së tre fazave të materies.
4. Cili është numri maksimal i fazave që mund të jenë në ekuilibër me njëra-tjetrën?
Zgjidhni përgjigjen e saktë nga përgjigjet e dhëna për këtë pyetje.
1. Sa është në dispozicion gjendjet agregate substancave?
d) katër.
2. Cilat gjendje të lëndës janë të kondensuara?
a) të ngurtë dhe të gaztë,
b) të lëngshme dhe të gazta,
c) të ngurtë dhe të lëngët
d) të ngurtë, të lëngët dhe të gaztë.
3. Cila është njësia matëse e potencialit termodinamik në SI?
a) xhaul
- (për një element që është një lloj anije Dewar) [A.S. Goldberg. Fjalori anglisht rus i energjisë. 2006] Temat e energjisë në përgjithësi EN pika e trefishtë e ujitTPW… Manuali i Përkthyesit Teknik
pikë e trefishtë- ujë; presion p; t temperaturës. PIKA E TRESHTË, gjendje e bashkëjetesës së ekuilibrit të tre fazave të materies, zakonisht të ngurtë, të lëngët dhe të gaztë. Temperatura e pikës së trefishtë të ujit (pika e bashkëjetesës së akullit, ujit dhe avullit) 0.01 ° C (273.16 K) në ... ... Fjalor Enciklopedik i Ilustruar
Gjendja e bashkëjetesës së ekuilibrit. Pika e trefishtë e ujit është tre faza e materies, zakonisht e ngurtë, e lëngët dhe e gaztë. Temperatura e pikës së trefishtë të ujit (pikat e bashkëjetesës së akullit, ujit dhe avullit, Fig.) është 0.01 .C (273.16 K) në një presion prej 6.1 hPa ... ... Fjalori i madh enciklopedik
pikë e trefishtë- një pikë në diagramin e gjendjes termodinamike që korrespondon me ekuilibrin e tre fazave të sistemit termodinamik të konsideruar. Për shembull, pika e trefishtë e ujit korrespondon me ekuilibrin e një sistemi të përbërë nga akulli, uji dhe avujt e ujit. Temperatura……
PIKA E TREVE- një pikë në diagramin e gjendjes termodinamike që korrespondon me ekuilibrin e tre fazave të sistemit termodinamik të konsideruar. Për shembull, pika e trefishtë e ujit korrespondon me ekuilibrin e një sistemi të përbërë nga akulli, uji dhe avujt e ujit. Temperatura…… Fjalori metalurgjik
Gjendja e bashkëjetesës së ekuilibrit të tre fazave të materies, zakonisht të ngurtë, të lëngët dhe të gaztë. Temperatura e pikës së trefishtë të ujit (pika e bashkëjetesës së akullit, ujit dhe avullit, Fig.) është 0,01 ° C (273,16 K) në një presion prej 6,1 hPa (4,58 mmHg). * * *… fjalor enciklopedik
Llojet tipike të diagrameve fazore. Vija e gjelbër me pika tregon sjelljen anormale të ujit.Pika e trefishtë është pika në diagramin fazor ku konvergojnë tre linjat fazore ... Wikipedia
pikë e trefishtë- një pikë në diagramin e gjendjes që korrespondon me bashkëjetesën e tre fazave të materies. Nga rregulli i fazës rrjedh se një substancë kimikisht individuale (sistemi me një përbërës) në ekuilibër nuk mund të ketë më shumë se tre faza. Këta të tre... ... Fjalor Enciklopedik i Metalurgjisë
Në termodinamikë, një pikë në një diagram të gjendjes që korrespondon me bashkëjetesën ekuilibër të tre fazave në va. Nga rregulli i fazës Gibbs rrjedh se një individ kimik në një (sistem me një komponent) në ekuilibër nuk mund të ketë më shumë se tre faza. ... ... Enciklopedia Fizike
PIKA E TRESHTË, temperatura dhe presioni në të cilin të tre gjendjet e materies (e ngurtë, e lëngët, e gaztë) mund të ekzistojnë njëkohësisht. Për ujin, pika e trefishtë është në një temperaturë prej 273.16 K dhe një presion prej 610 Pa ... Fjalor enciklopedik shkencor dhe teknik






