Avulli i ujit quhet i ngopur nëse. Avull i ngopur dhe i pangopur
Një avull i ngopur është një avull që është në ekuilibër me një lëng ose të ngurtë. Presioni i avullit të ngopjes së një substance varet nga natyra dhe temperatura e saj.
Ekuilibri midis lëngut dhe avullit është dinamik: midis tyre ka një shkëmbim të vazhdueshëm të grimcave (atomeve, molekulave) dhe për njësi të kohës, përmes njësive të ndërfaqes, aq grimca fluturojnë në avull sa kthehen.
Presioni i avullit të ngopur rritet me rritjen e temperaturës. Në mënyrë sasiore, kjo varësi shprehet me ekuacionin Clausius-Clapeyron
ku Р është presioni i avullit të ngopur; T është temperatura absolute;
ΔН është nxehtësia molare e avullimit; R është konstanta universale e gazit.
Duke integruar këtë ekuacion, duke supozuar ΔН=f(T), marrim
lnP = - + const(2)
ln = - ( - ). (3)
Ekuacioni (2) i korrespondon një varësie drejtvizore në koordinatat lnP – . Nga tangjentja e pjerrësisë së vijës së drejtë, mund të përcaktohet nxehtësia e avullimit ΔН, pasi ΔН = -Rtgα, ku α është këndi i formuar nga vija e drejtë dhe boshti i abshisave. Vlera e konstantës së integrimit varet nga dimensioni në të cilin shprehet presioni dhe mund të gjendet nga çdo vlerë e lnP në vijën e drejtë që rezulton.
Në përputhje me rregullin e fazës Gibbs, një sistem ekuilibri lëng-avull ka një shkallë lirie. Kjo do të thotë se presioni i avullit të ngopjes së një substance varet vetëm nga temperatura. Në këtë punë, ndryshorja e pavarur është presioni i jashtëm, i cili vendoset nga eksperimentuesi, dhe ndryshorja e varur është pika e vlimit.
Objektiv- të njihen me metodën dinamike të matjes së presionit të avullit të ngopur, të përcaktojnë varësinë e presionit të avullit të ngopur nga temperatura për një substancë të caktuar dhe të llogaritin nxehtësinë e avullimit nga grafiku.
PROCEDURA E PUNËS
Metoda dinamike bazohet në përcaktimin e pikave të vlimit të një lëngu në presione të ndryshme. Meqenëse vlimi ndodh në temperaturën në të cilën presioni i avullit të ngopjes është i barabartë me presionin e jashtëm, prandaj, matjet e temperaturave të vlimit në presione të ndryshme japin varësinë e presionit të avullit të ngopjes nga temperatura.
Instalimi për kryerjen e punës është paraqitur në figurë.
Ai përbëhet nga një enë pune 1, në të cilën lëngu avullon; një kondensator refluksi 2 ku kondensohet avulli; matës presioni 3; ngrohës 4 me një banjë uji 5. Një termometër 6 futet në enën e punës me lëngun e provës përmes tapës, fundi i të cilit është i lidhur me lesh pambuku për
matni pikën e vlimit direkt në sipërfaqe dhe shmangni gabimet për shkak të mbinxehjes së lëngut.
|

Puna reduktohet në faktin se në hapësirën mbi lëngun e hulumtuar, shkallë të ndryshme të rrallimit krijohen me radhë nga pompa Komovsky 7 dhe përcaktohen pikat e vlimit. Gjatë eksperimentit, vakuumi zvogëlohet duke hapur valvulën 9. Ena 8 është një enë shtesë që lejon mbushjen relativisht ngadalë të sistemit të evakuuar me ajër. Presioni nën të cilin ndodh vlimi përcaktohet nga leximi i matësit të presionit.
Mbyllni rubinetin, evakuoni sistemin në presionin e vendosur nga menaxheri. Kontrolloni ngushtësinë e sistemit. Konsiderohet e mjaftueshme nëse në 10 minuta presioni rritet jo më shumë se 2,6·10 -3 atm. Lëreni ujin në frigorifer duke hapur me kujdes rubinetin e ujit. Ndizni ngrohësin dhe shikoni temperaturën e lëngut të rritet. Ndërprerja e rritjes së merkurit në termometër tregon vlimin e lëngut. Regjistroni leximet
termometri dhe manometri. Duke përdorur një rubinet, duke komunikuar pajisjen me atmosferën, rrisni presionin me 0,04 atm. Në këtë rast, merkuri në termometër ngrihet dhe ndalon në pikën e vlimit që korrespondon me presionin e ri. Përsëritni veprimet aq herë sa është e nevojshme për të rritur presionin në sistem në presionin barometrik.
Regjistroni rezultatet e matjes në tabelë:
Në bazë të të dhënave të marra: 1) vizatoni varësinë e presionit të avullit të lëngut të hulumtuar nga temperatura në koordinatat Р – T, 0 С dhe lnP – , K; 2) përcaktoni nxehtësinë e avullimit të lëngut grafikisht dhe sipas ekuacionit (3) për tre intervale të temperaturës; 3) përcaktoni ndryshimin e entropisë gjatë avullimit të 1 mol të një substance.
PYETJE TESTI
me temën "Ekuilibri i fazës në një sistem me një komponent"
1. Kalimet fazore të llojit të parë dhe të dytë.
2. Kushti i bashkëjetesës ekuilibër të fazave.
3. Ekuacioni Clausius-Clapeyron (derivimi).
4. Cila marrëdhënie midis temperaturës dhe presionit është tipike për ekuilibrin lëng-avull? Pse?
5. Cila marrëdhënie midis presionit dhe pikës së shkrirjes është më tipike për shumicën e substancave? Pse kjo marrëdhënie është e ndryshme për ujin?
6. Si dhe pse varet nxehtësia e avullimit nga temperatura?
7. Në cilat koordinata shprehet si vijë e drejtë lidhja ndërmjet presionit të avullit të ngopur dhe temperaturës dhe si mund të përcaktohet vlera mesatare e nxehtësisë së avullimit në këtë rast?
8. Çfarë është ekuilibri dinamik dhe presioni i avullit të ngopur?
9. Diagrami i gjendjes së ujit. Si bën Presioni i atmosferës pikën e vlimit të ujit? Pse?
10. Ka varësi lnP - për substanca të ndryshme. Çfarë e përcakton pjerrësinë e këtyre vijave?
Tema 2. KALIMET FAZORE.
Faza e tranzicionit ( transformimi fazor) është kalimi i një substance nga një fazë në tjetrën me një ndryshim në kushtet e jashtme (për shembull, temperatura, presioni, fushat magnetike dhe elektrike, etj.), i shoqëruar nga një ndryshim vetitë fizike dhe parametrat e substancës.
Vlera e temperaturës, presionit ose ndonjë tjetër sasi fizike në të cilën ndodh kalimi fazor quhet pika e tranzicionit. Ekzistojnë dy lloje të tranzicionit fazor.
KALIMET FAZORE TË LLOJIT TË PARË
Gjatë një tranzicioni fazor të llojit të parë, i tillë termodinamik
karakteristikat e një substance, të tilla si dendësia, përqendrimi i përbërësve, vëllim specifik, sasia e energjisë së brendshme të ruajtur, d.m.th. lirohet ose absorbohet një sasi e caktuar nxehtësie, e cila quhet nxehtësia e tranzicionit. Për më tepër, kjo i referohet ndryshimit të menjëhershëm të këtyre sasive jo në kohë, por me një ndryshim në temperaturë, presion, etj. Shembujt më të zakonshëm të tranzicionit fazor të rendit të parë janë:
- shkrirja dhe kristalizimi
- avullimi dhe kondensimi
- sublimimi dhe desublimimi
KALIMET FAZORE TË LLOJIT TË DYTË
Gjatë një tranzicioni të fazës së rendit të dytë, dendësia dhe energjia e brendshme mos ndrysho, pra sy të lirë të tilla tranzicioni fazor mund të jetë i padukshëm. Kërcimi përjetohet nga derivatet e tyre në lidhje me temperaturën dhe presionin: kapaciteti termik, koeficienti i zgjerimit termik, ndjeshmëritë e ndryshme, etj. D.m.th. Tranzicionet fazore të llojit të dytë shoqërohen nga një ndryshim në simetrinë e strukturës së substancës, dhe jo nga çlirimi ose thithja e energjisë (nxehtësia). Shembujt më të zakonshëm të tranzicionit të fazës së rendit të dytë janë:
- kalimi i sistemit në një pikë kritike
- tranzicioni paramagnetik-ferromagnetik
- kalimi i metaleve dhe lidhjeve në gjendjen e superpërcjellshmërisë
- kalimi i heliumit të lëngshëm në një gjendje superfluid
- kalimi i materialeve amorfe në një gjendje qelqi
Fizika moderne gjithashtu heton sistemet që kanë tranzicione fazore të rendit të tretë ose më të lartë. Kohët e fundit përdorim të gjerë mori konceptin e një tranzicioni fazor kuantik, d.m.th. tranzicioni fazor i kontrolluar jo nga luhatjet termike klasike, por nga ato kuantike, të cilat ekzistojnë edhe në zero absolute temperaturat, ku kalimi i fazës klasike nuk mund të realizohet për shkak të teoremës së Nernst-it.
Le të shqyrtojmë më në detaje fenomenet me interes për ne, të cilat shoqërohen me tranzicione fazore të rendit të parë.
AVULLIMI, KONDENSIMI, vlimi.
Çiftet e Ngopura dhe të pangopura.
Çdo substancë në kushte të caktuara mund të jetë në gjendje të ndryshme grumbullimi - të ngurtë, të lëngët dhe të gaztë. kalimet nga një gjendja e grumbullimit tek e dyta janë kalimet fazore të rendit të parë.
Avullimi dhe kondensimi janë kalime fazore ndërmjet fazave të lëngëta dhe të gazta të një substance.
Të gjitha gaze reale(oksigjeni, azoti, hidrogjeni etj.) në kushte të caktuara mund të shndërrohen në lëng. Megjithatë, një transformim i tillë mund të ndodhë vetëm në temperatura nën një të caktuar, të ashtuquajtur temperaturë kritike T kr. Për shembull, për ujin, temperatura kritike është 647,3 K, për azotin 126 K, për oksigjenin 154,3 K. Në temperaturën e dhomës (≈ 300 K), uji mund të jetë në gjendje të lëngët dhe të gaztë, ndërsa azoti dhe oksigjeni ekzistojnë vetëm në formë e gazeve.
me avullim quhet kalimi fazor nga gjendja e lëngët në të gaztë. Nga pikëpamja e teorisë kinetike molekulare, avullimi është një proces në të cilin molekulat më të shpejta fluturojnë nga sipërfaqja e një lëngu, energjia kinetike që tejkalon energjinë e lidhjes së tyre me pjesën tjetër të molekulave të lëngut. Kjo çon në një ulje të energjisë mesatare kinetike të molekulave të mbetura, d.m.th., në ftohjen e lëngut (nëse nuk ka furnizim me energji nga trupat përreth).
Kondensimiështë procesi i kundërt i avullimit. Gjatë kondensimit, molekulat e avullit kthehen në lëng.
Në një enë të mbyllur, një lëng dhe avulli i tij mund të jenë në gjendje ekuilibër dinamik, kur numri i molekulave që largohen nga lëngu është i barabartë me numrin e molekulave që kthehen në lëng nga avulli, d.m.th., kur shpejtësitë e avullimit dhe kondensimit janë të njëjta. Një sistem i tillë quhet dyfazore . Avulli në ekuilibër me lëngun e tij quhet i pasur.
Numri i molekulave të emetuara nga një sipërfaqe njësi e një lëngu në një sekondë varet nga temperatura e lëngut. Numri i molekulave që kthehen nga avulli në lëng varet nga përqendrimi i molekulave të avullit dhe me radhë Shpejtësia mesatare lëvizja e tyre termike, e cila përcaktohet nga temperatura e avullit. Nga kjo rrjedh se për një substancë të caktuar, përqendrimi i molekulave të avullit në ekuilibrin e një lëngu dhe avullit të tij përcaktohet nga temperatura e tyre e ekuilibrit. Vendosja e ekuilibrit dinamik midis proceseve të avullimit dhe kondensimit me rritjen e temperaturës ndodh në përqendrime më të larta të molekulave të avullit. Meqenëse presioni i një gazi (avulli) përcaktohet nga përqendrimi dhe temperatura e tij, mund të konkludojmë: presioni avull i ngopur p 0 e një lënde të caktuar varet vetëm nga temperatura e saj dhe nuk varet nga vëllimi. Prandaj, izotermat e gazeve reale në aeroplan ( fq, V) përmbajnë seksione horizontale që korrespondojnë me një sistem dyfazor (Fig. 3.4.1).
Me rritjen e temperaturës rritet presioni i avullit të ngopjes dhe dendësia e tij, ndërsa dendësia e lëngut zvogëlohet për shkak të zgjerimit termik. Në një temperaturë të barabartë me temperaturën kritike T kr për një substancë të caktuar, dendësia e avullit dhe e lëngut bëhen të njëjta. Në T > T cr zhdukin dallimet fizike midis lëngut dhe tij avull i ngopur.
Nëse ngjeshet në mënyrë izotermale avull i ngopur në T < T cr, atëherë presioni i tij do të rritet derisa të bëhet i barabartë me presionin e avullit të ngopur. Me një ulje të mëtejshme të vëllimit, një lëng formohet në fund të enës dhe vendoset një ekuilibër dinamik midis lëngut dhe avullit të tij të ngopur. Me një ulje të vëllimit, një pjesë në rritje e avullit kondensohet dhe presioni i tij mbetet i pandryshuar (seksioni horizontal në izotermi). Kur i gjithë avulli kthehet në një lëng, presioni rritet ndjeshëm me një rënie të mëtejshme të vëllimit për shkak të kompresueshmërisë së ulët të lëngut.
Është e mundur të kalohet nga gjendja e gaztë në atë të lëngshme duke anashkaluar rajonin dyfazor. Për ta bërë këtë, ju duhet të përfundoni procesin duke anashkaluar pikën kritike K. Një nga proceset e mundshme të këtij lloji është paraqitur në Fig. 1 me një vijë të thyer ABC.
AT ajri atmosferik avulli i ujit është gjithmonë i pranishëm në një presion të pjesshëm fq, e cila zakonisht është më e vogël se presioni i avullit të ngopjes fq 0 . Qëndrimi fq / fq 0, e shprehur në përqindje, quhet lageshtia relative ajri.
| |
Avulli i pangopur teorikisht mund të përshkruhet duke përdorur ekuacionin e gjendjes gaz ideal nën kufizimet e zakonshme për gazrat realë: presioni i avullit nuk duhet të jetë shumë i lartë (praktikisht fq≤ (10 6 –10 7) Pa), dhe temperatura e tij është më e lartë se një vlerë e përcaktuar për secilën substancë. Ligjet e një gazi ideal mund të zbatohen përafërsisht edhe për avullin e ngopur, me kusht që për çdo temperaturë T presioni fq 0 avulli i ngopur përcaktohet nga kurba e ekuilibritfq 0 (T) për një substancë të caktuar.
Presioni fq 0 e avullit të ngopur rritet shumë shpejt me rritjen e temperaturës T. Varësia fq 0 (T) nuk mund të merret nga ligjet ideale të gazit. Presioni i një gazi në një përqendrim konstant të molekulave rritet në përpjesëtim të drejtë me temperaturën. Në avullin e ngopur, me rritjen e temperaturës, rritet jo vetëm energjia mesatare kinetike e lëvizjes molekulare, por edhe përqendrimi i tyre. Prandaj, presioni i avullit të ngopur rritet më shpejt me rritjen e temperaturës sesa presioni i një gazi ideal në një përqendrim konstant të molekulave.
Avullimi mund të ndodhë jo vetëm nga sipërfaqja, por edhe në pjesën më të madhe të lëngut. Lëngjet përmbajnë gjithmonë flluska të vogla gazi. Nëse presioni i avullit të ngopjes së një lëngu është i barabartë ose më i madh se presioni i jashtëm (d.m.th. presioni i gazit në flluska), lëngu do të avullojë në flluska. Flluskat e mbushura me avull zgjerohen dhe notojnë në sipërfaqe. Ky proces quhet duke vluar . Kështu, zierja e një lëngu fillon në një temperaturë në të cilën presioni i tij avujt e ngopur bëhet e barabartë me presionin e jashtëm.
Në veçanti, në presion normal atmosferik, uji vlon në 100°C. Kjo do të thotë se në këtë temperaturë presioni i avullit të ngopur të ujit është 1 atm. Kur ngjiteni në male, presioni atmosferik zvogëlohet, dhe për këtë arsye pika e vlimit të ujit zvogëlohet (afërsisht 1 ° C për çdo 300 metra lartësi). Në një lartësi prej 7 km, presioni është afërsisht 0,4 atm, dhe pika e vlimit bie në 70 °C.
Në një enë të mbyllur hermetikisht, lëngu nuk mund të vlojë, sepse në çdo vlerë të temperaturës, vendoset një ekuilibër midis lëngut dhe avullit të tij të ngopur. Përgjatë kurbës së ekuilibrit fq 0 (T) është e mundur të përcaktohet pika e vlimit të një lëngu në presione të ndryshme.
Fotografia e izotermave reale të gazit të paraqitur në figurën 1 përshkruan proceset e avullimit dhe kondensimit, d.m.th., kalimin fazor midis fazave të gazta dhe të lëngshme të një substance. Në fakt, kjo pamje është e paplotë, pasi çdo substancë mund të kalojë nga e gaztë dhe e lëngët në gjendje e ngurtë. Në një temperaturë të caktuar T Ekuilibri termodinamik ndërmjet dy fazave të së njëjtës substancë është i mundur vetëm në një presion të caktuar në sistem. Varësia e presionit të ekuilibrit nga temperatura quhet kurba e ekuilibrit fazor . Një shembull është kurba e ekuilibrit fq 0 (T) avull dhe lëng të ngopur. Nëse kthesat e ekuilibrit ndërmjet fazave të ndryshme të një substance të caktuar paraqiten në plan ( fq, T), pastaj e ndajnë këtë plan në zona të veçanta në të cilat substanca ekziston në një gjendje homogjene të grumbullimit - të ngurtë, të lëngët ose të gaztë (Fig. 2). Paraqitur në sistemin e koordinatave ( fq, T) quhen kurbat e ekuilibrit diagrami fazor .
Kurba 0 T, që i përgjigjet ekuilibrit ndërmjet fazës së ngurtë dhe të gaztë, quhet kurba e sublimimit. Kurbë TK ekuilibri ndërmjet lëngut dhe avullit quhet kurba e avullimit, përfundon në pikën kritike K. Kurbë TM ekuilibri midis një të ngurtë dhe të lëngshëm quhet kurba e shkrirjes.
Kurbat e ekuilibrit konvergjojnë në një pikë T, në të cilën të tre fazat mund të bashkëjetojnë në ekuilibër. Kjo pikë quhet pikë e trefishtë.
Për shumë substanca presioni fq tr në pikën e trefishtë është më pak se 1 atm ≈ 10 5 Pa. Substancat e tilla shkrihen kur nxehen në presionin atmosferik. Për shembull, pikë e trefishtë uji (Fig. 3) ka koordinata T tr = 273,16 K, fq tr \u003d 6.02 10 2 Pa dhe përdoret si referencë për kalibrimin e shkallës absolute të temperaturës së Kelvin.
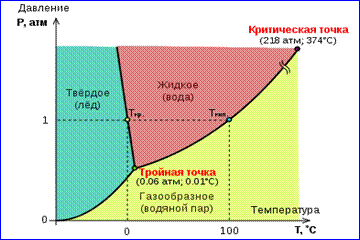 Megjithatë, ka edhe të tilla 3 Diagrami i fazave të ujit
Megjithatë, ka edhe të tilla 3 Diagrami i fazave të ujit
substancat që kanë fq tr
kalon 1 atm. Pra për
presioni i dioksidit të karbonit (CO 2).
fq tr = 5,11 atm dhe temperatura
T tr = 216,5 K. Prandaj, në atmosferë
presioni, dioksidi i ngurtë i karbonit mund
ekzistojnë vetëm në temperatura të ulëta, dhe në gjendje e lëngshme në fq= 1 atm nuk ekziston fare. Në gjendje të ngurtë, dioksidi i karbonit është në ekuilibër me avujt e tij në presionin atmosferik në një temperaturë prej 173 K ose -80 °C. Ky është një "akulli i thatë" i përdorur gjerësisht që nuk shkrihet kurrë, por vetëm avullohet (sublimon).
Pas zierjes, temperatura e ujit ndalon së ngrituri dhe mbetet e pandryshuar deri në avullimin e plotë. Avullimi është procesi i kalimit nga një gjendje e lëngshme në avull, i cili ka të njëjtin indeks të temperaturës si një lëng që zien. Ky avullim quhet avull i ngopur. Kur i gjithë uji ka avulluar, çdo shtim i mëvonshëm i nxehtësisë e rrit temperaturën. Avulli i nxehtë përtej nivelit të ngopur quhet i mbinxehur. Në industri, avulli i ngopur zakonisht përdoret për ngrohje, gatim, tharje ose aplikime të tjera. Mbinxehja përdoret ekskluzivisht për turbinat. Llojet e ndryshme të avullit kanë energji të ndryshme potenciale shkëmbimi dhe kjo justifikon përdorimin e tyre për qëllime krejtësisht të ndryshme.
Avulli si një nga tre gjendjet fizike
Kuptimi i strukturës së përgjithshme molekulare dhe atomike të materies dhe zbatimi i kësaj njohurie për akullin, ujin dhe avullin, mund t'ju ndihmojë të kuptoni më mirë vetitë e avullit. Një molekulë është njësia më e vogël e çdo elementi ose përbërësi. Ai, nga ana tjetër, përbëhet nga grimca edhe më të vogla të quajtura atome, të cilat përcaktojnë elementet bazë si hidrogjeni dhe oksigjeni. Kombinimet specifike të këtyre elementeve atomike sigurojnë një kombinim të substancave. Një nga këto komponime është formula kimike H 2 O, molekulat e së cilës përbëhen nga 2 atome hidrogjeni dhe 1 atom oksigjen. Karboni është gjithashtu i bollshëm, ai është një komponent kyç i të gjithë lëndës organike. Shumica e mineraleve mund të ekzistojnë në tre gjendje fizike ( të ngurta, lëngu dhe avulli), të cilat quhen faza.
Procesi i gjenerimit të avullit
Ndërsa uji i afrohet pikës së tij të vlimit, disa molekula fitojnë energji të mjaftueshme kinetike për të arritur shpejtësi që i lejojnë ato të ndahen momentalisht nga lëngu në hapësirën mbi sipërfaqe përpara se të kthehen. Ngrohja e mëtejshme shkakton më shumë ngacmim dhe numri i molekulave që dëshirojnë të largohen nga lëngu rritet. Në presionin atmosferik, temperatura e ngopjes është 100 °C. Avulli me një pikë vlimi në këtë presion quhet avull i thatë i ngopur. Ashtu si kalimi fazor nga akulli në ujë, procesi i avullimit është gjithashtu i kthyeshëm (kondensimi). Pikë kritikeështë temperatura më e lartë në të cilën uji mund të jetë në gjendje të lëngët. Mbi këtë pikë avulli mund të konsiderohet si gaz. Gjendja e gaztë është e ngjashme me gjendjen difuze, në të cilën molekulat kanë një mundësi lëvizjeje pothuajse të pakufizuar.
Marrëdhënia e variablave
Në një temperaturë të caktuar, ekziston një presion i caktuar i avullit që ekziston në ekuilibër me ujin e lëngshëm. Nëse ky tregues rritet, avulli mbinxehet dhe quhet i thatë. Ekziston një marrëdhënie midis presionit dhe temperaturës: duke ditur një vlerë, mund të përcaktoni tjetrën. Gjendja e avullit përcaktohet nga tre variabla: presioni, temperatura dhe vëllimi. Avulli i ngopur i thatë është gjendja ku avulli dhe uji mund të jenë të pranishëm në të njëjtën kohë. Me fjalë të tjera, kjo ndodh kur shpejtësia e avullimit është e barabartë me shkallën e kondensimit.
Avulli i ngopur dhe vetitë e tij
Kur diskutohen vetitë e avullit të ngopur, ai shpesh krahasohet me një gaz ideal. A kanë diçka të përbashkët apo është thjesht një ide e gabuar? Së pari, në një nivel konstant të temperaturës, dendësia nuk varet nga vëllimi. Vizualisht, kjo mund të imagjinohet si më poshtë: ju duhet të zvogëloni vizualisht vëllimin e rezervuarit të avullit pa ndryshuar treguesit e temperaturës. Numri i molekulave të kondensuar do të tejkalojë numrin e atyre që avullojnë dhe avulli do të kthehet në gjendjen e ekuilibrit. Si rezultat, dendësia do të jetë një parametër konstant. Së dyti, karakteristikat si presioni dhe vëllimi janë të pavarura nga njëra-tjetra. Së treti, duke pasur parasysh pandryshueshmërinë e karakteristikave vëllimore, dendësia e molekulave rritet kur temperatura rritet dhe bëhet më e vogël kur zvogëlohet. Në fakt, kur nxehet, uji fillon të avullojë më shpejt. Bilanci në këtë rast do të prishet dhe nuk do të rikthehet derisa dendësia e avullit të kthehet në pozicionet e mëparshme. Në të kundërt, gjatë kondensimit, dendësia e avullit të ngopur do të ulet. Ndryshe nga një gaz ideal, avulli i ngopur nuk mund të quhet sistem i mbyllur sepse është vazhdimisht në kontakt me ujin.

Avantazhet në fushën e ngrohjes
Avulli i ngopur është avulli i pastër në kontakt të drejtpërdrejtë me ujin e lëngshëm. Ka shumë karakteristika që e bëjnë atë një burim të shkëlqyer të energjisë termike, veçanërisht temperaturat e larta(mbi 100 °C). Disa prej tyre:

Lloje të ndryshme avulli
Avulli është faza e gaztë e ujit. Ai përdor nxehtësinë gjatë formimit të tij dhe lëshon një sasi të madhe nxehtësie më pas. Prandaj, ai
mund të përdoret si lëndë pune për motorët me nxehtësi. Gjendjet e mëposhtme janë të njohura: i ngopur i lagësht, i ngopur i thatë dhe i mbinxehur. Avulli i ngopur preferohet mbi avullin e mbinxehur si mjet i transferimit të nxehtësisë në shkëmbyesit e nxehtësisë. Kur lëshohet në atmosferë nga tubat, një pjesë e tij kondensohet, duke formuar re avullimi të bardha dhe të lagështa që përmbajnë pika të vogla uji. avull i mbinxehur nuk do t'i nënshtrohet kondensimit, edhe kur bie në kontakt të drejtpërdrejtë me atmosferën. AT gjendje e mbinxehur do të ketë një transferim më të madh të nxehtësisë për shkak të përshpejtimit të lëvizjes së molekulave dhe një densitet më të ulët. Prania e lagështirës shkakton kullim, korrozion dhe reduktim të jetëgjatësisë së kaldajave ose pajisjeve të tjera të shkëmbimit të nxehtësisë. Prandaj, avulli i thatë preferohet sepse gjeneron më shumë fuqi dhe është jo korroziv.

E thatë dhe e ngopur: cila është kontradikta
Shumë njerëz ngatërrohen me termat "i thatë" dhe "i pasur". Si mundet që diçka të jetë të dyja në të njëjtën kohë? Përgjigja qëndron në terminologjinë që përdorim. Termi "i thatë" shoqërohet me mungesën e lagështirës, domethënë "jo i lagësht". "I ngopur" do të thotë "i lagur", "i lagur", "i përmbytur", "i ndotur" e kështu me radhë. E gjithë kjo duket se konfirmon kontradiktën. Megjithatë, në inxhinierinë me avull, termi "i ngopur" ka një kuptim tjetër dhe në këtë kontekst nënkupton një gjendje në të cilën ndodh vlimi. Kështu, temperatura në të cilën ndodh vlimi njihet teknikisht si temperatura e ngopjes. Avulli i thatë në këtë kontekst nuk përmban lagështi. Nëse shikoni një kazan që zien, mund të shihni avull të bardhë që del nga gryka e kazanit. Në fakt, është një përzierje e avullit të thatë pa ngjyrë dhe avullit të lagësht që përmban pika uji që reflektojnë dritën dhe janë të ngjyrosura në Ngjyra e bardhë. Prandaj, termi "avull i ngopur i thatë" do të thotë që avulli është i dehidratuar dhe jo i mbinxehur. Pa grimca të lëngshme, është një substancë në gjendje të gaztë që nuk ndjek ligjet e përgjithshme të gazit.
Lëngjet priren të avullojnë. Nëse do të hidhnim një pikë ujë, eter dhe merkur në tryezë (thjesht mos e bëni në shtëpi!), Ne mund të shikonim se si pikat gradualisht zhduken - avullojnë. Disa lëngje avullojnë më shpejt, të tjerët më ngadalë. Procesi i avullimit të një lëngu quhet gjithashtu avullim. Procesi i kundërt i shndërrimit të avullit në lëng është kondensimi.
Këto dy procese ilustrojnë tranzicioni fazor- procesi i kalimit të substancave nga një gjendje grumbullimi në një tjetër:
- avullimi (kalimi nga lëngu në gjendje e gaztë);
- kondensimi (kalimi nga një gjendje e gaztë në një gjendje të lëngshme);
- desublimimi (kalimi nga një gjendje e gaztë në një gjendje të ngurtë, duke anashkaluar fazën e lëngshme);
- sublimim, është edhe sublimim (kalimi nga gjendja e ngurtë në të gaztë, duke anashkaluar lëngun).
Tani, meqë ra fjala, është stina e duhur për të vëzhguar procesin e desublimimit në natyrë: ngrica dhe ngrica në pemë dhe objekte, modele të ngrira në dritare janë rezultati i saj.
Si formohet avulli i ngopur dhe i pangopur?
Por përsëri te avullimi. Ne do të vazhdojmë të eksperimentojmë dhe derdhim një lëng - ujë, për shembull, në një enë të hapur dhe lidhim një matës presioni me të. E padukshme për syrin, avullimi bëhet në enë. Të gjitha molekulat e lëngshme janë në lëvizje të vazhdueshme. Disa lëvizin aq shpejt sa energjia e tyre kinetike është më e fortë se ajo që lidh molekulat e lëngut së bashku.
Pas largimit nga lëngu, këto molekula vazhdojnë të lëvizin rastësisht në hapësirë, shumica dërrmuese e tyre shpërndahen në të - ja si avulli i pangopur. Vetëm një pjesë e vogël e tyre kthehet përsëri në lëng.
Nëse e mbyllim enën, molekulat e avullit gradualisht do të bëhen gjithnjë e më shumë. Dhe gjithnjë e më shumë prej tyre do të kthehen në lëng. Kjo do të rrisë presionin e avullit. Kjo do të regjistrohet nga një manometër i lidhur me anijen.
Pas ca kohësh, numri i molekulave që largohen nga lëngu dhe kthehen në të do të jetë i barabartë. Presioni i avullit do të ndalojë së ndryshuari. Si rezultat ngopja me avull vendoset ekuilibri termodinamik i sistemit lëng-avull. Kjo do të thotë, avullimi dhe kondensimi do të jenë të barabarta.
Karakteristikat e avullit të ngopur
Për t'i ilustruar ato qartë, ne përdorim një eksperiment tjetër. Thirrni të gjithë fuqinë e imagjinatës tuaj për ta imagjinuar atë. Pra, le të marrim një manometër merkuri, i përbërë nga dy gjunjë - tuba komunikues. Merkuri derdhet në të dyja, njëri skaj është i hapur, tjetri është i mbyllur dhe mbi merkur përmban edhe pak eter dhe avujt e tij të ngopur. Nëse ulni dhe ngrini gjurin jo të salduar, niveli i merkurit në atë të salduar gjithashtu do të rritet dhe do të bjerë.
Në këtë rast, sasia (vëllimi) i avullit të eterit të ngopur gjithashtu do të ndryshojë. Dallimi midis niveleve të kolonave të merkurit në të dy gjunjët e manometrit tregon presionin e avullit të ngopur të eterit. Ajo do të mbetet e pandryshuar në çdo kohë.
Kjo nënkupton vetinë e avullit të ngopur - presioni i tij nuk varet nga vëllimi që zë. Presioni i avullit të ngopjes së lëngjeve të ndryshme (për shembull, uji dhe eteri) është i ndryshëm në të njëjtën temperaturë.
Megjithatë, temperatura e avullit të ngopur ka rëndësi. Sa më e lartë të jetë temperatura, aq më i lartë është presioni. Presioni i avullit të ngopur rritet më shpejt me rritjen e temperaturës sesa me avullin e pangopur. Temperatura dhe presioni i avullit të pangopur janë të lidhura nga një marrëdhënie lineare.
Mund të kryhet një eksperiment tjetër interesant. Merrni një balonë të zbrazët pa avuj të lëngshëm, mbylleni dhe lidhni një manometër. Gradualisht, pika pas pikë, futni lëngun në balonë. Ndërsa lëngu hyn dhe avullon, vendoset presioni i avullit të ngopur, i cili është më i larti për një lëng të caktuar në një temperaturë të caktuar.
Më shumë rreth temperaturës dhe avullit të ngopur
Temperatura e avullit ndikon gjithashtu në shkallën e kondensimit. Ashtu si temperatura e një lëngu përcakton shkallën e avullimit - me fjalë të tjera, numrin e molekulave që dalin nga sipërfaqja e lëngut për njësi të kohës.
Avulli i ngopur ka të njëjtën temperaturë si lëngu. Sa më e lartë të jetë temperatura e avullit të ngopur, aq më i lartë është presioni dhe dendësia e tij, aq më i ulët është dendësia e lëngut. Kur arrihet temperatura kritike për substancën, dendësia e lëngut dhe e avullit është e njëjtë. Nëse temperatura e avullit është mbi temperaturën kritike për substancën, ndryshimet fizike midis avullit të lëngshëm dhe të ngopur fshihen.
Përcaktimi i presionit të avullit të ngopjes në përzierjet me gazra të tjerë
Ne folëm për konstante temperaturë konstante presioni i avullit të ngopur. Ne përcaktuam presionin në kushte "ideale": kur një enë ose balonë përmban lëng dhe avull të vetëm një substance. Konsideroni gjithashtu një eksperiment në të cilin molekulat e një substance shpërndahen në hapësirë në një përzierje me gazra të tjerë.
Për ta bërë këtë, marrim dy cilindra xhami të hapur dhe i vendosim në të dy enët e mbyllura me eter. Si zakonisht, ne lidhim matës presioni. Ne hapim një enë me eter, pas së cilës matësi i presionit regjistron rritjen e presionit. Dallimi midis këtij presioni dhe presionit në cilindër me enën e mbyllur të eterit ju lejon të zbuloni presionin e avullit të ngopur të eterit.
Rreth presionit dhe vlimit
Avullimi është i mundur jo vetëm nga sipërfaqja e lëngut, por edhe në vëllimin e tij - atëherë quhet zierje. Ndërsa temperatura e lëngut rritet, formohen flluska avulli. Kur presioni i avullit të ngopjes është më i madh ose i barabartë me presionin e gazit në flluska, lëngu avullon në flluska. Dhe ato zgjerohen dhe ngrihen në sipërfaqe.
Lëngjet ziejnë në temperatura të ndryshme. Në kushte normale uji vlon në 100 0 C. Por me ndryshimin e presionit atmosferik ndryshon edhe pika e vlimit. Pra, në male, ku ajri është shumë i rrallë dhe presioni atmosferik më i ulët, me ngjitjen e maleve, ulet edhe pika e vlimit të ujit.
Nga rruga, në një enë të mbyllur hermetikisht, zierja është fare e pamundur.
![]()
Një shembull tjetër i marrëdhënies midis presionit të avullit dhe avullimit demonstrohet nga një karakteristikë e tillë e përmbajtjes së avullit të ujit në ajër si lageshtia relative ajri. Ai përfaqëson marrëdhënien presion i pjesshëm avujt e ujit në presionin e avullit të ngopur dhe përcaktohet nga formula: φ \u003d p / p rreth * 100%.
Kur temperatura e ajrit ulet, rritet përqendrimi i avullit të ujit në të, d.m.th. ato bëhen më intensive. Kjo temperaturë quhet pika e vesës.
Duke përmbledhur
Duke përdorur shembuj të thjeshtë, ne kemi analizuar thelbin e procesit të avullimit dhe avullin e pangopur dhe të ngopur që rezulton. Ju mund t'i vëzhgoni të gjitha këto fenomene rreth jush çdo ditë: për shembull, mund të shihni pellgje që thahen pas shiut në rrugë ose një pasqyrë në banjë të mjegulluar nga avulli. Në banjë, madje mund të shikoni se si ndodh avullimi së pari, dhe më pas lagështia e grumbulluar në pasqyrë kondensohet përsëri në ujë.
Ju gjithashtu mund ta përdorni këtë njohuri për ta bërë jetën tuaj më të rehatshme. Për shembull, në dimër, në shumë apartamente, ajri është shumë i thatë dhe kjo ndikon keq në mirëqenien. Ju mund të përdorni një lagështues modern për ta bërë atë më të lagësht. Ose, në mënyrën e vjetër, vendosni një enë me ujë në dhomë: duke avulluar gradualisht, uji do të ngopë ajrin me avujt e tij.
www.site, me kopjim të plotë ose të pjesshëm të materialit, kërkohet një lidhje me burimin.









