Si ndryshon entropia? Entropia termodinamike. proces rrethor. Cikli Carnot
Në shumicën e proceseve kimike, dy dukuri ndodhin njëkohësisht: transferimi i energjisë dhe një ndryshim në rregullimin e rendit të grimcave në lidhje me njëra-tjetrën. Të gjitha grimcat (molekulat, atomet, jonet) priren të lëvizin rastësisht, kështu që sistemi priret të lëvizë nga një gjendje më e renditur në një gjendje më pak të renditur. Një masë sasiore e çrregullimit (kaoticitetit, çrregullimit) të një sistemi është entropia S . Për shembull, nëse një cilindër gazi është i lidhur me një enë boshe, atëherë gazi nga cilindri do të shpërndahet në të gjithë vëllimin e enës. Sistemi do të kalojë nga një gjendje më e renditur në një gjendje më pak të renditur, që do të thotë se entropia do të rritet (ΔS > 0).
Nuk ka gjasa që koncepti i fizikës të përdoret kaq shpesh jashtë fizikës - dhe për këtë arsye shpesh devijon nga kuptimi i tij aktual - si entropi. Koncepti ka një kuptim shumë të ngushtë. Përkufizimi specifik i kësaj sasi fizikeështë bërë nga fizikani austriak Ludwig Boltzmann në gjysmën e dytë të vitit. Ai u fokusua në sjelljen mikroskopike të një lëngu, d.m.th. të një gazi ose lëngu. Lëvizja e çrregullt e atomeve ose molekulave kuptohej si nxehtësi, e cila ishte vendimtare për përcaktimin e saj.
AT sistem i mbyllur me një vëllim fiks dhe një numër të caktuar grimcash, vuri në dukje Boltzmann, entropia është proporcionale me logaritmin e numrit të mikrofazave në sistem. Në mikrostate, ai kuptoi të gjitha mundësitë e grumbullimit të molekulave ose atomeve të një lëngu të mbyllur në një lëng. Formula e tij e përcakton entropinë si një masë të "lirisë së rregullimit" të molekulave dhe atomeve: nëse rritet numri i mikrostateve të pranueshme, rritet entropia. Ka më pak mundësi se si mund të formohen grimcat e lëngshme, më pak entropi.
Entropia rritet gjithmonë (ΔS > 0) gjatë kalimit të sistemit nga një gjendje më e rregulluar në një gjendje më pak të renditur: gjatë kalimit të një substance nga një gjendje kristalore në një lëng dhe nga një gjendje e lëngshme në një gjendje të gaztë, me një rritje. në temperaturë, me shpërbërje dhe shpërbërje substancë kristalore etj.
Gjatë kalimit të sistemit nga një gjendje më pak e renditur në një gjendje më të rregullt, entropia e sistemit zvogëlohet (ΔS< 0), например при конденсации, кристаллизации, понижении температуры и т.д.
Formula e Boltzmann-it shpesh interpretohet sikur entropia është ekuivalente me "çrregullim". Megjithatë, kjo pamje e thjeshtuar është lehtësisht mashtruese. Shkuma e banjës është një shembull i kësaj: kur flluskat shpërthejnë dhe sipërfaqja e ujit bëhet e lëmuar, mërzitja duket se zvogëlohet. Por entropia jo! Në fakt, ajo madje rritet, sepse pasi shkuma shpërthen, hapësira e mundshme për molekulat e lëngshme nuk kufizohet më nga membranat e jashtme të vezikulave, kështu që numri i mikrostateve të gëlltitura është rritur.
Çfarë është entropia
Përkufizimi i Boltzmann-it na lejon të kuptojmë njërën anë të termit, por entropia ka gjithashtu një aspekt tjetër makroskopik, të cilin fizikani gjerman Rudolf Clausius e zbuloi tashmë disa vjet më parë. U shpik motori me avull, motori klasik i nxehtësisë. Motorët me nxehtësi konvertojnë ndryshimin e temperaturës në punë mekanike. Më pas, fizikantët u përpoqën të kuptonin parimet që drejtojnë këto makina. Studiuesit kanë zbuluar se vetëm disa për qind e energjisë termike mund të shndërrohet në energji mekanike.
Në termodinamikë, ndryshimi i entropisë lidhet me nxehtësinë me shprehjen:
dS = δQ/T ose ΔS=ΔH / T
Entropitë e substancave, si dhe entalpitë e tyre të formimit, quhen kushte standarde. entropia standarde shënohet 1 mol S 0 298 , kjo është një vlerë referencë, e matur në J / (K mol) (Shtojca 2).
Për shembull, entropia standarde
Pjesa tjetër humbi disi - pa e kuptuar arsyen. Teoria e termodinamikës, me sa duket, nuk kishte një koncept fizik që merrte parasysh valencat e ndryshme të energjisë dhe kufizonte mundësinë e shndërrimit të energjisë termike në energji mekanike. Zgjidhja mori formën e entropisë. Clausius prezantoi termin si një ndryshore termodinamike dhe e përkufizoi atë si një masë makroskopike të një vetie që kufizon përdorshmërinë e energjisë.
Sipas Clausius, ndryshimi në entropinë e një sistemi varet nga nxehtësia e furnizuar dhe temperatura. Së bashku me nxehtësinë, entropia gjithmonë transferohet, pra derivimi i saj. Për më tepër, Clausius arriti në përfundimin se entropia në sistemet e mbyllura, ndryshe nga energjia, nuk është një faktor ruajtjeje. Ky ishte momenti i dytë kryesor i termodinamikës në fizikë.
akull……………..S 0 298 = 39,7 J/(K mol);
ujë…………….S 0 298 = 70,08 J/(K mol);
avujt e ujit ... ..S 0 298 \u003d 188,72 J / (K mol),
ato. rritet entropia - shkalla e çrregullimit të një substance në gjendje e gaztë më shumë.
Për grafitin S 0 298 = 5,74 J / (K mol), për diamantin S 0 298 = 2,36 J / (K mol), pasi substancat me strukturë amorfe kanë më shumë entropi sesa me atë kristalore.
"Në një sistem të mbyllur, entropia nuk zvogëlohet kurrë." Prandaj, entropia gjithmonë rritet ose mbetet konstante. Kjo prezanton një afat kohor në fizikën e ciklit të mbyllur, pasi proceset termodinamike në sistemet e mbyllura janë të pakthyeshme me rritjen e entropisë.
Teoria e punës laboratorike
Procesi do të ishte i kthyeshëm nëse entropia do të mbetej konstante. Por kjo është vetëm teorikisht e mundur. Të gjitha proceset reale janë të pakthyeshme. Sipas Boltzmann, mund të thuhet gjithashtu se numri i mikrostateve të mundshme rritet në çdo kohë. Ky interpretim mikroskopik zgjeron interpretimin termodinamik-makroskopik të Clausius. Entropia më në fund zgjidhi misterin e zhdukjes së energjisë në motorët e nxehtësisë. Një pjesë e energjisë termike më në fund hiqet nga përdorshmëria mekanike dhe lirohet përsëri, sepse entropia në sistemet e mbyllura nuk duhet të ulet.
Entropia S 0 298, J / (K mol) rritet me ndërlikimin e molekulave, për shembull:
Në rrjedhën e reaksioneve kimike ndryshon edhe entropia, kështu që me rritjen e numrit të molekulave të substancave të gazta rritet entropia e sistemit dhe me ulje zvogëlohet.
Ndryshimi në entropinë e sistemit si rezultat i proceseve përcaktohet nga ekuacioni:
Informacione të përgjithshme rreth termodinamikës
Që nga rezultatet e Clausius dhe Boltzmann, entropia është zhvendosur edhe në fusha të tjera të fizikës. Edhe jashtë fizikës janë sulmuar, të paktën si koncept matematikor. Me këtë përmasa ai karakterizoi humbjen e informacionit në transmetimet telefonike.
Cikli ideal i një motori ngrohjeje Carnot
Entropia gjithashtu luan një rol në kimi dhe biologji: në disa sistemet e hapura struktura të reja mund të formohen për sa kohë që entropia lirohet. Këto duhet të jenë të ashtuquajturat sisteme disipative në të cilat energjia shndërrohet në energji termike. Kjo teori e formimit strukturor vjen nga fizikanti-kimisti belg Ilya Prigogine. Deri më sot është publikuar një vepër në të cilën sferës fizike të konceptit i shtohen aspekte të reja.
∆S 0 = ∑ ∆S 0 kont. - ∑ ΔS 0 ref.
Për shembull: në reagim
C (grafit) + CO 2 (g) \u003d 2CO (g); ΔS 0 298 = 87,8 J/K
Në anën e majtë të ekuacionit, ka 1 mol substancë të gaztë CO 2 (g), dhe në të djathtë - 2 mol substancë të gaztë 2CO (g), që do të thotë se vëllimi i sistemit rritet dhe entropia rritet ( ΔS > 0).
Me një rritje të entropisë (ΔS > 0), ndodhin edhe reagimet:
![]()
Pse është i kufizuar efikasiteti i motorëve me ngrohje? Rudolf Clausius e zgjidhi këtë gjëegjëzë duke prezantuar konceptin e entropisë. Fizikani shqyrtoi procesin rrethor të një motori të idealizuar të nxehtësisë në të cilin zgjerimi dhe tkurrja alternojnë në kushte izotermale dhe izentropike. Duke korreluar ruajtjen e energjisë në grupin e dytë bazë të termodinamikës, pabarazia e mëposhtme për efikasitet çon në këtë të ashtuquajtur proces Carnot.
Kështu, efikasiteti maksimal i arritshëm i një motori termik është i kufizuar nga ligjet termodinamike. Për shembull, nëse makina funksionon midis 100 dhe 200 gradë Celsius, efikasiteti maksimal i arritshëm është rreth 21 përqind. Dy njohuri shtesë të dobishme mund të nxirren matematikisht nga ruajtja e energjisë dhe grupi i dytë bazë i termodinamikës: kur kryeni punë, nxehtësia mund të kalojë vetëm nga një trup i ftohtë në një trup të ngrohtë - frigoriferët dhe pompat e nxehtësisë kanë nevojë për furnizim me energji elektrike.
2 H 2 O (g) \u003d 2 H 2 (g) + O 2 (g)
2 H 2 O 2 (g) \u003d 2 H 2 O (g) + O 2 (g)
CaCO 3 (c) \u003d CaO (c) + CO 2 (g), ΔS 0 298 \u003d 160,48 J / K
Në reagimin e formimit të amoniakut
N2 (g) + 3 H2 (g) \u003d 2 NH3 (g); ΔS 0 298 \u003d - 103,1 J / K
Vëllimi i sistemit zvogëlohet, dhe për këtë arsye ulet edhe entropia (ΔS< 0).
Me entropinë në rënie (ΔS< 0) протекают реакции:
3 H 2 (g) + N 2 (g) \u003d 2 NH 3 (g)
2 H 2 (g) + O 2 (g) \u003d 2 H 2 O (g)
Së dyti, nuk mund të punohet me rezervuarin e nxehtë temperaturë konstante. Për këtë qëllim, një rrjedhë nxehtësie midis rezervuarëve është gjithmonë e nevojshme. temperatura të ndryshme. Termi entropi është një formim i ri i Rudolf Clausius nga fjalët greke dhe përafërsisht përkthehet në "përmbajtje konvertimi".
Formula thotë se entropia gjithmonë transferohet së bashku me nxehtësinë. Përkufizimi i entropisë së Boltzmann-it bazohet në kuptimin e nxehtësisë si lëvizje e çrregullt e atomeve ose molekulave. Mikrostatet janë mundësitë se si mund të rregullohen molekulat ose atomet e një lëngu të bllokuar. Entropia është një e gjerë prej. Çdo gjendje ekuilibri të një sistemi termodinamik mund t'i caktohet në mënyrë unike një vlerë entropie. AT fizikës statistikore entropia është një masë e sasisë së hapësirës fazore që mund të arrijë një sistem.
Në reagimet ndërmjet të ngurta dhe në proceset në të cilat sasia e substancave të gazta nuk ndryshon, entropia praktikisht nuk ndryshon dhe ndryshimi i saj përcaktohet nga struktura e molekulave ose struktura e rrjetës kristalore, për shembull:
C (grafit) + O 2 (g) \u003d CO 2 (g), ΔS 0 298 \u003d 2,9 J / K
Al (c) + Sb (c) \u003d AlSb (c), ΔS 0 298 \u003d - 5,01 J / K
Shembulli #1. Llogaritni dhe shpjegoni ndryshimin e entropisë për një proces
Në kuadrin e termodinamikës klasike, entropia është një masë për. Ky ndryshim i entropisë është pozitiv kur futet nxehtësia, negativ kur largohet nxehtësia. Clausius gjithashtu përshkroi shumëzimin e entropisë pa transferim të nxehtësisë nga procese të pakthyeshme në një rast të izoluar me pabarazi.
Historia e termit "entropi"
![]()
Ekuacioni është një formë e grupit të dytë kryesor të termodinamikës. Me procesin e treguar në figurë në një sistem adiabatik, ku mund të specifikohet vetëm gjendja fillestare dhe gjendja përfundimtare, nuk është kështu. Megjithatë, për një gaz ideal, diferenca e entropisë mund të llogaritet në një mënyrë të thjeshtë përmes një procesi zhvendosjeje izotermike të kthyeshme siç përshkruhet në seksionin e Shembujve. Përveç energjisë, entropia është koncepti më i rëndësishëm dhe është e dobishme të shkohet në pikën fillestare të kësaj shkence për një kuptim dhe përsëritje më të mirë të zhvillimit.
2SO 2 (g) + O 2 (g) \u003d 2SO 2 (g)
Zgjidhje.
ΔS 0 \u003d 2 S 0 SO 3 (g) - (2 S 0 SO2 (g) + S 0 O 2 (g)) \u003d 2 256,23 - (2 248,1 + 205,04) \u003d - 188 ,78 J/K .
Që nga ΔS< 0, энтропия уменьшается вследствии уменьшения объема системы, т.е. уменьшения числа молей газообразных веществ (в левой части 3 моль газообразных веществ, в правой – 2 моль).
Shembulli #2. Llogaritni dhe shpjegoni ndryshimin e entropisë për një proces:
Makina ishte në gjendje të përfundonte detyrën e saj, por iu desh shumë karburant. Në këtë kohë, lidhja midis energjisë dhe nxehtësisë ishte plotësisht e errët, dhe Julius Mayer ende duhej ta botonte atë mbi 130 vjet më vonë. I frymëzuar nga puna e babait të tij në mullinj, Carnot përshkroi një motor me avull në një proces ciklik në të cilin nxehtësia rrjedh nga një burim i nxehtë në një prizë të ftohtë, duke bërë kështu punë.
Në veprën e tij origjinale, Carnot shprehu pikëpamjen se nxehtësia është një lloj lënde e pakalueshme që rrjedh gjithmonë nga një trup më i nxehtë në një trup më të ftohtë, pasi uji lëviz gjithmonë poshtë. Dhe ashtu si uji që bie, nxehtësia mund të vazhdojë të funksionojë, sa më i lartë të jetë gradienti, në veçanti, makina nuk mund të bëjë më shumë punë sesa ngrohja është furnizuar. Carnot e korrigjoi veten më vonë dhe e kishte njohur tashmë ekuivalencën e nxehtësisë dhe energjisë dhjetë vjet përpara Mayer, Joule dhe Thomson. Ai ndërkohë ishte përpara kohës së tij, por, për fat të keq, vdiq i ri dhe puna e tij kaloi pa u vënë re në shikim të parë.
Zgjidhje. Le të shkruajmë nga App. 2 vlera entropitë standarde substancave
Sipas përfundimit të ligjit të Hesit,
ΔS 0 \u003d (2 S 0 CuO (c) + S 0 SO 2 (g)) - (S 0 Cu2S (c) + 2 S 0 O 2 (g)) \u003d (2 42,64 + 248,1) - (119,24 + 205,04) = 9,1 J/K.
Entropia rritet pak, kjo është për shkak të ndërlikimit të strukturës së molekulës SO 2 (g) në krahasim me molekulën O 2 (g).
Shembulli #3. Përcaktoni ndryshimin e entropisë për procesin:
Vetëm Clausius formuloi lidhjen midis ndryshimit të temperaturës - burimit dhe lavamanit - me efikasitetin e shkëmbyesit të nxehtësisë dhe se ky efikasitet nuk mund të tejkalohet nga një motor tjetër i nxehtësisë, pasi nxehtësia përndryshe do të rrjedhte spontanisht nga një trup i ftohtë në një trup të nxehtë. Pamundësia e një procesi të tillë në natyrë tani quhet Clausius, i formuluar prej saj me një proces rrethor.
Nuk ka asnjë makinë çiklizmi, efekti i vetëm i së cilës është transferimi i nxehtësisë nga ftohësi në një rezervuar më të ngrohtë. E thënë thjesht, pretendimi kryesor thotë se ndryshimet e temperaturës nuk mund të rriten spontanisht në natyrë. Clausius mund të kërkojë një ofertë me këtë.
C (grafit) + O 2 (g) \u003d CO 2 (g)
Zgjidhja: Le të shkruajmë nga App. 2 vlera standarde të entropisë
ΔS 0 \u003d S 0 CO2 (g) - (S 0 C (g) + S 0 O2 (g)) \u003d 213,68 - (5,74 + 205,04) \u003d 2,9 J / K.
Meqenëse ΔS > 0, entropia rritet pak gjatë reaksionit. Vëllimi i sistemit nuk ndryshon, por entropia rritet për shkak të kompleksitetit të strukturës së molekulës CO 2 në krahasim me molekulën O 2.
Termodinamika si funksion i gjendjes
Për çdo proces rrethor. Shenja e ekuivalencës vlen vetëm për proceset e kthyeshme. Me këtë teoremë të Clausius madhësia është e dukshme. Clausius e quajti këtë sasi entropi dhe me kalimin e kohës është bërë zakon që fjalia kryesore të formulohet drejtpërdrejt me entropi, gjë që në asnjë mënyrë nuk çon në një kuptim më të thellë. Vetëm dekada më vonë, me mekanikën e saj statistikore, mund të gjendej një shpjegim i entropisë si një masë e mikrogjendjeve të arritshme të një sistemi. Nxehtësia shpërndahet në mënyrë të rastësishme nëpër atomet dhe molekulat, duke shpërndarë energji dhe duke shkuar nga nxehtësia në të ftohtë, sepse rruga e kthimit është thjesht shumë e pamundur.
Energjia e Gibbs
Në mënyrë spontane, d.m.th. pa shpenzimin e energjisë nga jashtë, sistemi mund të shkojë vetëm nga një gjendje më pak e qëndrueshme në një gjendje më të qëndrueshme.
AT proceset kimike dy faktorë në të njëjtën kohë:
Tendenca që sistemi të kalojë në gjendjen me energjinë më të ulët të brendshme, e cila redukton entalpinë e sistemit ( ∆H → min);
Tendenca që një sistem të kalojë në një gjendje më të çrregullt, gjë që rrit entropinë ( ∆S → max).
Ndryshimi i energjisë së sistemit quhet faktori entalpi , shprehet në mënyrë sasiore në termat e efektit termik të reaksionit ΔH. Ai pasqyron tendencën për të formuar lidhje dhe për të zmadhuar grimcat.
Rritja e entropisë në një sistem quhet faktori i entropisë , shprehet në mënyrë sasiore në njësi të energjisë (J) dhe llogaritet si T ΔS. Ai pasqyron një tendencë drejt një rregullimi më të rastësishëm të grimcave, drejt zbërthimit të substancave në grimca më të thjeshta.
Efekti total i këtyre dy tendencave të kundërta në proceset që ndodhin në konstante T dhe P , reflektohet nga ndryshimi i potencialit izobarizotermik ose energji e lirë Gibbs ΔG dhe shprehet me ekuacionin:
∆G = ∆H – T ∆S
Në presion dhe temperaturë konstante (procesi izobarik-izotermik), reaksionet zhvillohen në mënyrë spontane në drejtim të zvogëlimit të energjisë Gibbs.
Nga natyra e ndryshimit në energjinë Gibbs, mund të gjykohet mundësia ose pamundësia themelore e zbatimit të procesit.
Nese nje ΔG< 0 , reagimi mund të vazhdojë spontanisht në drejtimi përpara. Sa më i madh të jetë ulja e faktorit të entalpisë dhe rritja e faktorit të entropisë, aq më e fortë është tendenca e sistemit për të vazhduar reaksionin. Energjia Gibbs në gjendjen fillestare të sistemit është më e madhe se në gjendjen përfundimtare.
Nëse energjia Gibbs ∆G > 0, reagimi nuk mund të vazhdojë spontanisht në drejtimin përpara.
Nese nje ∆G=0, sistemi është në një gjendje ekuilibri kimik, faktorët e entalpisë dhe entropisë janë të barabartë (ΔH=T ΔS). Temperatura në të cilën ∆G = 0, quhet temperatura e fillimit të reaksionit : T = ∆H/∆S. Në këtë temperaturë, si reagimet e përparme ashtu edhe ato të kundërta janë po aq të mundshme. Mundësia (ose pamundësia) e një reagimi spontan në raporte të ndryshme vlerat e ΔH dhe ΔS janë paraqitur në tabelë.
Shembulli #1.
Cu 2 S (c) + 2 O 2 (g) \u003d 2 CuO (c) + SO 2 (g)
Specifikoni mundësinë e shfaqjes së tij në kushte standarde në sistem i mbyllur.
Zgjidhja: Ndryshimi i energjisë së lirë të Gibbs në reaksion kimik në kushte standarde (T \u003d 298 K, P \u003d 101325 Pa) llogaritet me ekuacionin ΔG 0 \u003d ΔH 0 - T ΔS 0.
Efekti termik i një reaksioni kimik ΔH 0 = - 545,5 kJ (shih llogaritjen më lart). Ndryshimi i entropisë në një reaksion kimik ΔS 0 = -9,1 J/K (shih llogaritjen më sipër).
Kur llogaritet ΔG 0, duhet të merret parasysh se ΔH 0 shprehet në kJ, dhe ΔS 0 në J / K, për këtë, ΔS 0 duhet të shumëzohet me 10 -3.
Ndryshimi i energjisë së lirë të Gibbsit në një reaksion kimik
ΔG 0 \u003d ΔH 0 - T ΔS 0 \u003d - 545,5 - \u003d -548,21 kJ.
Që nga ΔG 0< 0, следовательно, в стандартных условиях самопроизвольное протекание данной химической реакции в прямом направлении возможно.
Shembulli #2. Bazuar në vlerat e ∆H 0 dhe ∆S 0, llogaritni ∆G 0 të reaksionit
MgCO 3 (c) \u003d MgO (c) + CO 2 (g)
Tregoni mundësinë e rrjedhjes së tij në kushte standarde në një sistem të mbyllur. Në cilën temperaturë do të fillojë të dekompozohet karbonati i kalciumit?
Zgjidhja: Ne shkruajmë nga Shtojcat 1 dhe 2 vlerat e etalpive standarde ∆H0f, kJ/mol dhe entropia S 0 , J/(K mol):
Llogaritni ndryshimin e entalpisë dhe entropisë
∆H0= (∆H0f, MgО(c) + ∆H0f, CO 2 (g)) - ∆H0f, MgСО 3 (k) \u003d [-601,24 + (-393,5)] - (-1096,21) \u003d 101,46 kJ;
ΔS 0 \u003d - S 0 MgSO 3 (k) \u003d - 112,13 \u003d 128,41 J / K.
ΔG 0 \u003d ΔH 0 - T ΔS 0 \u003d 101,46 - 298 128,41 10 -3 \u003d 63,19 kJ.
Meqenëse ΔG 0 > 0, rrjedha e këtij reagimi në kushte standarde është e pamundur. Meqenëse ΔH > 0 dhe ΔS > 0, mund të konkludohet se reaksioni mund të vazhdojë spontanisht në një temperaturë mjaft të lartë.
Llogaritni temperaturën në të cilën fillon dekompozimi i karbonatit të magnezit:
T \u003d ΔH 0 / ΔS 0 \u003d 101,46 / (128,41 10 -3) \u003d 790,12 K (517,12 0 C).
Në një temperaturë prej 790.12 K, të dyja reagimet e përparme dhe të kundërta janë njësoj të mundshme. Në temperaturat mbi 790.12 K, do të vazhdojë një reaksion i drejtpërdrejtë, d.m.th. do të ndodhë dekompozimi i karbonatit të magnezit.
§6 Entropia
Zakonisht, çdo proces në të cilin një sistem kalon nga një gjendje në tjetrën vazhdon në atë mënyrë që është e pamundur të kryhet ky proces në drejtim të kundërt, në mënyrë që sistemi të kalojë nëpër të njëjtat gjendje të ndërmjetme pa asnjë ndryshim në trupat përreth. Kjo është për shkak të faktit se një pjesë e energjisë shpërndahet në proces, për shembull, për shkak të fërkimit, rrezatimit, etj. Pothuajse të gjitha proceset në natyrë janë të pakthyeshme. Në çdo proces, një pjesë e energjisë humbet. Për të karakterizuar shpërndarjen e energjisë, është paraqitur koncepti i entropisë. ( Vlera e entropisë karakterizon gjendjen termike të sistemit dhe përcakton probabilitetin e zbatimit të kësaj gjendje të trupit. Sa më e mundshme të jetë gjendja e dhënë, aq më e madhe është entropia.) Të gjitha proceset natyrore shoqërohen me një rritje të entropisë. Entropia mbetet konstante vetëm në rastin e një procesi të kthyeshëm të idealizuar që ndodh në një sistem të mbyllur, domethënë në një sistem në të cilin nuk ka shkëmbim energjie me trupa jashtë këtij sistemi.
Entropia dhe kuptimi i saj termodinamik:
Entropia- ky është një funksion i tillë i gjendjes së sistemit, ndryshimi pafundësisht i vogël i të cilit në një proces të kthyeshëm është i barabartë me raportin e sasisë pafundësisht të vogël të nxehtësisë së futur në këtë proces me temperaturën në të cilën është futur.
Në një proces përfundimtar të kthyeshëm, ndryshimi në entropi mund të llogaritet duke përdorur formulën:
![]()
ku integrali merret nga gjendja fillestare 1 e sistemit në gjendjen përfundimtare 2.
Meqenëse entropia është një funksion i gjendjes, atëherë veti e integralitështë pavarësia e tij nga forma e konturit (shtegut) përgjatë së cilës llogaritet, prandaj, integrali përcaktohet vetëm nga gjendjet fillestare dhe përfundimtare të sistemit.
- Në çdo proces të kthyeshëm ndryshimi i entropisë është 0
(1)
- Këtë e vërteton termodinamikaSsistemi që bën një cikël të pakthyeshëm rritet
Δ S> 0 (2)
Shprehjet (1) dhe (2) zbatohen vetëm për sistemet e mbyllura, nëse sistemi shkëmben nxehtësi me mjedisi i jashtëm, atëherë ështëSmund të sillet në çfarëdo mënyre.
Marrëdhëniet (1) dhe (2) mund të përfaqësohen si pabarazi Clausius
∆S ≥ 0
ato. entropia e një sistemi të mbyllur ose mund të rritet (në rastin e proceseve të pakthyeshme) ose të mbetet konstante (në rastin e proceseve të kthyeshme).
Nëse sistemi bën një kalim ekuilibri nga gjendja 1 në gjendjen 2, atëherë entropia ndryshon
![]()
ku dU dhe δAshkruar për një proces të caktuar. Sipas kësaj formule, ΔSpërcaktohet deri në një konstante shtesë. kuptimi fizik nuk ka vetë entropinë, por ndryshimin e entropive. Le të gjejmë ndryshimin e entropisë në proceset e një gazi ideal.
![]()
ato. ndryshimet e entropisëS Δ S 1→2 i një gazi ideal gjatë kalimit të tij nga gjendja 1 në gjendjen 2 nuk varet nga lloji i procesit.
Sepse për një proces adiabatik δP = 0, pastaj ∆ S= 0 => S= konst , domethënë, një proces i kthyeshëm adiabatik vazhdon në entropi konstante. Prandaj, quhet isentropic.
Në procesi izotermik (T= konst ; T 1 = T 2 : )
![]()
Në një proces izokorik (V= konst ; V 1 = V 2 ; )
![]()
Entropia ka vetinë e aditivitetit: entropia e sistemit është e barabartë me shumën e entropive të trupave të përfshirë në sistem.S = S 1 + S 2 + S 3 + ... Dallimi cilësor midis lëvizjes termike të molekulave dhe formave të tjera të lëvizjes është rastësia, çrregullimi i saj. Prandaj, për të karakterizuar lëvizjen termike, është e nevojshme të futet një masë sasiore e shkallës së çrregullimit molekular. Nëse marrim parasysh një gjendje të caktuar makroskopike të një trupi me vlera mesatare të caktuara të parametrave, atëherë është diçka tjetër përveç një ndryshimi i vazhdueshëm i mikrogjendjeve të afërta që ndryshojnë nga njëra-tjetra në shpërndarjen e molekulave në pjesë të ndryshme të vëllimit dhe në energjia e shpërndarë ndërmjet molekulave. Numri i këtyre mikrogjendjeve në ndryshim të vazhdueshëm karakterizon shkallën e çrregullimit të gjendjes makroskopike të të gjithë sistemit,wquhet probabiliteti termodinamik i një mikrogjendjeje të caktuar. Probabiliteti termodinamikwgjendjet e sistemit është numri i mënyrave në të cilat mund të realizohet një gjendje e caktuar e një sistemi makroskopik, ose numri i mikrogjendeve që zbatojnë një mikrostate të caktuar (w≥ 1, dhe probabiliteti matematik ≤ 1 ).
Ne ramë dakord që të marrim logaritmin e probabilitetit të tij, të marrë me shenjën minus, si masë e papritur të një ngjarjeje: papritshmëria e gjendjes është e barabartë me =-
Sipas Boltzmann, entropiaSsistemet dhe probabiliteti termodinamik janë të lidhura si më poshtë:
S=
ku - Konstanta Boltzmann (![]() ). Kështu, entropia përcaktohet nga logaritmi i numrit të gjendjeve me të cilat mund të realizohet një mikrogjendje e caktuar. Entropia mund të konsiderohet si masë e probabilitetit të gjendjes së sistemit t/d. Formula Boltzmann na lejon t'i japim entropisë interpretimin statistikor të mëposhtëm. Entropia është një masë e çrregullimit të një sistemi. Në të vërtetë, se më shumë numër mikrostate duke realizuar mikrogjendjen e dhënë, aq më shumë entropi. Në gjendjen e ekuilibrit të sistemit - gjendja më e mundshme e sistemit - numri i mikrogjendjeve është maksimal, ndërsa entropia është gjithashtu maksimale.
). Kështu, entropia përcaktohet nga logaritmi i numrit të gjendjeve me të cilat mund të realizohet një mikrogjendje e caktuar. Entropia mund të konsiderohet si masë e probabilitetit të gjendjes së sistemit t/d. Formula Boltzmann na lejon t'i japim entropisë interpretimin statistikor të mëposhtëm. Entropia është një masë e çrregullimit të një sistemi. Në të vërtetë, se më shumë numër mikrostate duke realizuar mikrogjendjen e dhënë, aq më shumë entropi. Në gjendjen e ekuilibrit të sistemit - gjendja më e mundshme e sistemit - numri i mikrogjendjeve është maksimal, ndërsa entropia është gjithashtu maksimale.
Sepse proceset reale janë të pakthyeshme, atëherë mund të argumentohet se të gjitha proceset në një sistem të mbyllur çojnë në një rritje të entropisë së tij - parimi i rritjes së entropisë. Në interpretimin statistikor të entropisë, kjo do të thotë që proceset në një sistem të mbyllur shkojnë në drejtim të rritjes së numrit të mikrogjendeve, me fjalë të tjera, nga gjendjet më pak të mundshme në ato më të mundshme, derisa probabiliteti i gjendjes të bëhet maksimal.
§7 Ligji i dytë i termodinamikës
Ligji i parë i termodinamikës, duke shprehur ligjin e ruajtjes së energjisë dhe transformimit të energjisë, nuk lejon që dikush të përcaktojë drejtimin e rrjedhës së proceseve t/d. Përveç kësaj, është e mundur të imagjinohet një grup procesesh që nuk kundërshtojnëIfillimi i m/d, në të cilin ruhet energjia, por në natyrë ato nuk realizohen. Formulimet e mundshme të fillimit të dytë t/d:
1) ligji i rritjes së entropisë së një sistemi të mbyllur gjatë proceseve të pakthyeshme: çdo proces i pakthyeshëm në një sistem të mbyllur ndodh në atë mënyrë që entropia e sistemit të rritet ΔS≥ 0 (proces i pakthyeshëm) 2) ΔS≥ 0 (S= 0 për të kthyeshme dhe ΔS≥ 0 për proces të pakthyeshëm)
Në proceset që ndodhin në një sistem të mbyllur, entropia nuk zvogëlohet.
2) Nga formula Boltzmann S =, prandaj, një rritje e entropisë nënkupton një kalim të sistemit nga një gjendje më pak e mundshme në një gjendje më të mundshme.
3) Sipas Kelvin: një proces rrethor nuk është i mundur, rezultati i vetëm i të cilit është shndërrimi i nxehtësisë së marrë nga ngrohësi në punë ekuivalente me të.
4) Sipas Clausius: një proces rrethor nuk është i mundur, rezultati i vetëm i të cilit është transferimi i nxehtësisë nga një trup më pak i nxehtë në një trup më të nxehtë.
Për të përshkruar sistemet t/d në 0 K, përdoret teorema Nernst-Planck (ligji i tretë i t/d): entropia e të gjithë trupave në ekuilibër tenton në zero kur temperatura i afrohet 0 K.
Nga teorema Nernst-Planck e ndjek këtëC p= C v = 0 në 0 te
§8 Makina termike dhe ftohëse.
Cikli Carnot dhe efikasiteti i tij
Nga formulimi i ligjit të dytë të t / d sipas Kelvin, rezulton se një makinë e lëvizjes së përhershme e llojit të dytë është e pamundur. (Një makinë me lëvizje të përhershme është një motor që funksionon periodikisht që funksionon duke ftohur një burim nxehtësie.)
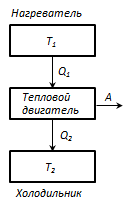 Termostat- ky është një sistem t / d që mund të shkëmbejë nxehtësinë me trupat pa ndryshuar temperaturën.
Termostat- ky është një sistem t / d që mund të shkëmbejë nxehtësinë me trupat pa ndryshuar temperaturën.
Parimi i funksionimit të një motori termik: nga një termostat me një temperaturë T 1 - ngrohës, sasia e nxehtësisë hiqet për cikëlP 1 , dhe termostat me temperaturë T 2 (T 2 < T 1) - frigorifer, sasia e nxehtësisë së transferuar për cikëlP 2 , gjatë kryerjes së punës POR = P 1 - P 2
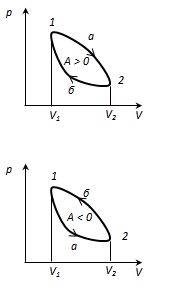 Procesi ose cikël rrethorështë procesi në të cilin sistemi, pasi ka kaluar nëpër një sërë gjendjesh, kthehet në gjendjen e tij origjinale. Në diagramin e gjendjes, cikli përfaqësohet nga një kurbë e mbyllur. Cikli që gaz ideal, mund të ndahet në proceset e zgjerimit (1-2) dhe tkurrjes (2-1), puna e zgjerimit është pozitive. POR 1-2 > 0, sepseV 2
>
V 1
, puna e kompresimit është negative POR 1-2 < 0, т.к.
V 2
<
V 1
. Prandaj, puna e bërë nga gazi për cikël përcaktohet nga zona e mbuluar nga kurba e mbyllur 1-2-1. Nëse puna pozitive kryhet në një cikël (cikli është në drejtim të akrepave të orës), atëherë cikli quhet i drejtpërdrejtë, nëse është një cikël i kundërt (cikli ndodh në drejtim të kundërt të akrepave të orës).
Procesi ose cikël rrethorështë procesi në të cilin sistemi, pasi ka kaluar nëpër një sërë gjendjesh, kthehet në gjendjen e tij origjinale. Në diagramin e gjendjes, cikli përfaqësohet nga një kurbë e mbyllur. Cikli që gaz ideal, mund të ndahet në proceset e zgjerimit (1-2) dhe tkurrjes (2-1), puna e zgjerimit është pozitive. POR 1-2 > 0, sepseV 2
>
V 1
, puna e kompresimit është negative POR 1-2 < 0, т.к.
V 2
<
V 1
. Prandaj, puna e bërë nga gazi për cikël përcaktohet nga zona e mbuluar nga kurba e mbyllur 1-2-1. Nëse puna pozitive kryhet në një cikël (cikli është në drejtim të akrepave të orës), atëherë cikli quhet i drejtpërdrejtë, nëse është një cikël i kundërt (cikli ndodh në drejtim të kundërt të akrepave të orës).
cikli i drejtpërdrejtë përdoret në motorët me nxehtësi - motorë që funksionojnë periodikisht që kryejnë punë për shkak të nxehtësisë së marrë nga jashtë. Cikli i kundërt përdoret në makina frigoriferike- instalimet që funksionojnë periodikisht, në të cilat për shkak të punës forcat e jashtme nxehtësia transferohet në një trup me temperaturë më të lartë.
Si rezultat i një procesi rrethor, sistemi kthehet në gjendjen e tij origjinale dhe, rrjedhimisht, një ndryshim i plotë. energjia e brendshme barazohet me zero. PastajІ start t/d për procesin rrethor
P= Δ U+ A= A,
Kjo do të thotë, puna e bërë për cikël është e barabartë me sasinë e nxehtësisë së marrë nga jashtë, por
P= P 1 - P 2
P 1 - sasia nxehtësia e marrë nga sistemi,
P 2 - sasia nxehtësia e lëshuar nga sistemi.
Efikasiteti termik për një proces rrethor është i barabartë me raportin e punës së bërë nga sistemi me sasinë e nxehtësisë së furnizuar në sistem:
![]()
Për η = 1, kushtiP 2 = 0, d.m.th. motori i nxehtësisë duhet të ketë një burim nxehtësieP 1 , por kjo bie ndesh me ligjin e dytë të t/d.
Procesi i kundërt me atë që ndodh në një motor ngrohjeje përdoret në një makinë ftohëse.
 Nga termostati me temperaturë T 2 sasia e nxehtësisë hiqetP 2
dhe transmetohet në termostat me temperaturëT 1
, sasia e nxehtësisëP 1
.
Nga termostati me temperaturë T 2 sasia e nxehtësisë hiqetP 2
dhe transmetohet në termostat me temperaturëT 1
, sasia e nxehtësisëP 1
.
P= P 2 - P 1 < 0, следовательно A< 0.
Pa bërë punë, është e pamundur të marrësh nxehtësi nga një trup më pak i nxehtë dhe t'ia japësh një trupi më të nxehtë.
Bazuar në ligjin e dytë të t/d, Carnot nxori një teoremë.
Teorema e Carnot: e të gjithë motorëve të nxehtësisë që funksionojnë periodikisht me të njëjtat temperatura ngrohës ( T 1) dhe frigoriferë ( T 2), efikasiteti më i lartë. kanë makina të kthyeshme. K.P.D. makina të kthyeshme për të barabartë T 1 dhe T 2 janë të barabarta dhe nuk varen nga natyra e lëngut punues.
Trupi punues është një trup që kryen një proces rrethor dhe shkëmben energji me trupa të tjerë.
Cikli Carnot është cikli i kthyeshëm më ekonomik, i përbërë nga 2 izoterma dhe 2 adiabate.
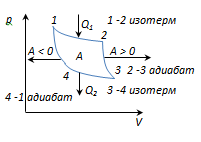 1-2-zgjerimi izotermik në T 1 ngrohës; ngrohjes i jepet gazitP 1
dhe puna është bërë
1-2-zgjerimi izotermik në T 1 ngrohës; ngrohjes i jepet gazitP 1
dhe puna është bërë![]()
2-3 - adiabat. zgjerimi, gazi funksiononA 2-3 >0 mbi trupat e jashtëm.
3-4 ngjeshje izotermike në T 2 frigoriferë; i hiqet nxehtësiaP 2
dhe puna është bërë![]() ;
;
4-1-ngjeshja adiabatike, punohet në gaz Një 4-1 <0 внешними телами.
Në një proces izotermikU= konst , pra P 1 = A 12
![]() 1
1
Me zgjerim adiabatikP 2-3 = 0, dhe puna me gaz A 23 bëhet me energji të brendshme A 23 = - U
![]()
Sasia e nxehtësisëP 2 , i dhënë nga gazi në frigorifer gjatë kompresimit izotermik është i barabartë me punën e ngjeshjes POR 3-4
![]() 2
2
Puna e ngjeshjes adiabatike
![]()
Puna e kryer në një proces rrethor
A = A 12 + A 23 + A 34 + A 41 = P 1 + A 23 - P 2 - A 23 = P 1 - P 2
dhe është e barabartë me sipërfaqen e kurbës 1-2-3-4-1.
Efikasiteti termik Cikli Carnot
![]()
Nga ekuacioni adiabatik për proceset 2-3 dhe 3-4 marrim
Pastaj ![]()
![]()
ato. efikasiteti Cikli Carnot përcaktohet vetëm nga temperaturat e ngrohësit dhe ftohësit. Për të rritur efikasitetin duhet të rritet diferenca T 1 - T 2 .
******************************************************* ******************************************************






