Nën pikën e vlimit të një lëngu, ndodh avullimi. Tretësirat ziejnë në një temperaturë më të lartë se tretësit e pastër. Cikli teorik dhe real i ftohjes
vlimi, procesi i avullimit në një lëng, duke përfshirë lindjen e flluskave të avullit, rritjen, lëvizjen dhe ndërveprimin e tyre; tranzicioni fazor joekuilibrues i llojit të parë.
Zierja shkaktohet nga mbinxehja e një lëngu, gjendja e të cilit bie në rajonin mbi vijën e ekuilibrit lëng-avull (binodal 1, figura), ose nga një ulje e presionit nën vlerën e tij në vijën e ekuilibrit. Në diagramin fazor, procesi i vlimit përshkruhet nga një trajektore ose një pikë brenda rajonit të gjendjes metastabile (të mbinxehur), e kufizuar nga njëra anë nga binodalja (varësia e temperaturës së vlimit të ekuilibrit nga presioni), nga ana tjetër. , nga spinodal (kufiri i qëndrueshmërisë termodinamike të lëngut). Pika e ekuilibrit të vlimit në presionin atmosferik zakonisht jepet si një nga karakteristikat kryesore fiziko-kimike të një lënde kimikisht të pastër. Kur një lëng shtrihet, vërehet fenomeni i kavitacionit, i ngjashëm me vlimin.
Presioni i avullit në një flluskë pothuajse ekuilibër p p balancohet nga presioni i lëngut p l dhe tensioni ndërfaqesor σ dhe lidhet me presionin avull i ngopur mbi një sipërfaqe horizontale në të njëjtën temperaturë Kelvin nga ekuacioni. Rrezja kritike e flluskës në përputhje me ligjin e Laplace është e barabartë me
R cr = 2σ/(r p −r w),
dhe për R< R кp пузырьки схлопываются, при R >R kp - rriten.
Procesi i lindjes së flluskave të avullit në vëllimin e një lëngu të pastruar homogjen ndodh për shkak të luhatjeve termodinamike në densitetin e lëngut. Ky proces zhvillohet me mbinxehje të lartë të lëngut. Në vëllimin e lëngut të papërpunuar dhe në kufijtë me fazën e ngurtë (afër mureve të enës), zakonisht (ose shfaqen përkohësisht) zona të lindjes preferenciale të flluskave - qendra vlimi, të cilat mund të jenë të dyja luhatëse (të lagura dobët). zona, zona me përqendrim të shtuar të një përbërësi me valë të lehtë, zona të një reaksioni ekzotermik etj.), dhe të gatshme, tashmë të pranishme në lëng (flluska gazi të patretur, flluska gazi ose avulli në mikroçarje me lagështim jo të plotë të një trupi të ngurtë sipërfaqe). Me vlimin e zhvilluar, qendrat e vlimit rinovohen kur avulli kapet nga mikrodepresioni (poret) në sipërfaqen e nxehtë.
Në aparatet industriale, zierja zakonisht sigurohet nga qendra të gatshme dhe mbinxehja mbi pikën e vlimit të ekuilibrit është e vogël (në presion atmosferik më të vogël se 10 K). Me një fuqi të lartë të lëshimit të nxehtësisë në proceset shpërthyese, mbinxehja e arritshme e lëngut është shumë më e lartë dhe realizohen regjimet e prodhimit të flluskave të luhatjeve.
Të dallojë vlimin vëllimor dhe sipërfaqësor (mur). Në zierjen sipërfaqësore, burimi kryesor i flluskave të avullit është shtresa e lëngshme ngjitur me sipërfaqen e nxehtë. Nëse vëllimi i lëngut ka një temperaturë nën temperaturën e ekuilibrit në binodal (e ashtuquajtura vlimi me nënftohje), atëherë flluskat e avullit të formuara pranë sipërfaqes së nxehtë, duke rënë në shtresat e ftohta të lëngut gjatë migrimit, shemben. Zierja me shumicë ndodh kur lëngu mbinxehet në të gjithë vëllimin e tij (ose kur presioni zvogëlohet). Në këtë rast, flluska avulli lindin në të gjithë vëllimin e lëngut.
Rritja e flluskave gjatë zierjes ka një efekt mekanik (hidrodinamik) në sistemin në tërësi. Në veçanti, në një vëllim të mbyllur të një lëngu të mbinxehur, ndërsa përmbajtja e avullit rritet, presioni rritet. Në rrjedhat nënsonike të lëngut të vluar të kufizuar nga mure të ngurta (për shembull, në tuba), një rritje në përmbajtjen e avullit në rrjedhën e poshtme shoqërohet me një ulje të presionit. Ndërsa flluskat e avullit rriten dhe shemben, ato rrezatojnë valë akustike - ndodh zhurma e vlimit. Rritja e shpejtë e presionit gjatë zierjes, e cila ndodh kur një lëng nxehet mjaft shpejt (modaliteti i vlimit shpërthyes), mund të çojë në të ashtuquajturin shpërthim me avull me shkatërrimin e strukturave. Flluskat e avullit që notojnë lart në fushën gravitacionale shkaktojnë rrjedha shtesë konvektive, të cilat kontribuojnë në përzierjen e lëngut dhe vlimi sipërfaqësor shkakton lëvizjen e turbullt të shtresës afër murit të lëngut.
Në vlimin e bërthamave sipërfaqësore, me një rritje të temperaturës së ngrohësit, largimi i nxehtësisë nga sipërfaqja rritet derisa të fillojë kriza e vlimit. Kriza e vlimit është pasojë e kalimit nga zierja bërthamore në vlimin e filmit, kur flluskat në sipërfaqen e nxehtë zëvendësohen nga një shtresë avulli. Kriza e vlimit çon në një përkeqësim të heqjes së nxehtësisë dhe është e rrezikshme për një numër pajisjesh energjetike.
Përdorimi i proceseve të vlimit në jetën e përditshme, shkencën dhe teknologjinë është i larmishëm. Zierja sipërfaqësore përdoret gjerësisht për ftohjen intensive të sipërfaqes - heqjen e nxehtësisë (për shembull, në reaktorët bërthamorë, motorët reaktiv, gjatë ftohjes së elementeve të pajisjeve elektronike). Zierja përdoret për të rritur sipërfaqen e avullimit në impiantet e shkripëzimit, në kaldaja me avull në termocentralet, dhomat e flluskave për vizualizimin e gjurmëve grimcat elementare, në ftohje, procese korrigjimi, teknologji të ndryshme kimike, industri ushqimore etj.
Lit .: Skripov V.P. Lëng metastabile. M., 1972; Prisnyakov VF Zierje. K., 1988; Labuntsov D. A. Bazat fizike energji. M., 2000.
Dihet se çdo substancë vlon në vlera të caktuara të temperaturës dhe presionit të jashtëm.
Zierja është procesi i avullimit të një lëngu, i shoqëruar nga formimi dhe rritja e shpejtë e flluskave të avullit që çajnë sipërfaqen e lëngut në pjesën e jashtme.
Merrni parasysh kushtet në të cilat ndodh procesi i zierjes.
Një flluskë avulli në një lëng mund të formohet nëse një zonë me densitet të ulët formohet në një pikë në lëng. Në parim, një rajon i tillë mund të formohet, pasi për shkak të natyrës kaotike të lëvizjeve termike, devijimet e rastësishme nga shpërndarja mesatare uniforme e grimcave në vëllim janë jo vetëm të mundshme, por edhe të pashmangshme. Devijimet e tilla nga mesatarja, siç u përmend tashmë, quhen luhatje. Flluskat në avull dhe janë formuar në rendin e luhatjeve. Megjithatë, duhet mbajtur parasysh sa vijon.
Dendësia e një avulli në një temperaturë larg nga ajo kritike është mijëra herë më e vogël se dendësia e një lëngu. Prandaj, në mënyrë që të formohet një flluskë, nevojitet një luhatje shumë domethënëse: duhet të formohet aksidentalisht një rajon në të cilin dendësia e grimcave është mijëra herë më e vogël se në pjesën tjetër të vëllimit! Është e qartë se probabiliteti i një luhatjeje të tillë është shumë i vogël. Për më tepër, nuk ka gjasa që ai të mbulojë ndonjë vëllim të rëndësishëm. Në shumicën dërrmuese të rasteve, flluskat, nëse formohen, janë shumë të vogla në madhësi. Por në këtë rast ata nuk kanë kushtet për rritje. Në fund të fundit, një flluskë është një enë me avull i ngopur(sepse ena është e mbyllur), dhe muret e enës janë sipërfaqja konkave e lëngut që rrethon flluskën. Për shkak të lakimit të sipërfaqes, ekziston një forcë e drejtuar drejt qendrës së lakimit. Kjo forcë do ta shtypë flluskën, sepse në madhësi të vogla flluskë është shumë e madhe.
Duket se në kushte të tilla, flluska avulli në një lëng nuk mund të formohen fare, që do të thotë se zierja është gjithashtu e pamundur. Megjithatë, situata ndryshon ndjeshëm nëse në vetë lëngun ose në muret e enës në të cilën është mbyllur, ka ajër të tretur ose të përthithur (të përthithur) (ose ndonjë gaz tjetër). Në këtë rast, kur lëngu nxehet, formohen flluska gazi, dhe formimi i tyre nuk shoqërohet me luhatje në densitetin e lëngut. Prandaj, ato nuk duhet të jenë shumë të vogla që në fillim dhe presioni i lidhur me lakimin e sipërfaqes nuk duhet t'i shtypë ato.
Flluskat e gazit, pra, luajnë të njëjtin rol në fenomenin e avullimit (valimit) siç luajnë grimcat e pluhurit ose jonet në fenomenin e kondensimit, d.m.th., rolin e bërthamave.
Pra, le, për një arsye ose një tjetër, një flluskë gazi të formohet në lëng. Pas formimit të tij, ai mbushet menjëherë me avujt e ngopur të lëngut përreth dhe do të jetë në ekuilibër me të. Presioni i avullit brenda flluskës përcaktohet qartë nga temperatura e lëngut. Për sa kohë që temperatura e lëngut është e tillë që presioni i avullit të ngopur brenda flluskës është më i vogël se presioni i jashtëm mbi lëngun, flluska nuk mund të rritet, sepse edhe tani nuk ka mungesë të Forcave që përpiqen ta shtypin atë. Ende ekziston një forcë e lidhur me lakimin e sipërfaqes së lëngut në flluskë. Përveç kësaj, flluska ndikohet nga presioni hidrostatik i kolonës së lëngshme mbi të. Së fundi, një presion i jashtëm vepron në flluskë, nën të cilën ndodhet i gjithë lëngu dhe është ky presion që luan rolin kryesor. Dy forcat e mbetura lehtësojnë vetëm shtypjen e flluskës nga presioni i jashtëm.
Por kur temperatura e lëngut arrin një vlerë në të cilën elasticiteti i avullit të tij të ngopur bëhet i barabartë me presionin e jashtëm, presioni i avullit brenda flluskës do të jetë gjithashtu i barabartë me presionin e jashtëm (nëse nuk marrim parasysh presionin hidrostatik dhe presioni i shkaktuar nga lakimi i sipërfaqes). Atëherë rritja më e vogël e temperaturës është e mjaftueshme që presioni i avullit brenda flluskës të kalojë atë të jashtëm: nën ndikimin e këtij ndryshimi presioni, flluska do të fillojë të fryhet shpejt dhe përfundimisht do të notojë lart dhe do të shpërthejë;
Kjo do të thotë që gjatë zierjes, lëngu avullon jo vetëm nga sipërfaqja e lëngut, por edhe nga sipërfaqja e flluskave brenda lëngut. Në mënyrë që lëngu të vlojë, është e nevojshme të sillni temperaturën e tij në një vlerë në të cilën elasticiteti avujt e ngopur i këtij lëngu është i barabartë me presionin e jashtëm (më saktë, disi më shumë).
Është e qartë se sa më i ulët të jetë presioni i jashtëm, aq më e ulët është pika e vlimit të lëngut. Kjo shpjegon mirë fakt i njohur që në lartësi të mëdha ku Presioni i atmosferës të ulëta, lëngjet ziejnë në temperatura më të ulëta se në nivelin e detit. Duke matur pikën e vlimit të një lëngu, mund të përcaktoni presionin barometrik dhe rrjedhimisht lartësinë mbi nivelin e detit. Pajisja përkatëse quhet hipsotermometër.
Uji, normalisht (d.m.th., në një presion të jashtëm prej 1 atm) që vlon në 100 ° C (është në këtë temperaturë që elasticiteti i avullit të ujit të ngopur është 1 atm), mund të vlojë edhe në temperaturën e dhomës, nëse pompohet intensivisht ajri dhe avujt mbi sipërfaqen e tij ulin mjaftueshëm presionin e jashtëm mbi të.
Është e lehtë të përcaktohet varësia e pikës së vlimit të një lëngu nga presioni i jashtëm. Në të vërtetë, më lart kemi
formula (105.6), e cila përcakton varësinë e elasticitetit të avujve të ngopur të një lëngu nga temperatura:
(Formula Clapeyron-Clausius). Meqenëse, në momentin e vlimit, presioni i jashtëm është vetëm i barabartë me elasticitetin e avullit të ngopur të lëngut, është e qartë se nëse e kthejmë ekuacionin Clausius-Clapeyron, atëherë do të marrim varësinë e pikës së vlimit të lëngut nga presioni i jashtëm. Prandaj, kjo varësi duket si kjo:
![]()
Mbinxehje e lëngshme. Nga sa u tha më sipër, është e qartë se fenomeni i vlimit mund të ndodhë vetëm nëse në lëng mund të krijohen flluska gazi dhe për këtë lëngu duhet të përmbajë gazra të tretur në të. Mund të thuhet se, ashtu si kondensimi është i mundur vetëm në prani të qendrave të kondensimit (grimcat e pluhurit, jonet), vlimi, d.m.th., avullimi intensiv, kërkon praninë e qendrave të avullimit, të cilat janë flluska gazi. (Tranzicionet fazore që ndodhin vetëm në prani të bërthamave quhen tranzicionet fazore lloji i parë.)
Në mungesë të qendrave të kondensimit, është e mundur, siç kemi parë, të merret avulli i mbingopur. Në të njëjtën mënyrë, në mungesë të gazeve të tretur në lëng që mund të formojnë flluska, mund të merret një lëng i mbinxehur, d.m.th., një lëng, temperatura e të cilit është më e lartë se pika e vlimit në një presion të jashtëm të caktuar, por që megjithatë, të mos ziejë.
Mundësia e mbinxehjes së lëngut shoqërohet me presionin shtesë që lëngu përjeton nën sipërfaqen e lakuar. Në të vërtetë, sipërfaqja sferike e lëngut që rrethon flluskën tenton të tkurret. Presioni që rezulton
drejtuar drejt qendrës së flluskës, d.m.th., i shtohet presionit të jashtëm duke shtypur flluskën. Dhe në madhësi të vogla flluskash arrin një vlerë shumë domethënëse. Prandaj, nëse lëngu që do të ngrohet dhe muret e enës në të cilën ndodhet pastrohen me kujdes nga gazrat e tretur, formimi i flluskave në lëng është aq i vështirë sa mund të nxehet pa vluar në një temperaturë shumë më të lartë se sa pikë vlimi. Më saktësisht, lëngu mund të mbinxehet në një temperaturë në të cilën elasticiteti
i avullit të ngopur në flluska nuk e kalon presionin e jashtëm plus presionin e shkaktuar nga lakimi i sipërfaqes së flluskave më të vogla.
Siç e kemi parë, formimi i flluskave të avullit në temperatura të ulëta është praktikisht i pamundur për faktin se kjo kërkon luhatje të mëdha të densitetit, probabiliteti i të cilave është shumë i vogël. Por me rritjen e temperaturës, ndryshimi në densitetin e lëngut dhe avullit zvogëlohet (në temperaturën kritike, ai zhduket fare). Prandaj, luhatjet e densitetit të nevojshëm për formimin e flluskave bëhen gjithnjë e më pak të rëndësishme. Prandaj, probabiliteti i tyre rritet. Kur mjafton temperaturë të lartë(i lartë do të thotë afër temperaturës kritike) flluskat mund të formohen dhe të rriten edhe në mungesë të bërthamave në formën e flluskave të gazit. Kjo do të thotë se në këtë rast, zierja e një lëngu është gjithashtu e mundur, por vetëm e mbinxehur. Dhe sa më shumë të pastrohet lëngu, aq më i fortë mund të mbinxehet.
Kur lëng i mbinxehur megjithatë, në fund, ajo vlon, pastaj vlimi ndodh shumë dhunshëm, i ngjan një shpërthimi. Në këtë rast, lëngu ftohet me shpejtësi deri në pikën normale të vlimit në një presion të caktuar.
Mbinxehja e lëngut dhe vlimi i dhunshëm pasues janë një rrezik i madh për enën në të cilën është mbyllur lëngu. Prandaj, merren masa të veçanta për të parandaluar mbinxehjen. Për ta bërë këtë, trupat porozë vendosen në lëng, nga të cilët ajri lëshohet me bollëk kur nxehet. Trupa të tillë janë tubat qeramikë (porcelani i papjekur, për shembull) ose zbukurimet e tubave kapilar.
Nuk është e vështirë të përcaktohet madhësia e flluskave, të cilat garantojnë kundër mbinxehjes së dukshme të lëngut. Le të bëjmë një vlerësim të tillë për ujin. Në këtë rast, do të supozojmë se mbinxehja e ujit me presion normal të jashtëm me 0,1 gradë është e lejueshme.
Sa duhet të jetë madhësia e flluskave në mënyrë që mbinxehja të mos e kalojë këtë vlerë?
Për ta bërë këtë, është e nevojshme të përcaktohet se sa do të rritet presioni i avullit kur temperatura rritet nga 100 në. Kjo mund të bëhet duke përdorur kurbën e varësisë nga temperatura e presionit të avullit të ujit. Nga kjo kurbë mund të përcaktohet se një ndryshim i temperaturës me 0,1° shkakton një ndryshim të presionit të avullit me . Prandaj, në mënyrë që mbinxehja të mos kalojë 0,1°, është e nevojshme që rrezja mesatare e flluskave të jetë jo më e vogël se
![]()
Le të vlerësojmë gjithashtu ndikimin e presionit hidrostatik të përjetuar nga flluskat në mbinxehjen e lëngut.
Në një thellësi nën sipërfaqen e lëngshme, një flluskë gazi përjeton presion
I shtohet presionit të jashtëm (si dhe presionit për shkak të lakimit të sipërfaqes së flluskës), dhe me këtë sasi presioni i avullit brenda flluskës duhet të rritet në mënyrë që ajo të notojë. Nga e njëjta kurbë mund të gjendet se sa ndryshon temperatura e ujit në vlim me thellësinë nën sipërfaqe. Shih, për shembull,
Kjo korrespondon me një rritje të pikës së vlimit me
Temperatura e ujit të vluar nuk është, siç e shohim, një vlerë e përcaktuar mirë. Për arsyet që sapo kemi shqyrtuar, ai luhatet brenda kufijve të vegjël. Jo vetë uji i vluar, por avulli i ujit mbi të, ka një temperaturë mjaft të caktuar, pasi, pavarësisht se çfarë ndodh brenda lëngut, avulli që del nga flluskat që shpërthejnë në sipërfaqen e tij ka një temperaturë mjaft të caktuar - temperaturën në të cilën elasticiteti i avujve të ngopur është i barabartë me presionin e jashtëm. Kjo është arsyeja pse, kur kalibroni termometrat, ato vendosen jo në ujë të valë, por në avuj mbi të.
dhomë flluskë. Në dhomën e reve, siç e kemi parë, përdoret mbingopja e avullit dhe kondensimi i avullit të mbingopur në jonet si qendra kondensimi. Në mënyrë të ngjashme, dhe për të njëjtat qëllime, d.m.th., për të zbuluar grimcat e shpejta, mund të përdoret edhe fenomeni i mbinxehjes së një lëngu me formimin e mëvonshëm të flluskave në të. Ky parim është baza për funksionimin e të ashtuquajturës dhomë flluskë, e cila kohët e fundit është bërë e përhapur në kërkime në fushën e fizika bërthamore dhe fizika e grimcave me energji të lartë.
Dhoma e flluskës është një enë me një lëng që mund të mbinxehet duke përdorur një ngrohës. Kjo anije është e lidhur me një pajisje që ju lejon të krijoni një presion të rritur mbi lëngun dhe të hiqni shpejt këtë presion. Nëse fillimisht e ngrohni lëngun dhe e ngjeshni me presion të jashtëm, dhe më pas hiqni presionin e jashtëm, atëherë lëngu, natyrisht, do të mbinxehet, por gjatë kohës së mjaftueshme për eksperimentin (disa dhjetëra sekonda), ai nuk vlon. . Nëse në këtë moment një grimcë e shpejtë fluturon në dhomë, atëherë në rrugën e saj në lëng do të humbasë një pjesë të energjisë së saj, e cila do të shndërrohet kryesisht në nxehtësi. Meqenëse lëngu është mbinxehur, kjo nxehtësi shtesë është e mjaftueshme për formimin intensiv të flluskave në rrugën e grimcave. Flluskat që rezultojnë rriten me shpejtësi në madhësitë në të cilat ato
bëhen të dukshme, në mënyrë që zinxhiri i flluskave - gjurma e grimcës - të mund të fotografohet.
Nëse një dhomë re e mbushur me avull të lirshëm mund të depërtojë përmes një grimce, atëherë në një dhomë flluskë të mbushur me një substancë të dendur - të lëngshme, grimca kalon gjatë gjithë rrugës pa dalë nga dhoma, gjë që lehtëson studimin e vetive të kësaj grimce. Ky është një nga avantazhet e rëndësishme të dhomës së flluskës.
Detaje Kategoria: Teoria molekulare-kinetike Postuar më 09.11.2014 21:08 Shikime: 8345Në një gjendje të lëngshme, një substancë mund të ekzistojë në një interval të caktuar të temperaturës. Në një temperaturë nën vlerën më të ulët të këtij intervali, lëngu kthehet në një të ngurtë. Dhe nëse vlera e temperaturës tejkalon kufirin e sipërm të intervalit, lëngu kalon në gjendje e gaztë.
Të gjitha këto mund t'i vëzhgojmë në shembullin e ujit. Në gjendje të lëngshme, ne e shohim atë në lumenj, liqene, dete, oqeane, një rubinet uji. Gjendja e ngurtë uji është akull. Ai shndërrohet në të kur, në presion normal atmosferik, temperatura e tij bie në 0 o C. Dhe kur temperatura rritet në 100 o C, uji vlon dhe shndërrohet në avull, që është gjendja e tij e gaztë.
Procesi i shndërrimit të një substance në avull quhet avullimi. Procesi i kundërt i ndryshimit nga avulli në lëng është kondensimi .
Avullimi ndodh në dy raste: gjatë avullimit dhe gjatë zierjes.
Avullimi
Avullimi është procesi fazor i kalimit të një substance nga gjendje e lëngshme në të gaztë ose avull, që ndodhin në sipërfaqen e lëngut .
Ashtu si me shkrirjen, nxehtësia absorbohet nga një substancë gjatë avullimit. Shpenzohet për tejkalimin e forcave kohezive të grimcave (molekulave ose atomeve) të lëngut. Energjia kinetike molekulat me shpejtësinë më të madhe i tejkalon ato energji potenciale ndërveprimet me molekula të tjera të lëngshme. Për shkak të kësaj, ata kapërcejnë tërheqjen e grimcave fqinje dhe fluturojnë nga sipërfaqja e lëngut. Energjia mesatare e grimcave të mbetura bëhet më e vogël, dhe lëngu gradualisht ftohet nëse nuk nxehet nga jashtë.
Meqenëse grimcat janë në lëvizje në çdo temperaturë, ndodh edhe avullimi. në çdo temperaturë. Ne e dimë se pellgjet thahen pas shiut, edhe në mot të ftohtë.
Por shkalla e avullimit varet nga shumë faktorë. Një nga më të rëndësishmet - temperatura e substancës. Sa më i lartë të jetë, aq më e madhe është shpejtësia e grimcave dhe energjia e tyre, dhe aq më i madh është numri i tyre që largohet nga lëngu për njësi të kohës.
Mbushni 2 gota me të njëjtën sasi uji. Njërën e vendosim në diell dhe tjetrën e lëmë në hije. Pas pak, do të shohim se në gotën e parë ka më pak ujë sesa në të dytën. Ngrohej nga rrezet e diellit dhe avullonte më shpejt. Pellgjet pas shiut gjithashtu thahen shumë më shpejt në verë sesa në pranverë ose në vjeshtë. Në nxehtësi ekstreme, ndodh avullimi i shpejtë i ujit nga sipërfaqet e rezervuarëve. Pellgjet dhe liqenet po thahen, shtretërit e lumenjve të cekët po thahen. Sa më e lartë të jetë temperatura mjedisi, aq më e lartë është shkalla e avullimit.
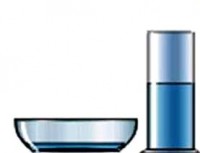
Me të njëjtin vëllim, lëngu në një pjatë të gjerë do të avullojë shumë më shpejt se lëngu i derdhur në një gotë. Do të thotë se shkalla e avullimit varet nga sipërfaqja e avullimit . Sa më e madhe kjo zonë, aq më i madh është numri i molekulave që fluturojnë nga lëngu për njësi të kohës.
Me të njëjtën kushtet e jashtme Shpejtësia e avullimit varet nga lloji i substancës . Mbushni shishet e qelqit me të njëjtin vëllim uji dhe alkooli. Pas pak, do të shohim se ka mbetur më pak alkool se uji. Ai avullon me një shpejtësi më të shpejtë. Kjo ndodh sepse molekulat e alkoolit ndërveprojnë më dobët me njëra-tjetrën sesa molekulat e ujit.
ndikojnë në shpejtësinë e avullimit dhe prania e erës . Ne e dimë se gjërat pas larjes thahen shumë më shpejt kur i fryn era. Rrjedha e ajrit të nxehtë në një tharëse flokësh mund të na thajë shpejt flokët.
Era i merr me vete molekulat që kanë dalë nga lëngu dhe ato nuk kthehen më. Vendin e tyre e zënë molekula të reja që largohen nga lëngu. Prandaj, ato bëhen më pak në vetë lëngun. Prandaj, avullon më shpejt.
Sublimimi

Avullimi bëhet në të ngurta Oh. Ne shohim se si liri i ngrirë, i mbuluar me akull thahet gradualisht në të ftohtë. Akulli kthehet në avull. Ne nuhasim aromën e mprehtë të prodhuar nga avullimi lëndë e ngurtë naftalinë.
Disa substanca nuk kanë fare fazë të lëngshme. Për shembull, jodi elementarI 2 - një substancë e thjeshtë, e cila është kristale gri të zezë me një shkëlqim metalik të purpurt, në kushte normale shndërrohet menjëherë në jod të gaztë - avull vjollcë me erë të athët. Jodi i lëngshëm që blejmë në barnatore nuk është gjendja e tij e lëngshme, por një tretësirë e jodit në alkool.
Procesi i kalimit të trupave të ngurtë në gjendje të gaztë, duke anashkaluar fazën e lëngshme, quhet sublimimi, ose sublimimi .
Duke zier

Duke zier Ky është gjithashtu procesi i shndërrimit të lëngut në avull. Por avullimi gjatë zierjes ndodh jo vetëm në sipërfaqen e lëngut, por në të gjithë vëllimin e tij. Për më tepër, ky proces është shumë më intensiv sesa gjatë avullimit.
Vendosni një kazan me ujë në zjarr. Meqenëse gjithmonë ka ajër të tretur në ujë, kur nxehet, shfaqen flluska në fund të kazanit dhe në muret e tij. Këto flluska përmbajnë ajër dhe avuj uji të ngopur. Fillimisht ato shfaqen në muret e çajnikut. Sasia e avullit në to rritet, dhe ato vetë rriten në madhësi. Pastaj, nën ndikimin e forcës lundruese të Arkimedit, ata do të shkëputen nga muret, do të ngrihen dhe do të shpërthejnë në sipërfaqen e ujit. Kur temperatura e ujit arrin 100 ° C, flluska do të formohen në të gjithë vëllimin e ujit.
Avullimi ndodh në çdo temperaturë, dhe vlimi ndodh vetëm në një temperaturë të caktuar, e cila quhet pikë vlimi .
Çdo substancë ka pikën e vet të vlimit. Varet nga sasia e presionit.
Në presion normal atmosferik, uji vlon në një temperaturë prej 100 o C, alkooli - në 78 o C, hekuri - në 2750 o C. Dhe pika e vlimit të oksigjenit është minus 183 o C.
Me uljen e presionit, pika e vlimit zvogëlohet. Në male, ku presioni atmosferik është më i ulët, uji vlon në një temperaturë më të vogël se 100 o C. Dhe sa më i lartë mbi nivelin e detit, aq më e ulët do të jetë pika e vlimit. Dhe në një tenxhere me presion, ku krijohet presion i shtuar, uji vlon në një temperaturë mbi 100 o C.
Avull i ngopur dhe i pangopur
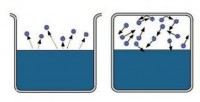
Nëse një substancë mund të ekzistojë njëkohësisht në një fazë të lëngshme (ose të ngurtë) dhe në një të gaztë, atëherë gjendja e saj e gaztë quhet traget . Avulli përbëhet nga molekula që ikin nga një lëng ose i ngurtë gjatë avullimit.
Lëngun e derdhim në enë dhe e mbyllim fort me kapak. Pas një kohe, sasia e lëngut do të ulet për shkak të avullimit të tij. Molekulat që largohen nga lëngu do të përqendrohen mbi sipërfaqen e tij në formën e avullit. Por kur dendësia e avullit bëhet mjaft e lartë, disa prej tyre do të fillojnë të kthehen përsëri në lëng. Dhe do të ketë gjithnjë e më shumë molekula të tilla. Më në fund, do të vijë një moment kur numri i molekulave që largohen nga lëngu dhe numri i molekulave që kthehen në të do të jenë të barabartë. Në këtë rast, ata thonë se lëngu është në ekuilibër dinamik me avujt e tij . Ky çift quhet i pasur .
Nëse, gjatë avullimit, më shumë molekula fluturojnë nga lëngu sesa kthehen, atëherë avulli i tillë do të jetë të pangopura . avulli i pangopur formohet kur lëngu avullues është në një enë të hapur. Molekulat që e lënë atë shpërndahen në hapësirë. Jo të gjithë kthehen në lëng.
Kondensimi i avullit

Kalimi i kundërt i një lënde nga një gjendje e gaztë në një gjendje të lëngshme quhet kondensimi. Gjatë kondensimit, disa nga molekulat e avullit kthehen në lëng.
Avulli fillon të shndërrohet në një lëng (kondensohet) në një kombinim të caktuar të temperaturës dhe presionit. Ky kombinim quhet pikë kritike . Temperatura maksimale , nën të cilin fillon kondensimi quhet kritike temperatura. Mbi temperaturën kritike, gazi nuk do të kthehet kurrë në lëng.
AT pikë kritike ndërfaqja lëng-avull është e turbullt. zhduket tensioni sipërfaqësor lëngu, dendësia e lëngut dhe avullit të tij të ngopur barazohen.
Në ekuilibrin dinamik, kur numri i molekulave që largohen nga lëngu dhe kthehen në të është i barabartë, proceset e avullimit dhe kondensimit janë të balancuara.
Kur uji avullon, formohen molekulat e tij avujt e ujit , i cili përzihet me ajër ose gaz tjetër. Temperatura në të cilën avulli i tillë në ajër ngopet, fillon të kondensohet me ftohjen dhe shndërrohet në pika uji, quhet pika e vesës .

Kur në ajër ka një sasi të madhe avulli uji, thuhet se lagështia e tij rritet.
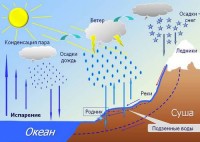
Ne vëzhgojmë avullimin dhe kondensimin shumë shpesh në natyrë. Mjegulla e mëngjesit, retë, shiu - e gjithë kjo është rezultat i këtyre fenomeneve. NGA sipërfaqen e tokës lagështia avullon kur nxehet. Molekulat e avullit që rezulton ngrihen lart. Duke hasur në gjethe të ftohta ose fije bari gjatë rrugës, avulli kondensohet mbi to në formën e pikave të vesës. Pak më lart, në shtresat sipërfaqësore, bëhet mjegull. Dhe lart në atmosferë në temperatura të ulëta, avulli i ftohur shndërrohet në re të përbëra nga pika uji ose kristale akulli. Më pas, shiu ose breshri do të bjerë nga këto re në tokë.
Por pikat e ujit formohen gjatë kondensimit vetëm kur grimcat më të vogla të ngurta ose të lëngshme janë në ajër, të cilat quhen bërthamat e kondensimit . Ato mund të jenë produkte të djegies, spërkatjes, grimcave të pluhurit, kripës së detit mbi oqean, grimcave të formuara si rezultat i reaksionet kimike në atmosferë etj.
desublimimi

Ndonjëherë një substancë mund të kalojë nga një gjendje e gaztë menjëherë në një gjendje të ngurtë, duke anashkaluar fazën e lëngshme. Një proces i tillë quhet desublimimi .
Modelet e akullit që shfaqen në gota në mot të ftohtë janë një shembull i desublimimit. Gjatë ngricave, toka mbulohet me ngrica - kristale të hollë akulli në të cilat avulli i ujit është kthyer nga ajri.
Dy pasoja të rëndësishme rrjedhin nga ligji i Raoult:
1) Tretësirat ziejnë në një temperaturë më të lartë se një tretës i pastër;
2) Tretësirat ngrijnë në një temperaturë më të ulët se një tretës i pastër.
Le t'i shqyrtojmë ato në mënyrë më të detajuar.
Zierja është procesi fizik me të cilin një lëng shndërrohet në gjendje të gaztë ose avull, në të cilin formohen flluska gazi në të gjithë vëllimin e lëngut.
Një lëng vlon kur presioni i tijavulli i ngopur bëhet i barabartë me presionin e jashtëm. Nëse presioni i jashtëm (për shembull, atmosferik) nuk ndryshon, dhelëngu është një substancë individuale dhe kimikisht e pastër, atëherë zierja e tij në një enë të hapur të ndezur ndodh në një temperaturë konstante derisa faza e lëngshme të zhduket plotësisht.
Pra, në një presion atmosferik prej 101.325 kPa, pika e vlimit të ujit të pastruar (të distiluar) është 100 o C ose 373.16 K.
Nëse një substancë jo e paqëndrueshme tretet në H 2 O, atëherë presioni i avullit të tij të ngopur do të ulet. Në mënyrë që tretësira që rezulton të vlojë, është e nevojshme ta ngrohni atë në një temperaturë më të lartë se 373.16 K, sepse vetëm në kushte të tilla presioni i avullit të ngopur të tretësit përsëri do të bëhet i barabartë me atmosferën.
Ngrirja ose kristalizimiështë një fenomen fizik, i shoqëruar nga shndërrimi i një lëngu në të ngurtë. Për më tepër, strukturat kristalore formohen në të gjithë vëllimin e lëngut.
Procesi i ngrirjes fillon nëse presioni i avullit të ngopur mbi lëng bëhet i barabartë me presionin e avullit të ngopur mbi kristalet e tij të ngurta.
Nëse presioni i jashtëm (atmosferik) mbetet konstant, dhelëngu nuk përmban papastërti të huaja, atëherë gjatë procesit të kristalizimit temperatura e lëngut të ftohur do të mbetet konstante derisa faza e lëngshme të kthehet plotësisht në një gjendje të ngurtë.
Në një presion atmosferik prej 101.325 kPa, uji i distiluar ngrin në 0°C (273.16K). Presioni i avullit të ujit të ngopur mbi akull dhe lëng në këtë rast është 613.3 Pa.
Për një zgjidhje ujore, presioni i avullit të ngopur të tretësit në 0 ° C do të jetë më pak se 613.3 Pa, por mbi akull mbetet i pandryshuar. Akulli i ulur në një zgjidhje të tillë do të shkrihet shpejt për shkak të kondensimit të një sasie të tepërt avulli mbi të.
Vetëm kur temperatura ulet, presioni i avullit të ngopjes mbi fazat e lëngëta dhe të ngurta mund të barazohet përsëri dhe të fillojë procesi i kristalizimit.
Në mënyrë empirike, u zbulua se një rritje në pikën e vlimit ( t balon ) dhe uljen e pikës së ngrirjes zgjidhje ( t zv ) në krahasim me një tretës të pastër, është drejtpërdrejt proporcional me përqendrimin molar të substancës së tretur. Matematikisht, kjo mund të shkruhet si më poshtë:
t b.p. p-ra –t kip. p-calf \u003d t kip. =em
t r-tel -t deputet. p-ra \u003d t deputet. = Km
kum– përqendrimi molaltretësirë;EdheK, përkatësisht, ebulioskopik (lat.ebulio- valoj) dhe konstante krioskopike (greqisht "cryos" - ftohtë), vlerat e të cilave varen vetëm nga natyratretës (Tabela 7).
Tabela 7 Ebulioskopike E dhe konstantet K krioskopike të disa tretësve (deg/mol)
Konstantet ebulioskopike dhe krioskopike tretës tregojnë se sa gradë ngrihet pika e vlimit dhe pika e ngrirjes tretësirë e përftuar duke tretur një mol jo elektrolit në një kilogram tretës ( m = 1 mol/kg).
Për të përcaktuar vlerat e E dhe K, së pari përcaktoni eksperimentalisht Dt kip. dhe Dt deputet. tretësira shumë të holluara (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
kuRështë konstanta universale e gazit;Tështë pika e vlimit të tretësit; është nxehtësia specifike e avullimit të tretësit.
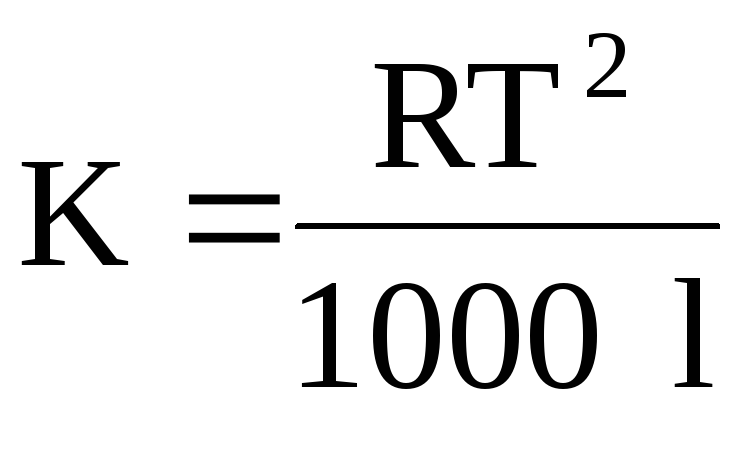
kuT- temperatura e shkrirjeszgjidhjeklient;l- nxehtësia specifike e shkrirjestretës.
Në këtë mënyrë, tretësirat e substancave të natyrës së ndryshme, por me të njëjtin përqendrim molar do të ziejnë dhe ngrijnë në të njëjtën kohëtemperatura.
Vëmendja duhet t'i kushtohet një ndryshimi të rëndësishëmtretësirë nga një tretës i pastër. Nëse kjo e fundit vlon dhe ngrin në një konstantetemperatura, atëherëzgjidhjet e bëjnë këtë në intervaltemperaturat, d.m.th. në procesin e zierjes së tyre, temperatura rritet gjatë gjithë kohës, dhe kur ngrin, zvogëlohet. Kjo për faktin se largimi nga faza e lëngshmetretës në formën e avullit ose kristaleve të ngurta çon në një rritje të përqendrimit molar të tretësirës, tk. substanca e tretur në procesin e zierjes dhe ngrirjes mbetet e pandryshuar në fazën e lëngshme (deri në vlimin ose ngrirjen e saj të plotë), dhe masa e tretësit të lëngshëm zvogëlohet.
Në matjet praktike pika e ngrirjes ose e vlimit zgjidhje, momenti i shfaqjes së kristaleve të parë të ngurtë në të është i fiksuar (për t zv ) ose flluska gazi (për t balon ).
Vetia e solucioneve për të ulur pikën e ngrirjes i lejon ato të përdoren si ftohës.
Pra, tretësirat e disa substancave organike dhe inorganike përdoren si antifriz për ftohjen e motorëve me djegie të brendshme kur ato funksionojnë në kushte të ndryshme klimatike.
ulje temperatura e ngrirjes zgjidhjet kanë një rëndësi të madhe për organizmat e gjallë. Pra, lëngu në qelizat e tyre është një zgjidhje e substancave të ndryshme inorganike dhe organike. E tijtemperatura e ngrirjes është nën 0 rreth C (273.16 K ), kështu qelizat nuk vdesin në kushte superftohjeje.
Falë këtij fenomeni, bimët ruhen në dimër. Për më tepër, sa më i lartë të jetë përqendrimi i substancave në lëngun qelizor, aq më të ulëta temperaturat e jashtme mund të tolerojë bima.
Në të njëjtën kohë, për të ulur pikën e ngrirjes së tretësirës në qelizat e ftohura, përmirësohet procesi i hidrolizës së përbërjeve me peshë molekulare më të lartë në komponime me peshë molekulare të ulët (për shembull, karbohidratet në glukozë).






