Si dhe kur ndryshon energjia e brendshme e trupit. Mënyrat për të ndryshuar energjinë e brendshme
Zbuloni se si mund ta llogarisni ndryshimin energjia e brendshme gjatë transferimit të nxehtësisë. Për ta bërë këtë sa më saktë që të jetë e mundur, është e nevojshme të minimizohen humbjet e pallogaritura të nxehtësisë gjatë shkëmbimit të nxehtësisë. Prandaj, kur kërkimin shkencor transferimi i nxehtësisë kryhet në një kalorimetër (Fig. 6.1), përdorimi i të cilit ju lejon të përcaktoni me saktësi nxehtësinë e dhënë ose të marrë nga trupi në procesin e transferimit të nxehtësisë.
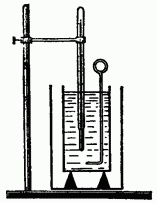
Kalorimetri përbëhet nga dy enë: të jashtme dhe të brendshme. Ena e brendshme është bërë nga një përcjellës i mirë i nxehtësisë (tunxh, bakër), pasi temperatura e saj duhet të jetë e njëjtë me atë të lëngut të derdhur në të.
Ena e jashtme mbron enën e brendshme nga humbja e nxehtësisë nga konvekcioni dhe rrezatimi. Prandaj, zakonisht lyhet me bojë të bardhë ose prej kallaji me shkëlqim.
Për të mbrojtur enën e brendshme nga humbja e nxehtësisë nga përçueshmëria, ajo vendoset në mbështetëse prej druri (druri ka përçueshmëri të dobët termike). Vendosni një përzierës (nga i njëjti material si ena) dhe një termometër në enën e brendshme.
Shkëmbimi i nxehtësisë kryhet si më poshtë. Me ndihmën e balancave, përcaktohet masa e enës së brendshme të kalorimetrit dhe trazuesit dhe më pas masa e lëngut të derdhur në të, për shembull, uji. Pas kësaj, masa e trupit matet, nxehet në një temperaturë të njohur dhe, duke vënë re temperatura e fillimit lëngu, uleni trupin e ndezur në kalorimetër. Duke matur temperaturën përfundimtare të lëngut, është e mundur të llogaritet se sa nxehtësi ka lëshuar trupi në procesin e transferimit të nxehtësisë.
Me ndihmën e eksperimenteve të tilla, është e lehtë të përcaktohet se ndryshimi në energjinë e brendshme të një trupi është drejtpërdrejt proporcional me masën e tij dhe ndryshimin e temperaturës së trupit.
![]()
këtu c është koeficienti i proporcionalitetit. Meqenëse ndryshimi i energjisë së brendshme gjatë transferimit të nxehtësisë vlerësohet nga sasia e nxehtësisë, ne kemi
Temperatura fillestare e trupit zakonisht shënohet si temperaturë përfundimtare, pastaj në rastin e ngrohjes së trupit dhe në rastin e ftohjes.
Eksperimentet tregojnë se varet nga lloji i substancës, në kushtet e jashtme, nga gjendja agregate e materies. Këto varësi shprehen me koeficientin c në formulat (6.1) dhe (6.2).
Vlera c që karakterizon varësinë e ndryshimit të energjisë së brendshme të trupit gjatë ngrohjes ose ftohjes nga lloji i substancës dhe nga kushtet e jashtme quhet ngrohje specifike substancave. Kapaciteti specifik i nxehtësisë i një substance matet me sasinë e nxehtësisë që kërkohet për të ngrohur një njësi masë të një substance për njësi të temperaturës:
![]()
Ne nxjerrim njësinë ngrohje specifike në SI:
Në SI, njësia e kapacitetit specifik të nxehtësisë është kapaciteti specifik i nxehtësisë së një substance të tillë për të cilën shpenzohet 1 J energji për ngrohjen e një mase prej 1 kg për 1 K. Për ndryshime të vogla të temperaturës, kapaciteti specifik i nxehtësisë mund të konsiderohet konstant. Për të zgjidhur problemet, ai merret nga tabelat.
Duhet të kihet parasysh se gjatë përcaktimit të sasisë së nxehtësisë së nevojshme për ngrohje ose të lëshuar gjatë ftohjes së një trupi, ndonjëherë përdoret kapaciteti i nxehtësisë së trupit C - një vlerë e matur me sasinë e nxehtësisë së nevojshme për ngrohjen e trupit për njësi. temperatura. Rrjedhimisht,
Është veçanërisht i përshtatshëm për të përdorur kapacitetin e nxehtësisë së të gjithë trupit në llogaritjet kur pjesët individuale të trupit janë bërë nga substanca të ndryshme. Në SI, merret njësia e kapacitetit të nxehtësisë së një trupi (Trego këtë duke përdorur formulën (6.3).)
Vëmë re gjithashtu se kapaciteti specifik i nxehtësisë së një gazi varet nga natyra e procesit në të cilin ai nxehet. Për shembull, kapaciteti specifik termik i një gazi në presion konstant më i madh se kapaciteti i tij specifik i nxehtësisë në vëllim konstant pasi në rastin e parë është e nevojshme jo vetëm të rritet energjia e brendshme e gazit, por edhe të shpenzohet energji për të kryer punën e bërë nga gazi në trupat e jashtëm në procesin e zgjerimit të tij (§ 5.10). Në rastin e dytë, nxehtësia e furnizuar me gazin shkon vetëm për të rritur energjinë e tij të brendshme.
energjia e brendshmeështë shuma e energjive kinetike të të gjitha grimcave që përbëjnë trupin, dhe energjitë e mundshme ndërveprimet ndërmjet këtyre grimcave. Kjo përfshin energjinë e ndërveprimit të elektroneve me bërthamat dhe energjinë e ndërveprimit pjesë përbërëse bërthamat.
Energjia e brendshme varet nga temperatura e saj. Temperatura karakterizon energjinë mesatare kinetike të grimcave të një substance. Kur ndryshon temperatura, distanca midis grimcave ndryshon, prandaj ndryshon edhe energjia e ndërveprimit midis tyre.
Energjia e brendshme gjithashtu ndryshon kur një substancë kalon nga një gjendje grumbullimi në një tjetër. Proceset që lidhen me ndryshimin e temperaturës ose gjendjen e grumbullimit të një substance quhen termike. Proceset termike shoqërohen nga një ndryshim në energjinë e brendshme të trupit.
reaksionet kimike, reaksionet bërthamore shoqërohen edhe me një ndryshim në energjinë e brendshme të trupit, tk. energjia e ndërveprimit të grimcave të përfshira në reaksione ndryshon. Energjia e brendshme ndryshon kur energjia emetohet ose absorbohet nga atomet gjatë kalimit të elektroneve nga një shtresë në tjetrën.
Nje nga Mënyrat për të ndryshuar energjinë e brendshmeështë Puna. Pra, gjatë fërkimit të dy trupave rritet temperatura e tyre, d.m.th. energjia e tyre e brendshme rritet. Për shembull, në përpunimin e metaleve - shpimi, kthimi, bluarja.
Kur dy trupa me temperatura të ndryshme vijnë në kontakt, energjia transferohet nga trupi me temperaturë të lartë në një trup me temperaturë të ulët. Procesi i transferimit të energjisë nga një trup në tjetrin në një temperaturë më të ulët quhet transferim i nxehtësisë.
Kështu, në natyrë ekzistojnë dy procese në të cilat energjia e brendshme e trupit ndryshon:
a) transformim energji mekanike në të brendshme dhe anasjelltas; gjatë kryerjes së punës;
b) transferimi i nxehtësisë; ndërsa nuk punohet.
Nëse përzieni ujin e nxehtë dhe të ftohtë, atëherë nga përvoja mund të shihni se sasia e nxehtësisë lëshohet ujë i nxehtë, dhe sasia e nxehtësisë së marrë nga uji i ftohtë janë të barabarta me njëra-tjetrën. Përvoja tregon se nëse shkëmbimi i nxehtësisë ndodh ndërmjet trupave, atëherë energjia e brendshme e të gjithë trupave ngrohës rritet aq sa zvogëlohet energjia e brendshme e trupave ftohës. Kështu, energjia kalon nga një trup në tjetrin, por energjia totale e të gjithë trupave mbetet e pandryshuar. atë ligji i ruajtjes dhe transformimit të energjisë.
Në të gjitha fenomenet që ndodhin në natyrë, energjia nuk lind dhe nuk zhduket. Ajo ndryshon vetëm nga një specie në tjetrën, ndërsa vlera e saj ruhet.
Për shembull, një plumb plumbi që fluturon me një shpejtësi të caktuar godet një pengesë dhe nxehet.
Ose, një lugë akulli, që bie nga një re bore, shkrihet pranë tokës.
Ose, një kazan me ujë nxehet në një sobë me gaz, një pjesë e ujit avullon.
Ligji i ruajtjes së energjisë është baza shkencore për llogaritjet në të gjitha fushat e shkencës dhe teknologjisë. Duhet të kihet parasysh se energjia plotësisht e brendshme nuk mund të shndërrohet në energji mekanike.
Energjia e brendshme mund të ndryshohet në dy mënyra.
Nëse punohet në një trup, energjia e brendshme e tij rritet.
Energjia e brendshme e trupit(e shënuar si E ose U) është shuma e energjive të ndërveprimeve molekulare dhe lëvizjeve termike të një molekule. Energjia e brendshme është një funksion me një vlerë të vetme të gjendjes së sistemit. Kjo do të thotë se sa herë që një sistem e gjen veten në një gjendje të caktuar, energjia e tij e brendshme merr vlerën e natyrshme në këtë gjendje, pavarësisht nga historia e sistemit. Rrjedhimisht, ndryshimi i energjisë së brendshme gjatë kalimit nga një gjendje në tjetrën do të jetë gjithmonë e barabartë me diferencën midis vlerave të saj në gjendjen përfundimtare dhe fillestare, pavarësisht nga rruga përgjatë së cilës është bërë kalimi.
Energjia e brendshme e një trupi nuk mund të matet drejtpërdrejt. Vetëm ndryshimi në energjinë e brendshme mund të përcaktohet:
Kjo formulë është një shprehje matematikore e ligjit të parë të termodinamikës
Për proceset kuazi-statike, lidhja e mëposhtme vlen:
Temperatura e matur në Kelvin
Entropia, e matur në xhaul/kelvin
Presioni i matur në Pascal
Numri i grimcave në sisteme
Nxehtësia e djegies së karburantit. karburant i kushtëzuar. Sasia e ajrit që nevojitet për të djegur karburantin.
Cilësia e një karburanti gjykohet nga vlera e tij kalorifike. Indeksi përdoret për të karakterizuar lëndët djegëse të ngurta dhe të lëngshme. ngrohje specifike djegia, e cila është sasia e nxehtësisë që çlirohet gjatë djegies së plotë të një njësie masë (kJ / kg). Për specie të gazta karburanti, përdoret një tregues i nxehtësisë vëllimore të djegies, që është sasia e nxehtësisë së lëshuar gjatë djegies së një njësie vëllimi (kJ / m3). Për më tepër, karburanti i gaztë në disa raste vlerësohet nga sasia e nxehtësisë së lëshuar gjatë djegies së plotë të një mol gazi (kJ / mol).
Nxehtësia e djegies përcaktohet jo vetëm teorikisht, por edhe empirikisht, duke djegur një sasi të caktuar karburanti në pajisje speciale të quajtura kalorimetra. Nxehtësia e djegies vlerësohet nga rritja e temperaturës së ujit në kolorimetër. Rezultatet e marra me këtë metodë janë afër vlerave të llogaritura nga përbërja elementare e karburantit.
Pyetja 14Ndryshimi i energjisë së brendshme gjatë ngrohjes dhe ftohjes. Puna e gazit me një ndryshim në vëllim.
Energjia e brendshme e trupit varet nga energjia mesatare kinetike e molekulave të saj, dhe kjo energji, nga ana tjetër, varet nga temperatura. Prandaj, me ndryshimin e temperaturës së trupit, ne ndryshojmë edhe energjinë e tij të brendshme.Kur një trup nxehet i rritet energjia e brendshme, ndërsa kur ftohet zvogëlohet.
Energjia e brendshme e trupit mund të ndryshohet pa bërë punë. Kështu, për shembull, mund të rritet duke ngrohur një kazan me ujë në sobë ose duke ulur një lugë në një gotë çaj të nxehtë. Oxhaku në të cilin ndizet zjarri, çatia e shtëpisë e ndriçuar nga dielli etj.. Rritja e temperaturës së trupave në të gjitha këto raste nënkupton rritje të energjisë së brendshme të tyre, por kjo rritje ndodh pa bërë punë. .
Ndryshimi në energjinë e brendshme trupi pa bërë punë quhet transferim i nxehtësisë. Transferimi i nxehtësisë ndodh ndërmjet trupave (ose pjesëve të të njëjtit trup) që kanë temperatura të ndryshme.
Si ndodh, për shembull, transferimi i nxehtësisë kur një lugë e ftohtë bie në kontakt me ujin e nxehtë? Së pari, shpejtësia mesatare dhe energjia kinetike molekulat e ujit të nxehtë tejkalojnë shpejtësinë mesatare dhe energjinë kinetike të grimcave metalike nga të cilat është bërë luga. Por në ato vende ku luga bie në kontakt me ujin, molekulat e ujit të nxehtë fillojnë të transferojnë një pjesë të energjisë së tyre kinetike tek grimcat e lugës dhe ato fillojnë të lëvizin më shpejt. Në këtë rast, energjia kinetike e molekulave të ujit zvogëlohet, dhe energjia kinetike e grimcave të lugës rritet. Së bashku me energjinë ndryshon edhe temperatura: uji gradualisht ftohet dhe luga nxehet. Ndryshimi i temperaturës së tyre ndodh derisa të bëhet i njëjtë si për ujin ashtu edhe për lugën.
Një pjesë e energjisë së brendshme të transferuar nga një trup në tjetrin gjatë shkëmbimit të nxehtësisë shënohet me një shkronjë dhe quhet sasia e nxehtësisë.
Q është sasia e nxehtësisë.
Sasia e nxehtësisë nuk duhet të ngatërrohet me temperaturën. Temperatura matet në gradë, dhe sasia e nxehtësisë (si çdo energji tjetër) matet në xhaul.
Me kontaktin e trupave me temperatura të ndryshme trupi më i nxehtë lëshon pak nxehtësi dhe trupi më i ftohtë e merr atë.
Puna në zgjerimin izobarik të gazit. Një nga kryesore proceset termodinamike, që zhvillohet në shumicën e motorëve me nxehtësi, është procesi i zgjerimit të gazit me kryerjen e punës. Është e lehtë të përcaktohet puna e bërë gjatë zgjerimit izobarik të një gazi.
Nëse gjatë zgjerimit izobarik të gazit nga vëllimi V1 në vëllimin V2, pistoni lëviz në cilindër në një distancë l (Fig. 106), atëherë puna A "e kryer nga gazi është e barabartë me
Ku p është presioni i gazit, është ndryshimi në vëllimin e tij.
Punoni me një proces arbitrar të zgjerimit të gazit. Një proces arbitrar i zgjerimit të gazit nga vëllimi V1 në vëllimin V2 mund të përfaqësohet si një grup procesesh izobarike dhe izokorike të alternuara.
Puna me zgjerimin izotermik të gazit. Duke krahasuar sipërfaqet e figurave nën seksionet e izotermës dhe izobarit, mund të konkludojmë se zgjerimi i gazit nga vëllimi V1 në vëllimin V2 me të njëjtën vlerë fillestare të presionit të gazit shoqërohet në rastin e zgjerimit izobarik me më shumë punë.
Puna me kompresim të gazit. Kur gazi zgjerohet, drejtimi i vektorit të forcës së presionit të gazit përkon me drejtimin e vektorit të zhvendosjes, prandaj puna A "e kryer nga gazi është pozitive (A" > 0), dhe puna A e forcave të jashtme është negative: A \u003d -A "< 0.
Kur gazi është i ngjeshur drejtimi i vektorit të forcës së jashtme përkon me drejtimin e lëvizjes, prandaj puna A e forcave të jashtme është pozitive (A > 0), dhe puna A "e kryer nga gazi është negative (A"< 0).
procesi adiabatik. Përveç izobarit, izokorik dhe proceset izotermike, proceset adiabatike shpesh konsiderohen në termodinamikë.
procesi adiabatikështë një proces që ndodh në një sistem termodinamik në mungesë të shkëmbimit të nxehtësisë me trupat përreth, d.m.th., në kushtin Q = 0.
Pyetja 15 Kushtet për ekuilibrin e trupit. Momenti i fuqisë. Llojet e bilancit.
Ekuilibri, ose ekuilibri, i një sërë dukurish të ndërlidhura në shkencat natyrore dhe njerëzore.
Një sistem konsiderohet të jetë në një gjendje ekuilibri nëse të gjitha ndikimet në këtë sistem kompensohen nga të tjerët ose mungojnë fare. Një koncept i ngjashëm është qëndrueshmëria. Ekuilibri mund të jetë i qëndrueshëm, i paqëndrueshëm ose indiferent.
Shembuj tipikë të bilancit:
1. Bilanci mekanik, i njohur edhe si ekuilibër statik, - gjendja e një trupi në prehje, ose në lëvizje të njëtrajtshme, në të cilën shuma e forcave dhe momenteve që veprojnë mbi të është e barabartë me zero.
2. Ekuilibri kimik – pozicioni në të cilin reaksion kimik vazhdon në të njëjtën masë si reaksioni i kundërt, dhe si rezultat nuk ka ndryshim në sasinë e secilit komponent.
3. Ekuilibri fizik i njerëzve dhe i kafshëve, i cili ruhet duke kuptuar domosdoshmërinë e tij dhe, në disa raste, duke ruajtur artificialisht këtë ekuilibër [burimi nuk specifikohet 948 ditë].
4. Ekuilibri termodinamik - gjendja e sistemit në të cilin proceset e brendshme të tij nuk çojnë në ndryshime në parametrat makroskopikë (si temperatura dhe presioni).
R barazi me zero të shumës algjebrike momentet e forcave gjithashtu nuk do të thotë se trupi është domosdoshmërisht në qetësi. Për disa miliarda vjet, rrotullimi i Tokës rreth boshtit të saj vazhdon me një periudhë konstante pikërisht sepse shuma algjebrike e momenteve të forcave që veprojnë në Tokë nga trupat e tjerë është shumë e vogël. Për të njëjtën arsye, rrota rrotulluese e biçikletës vazhdon të rrotullohet me një frekuencë konstante dhe vetëm forcat e jashtme ndaloni këtë rrotullim.
Llojet e bilancit. Në praktikë, një rol të rëndësishëm luan jo vetëm përmbushja e kushtit të ekuilibrit për trupat, por edhe karakteristika cilësore e ekuilibrit, e quajtur qëndrueshmëri. Ekzistojnë tre lloje të ekuilibrit të trupave: të qëndrueshëm, të paqëndrueshëm dhe indiferent. Ekuilibri quhet i qëndrueshëm nëse, pas ndikimeve të vogla të jashtme, trupi kthehet në gjendjen e tij origjinale të ekuilibrit. Kjo ndodh nëse, me një zhvendosje të lehtë të trupit në çdo drejtim nga pozicioni fillestar, rezultanta e forcave që veprojnë në trup bëhet jo zero dhe drejtohet drejt pozicionit të ekuilibrit. Në ekuilibër të qëndrueshëm është, për shembull, një top në fund të prerjes.
Kushti i përgjithshëm për ekuilibrin e një trupi. Duke kombinuar dy përfundimet, mund të formulojmë një kusht të përgjithshëm për ekuilibrin e një trupi: një trup është në ekuilibër nëse shuma gjeometrike e vektorëve të të gjitha forcave të aplikuara ndaj tij dhe shuma algjebrike e momenteve të këtyre forcave rreth boshtit të rrotullimi janë të barabartë me zero.
Pyetja 16Avullimi dhe kondensimi. Avullimi. Lëng i vluar. Varësia e vlimit të lëngut nga presioni.
avullimi - veti e hedhjes së lëngjeve për të ndryshuar ato gjendja e grumbullimit dhe shndërrohen në avull. Avullimi që ndodh vetëm në sipërfaqen e një lëngu që bie quhet avullim. Avullimi në të gjithë vëllimin e një lëngu quhet zierje; ndodh në një temperaturë të caktuar, në varësi të presionit. Presioni në të cilin lëngu vlon në një temperaturë të caktuar quhet presion. avujt e ngopur pnp, vlera e tij varet nga lloji i lëngut dhe temperatura e tij.
Avullimi- procesi i transferimit të një substance nga gjendje e lëngët në të gaztë (avull). Procesi i avullimit është e kundërta e procesit të kondensimit (kalimi nga një gjendje avulli në një gjendje të lëngshme. Avullimi (avullimi), kalimi i një lënde nga një fazë e kondensuar (e ngurtë ose e lëngët) në një të gaztë (avull); tranzicioni fazor lloji i parë.
Kondensimi -është procesi i kundërt i avullimit. Gjatë kondensimit, molekulat e avullit kthehen në lëng. Në një enë të mbyllur, një lëng dhe avulli i tij mund të jenë në një gjendje ekuilibri dinamik kur numri i molekulave që largohen nga lëngu është i barabartë me numrin e molekulave që kthehen në lëng nga avulli, domethënë kur shpejtësia e avullimit dhe kondensimi janë të njëjta. Një sistem i tillë quhet sistem dyfazor. Një avull që është në ekuilibër me lëngun e tij quhet i ngopur. Numri i molekulave të emetuara nga një sipërfaqe njësi e një lëngu në një sekondë varet nga temperatura e lëngut. Numri i molekulave që kthehen nga avulli në lëng varet nga përqendrimi i molekulave të avullit dhe me radhë Shpejtësia mesatare lëvizja e tyre termike, e cila përcaktohet nga temperatura e avullit.
Duke zier- procesi i avullimit në një lëng (kalimi i një substance nga lëngu në gjendje e gaztë), me shfaqjen e kufijve të ndarjes së fazave. Pika e vlimit në presioni atmosferik zakonisht jepet si një nga karakteristikat kryesore fiziko-kimike të një lënde kimikisht të pastër.
Zierja dallohet sipas llojit:
1. zierje me konvekcion të lirë në vëllim të madh;
2. zierje nën konvekcion të detyruar;
3. si dhe në relacion temperature mesatare Temperatura e lëngshme deri në ngopje:
4. zierja e një lëngu të nënftohur deri në temperaturën e ngopjes (zierje sipërfaqësore);
5. zierja e një lëngu të ngrohur në temperaturën e ngopjes
Flluskë
Duke zier , në të cilin avulli formohet në formën e flluskave periodike që dalin dhe rriten, quhet zierje nukleate. Me vlimin e ngadaltë të bërthamës në një lëng (më saktë, si rregull, në muret ose në fund të enës), shfaqen flluska të mbushura me avull. Për shkak të avullimit intensiv të lëngut brenda flluskave, ato rriten, notojnë dhe avulli lëshohet në fazën e avullit mbi lëng. Në këtë rast, në shtresën afër murit, lëngu është paksa gjendje e mbinxehur d.m.th temperatura e tij e kalon pikën nominale të vlimit. Në kushte normale, ky ndryshim është i vogël (në rendin e një shkalle).
Film
Kur fluksi i nxehtësisë rritet në një vlerë të caktuar kritike, flluska individuale bashkohen, duke formuar një shtresë të vazhdueshme avulli pranë murit të anijes, e cila në mënyrë periodike depërton në vëllimin e lëngut. Kjo mënyrë quhet modaliteti i filmit.
©2015-2017 sajti
Të gjitha të drejtat u përkasin autorëve të tyre. Kjo faqe nuk pretendon autorësinë, por ofron përdorim falas.






