Proceset termodinamike në koordinatat p v. Cikli i ftohjes së kompresorit me avull. Procesi i gazit adiabatik
Secili prej këtyre ekuacioneve përmban dy faktorë. Njëra karakterizon cilësinë ose intensitetin e energjisë ( ω2− katrori i shpejtësisë, H- lartësia e ngritjes, T- temperatura, fq- presioni), dhe e dyta shpreh sasinë ose kapacitetin e trupit në lidhje me një energji të caktuar ( m – masa trupore, V − vëllim specifik, S – entropia). Faktori i parë është një faktor intensiv dhe i dyti është një faktor i gjerë. Kjo do të thotë, entropia është kapaciteti i një sistemi termodinamik në lidhje me tensionin termik.
Clausius formuloi ligjet e parë dhe të dytë të termodinamikës.
Energjia e universit është konstante.
Entropia e universit tenton në maksimum.
Kështu, kjo duhet të çojë në vdekjen e nxehtësisë së universit kur temperatura të barazohet. Por kjo bie ndesh me faktin që ligji i rritjes së entropisë është marrë për sistem i izoluar.
TS - diagramë.
Në këtë diagram, temperatura vizatohet përgjatë boshtit të ordinatave dhe entropia paraqitet përgjatë boshtit të abshisës.
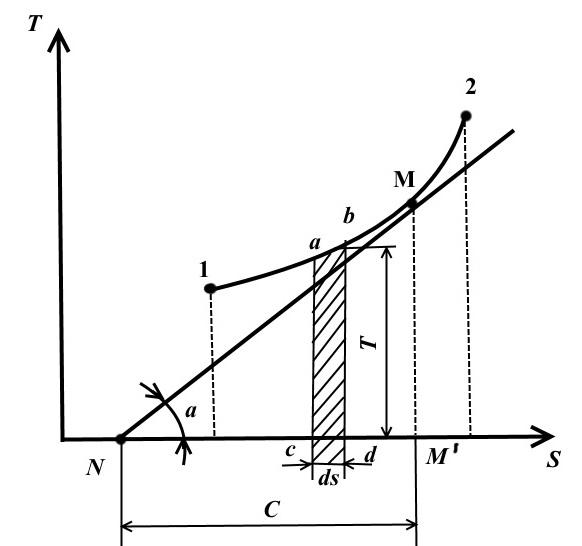
Gjendja e ekuilibrit në diagramin TS përfaqësohet nga pika me koordinata që korrespondojnë me vlerat e temperaturës dhe entropisë.
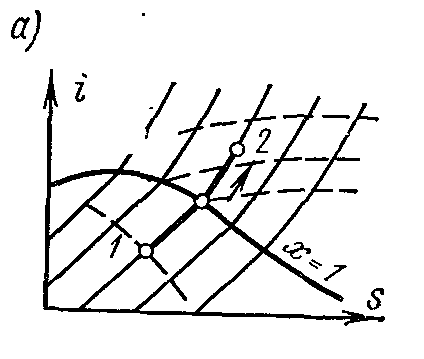
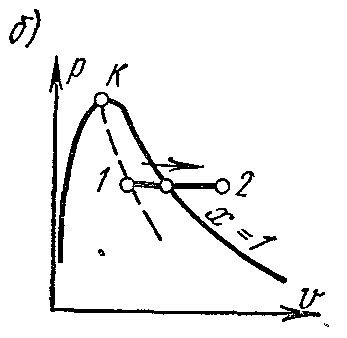
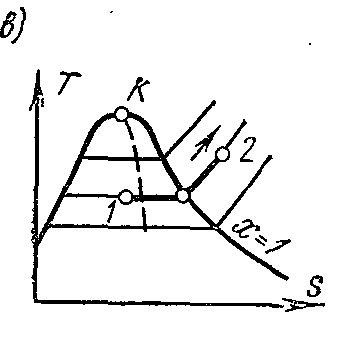
Procesi termodinamik i kthyeshëm i ndryshimit të gjendjes së lëngut të punës nga gjendja fillestare 1 në gjendjen përfundimtare 2 përshkruhet në TS − diagrami i një lakore të vazhdueshme që kalon ndërmjet këtyre pikave.
Sheshi abdcështë e barabartë me TdS = dq , ato. shpreh sasinë elementare të nxehtësisë së marrë ose të lëshuar nga sistemi në një proces të kthyeshëm.
Zona nën kurbën 1-2 është
Kjo është, zona nën kurbë në TS − diagrami, përfaqëson nxehtësinë e furnizuar në sistem ose të hequr prej tij.
Kjo është arsyeja pse TS − diagrami quhet termik.
Vizatoni në një pikë arbitrare M në lakoren 1-2 tangjente me këtë kurbë
Vlera përfaqëson kapacitetin e vërtetë të nxehtësisë së procesit.
![]()
Proceset e gazit nëTS − diagrami.
Procesi izotermik.
Në një proces izotermik T= konst. Kjo është arsyeja pse TS- në diagram, përshkruhet nga një vijë e drejtë paralele me boshtin x.
Duke marrë parasysh faktin se dT=0 , varësitë e ndryshimit të entropisë së një gazi ideal në një proces izotermik do të marrin formën
(termi në anën e djathtë largohet)
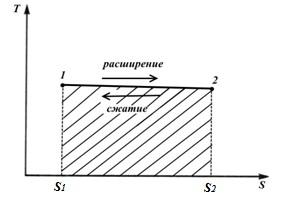
Procesi 1-2 është një proces në të cilin entropia rritet, dhe për këtë arsye nxehtësia furnizohet me gazin dhe gazi kryen një punë zgjerimi të barabartë me këtë nxehtësi.
Procesi 2-1 është një proces kompresimi në të cilin nxehtësia ekuivalente me punën e ngjeshjes hiqet nga gazi dhe entropia zvogëlohet
sipërfaqja e figurës S 1 12 S 2 korrespondon me sasinë e nxehtësisë q në gazin e furnizuar, dhe në të njëjtën kohë punë l (procesi izotermik)
procesi adiabatik
Në një proces adiabatik q=0 dhe dq=0, dhe rrjedhimisht dS=0.
Prandaj, në një proces adiabatik S= konst dhe ne TS− në diagram, procesi adiabatik përfaqësohet nga një vijë e drejtë paralele me boshtin T.
Sepse në një proces adiabatik S= konst, atëherë proceset e kthyeshme adiabatike quhen edhe isentropike.
Gjatë ngjeshjes adiabatike, temperatura e lëngut të punës rritet, dhe gjatë zgjerimit zvogëlohet. Prandaj, procesi 1-2 është një proces tkurrjeje dhe procesi 2-1 është një proces zgjerimi.
Nga ekuacioni
![]() (3)
(3)
Në k= konst marrim
![]()
Për një proces adiabatik të kthyeshëm S 1 = S 2 = konst, pastaj nga (*)
− ekuacioni adiabatik në koordinata fq dhe V.
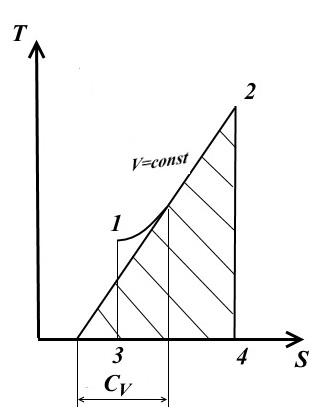
Procesi izokorik
Për procesin izokorik V= konst, dV=0.
Me një kapacitet të vazhdueshëm nxehtësie (nga barazimi (1))
− pamje e TS - grafiku
Nëntangjentja e kurbës së procesit në çdo pikë përcakton vlerën e kapacitetit të vërtetë të nxehtësisë C V .
Nëntangjentja do të jetë pozitive vetëm nëse kurba është konvekse poshtë.
Zona nën kurbën e procesit 1-2 TS - diagrami jep një sasi të shkallëzuar të nxehtësisë së furnizuar (ose hequr në procesin 2-1) q, e barabartë me ndryshimin energjia e brendshme U 2 - U 1 .
procesi izobarik
Në një proces izobarik, presioni është konstant. fq= konst
Në këtë rast
![]() nga (2)
nga (2)
Prandaj, në fq= konst si me V= konst izobari është një kurbë logaritmike, gjurma ngrihet në të djathtë dhe është konvekse poshtë.
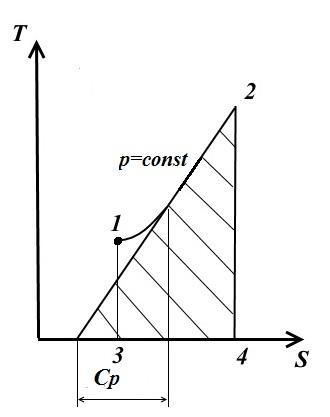
Tangjenti ndaj kurbës 1-2 në çdo pikë jep vlerat e kapacitetit të vërtetë të nxehtësisë C fq .
Zona nën kurbë jep sasinë e nxehtësisë q, e cila është raportuar në gaz në fq= konst, e barabartë me ndryshimin e entalpisë i 2 - i 1 .
Procesi politropik
Në një proces politropik.Kapaciteti i nxehtësisë në këtë proces
![]()
Prandaj, për ndryshimin përfundimtar të gjendjes së gazit
![]()
Procesi politropik TS - diagrami përshkruhet nga një kurbë, vendndodhja e së cilës varet nga treguesi n.
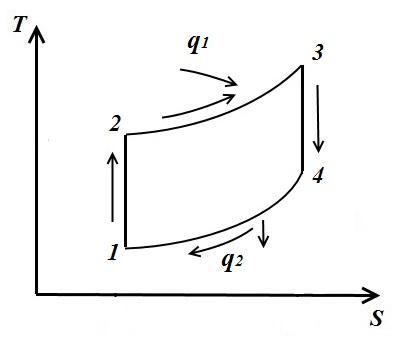
proces rrethor. Cikli Carnot.
Le të përshkruajmë në TS – diagrami i një cikli të kthyeshëm arbitrar 1 a2 b1 .

Në proces 1 a2 trupi punues merr sasinë e nxehtësisë q 1 , numerikisht e barabartë me sipërfaqen nën kurbë 1 a2, dhe në procesin 2- b-1 jep sasinë e nxehtësisë q 2 , numerikisht e barabartë me sipërfaqen nën kurbë 2- b-1.
Pjesë e ngrohtësisë
shkon në cikël l (∆ u=0 në lak).
Puna e ciklit është pozitive nëse cikli kalon në drejtim të akrepave të orës dhe negative nëse është në të kundërt (drejtimi i ciklit është në pVdheTS− diagramet janë të njëjta).
Efikasiteti termik proces rrethor
Ndryshimi i entropisë në çdo cikël është zero.
Cikli Carnot përbëhet nga dy izoterma dhe dy adiabate. AT TS- në diagram, ai do të shfaqet si një drejtkëndësh (vijat horizontale janë izotermike, vijat vertikale janë adiabat)
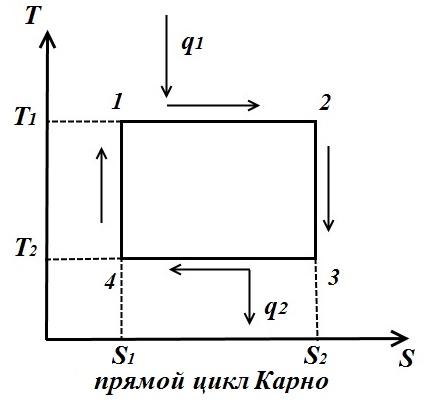
Sasia e nxehtësisë së furnizuar në lëngun e punës është numerikisht e barabartë me sipërfaqen e drejtkëndëshit 12 S 2 S 1 :
Sasia e nxehtësisë së transferuar në frigorifer korrespondon me sipërfaqen e drejtkëndëshit 34 S 1 S 2 :
Nxehtësia e barabartë me punën e ciklit, e barabartë me sipërfaqen e ciklit
Efikasiteti termik ciklit
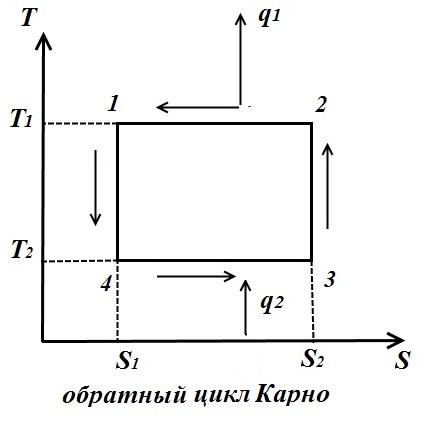
Për ciklin e kundërt (fig. djathtas)
Koeficienti i performancës së ciklit të kundërt
![]()
Temperatura mesatare integrale
Në një cikël të kthyeshëm arbitrar, nxehtësia furnizohet dhe hiqet në temperatura të ndryshueshme. Për të thjeshtuar studimet termodinamike, është prezantuar koncepti i temperaturës mesatare integrale.
Konsideroni një proces arbitrar politropik në TS- një diagram në të cilin nxehtësia furnizohet me lëngun e punës q(procesi 1-2).
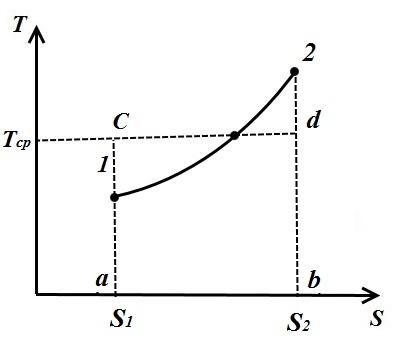
Nën temperaturën mesatare integrale të lëngut punues në procesin 1-2 kuptohet temperatura, e cila është e barabartë me lartësinë e drejtkëndëshit. abdc sipërfaqe të barabartë a12 b nën lakoren e procesit 1-2, d.m.th.
![]()
Sepse
dhe segmentin
Kështu, temperatura mesatare integrale e gazit për çdo proces është e barabartë me raportin e sasisë, nxehtësisë, të furnizuar me gaz ose të marrë prej tij, me ndryshimin e entropisë.
Për çdo proces politropik
![]()
dhe temperatura mesatare integrale (nga (*))

Kjo tregon se temperatura mesatare integrale në çdo proces politropik varet vetëm nga ajo fillestare T 1 dhe përfundimtare T 2 temperaturat dhe nuk varet nga natyra e procesit.
Në një cikël arbitrar në të cilin ngjeshja dhe zgjerimi i gazit janë adiabatike (seksionet 1-2, 3-4), sasia e nxehtësisë e furnizuar në seksionin 2-3
dhe tërhiqet në seksionin 4-1
Pastaj efikasiteti termik ciklit
![]() ,
,
dmth efikasiteti termik cikli arbitrar është i barabartë me efikasitetin termik. Cikli Carnot, i kryer midis temperaturave mesatare integrale të proceseve, duke përmbledhur T 1 cp dhe duke marrë T 2 cp ngrohtësi.
Cikli i përgjithësuar i Carnot
Cikli Carnot ka efikasitetin më të lartë termik. megjithatë, janë të mundshme edhe cikle të tjera, të cilat, në kushte të caktuara shtesë, mund të kenë një efikasitet termik të barabartë me efikasitetin. ciklin Carnot.
Konsideroni një shembull të një cikli të tillë në Fig. tregon ciklin Carnot 1-2-3-4, i përbërë nga dy adiabat 2-3, 4-1 dhe dy izoterma 1-2, 3-4.
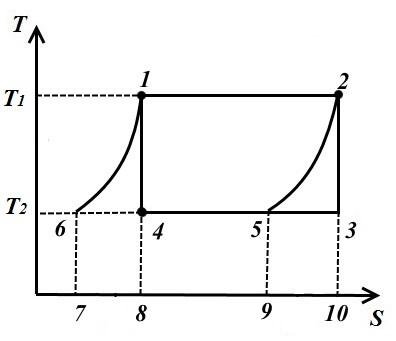
Vizatoni dy kthesa të barabarta 1-6 dhe 2-5 nga pikat 1 dhe 2 derisa të kryqëzohen me izotermën T 2 = konst dhe merrni parasysh ciklin e anasjelltë 1-2-5-6, i përbërë nga dy izoterma dhe dy kthesa të baraslarguara 6-1 (politrope) dhe 2-5.
Në proces 1-2 në lëngun e punës në një temperaturë T 1 = konst sasia e nxehtësisë së dhënë
Në procesin 2-5, një sasi nxehtësie e barabartë me sipërfaqen e figurës 9-5-2-10 hiqet nga lëngu i punës.
Në procesin 5-6 nga lëngu i punës në T 2 = konst sasia e nxehtësisë së hequr
Në procesin 6-1, sasia e nxehtësisë i jepet lëngut të punës q 6-1 , e barabartë me sipërfaqen 7-6-1-8.
Meqenëse kthesat 1-6, 2-5 janë të barabarta, atëherë sq. 7618 = pl. 952-10 prandaj edhe sasia e nxehtësisë është e njëjtë.
Kjo tregon se ngrohëset e ndërmjetme dhe pajisjet e transferimit të nxehtësisë janë vetëm rigjenerues të nxehtësisë, të cilët marrin nxehtësinë nga lëngu i punës në procesin 2-5 dhe ia japin në të njëjtën sasi lëngut punues në procesin 6-1. Kështu, 1-2-5-6 burimet e jashtme të vlefshme janë një pajisje e transferimit të nxehtësisë me temperaturë T 1 dhe një ftohës me temperaturë T 2 .
Nxehtësia shndërrohet në punë në një cikël
Efikasiteti termik përcaktohet nga formula
Kjo është, efikasiteti termik Cikli i konsideruar është i barabartë me efikasitetin. ciklin Carnot.
Cikli termodinamik në të cilin nxehtësia largohet nga lëngu i punës në një ose më shumë procese të ciklit për furnizim në një ose më shumë procese quhet cikli rigjenerues.
Ndryshe nga cikli Carnot, cikli rigjenerues kërkon një burim të ndërmjetëm të ruajtjes së nxehtësisë.
Shkalla termodinamike e temperaturës
Kur përdoren trupa të ndryshëm termodinamikë, shkalla është e pabarabartë për shkak të veçorive të zgjerimit termik të këtyre substancave.
Ligji i dytë i termodinamikës ju lejon të ndërtoni një shkallë të temperaturës që nuk varet nga vetitë e një trupi termometrik (propozuar nga Kelvin)
Në ciklin Carnot, efikasiteti termik nuk varet nga vetitë e lëngut punues, por është funksion i temperaturave të burimit të nxehtë dhe të ftohtë.
Efikasiteti termik
Kështu, raporti i temperaturave të lëngut të punës mund të përcaktohet nga raporti i nxehtësisë. Nga kjo rrjedh se nëse ciklet Carnot (Fig.) formohen duke përdorur izoterma të barabarta, atëherë në këto cikle e njëjta sasi nxehtësie shndërrohet në punë.

Lëreni temperaturën në izotermi T 0 dhe T k korrespondojnë me temperaturat e shkrirjes së akullit (0 °C) dhe ujit të vluar (100 °C).
Në ciklin Carnot 1234 nxehtësia shndërrohet në punë q e barabartë me sipërfaqen e figurës 1234 . Nëse kjo zonë ndahet nga një rrjet izotermash të barabarta në 100 pjesë të barabarta, në secilin prej cikleve Carnot që rezultojnë, sasia e nxehtësisë do të shndërrohet në punë. 0,01 q. Intervali i temperaturës ndërmjet izotermave do të jetë 1 °С.
Në mënyrë të ngjashme, mund të ndërtohet një shkallë që shtrihet nën izotermën me temperaturën T 0 (0 °C).
Pika e poshtme e shkallës termodinamike merret si temperatura në të cilën është efikasiteti termik Cikli Carnot =1. Sipas
në T 2 =0 . Një temperaturë më e ulët nuk mund të ekzistojë, sepse në këtë rast, e cila bie ndesh me ligjin e dytë të termodinamikës.
Rrjedhimisht T=0 (-273.15 ) është temperatura më e ulët e mundshme dhe mund të merret si pika fillestare konstante natyrore në shkallën e temperaturës. Kështu, temperatura absolute nuk mund të ketë vlera negative.
Shkalla termodinamike e temperaturës është marrë për një gaz ideal.
Në termodinamikë, studiohen një shumëllojshmëri e gjerë procesesh. Megjithatë, ata dallojnë katër procese kryesore të konsideruara si të kthyeshme:
izokorik, që rrjedh në vëllim konstant;
izobarike, që rrjedh në presion konstant;
izotermike, që rrjedh në temperaturë konstante(emri i procesit vjen nga kombinimi i fjalëve greke "isos" - e barabartë dhe "terme" - ngrohtësi);
adiabatike, që rrjedh pa furnizim dhe largim të nxehtësisë (në greqisht "adiabatos" - i padepërtueshëm).
Përveç katër proceseve themelore të listuara në termodinamikë, të ashtuquajturat politropike proceset (në greqisht "poli" - shumë, "tropos" - një mënyrë). Në këto procese, të gjithë parametrat e lëngut të punës mund të ndryshojnë njëkohësisht dhe, përveç kësaj, nxehtësia furnizohet ose hiqet. Siç do të shpjegohet më poshtë, katër proceset bazë janë raste të veçanta të procesit politropik.
Metodologjia e studimit të proceseve termodinamike
Para së gjithash, duhet theksuar se çdo proces gazi në të cilin
c = const quhet politropike me ekuacionin e përgjithshëm pvn= konst.
n i quajtur indeksi politropik.
Teknika për studimin e proceseve termodinamike është si më poshtë:
1. Vendosni ekuacionin për këtë proces dhe prodhoni atë imazh grafik në pv dhe Ts sistemet e koordinatave (kjo e fundit diskutohet më poshtë).
2. Vendosni raportin ndërmjet p,v dhe T.
3. Sipas formulës së llogaritjes së zakonshme për të gjitha proceset, ne përcaktojmë ndryshimin në energjinë e brendshme ( du= c v dT).
4. Nga ekuacioni i përgjithshëm puna përcakton punën e një procesi të caktuar termodinamik.
5. Nxehtësia e këtij procesi përcaktohet nga formula q = .
Procesi izokorik
1. Ekuacioni politropik pv n= const mund të shkruhet si p v=const, që tregon se për një proces izokorik n merr vlerën.
2. Nga ekuacionet e gjendjes fq 1 v = RT 1 dhe fq 2 v = RT 2 marrim .
Në praktikë, ky proces ndodh si komponent proceset që ndodhin në motorët me djegie të brendshme (formimi i shpërthimit (djegia e karburantit) në motorët me karburator) dhe gjatë ftohjes ose ngrohjes së gazit në një cilindër (Fig. 9, a).
5.q = u ato. e gjithë nxehtësia e dhënë shkon për të rritur energjinë e brendshme. Koeficienti tregon pjesën e nxehtësisë së përdorur për të ndryshuar energjinë e brendshme; 1 –z tregon se sa nga nxehtësia e futur përdoret për të kryer punë. Isochora në T-s koordinatat (Fig. 9, b) përshkruhet nga një kurbë logaritmike (shih 6.5).
procesi izobarik
1. Nga ekuacioni politropik pv n= konst, shihet se kthehet në ekuacionin e procesit izobarik ( R= konst) kur n= 0.
2. Nga ekuacionet e gjendjes pv 1 = RT 1 dhe pv 2 = RT 2 kemi
3. u= me v(T 2 – T 1). (47)
4. d.m.th. . (48)
5.dq = du + d . (49)
Le të përcaktojmë se si shpërndahet nxehtësia e furnizuar:
z = = ,
ato. nga e gjithë nxehtësia e dhënë.
Ky proces është pjesë integrale Ciklet e akullit dhe turbinat me gaz (Fig. 10). Isobar në T-s koordinatat përshkruhen nga një kurbë logaritmike që është më e sheshtë se izokore (sepse me f > me v, shih 6.5).
Procesi izotermik
1.T= konst , pvn = konst . Nga ekuacionet e gjendjes pv=RT rrjedh se për këtë proces n duhet të jetë e barabartë me 1, d.m.th. pv= konst. Izotermi në p-v koordinatat përshkruhen nga një hiperbolë izoscele (Fig. 11, a), dhe në T-s koordinatat - një vijë e drejtë (Fig. 11, b).
2. fq 1 v 1 = fq 2 v 2 ; . (50)
3. du=0, t .të. dT= 0.
5. q= , në këtë proces e gjithë nxehtësia shkon në punë.
Ky është procesi më i favorshëm për kompresimin e kompresorëve, si temperatura e kompresimit është konstante
z= 1 – z= 1.
procesi adiabatik
Një proces adiabatik është një proces që nuk shkëmben nxehtësinë me mjedisin. Të gjitha proceset e shpejta (qëllimi, shpërthimi, rrjedhja e avullit përmes pjesës rrjedhëse të turbinës etj.) i afrohen shumë adiabatit.
Për shkak të kësaj, në atë që vijon, proceset termike reale që zhvillohen mjaft shpejt, me një gabim inxhinierik të pranueshëm, do të konsiderohen si procese adiabatike (për shembull, proceset e ngjeshjes dhe zgjerimit në motorët me nxehtësi).
1. dq = me v dT + pdf; dq= 0, atëherë
me v dT + pdf = 0. (52)
diferenconi pv=R.T. Marr pdv+vdp=RdT, ku . Le të zëvendësojmë atë të marrë dT në (52): . Ndani sipas dhe merrni pdf= 0. Megjithatë, = k-1, atëherë pdf + vdp + (k- 1)pdf = 0.
pdv + vdp + kpdv – pdv= 0. Pjestojeni me p v: . Ne integrohemi dhe marrim ln fq+ln v k= konst ose ln( p.v.k) = konst. AT formë përfundimtare fitohet ekuacioni adiabatik:
pv k = konst . (53)
AT p-v koordinatat adiabatike është një hiperbolë me anë të pabarabartë që shkon më e pjerrët se izoterma ( n=k= 1.4, fig. 12a).
2. Nga ekuacioni adiabatik p 1 v 1 k = p 2 v 2k. . Nga këtu
Shkruajmë ekuacionin karakteristik për pikat 1 dhe 2: fq 1 v 1 =RT 1 dhe fq 2 v 2 =RT 2 dhe ndani të parën me të dytën. Marr
Tani le të përdorim shprehjen (54), duke e zëvendësuar atë në shprehjen (55):
Për të marrë marrëdhënien midis temperaturave dhe presioneve, ne zëvendësojmë me (55), të shprehur përmes raportit të presionit nga (54):
3, 4. Në procesin adiabatik, ndryshimi i energjisë së brendshme përdoret për të kryer punë: O = d + du, prandaj d = -du ose .
Pas integrimit, marrim ose (sepse me zgjerimin)
Nga ekuacioni i Mayer-it c p – c v = R. c p = kc v. Nga këtu kcv – cv = R dhe .
Zëvendësoni vlerën që rezulton c v në formulën (58):
Nga ekuacioni Clapeyron ( pv=RT) mund të shkruhet dhe të merret p 1 v 1 jashtë kllapave, marrim
5. q= 0.
Në një proces adiabatik, entropia mbetet konstante ( s= const), kështu që ky proces nganjëherë quhet isentropik (shih 5.6).
Koeficient z nuk ka kuptim.
Procesi politropik
Të gjitha proceset e konsideruara më sipër kishin një veçori: në secilën prej tyre, u vendos një kufizim për secilën nga sasitë ( R= konst, t= konst, v= konst, dq= 0). Prandaj, këto procese mund të konsiderohen raste të veçanta të ndryshimeve në gjendjen e gazit.
Përveç kësaj, pasojë e këtyre kufizimeve është që nxehtësia hyrëse ose dalëse q shpërndahet ndërmjet dhe në mënyrë të tillë që të marrë një vlerë të caktuar.
Megjithatë, është e qartë se mund të ketë procese në të cilat nuk ka këto kufizime dhe z mund të marrë vlera të tjera. Kufizimi i vetëm për procese të tilla do të jetë këmbëngulja z, d.m.th. dhe qëndrueshmëria e kapacitetit të nxehtësisë (sepse, q = Me ).
Duke e integruar me n= konst, marrim ekuacionin politropik
pvn= konst. (65)
Siç u përmend më lart, treguesi n merr një vlerë specifike për çdo proces.
Meqenëse ekuacioni politropik nuk ndryshon në formë nga ekuacioni adiabatik, të gjitha marrëdhëniet midis parametrave kryesorë përfaqësohen nga formula të ngjashme me procesin adiabatik.
E njëjta gjë mund të thuhet edhe për shprehjet për përcaktimin e punës së procesit politropik
n1.docx
*Ligji i parë i dinamikës.
Parametrat e trupit të punës fq, V, T, U, i, S.
Energjia e brendshme e trupit punues
Energjia e brendshme e trupit punues. kuptimi fizik dhe dimensioni.
Proceset janë të kthyeshme dhe të pakthyeshme. Ekuilibri dhe joekuilibri.
Entalpia. vetitë fizike.
Kapaciteti termik i lëngut punues
Procesi i gazit izokorik
Procesi i gazit izobarik.
Procesi i gazit izotermik.
procesi i gazit adiabatik.
Ligji i dytë i termodinamikës
Formulimet e ligjit të dytë të termodinamikës.
Cikli Carnot dhe vetitë e tij.
Tavolina me avull uji.
i – S diagrami i avullit të ujit.
procesi adiabatik fq – V , i – S dhe T – S diagramet.
Kompresimi me shumë faza në kompresor.
Cikli i akullit me djegie në V= konst
Cikli i akullit me djegie në fq= konst
Cikli i akullit me furnizim me nxehtësi në Vdhefq = konst
Cikli ICE me furnizim të përzier me nxehtësi.
Cikli i një impianti turbinash me gaz
Cikli i fuqisë së avullit. Cikli Rankine.
Cikli i ftohjes së kompresorit të ajrit.
Cikli i ftohjes së kompresorit me avull.
Procesi i avullimit në fq – V grafiku.
Procesi fq = konst avujt e ujit. Përpunoni imazhin në fq – V , i – S dhe T – S diagramet.
Ngrohje me avull.
Procesi T= konst avujt e ujit. Përpunoni imazhin në fq – V , i – S dhe T – S diagramet.
Tabelat e kapaciteteve mesatare të nxehtësisë. Përcaktimi i nxehtësisë duke përdorur tabela.
Konsumi specifik i avullit dhe nxehtësisë në termocentralet me avull
Cikli i impiantit të turbinave me gaz me rigjenerim.
Ekuacioni i gjendjes së lëngut punues.
Formula Mayer.
Koncepti i "Koeficientit të ftohjes".
Ligji i parë i termodinamikës është një rast i veçantë i ligjit të përgjithshëm të ruajtjes dhe transformimit të energjisë në lidhje me proceset e transformimit të ndërsjellë të nxehtësisë dhe punës. Ligji thotë se shuma e të gjitha llojeve të energjisë në një sistem të izoluar mbetet konstante për çdo proces që ndodh në sistem:
Gjatë zbatimit të një procesi termodinamik, nxehtësia i furnizohet trupit P shkon për të ndryshuar energjinë e saj të brendshme dhe për të kryer punë mekanike:
Për 1 kg lëng pune
PARAMETRAT E TRUPIT TË PUNËSP , V , T , U , I , S .
Quhen sasitë që karakterizojnë trupin në një gjendje të caktuar parametrave shteteve. Më shpesh, gjendja e trupit përcaktohet nga parametrat e mëposhtëm: vëllimi specifik, presioni, entalpia dhe temperatura.
Vëllimi specifik (v) trupi është vëllimi i një njësie të masës së tij. Në termodinamikën teknike, një kilogram (kg) merret si njësi e masës, dhe një metër kub (m 3) merret si njësi vëllimi. Nese nje V - vëllimi në m 3 i zënë nga masa e trupit M në kg, pastaj vëllimi specifik
Dendësiaështë reciproke e vëllimit specifik
presioni p në sistemit ndërkombëtar njësitë (SI) maten në paskale. Pascal (Pa) - presioni i shkaktuar nga një forcë prej 1 njuton (N), e shpërndarë në mënyrë të barabartë në një sipërfaqe normale me të me një sipërfaqe prej 1 m 2. Kështu, në njësitë SI, paskali matet në njuton për metër katror (N / m 2).
Temperatura karakterizon shkallën e trupit të nxehtë. Ajo matet ose në shkallën termodinamike të temperaturës ose në shkallën praktike ndërkombëtare të temperaturës. Njësia e temperaturës termodinamike është kelvini (K), që është 1/273,16 e temperaturës termodinamike të pikës së trefishtë të ujit.
Entalpia
u dhe punon pv .
Ku dl t ( dl t = - vdp ).
Vlera i fq , v , T , dhe. Kuptimi fizik i sasisë i mund të shpjegohet në bazë të ekuacionit dq = di - vdp, e cila për procesin fq = const do të shkruhet si:
dq p = di . (86)
Nga rrjedh se di
Ndryshimi i entalpisë në çdo proces përcaktohet vetëm nga gjendja fillestare dhe përfundimtare e trupit dhe nuk varet nga natyra e procesit.
Entropiaështë një funksion i gjendjes, prandaj ndryshimi i tij në procesin termodinamik përcaktohet vetëm nga vlerat fillestare dhe përfundimtare të parametrave të gjendjes. Ndryshimi i entropisë në proceset bazë termodinamike:
në izokorik
në isobarike
në izotermike
në adiabatik
në politropike
ENERGJIA E BRENDSHME E TRUPIT TË PUNËS, KUPTIMI FIZIK DHE DIMENSIONALITETI.
Energjia e brendshme- kjo është e gjithë energjia që përmban trupi ose sistemi i trupave. Kjo energji mund të përfaqësohet si shumë lloje të caktuara energjitë: energjia kinetike e molekulave, duke përfshirë energjinë e përkthimit dhe lëvizje rrotulluese molekulat, dhe lëvizje osciluese atomet në vetë molekulën; energjia e elektroneve; energjia intranukleare; energjitë e bashkëveprimit ndërmjet bërthamës së një molekule dhe elektroneve; energjia potenciale ose energjia e pozicionit të molekulave në çdo fushë të jashtme të forcave; energjia e rrezatimit elektromagnetik.
Energjia totale e brendshme e trupit zakonisht shënohet U(J) dhe energjinë specifike të brendshme ju (j/kg) .
Energjia e brendshme është:
Ku është e brendshme energjia kinetike molekulat, të brendshme energji potenciale molekulat, është konstanta e integrimit.
Në termodinamikën teknike, konsiderohen vetëm procese të tilla në të cilat komponentët kinetikë dhe potencialë të energjisë së brendshme ndryshojnë.
Ndryshimi në energjinë e brendshme të një gazi ideal për çdo proces me një ndryshim të pafundëm të gjendjes (për 1 kg)
Në llogaritjet termike, zakonisht kërkohet të dihet ndryshimi i energjisë së brendshme, dhe jo vlera e saj absolute; prandaj, pika e referencës (0 K ose 0 0 C) për rezultati përfundimtar() e parëndësishme.
ku është kapaciteti mesatar i masës së nxehtësisë në një vëllim konstant brenda
Kështu, ndryshimi në energjinë e brendshme të një gazi ideal për çdo proces është i barabartë me produktin e kapacitetit mesatar të nxehtësisë në një vëllim konstant dhe ndryshimit të temperaturës së gazit.
PROCESET JANË TË KTHYSHME DHE TË KTHYSHME. EKUILIBRI DHE JO EKUILIBRI
Një proces termodinamik është një ndryshim i njëpasnjëshëm në gjendjen e një trupi që ndodh si rezultat i ndërveprimit energjetik të trupit punues me mjedisin.
Konceptet e procesit termodinamik të kthyeshëm dhe të pakthyeshëm janë të lidhura ngushtë me ekuilibrin e sistemit. Le të shqyrtojmë një sistem të tillë termodinamik në të cilin nuk ka shkëmbim nxehtësie me mjedisin (sistemi termodinamik adiabatik). Proceset termodinamike që ndodhin në një sistem të tillë quhen të kthyeshëm nëse sistemi kthehet në gjendjen e tij origjinale gjatë proceseve të drejtpërdrejta dhe të kundërta pa ndonjë efekt termik shtesë. mjedisi ndaj sistemit. Nëse sistemi nuk mund të kthehet në gjendjen e tij origjinale gjatë procesit të kundërt ose kjo kërkon furnizim me nxehtësi, atëherë një proces i tillë quhet i pakthyeshëm.
Procesi me çdo ndryshim në presion dhe temperaturë mund të jetë i kthyeshëm vetëm nëse, gjatë gjithë procesit nga pika në pikë e sistemit termodinamik, presioni është konstant dhe temperatura në çdo pikë është e barabartë me temperaturën e ambientit ose ndryshimi i tyre është pafundësisht i vogël. .
Proceset termodinamike të kthyeshme janë rasti ideal ose teorik. Të gjitha proceset reale janë të pakthyeshme, pasi në praktikë është e vështirë të plotësohet kushti kuazi-statik. Përveç kësaj, pakthyeshmëria e proceseve shkaktohet nga prania e fërkimit të brendshëm në lëngun e punës dhe fërkimi sipërfaqësor në pajisjet teknike (rrjedhja në grykë, fërkimi i sipërfaqes së pistonit kundër murit të cilindrit, etj.). Për të kapërcyer fërkimin, është gjithmonë e nevojshme të shpenzoni një sasi të caktuar të punës mekanike, e cila gjatë procesit shndërrohet në nxehtësi.
ENTALPI. VETITË FIZIKE
Entalpia e një trupi termodinamik është shuma e energjisë së brendshme u dhe punon fq v .
Ku dl t - ka një ndryshim në punën teknike ( dl t = - vdp ).
Ekuacioni që rezulton është gjithashtu formulimi i dytë i ligjit të parë të termodinamikës, duke përdorur konceptet e entalpisë dhe punës teknike. 
Vlera i mund të konsiderohet edhe si parametër i gjendjes së një trupi termodinamik së bashku me të paraqitur më parë fq , v , T , u . Kuptimi fizik i sasisë i mund të shpjegohet në bazë të ekuacionit ( dq = di - vdp), i cili për procesin fq = const do të shkruhet si: dq p = di .
Nga rrjedh se di
është një sasi elementare e nxehtësisë që i jepet një trupi termodinamik në procesin e presionit konstant.
Ndryshimi i entalpisë në çdo proces përcaktohet vetëm nga gjendja fillestare dhe përfundimtare e trupit dhe nuk varet nga gjendjet e ndërmjetme dhe nga natyra e procesit.
KAPACITETI NXEHTËSOR I MJETETIT PUNE
kapaciteti i nxehtësisë quaj sasinë e nxehtësisë që duhet t'i jepet një trupi (gaz) në mënyrë që të rritet temperatura e çdo njësie sasiore me 1 ° C.
Për të përcaktuar vlerat e kapaciteteve të nxehtësisë të listuara më sipër, mjafton të dini vlerën e njërit prej tyre. Është më e përshtatshme të kemi vlerën e kapacitetit molar të nxehtësisë, pastaj kapacitetin e nxehtësisë në masë:
dhe kapaciteti vëllimor i nxehtësisë:
Kapacitetet vëllimore dhe masive të nxehtësisë janë të ndërlidhura nga varësia:
ku është dendësia e gazit në kushte normale.
Kapaciteti termik i një gazi varet nga temperatura e tij. Mbi këtë bazë dallohet kapaciteti mesatar dhe i vërtetë i nxehtësisë.
Nese njeq-
sasia e nxehtësisë e raportuar në një njësi të sasisë së gazit (ose e hequr prej saj) kur temperatura e gazit ndryshon nga t 1
përpara t 2
pastaj
përfaqëson kapaciteti mesatar i nxehtësisë brenda. Kufiri i këtij raporti, kur diferenca e temperaturës tenton në zero, quhet kapaciteti i vërtetë i nxehtësisë.
PROCESI I GAZIT ISOKORIK
Procesi izokorik- procesi i komunikimit ose heqjes së nxehtësisë në një vëllim konstant të gazit (
v
=
konst).
Në një vëllim konstant, presioni i një gazi ndryshon në përpjesëtim të drejtë me temperaturat absolute:
Puna e jashtme gaz në v
=
konstiti është zero l=0.
sasia e nxehtësisë ose ndryshimi në energjinë e brendshme të gazit:
Procesi izokorik pv- grafiku shfaqet nga një vijë e drejtë vertikale - izokore. Me një sasi pozitive nxehtësie, linja shkon nga poshtë lart.
Ndryshimi i entropisë është:
PROCESI I GAZIT IZOBARIK.
Procesi izobarik - procesi i komunikimit ose heqjes së nxehtësisë në presion të vazhdueshëm (R
= konst)
Kurba e procesit quhet izobar.
Sepse në një proces izobarik dp=0
atëherë nuk kryhet asnjë punë teknike në sistem dhe sasia e nxehtësisë e nevojshme për të transferuar trupin nga gjendja 1 në gjendjen 2 përcaktohet si:
Kështu, në një proces termodinamik izobarik, sasia e nxehtësisë e furnizuar (e hequr) në trup është proporcionale me ndryshimin e entalpisë në këtë proces. Ky përfundim është i vlefshëm si për proceset e kthyeshme ashtu edhe për ato të pakthyeshme, me kusht që sistemi të jetë në ekuilibër termodinamik në fillim dhe në fund të procesit.
Për një proces të kthyeshëm:
procesi izobarik pv –
diagrami shfaqet si një vijë e drejtë horizontale. Kur nxehtësia i shtohet procesit, linja shtrihet nga e majta në të djathtë.

Puna mekanike në një proces të tillë:
Puna e jashtme specifike e disponueshme (e dobishme):
Nga ekuacioni i gjendjes për një gaz ideal, marrëdhënia e mëposhtme mund të merret për një proces izobarik:
Kështu, në një proces izobarik, vëllimi i një gazi ideal është proporcional me temperaturë absolute. Kur një gaz zgjerohet, temperatura rritet, kur ngjeshet, zvogëlohet.
Ndryshimi i entropisë në një proces izobarik mund të llogaritet si më poshtë:
PROCESI I GAZIT ISOTERMAL.
Procesi izotermik - procesi i komunikimit ose. heqja e nxehtësisë në temperaturë konstante (
t
-
konst)
Për një proces izotermik të një gazi ideal, marrëdhënia midis parametrave fillestarë dhe përfundimtarë përcaktohet nga formula:
Në temperaturë konstante, vëllimi i një gazi ndryshon në mënyrë të kundërt me presionin e tij.
Në pv-
Diagramet izotermike të gazit ideal përfaqësohen nga një hiperbolë barabrinjës. Zona nën lakoren e procesit shpreh numerikisht punën mekanike në një proces të caktuar. 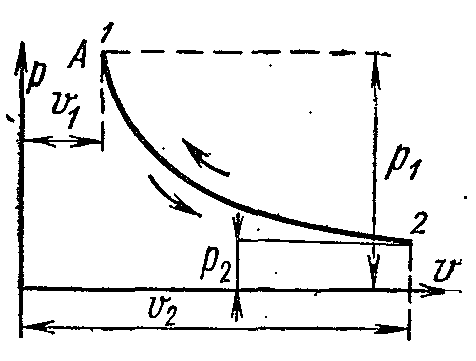
Puna e 1 kg gaz ideal gjendet nga ekuacionet:
Meqenëse në një proces izotermik t
= konst, pastaj për një gaz ideal
Ndryshimi i entropisë në një proces izotermik
Shprehet me formulën e mëposhtme:
PROCESI I GAZIT ADIABATIK.
Procesi vazhdon pa furnizim dhe largim të nxehtësisë, d.m.th. në mungesë të shkëmbimit të nxehtësisë me mjedisin, quhet adiabatik, dhe kurba e këtij procesi quhet adiabatike. Kushtet e procesit: dq=0 , q=0.
Sepse dq=0 , atëherë sipas ligjit të parë të termodinamikës:
Kështu kryhet nga trupi punues punë mekanike në një proces termodinamik adiabatik është i barabartë me një ulje të energjisë së brendshme të trupit, ndërsa puna teknike është në përpjesëtim me ndryshimin (uljen) e entalpisë. Në një proces diabatik të kthyeshëm, entropia e një trupi termodinamik nuk ndryshon: S= Konst.
Ekuacioni adiabatik në sistemin koordinativ pv – diagramet me kapacitet të vazhdueshëm nxehtësie () për një gaz ideal: ku është eksponenti adiabatik
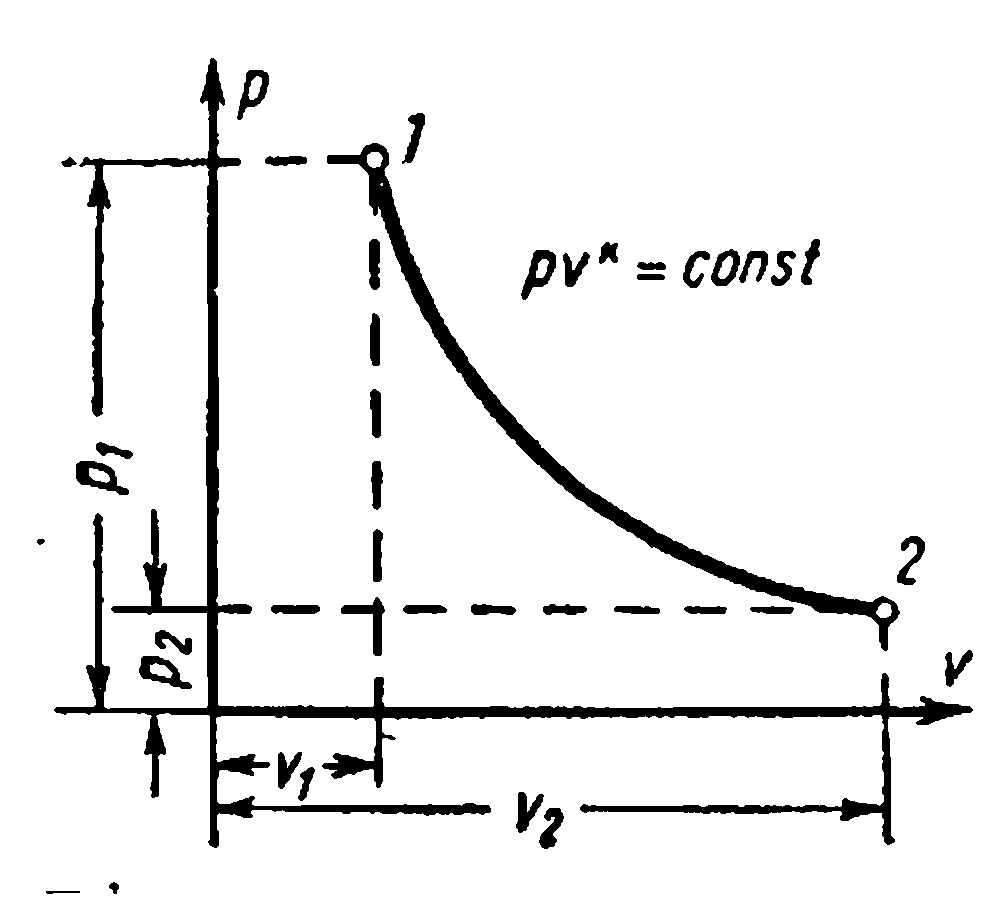
Varësitë ndërmjet parametrave fillestarë dhe përfundimtarë të procesit: ndërmjet R dhe v ,
ndërmjet T dhe v
ndërmjet R dhe T
Puna e 1 kg gaz gjendet me formulat e mëposhtme
Ndryshimi i energjisë së brendshme të gazit dhe puna e procesit adiabatik janë të barabarta në madhësi dhe të kundërta në shenjë. .
Ndryshimi në energjinë e brendshme të një gazi ideal në një proces adiabatik mund të shprehet gjithashtu me ekuacion
Ligji i dytë i termodinamikës
Ligji i dytë i termodinamikës përcakton drejtimin e rrjedhës së proceseve termike spontane në natyrë dhe përcakton kushtet për shndërrimin e nxehtësisë në punë. Ligji thotë se nxehtësia në natyrë kalon spontanisht vetëm nga trupat që janë më të nxehtë në më pak të nxehtë.
Në përputhje me ligjin e dytë të termodinamikës, për të kthyer nxehtësinë në punë në çdo motor ngrohjeje, është e nevojshme të kemi dy trupa me temperatura të ndryshme. Një trup më i nxehtë do të jetë një burim nxehtësie për punë, një trup më pak i nxehtë do të jetë një lavaman nxehtësie. Në këtë rast, efikasiteti i motorit të nxehtësisë do të jetë gjithmonë më i vogël se uniteti.
Ligji i dytë i dinamikës mund të shprehet matematikisht:
Ku dS –
një rritje pafundësisht e vogël e entropisë së sistemit;
dQ – një sasi e pafundme nxehtësie e marrë nga sistemi nga një burim nxehtësie;
T - temperatura absolute e burimit të nxehtësisë.
Shenja e pabarazisë korrespondon me procese të pakthyeshme dhe e barabartë me ato të kthyeshme. Prandaj, shprehja analitike për ligjin e dytë të termodinamikës për një proces të kthyeshëm pafundësisht të vogël merr formën
dQ= TdS
dhe që nga ajo kohë sipas ligjit të parë të termodinamikës
dQ=dU+pdV
TdS=dU+pdV.
Cikli Carnot dhe vetitë e tij.
Cikli Carnot. Përbëhet nga dy izoterma dhe dy adiabate. Ky cikël është një proces i mbyllur që kryhet nga lëngu i punës në një motor ngrohje ideale në prani të dy burimeve të nxehtësisë: një ngrohës dhe një frigorifer.

Cikli i Carnot pv-diagramë
Proceset 1-2 dhe 3-4 janë izotermale, ndërsa proceset 2-3 dhe 4-1 janë adiabatike. Merret temperatura fillestare e lëngut të punës në cikël e barabartë me temperaturën ngrohësT 1 . Gjatë zgjerimit izotermik nga gjendja 1 në gjendjen 2, lëngu i punës merr nga ngrohësi sasinë e nxehtësisë.q 1 në një temperaturëT 1 . Në seksionin 2-3, lëngu i punës zgjerohet në mënyrë adiabatike. Në të njëjtën kohë, temperatura e lëngut të punës zvogëlohet ngaT 1 përpara T 2 dhe presioni bie nga fq 2 përpara fq 3 . Kur kompresohet përgjatë izotermës 3-4, sasia e nxehtësisë largohet nga lëngu i punës në frigorifer.q 2 në një temperaturëT 2 . Tkurrje e mëtejshme adiabatike4-1 çon në një rritje të temperaturës së lëngut të punës ngaT 2 përpara T 1 , dhe lëngu i punës kthehet në gjendjen e tij origjinale.
Puna totale e ciklitl c paraqitet grafikisht nga një sipërfaqe prej 12341.
Efikasiteti i ciklit termik:
Puna e ciklit Carnot
Efikasiteti termik cikli:

Karakteristikat e ciklit:
Raporti i kompresimit
Raporti i presionit
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Një cikël me furnizim me nxehtësi në presion konstant përbëhet nga dy adiabat, një izobar dhe një izokor.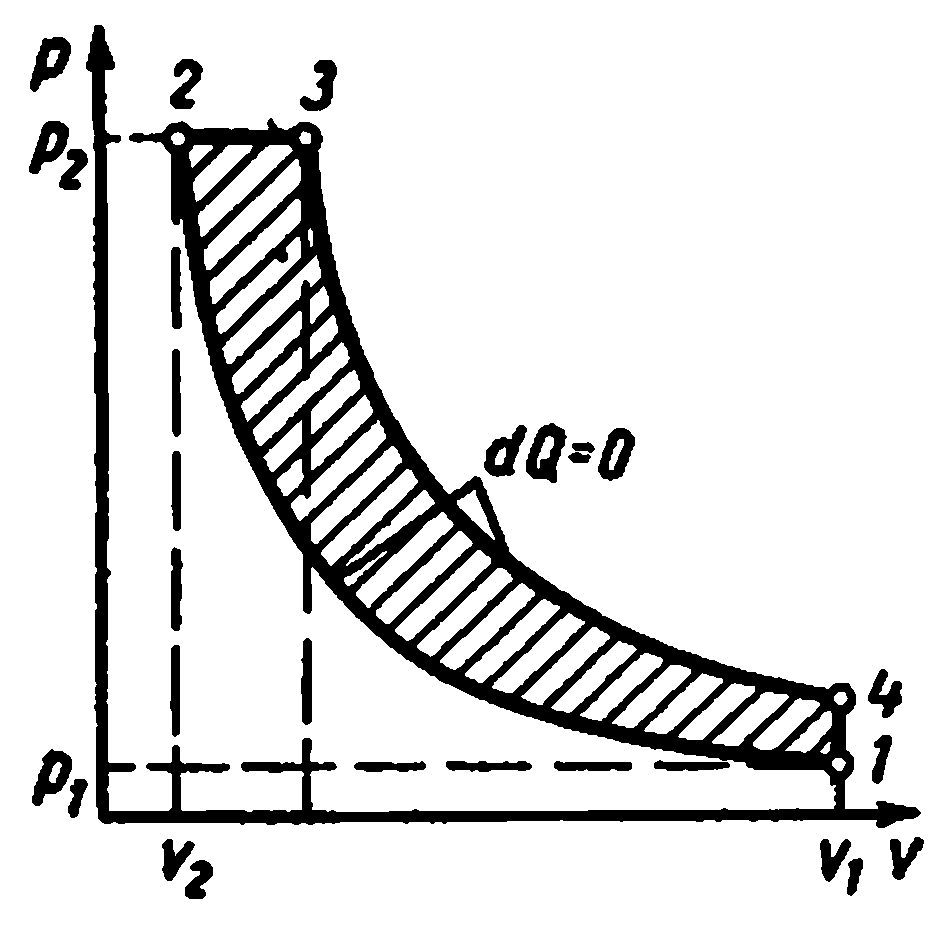
Karakteristikat e ciklit:
Raporti i kompresimit
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Cikli me furnizim të kombinuar me nxehtësi përbëhet nga dy adiabat, dy izokore dhe një izobar

Karakteristikat e Ciklit
Sasia e nxehtësisë së dhënë
Sasia e nxehtësisë së hequr
Efikasiteti termik ciklit
Tavolina me avull uji.
avull i mbinxehur ose avulli i ngopur në vetitë e tyre ndryshojnë ndjeshëm nga gazet ideale. Ekuacionet për gjendjen e avujve janë shumë komplekse dhe nuk përdoren në praktikën llogaritëse. Për qëllime praktike përdoren tabela dhe diagrame, të përpiluara në bazë të të dhënave eksperimentale dhe teorike. Tabelat janë përpiluar me një shkallë të lartë saktësie për mbinxehje dhe avujt e ngopur deri në temperaturën 1000 0 C dhe presionin 98.0 MPa.
Në tabelat për avull i ngopur temperaturat e ngopjes, presionet, vlerat vëllime specifike, entalpia dhe entropia e avullit të lëngshëm dhe të thatë, nxehtësia e avullimit. Në tabelat e avullit të mbinxehur jepen vlerat e parametrave kryesorë për presione dhe temperatura të ndryshme: vëllimi specifik, entalpia dhe entropia.
i – S diagrami i avullit të ujit.
dinjitet i madh është diagrami është se puna teknike dhe sasia e nxehtësisë e përfshirë në procese përfaqësohen nga segmentet e linjës, jo nga zonat. Gjatë ndërtimit është- grafikët vizatuar përgjatë boshtit y entalpi specifikeçift, dhe përgjatë abshisës është entropia specifike. Origjina e koordinatave merret si gjendja e ujit në të pikë e trefishtë, ku, .
Duke përdorur të dhënat e tabelave të avullit të ujit, kurbat kufitare të lëngut dhe avullit janë paraqitur në diagram, duke konverguar në pikën kritike K. Lakorja kufitare e lëngut largohet nga origjina, sepse në këtë pikë, entropia dhe entalpia merren të barabarta me zero. Gjendja e ujit shënohet me pika në izobaret përkatëse. Linjat Isobar në zonë avull i lagësht janë vija të drejta të pjerrëta që dalin nga kurba e kufirit të lëngut. Në një proces izobarik:
Pjerrësia e izobarit drejt abshisës në secilën pikë të diagramit është numerikisht e barabartë me temperaturën absolute të gjendjes së dhënë. Sepse në zonën e avullit të lagësht, izobari përkon me izotermën, atëherë sipas ekuacionit të fundit, izobari i avullit të lagësht janë vija të drejta:
Dhe ky është ekuacioni i një vije të drejtë. Në rajonin e avullit të mbinxehur, izobaret kanë një lakim me një konveksitet të drejtuar nga poshtë. Në zonën e avullit të lagësht aplikohet një rrjet vijash me tharje konstante avulli (x=const), të cilat konvergojnë në pikën kritike K.
Izotermat në rajonin e avullit të lagësht përkojnë me izobaret. Në zonën e avullit të mbinxehur, ato ndryshojnë: izobaret ngrihen lart, dhe izotermat janë vija të lakuara me një konveksitet lart. Një rrjet izokoresh është aplikuar në diagram, të cilat kanë formën e kthesave që ngrihen më shumë në krahasim me izobaret. Një proces adiabatik i kthyeshëm përfaqësohet nga një vijë e drejtë vertikale. Zona nën izobarin e pikës së trefishtë përshkruan gjendjet e përzierjes së avullit + akullit.
procesi adiabatikfq – V , i – S dheT – S diagramet.
Procesi adiabatik zhvillohet pa furnizim dhe largim të nxehtësisë, dhe entropia e lëngut të punës në procesin e kthyeshëm mbetet vlerë konstante: s=konst. Prandaj, në është
dhe
Ts-
Diagramet adiabatike paraqiten me vija të drejta vertikale: fig. a dhe b 

Gjatë zgjerimit adiabatik, presioni dhe temperatura e avullit ulen; avulli i mbinxehur kthehet në avull të thatë dhe më pas në avull të lagësht. Nga kushtet e qëndrueshmërisë së entropisë, është e mundur të përcaktohen parametrat përfundimtarë të avullit nëse dihen parametrat e gjendjes fillestare dhe një parametër të gjendjeve përfundimtare.
Në pv- në diagram, një proces adiabatik i kthyeshëm përshkruhet nga një kurbë e caktuar (Fig. c)
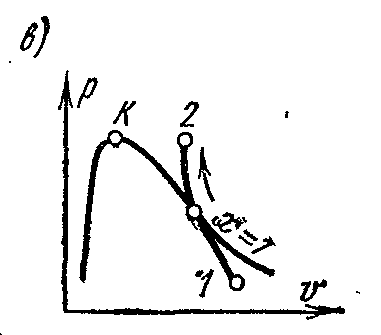
Puna specifike në një proces adiabatik përcaktohet nga ekuacioni:
Ndryshimi në energjinë specifike të brendshme:
Kompresimi me shumë faza në kompresor.
Kompresorët me shumë faza përdoren për të prodhuar gaz me presion të lartë
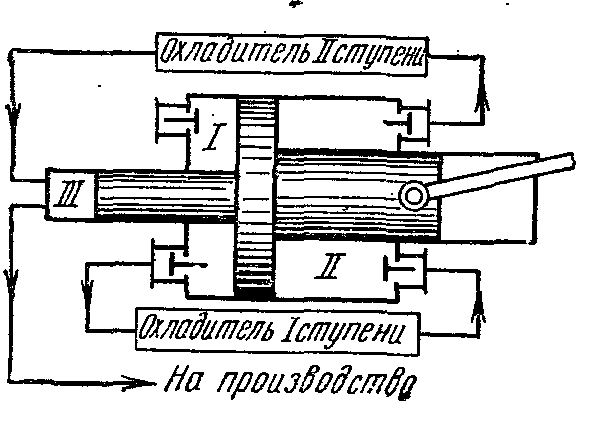
Në të cilin ngjeshja e gazit kryhet në mënyrë politropike në disa cilindra të lidhur në seri me ftohjen e ndërmjetme të tij pas çdo ngjeshjeje.
Përdorimi i kompresimit të gazit në disa cilindra ul raportin e presionit në secilin prej tyre dhe rrit efikasitetin vëllimor. kompresor. Përveç kësaj, ftohja e ndërmjetme e gazit pas çdo faze përmirëson kushtet e lubrifikimit të pistonit në cilindër dhe zvogëlon konsumin e energjisë për ngasjen e kompresorit.

Diagrami tregues ideal i një kompresori me tre faza, ku 0-1 është linja e thithjes në fazën e parë;
1-2 - procesi i kompresimit politropik në fazën e parë; 2-a - linja e injektimit nga faza e parë në ftohësin e parë; a-3 - linja e thithjes në fazën e dytë; 3-4 - procesi i kompresimit politropik në fazën e dytë; 4-c - linja e shkarkimit nga faza e dytë në ftohësin e dytë; c-5 - linja e thithjes në fazën e tretë; 5-6 - procesi i kompresimit politropik në fazën e tretë; 6-c - linja e injektimit nga faza e tretë në rezervuar ose në prodhim. Segmentet 2-3, 4-5 përshkruajnë uljen e vëllimit të gazit në proces me presion konstant nga ftohja në ftohësit e parë dhe të dytë. Ftohja e lëngut të punës në të gjithë ftohësit kryhet në të njëjtën temperaturë të barabartë me fillestarin T 1, prandaj, temperaturat e gazit në pikat 1, 3 dhe 5 janë të njëjta dhe shtrihen në izotermën 1 - 7.
Raporti i presioneve në të gjitha fazat zakonisht merret i njëjtë:
Me të njëjtat raporte presioni në të gjitha fazat, barazia e temperaturave fillestare dhe barazia e treguesve politropikë, temperaturat përfundimtare të gazit në fazat individuale të kompresorit janë të barabarta me njëra-tjetrën:
Shkalla e rritjes së presionit në çdo fazë ose në fazat z
Shkalla e rritjes së presionit në çdo fazë është e barabartë me rrënjën shkalla z-të nga raportet e presionit përfundimtar
Kthehu në fillim
Me temperatura të barabarta të gazit në hyrje të çdo faze dhe raporte të barabarta presioni në të gjithë cilindrat, marrim barazinë e punës së shpenzuar në të gjitha fazat e kompresorit:
Në hapin e dytë
Puna në fazën e tretë
Ku l 1
=l 2
=l 3
Puna specifike totale në joule e shpenzuar për kompresimin e gazit në tre faza të kompresorit: l te =3 l 1
Në të njëjtat kushte të kompresimit të gazit, sasitë e nxehtësisë së larguar nga gazi në faza të veçanta janë të barabarta me njëra-tjetrën:
Nxehtësia e larguar nga gazi në çdo ftohës gjatë procesit të ftohjes izobarike gjendet me formulën:

AT Ts- Në diagrame, proceset e ngjeshjes adiabatike tregohen me vija të drejta 1-2, 3-4, 5-6 dhe proceset e ftohjes me kthesat 2-3, 4-5, 6-7.
Proceset e kompresimit politropik tregohen nga kthesat 1-2, 3-4, 5-6, dhe proceset e ftohjes në ftohës - nga rreshtat 2-3, 4-5, 6-7.
Cikli i akullit me djegie nëV = konst
![]()
Figura tregon një diagram tregues të një motori që funksionon me karburant me djegie të shpejtë në një vëllim konstant. Si lëndë djegëse përdoret benzina, gazi ndriçues apo gjeneratori, alkoolet etj.
Kur pistoni lëviz nga pozicioni i majtë i vdekur në ekstremin e djathtë, përzierja e djegshme thithet përmes valvulës së thithjes. Ky proces përshkruhet nga një kurbë 0-1, e quajtur linja e thithjes, nuk është një proces termodinamik, sepse. në të, parametrat kryesorë nuk ndryshojnë, por vetëm masa dhe vëllimi i përzierjes në cilindër ndryshojnë. Kur pistoni lëviz prapa, valvula e thithjes mbyllet dhe përzierja e djegshme kompresohet. Përshkruar nga kurba 1-2, e quajtur linja e kompresimit. Në pikën 2, përzierja e djegshme ndizet nga një shkëndijë elektrike. Djegia e përzierjes së djegshme ndodh pothuajse menjëherë, d.m.th. në vëllim pothuajse konstant. Ky proces përshkruhet nga kurba 2-3. Si rezultat i djegies së karburantit, temperatura e gazit rritet ndjeshëm dhe presioni rritet (pika 3). Pastaj produktet e djegies zgjerohen. Pistoni lëviz në pozicionin e duhur të vdekur dhe gazrat bëjnë punë të dobishme. Në diagramin e treguesit, procesi i zgjerimit përshkruhet nga një kurbë 3-4, e quajtur vija e zgjerimit. Në pikën 4, valvula e shkarkimit hapet dhe presioni në cilindër bie në presion pothuajse të jashtëm. Me lëvizjen e mëtejshme të pistonit nga e djathta në të majtë, produktet e djegies hiqen nga cilindri përmes valvulës së shkarkimit me një presion pak më të madh. Presioni i atmosferës. Ajo përshkruhet si një kurbë 4-0 dhe quhet vija e shkarkimit. Një rrjedhë e tillë e punës përfundon në katër goditje të pistonit ose në dy rrotullime të boshtit. Motorë të tillë quhen me katër goditje.
Cikli me furnizim me nxehtësi në vëllim konstant përbëhet nga dy adiabat dhe dy izokore
Karakteristikat e ciklit janë:
- raporti i kompresimit
– shkalla e rritjes së presionit
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
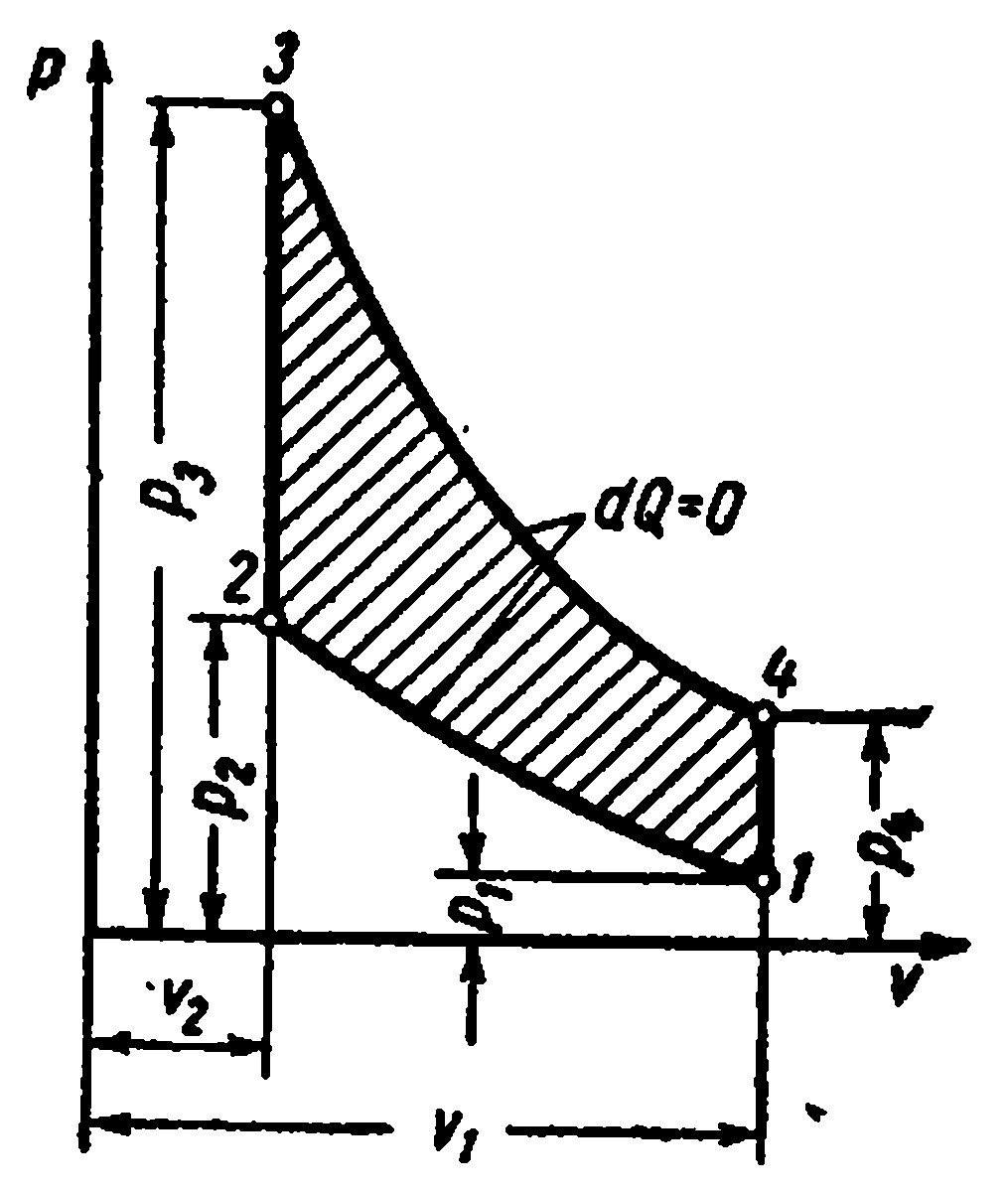
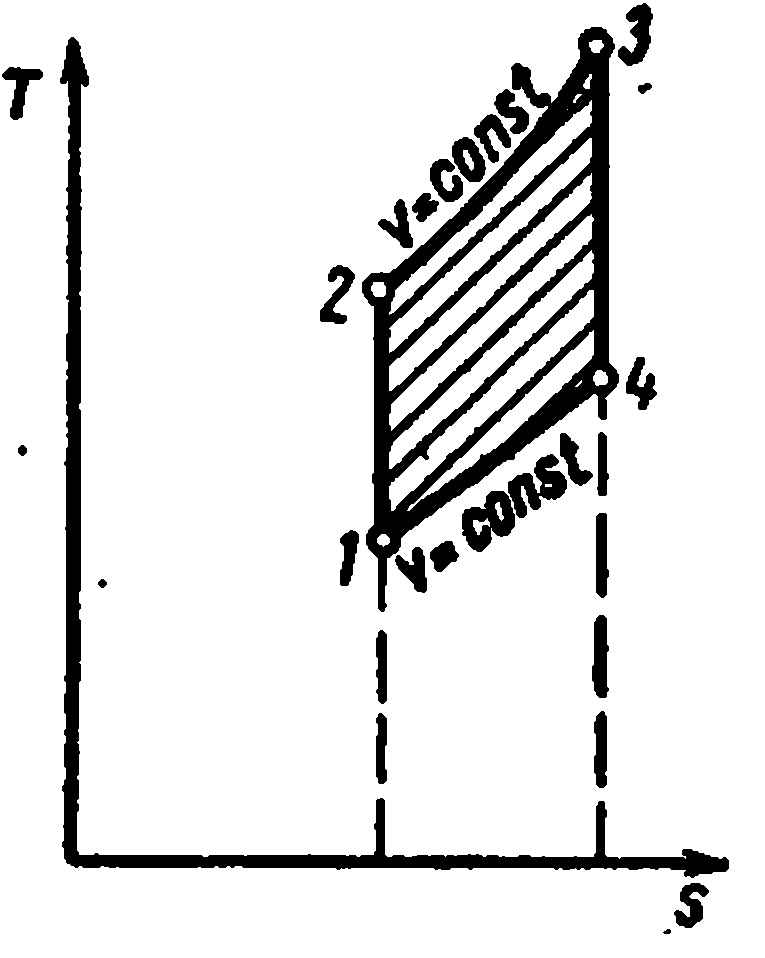
Cikli i akullit me djegie nëfq = konst
Studimi i cikleve me furnizim me nxehtësi në një vëllim konstant tregoi se për të rritur efikasitetin e një motori që funksionon sipas këtij cikli, është e nevojshme të aplikohen raporte të larta kompresimi. Ajri me kompresim të lartë ka një temperaturë kaq të lartë sa që karburanti i furnizuar në cilindër ndizet spontanisht pa ndezës. Kompresimi i veçantë i ajrit dhe karburantit lejon përdorimin e çdo karburanti të lëngshëm të rëndë dhe të lirë - naftë, naftë, rrëshirë, vajra qymyri.
Ky avantazh posedohet nga motorët që funksionojnë me djegie graduale të karburantit me presion konstant. Në to, ajri është i ngjeshur në cilindrin e motorit, dhe karburanti i lëngshëm spërkatet me ajër të ngjeshur nga kompresori.
Cikli ideal i motorit me djegie graduale të karburantit me presion konstant, d.m.th. cikli me furnizimin e nxehtësisë me presion konstant kryhet si më poshtë.
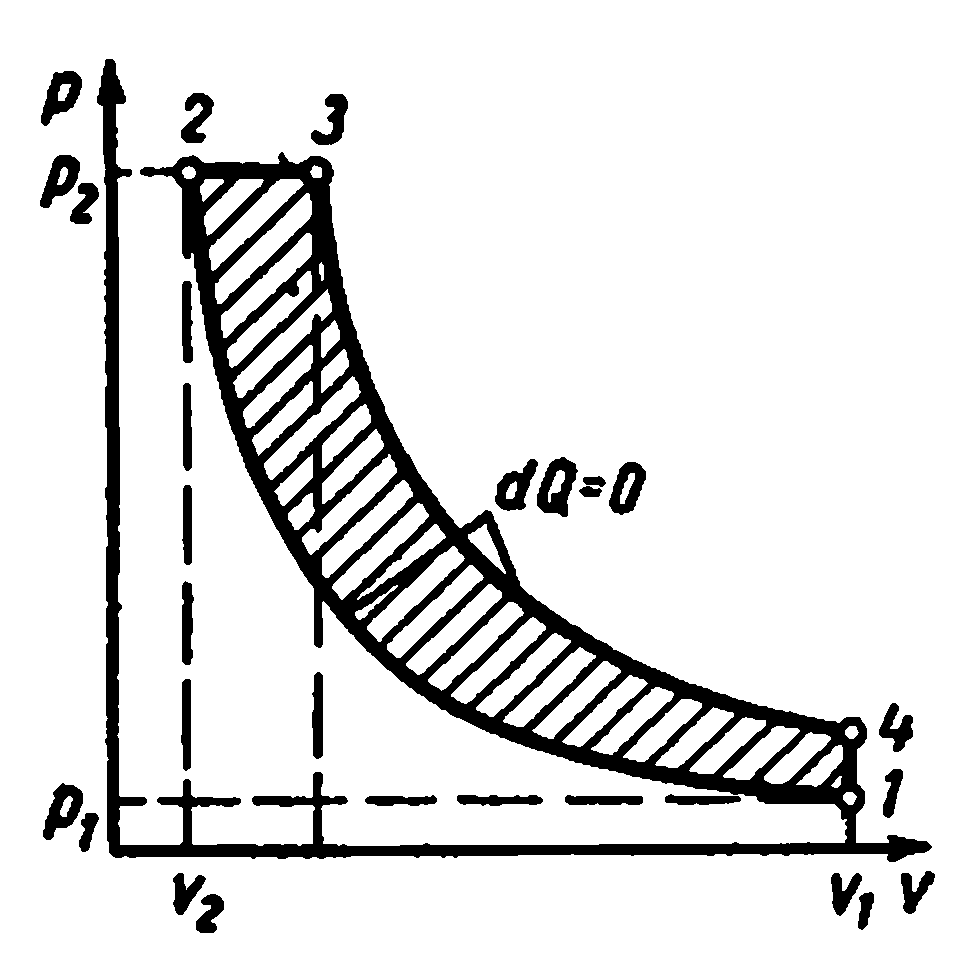

Lëngu punues i gaztë me parametra fillestarë fq 1 , v 1 , T 1 tkurret përgjatë adiabatit 1-2; atëherë një sasi e caktuar nxehtësie i jepet trupit përgjatë izobarit 2-3 q 1 . Nga pika 3, trupi i punës zgjerohet përgjatë adiabatit 3-4. Sipas izokorës 4-1, lëngu i punës kthehet në gjendjen e tij origjinale, ndërsa nxehtësia largohet në lavamanin e nxehtësisë. q 2 .
Karakteristikat e ciklit:
Raporti i kompresimit
Shkalla e parazgjerimit.
Sasia e nxehtësisë së furnizuar:
Sasia e nxehtësisë së hequr:
Punë me cikël
Efikasiteti termik cikli:
Cikli i akullit me furnizim me nxehtësi nëV dhe fq = konst
Në një motor me kompresim të lartë pa kompresor me një hyrje të përzier nxehtësie, karburanti i lëngshëm furnizohet nga një pompë karburanti përmes një injektori karburanti në kokën e cilindrit në formën e pikave të vogla. Duke hyrë në ajrin e nxehtë, karburanti ndizet dhe digjet spontanisht gjatë gjithë periudhës kur hunda është e hapur: së pari në një vëllim konstant dhe më pas me një presion konstant.
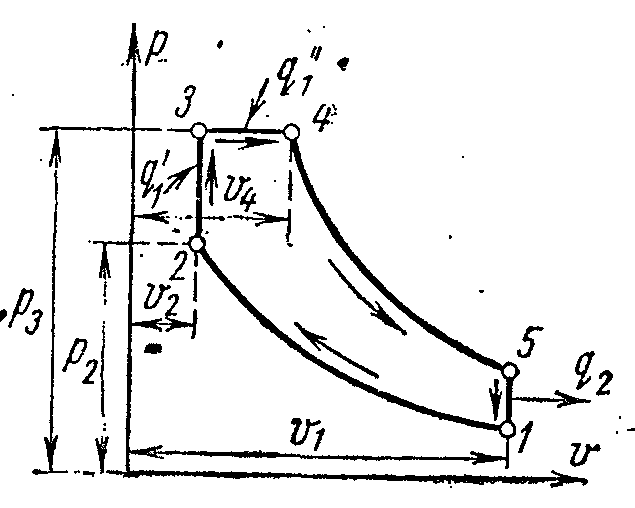

Cikli ideal i një motori me një hyrje të përzier nxehtësie është paraqitur në pv- dheTs- diagramet.
Trupi i punës me parametrat fillestarë fq 1 , v 1 , T 1 është i ngjeshur përgjatë adiabatit 1-2 deri në pikën 2. Fraksioni i parë i nxehtësisë i jepet lëngut punues përgjatë izokorës 2-3. Pjesa e dytë e nxehtësisë furnizohet përgjatë izobarit 3-4. Nga pika 4, trupi i punës zgjerohet përgjatë adiabatit 4-5. Përgjatë izokorës 5-1, lëngu i punës kthehet në gjendjen e tij origjinale - në pikën 1, ndërsa nxehtësia hiqet në lavamanin e nxehtësisë.
Karakteristikat e ciklit janë:
Raporti i kompresimit
– shkalla e rritjes së presionit
Shkalla e parazgjerimit.
Përcaktoni termike efikasiteti i ciklit me kusht që kapaciteti termik c fq ,
c v
dhe eksponent adiabatik k=
c fq /
c v
konstante:
Pjesa e parë e nxehtësisë së furnizuar:
Pjesa e dytë e sasisë së furnizuar të nxehtësisë:
Sasia e nxehtësisë së hequr:
Efikasiteti i ciklit termik
Cikli i një impianti turbinash me gaz
Lëngu i punës në impiantet e turbinave me gaz janë produkte të djegies së lëndëve djegëse të lëngshme ose të gazta.

Figura tregon një diagram të llojit më të zakonshëm të impiantit të turbinave me gaz me djegie të karburantit në presion konstant.
Kompresori K, i vendosur në të njëjtin bosht me një turbinë me gaz T, thith ajrin nga atmosfera dhe e ngjesh atë në një presion të caktuar. Ajri i kompresuar hyn në dhomën e djegies KS; e njëjta pompë karburanti TN furnizohet me karburant të lëngshëm. Djegia bëhet me presion të vazhdueshëm. Nga dhoma e djegies gazrat hyjnë në grykë NGA, nga të cilat ata shpejtësi e lartë futni tehet e punës L turbinat dhe vendosin rotorin në rrotullim. Gazrat e shkarkimit përmes tubit të shkarkimit P lëshuar në atmosferë.
Cikli i turbinës me gaz me furnizim me nxehtësi në procesfq
=
konst
.
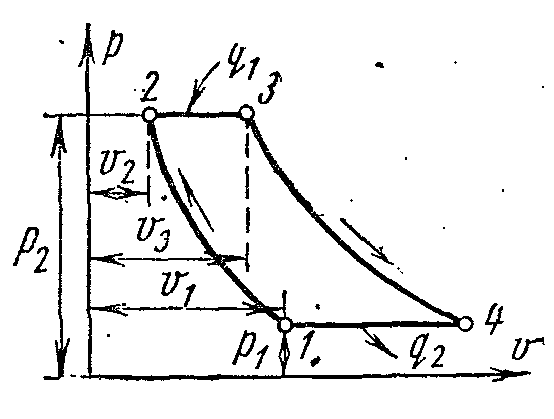
Cikli ideal i një impianti turbinash me gaz në pv- dheTs- diagramet me hyrje të nxehtësisë në fq=
konst.
Cikli përbëhet nga dy adiabat dhe dy izobare.
Nxehtësia hiqet nga lëngu i punës jo përgjatë izokorit, si në një motor me djegie të brendshme, por përgjatë izobarit. Trupi i punës me parametrat fillestarë fq 1 , v 1 , T 1 është i ngjeshur përgjatë adiabatit 1-2 në pikën 2. Nga pika 2, një sasi e caktuar nxehtësie i jepet lëngut të punës q 1 përgjatë izobarit 2-3. Pastaj lëngu i punës zgjerohet përgjatë adiabatit 3-4 deri në presionin fillestar dhe kthehet përgjatë izobarit 4-1 në gjendjen e tij origjinale, ndërsa sasia specifike e nxehtësisë hiqet. q 2 .
Karakteristikat e ciklit janë shkalla e presionit në kompresor dhe shkalla e zgjerimit izobarik.
Sasia e nxehtësisë së futur:
Sasia e nxehtësisë së hequr:
Efikasiteti i ciklit termik
Cikli i fuqisë së avullit. Cikli Rankine.
Cikli ideal Rankine merret si cikli kryesor në një impiant turbinash me avull. Në këtë cikël, lëngu i punës kondensohet plotësisht në kondensator, si rezultat i të cilit, në vend të një kompresori të rëndë joefikas, përdoret një pompë uji ushqyes për furnizimin me ujë të bojlerit, i cili ka përmasa të vogla dhe efikasitet të lartë.
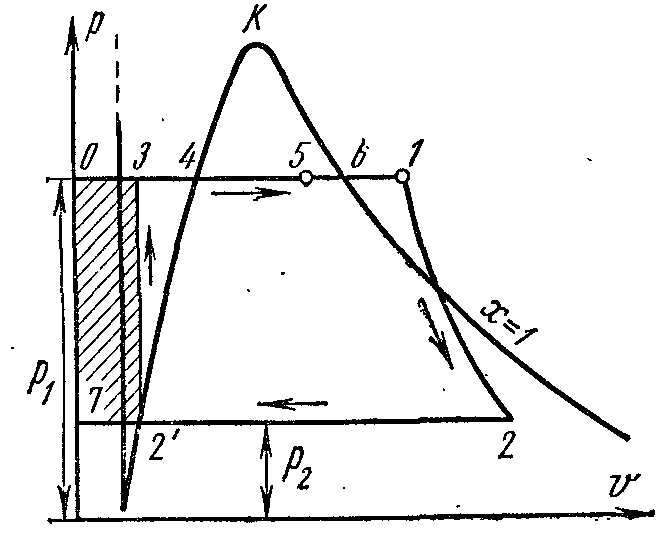
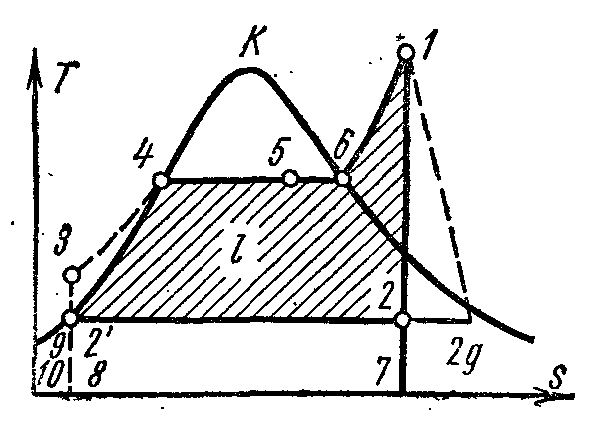
Në pv- pika 4 në diagram karakterizon gjendjen e ujit të vluar në kazan në presion fq 1 . Rreshti 4-5 përshkruan procesin e gjenerimit të avullit në kazan; pastaj avulli thahet në një mbinxehës me presion fq 1 . Avulli që rezulton zgjerohet përgjatë adiabatit 1-2 në cilindrin e motorit me avull në një presion fq 2 në kondensator. Në procesin 2, avulli kondensohet plotësisht në gjendjen e një lëngu të vluar nën presion fq 2 duke transferuar nxehtësinë e avullimit në ujin ftohës. Procesi i ngjeshjes së ujit kryhet në pompë; rritja që rezulton në temperaturën e ujit është e papërfillshme dhe është neglizhuar në studime në presione deri në 3.0-4.0 MPa. Rreshti 3-4 përshkruan ndryshimin në vëllimin e ujit kur nxehet nga temperatura në kondensator në pikën e vlimit. Funksionimi i pompës tregohet si një katror me hije. 03 7. Entalpia e avullit në daljen e superngrohësit në pikën 1 është e barabartë me i 1 dhe me radhë Ts-diagramë paraqitet pl. 9 34617109. Entalpia e avullit në hyrje të kondensatorit në pikën 2 është e barabartë me i 2 dhe me radhë Ts-diagramë paraqitet pl. 9 . Entalpia e ujit kur largohet nga kondensatori në një pikë është e barabartë me i 1 dhe me radhë Ts-diagramë paraqitet pl. 9 8109. Puna e dobishme e avullit në ciklin Rankine l përshkruar në pv- diagrami katror. .
Nëse cikli Rankine merr parasysh funksionimin e pompës, atëherë procesi i ngjeshjes adiabatike të ujit në të do të përfaqësohet nga Ts- diagramë adiabatike, dhe izobar 3-4 korrespondon me ngrohjen e ujit në kazan në presion fq 1 deri në pikën e duhur të vlimit.
Efikasiteti termik i ciklit Rankine përcaktohet nga formula:
Sasia specifike e nxehtësisë në cikël furnizohet në fq=
konst
në proceset 3-4 (ngrohja e ujit deri në pikën e vlimit), 4-6 (avullim) dhe 6-1 (mbinxehja e avullit) dhe është e barabartë me diferencën midis entalpive të pikave fillestare dhe përfundimtare të procesit:
Kjo sasi specifike e nxehtësisë tregohet në Ts-diagramë sq. tetë . Heqja e sasisë specifike të nxehtësisë q 2
kryhet në kondensator përgjatë izobarit 2-, pra
Nxehtësia e hequr përshkruar në Ts-diagramë sq.
Efikasiteti termik i ciklit Rankine:
Cikli i ftohjes së kompresorit të ajrit
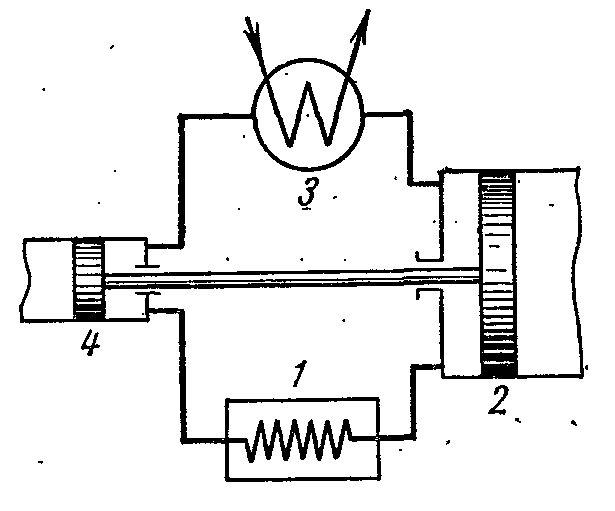
Figura tregon diagramin e një impianti ftohjeje ajri, ku si lëng pune përdoret ajri, i cili është lëngu i punës më i përshtatshëm, i padëmshëm dhe i përballueshëm. Njësia e ftohjes së ajrit funksionon si më poshtë.
Ajri që ftoh dhomën 1 është i ngjeshur në kompresorin 2, si rezultat i të cilit temperatura e tij rritet. Ajri i kompresuar me presion konstant injektohet në shkëmbyesin e nxehtësisë 3, në të cilin ftohet me ujë në temperaturën e ambientit. Pas kësaj, ajri i kompresuar hyn në cilindrin e zgjerimit, ose zgjeruesin 4, ku zgjerohet në presionin fillestar. Kur zgjerohet, temperatura e ajrit bie në -60 ose -70 0 C dhe ajri ftohës dërgohet për të ftohur dhomën, ku, i nxehtë, përsëri hyn në kompresor.

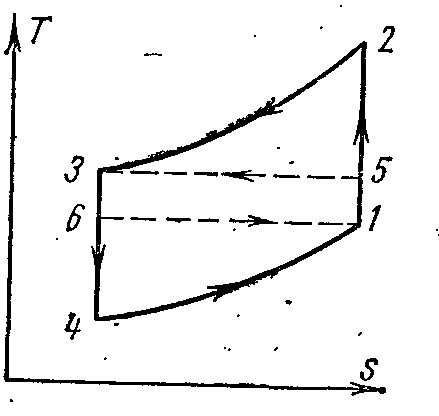
AT pv- dheTs- diagramet:
Ajri në procesin 1-2 është i ngjeshur në mënyrë adiabatike nga presioni fq 1 përpara fq 2 . Në procesin izobarik 2-3, sasia specifike e nxehtësisë largohet nga ajri në një burim të jashtëm dhe temperatura e tij ulet nga T 2 te T 3 . Me zgjerim adiabatik në procesin 3-4, ajri ftohet shtesë nga temperatura T 3 te T 4 . Më tej, në procesin izobarik 4-1, nxehtësia largohet nga dhoma e ftohur (transmetuesi i nxehtësisë), si rezultat i së cilës ajri nxehet nga T 4 te T 1 .
Puna e shpenzuar për zbatimin e ciklit është e barabartë me diferencën në sasitë specifike të nxehtësisë q 1 dhe q 2. Duke supozuar se kapaciteti i nxehtësisë është konstant, kemi:
Pastaj koeficienti i ftohjes së ciklit:
=
Nga proceset adiabatike 1-2 dhe 3-4
Dhe
Por fq 2
=
fq 3
, a fq 1
=
fq 4
pastaj
Më në fund kemi
Ku T 1
është temperatura e dhomës që do të ftohet ose temperatura e ajrit të thithur në kompresor.
T 2 është temperatura e ajrit të kompresuar.
Cikli i ftohjes së kompresorit me avull
Më të përhapurit për trupat ftohës në një temperaturë prej -20 0 C janë njësitë ftohëse në të cilat ftohësi është lëngje me valë të ulët - amoniak, freon, dioksid squfuri dhe të tjera në presione të ulëta (mundësisht afër atmosferës).
Figura tregon një diagram të një njësie kompresori që funksionon me avujt e amoniakut NH 3 .
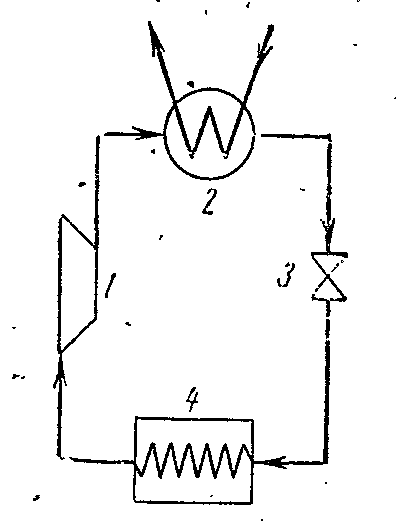

1- kompresor; 2- kondensator; 3- valvula e mbytjes; 4 - dhomë frigoriferike (avullues)
Kompresori kompreson avullin e ngopur të thatë të amoniakut ose avullin e lagësht me një shkallë të lartë thatësie përgjatë adiabatit 1-2 në gjendjen e avullit të mbinxehur në pikën 2. Nga kompresori, avulli injektohet në kondensator, ku shndërrohet plotësisht në një lëng. (procesi 2-3-4). Nga kondensatori, amoniaku i lëngshëm kalon përmes një valvule mbytëse, ku mbytet, e cila shoqërohet me ulje të temperaturës dhe presionit. Më pas amoniaku i lëngshëm me temperaturë të ulët hyn në ftohës, ku duke marrë sasinë e nxehtësisë (në procesin 5-1) avullohet dhe ftohet shëllira, e cila qarkullon në dhomat e ftohura. Procesi i mbytjes si një proces i pakthyeshëm është paraqitur në diagramin e kurbës së kushtëzuar 4-5.
Në një instalim të kompresorit me avull, një cilindër zgjerimi (zgjerues) nuk përdoret, dhe lëngu i punës mbytet në valvulën e kontrollit. Zëvendësimi i cilindrit të zgjerimit me një mbytës shoqërohet me një rritje të entropisë, e cila shkakton njëfarë humbjeje të kapacitetit ftohës, por ky zëvendësim thjeshton shumë instalimin dhe bën të mundur rregullimin e lehtë të presionit të avullit dhe marrjen e një temperature të pakthyeshme në ftohës.
Puna specifike e shpenzuar në cikël: =
Koeficienti i ftohjes së njësisë së kompresorit të amoniakut:
Ku është sasia specifike e nxehtësisë e perceptuar nga avulli i amoniakut në ftohës.
Faktori ftohës i instalimit
Vlerat e entalpisë në ekuacion përcaktohen nga është-diagramë ose sipas tabelës së amoniakut.
Njësitë e ftohjes me avull kanë një avantazh të madh ndaj ftohjes së ajrit. Ato janë kompakte, të lira dhe kanë një COP më të lartë.
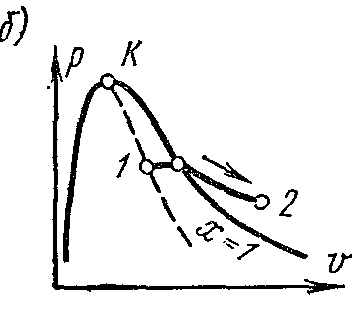
Procesi i avullimit nëfq – V diagramë
Faza pv- grafiku i një sistemi të përbërë nga lëngu dhe avulli është një grafik i varësisë së vëllimeve specifike të ujit dhe avullit nga presioni.
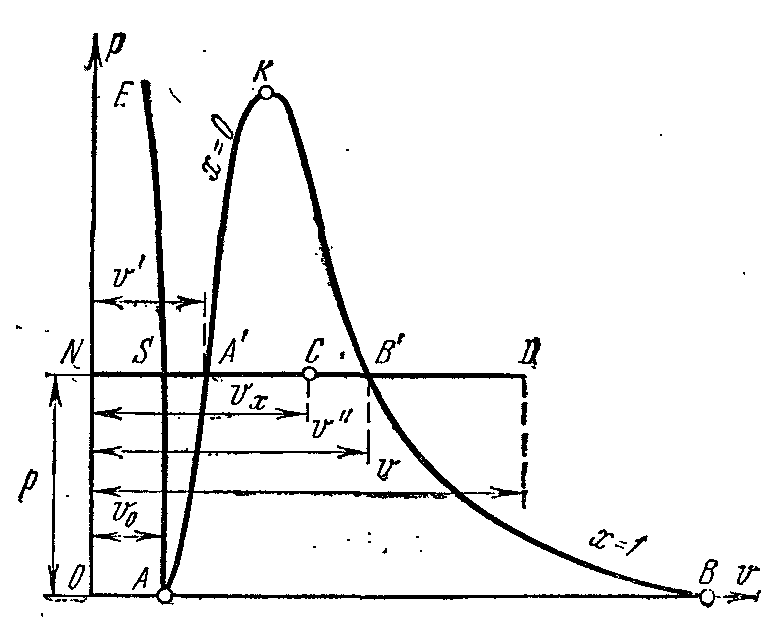
Lëreni ujin në temperaturë 0 0 NGA dhe pak presion? zë një vëllim të caktuar v 0 (segmenti NS) . Kurbë e tërë AE shpreh varësinë e vëllimit specifik të ujit nga presioni në temperaturë 0 0 NGA. Sepse uji është një substancë pothuajse e pakompresueshme, atëherë kurbë AE pothuajse paralel me boshtin y. Nëse nxehtësia i jepet ujit me presion konstant, atëherë temperatura e tij do të rritet dhe vëllimi specifik do të rritet. Në një farë temperature t s uji vlon dhe vëllimi i tij specifik v’ në pikën POR' arrin vlerën maksimale në një presion të caktuar. Me rritjen e presionit, temperatura e lëngut të vluar rritet. t s dhe vëllimi v’ gjithashtu rritet. grafiku i varësisë v’ AK që quhet kurba kufitare e lëngut. Karakteristikë e kurbës është shkalla e thatësisë x=0 . Në rastin e furnizimit të mëtejshëm me nxehtësi me presion konstant, do të fillojë procesi i avullimit. Në të njëjtën kohë, sasia e ujit zvogëlohet, sasia e avullit rritet. Në fund të avullimit në pikë AT' avulli do të jetë i thatë dhe i ngopur. Vëllimi specifik shënohet avulli i thatë i ngopur v’’ .
Nëse procesi i avullimit vazhdon me një presion konstant, atëherë temperatura e tij nuk ndryshon dhe procesi A’ B’ është edhe izobarik edhe izotermik. Në pika A’ dhe B’ substanca është në gjendje njëfazore. Në pikat e ndërmjetme, substanca përbëhet nga një përzierje e ujit dhe avullit. Kjo përzierje trupash quhet sistem dyfazor.
Komplot vëllimi specifik v’’ nga presioni përfaqësohet me një kurbë KV, e cila quhet kurba e kufirit të avullit.
Nëse nxehtësia i jepet avullit të thatë të ngopur me presion konstant, atëherë temperatura dhe vëllimi i tij do të rriten dhe avulli do të shkojë nga i thatë i ngopur në i mbinxehur (pika D). Të dyja kthesat AK dhe HF ndani diagramin në tre pjesë. Në të majtë të kurbës kufitare të lëngut AK rajoni i lëngshëm ndodhet para izotermës zero. Mes kthesave AK dhe HF ekziston një sistem dyfazor i përbërë nga një përzierje e ujit dhe avullit të thatë. ne te djathte HF dhe lart nga pika te ka një zonë me avull të mbinxehur ose gjendje e gaztë trupi. Të dyja kthesat AK dhe HF konvergojnë në një pikë te quhet pika kritike.
Pika kritike është pika e fundit tranzicioni fazor lëng - avull, duke filluar nga pika e trefishtë. sipër pikë kritike ekzistenca e materies në gjendje dyfazore është e pamundur. Asnjë presion nuk mund ta shndërrojë gazin në gjendje e lëngshme në temperatura mbi kritike.
Parametrat e pikës kritike për ujin:
t te =374,12 0 NGA;v te =0,003147 m 3 / kg;
? te =22.115 MPa;i te =2095.2 kJ/kg
s te =4,424 kJ/(kg K).
Procesifq = konst avujt e ujit. Përpunoni imazhin nëfq – V , i – S dheT – S diagramet.
Në është- grafiku izobari në rajonin e avullit të ngopur përfaqësohet nga një vijë e drejtë që kalon kthesat kufitare të lëngut të avullit. Kur nxehtësia i jepet avullit të lagësht, shkalla e thatësisë së tij rritet dhe (në një temperaturë konstante) kalon në të thatë, dhe me furnizim të mëtejshëm të nxehtësisë - në avull të mbinxehur. Izobari në rajonin e avullit të mbinxehur është një kurbë me një konveksitet poshtë.
Në pv- grafiku procesi izobarik përfaqësohet nga një segment i një vije të drejtë horizontale, e cila në rajonin e avullit të lagësht paraqet njëkohësisht një proces izotermik.
Në Ts- grafiku në rajonin e avullit të lagësht, izobari përshkruhet nga një vijë e drejtë horizontale, dhe në rajonin e avullit të mbinxehur, nga një kurbë konvekse poshtë. Vlerat e të gjitha sasive të kërkuara për llogaritjen merren nga tabelat e avujve të ngopur dhe të mbinxehur.
Ndryshimi në energjinë specifike të brendshme të avullit:
Puna e jashtme:
Sasia specifike e furnizuar e nxehtësisë:
Në atë rast kur q dhënë dhe kërkohet gjetja e parametrave të pikës së dytë, e cila shtrihet në rajonin e gjendjeve dyfazore, zbatohet formula për entalpinë e avullit të lagësht:
Procesi T = konst avujt e ujit. Përpunoni imazhin nëfq – V , i – S dheT – S diagramet.
procesi izotermik.

Në është- grafiku në rajonin e avullit të lagësht, izotermi përkon me izobarin dhe është një vijë e drejtë e pjerrët. Në zonën e avullit të mbinxehur, izotermi përfaqësohet nga një kurbë me një konveksitet lart.
Në pv- grafiku në rajonin e avullit të lagësht, procesi izotermik përfaqësohet nga një vijë e drejtë horizontale. Për avullin e ngopur, ky proces përkon me atë izobarik. Në rajonin e mbinxehjes, presioni i avullit zvogëlohet, dhe procesi përshkruhet nga një kurbë me një konveksitet në boshtin e abscisës.
![]()
Në Ts- grafiku procesi izotermik përfaqësohet nga një segment horizontal.
Energjia e brendshme specifike e avullit të ujit, në kontrast me energjinë e brendshme të një gazi ideal, ndryshon si rezultat i një ndryshimi në përbërësin potencial, prandaj, kur T=
konst
Sasia specifike e përmbledhur e nxehtësisë në proces:
Puna e jashtme përcaktohet nga ligji i parë i termodinamikës:
Formula Mayer.
Rëndësi të veçantë në termodinamikë kanë kapacitetet termike të një gazi në presion konstant, d.m.th. në një proces izobarik - dhe në një vëllim konstant, d.m.th. në një proces izokorik. Këto kapacitete të nxehtësisë lidhen me formulën Mayer
Raporti i kapacitetit të nxehtësisë
Ku kështë indeksi adiabatik.
Koncepti i "Koeficientit të ftohjes"
Sasi pa dimension COP (zakonisht më shumë se një), duke karakterizuar efikasitetin energjetik të punësmakinë ftohëse; është e barabartë me raportinkapaciteti ftohësnë sasinë e energjisë (punës) të shpenzuar për njësi të kohës për zbatimin cikli i ftohjes. Përcaktohet nga lloji i ciklit të ftohjes sipas të cilit funksionon makina, nga përsosja e elementeve kryesore të saj dhe për të njëjtën makinë varet nga kushtet e temperaturës së funksionimit të saj.
Koeficienti i performancës së një makine frigoriferike ideale që funksionon në ciklin e kundërt Carnot:
ku T min dhe T Maks janë, përkatësisht, më të ulëta dhe temperaturë më të lartë në një cikël.
Koeficienti i performancës së një ftohësi ajri (figura),
ku T 1 dhe T 2 janë respektivisht temperaturat e fillimit dhe të fundit të ngjeshjes adiabatike;
T 3
dhe T 4
janë temperaturat e fillimit dhe mbarimit të zgjerimit adiabatik në ekspander.
fq n dhe T n)
sipas formulës
Cikli i një impianti turbinash me gaz me rigjenerim
Efikasiteti termik i turbinave me gaz me djegie të karburantit në fq= konst rritet me rritjen e presionit. Megjithatë, me rritjen, temperatura e gazeve në fund të djegies së karburantit gjithashtu rritet. T 3 si rezultat, fletët dhe grykat e turbinës shkatërrohen me shpejtësi, ftohja e të cilave është e vështirë. Për të rritur efikasitetin e turbinave me gaz, ato ndryshuan pjesërisht kushtet e tyre të punës. Instalimet filluan të përdorin rikuperimin e nxehtësisë, kompresimin e ajrit me shumë faza në kompresor, djegien me shumë faza, etj. Kjo dha një efekt domethënës dhe rriti shkallën e përsosjes së shndërrimit të punës në nxehtësi në instalime.
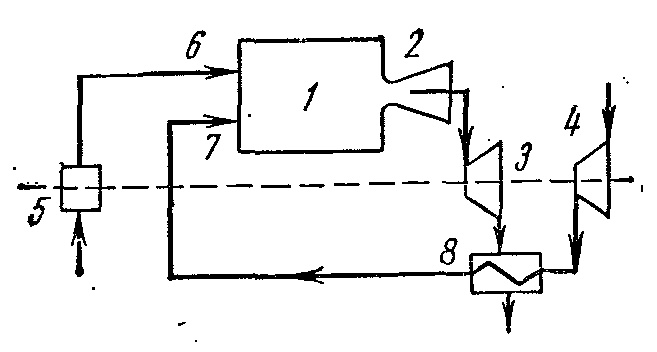
Ajri i kompresuar nga turbongarkuesi 4 dërgohet në rigjeneratorin 8 ku merr nxehtësi me presion konstant nga gazrat që dalin nga dhoma e djegies 1 përmes grykës 2 në turbinën 3. Ajri i nxehtë nga rigjeneruesi 8 përmes grykës 7, dhe karburanti nga pompa e karburantit 5 përmes grykës 6 dërgohet në dhomën e djegies 1.
Cikli ideal i një instalimi të tillë në diagrame:

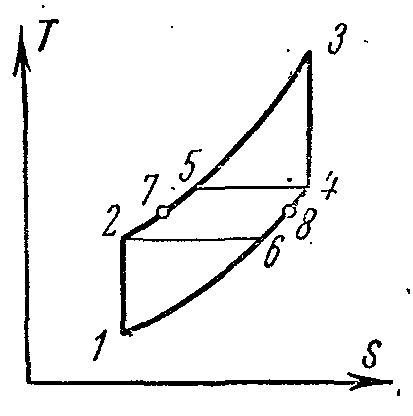
1-2 kompresim adiabatik i ajrit në kompresor;
2-5 furnizim me nxehtësi izobarike në rigjenerator;
5-3 furnizimi me nxehtësi me presion konstant në dhomën e djegies;
3-4 zgjerimi adiabatik i produkteve të djegies në grykat e turbinës;
4-6 largimi izobarik i nxehtësisë nga gazrat në rigjenerues;
6-1 largim izobarik i nxehtësisë nga gazrat në daljen e rigjeneruesit në lavamanin e nxehtësisë.
Nëse supozojmë se ftohja e gazeve në rigjenerator ndodh në temperaturën e ajrit që hyn në të, d.m.th. nga T 4 te T 6 =T 2 rigjenerimi ka përfunduar.
Efikasiteti termik i ciklit në rigjenerimin e plotë kur T 4
-T 6
=T 5
-T 2
e vendosur:
ku
Temperaturat në pikat kryesore të ciklit:
efikasiteti i ciklit
Konsumi specifik i avullit dhe nxehtësisë në termocentralet me avull
Gjatë llogaritjes së impianteve të turbinave me avull dhe elementëve individualë në të, njohja e konsumit specifik të avullit, e shënuar d.
Konsumi specifik teorik i avullit dhe nxehtësisë në kilogramë për 1 MJ:
Ku i 1
dhe i 2
–entalpi, kJ/kg.
Konsumi specifik teorik i avullit dhe nxehtësisë në kilogramë për 1 kWh:
Ngrohje me avull
Një studim i funksionimit të një impianti turbinash me avull tregon se një rritje në presionin fillestar dhe një ulje e presionit përfundimtar çon në një rritje të efikasitetit të ciklit. Megjithatë, një rritje në presionin fillestar rrit përmbajtjen përfundimtare të lagështisë së avullit. Për të reduktuar lagështinë e avullit në fund të zgjerimit rritet temperatura e fillimit e tij. Një nga mënyrat për të rritur shkallën e tharjes së avullit në daljen e turbinës është mbinxehja dytësore e saj. Avulli i mbinxehur nga kaldaja me presion dhe temperaturë fillestare hyn në cilindrin e parë të turbinës, i përbërë nga disa faza, ku zgjerohet në mënyrë adiabatike në një presion të caktuar. fq 1 . Avulli që rezulton hiqet në një mbinxehës të veçantë, ku i nënshtrohet mbinxehjes dytësore me presion të vazhdueshëm. Më pas kthehet sërish në turbinë, ku avulli vazhdon të zgjerohet deri në presionin e kondensatorit.

Pika 1 korrespondon me gjendjen fillestare të avullit; pika 2 - gjendja përfundimtare e avullit pas turbinës pas mbinxehjes dytësore. Shkalla përfundimtare e thatësisë si rezultat i futjes së rinxehjes rritet nga x 2 përpara x 1 . Përveç kësaj, mbinxehja dytësore e avullit jep një efekt ekonomik (2-3%) nëse temperatura mesatare e furnizimit me nxehtësi në ciklin shtesë 7-2-2 '-6-7 është më e lartë. temperature mesatare furnizimi me nxehtësi në një cikël me një mbinxehje të vetme, dhe efekti do të jetë më i madh, sa më e lartë të jetë temperatura në pikat fillestare dhe përfundimtare të mbinxehjes së ndërmjetme. Në presione afër kritikës dhe superkritike, ndonjëherë përdoren dy ose më shumë mbinxehje të ndërmjetme. Pastaj efikasiteti termik i ciklit
Ku është rënia e nxehtësisë adiabatike në cilindrat e turbinës së parë dhe të dytë;
- sasia e nxehtësisë së furnizuar në bojler dhe superngrohësin e parë;
Sasia e nxehtësisë që i jepet mbingrohësit të dytë.
Konsumi specifik i avullit






