Ajo që quhet avulli i ngopur. Enciklopedia e madhe e naftës dhe gazit
Para se t'i përgjigjemi pyetjes së parashtruar në titullin e artikullit, le të kuptojmë se çfarë është steam. Imazhet që shumica e njerëzve kanë me këtë fjalë: një kazan ose tenxhere që zien, një dhomë me avull, një pije e nxehtë dhe shumë fotografi të tjera të ngjashme. Në një mënyrë apo tjetër, në idetë tona ekziston një substancë e lëngshme dhe e gaztë që ngrihet mbi sipërfaqen e saj. Nëse ju kërkohet të jepni një shembull të avullit, menjëherë do të mbani mend avujt e ujit, avujt e alkoolit, eterit, benzinës, acetonit.

Ekziston një fjalë tjetër për gjendjet e gazta - gazit. Këtu zakonisht mendojmë për oksigjen, hidrogjen, azot dhe gazra të tjerë pa i lidhur ato me lëngjet përkatëse. Dihet mirë se ato ekzistojnë edhe në gjendje e lëngshme. Në pamje të parë, dallimet qëndrojnë në faktin se avulli korrespondon me lëngjet natyrore, dhe gazrat duhet të lëngohen me qëllim. Megjithatë, kjo nuk është plotësisht e vërtetë. Për më tepër, imazhet që dalin me fjalën avull nuk janë avull. Për të dhënë një përgjigje më të saktë, le të shohim se si krijohet avulli.
Si ndryshon avulli nga gazi?
Gjendja e grumbullimit të një lënde përcaktohet nga temperatura, më saktë nga raporti ndërmjet energjisë me të cilën ndërveprojnë molekulat e saj dhe energjisë së lëvizjes së tyre termike kaotike. Përafërsisht, mund të supozojmë se nëse energjia e ndërveprimit është shumë më e madhe - gjendje e ngurtë, nëse energjia e lëvizjes termike është shumë më e madhe - e gaztë, nëse energjitë janë të krahasueshme - e lëngshme.

Rezulton se në mënyrë që një molekulë të shkëputet nga një lëng dhe të marrë pjesë në formimin e avullit, vlera e energjisë termike duhet të jetë më e madhe se energjia e ndërveprimit. Si mund të ndodhë kjo? Shpejtësia mesatare e lëvizjes termike të molekulave është e barabartë me një vlerë të caktuar, në varësi të temperaturës. Megjithatë, shpejtësitë individuale të molekulave janë të ndryshme: shumica prej tyre kanë shpejtësi afër vlerës mesatare, por disa prej tyre kanë shpejtësi më të mëdha se mesatarja, disa më pak.
Molekulat më të shpejta mund të kenë energji termale më e madhe se energjia e ndërveprimit, që do të thotë se, pasi kanë goditur sipërfaqen e lëngut, ata janë në gjendje të shkëputen prej saj, duke formuar avull. Ky lloj avullimi quhet avullimi. Për shkak të shpërndarjes së njëjtë të shpejtësive, ekziston një proces i kundërt - kondensimi: molekulat nga një avull kalojnë në një lëng. Nga rruga, imazhet që zakonisht shfaqen me fjalën avull nuk janë avull, por rezultat i procesit të kundërt - kondensimit. Ju nuk mund ta shihni çiftin.

Avulli në kushte të caktuara mund të bëhet lëng, por për këtë temperatura e tij nuk duhet të kalojë një vlerë të caktuar. Kjo vlerë quhet temperatura kritike. Avulli dhe gazi janë gjendje të gazta që ndryshojnë në temperaturën në të cilën ekzistojnë. Nëse temperatura nuk e kalon kritikën - avulli, nëse tejkalon - gazi. Nëse e mbani temperaturën konstante dhe zvogëloni vëllimin, avulli lëngëzohet, gazi nuk lëngëzohet.
Çfarë është avulli i ngopur dhe i pangopur
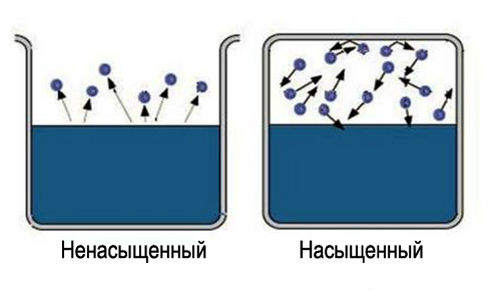
Vetë fjala "i ngopur" mbart informacione të caktuara, është e vështirë të ngopësh një zonë të madhe hapësire. Pra për të marrë avull i ngopur, e nevojshme kufizoni hapësirën në të cilën ndodhet lëngu. Në këtë rast, temperatura duhet të jetë më e vogël se ajo kritike për substancën e dhënë. Tani molekulat e avulluara mbeten në hapësirën ku ndodhet lëngu. Në fillim, shumica e kalimeve të molekulave do të ndodhin nga lëngu, ndërsa densiteti i avullit do të rritet. Kjo nga ana tjetër do të shkaktojë më shumë kalimet e kundërta të molekulave në lëng, gjë që do të rrisë shpejtësinë e procesit të kondensimit.
Së fundi, krijohet një gjendje për të cilën numri mesatar i molekulave që kalojnë nga një fazë në tjetrën do të jetë i barabartë. Një gjendje e tillë quhet ekuilibër dinamik. Kjo gjendje karakterizohet nga i njëjti ndryshim në madhësinë dhe drejtimin e shkallëve të avullimit dhe kondensimit. Kjo gjendje korrespondon me avullin e ngopur. Nëse nuk arrihet gjendja e ekuilibrit dinamik, kjo korrespondon me një avull të pangopur.
Ata fillojnë studimin e ndonjë objekti, gjithmonë me modelin e tij më të thjeshtë. Në teorinë kinetike molekulare, ky është një gaz ideal. Thjeshtimet kryesore këtu janë neglizhenca e vëllimit të brendshëm të molekulave dhe energjisë së ndërveprimit të tyre. Rezulton se ky model përshkruan në mënyrë të kënaqshme avulli i pangopur. Për më tepër, sa më pak i ngopur të jetë, aq më legjitim është përdorimi i tij. Një gaz ideal është një gaz; ai nuk mund të bëhet as avull as lëng. Prandaj, për avullin e ngopur, një model i tillë nuk është adekuat.
Dallimet kryesore midis avullit të ngopur dhe të pangopur
- Saturated do të thotë që objekti i dhënë ka vlerën më të madhe të mundshme të disa parametrave. Për një çift është dendësia dhe presioni. Këto parametra për avullin e pangopur kanë vlera më të vogla. Sa më larg të jetë avulli nga ngopja, aq më të vogla janë këto vlera. Një sqarim: temperatura e referencës duhet të jetë konstante.
- Për avull të pangopur, ligji boyle-mariotte: nëse temperatura dhe masa e gazit janë konstante, rritja ose zvogëlimi i vëllimit shkakton një ulje ose rritje të presionit me të njëjtën sasi, presioni dhe vëllimi janë të ndërlidhura. Nga dendësia maksimale dhe presioni në temperaturë konstante vijon pavarësia e tyre nga vëllimi i avullit të ngopur, rezulton se për avullin e ngopur presioni dhe vëllimi janë të pavarura nga njëri-tjetri.
- Për avull të pangopur dendësia nuk varet nga temperatura, dhe nëse vëllimi ruhet, as vlera e densitetit nuk ndryshon. Për avullin e ngopur, duke ruajtur vëllimin, dendësia ndryshon nëse temperatura ndryshon. Në këtë rast, marrëdhënia është e drejtpërdrejtë. Nëse temperatura rritet, densiteti gjithashtu rritet; nëse temperatura zvogëlohet, densiteti gjithashtu ndryshon.
- Nëse vëllimi është konstant, avulli i pangopur sillet në përputhje me ligjin e Charles: me rritjen e temperaturës, presioni rritet me të njëjtin faktor. Kjo marrëdhënie quhet lineare. Për avullin e ngopur, me rritjen e temperaturës, presioni rritet më shpejt se sa për avullin e pangopur. Varësia është eksponenciale.
Duke përmbledhur, mund të vërejmë ndryshime të rëndësishme në vetitë e objekteve të krahasuara. Dallimi kryesor është se avulli, në një gjendje ngopjeje, nuk mund të konsiderohet i izoluar nga lëngu i tij. Është një sistem me dy komponentë në të cilin shumica e ligjeve të gazit nuk mund të zbatohen.
avullimi - ky është avullimi që ndodh vetëm nga sipërfaqja e lirë e një lëngu që ngjitet me një mjedis të gaztë ose vakum.
Shpërndarja e pabarabartë e energjisë kinetike të lëvizjes termike të molekulave çon në faktin se në çdo temperaturë energjia kinetike e disa molekulave të një lëngu ose të ngurtë mund të tejkalojë energjinë potenciale të lidhjes së tyre me pjesën tjetër të molekulave.
Avullimiështë procesi me të cilin molekulat nxirren nga sipërfaqja e një lëngu ose të ngurtë energjia kinetike e cila tejkalon energjinë potenciale të bashkëveprimit të molekulave. Avullimi shoqërohet me ftohje të lëngut.
Le të shqyrtojmë procesin e avullimit nga pikëpamja e teorisë molekulare-kinetike. Për të lënë lëngun, molekulat duhet të punojnë duke reduktuar energjinë e tyre kinetike. Midis molekulave që lëvizin rastësisht të një lëngu në shtresën sipërfaqësore të tij, gjithmonë do të ketë molekula që tentojnë të fluturojnë jashtë lëngut. Kur një molekulë e tillë shkon përtej shtresa sipërfaqësore, atëherë lind një forcë që e tërheq molekulën përsëri në lëng. Prandaj, vetëm ato molekula fluturojnë nga lëngu, në të cilat energjia kinetike është më e madhe se puna e nevojshme për të kapërcyer kundërveprimin e forcave molekulare.
Shkalla e avullimit varet nga:
a) llojin e lëngut;
b) në sipërfaqen e sipërfaqes së tij të lirë. Sa më e madhe kjo zonë, aq më shpejt lëngu avullon.
c) sa më i ulët të jetë dendësia e avullit të një lëngu mbi sipërfaqen e tij, aq më e madhe është shpejtësia e avullimit. Prandaj, pompimi i avujve (erës) nga sipërfaqja do të përshpejtojë avullimin e saj.
d) me rritjen e temperaturës, shpejtësia e avullimit të lëngut rritet.
avullimiështë kalimi i një lënde nga një gjendje e lëngshme në një gjendje të gaztë.
Kondensimi -është bartja e materies nga gjendje e gaztë në gjendje të lëngshme.
Gjatë avullimit energjia e brendshme materia rritet, dhe kur kondensohet - zvogëlohet.
Nxehtësia e avullimit – është sasia e nxehtësisë Q e nevojshme për të kthyer një lëng në avull në një temperaturë konstante.
Nxehtësia specifike avullimi L matet me sasinë e nxehtësisë që kërkohet për të kthyer një masë njësi lëngu në avull në një temperaturë konstante
Avull i ngopur dhe i pangopur. Avullimi i një lëngu në një enë të mbyllur në një temperaturë konstante çon në një rritje graduale të përqendrimit të molekulave të substancës avulluese në gjendje të gaztë. Disa kohë pas fillimit të procesit të avullimit, përqendrimi i një lënde në gjendje të gaztë arrin një vlerë në të cilën numri i molekulave që kthehen në lëng për njësi të kohës bëhet i barabartë me numrin e molekulave që largohen nga sipërfaqja e lëngut në ne te njejten kohe. Është vendosur një ekuilibër dinamik midis proceseve të avullimit dhe kondensimit të lëndës.
Artikulli tregon se çfarë është avulli, cilat lloje të tij janë dhe si përdoren në industri dhe në jetën e përditshme.
Fizika
Një nga shkencat kryesore që ndihmon për të zbuluar strukturën e botës përreth dhe disa nga proceset e saj është fizika. Ka shumë reagime interesante që ndodhin rreth nesh çdo sekondë. Ne jemi mësuar prej kohësh me shumë prej tyre dhe nuk u kushtojmë vëmendje. Për më tepër, në Jeta e përditshme pak njerëz mendojnë për natyrën e djegies së Diellit, apo shfaqjen e avullit të ujit, i cili ka një ndikim të madh në klimë. Dhe megjithëse proceset e përshkruara më sipër janë studiuar mjaft mirë, ne ende do të shqyrtojmë pyetjen se çfarë është avulli. Nga rruga, ajo mund të formohet si rezultat jo vetëm i vlimit ose reagimeve të tjera të substancave të ndryshme, por së pari.
Përkufizimi
Avulli është gjendja e gaztë e një lënde, me kusht që kjo fazë e saj të jetë në ekuilibër me gjendjet e tjera agregate të kësaj lënde. Vetë procesi, si rezultat i të cilit shfaqet avulli, zakonisht quhet avullim, dhe procesi i kundërt quhet kondensim. Pra, tani ne e dimë se çfarë është avulli. Nga rruga, zakonisht kur përmendet fjala "avull", njerëzit pothuajse gjithmonë nënkuptojnë avullin që merret nga uji i zakonshëm, megjithëse, siç u përmend më lart, shumë substanca mund të marrin këtë gjendje grumbullimi.
Përveç kësaj, është zakon të dallohen dy lloje kryesore: të ngopura dhe të pangopura. Por këto përkufizime zbatohen vetëm për substancat që janë kimikisht të pastra. Le t'i analizojmë ato në mënyrë më të detajuar.
Çfarë është avulli i pangopur?

Kështu e quajnë kur nuk mund të arrinte një ekuilibër, të quajtur dinamik, në raport me lëngun nga i cili u formua. Shpesh një përkufizim i tillë ngatërrohet me termodinamik, gjë që është e gabuar. Nëse krahasoni presionin e avullit të pangopur me të ngopur, atëherë ai gjithmonë do të ketë një vlerë më të ulët.
Kur avulli i pangopur shfaqet në sipërfaqen e një lëngu, procesi i formimit të tij vazhdon më shpejt dhe mbizotëron mbi procesin e kundërt (siç kemi thënë tashmë, quhet kondensim). Dhe si rezultat, gradualisht lëngu bëhet gjithnjë e më pak.
Tani le të shohim se çfarë është
Avull i ngopur

Avulli i ngopur quhet kur ka mundur të arrijë ekuilibrin dinamik me lëngun nga i cili është marrë. E thënë thjesht, në këtë rast, avullimi është i barabartë me kondensimin, dhe ndryshe nga situata me avullin e pangopur, sasia e lëngut mund të mbetet e pandryshuar. Tani e dimë se çfarë është avulli dhe llojet e tij.
Nëse, për shembull, ngjesh një avull që është në ekuilibër me lëngun e tij, atëherë ky ekuilibër gradualisht do të zhduket dhe kondensimi do të bëhet më i fortë dhe më i fortë derisa, për shkak të një ndryshimi në densitetin e substancës së gaztë, të rivendoset ekuilibri dinamik. përsëri.
Në varësi të llojit të lëngut, ekuilibri dinamik me avull shfaqet në vlera të ndryshme të densitetit të tij. Kjo është për shkak të faktit se të gjitha substancat kanë një forcë të ndryshme të tërheqjes ndërmolekulare.
avujt e ujit

E megjithatë, më shpesh njerëzit e kuptojnë këtë fjalë si gjendje e gaztë e ujit që është e njohur për të gjithë. Nëse shikoni në enciklopedi, mund të gjeni karakteristikat kryesore përcaktuese të avullit: mungesa e ngjyrës, erës dhe marrja e tij, në fakt, nga uji.
Të gjithë e kemi vënë re në mënyrë të përsëritur, pavarësisht nëse është ujë i valë për gatim apo avullimi i lagështisë nga trotuari i nxehtë pas shiut. Por nëse mendoni për këtë dhe mbani mend periudhat e revolucionit industrial dhe teknologjik, bëhet e qartë se rëndësi të madhe në jetën e njeriut ka avull. Fizika e këtij fenomeni është e tillë që zë një vëllim dhjetë herë më të madh se forma e tij origjinale e lëngshme. Ishte ky vëzhgim që në një kohë i dha shtysë zhvillimit të teknologjisë.
Gjithçka nisi me karrocat e para dhe pak më vonë “vetëlëvizëse”, siç quheshin mjetet me motorë të tillë. Por makina të tilla u sollën në gjendje pune për një kohë shumë të gjatë, kishin shpejtësi të ulët dhe trajtim të dobët. Gjithçka ndryshoi vetëm me shpikjen e lokomotivave me avull.
Përveç kësaj, uji është gjithashtu një bartës i mirë i nxehtësisë dhe përdoret në shumë sisteme ftohjeje dhe nëse qarku i tyre nuk është i mbyllur, atëherë si rezultat shfaqet edhe avulli. Në kohën tonë, ndonjëherë është sjellë posaçërisht në një gjendje të gaztë, por jo në motorët primitivë, por në termocentralet bërthamore, ku turbinat e gjeneratorëve elektrikë rrotullohen me avull.
Uji i avulluar ka gjithashtu një rëndësi të madhe në klimë. Duke u ngritur në një lartësi ku temperatura është shumë më e ulët, avulli kondensohet dhe bie në sipërfaqen e tokës në formën e shiut. Bora është pothuajse e njëjtë.
Epo, në fund, ata gatuajnë ushqim dietik dhe thjesht të shëndetshëm për një çift.
Në kushtet e duhura, avulli formon një mjegull në sipërfaqen e tokës.
Tani e dimë se çfarë është avulli dhe si ndodh.
Tema 2. KALIMET FAZORE.
Faza e tranzicionit ( transformimi fazor) është kalimi i një substance nga një fazë në tjetrën me një ndryshim në kushtet e jashtme (për shembull, temperatura, presioni, fushat magnetike dhe elektrike, etj.), i shoqëruar nga një ndryshim vetitë fizike dhe parametrat e substancës.
Vlera e temperaturës, presionit ose ndonjë tjetër sasi fizike në të cilën ndodh kalimi fazor quhet pika e tranzicionit. Ekzistojnë dy lloje të tranzicionit fazor.
KALIMET FAZORE TË LLOJIT TË PARË
Gjatë një tranzicioni fazor të llojit të parë, i tillë termodinamik
karakteristikat e një substance, të tilla si dendësia, përqendrimi i përbërësve, vëllim specifik, sasia e energjisë së brendshme të ruajtur, d.m.th. lirohet ose absorbohet një sasi e caktuar nxehtësie, e cila quhet nxehtësia e tranzicionit. Për më tepër, kjo i referohet ndryshimit të menjëhershëm të këtyre sasive jo në kohë, por me një ndryshim në temperaturë, presion, etj. Shembujt më të zakonshëm të tranzicionit fazor të rendit të parë janë:
- shkrirja dhe kristalizimi
- avullimi dhe kondensimi
- sublimimi dhe desublimimi
KALIMET FAZORE TË LLOJIT TË DYTË
Gjatë një tranzicioni fazor të rendit të dytë, dendësia dhe energjia e brendshme nuk ndryshojnë, kështu që sy të lirë të tilla tranzicioni fazor mund të jetë i padukshëm. Kërcimi përjetohet nga derivatet e tyre në lidhje me temperaturën dhe presionin: kapaciteti termik, koeficienti i zgjerimit termik, ndjeshmëritë e ndryshme, etj. D.m.th. Tranzicionet fazore të llojit të dytë shoqërohen nga një ndryshim në simetrinë e strukturës së substancës, dhe jo nga çlirimi ose thithja e energjisë (nxehtësia). Shembujt më të zakonshëm të tranzicionit të fazës së rendit të dytë janë:
- kalimi i sistemit në një pikë kritike
- tranzicioni paramagnetik-ferromagnetik
- kalimi i metaleve dhe lidhjeve në gjendjen e superpërcjellshmërisë
- kalimi i heliumit të lëngshëm në një gjendje superfluid
- kalimi i materialeve amorfe në një gjendje qelqi
Fizika moderne gjithashtu heton sistemet që kanë tranzicione fazore të rendit të tretë ose më të lartë. Kohët e fundit përdorim të gjerë mori konceptin e një tranzicioni fazor kuantik, d.m.th. tranzicioni fazor i kontrolluar jo nga luhatjet termike klasike, por nga ato kuantike, të cilat ekzistojnë edhe në zero absolute temperaturat, ku kalimi i fazës klasike nuk mund të realizohet për shkak të teoremës së Nernst-it.
Le të shqyrtojmë më në detaje fenomenet me interes për ne, të cilat shoqërohen me tranzicione fazore të rendit të parë.
AVULLIMI, KONDENSIMI, vlimi.
Çiftet e Ngopura dhe të pangopura.
Çdo substancë në kushte të caktuara mund të jetë në gjendje të ndryshme grumbullimi - të ngurtë, të lëngët dhe të gaztë. Kalimet nga një gjendje grumbullimi në të dytin janë kalime fazore të llojit të parë.
Avullimi dhe kondensimi janë kalime fazore ndërmjet fazave të lëngëta dhe të gazta të një substance.
Të gjitha gaze reale(oksigjeni, azoti, hidrogjeni etj.) në kushte të caktuara mund të shndërrohen në lëng. Megjithatë, një transformim i tillë mund të ndodhë vetëm në temperatura nën një të caktuar, të ashtuquajtur temperaturë kritike T kr. Për shembull, për ujin, temperatura kritike është 647,3 K, për azotin 126 K, për oksigjenin 154,3 K. Në temperaturën e dhomës (≈ 300 K), uji mund të jetë në gjendje të lëngët dhe të gaztë, ndërsa azoti dhe oksigjeni ekzistojnë vetëm në formë e gazeve.
me avullim quhet kalimi fazor nga gjendja e lëngët në të gaztë. Nga pikëpamja e teorisë kinetike molekulare, avullimi është një proces në të cilin molekulat më të shpejta fluturojnë nga sipërfaqja e një lëngu, energjia kinetike e të cilave tejkalon energjinë e lidhjes së tyre me pjesën tjetër të molekulave të lëngshme. Kjo çon në një ulje të energjisë mesatare kinetike të molekulave të mbetura, d.m.th., në ftohjen e lëngut (nëse nuk ka furnizim me energji nga trupat përreth).
Kondensimiështë procesi i kundërt i avullimit. Gjatë kondensimit, molekulat e avullit kthehen në lëng.
Në një enë të mbyllur, një lëng dhe avulli i tij mund të jenë në gjendje ekuilibër dinamik, kur numri i molekulave që largohen nga lëngu është i barabartë me numrin e molekulave që kthehen në lëng nga avulli, d.m.th., kur shpejtësitë e avullimit dhe kondensimit janë të njëjta. Një sistem i tillë quhet dyfazore . Avulli në ekuilibër me lëngun e tij quhet i pasur.
Numri i molekulave të emetuara nga një sipërfaqe njësi e një lëngu në një sekondë varet nga temperatura e lëngut. Numri i molekulave që kthehen nga avulli në lëng varet nga përqendrimi i molekulave të avullit dhe me radhë Shpejtësia mesatare lëvizja e tyre termike, e cila përcaktohet nga temperatura e avullit. Nga kjo rrjedh se për një substancë të caktuar, përqendrimi i molekulave të avullit në ekuilibrin e një lëngu dhe avullit të tij përcaktohet nga temperatura e tyre e ekuilibrit. Vendosja e ekuilibrit dinamik midis proceseve të avullimit dhe kondensimit me rritjen e temperaturës ndodh në përqendrime më të larta të molekulave të avullit. Meqenëse presioni i një gazi (avulli) përcaktohet nga përqendrimi dhe temperatura e tij, mund të konkludojmë: presioni avull i ngopur p 0 e një lënde të caktuar varet vetëm nga temperatura e saj dhe nuk varet nga vëllimi. Prandaj, izotermat e gazeve reale në aeroplan ( fq, V) përmbajnë seksione horizontale që korrespondojnë me një sistem dyfazor (Fig. 3.4.1).
Me rritjen e temperaturës rritet presioni i avullit të ngopjes dhe dendësia e tij, ndërsa dendësia e lëngut zvogëlohet për shkak të zgjerimit termik. Në një temperaturë të barabartë me temperaturën kritike T kr për një substancë të caktuar, dendësia e avullit dhe e lëngut bëhen të njëjta. Në T > T kr, dallimet fizike midis lëngut dhe avullit të tij të ngopur zhduken.
Nëse avulli i pangopur është i ngjeshur në mënyrë izotermale në T < T cr, atëherë presioni i tij do të rritet derisa të bëhet i barabartë me presionin e avullit të ngopur. Me një ulje të mëtejshme të vëllimit, një lëng formohet në fund të enës dhe vendoset një ekuilibër dinamik midis lëngut dhe avullit të tij të ngopur. Me një ulje të vëllimit, një pjesë në rritje e avullit kondensohet dhe presioni i tij mbetet i pandryshuar (seksioni horizontal në izotermi). Kur i gjithë avulli kthehet në një lëng, presioni rritet ndjeshëm me një rënie të mëtejshme të vëllimit për shkak të kompresueshmërisë së ulët të lëngut.
Është e mundur të kalohet nga gjendja e gaztë në atë të lëngshme duke anashkaluar rajonin dyfazor. Për ta bërë këtë, ju duhet të përfundoni procesin duke anashkaluar pikën kritike K. Një nga proceset e mundshme të këtij lloji është paraqitur në Fig. 1 me një vijë të thyer ABC.
AT ajri atmosferik avujt e ujit janë gjithmonë të pranishëm në disa presion i pjesshëm fq, e cila zakonisht është më e vogël se presioni i avullit të ngopjes fq 0 . Qëndrimi fq / fq 0, e shprehur në përqindje, quhet lageshtia relative ajri.
| |
Avulli i pangopur teorikisht mund të përshkruhet duke përdorur ekuacionin e gjendjes gaz ideal nën kufizimet e zakonshme për gazrat realë: presioni i avullit nuk duhet të jetë shumë i lartë (praktikisht fq≤ (10 6 –10 7) Pa), dhe temperatura e tij është më e lartë se një vlerë e përcaktuar për secilën substancë. Ligjet e një gazi ideal mund të zbatohen përafërsisht edhe për avullin e ngopur, me kusht që për çdo temperaturë T presioni fq 0 avulli i ngopur përcaktohet nga kurba e ekuilibritfq 0 (T) për një substancë të caktuar.
Presioni fq 0 e avullit të ngopur rritet shumë shpejt me rritjen e temperaturës T. Varësia fq 0 (T) nuk mund të merret nga ligjet ideale të gazit. Presioni i një gazi në një përqendrim konstant të molekulave rritet në përpjesëtim të drejtë me temperaturën. Në avullin e ngopur, me rritjen e temperaturës, rritet jo vetëm energjia mesatare kinetike e lëvizjes molekulare, por edhe përqendrimi i tyre. Prandaj, presioni i avullit të ngopur rritet më shpejt me rritjen e temperaturës sesa presioni i një gazi ideal në një përqendrim konstant të molekulave.
Avullimi mund të ndodhë jo vetëm nga sipërfaqja, por edhe në pjesën më të madhe të lëngut. Lëngjet përmbajnë gjithmonë flluska të vogla gazi. Nëse presioni i avullit të ngopjes së një lëngu është i barabartë ose më i madh se presioni i jashtëm (d.m.th. presioni i gazit në flluska), lëngu do të avullojë në flluska. Flluskat e mbushura me avull zgjerohen dhe notojnë në sipërfaqe. Ky proces quhet duke vluar . Kështu, zierja e një lëngu fillon në një temperaturë në të cilën presioni i tij avujt e ngopur bëhet e barabartë me presionin e jashtëm.
Në veçanti, në normale presioni atmosferik uji vlon në 100°C. Kjo do të thotë se në këtë temperaturë presioni i avullit të ngopur të ujit është 1 atm. Kur ngjiteni në male, presioni atmosferik zvogëlohet, dhe për këtë arsye pika e vlimit të ujit zvogëlohet (afërsisht 1 ° C për çdo 300 metra lartësi). Në një lartësi prej 7 km, presioni është afërsisht 0,4 atm, dhe pika e vlimit bie në 70 °C.
Në një enë të mbyllur hermetikisht, lëngu nuk mund të vlojë, sepse në çdo vlerë të temperaturës, vendoset një ekuilibër midis lëngut dhe avullit të tij të ngopur. Përgjatë kurbës së ekuilibrit fq 0 (T) është e mundur të përcaktohet pika e vlimit të një lëngu në presione të ndryshme.
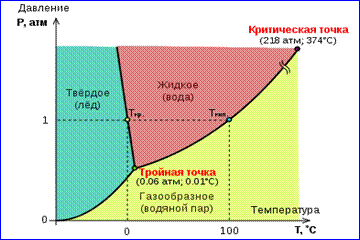
Fotografia e izotermave reale të gazit të paraqitur në figurën 1 përshkruan proceset e avullimit dhe kondensimit, d.m.th., kalimin fazor midis fazave të gazta dhe të lëngshme të një substance. Në fakt, kjo pamje është e paplotë, pasi çdo substancë mund të kalojë nga gjendje e gaztë dhe e lëngshme në një gjendje të ngurtë. Në një temperaturë të caktuar T Ekuilibri termodinamik ndërmjet dy fazave të së njëjtës substancë është i mundur vetëm në një presion të caktuar në sistem. Varësia e presionit të ekuilibrit nga temperatura quhet kurba e ekuilibrit fazor . Një shembull është kurba e ekuilibrit fq 0 (T) avull dhe lëng të ngopur. Nëse kthesat e ekuilibrit ndërmjet fazave të ndryshme të një substance të caktuar paraqiten në plan ( fq, T), pastaj e ndajnë këtë rrafsh në rajone të veçanta në të cilat materia ekziston në një formë homogjene gjendja e grumbullimit- të ngurtë, të lëngët ose të gaztë (Fig. 2). Paraqitur në sistemin e koordinatave ( fq, T) quhen kurbat e ekuilibrit diagrami fazor .
Kurba 0 T, që i përgjigjet ekuilibrit ndërmjet fazës së ngurtë dhe të gaztë, quhet kurba e sublimimit. Kurbë TK ekuilibri ndërmjet lëngut dhe avullit quhet kurba e avullimit, ajo shkëputet në pikë kritike K. Kurbë TM ekuilibër ndërmjet të ngurta dhe quhet lëng kurba e shkrirjes.
Kurbat e ekuilibrit konvergjojnë në një pikë T, në të cilën të tre fazat mund të bashkëjetojnë në ekuilibër. Kjo pikë quhet pikë e trefishtë.
Për shumë substanca presioni fq tr në pikën e trefishtë është më pak se 1 atm ≈ 10 5 Pa. Substancat e tilla shkrihen kur nxehen në presionin atmosferik. Për shembull, pikë e trefishtë uji (Fig. 3) ka koordinata T tr = 273,16 K, fq tr \u003d 6.02 10 2 Pa dhe përdoret si referencë për kalibrimin e shkallës absolute të temperaturës së Kelvin.
 Megjithatë, ka edhe të tilla 3 Diagrami i fazave të ujit
Megjithatë, ka edhe të tilla 3 Diagrami i fazave të ujit
substancat që kanë fq tr
kalon 1 atm. Pra për
presioni i dioksidit të karbonit (CO 2).
fq tr = 5,11 atm dhe temperatura
T tr = 216,5 K. Prandaj, në atmosferë
presioni, dioksidi i ngurtë i karbonit mund
ekzistojnë vetëm në temperatura të ulëta, dhe në gjendje të lëngët në fq= 1 atm nuk ekziston fare. Në gjendje të ngurtë, dioksidi i karbonit është në ekuilibër me avujt e tij në presionin atmosferik në një temperaturë prej 173 K ose -80 °C. Ky është një "akulli i thatë" i përdorur gjerësisht që nuk shkrihet kurrë, por vetëm avullohet (sublimon).






