Motori i ngrohjes bën. Motori i nxehtësisë: cikli, puna, efikasiteti. Problemet ekologjike të makinerive termike. Cili është motori ideal i nxehtësisë?
Për një cikël funksionimi të një motori ideal Carnot, 1000 kJ nxehtësi u transferuan në lëngun e punës nga ngrohësi dhe 800 kJ nxehtësi iu dhanë frigoriferit. Sa është temperatura e frigoriferit nëse temperatura e ngrohësit është 800 K? A) 600 K B) 640 K C) 340 K D) 300 K Ndihmë
Përgjigje:
Efikasiteti \u003d (Qload-Qcold) / Qload \u003d 200/1000 \u003d 0.2. (800-Thol)/800=0,2, Thol/800= 0,8, Thol=640K. (B)
Pyetje të ngjashme
- Do të ishte për të ardhur keq nëse beli i tij i hollë nuk do të ishte tërhequr kurrë nga një uniformë ushtarake dhe nëse ai do ta kishte kaluar rininë e tij i përkulur mbi artikuj shkrimi. Baza gramatikore, skema dhe karakteristikat
- Masha është në klasën e gjashtë. Në këtë klasë ka 2 herë më pak djem se vajza. Masha ka 8 shokë klase më shumë se shokët e saj të klasës. Sa nxënës janë në klasë?
- Zgjidhni tre paragrafë nga teksti dhe lexoni me zë të lartë. Shkruani një fjali nga çdo paragraf që shpreh idenë kryesore. Cilat sinonime mund të përdoren kur flasim për gjuhën ruse? Cila prej tyre përdoret nga D. Likhachev. Letërsia ruse është një nga majat e kulturës botërore, pasuria më e vlefshme e gjithë njerëzimit. Emrat e A. S. Pushkin, M. N. Tolstoy, F. M. Dostoevsky, A. P. Chekhov dhe shkrimtarë të tjerë të mëdhenj rusë janë të njohur për të gjithë. bota kulturore. Si lindi kjo letërsi? Mbi një përvojë mijëravjeçare të kulturës së fjalës. Studiuesi i shquar letrar Dmitry Sergeevich Likhachev shkroi:<Рождению русской литературы способствовал превосходный, гибкий и лаконичный русский язык, достигший ко времени возникновения русской литературы высокого уровня развития... Это был язык с обширным словарным составом, с развитой терминологией -- юридической, военной, феодальной, технической; обильный синонимами, способными отразить различные эмоциональные оттенки...>
Në prodhim çoi në shfaqjen e motorëve termikë.
Pajisja e motorëve me nxehtësi
Motori i nxehtësisë (motori i nxehtësisë) - një pajisje për konvertim energjia e brendshme në mekanike.
Çdo motor ngrohje ka një ngrohës, një lëng pune (gaz ose avull), i cili, si rezultat i ngrohjes, kryen punë (kthen boshtin e turbinës, lëviz pistonin etj.) dhe një frigorifer. Figura më poshtë tregon një diagram të një motori ngrohjeje.
Bazat e motorëve me nxehtësi
Çdo motor ngrohje funksionon falë motorit. Për të bërë punën, ai duhet të ketë një ndryshim presioni në të dyja anët e pistonit të motorit ose tehut të turbinës. Ky ndryshim arrihet në të gjithë motorët me nxehtësi si më poshtë: temperatura e lëngut të punës rritet me qindra ose mijëra gradë në krahasim me temperaturën e ambientit. Në dhe në motorë djegia e brendshme(ICE) ka një rritje të temperaturës për shkak të faktit se karburanti digjet brenda vetë motorit. Frigoriferi mund të jetë një atmosferë ose një pajisje për qëllime të veçanta për kondensimin dhe ftohjen e avullit të shkarkimit.
Cikli Carnot
Cikli ( proces rrethor) - një grup ndryshimesh në gjendjen e gazit, si rezultat i të cilave ai kthehet në gjendjen e tij origjinale (mund të bëjë punë). Në 1824, fizikani francez Sadi Carnot tregoi se cikli i motorit të nxehtësisë (cikli Carnot), i cili përbëhet nga dy procese, izotermik dhe adiabatik, është i dobishëm. Figura më poshtë tregon një grafik të ciklit Carnot: 1-2 dhe 3-4 janë izotermë, 2-3 dhe 4-1 janë adiabat.
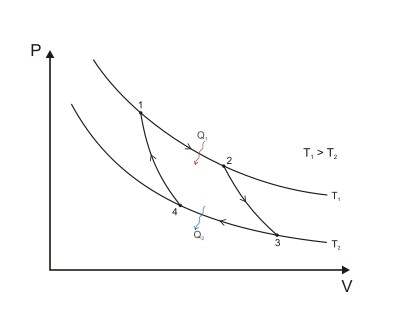
Në përputhje me ligjin e ruajtjes së energjisë, puna e motorëve me nxehtësi të kryer nga motori është e barabartë me:
A \u003d Q 1 - Q 2,
ku Q 1 është sasia e nxehtësisë që merret nga ngrohësi, dhe Q 2 është sasia e nxehtësisë që dërgohet në frigorifer.
Efikasiteti i një motori me nxehtësi është raporti i punës A që kryen motori me sasinë e nxehtësisë që merret nga ngrohësi:
η \u003d A / Q \u003d (Q 1 - Q 2) / Q 1 \u003d 1 - Q 2 / Q 1.

Në "Mendime mbi forca lëvizëse zjarri dhe në lidhje me makinat që janë të afta të zhvillojnë këtë forcë "(1824) Carnot përshkroi një motor nxehtësie të quajtur "një motor termik ideal me një gaz ideal, i cili është një lëng pune". Falë ligjeve të termodinamikës, është e mundur të llogaritet efikasiteti (maksimumi i mundshëm) i një motori ngrohjeje me një ngrohës që ka një temperaturë T 1 dhe një frigorifer me një temperaturë T 2. Motori i ngrohjes Carnot ka një efikasitet:
η max \u003d (T 1 - T 2) / T 1 \u003d 1 - T 2 / T 1.
Sadi Carnot vërtetoi se çdo motor me nxehtësi të vërtetë që punon me një ngrohës me temperaturë T 1 dhe një frigorifer me temperaturë T 2 nuk është në gjendje të ketë një efikasitet që do të tejkalonte efikasitetin e një motori termik (ideal).
Motori me djegie të brendshme (ICE)
Një motor me djegie të brendshme me katër goditje përbëhet nga një ose më shumë cilindra, një piston, një mekanizëm me maniak, valvulat e marrjes dhe shkarkimit dhe kandelat.

Cikli i punës përbëhet nga katër cikle:
1) thithje - përzierja e djegshme hyn në cilindër përmes valvulës;
2) kompresim - të dy valvulat janë të mbyllura;
3) goditje pune - djegie shpërthyese e një përzierjeje të djegshme;
4) shter - lëshimi i gazrave të shkarkimit në atmosferë.
Turbinë me avull
Në një turbinë me avull, shndërrimi i energjisë ndodh për shkak të ndryshimit në presionin e avullit të ujit në hyrje dhe dalje.
Fuqia e turbinave moderne me avull arrin 1300 MW.
Disa parametra teknikë të një turbine me avull 1200 MW
- Presioni i avullit (i freskët) - 23,5 MPa.
- Temperatura e avullit - 540 °C.
- Konsumi i avullit nga turbina - 3600 t/h.
- Shpejtësia e rotorit - 3000 rpm.
- Presioni i avullit në kondensator është 3.6 kPa.
- Gjatësia e turbinës - 47,9 m.
- Pesha e turbinës - 1900 ton.

Motori i nxehtësisë përbëhet nga një kompresor ajri, një dhomë djegieje dhe një turbinë me gaz. Parimi i funksionimit: ajri thithet në mënyrë adiabatike në kompresor, kështu që temperatura e tij rritet në 200 ° C ose më shumë. Pastaj hyn në dhomën e djegies, ku në të njëjtën kohë nën presion i madh Furnizohet karburant i lëngshëm - vajguri, fotogjen, vaj djegës. Kur karburanti digjet, ajri nxehet në një temperaturë prej 1500-2000 ° C, zgjerohet dhe shpejtësia e tij rritet. Ajri lëviz nga shpejtësi e lartë, dhe produktet e djegies dërgohen në turbinë. Pas kalimit nga faza në fazë, produktet e djegies japin energjinë e tyre kinetike te fletët e turbinës. Një pjesë e energjisë së marrë nga turbina shkon në rrotullimin e kompresorit; pjesa tjetër shpenzohet për rrotullimin e rotorit të gjeneratorit elektrik, helikës së një avioni ose një anijeje detare, rrotat e një makine.
Turbina me gaz mund të përdoret, përveç rrotullimit të rrotave të një makine dhe helikave të një avioni ose anijeje, si motor reaktiv. Prandaj, ajri dhe produktet e djegies largohen nga turbina me gaz me shpejtësi të lartë shtytje jet, që ndodh gjatë këtij procesi, mund të përdoret për lëvizjen e anijeve ajrore (aeroplanë) dhe ujorë (anije), transportin hekurudhor. Për shembull, avionët An-24, An-124 ("Ruslan"), An-225 ("Dream") kanë motorë turboprop. Pra, "Dream" me një shpejtësi fluturimi 700-850 km / orë është në gjendje të transportojë 250 tonë ngarkesë në një distancë prej gati 15,000 km. Është avioni transportues më i madh në botë.
Problemet mjedisore të motorëve termikë
Gjendja e atmosferës, në veçanti prania e dioksidit të karbonit dhe avullit të ujit, ka një ndikim të madh në klimë. Kështu, një ndryshim në përmbajtjen e dioksidit të karbonit çon në një rritje ose ulje të efektit serë, në të cilin dioksidi i karbonit thith pjesërisht nxehtësinë që Toka rrezaton në hapësirë, e mban atë në atmosferë dhe në këtë mënyrë rrit temperaturën e sipërfaqes dhe shtresat e poshtme të atmosferës. Fenomeni i efektit serrë luan një rol vendimtar në zbutjen e klimës. Në mungesë të tij temperature mesatare planeti nuk do të ishte +15 °С, por më i ulët me 30-40 °С.
Tani ka më shumë se 300 milionë lloj te ndryshme automjetet, të cilat krijojnë më shumë se gjysmën e të gjithë ndotjes së ajrit.
 Për 1 vit, 150 milion ton oksid squfuri, 50 milion ton 50 milion ton hi, 200 milion ton monoksid karboni, 3 milion ton feon lëshohen në atmosferë nga termocentralet si rezultat i djegies së karburantit.
Për 1 vit, 150 milion ton oksid squfuri, 50 milion ton 50 milion ton hi, 200 milion ton monoksid karboni, 3 milion ton feon lëshohen në atmosferë nga termocentralet si rezultat i djegies së karburantit.
Përbërja e atmosferës përfshin ozonin, i cili mbron të gjithë jetën në tokë nga efektet e dëmshme të rrezeve ultravjollcë. Në vitin 1982, J. Farman, një studiues anglez, zbuloi një vrimë ozoni mbi Antarktidë - një ulje e përkohshme e përmbajtjes së ozonit në atmosferë. Në kohën e zhvillimit maksimal të vrimës së ozonit më 7 tetor 1987, sasia e ozonit në të u ul me 2 herë. Vrima e ozonit ndoshta u ngrit si rezultat i faktorëve antropogjenë, duke përfshirë përdorimin e freoneve (freoneve) që përmbajnë klor në industri, të cilët shkatërrojnë shtresa e ozonit. Megjithatë, kërkimet në vitet 1990 nuk e mbështeti këtë pikëpamje. Me shumë mundësi, shfaqja e vrimës së ozonit nuk është e lidhur me aktivitetin njerëzor dhe është një proces natyror. Në vitin 1992, një vrimë ozoni u zbulua mbi Arktik.
Nëse i gjithë ozoni atmosferik mblidhet në një shtresë afër sipërfaqes së Tokës dhe kondensohet në densitetin e ajrit në normale presioni atmosferik dhe një temperaturë prej 0 °C, trashësia e mburojës së ozonit do të jetë vetëm 2-3 mm! Kjo është e gjithë mburoja.
Pak histori...
- korrik 1769. Në parkun parizian Meudon, inxhinieri ushtarak N. J. Cugno në një "karrocë zjarri", e cila ishte e pajisur me një motor me avull me dy cilindra, përshkoi disa dhjetëra metra.
- 1885 Karl Benz, një inxhinier gjerman, ndërtoi makinën e parë me katër rrota me benzinë Motorwagen me një fuqi prej 0,66 kW, për të cilën mori një patentë më 29 janar 1886. Shpejtësia e makinës arriti në 15-18 km / orë.
- 1891 Gottlieb Daimler, një shpikës gjerman, bëri një kamion mallrash të fuqizuar nga një motor 2.9 kW (4 kuajfuqi) nga një makinë pasagjerësh. makina arriti 10 km / orë, kapaciteti mbajtës në modele të ndryshme varionte nga 2 në 5 ton.
- 1899 Belgu K. Zhenatzi me makinën e tij "James Content" ("Gjithmonë i pakënaqur") kapërceu për herë të parë kufirin e shpejtësisë prej 100 kilometrash.

Shembuj të zgjidhjes së problemeve
Detyra 1. Një motor ideal me nxehtësi ka një temperaturë ngrohës prej 2000 K dhe një temperaturë frigoriferi prej 100 °C. Përcaktoni efikasitetin.
Zgjidhje:
Formula që përcakton efikasitetin e një motori termik (maksimumi):
ŋ \u003d T 1 -T 2 / T 1.
ŋ \u003d (2000K - 373K) / 2000 K \u003d 0,81.
Përgjigje: Efikasiteti i motorit - 81%.
Detyra 2. Në motorin e nxehtësisë gjatë djegies së karburantit, u morën 200 kJ nxehtësi, dhe 120 kJ nxehtësi u transferuan në frigorifer. Cili është efikasiteti i motorit?
Zgjidhja:
Formula për përkufizimet e efikasitetit duket si kjo:
ŋ = Q1 - Q2 / Q1.
ŋ \u003d (2 10 5 J - 1.2 10 5 J) / 2 10 5 J \u003d 0.4.
Përgjigje: Efikasiteti i motorit të nxehtësisë është 40%.
Detyra 3. Sa është rendimenti i një motori termik nëse lëngu i punës, pasi ka marrë një sasi nxehtësie prej 1,6 MJ nga ngrohësi, ka kryer 400 kJ punë? Sa nxehtësi u transferua në frigorifer?
Zgjidhja:
Efikasiteti mund të përcaktohet nga formula
ŋ \u003d 0,4 10 6 J / 1,6 10 6 J \u003d 0,25.
Sasia e nxehtësisë së transferuar në frigorifer mund të përcaktohet nga formula
Q 1 - A \u003d Q 2.
Q 2 \u003d 1,6 10 6 J - 0,4 10 6 J \u003d 1,2 10 6 J.
Përgjigje: motori i nxehtësisë ka një efikasitet prej 25%; sasia e nxehtësisë së transferuar në frigorifer është 1.2 10 6 J.
5.196. Një motor ngrohje ideale që funksionon sipas ciklit Carnot kryen punën A = 2,94 kJ në një cikël dhe transferon sasinë e nxehtësisë H2 = 13,4 kJ në frigorifer në një cikël. Gjeni efikasitetin ciklit.
5.197. Një motor ideal i nxehtësisë që funksionon në ciklin Carnot kryen punën A \u003d 73,5 kJ në një cikël. Temperatura e ngrohësit t1 = 100 ° C, temperatura e frigoriferit t2 = 0 ° C. Gjeni efikasitetin e ciklit, sasinë e nxehtësisë Q1 të marrë nga makina në një cikël nga ngrohësi dhe sasinë e nxehtësisë Q2 të dhënë në një cikël në frigorifer .

5.198. Një motor ideal i nxehtësisë funksionon sipas ciklit Carnot. Në të njëjtën kohë, 80% e sasisë së nxehtësisë së marrë nga ngrohësi transferohet në frigorifer. Makina merr nga ngrohësi sasinë e nxehtësisë Q1 = 6,28 kJ. Gjeni efikasitetin e ciklit dhe të punës A të kryer në një cikël.
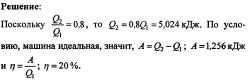
5.199. Një motor ideal i nxehtësisë funksionon sipas ciklit Carnot. Ajri në presion p1 = 708 kPa dhe temperaturë t1 = 127°C zë një vëllim V1 = 2 litra. Pas zgjerimit izotermik, ajri zinte vëllimin V2 = 5 l; pas zgjerimit adiabatik, vëllimi u bë i barabartë me V3 = 8 l. Gjeni: a) koordinatat e kryqëzimit të izotermave dhe adiabateve; b) puna A e kryer në çdo seksion të ciklit; në) punë e plotë A, kryhet për të gjithë ciklin; efikasiteti i ciklit; e) sasinë e nxehtësisë Q1 të marrë nga ngrohësi në një cikël; f) sasinë e nxehtësisë Q2 që i jepet frigoriferit në një cikël.


5.200. Sasia v = 1 kmol gaz ideal përfundon një cikël të përbërë nga dy izokore dhe dy izobare. Në këtë rast, vëllimi i gazit ndryshon nga V1 = 25 m3 në V2 = 50 m3 dhe presioni ndryshon nga p1 = 100 kPa në p2 = 200 kPa. Sa herë puna e bërë në një cikël të tillë është më e vogël se puna e bërë në ciklin Carnot, izotermat e të cilit korrespondojnë me temperaturat më të larta dhe më të ulëta të ciklit në shqyrtim, nëse vëllimi rritet me 2 herë gjatë zgjerimit izotermik?
![]()
1. Shpërndarja Maxwell. Verifikimi eksperimental i ligjit të shpërndarjes së Maxwell
2. Përkufizimi i numrit të valës dhe vektorit të valës
3. Motori i nxehtësisë kryen 3 kJ punë në një cikël dhe i jep frigoriferit një sasi nxehtësie të barabartë me 12 kJ. Përcaktoni efikasitetin e një motori me nxehtësi
Shpërndarja Maxwell
Shpërndarja e shpejtësisë (ose momentit) të molekulave në një sistem në ekuilibër termodinamik. Duke supozuar se një numër i caktuar molekulash do të ketë një shpejtësi të caktuar dhe proporcioni i molekulave të shpejta dhe të ngadalta nuk është i madh, ne mund të
përcaktoni se çfarë proporcioni të molekulave ∆! ka shpejtësinë e përfshirë në def. intervali | ||||||||
!!!! | ||||||||
Verifikimi eksperimental i ligjit të shpërndarjes së Maxwell
Përvoja e Estherman. Një rreze atomesh ceziumi fluturoi nga furra përmes vrimës 1, lëvizi përgjatë një parabole nën veprimin e gravitetit. Disa trajektore të lëvizjes kaluan nëpër çarjen 2, dhe më pas u kapën nga detektori 3, me lartësi të ndryshme h, ku h varej nga shpejtësia e atomeve. Kjo do të thotë, detektori numëroi sa atome fluturuan në slot (dhe vetëm ata që kishin një shpejtësi të caktuar fluturuan) Kështu u mor shpërndarja e shpejtësive të atomeve të Ceziumit. Ata konfirmuan formulën e Maxwell.
Përkufizimi i numrit të valës
Numri i valëve në një centimetër; numerikisht e barabartë me numrin e periudhave të valës që përshtaten në një segment prej 2π metrash. Ky është analog hapësinor i frekuencës rrethore; përcakton
periudha hapësinore dhe drejtimi i përhapjes së valëve. = 2 = faza
Përkufizimi i vektorit të valës
Ku është një vektor njësi i drejtuar pingul me sipërfaqen e valës, në drejtim të përhapjes së valës.

1. Arsyetimi statistikor i ligjit të dytë të termodinamikës. Formula Boltzmann për entropinë statistikore.
2. Përkufizimi i ekuacionit të gjendjes së lëndës.
3. Përcaktoni raportin e shpejtësive rrënjë-mesatare katrore të molekulave të heliumit dhe azotit në të njëjtat temperatura. I afërm masë atomike heliumi është 4, dhe azoti 14.
Arsyetimi statistikor i ligjit të dytë të termodinamikës.
Le të ketë gjashtë molekula gazi në enë. Ndani enën mendërisht në tre pjesë të barabarta. Duke lëvizur në mënyrë kaotike, molekulat krijojnë makroshpërndarje të caktuara. Në fizikën teorike, vërtetohet se probabiliteti termodinamik, d.m.th., numri N i grimcave sipas
P gjendjet (gjashtë grimca në tre pjesë të enës), përcaktohet nga formula
= ! !! !. .! !
Shpërndarja uniforme ka probabilitetin më të lartë termodinamik, mund të kryhet numri më i madh mënyrat. Të gjitha proceset në natyrë ecin në një drejtim, duke çuar në një rritje të probabilitetit të një gjendjeje
Formula Boltzmann për entropinë statistikore.
Lidhja midis entropisë dhe probabilitetit termodinamik u vendos nga Boltzmann - entropia është proporcionale me logaritmin e probabilitetit termodinamik: = . Kuptimi statistikor i konceptit të entropisë është se një rritje në entropinë e një sistemi të izoluar shoqërohet me kalimin e këtij sistemi nga një gjendje më pak e mundshme në një gjendje më të mundshme.
Përkufizimi i ekuacionit të gjendjes së lëndës.
Përshkruan marrëdhënien ndërmjet parametrave termodinamikë (makroskopikë) të sistemit (presion, vëllim, temperaturë).
Ku =! =!

1. Ligji i rritjes së entropisë. Ligji i tretë i termodinamikës
2. Përkufizimi i një gazi ideal.
3. Sa herë energjia kinetike grimca është më e vogël se energjia e saj e pushimit nëse grimca lëviz me një shpejtësi prej 0.8C, ku C \u003d 3 * 10^8 m / s është shpejtësia e dritës
Ligji i rritjes së entropisë.
"Në një sistem të izoluar, entropia nuk zvogëlohet." Nëse në një moment në kohë sistem i mbyllurështë në një gjendje makroskopike jo ekuilibër, atëherë në kohët e mëvonshme pasoja më e mundshme do të jetë një rritje monotonike e entropisë së saj. Nëse në një moment në kohë entropia e një sistemi të mbyllur është e ndryshme nga maksimumi, atëherë në momentet pasuese entropia nuk zvogëlohet - rritet ose, në rastin kufizues, mbetet konstante.
Le të shqyrtojmë transferimin e nxehtësisë midis dy pjesëve të sistemit A1 dhe A2 që kanë temperatura T1 dhe T2. Le të T1 Në këtë rast, entropia e trupit A1 do të ndryshojë me vlerën ΔQ1/T1, dhe entropia e trupit A2 do të ndryshojë me vlerën E vlefshme vetëm për sistemet e ekuilibrit. Kur një sistem priret në zero absolute, entropia e tij tenton në një konstante, e marrë si zero. Kapaciteti i nxehtësisë gjithashtu tenton në zero. Pasojat: është e pamundur të arrihet një gjendje me zero absolute; ur. Mend-duartrokitje. nuk zbatohet për të përshkruar një gaz ideal si → 0 Përkufizimi i një gazi ideal. Një model matematik i një gazi, në të cilin supozohet se: 1) energjia potenciale e bashkëveprimit të molekulave mund të neglizhohet në krahasim me energjinë e tyre kinetike; 2) vëllimi i përgjithshëm i molekulave të gazit është i papërfillshëm. Forcat nuk veprojnë ndërmjet molekulave tërheqja ose zmbrapsja, përplasjet e grimcave ndërmjet tyre dhe me muret e enës janë absolutisht elastike dhe koha e bashkëveprimit ndërmjet molekulave është e papërfillshme në krahasim me kohën mesatare midis përplasjeve. 1.
Cikli Carnot. Teorema e Carnot. efikasiteti i një motori ideal me nxehtësi. 2.
Përcaktimi i energjisë mesatare kinetike të një atomi. 3.
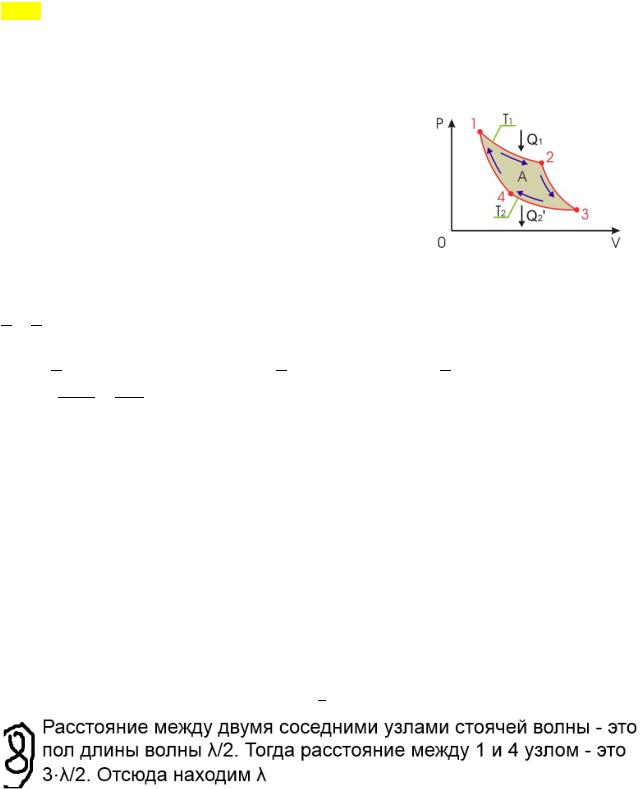
Përcaktoni gjatësinë valore të valës në këmbë nëse distanca ndërmjet këndit të parë dhe këndit të katërt të valës në këmbë është 18 cm Cikli Carnot. Cikli i mbyllur. Që të ndodhë transferimi i nxehtësisë, kërkohet një ndryshim i temperaturës. 1-2-procesi izotermik: gazi merr nxehtësi (!) nga ngrohësi, duke u zgjeruar në një temperaturë konstante T! . 2-3-adiabatik: gazi zgjerohet pa shkëmbim nxehtësie 3-4-izotermik: gazi lëshon nxehtësi në frigorifer (frigoriferi merr ′! =! ), tkurret në një temperaturë konstante T! 4-1-adiabatik: gazi është i ngjeshur pa shkëmbim nxehtësie. efikasiteti i një motori ideal me nxehtësi. Duke përdorur ekuacionin adiabatik, ne shkruajmë proceset 2-3 4-1: Të parën e ndajmë me të dytën: Meqenëse proceset 1-2 dhe 3-4 janë izotermale, ndryshimi në energjinë e brendshme = 0, !
!!
! atëherë sipas ligjit të parë të termodinamikës dhe punës së procesit izotermik ( !" =
! ! ), marrim:! Ne përdorim ! (!)
!!
!!!
!!
!!!!
Teorema e Carnot. 1.
Efikasiteti i çdo motori termik të kthyeshëm që funksionon sipas ciklit Carnot nuk varet nga natyra e lëngut të punës dhe dizajni i makinës, por është një funksion vetëm i temperaturës së ngrohësit.! dhe frigorifer! : arr = 1 − Ф(! ,! ) 2.
Efikasiteti i çdo motori termik që funksionon në një cikël të pakthyeshëm është më i vogël se efikasiteti i një makine me një cikël të kthyeshëm Carnot, me kusht që temperaturat e ngrohësve dhe frigoriferëve të tyre të jenë të barabarta: nebr<
обр Përcaktimi i energjisë mesatare kinetike të një atomi. =
!
<
!
>
3
Energjia kinetike e lëvizjes përkthimore të atomeve dhe molekulave, mesatarisht mbi një numër të madh grimcash që lëvizin rastësisht, është një masë e asaj që quhet temperaturë. Nëse temperatura T matet në gradë Kelvin (K), atëherë lidhja e saj me ! jepet nga raporti: 1.
formula barometrike. Shpërndarja Boltzmann. 2.
Përkufizimi i njësisë së masës atomike. 3.
Përcaktoni eksponentin adiabatik të një gazi diatomik. Duke përdorur ekuacionin e njohur Poisson, shkruani ekuacionin adiabatik për këtë gaz në Variablat P-T. formula barometrike. Ju lejon të llogaritni presionin atmosferik në varësi të lartësisë ose, duke matur presionin, të gjeni lartësinë. Le të jetë një gaz ideal në një fushë të jashtme graviteti. Merrni parasysh ekuilibrin e një vëllimi të vogël gazi: − − − = !"#
! =
!" Duke vendosur presionin në ku = = !
!
!!
!" => !
Pjestojeni me numrin e Avogadros: ! ! − Konstanta e Boltzmanit Shpërndarja Boltzmann. !", por ! =
! - shpërndarja Boltzmann. ! !"
Përkufizimi i a.m.u. Njësia e karbonit - një njësi e masës jashtë sistemit që përdoret për masat e molekulave, atomeve, bërthamat atomike dhe grimcat elementare. Njësia e masës atomike shprehet në masën e nuklidit të karbonit 12 C dhe është e barabartë me 1/12 e masës së këtij nuklidi. 1.
pabarazia e Clausius. Entropia termodinamike. Ligji i dytë i termodinamikës. 2.
Përcaktimi i masës atomike relative të një atomi. 3.
Përcaktoni numrin e molekulave të hidrogjenit për njësi vëllimi të një ene, presioni në të cilin është 270 Pa, nëse shpejtësia mesatare katrore e molekulave të saj është 2,4 km/s. pabarazia e Clausius. Sasia totale e nxehtësisë së reduktuar në çdo qark. Cikli për çdo TermSist nuk mund të jetë më i madh se zero: !! ! ≤ 0, ku është sasia e nxehtësisë e raportuar në sistem (ose e hequr prej tij: -) në një seksion pafundësisht të vogël të ciklit; T - abs. temp-pa resp. element mjedisi;!! ! − ngrohje elementare e reduktuar. të pakthyeshme (të paktën një seksion) cikli korrespondon me pabarazinë, cikli i përbërë vetëm nga procese të kthyeshme - shenja e barabartë (barazia Clausius). Varet vetëm nga gjendja fillestare dhe përfundimtare. Entropia termodinamike. Një masë e shpërndarjes së pakthyeshme të energjisë. = (forma e ndryshimit), ! − ! = ! ! !! ! (forma integrale), ku! ,! − entropia e gjendjes përfundimtare dhe fillestare. Ligji i dytë i termodinamikës. Sipas Clasius: - nxehtësia në vetvete, pa ndryshim në trupat përreth, nuk mund të kalojë nga një trup më pak i nxehtë në një trup më të nxehtë. Sipas Thomson: në natyrë, një proces rrethor është i pamundur, rezultati i vetëm i të cilit do të ishte puna mekanike e kryer duke hequr nxehtësinë nga një rezervuar termik. Nxehtësia nuk mund të kalojë nga një trup i ftohtë në një trup të nxehtë pa të ndonjë ndryshime të tjera në sistem (shpërndarja e energjisë). Masa atomike relative. Një "masë tmonaya, masë atomike relative (emri i vjetër - peshë atomike ) është vlera e masës së një atomi, e shprehur në njësi të masës atomike. Aktualisht, njësia e masës atomike merret e barabartë me 1/12 e masës së një atomi neutral të izotopit më të zakonshëm të karbonit 12
C, kështu që masa atomike e këtij izotopi është, sipas përkufizimit, saktësisht 12. 1.
Ligji i parë i termodinamikës në integrale dhe forma diferenciale rekorde. 2.
Përcaktimi i intervalit të ngjarjeve në teorinë speciale të relativitetit. 3.
Çfarë numri atomesh të gazit përmban një njësi e vëllimit të një ene në një temperaturë prej 20 gradë Celsius dhe një presion prej 0,5 atm. Përcaktoni shpejtësinë mesatare katrore të atomeve të këtij gazi. Aminoacidi relativ i këtij gazi është 4. Ligji i parë i termodinamikës. Ndryshimi në energjinë e brendshme të një sistemi (trupi) termodinamik mund të kryhet "në dy mënyra: duke bërë punë mekanike dhe nga transferimi i nxehtësisë. = ∆ − ′, ku është sasia e nxehtësisë së transferuar në sistem, ∆ është ndryshimi i energjisë së brendshme të sistemit, ! − puna e bërë në sistem. = − . Ligji i parë ndalon ekzistencën e një makine me lëvizje të përhershme pa furnizim me energji të jashtme. Përcaktimi i intervalit të ngjarjeve në SRT. Është: ∆ ! =! ∆! −∆! −∆! −∆! , ku: ∆ =! −! , ∆ =! −! , ∆ =! −! , ∆ = ! −! - dallimi i kohërave dhe koordinatave të dy ngjarjeve. Kjo do të thotë, kjo është distanca midis dy ngjarjeve në hapësirën kohore, e cila është një përgjithësim i hapësirës Euklidiane midis dy pikave. 1.
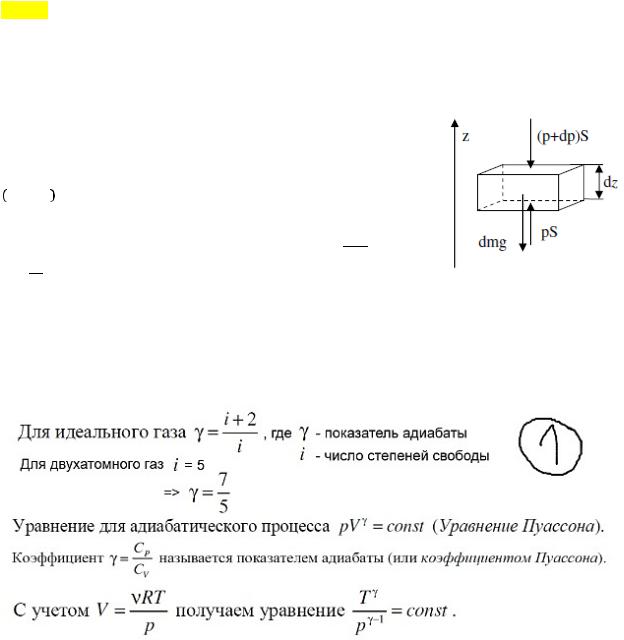
procesi adiabatik. Ekuacioni Poisson. Ekuacioni adiabatik në Koordinatat P-T 2.
Përcaktimi i peshës molekulare relative të një molekule. 3.
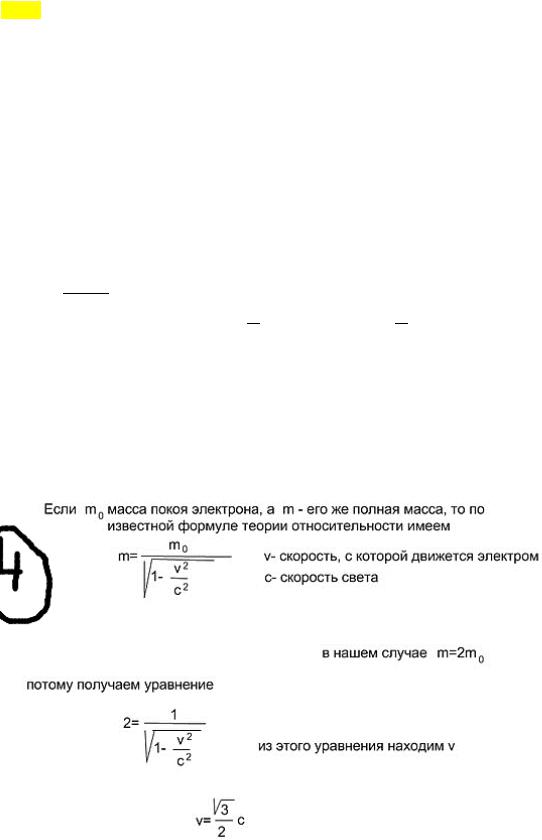
Me çfarë shpejtësie është masa e një elektroni në lëvizje sa dyfishi i masës së tij të prehjes? procesi adiabatik. Një proces në të cilin nuk ka shkëmbim nxehtësie (= 0 ) ndërmjet sistemit dhe mjedisi. Të gjitha proceset e shpejta mund të konsiderohen si procese adiabatike. Nga ligji i parë i termodinamikës: − = , d.m.th. punë jashtë kryhet për shkak të një ndryshimi në energjinë e brendshme të sistemit.ad \u003d 0. Ekuacioni Poisson. Ligji i parë i termodinamikës. + + - ur. Mendeleev-Klap. ! =! + - ur. Mayer Pasi kemi kryer transformimet (ne shprehim dT nga e dyta, zëvendësojmë në të parën, gjithashtu nga R e treta në të parën), marrim: ! për qind!! ! + = 0 është ekuacioni i disa proceseve politropike. Për Perc!! ! adiabats (proc = ferr = 0), marrim:! ! + = 0, ku! ! = - eksponent adiabatik, atëherë !
!!
! integro + = 0: !" !! +!" ! = 0 => ln + ln = ln() => ln(! ) = ln() =>! = - Ekuacioni Poisson. Ekuacioni adiabatik në koordinatat P-T. Me ndihmën e ur. Mend-Clap është i përjashtuar nga! = :!!! = Përcaktimi i peshës molekulare relative të një molekule. Ky është raporti i masës së një molekule të një substance me 1/12 e masës së një atomi 12 C (karbon). 1.
Ekuacioni i valëve të qëndrueshme. Nyjet dhe antinyjet e një vale në këmbë. 3.
Dioksidi i karbonit CO2 me peshë 8 g u ngroh në Δt = 20 gradë Celsius në kushte të zgjerimit të lirë. Gjeni punën e zgjerimit të gazit dhe ndryshimin e energjisë së brendshme të tij. Masa atomike relative e karbonit është 12, dhe oksigjeni është 16 Ekuacioni i valëve të qëndrueshme. Vala në këmbë - lëkundjet në sistemet oshiluese të shpërndara me një rregullim karakteristik të maksimumeve alternative (antinoda) dhe minimale (nyje) të amplitudës. Në praktikë, një valë e tillë lind gjatë reflektimeve nga pengesat dhe johomogjenitetet si rezultat i mbivendosjes së valës së reflektuar në atë rënëse. Ekuacioni i valës së qëndrueshme: = (−) Nxjerrja e ekuacionit të valës në këmbë. Konsideroni dy forma valore me tre intervale identike të frekuencës, të cilat Kur dy valë mbivendosen mbi njëra-tjetrën: Nyjet dhe antinyjet e një vale në këmbë. Antinode - seksione të një valë në këmbë, ku amplituda e lëkundjeve është maksimale. =±. Në mënyrë të ngjashme, nyjet janë seksione të një valë në këmbë me një amplitudë minimale. = ! ! ± Përkufizimi i Sistemit Termodinamik (TS).. Një sistem termodinamik është a sistemi fizik, i përbërë nga një numër i madh grimcash, të afta për të shkëmbyer me mjedisin, energjinë, materien. Zakonisht supozohet gjithashtu se një sistem i tillë i bindet rregullsive statistikore. Për sistemet termodinamike, ligjet e termodinamikës janë të vlefshme. Përkufizimi i izoluar i automjetit Një sistem i izoluar (sistemi i mbyllur) është një sistem termodinamik që nuk shkëmben as lëndë dhe as energji me mjedisin. Në termodinamikë është postuluar (si rezultat i përgjithësimit të përvojës) se sistem i izoluar gradualisht vjen në një gjendje ekuilibri termodinamik, nga i cili nuk mund të dalë spontanisht (ligji zero i termodinamikës). 1.
Rrjedha e energjisë e një valë elastike. Llogaritja e rrjedhës së energjisë duke përdorur vektorin Umov. 2.
Përkufizimi shkallë absolute temperatura dhe lidhja e saj me shkallën e temperaturës Celsius. 3.
Përcaktoni eksponentin adiabatik për një gaz monoatomik. Duke përdorur ekuacionin e njohur Poisson, shkruani ekuacionin adiabatik në variablat V – T. Rrjedha e energjisë e një valë elastike. Fluksi i energjisë i një vale elastike është sasia e energjisë së bartur nga një valë nëpër një sipërfaqe të caktuar për njësi të kohës. F = Matur në vat. Llogaritja e rrjedhës së energjisë duke përdorur vektorin Umov. Vektori Umov është vektori i densitetit të fluksit. Mesatarja:< > = < > = . Është i ndryshëm në pika të ndryshme të hapësirës, ndryshon në kohë sipas ligjit të katrorit të sinusit. Përcaktimi i shkallës absolute të temperaturës dhe lidhja e saj me shkallën e temperaturës Celsius. Shkalla absolute e temperaturës - masa e bazës së kufirit të poshtëm të një shkalle të tillë është 0 absolute, nën të cilën temperatura nuk mund të bjerë. 0K korrespondon me -273. Prandaj, pika e ngrirjes së ujit në Kelvin është 273 gradë, dhe pika e vlimit është 373 K. 1 = 1 K