Konfigurimi elektronik i atomit të të gjithë elementëve. Predhat elektronike të atomit. Modelet atomike të Bohr-it
Njohja e gjendjeve të mundshme të një elektroni në një atom, rregulli i Kleçkovskit, parimi i Paulit dhe rregulli i Hundit bëjnë të mundur shqyrtimin e konfigurimit elektronik të një atomi. Për këtë përdoren formula elektronike.
Formula elektronike tregon gjendjen e një elektroni në një atom, duke treguar kryesoren numër kuantik, duke karakterizuar gjendjen e saj, dhe shkronja - numri kuantik orbital. Një numër që tregon se sa elektrone janë në një gjendje të caktuar shkruhet në të djathtë të majës së shkronjës që tregon formën e resë elektronike.
Për një atom hidrogjeni (n \u003d 1, l \u003d 0, m \u003d 0), formula elektronike do të jetë: 1s 1. Të dy elektronet e elementit tjetër helium He karakterizohen nga të njëjtat vlera n, l, m dhe ndryshojnë vetëm në rrotullime. Formula elektronike e atomit të heliumit është ls 2. Predha elektronike e atomit të heliumit është e plotë dhe shumë e qëndrueshme. Heliumi është një gaz fisnik.
Për elementët e periudhës së dytë (n = 2, l = 0 ose l = 1), së pari plotësohet gjendja 2s dhe më pas nënniveli p i nivelit të dytë energjetik.
Formula elektronike e atomit të litiumit është: ls 2 2s 1. Elektroni 2s 1 është më i dobët i lidhur me bërthamën atomike (Fig. 6), kështu që atomi i litiumit mund ta lërë atë lehtësisht (siç e mbani mend qartë, ky proces quhet oksidim), duke u kthyer në një jon Li +.
Oriz. 6.
Prerje tërthore të reve elektronike 1s dhe 2s nga një rrafsh që kalon nëpër bërthamë
Në atomin e beriliumit, elektroni i katërt gjithashtu zë gjendjen 2s: ls 2 2s 2 . Dy elektronet e jashtme të atomit të beriliumit shkëputen lehtësisht - në këtë rast, Be oksidohet në kationin Be 2+.
Atomi i borit ka një elektron në gjendjen 2p: ls 2 2s 2 2p 1 . Më pas, në atomet e karbonit, azotit, oksigjenit dhe fluorit (në përputhje me rregullin e Hundit), mbushet nënniveli 2p, i cili përfundon në neonin e gazit fisnik: ls 2 2s 2 2p 6 .
Nëse duam të theksojmë se elektronet në një nënnivel të caktuar zënë qelizat kuantike një nga një, në formulën elektronike përcaktimi i nënnivelit shoqëron indeksin. Për shembull, formula elektronike e atomit të karbonit
![]()
Për elementët e periudhës së 3-të, plotësohen përkatësisht gjendja 3s (n = 3, l = 0) dhe nënniveli 3p (n = 3, l - 1). Nënniveli 3d (n = 3, l = 2) mbetet i lirë:
Ndonjëherë në diagramet që përshkruajnë shpërndarjen e elektroneve në atome, tregohet vetëm numri i elektroneve në çdo nivel energjie, domethënë, ata shkruajnë formulat elektronike të shkurtuara të atomeve. elementet kimike, në krahasim me formulat e plota elektronike të mësipërme, për shembull:
Për elementët e periudhave të mëdha (4 dhe 5), në përputhje me rregullin Klechkovsky, dy elektronet e para të shtresës së jashtme elektronike zënë gjendjet 4s (n = 4, l = 0) dhe 5s (n = 5, l = 0 ) përkatësisht. 0):
Duke u nisur nga elementi i tretë i çdo periudhe të madhe, dhjetë elektronet e ardhshme hyjnë përkatësisht në nënnivelet e mëparshme 3d dhe 4d (për elementët e nëngrupeve anësore):
Si rregull, kur mbushet nënniveli i mëparshëm d, atëherë nënniveli i jashtëm (përkatësisht 4p dhe 5p) p do të fillojë të mbushet:
Për elementët e periudhave të mëdha - e 6-ta dhe e 7-ta jo e plotë - nivelet dhe nënnivelet e energjisë mbushen me elektrone, si rregull, si më poshtë: dy elektronet e para hyjnë në nënnivelin e jashtëm s, për shembull:
elektroni tjetër (për La dhe Ac) - në nënnivelin e mëparshëm d:
Pastaj 14 elektronet e ardhshme hyjnë në nivelin e tretë të energjisë nga jashtë në nënnivelet 4f dhe 5f, përkatësisht, për lantanidet dhe aktinidet:
Pastaj niveli i dytë i jashtëm i energjisë (nënniveli d) do të fillojë të ndërtohet përsëri për elementët e nëngrupeve anësore:
Vetëm pasi nënniveli d të jetë mbushur plotësisht me dhjetë elektrone, nënniveli i jashtëm p do të mbushet përsëri:
Si përfundim, ne do të shqyrtojmë edhe një herë mënyra të ndryshme të shfaqjes së konfigurimeve elektronike të atomeve të elementeve sipas periudhave të tabelës së D. I. Mendeleev.
Konsideroni elementet e periudhës së 1-të - hidrogjeni dhe heliumi.

Formulat elektronike të atomeve tregojnë shpërndarjen e elektroneve mbi nivelet dhe nënnivelet e energjisë.
Formulat elektronike grafike të atomeve tregojnë shpërndarjen e elektroneve jo vetëm sipas niveleve dhe nënniveleve, por edhe sipas qelizat kuantike (orbitalet atomike).

Në një atom helium, shtresa e parë e elektroneve është përfunduar - ajo ka 2 elektrone.
Hidrogjeni dhe heliumi janë elementë s; nënniveli ls i këtyre atomeve është i mbushur me elektrone.
Për të gjithë elementët e periudhës së dytë, shtresa e parë elektronike është e mbushur, dhe elektronet mbushin gjendjet 2s- dhe 2p në përputhje me parimin e energjisë më të vogël (së pari S- dhe më pas p) dhe rregullat e Pauli dhe Hund ( Tabela 2).
Në atomin e neonit, shtresa e dytë e elektroneve është përfunduar - ajo ka 8 elektrone.
tabela 2
Struktura e predhave elektronike të atomeve të elementeve të periudhës së 2-të

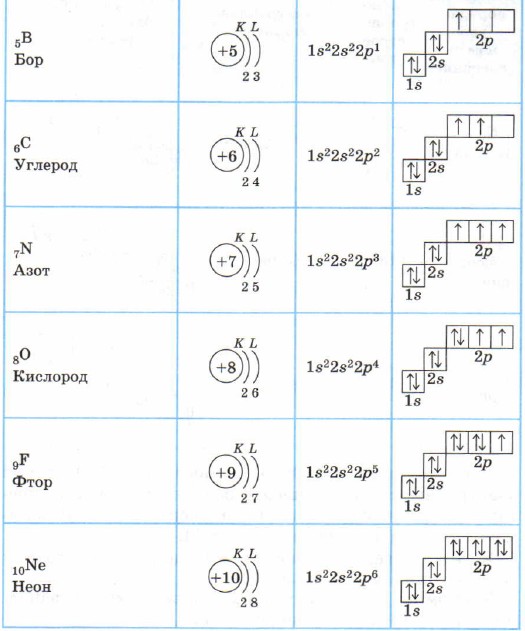
Litium Li, berilium Be - s-elemente.
Bori B, karboni C, azoti N, oksigjeni O, fluori F, neoni Ne janë p-elemente, nënniveli p i këtyre atomeve është i mbushur me elektrone.
Për atomet e elementeve të periudhës së 3-të, shtresa e parë dhe e dytë elektronike plotësohet, pra mbushet shtresa e tretë elektronike, në të cilën elektronet mund të zënë gjendjet 3s, 3p dhe 3d (Tabela 3).
Tabela 3
Struktura e predhave elektronike të atomeve të elementeve të periudhës së 3-të
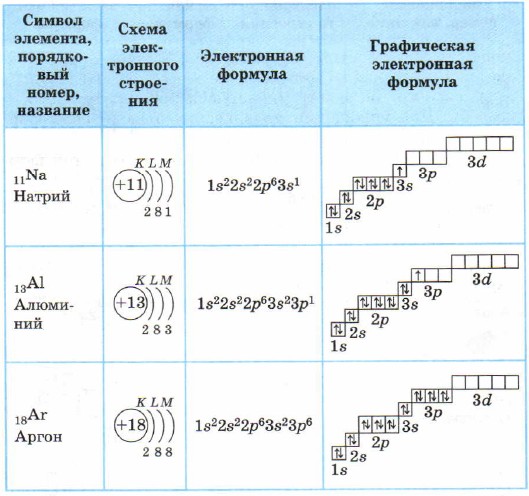
Në atomin e magnezit përfundon nënniveli 3s. Natriumi Na dhe magnezi Mg janë elementë s.
Për aluminin dhe elementët pas tij, nënniveli 3p është i mbushur me elektrone.
Ka 8 elektrone në shtresën e jashtme (shtresa e tretë elektronike) në atomin e argonit. Si shtresë e jashtme është e plotë, por në total, në shtresën e tretë elektronike, siç e dini tashmë, mund të jenë 18 elektrone, që do të thotë se elementët e periudhës së 3-të kanë një gjendje 3d boshe.
Të gjithë elementët nga alumini Al në argon Ar janë p-elemente.
Elementet s dhe p formojnë nëngrupet kryesore në sistemin periodik.
Atomet e elementeve të periudhës së 4-të - kaliumi dhe kalciumi - kanë një nivel të katërt të energjisë, nënniveli 48 është i mbushur (Tabela 4), pasi, sipas rregullit Klechkovsky, ai ka më pak energji se nënniveli 3d.
Tabela 4
Struktura e predhave elektronike të atomeve të elementeve të periudhës së 4-të
![]()
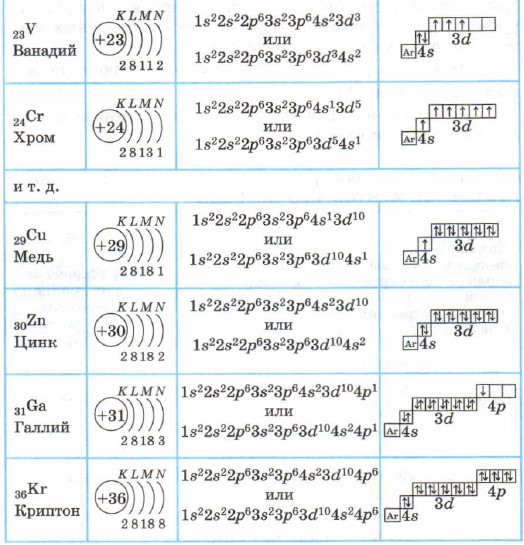
Për të thjeshtuar formulat elektronike grafike të atomeve të elementeve të periudhës së 4-të:
Kaliumi K dhe kalciumi Ca janë s-elementë të përfshirë në nëngrupet kryesore. Në atomet nga skandiumi Sc tek zinku Zn, nënniveli 3d është i mbushur me elektrone. Këto janë elemente 3d. Ato përfshihen në nëngrupet dytësore, kanë një shtresë elektronike para të jashtme të mbushur, ato quhen elemente kalimtare.
Kushtojini vëmendje strukturës së predhave elektronike të atomeve të kromit dhe bakrit. Në to, ndodh një "dështim" i një elektroni nga nënniveli 4s- në 3d, i cili shpjegohet me stabilitetin më të madh të energjisë të konfigurimeve elektronike që rezultojnë 3d 5 dhe 3d 10:
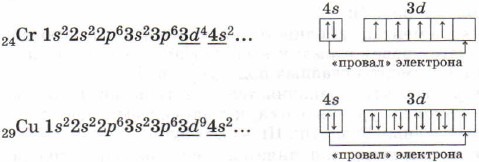
Në atomin e zinkut, niveli i tretë i energjisë përfundon, të gjitha nënnivelet janë të mbushura në të - 3s, 3p dhe 3d, në total ata kanë 18 elektrone.
Në elementët pas zinkut, niveli i katërt i energjisë, nënniveli 4p, vazhdon të mbushet.
Elementet nga galium Ga në krypton Kr janë p-elemente.
Shtresa e jashtme (e katërta) e atomit të kriptonit Kr është e plotë dhe ka 8 elektrone. Por vetëm në shtresën e katërt të elektroneve, siç e dini, mund të ketë 32 elektrone; gjendjet 4d dhe 4f të atomit të kriptonit mbeten ende të pabanuara.
Për elementët e periudhës së 5-të, në përputhje me rregullin Klechkovsky, nënnivelet plotësohen në rendin e mëposhtëm: 5s ⇒ 4d ⇒ 5p. Dhe ka gjithashtu përjashtime që lidhen me "dështimin" e elektroneve në 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
Në periudhat e 6-të dhe të 7-të shfaqen elementet f, d.m.th., elementë në të cilët po plotësohen respektivisht nënnivelet 4f dhe 5f të nivelit të tretë të energjisë jashtë.
Elementet 4f quhen lantanide.
Elementet 5f quhen aktinide.
Rendi i mbushjes së nënniveleve elektronike në atomet e elementeve të periudhës së 6-të: 55 Cs dhe 56 Ba - bs-elemente; 57 La ...6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - 4f elemente; 72 Hf - 80 Hg - 5d elemente; 81 Tl - 86 Rn - br elemente. Por edhe këtu ka elementë në të cilët "shkelet" rendi i mbushjes së nënniveleve energjetike, i cili, për shembull, shoqërohet me stabilitet më të madh energjetik të nënniveleve f gjysmë dhe plotësisht të mbushura, d.m.th. nf 7 dhe nf 14 .
Në varësi se cili nënnivel i atomit është i mbushur me elektrone i fundit, të gjithë elementët, siç e keni kuptuar tashmë, ndahen në katër familja elektronike ose bllok (Fig. 7):

Oriz. 7.
Ndarja e sistemit periodik (tabela) në blloqe elementësh
- s-elementet; nënniveli s i nivelit të jashtëm të atomit është i mbushur me elektrone; s-elementet përfshijnë hidrogjenin, heliumin dhe elementet e nëngrupeve kryesore të grupeve I dhe II;
- p-elementet; nënniveli p i nivelit të jashtëm të atomit është i mbushur me elektrone; p-elementet përfshijnë elemente të nëngrupeve kryesore të grupeve III-VIII;
- d-elementet; nënniveli d i nivelit para të jashtëm të atomit është i mbushur me elektrone; d-elementët përfshijnë elementë të nëngrupeve dytësore të grupeve I-VIII, d.m.th. elementë të dekadave ndërkalare të periudhave të mëdha të vendosura midis elementeve s dhe p. Quhen edhe elemente kalimtare;
- f-elementet; nënniveli f i nivelit të tretë të jashtëm të atomit është i mbushur me elektrone; këto përfshijnë lantanide dhe aktinide.
Pyetje dhe detyra për § 3
- Bëni diagrame të strukturës elektronike, formula elektronike dhe formula elektronike grafike të atomeve të elementeve kimike të mëposhtme:
- a) kalcium;
b) hekuri;
c) zirkon;
d) niobium;
e) hafnium;
e) ari. - Shkruani formulën elektronike për elementin #110 duke përdorur simbolin për gazin fisnik përkatës.
- Cila është "zhytja" e elektronit? Jepni shembuj të elementeve në të cilët vërehet kjo dukuri, shkruani formulat e tyre elektronike.
- Si përcaktohet përkatësia e një elementi kimik në një familje të caktuar elektronike?
- Krahasoni formulat elektronike dhe grafike elektronike të atomit të squfurit. Çfarë Informacion shtese përmban formulën e fundit?
Në këtë mësim, do të mësoni për predha elektronike të atomit, cilat janë modelet atomike të Bohr-it. Ju përsërisni strukturën bërthama atomike, pastaj vazhdoni me shqyrtimin e pikëpamjeve moderne në studimin e predhave elektronike të atomit, imazhet e kushtëzuara të niveleve elektronike dhe nënnivelet. Ju gjithashtu do të merrni parasysh modelet atomike të Bohr-it.
Tema: Ligji periodik dhe sistemi periodik i elementeve kimike të D. I. Mendeleev
Mësimi: Predhat elektronike të një atomi. Modelet atomike të Bohr-it
1. Postulatet e N. Bohr
Bërthama atomike përbëhet nga protone - grimca të ngarkuara pozitivisht dhe neutrone - grimca që nuk kanë ngarkesë. Në këtë mësim, ne do të shikojmë strukturën e shtresës elektronike të një atomi.
Oriz. 1. Modeli planetar i atomit
Në vitin 1913, fizikani danez Niels Bohr sugjeroi se atomi është i ngjashëm në strukturë me strukturën. sistem diellor. Brenda atomit, si dhe brenda sistemit diellor, dielli është një bërthamë masive, në të cilën është e përqendruar e gjithë masa e atomit. Dhe rreth kësaj bërthame, si planetët rreth diellit, elektronet rrotullohen. Fig.1. Një elektron ka një masë 1832 herë më pak se një proton ose një neutron. Modeli i Niels Bohr u bazua në atë të mësuesit të tij Ernest Rutherford.
Niels Bohr sugjeroi që elektronet në një atom nuk lëvizin rastësisht, por lëvizin në orbita të caktuara. Ai postuloi, pra pranoi pa prova, dy propozime.
Postulatet e Niels Bohr.
1. Ka orbita në atom, në të cilat elektroni nuk rrezaton energji. Këto orbita quhen të palëvizshme.
2. Rrezatimi ndodh vetëm kur një elektron kërcen nga një orbitë e palëvizshme në tjetrën.
2. Struktura e shtresës elektronike të atomit
Sipas teoria kuantike struktura e një atomi, të gjitha elektronet në një atom lëvizin përgjatë niveleve të energjisë ose orbitave. Këto nivele përbëhen nga nënnivele. Nga ana tjetër, nënnivelet përbëhen nga orbitale atomike. Një strukturë e tillë është e lehtë të imagjinohet nëse supozojmë se shtresa elektronike e një atomi është një shtëpi që qëndron në bërthamë. Shtëpia përbëhet nga shumë kate - nivele. Çdo nivel ka nënnivele - këto janë apartamente. Apartamentet kanë orbitale atomike, domethënë dhoma. Ne nuk mund të përcaktojmë vendndodhjen specifike të një elektroni në orbitale, por të përcaktojmë probabilitetin që ai të jetë në orbitalet atomike.
Nivelet.
Orbitat elektronike në modelin Bohr shënohen me numra të plotë: 1, 2, 3, 4, ... e kështu me radhë deri në n, ose me shkronja latine në mënyrë alfabetike, duke filluar me shkronjën K, L, M, N, O P, Q Duke filluar nga niveli më i afërt me bërthamën. Në vijim, ne do t'i quajmë orbita të tilla - nivele.
Nënnivelet.
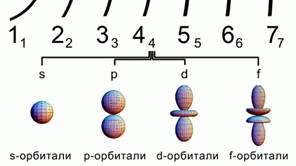
Oriz. 2. Format e orbitaleve atomike
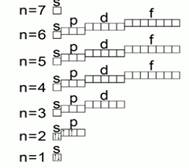
Nivelet nga ana e tyre përbëhen nga nënnivele. Numri i nënniveleve në çdo nivel është i barabartë me numrin e nivelit. Nënnivelet kanë emra.
Nënniveli i parë i çdo niveli quhet S,
Nënniveli i dytë i çdo niveli quhet P,
Nënniveli i tretë i çdo niveli quhet d,
Nënniveli i katërt i çdo niveli quhet f
Orbitalet vijnë në forma të ndryshme.
s - orbital sferik, orbitali p ka formën e një vëllimi tetë. Orbitalet d dhe f janë edhe më shumë formë komplekse. Fig 2.
Të gjitha këto shifra përshkruajnë zonën me shumë gjasa gjetja e elektroneve në një atom.
Modeli valor i një atomi nuk është modeli fizik, dhe së shpejti abstrakt ose modeli matematik struktura e një atomi, rregullimi i elektroneve në të.
S - elementet.
Këta janë elementë që përmbajnë vetëm s-elektrone në nivelin e jashtëm.
Nëse këto janë p - elektrone, atëherë kjo është p - element.
Sa më larg të jetë niveli i energjisë nga bërthama, aq më shumë elektrone mund të strehojë, sepse çdo nivel energjie pasues ka një numër më të madh nënnivelesh. Pra, çdo nivel N mund të ketë n2 nënnivele. Prandaj, elektronet mund të strehojnë 2n2. Pse e shumëzuam n2 me 2? Sepse nuk mund të ketë më shumë se 2 elektrone në çdo orbitale atomike.
Numri më i madh i elektroneve në çdo nivel është dhënë në Tabelën 1.
Oriz. 3. Diagrami orbital
Ne kemi nevojë për të gjithë këtë informacion në mënyrë që të mësojmë se si të vendosim elektronet në nivelet atomike, nënnivelet dhe orbitalet.
3. Diagrami kuantik
Ekziston një imazh i kushtëzuar i niveleve dhe nënnivele elektronike. Ky është një diagram orbital ose kuantik. Në një diagram të tillë, orbitalet përshkruhen në mënyrë konvencionale si katrorë, dhe elektronet si shigjeta. Oriz. 3. Nëse ka dy shigjeta në një qelizë, atëherë ato do të tregohen me shigjeta që tregojnë drejtime të ndryshme. Kjo veti e elektroneve quhet spin.
Pasi të keni mbushur të gjitha orbitalet atomike me elektrone, duhet të shkruani "pasaportën elektronike" të elementit ose formulën e tij elektronike. Për ta bërë këtë, ju duhet të caktoni çdo nivel energjie me numrin 1, 2, 3, ..., nënnivelin me shkronjën s, p, d ...
Si fuqi, hiqni numrin e elektroneve në një nënnivel të caktuar.
4. Struktura elektronike e atomit të azotit
Shembulli #1.

Oriz. 4. Formula elektronike e azotit
Shkruani formulën elektronike të elementit kimik me numrin atomik 7.
Një atom i një elementi të tillë duhet të ketë 7 elektrone. Le t'i mbushim orbitalet me elektrone, duke filluar nga 1-të e poshtme.
Oriz. 5. Diagrami i renditjes së elektroneve në një atom
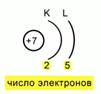
Do të fitohet konfigurimi elektronik i mëposhtëm: 1s22s22p3.Fig.4.
Pas kësaj, ju duhet të rregulloni vendndodhjen e elektroneve për sa i përket niveleve të energjisë. Për ta bërë këtë, duhet të përshkruani në mënyrë skematike bërthamën, të tregoni ngarkesën e saj dhe të përcaktoni numrin nivelet e energjisë. Më lejoni t'ju kujtoj se azoti ka vetëm 2 prej tyre.Ne vizatojmë 2 harqe, dhe nën këto harqe shkruajmë numrin e elektroneve që ndodhen në to. Pastaj marrim një skemë të tillë të rregullimit elektronik në atom. Fig.5.
5. Struktura elektronike e atomit të argonit
Shembulli #2.
Shkruani formulën elektronike të elementit kimik me numrin atomik 18.
Duke vepruar në të njëjtën mënyrë si në rastin e parë, ne do t'i rregullojmë elektronet në orbitale atomike. 1s22s22p63s23p6. Ky është elementi argon. Fig.6. Përkthyer nga greqishtja "joaktiv". E mori këtë emër sepse nuk ndërvepron me asnjë element kimik.
Elemente me një shtresë elektronike të jashtme të kompletuar.
Përfshihet në nëngrupin e gazeve fisnike ose inerte. Inertiteti i tyre shkaktohet nga struktura e atomit të tyre. Këto gaze kanë një shtresë të plotë të energjisë së jashtme - ns2np6. Gazrat inerte formojnë një molekulë monoatomike. Të gjithë gazrat e tjerë në natyrë kanë vetëm një molekulë diatomike. Për shembull, O2, H2 Arsyeja e qëndrueshmërisë së elementeve kimike me një shtresë elektronike të kompletuar nuk është ende e qartë. Por kimistët e marrin atë thjesht si një ligj të natyrës. Të gjithë elementët e tjerë do të tentojnë të plotësojnë guaskën e tyre të jashtme.
6. Etimologjia e emërtimeve të orbitaleve të elektroneve
Do të jetë interesante të dihet pse nënnivelet e niveleve të caktuara emërtohen me shkronja të caktuara. Alfabeti anglez. Çdo atom lëshon energji. Kjo energji mund të fiksohet në spektrat e emetimit të atomeve. Spektrat e ndryshëm të emetimit të atomeve kanë lloj te ndryshme. Linjat e tyre janë të ndryshme. Pra, vijat më të ngushta të mprehta quheshin shkronja s. Nga fjalë angleze"top".
s - nënniveli është emëruar sipas vijës "të mprehtë".
p - nënniveli është emëruar sipas linjës "principal".
d - nënniveli është emëruar sipas linjës "difuz", "e paqartë" (difuze)
f - nënniveli është emëruar sipas linjës "themelore".
7. Disa informacione rreth gazeve inerte


Për shkak të inertitetit të tyre kimik, gazrat fisnikë nuk ishin të njohur në kimi për një kohë të gjatë. Vetëm në 1892 u mor argoni i parë i gazit inert. Ajo u prit nga D. Rayleigh. Ai e mori atë gjatë eksperimenteve me azot. D. Rayleigh vuri re se nëse azoti merret nga ajri, atëherë ky gaz azotik do të ketë një masë më të madhe sesa nëse azoti fitohet në eksperimente të ndryshme kimike. Nëse nga ajri fitohet 1 litër azot, atëherë ai do të ketë një masë prej 1,2572 g, dhe nëse azoti fitohet nga zbërthimi i përbërjeve azotike, atëherë masa do të jetë 1,2505 g, nga vjen një ndryshim i tillë? Shumë shkencëtarë menduan se ata thjesht kryen një eksperiment dhe ndaluan së peshuari ajrin e marrë në këtë mënyrë. D. Rayleigh me mikun e tij W. Ramsay. Ata kryen shumë eksperimente dhe konfirmuan se gazi i azotit i marrë nga ajri përmban një gaz tjetër në përbërjen e tij, i cili ishte 20 herë më i rëndë se hidrogjeni. Kështu u izolua për herë të parë argoni. Deri në vitet 60 të shekullit XX, nuk u mor asnjë përbërje e vetme e gazrave inerte. Tani ata kanë mësuar se si të marrin artificialisht komponime të gazeve inerte me fluor dhe oksigjen. Nëse çmontoni një llambë të zakonshme inkandeshente, atëherë do të hasni gaz argon. Por ju nuk duhet ta bëni këtë, sepse mund të lëndoheni.
Duke përmbledhur mësimin.
Në këtë mësim, mësuat për predha elektronike të atomit, cilat janë modelet atomike të Bohr-it. Ju përsëritët strukturën e bërthamës atomike, duke konsideruar pikëpamjet moderne në studimin e predhave elektronike të atomit, imazhet e kushtëzuara të niveleve dhe nënniveleve elektronike. Konsideroni modelet atomike të Bohr-it. Ne do të shqyrtojmë strukturën e bërthamës më në detaje në mësimet e kimisë në klasën 11.
1. Rudzitis G. E. Inorganike dhe kimi organike. Klasa 8: tekst shkollor për institucionet arsimore: niveli bazë / G. E. Rudzitis, F. G. Feldman. M.: Iluminizmi. 2011 176 fq.: ill.
2. Popel P. P. Kimi: Klasa e 8-të: një libër shkollor për institucionet arsimore të përgjithshme / P. P. Popel, L. S. Krivlya. - K .: Qendra e Informacionit "Akademia", 2008.-240 f.: ill.
3. Gabrielyan O. S. Kimi. Klasa 9 Libër mësuesi. Botues: Drofa.: 2001. 224s.
1. Chemport. ru.
1. Nr 4-6 (f. 138) Rudzitis G. E. Kimi inorganike dhe organike. Klasa 8: tekst shkollor për institucionet arsimore: niveli bazë / G. E. Rudzitis, F. G. Feldman. M.: Iluminizmi. 2011 176 fq.: ill.
2. Në bazë të strukturës së atomeve, shpjegoni arsyen e periodicitetit të vetive të elementeve kimike.
3. Përgatitni një raport të shkurtër mbi historinë e zbulimit të gazeve inerte.
Bërthama atomike përbëhet nga protone - grimca të ngarkuara pozitivisht dhe neutrone - grimca që nuk kanë ngarkesë. Në këtë mësim, ne do të shikojmë strukturën e shtresës elektronike të një atomi.
Oriz. 1. Modeli planetar i atomit
Në vitin 1913, fizikani danez Niels Bohr sugjeroi se atomi ishte i ngjashëm në strukturë me strukturën e sistemit diellor. Brenda atomit, si dhe brenda sistemit diellor, dielli është një bërthamë masive, në të cilën është e përqendruar e gjithë masa e atomit. Dhe rreth kësaj bërthame, si planetët rreth diellit, elektronet rrotullohen. Fig.1. Një elektron ka një masë 1832 herë më pak se një proton ose një neutron. Modeli i Niels Bohr u bazua në atë të mësuesit të tij Ernest Rutherford.
Niels Bohr sugjeroi që elektronet në një atom nuk lëvizin rastësisht, por lëvizin në orbita të caktuara. Ai postuloi, pra pranoi pa prova, dy propozime.
Postulatet e Niels Bohr.
1. Ka orbita në atom, në të cilat elektroni nuk rrezaton energji. Këto orbita quhen të palëvizshme.
2. Rrezatimi ndodh vetëm kur një elektron kërcen nga një orbitë e palëvizshme në tjetrën.
Sipas teorisë kuantike të strukturës atomike, të gjitha elektronet në një atom lëvizin përgjatë niveleve të energjisë ose orbitave. Këto nivele përbëhen nga nënnivele. Nga ana tjetër, nënnivelet përbëhen nga orbitale atomike. Një strukturë e tillë është e lehtë të imagjinohet nëse supozojmë se shtresa elektronike e një atomi është një shtëpi që qëndron në bërthamë. Shtëpia përbëhet nga shumë kate - nivele. Çdo nivel ka nënnivele - këto janë apartamente. Apartamentet kanë orbitale atomike, d.m.th. dhomat. Ne nuk mund të përcaktojmë vendndodhjen specifike të një elektroni në orbitale, por të përcaktojmë probabilitetin që ai të jetë në orbitalet atomike.
Nivelet.
Orbitat elektronike në modelin Bohr shënohen me numra të plotë: 1, 2, 3, 4, ... dhe kështu me radhë derisa n, ose me shkronja latine sipas alfabetit, duke filluar me shkronjën K, L, M, N, O P, Q. Duke filluar nga niveli më afër bërthamës. Në vijim, ne do t'i quajmë orbita të tilla - nivele.
Nënnivelet.

Oriz. 2. Format e orbitaleve atomike
Nivelet nga ana e tyre përbëhen nga nënnivele. Numri i nënniveleve në çdo nivel është i barabartë me numrin e nivelit. Nënnivelet kanë emra.
Nënniveli i parë i çdo niveli quhet S,
Nënniveli i dytë i çdo niveli quhet P,
Nënniveli i tretë i çdo niveli quhet d,
Nënniveli i katërt i çdo niveli quhet f
Orbitalet vijnë në forma të ndryshme.
Orbitalja s është sferike, orbitalja p ka formën e vëllimit tetë. d dhe orbitalet f janë edhe më komplekse. Fig 2.
Të gjitha këto shifra përshkruajnë rajonin e probabilitetit më të madh për të gjetur elektrone në një atom.
Modeli valor i një atomi nuk është një model fizik, por një model abstrakt ose matematik i strukturës së një atomi, rregullimi i elektroneve në të.
S - elementet.
Këta janë elementë që përmbajnë vetëm s-elektrone në nivelin e jashtëm.
Nëse këto janë p - elektrone, atëherë kjo është p - element.
Sa më larg të jetë niveli i energjisë nga bërthama, aq më shumë elektrone mund të strehojë, sepse çdo nivel energjie pasues ka një numër më të madh nënnivelesh. Pra, në çdo n nivel mund të ketë n 2 orbitale. Prandaj, elektronet mund të akomodojnë 2n 2 . Pse e shumëzuam n 2 me 2? Sepse nuk mund të ketë më shumë se 2 elektrone në çdo orbitale atomike.
Numri më i madh i elektroneve në çdo nivel është dhënë në Tabelën 1.

Oriz. 3. Diagrami orbital
Ne kemi nevojë për të gjithë këtë informacion në mënyrë që të mësojmë se si të vendosim elektronet në nivelet atomike, nënnivelet dhe orbitalet.
Ekziston një imazh i kushtëzuar i niveleve dhe nënnivele elektronike. Ky është një diagram orbital ose kuantik. Në një diagram të tillë, orbitalet përshkruhen në mënyrë konvencionale si katrorë, dhe elektronet si shigjeta. Oriz. 3. Nëse ka dy shigjeta në një qelizë, atëherë ato do të tregohen me shigjeta që tregojnë drejtime të ndryshme. Kjo veti e elektroneve quhet rrotullim.
Pasi të keni mbushur të gjitha orbitalet atomike me elektrone, duhet të shkruani "pasaportën elektronike" të elementit ose formulën e tij elektronike. Për ta bërë këtë, ju duhet të caktoni çdo nivel energjie me numrin 1, 2, 3, ..., nënnivelin me shkronjën s, p, d ...
Si fuqi, hiqni numrin e elektroneve në një nënnivel të caktuar.
Shembulli #1.

Oriz. 4. Formula elektronike e azotit
Shkruani formulën elektronike të elementit kimik me numrin atomik 7.
Një atom i një elementi të tillë duhet të ketë 7 elektrone. Le t'i mbushim orbitalet me elektrone, duke filluar nga 1-të e poshtme.

Oriz. 5. Diagrami i renditjes së elektroneve në një atom
Do të fitohet konfigurimi elektronik i mëposhtëm: 1s 2 2s 2 2p 3. Fig.4.
Pas kësaj, ju duhet të rregulloni vendndodhjen e elektroneve për sa i përket niveleve të energjisë. Për ta bërë këtë, ju duhet të përshkruani në mënyrë skematike bërthamën, të tregoni ngarkesën e saj dhe të përcaktoni numrin e niveleve të energjisë. Më lejoni t'ju kujtoj se azoti ka vetëm 2 prej tyre.Ne vizatojmë 2 harqe, dhe nën këto harqe shkruajmë numrin e elektroneve që ndodhen në to. Pastaj marrim një skemë të tillë të rregullimit elektronik në atom. Fig.5.
Shembulli #2.
Shkruani formulën elektronike të elementit kimik me numrin atomik 18.
Duke vepruar në të njëjtën mënyrë si në rastin e parë, ne do t'i rregullojmë elektronet në orbitale atomike. 1s 2 2s 2 2p 6 3s 2 3p 6 . Ky është elementi argon. Fig.6. Përkthyer nga greqishtja "joaktiv". E mori këtë emër sepse nuk ndërvepron me asnjë element kimik.
Elemente me një shtresë elektronike të jashtme të kompletuar.
Përfshihet në nëngrupin e gazeve fisnike ose inerte. Inertiteti i tyre shkaktohet nga struktura e atomit të tyre. Këto gaze kanë një shtresë të plotë energjie të jashtme - ns 2np 6. Gazrat inerte formojnë një molekulë monoatomike. Të gjithë gazrat e tjerë në natyrë kanë vetëm një molekulë diatomike. Për shembull, O 2, H 2. Arsyeja e stabilitetit të elementeve kimike me një shtresë elektronike të kompletuar nuk është ende e qartë. Por kimistët e marrin atë thjesht si një ligj të natyrës. Të gjithë elementët e tjerë do të tentojnë të plotësojnë guaskën e tyre të jashtme.
Do të jetë interesante të dihet pse nënnivelet e niveleve të caktuara emërtohen me shkronja të caktuara të alfabetit anglez. Çdo atom lëshon energji. Kjo energji mund të fiksohet në spektrat e emetimit të atomeve. Spektrat e ndryshëm të emetimit të atomeve kanë një formë të ndryshme. Linjat e tyre janë të ndryshme. Pra, vijat më të ngushta të mprehta quheshin shkronja s. Nga fjala angleze "top".
s- nënniveli i emërtuar sipas vijës "të mprehtë".
p- nënniveli është emëruar sipas linjës "principal".
d- nënniveli është emërtuar sipas linjës "difuz", "e paqartë" (difuze).
f- nënniveli emërtohet sipas linjës "themelore".


Për shkak të inertitetit të tyre kimik, gazrat fisnikë nuk ishin të njohur në kimi për një kohë të gjatë. Vetëm në 1892 u mor argoni i parë i gazit inert. Ajo u prit nga D. Rayleigh. Ai e mori atë gjatë eksperimenteve me azot. D. Rayleigh vuri re se nëse azoti merret nga ajri, atëherë ky gaz azotik do të ketë një masë më të madhe sesa nëse azoti fitohet në eksperimente të ndryshme kimike. Nëse nga ajri fitohet 1 litër azot, atëherë ai do të ketë një masë prej 1,2572 g, dhe nëse azoti fitohet nga zbërthimi i përbërjeve azotike, atëherë masa do të jetë 1,2505 g, nga vjen një ndryshim i tillë? Shumë shkencëtarë menduan se ata thjesht kryen një eksperiment dhe ndaluan së peshuari ajrin e marrë në këtë mënyrë. D. Rayleigh me mikun e tij W. Ramsay. Ata kryen shumë eksperimente dhe konfirmuan se gazi i azotit i marrë nga ajri përmban një gaz tjetër në përbërjen e tij, i cili ishte 20 herë më i rëndë se hidrogjeni. Kështu u izolua për herë të parë argoni. Deri në vitet 60 të shekullit XX, nuk u mor asnjë përbërje e vetme e gazrave inerte. Tani ata kanë mësuar se si të marrin artificialisht komponime të gazeve inerte me fluor dhe oksigjen. Nëse çmontoni një llambë të zakonshme inkandeshente, atëherë do të hasni gaz argon. Por ju nuk duhet ta bëni këtë, sepse mund të lëndoheni.
Duke përmbledhur mësimin.
Në këtë mësim, mësuat për predha elektronike të atomit, cilat janë modelet atomike të Bohr-it. Ju përsëritët strukturën e bërthamës atomike, duke konsideruar pikëpamjet moderne në studimin e predhave elektronike të atomit, imazhet e kushtëzuara të niveleve dhe nënniveleve elektronike. Konsideroni modelet atomike të Bohr-it. Mësimet e kimisë në klasën 11 do t'i shikojmë më në detaje.
1. Rudzitis G.E. Kimi inorganike dhe organike. Klasa 8: tekst shkollor për institucionet arsimore: niveli bazë / G. E. Rudzitis, F.G. Feldman. M.: Iluminizmi. 2011 176 fq.: ill.
2. Popel P.P. Kimi: Klasa e 8-të: një libër shkollor për institucionet arsimore të përgjithshme / P.P. Popel, L.S. Krivlya. -K.: IC "Akademia", 2008.-240 f.: ill.
3. Gabrielyan O.S. Kimia. Klasa 9 Libër mësuesi. Botues: Drofa.: 2001. 224s.
1. Nr 4-6 (f. 138) Rudzitis G.E. Kimi inorganike dhe organike. Klasa 8: tekst shkollor për institucionet arsimore: niveli bazë / G. E. Rudzitis, F.G. Feldman. M.: Iluminizmi. 2011 176 fq.: ill.
2. Në bazë të strukturës së atomeve, shpjegoni arsyen e periodicitetit të vetive të elementeve kimike.
3. Përgatitni një raport të shkurtër mbi historinë e zbulimit të gazeve inerte.






