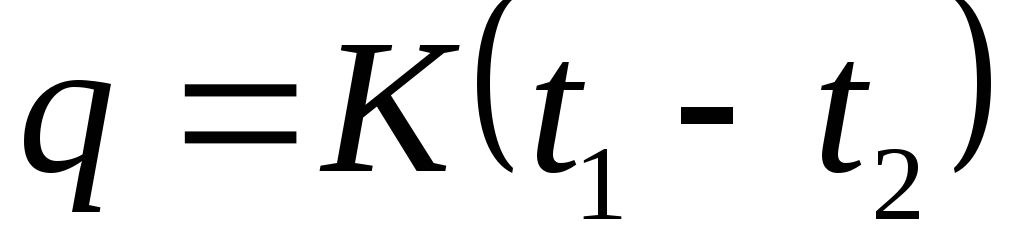Cili proces gazi ndodh me presion konstant. Kapaciteti i nxehtësisë. Proceset termodinamike me një gaz ideal
Vetitë themelore termodinamike të gazeve ideale
Në studimin e proceseve termodinamike përdoret ekuacioni i gjendjes
dhe shprehja matematikore e ligjit të parë të termodinamikës
Kur studiohen proceset termodinamike të gazeve ideale, në rastin e përgjithshëm, kërkohet të përcaktohet ekuacioni i kurbës së procesit në PV , PT , VT diagrami, vendosni një marrëdhënie midis parametrave termodinamikë dhe përcaktoni sasitë e mëposhtme:
− ndryshim energjia e brendshme trupi punues
![]()
(Formula është e vlefshme jo vetëm për V = konst, por edhe për çdo proces)
− të përcaktojë punën specifike të jashtme (termodinamike).
dhe punë specifike në dispozicion
është sasia e nxehtësisë e përfshirë në procesin termodinamik
Ku është kapaciteti termik i procesit
– ndryshimi i entalpisë në një proces termodinamik
(Formula është e vlefshme jo vetëm për fq = konst, por edhe në çdo proces)
- përqindja e nxehtësisë që shpenzohet për ndryshimin e energjisë së brendshme në këtë proces:
është proporcioni i nxehtësisë që shndërrohet në punë të dobishme në këtë proces
Në rastin e përgjithshëm, çdo dy nga tre parametrat termodinamikë ( P , V , T) mund të ndryshohet në mënyrë arbitrare. Për praktikë, proceset e mëposhtme janë me interes më të madh:
Proceset në vëllim konstant (V = konst) është izokorik.
Në presion të vazhdueshëm ( P = konst) është izobarike.
Në temperaturë konstante (T = konst) është izotermike.
Procesi dq =0 (rrjedhja pa shkëmbim nxehtësie të lëngut punues me mjedisin) është një proces adiabatik.
Një proces politropik, i cili, në kushte të caktuara, mund të konsiderohet si përgjithësues në lidhje me të gjitha proceset kryesore.
Në të ardhmen do të konsiderojmë ligjin e parë të termodinamikës dhe sasitë e përfshira në të, të lidhura me 1 kg masë.
Procesi me volum konstant
(procesi izokorik)
Një proces i tillë mund të kryhet nga një lëng pune, për shembull, i vendosur në një enë që nuk e ndryshon vëllimin e tij, nëse nxehtësia furnizohet me lëngun e punës nga një burim nxehtësie ose nxehtësia largohet nga lëngu i punës në frigorifer.
Në një proces izokorik V = konst dhe dV =0 . Ekuacioni i procesit izokorik përftohet nga ekuacioni i gjendjes në V = konst .
- Ligji i Charles (*)
Kjo është, në V = konst Presioni i gazit është proporcional me temperaturën absolute. Kur furnizohet nxehtësia, presioni rritet, dhe kur largohet nxehtësia, zvogëlohet.
Le të përshkruajmë procesin në V = konst në pV , pT dhe VT diagramet.


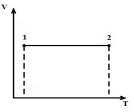
AT fq V - diagrami izokor 1-2 - vijë vertikale e drejtë paralele me boshtin fq . Në procesin 1-2, nxehtësia furnizohet me gazin, presioni rritet, dhe për këtë arsye, nga ekuacioni (*), temperatura rritet. Në procesin e kundërt 2-1, nxehtësia largohet nga gazi, si rezultat i së cilës energjia e brendshme e gazit zvogëlohet dhe temperatura e tij ulet, d.m.th. procesi 1-2 - ngrohje, 2-1 - ftohje me gaz.
AT fq T - diagrami izohor - vija të drejta që dalin nga origjina me një pjerrësi (faktori i proporcionalitetit)
Për më tepër, sa më i lartë të jetë niveli i volumit, aq më i ulët është izokori.
Në diagramin VT - izokore - vija të drejta paralele me boshtin T.
Puna e jashtme e gazit në procesin izokorik:
sepse
Puna specifike në dispozicion
![]()
Ndryshimi i energjisë së brendshme të një gazi në një proces izokorik, nëse
![]()
Nxehtësia specifike e furnizuar me lëngun e punës, në
![]()
Që në V = konst gazi nuk punon dl =0 ), atëherë ekuacioni i ligjit të parë të termodinamikës do të marrë formën:
![]()
Kjo është, në proces V = konst e gjithë nxehtësia e furnizuar në lëngun e punës shpenzohet në rritjen e energjisë së brendshme, domethënë në rritjen e temperaturës së gazit. Kur një gaz ftohet, energjia e tij e brendshme zvogëlohet nga sasia e nxehtësisë së hequr.
Përqindja e nxehtësisë së konsumuar për të ndryshuar energjinë e brendshme
Përqindja e nxehtësisë së shpenzuar për kryerjen e punës
Procesi me presion të vazhdueshëm
(procesi izobarik)
Një proces izobarik, për shembull, mund të zhvillohet në një cilindër nën një pistoni që lëviz pa fërkime në mënyrë që presioni në cilindër të mbetet konstant.
Me një proces izobarik fq = konst , dp =0
Ekuacioni i procesit izobarik fitohet kur fq = konst nga ekuacioni i gjendjes:
– Ligji Gay-Lussac (*)
Në proces në fq = konst Vëllimi i gazit është në proporcion me temperaturën, domethënë kur gazi zgjerohet, temperatura dhe si rrjedhojë energjia e brendshme rritet, dhe kur ngjeshet, zvogëlohet.
Le të përshkruajmë procesin në pV , pT , VT - diagramet.
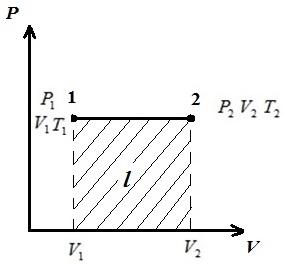

AT pV-diagrami i proceseve në fq = konst përshkruhen si vija të drejta paralele me boshtin V . Zona e drejtkëndëshit 12 jep, në shkallën e duhur, punën e gazit l. Në procesin 1-2, nxehtësia furnizohet me gazin ndërsa vëllimi specifik rritet, dhe kështu, sipas ekuacionit (*), temperatura rritet. Në procesin e kundërt 2-1, nxehtësia largohet nga gazi, si rezultat, energjia e brendshme dhe temperatura e gazit ulen, d.m.th. procesi 1-2 është ngrohja, dhe 2-1 është ftohja e gazit.
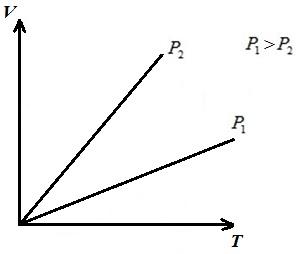
AT VT- diagrami izobar është një vijë e drejtë që del nga origjina e koordinatave, me një pjerrësi .
AT pT- diagrami izobar është një vijë e drejtë paralele me boshtin T .
Puna e një gazi në një proces izobarik ( fq = konst )
![]()
Që atëherë
Kjo do të thotë, nëse temperatura e gazit rritet, atëherë puna është pozitive.
Punë në dispozicion
sepse ,.
Ndryshimi i energjisë së brendshme të gazit, nëse
![]()
Sasia e nxehtësisë që i raportohet gazit kur nxehet (ose lëshohet prej tij kur ftohet), nëse
![]()
Domethënë, nxehtësia e furnizuar me lëngun e punës në procesin izobarik shkon për të rritur entalpinë e tij, d.m.th. në një proces izobarik është një diferencial total.
Ekuacioni i ligjit të parë të termodinamikës ka formën
![]()
Pjesa e nxehtësisë e konsumuar për të ndryshuar energjinë e brendshme në procesin izobarik,
![]()
ku k është indeksi adiabatik.
Përqindja e nxehtësisë së konsumuar për të kryer punën në fq = konst ,
![]()
Në MKT, n është numri i shkallëve të lirisë.
Për një gaz monoatomik n =3 dhe pastaj φ=0.6, ψ=0.4, domethënë, 40% e nxehtësisë që i jepet gazit shkon për të kryer punë të jashtme dhe 60% shkon për të ndryshuar energjinë e brendshme të trupit.
Për një gaz diatomik n =5 dhe pastaj φ=0.715, ψ=0.285, domethënë, ≈28.5% e nxehtësisë së furnizuar me gaz shkon për të kryer punë të jashtme dhe 71.5% shkon për të ndryshuar energjinë e brendshme.
Për një gaz triatomik n =6 dhe pastaj φ=0.75, ψ=0.25, pra 25% e nxehtësisë (motori me avull) shkon për të kryer punë të jashtme.
Përpunoni në temperaturë konstante
(procesi izotermik)
Një proces i tillë termodinamik mund të zhvillohet në cilindrin e një makine reciproke nëse, ndërsa nxehtësia furnizohet me lëngun e punës, pistoni i makinës lëviz, duke rritur vëllimin aq shumë sa temperatura e lëngut punues mbetet konstante.
Në procesi izotermik T = konst , dT =0.
Nga ekuacioni i gjendjes
− Ligji Boyle-Mariotte.
Prandaj, në një proces në temperaturë konstante, presioni i gazit është në përpjesëtim të zhdrejtë me vëllimin, d.m.th. Me zgjerimin izotermik, presioni bie, dhe me ngjeshje, rritet.
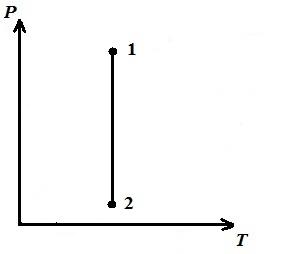
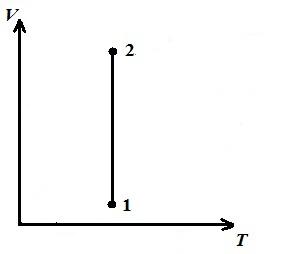
Ne përshkruajmë një proces izotermik në pV , pT , VT − diagramet.
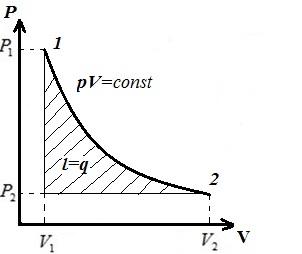
AT pV- diagrami - procesi izotermik përfaqësohet nga një hiperbolë barabrinjës, dhe sa më e lartë të jetë temperatura, aq më e lartë është izotermia.
AT pT − diagrami - izotermi - i drejtë, paralel me boshtin fq .
AT VT − diagrami - vija të drejta, paralele me boshtin V .
dT =0, pastaj
Kjo eshte U = konst , i = konst – Energjia e brendshme dhe entalpia nuk ndryshojnë.
Ekuacioni i ligjit të parë të termodinamikës merr formën ( T = konst)
Kjo do të thotë, e gjithë nxehtësia që i jepet gazit në procesin izotermik shpenzohet në punën e zgjerimit. Në procesin e kundërt, në procesin e ngjeshjes, nxehtësia largohet nga gazi e barabartë me punë e jashtme ngjeshja.
Punë specifike në një proces izotermik
Punë specifike e disponueshme
Nga dy ekuacionet e fundit rezulton se në një proces izotermik për një gaz ideal, puna e disponueshme është e barabartë me punën e procesit.
Nxehtësia e dhënë gazit në procesin 1-2,
Ligji 1 i termodinamikës
Nga kjo rezulton se kur T = konst l = l 0= q , ato. puna, puna e disponueshme dhe sasia e nxehtësisë së marrë nga sistemi janë të barabarta.
Sepse në një proces izotermik dT =0, q = l = ndonjë vlerë përfundimtare, pastaj nga
![]()
ne e marrim atë në procesin izotermik C =∞. Prandaj, për të përcaktuar sasinë e nxehtësisë që i jepet gazit në një proces izotermik, duke përdorur ngrohje specifike e pamundur.
Përqindja e nxehtësisë së konsumuar për të ndryshuar energjinë e brendshme në T = konst
dhe përqindja e nxehtësisë së shpenzuar për kryerjen e punës,
Proces pa shkëmbim nxehtësie me mjedisin
(procesi adiabatik)
Në një proces adiabatik, shkëmbimi i energjisë i lëngut punues me mjedisin ndodh vetëm në formën e punës. Lëngu i punës supozohet se është i izoluar termikisht nga mjedisi, d.m.th. nuk ka transferim të nxehtësisë midis tij dhe mjedisit;
q =0, dhe rrjedhimisht dq =0
Atëherë, ekuacioni i ligjit të parë të termodinamikës do të marrë formën
Kështu, ndryshimi në energjinë e brendshme dhe punën në një proces adiabatik janë të barasvlefshëm në madhësi dhe të kundërt në shenjë.
Prandaj, punoni procesi adiabatik zgjerimi ndodh për shkak të zvogëlimit të energjisë së brendshme të gazit dhe, rrjedhimisht, temperatura e gazit do të ulet. Puna e ngjeshjes adiabatike shkon tërësisht në rritjen e energjisë së brendshme, d.m.th. për të rritur temperaturën e saj.
Ne marrim ekuacionin adiabatik për një gaz ideal. Nga ligji i parë i termodinamikës
në dq =0 marrim ( du = CV dT )
Kapaciteti i nxehtësisë , ku
Diferencimi i ekuacionit të gjendjes pV = RT marrim
Zëvendësimi RdT nga tek (*)
ose duke e ndarë me pV ,
Duke u integruar në k = konst , marrim
![]()
Ekuacioni i fundit quhet ekuacioni Poisson dhe është ekuacioni adiabatik për .
Nga ekuacioni Poisson rezulton se
gjegjësisht gjatë zgjerimit adiabatik presioni zvogëlohet, kurse gjatë ngjeshjes rritet.
Ne përfaqësojmë procesin izokorik në pV , pT dhe VT - diagramet
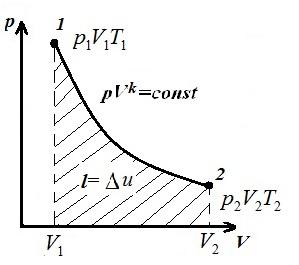
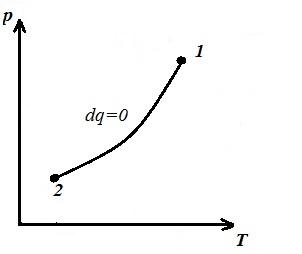
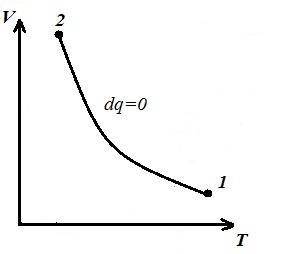
Sheshi V 1 12 V 2 nën adiabatik 1-2 në pV – diagrami jep punë l e barabartë me ndryshimin e energjisë së brendshme të gazit
Krahasimi i ekuacionit adiabatik me ligjin Boyle-Mariotte ( T = konst ) mund të konkludojmë se, pasi k >1, atëherë, kur zgjerohet përgjatë adiabatit, presioni bie më fort sesa përgjatë izotermës, d.m.th. në pV – diagrami adiabatik është më i madh se izotermi, d.m.th. adiabat është një hiperbolë e pabarabartë që nuk i pret boshtet koordinative.
Ne marrim ekuacionin adiabatik në pT dhe VT − diagramet. Në një proces adiabatik, të tre parametrat ndryshojnë ( fq , V , T ).
Ne marrim marrëdhëniet ndërmjet T dhe V . Ekuacionet e gjendjes për pikat 1 dhe 2
prej nga pjesëtimi i ekuacionit të dytë me të parin
Zëvendësimi i raportit të presionit nga ekuacioni adiabatik Poisson
ose TVk -1= konst është ekuacioni adiabatik në VT - grafiku.
Duke zëvendësuar në (*) (3) raportin e vëllimeve nga ekuacioni adiabatik (Poisson)
ose − ekuacioni adiabatik në pT - grafiku. Këto ekuacione merren me supozimin se k = konst .
Puna në një proces adiabatik në CV = konst
Duke marrë parasysh lidhjen ndërmjet temperaturës T dhe V
![]()
Duke marrë parasysh raportin ndërmjet T dhe fq

Ndryshimi në energjinë e brendshme u=- l.
Puna në dispozicion, duke pasur parasysh atë
![]() ,
,
Ato. punë në dispozicion në k herë më shumë punë e procesit adiabatik l .
φ dhe ψ nuk gjejmë.
Procesi politropik
Një proces politropik është çdo proces arbitrar që ndodh me një kapacitet të vazhdueshëm nxehtësie, d.m.th.
Atëherë, ekuacioni i ligjit të 1-rë të termodinamikës do të marrë formën
![]() (*)
(1)
(*)
(1)
Kështu, nëse C = konst dhe CV = konst , atëherë shpërndarja sasiore e nxehtësisë ndërmjet energjisë së brendshme dhe punës në një proces politropik mbetet konstante (për shembull, 1:2).
Përqindja e nxehtësisë së konsumuar për të ndryshuar energjinë e brendshme të lëngut të punës
![]()
Përqindja e nxehtësisë së shpenzuar për punë të jashtme,
![]()
Marrim ekuacionin e procesit politropik. Për ta bërë këtë, ne përdorim ekuacionin e ligjit të 1-të të termodinamikës (*)
Nga këtu, nga (*) dhe (**)
Pjestimi i ekuacionit të dytë (4) me të parën (3)
Prezantojmë një sasi të quajtur eksponent politropik. Pastaj,
Duke integruar këtë shprehje, marrim
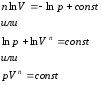
Ky ekuacion është ekuacioni politropik në pV − grafiku. Indeksi i Potlitropit n është konstante për një proces të caktuar dhe mund të ndryshojë nga -∞ në +∞.
Duke përdorur ekuacionin e gjendjes, mund të marrim ekuacionin politropik në VT dhe pT- diagramet.
Nga ![]() - ekuacioni politropik në VT -
grafiku.
- ekuacioni politropik në VT -
grafiku.
Nga ![]()
− ekuacioni politropik në pT - grafiku.
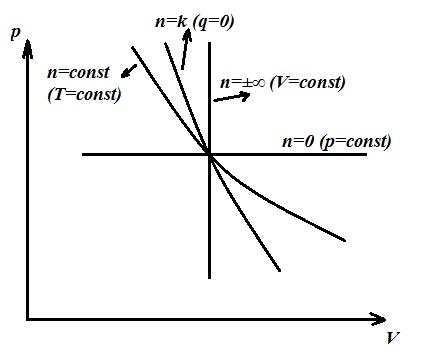
Procesi politropik është përgjithësues dhe proceset kryesore (izokorik, izotermik, adiabatik) janë raste të veçanta të procesit politropik, secili prej të cilëve ka vlerën e vet. n . Kështu, për çdo proces izokorik n =±∞, izobarike n =0, izotermike n =1, adiabatike n = k .
Meqenëse ekuacionet politropike dhe adiabatike janë të njëjta në formë dhe ndryshojnë vetëm në madhësi n(eksponent politropik në vend të k − eksponent adiabatik), mund të shkruajmë
funksionimi i procesit politropik
![]()
punë e disponueshme e një procesi politropik
Kapaciteti termik i gazit nga , prej nga
![]()
Për më tepër, në varësi të n kapaciteti termik i procesit mund të jetë pozitiv, negativ, i barabartë me zero dhe varion nga -∞ në +∞.
Në proceset C<0 всегда l> q ato. për të kryer punën e zgjerimit, përveç nxehtësisë së furnizuar, harxhohet një pjesë e energjisë së brendshme të gazit.
Ndryshimi në energjinë e brendshme të një procesi politropik
![]()
Nxehtësia që i jepet gazit në një proces politropik
![]()
Ndryshimi i entalpisë së lëngut të punës
![]()
Ligji i dytë i termodinamikës
Ligji i parë i termodinamikës karakterizon proceset e shndërrimit të energjisë nga pikëpamja sasiore, d.m.th. ai pretendon se nxehtësia mund të shndërrohet në punë, dhe puna në nxehtësi, pa vendosur kushtet në të cilat këto transformime janë të mundshme. Kështu, ajo vendos vetëm ekuivalencën e formave të ndryshme të energjisë.
Ligji i dytë i termodinamikës përcakton drejtimin dhe kushtet e procesit
Si ligji i parë i termodinamikës, ligji i dytë është nxjerrë nga të dhënat eksperimentale.
Përvoja tregon se shndërrimi i nxehtësisë në punë të dobishme mund të ndodhë vetëm kur nxehtësia kalon nga një trup i nxehtë në një të ftohtë, d.m.th. kur ka një ndryshim të temperaturës midis ftohësit dhe ftohësit. Është e mundur të ndryshohet drejtimi natyror i transferimit të nxehtësisë në të kundërtën vetëm në kurriz të kostos së punës (për shembull, në frigoriferë).
Sipas ligjit të 2-të të termodinamikës
Një proces është i pamundur në të cilin nxehtësia do të transferohej spontanisht nga trupat e ftohtë në trupat e nxehtë.
Jo e gjithë nxehtësia e marrë nga transferimi i nxehtësisë mund të hyjë në punë, por vetëm një pjesë e saj. Një pjesë e nxehtësisë duhet të shkojë në lavamanin e nxehtësisë.
Kështu, krijimi i një pajisjeje që, pa kompensim, do ta kthente plotësisht nxehtësinë e çdo burimi në punë dhe thirri makineri perpetual motion e llojit te dyte, e pamundur!
Procese të kthyeshme dhe të pakthyeshme
Për çdo sistem termodinamik, mund të imagjinohen dy gjendje, ndërmjet të cilave do të ndodhin dy procese (Fig. 1): njëri nga gjendja e parë në të dytin dhe tjetri anasjelltas, nga gjendja e dytë në të parën.
Procesi i parë quhet e drejtpërdrejtë procesi, dhe i dyti e kundërta.
Nëse një proces i drejtpërdrejtë pasohet nga një proces i kundërt dhe sistemi termodinamik kthehet në gjendjen e tij origjinale, atëherë procese të tilla konsiderohen të jenë e kthyeshme.
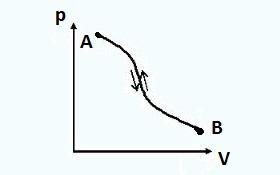
Në proceset e kthyeshme, sistemi në procesin e kundërt kalon nëpër të njëjtat gjendje ekuilibri si në procesin e drejtpërdrejtë. Në këtë rast, as në mjedis dhe as në vetë sistem nuk ka efekte të mbetura (nuk ka ndryshim në parametra, punë të kryer etj.). Përmes një procesi të drejtpërdrejtë AB , dhe pastaj mbrapsht BA gjendja përfundimtare e sistemit do të jetë identike me gjendjen fillestare.
Figura tregon një konfigurim të procesit mekanikisht të kthyeshëm. Instalimi përbëhet nga cilindri 1, pistoni 2 me tavolinë 3 dhe rërë mbi të. Nën piston, cilindri përmban gaz, i cili është nën presionin e rërës në tryezë.
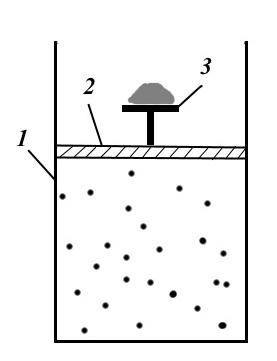
Për të krijuar një proces të kthyeshëm, është e nevojshme të hiqni pafundësisht ngadalë një kokërr rërë pas tjetrës. Atëherë procesi do të jetë izotermik, dhe presioni do të jetë i barabartë me presionin e jashtëm, dhe sistemi do të jetë vazhdimisht në një gjendje ekuilibri. Nëse procesi kryhet në drejtim të kundërt, d.m.th. pafundësisht ngadalë hidhni kokrra rëre në tabelën 3, atëherë sistemi do të kalojë në mënyrë sekuenciale nëpër të njëjtat gjendje ekuilibri dhe do të kthehet në gjendjen e tij origjinale (nëse nuk ka fërkim).
Kur zgjerohet, trupi i punës në një proces të kthyeshëm prodhon punë maksimale.
Pjesa e shkurtër teorike
Raporti i nxehtësisë δq të marrë nga një njësi sasie e një lënde me ndryshimin e temperaturës dt quhet nxehtësi specifike.
(1.1)Meqenëse sasia e nxehtësisë δq varet nga natyra e procesit, kapaciteti termik i sistemit CX varet gjithashtu nga kushtet e procesit.
Kapaciteti i nxehtësisë, në varësi të sasisë së substancës, mund të jetë në masë - C, vëllimor - C "dhe molar μC. Marrëdhënia midis tyre:
Kuptimi fizik i kapaciteteve të nxehtësisë së një substance ideale në V = konst dhe P = konst rrjedh nga shqyrtimi i marrëdhënieve termodinamike diferenciale të formës:
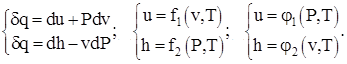 (1.3)
(1.3)
Pas transformimeve të duhura, duke marrë parasysh vetitë e një gazi ideal, marrim:
(1.4)Kjo tregon se ndryshimet në energjinë e brendshme dhe entalpinë përkufizohen si:
(1.5)ato. pavarësisht nga natyra e procesit.
Marrëdhëniet midis CP dhe CV:
Në përputhje me teorinë kinetike molekulare të gazeve, kapaciteti molar i nxehtësisë në V = Const është në përpjesëtim me numrin e shkallëve të lirisë së tyre, të shprehur në ekuivalentin xhaul, dhe për një mol gaz është μСV = 3 × 4,19 = 12,5 J/ (mol×K). Pastaj, në përputhje me ligjin e Mayer-it, μСP = 5 × 4,19 = 20,8 J / (mol × K), i cili lejon, në varësi të atomicitetit të gazit dhe shkallëve të tyre të lirisë, të përfaqësojë vlerat e kapaciteteve molare të nxehtësisë në formën e mëposhtme:
Tabela nr. 1.1.
Kapaciteti i nxehtësisë i përcaktuar nga ekuacioni (4.1) për parametrat e gjendjes së dhënë (P, v, T) quhet i vërtetë dhe mund të shprehet si:
CX = CX0 + ΔCX, (1.7)
ku СX0 është kapaciteti i nxehtësisë së gazit në gjendje të shkarkuar (në P "0) dhe varet vetëm nga temperatura, dhe ΔСX përcakton varësinë e kapacitetit të nxehtësisë nga presioni dhe vëllimi.
Kapaciteti mesatar i nxehtësisë CXm në intervalin e temperaturës nga T1 në T2 shprehet si:
 (1.8)
(1.8)
Nëse pranojmë që një nga kufijtë, për shembull T1 = 273,15 K, atëherë mund të llogarisim kapacitetet mesatare të nxehtësisë së gazeve në intervalin e temperaturës nga t1 = 0 °C deri në t2 = x °C dhe t'i paraqesim vlerat e tyre në formë tabelare. formulari, shih Shtojcën, tabelat Nr. 2 - Nr. 4.
Sasia e nxehtësisë së transferuar në sistem sipas ekuacionit (4.8) dhe duke përdorur të dhënat e kapacitetit të nxehtësisë, tabelat Nr. 2 - Nr. 4, duke marrë parasysh (4.2), në varësi të procesit, llogaritet me formulat:
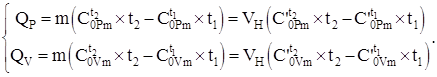 (1.9)
(1.9)
Për llogaritjet e përafërta të sasisë së nxehtësisë në jo shumë temperaturat e larta mund të marrim C = Const dhe më pas ekuacionet (1.14) duke marrë parasysh (1.2) - (1.4) dhe vlerat e tabelës nr. 4.1. do të duket si:
 (1.15)
(1.15)
Detyra numër 1-1. Ajri që ka një vëllim V = 15 m3 në një temperaturë t1 = 1500 °C dhe një presion P = 760 mmHg ftohet në mënyrë izobare në një temperaturë t2 = 250 °C. Përcaktoni nxehtësinë e hequr QP nëse: a) merrni parasysh kapacitetin e nxehtësisë konstante, b) përdorni formulën μСP = 6,949 + + 0,000576×t.
Detyra numër 1-2. Rrjedha e ajrit matet duke përdorur një ngrohës elektrik të instaluar në kanalin e ajrit. Temperatura e ajrit para dhe pas ngrohësit matet duke përdorur dy termometra. Përcaktoni rrjedhën e ajrit në orë G kg / orë, nëse, kur ngrohësi elektrik me fuqi 0,75 kW është i ndezur, temperatura e ajrit përpara ngrohësit T1 \u003d 288 K, dhe prapa ngrohësit T2 \u003d 291,1 K. Përcaktoni gjithashtu shkallën e rrjedhës së ajrit pas ngrohësit, nëse presioni i tij është (pranuar nga ne i pandryshuar) P = 870 mmHg, dhe diametri i kanalit të ajrit d = 90 mm.
Detyra numër 1-3. Si rezultat i djegies së plotë të karbonit në një atmosferë me oksigjen të pastër, në enë u formua dioksidi i karbonit CO2 me një presion prej P = 6,04 bar dhe një temperaturë prej T1 = 1673 K. Sa nxehtësi do të lirohet kur CO2 ftohet në një temperaturë prej T2 = 293 K. Përcaktoni gjithashtu se çfarë presioni do të vendoset në të njëjtën kohë në enë dhe çfarë presioni kishte oksigjeni në enë para djegies, nëse temperatura e tij ishte 10 ° C. Vëllimi i enës merret i pandryshuar dhe i barabartë me 5 litra.
Detyra numër 1-4. Gjeni sasinë e nxehtësisë që kërkohet për të ngrohur 1 Nm3 të një përzierje gazi me përbërje τ(CO2) = 14,5%; τ(O2) = 6,5%; τ(N2) = 79,0% nga 200 në 1200 °C në P = Konst dhe varësia jolineare e kapacitetit të nxehtësisë nga temperatura.
Shembull. Ajri në sasi prej 6 m3 në presion P1 = 3 bar dhe temperaturë t1 = 25 °C nxehet në procesin P = Const në t2 = 130 °C. Përcaktoni sasinë e nxehtësisë së furnizuar, duke marrë parasysh C \u003d Const dhe C \u003d f (T).
QP \u003d m × CP × (t2 - t1) \u003d VH × C "P × (t2 - t1);
QP \u003d m × (CPm × t2 - CPm × t1) \u003d VH × (C "Pm × t2 - C" Pm × t1).
m = (P1 × V1 × µ) / (R × T1) = (3 × 105 × 6 × 2,896 × 10–2) / (8,314 × 298,15) = 21,03 kg.
VН = (Р1 × V1 × TN) / (РН × T1) = (3 × 105 × 6 × 273,15) / (101325 Pa × 298,15) = 16,28 nm3.
QP = 21,03 × (29,33/2,896 × 10–2) × (130 – 25) = 16,28 × (29,33/2,24 × 10–2) × (130 – 25) = 2236, 4 kJ.
QP = 21,03 kg × (1,0079 × 130 - 1,0042 × 25) = 16,28 × (1,3026 × 130 - 1,298 × 25) = 2227,5 kJ.
Mospërputhje 0.40%.
Detyra numër 1-5. Një enë e mbyllur me kapacitet V = 0,5 m5 përmban dioksid karboni në P = 6 bar dhe T = 800 K. Si do të ndryshojë presioni i gazit nëse i zbriten 100 kcal? Pranojeni varësinë C = f(T) si lineare.
Detyra numër 1-6. Një enë me kapacitet 90 litra përmban ajër me presion 8 bar dhe temperaturë 303 K. Përcaktoni sasinë e nxehtësisë që duhet t'i jepet ajrit për të rritur presionin e tij në V = Const në 16 bar. Pranojeni varësinë C = f(T) si jolineare. Jepni përgjigjen tuaj në kcal.
Detyra numër 1-7. Çfarë sasie nxehtësie duhet shpenzuar për të ngrohur 2 m3 ajër me një mbipresion konstant PM = 2 bar nga t1 = 100 °C në t2 = 500 °C? sa punë bëhet nga ajri? Presioni i ajrit në barometër merret i barabartë me 760 mmHg.
Detyra numër 1-8. Nën ngrohjen izobarike nga T1 = 313 K në T2 = 1023 K, një gaz homogjen funksionon l = 184 kJ/kg. Përcaktoni se çfarë lloj gazi është, sa nxehtësi i komunikohet dhe si ka ndryshuar presioni i tij në këtë rast.
Detyra numër 1-9. Në procesin e furnizimit me nxehtësi me presion konstant, temperatura prej 0,9 nm3 azoti rritet nga T1 = 288 K në T2 = 1873 K. Përcaktoni ndryshimet në entalpinë e azotit dhe përqindjen e nxehtësisë së shpenzuar për rritjen e energjisë së brendshme.
Detyra numër 1-10. Cilindri me piston të lëvizshëm përmban oksigjen në sasinë VH = 0,3 nm3 në T1 = 318 K dhe P1 = 776 mmHg. Një sasi e caktuar nxehtësie i jepet oksigjenit në P = Const, dhe më pas ftohet në temperaturën fillestare (318 K) në V = Const. Përcaktoni sasinë e futjes së nxehtësisë, ndryshimin e entalpisë, energjinë e brendshme dhe punën e bërë për të dy proceset nëse dihet se në fund të ftohjes izokorik presioni i oksigjenit P3 = 0,588 bar. Vizatoni gjendjet e gazit në koordinatat P-V dhe T-S.
Proceset termodinamike me një gaz ideal.
Pjesa e shkurtër teorike
Nën procesin termodinamik kuptohet ndërveprimi i mjetit me mjedisin, si rezultat i të cilit mjeti kalon nga një gjendje e caktuar fillestare në një gjendje të caktuar përfundimtare.
Nëse mjeti në të cilin po zhvillohet procesi mund të kthehet në gjendjen fillestare në mënyrë që gjatë mjedisi i jashtëm nuk ndodh asnjë ndryshim, procesi thuhet se është i kthyeshëm. Nëse gjendja fillestare e automjetit pa ndryshime në mjedisin e jashtëm është e pakthyeshme, atëherë procesi quhet i pakthyeshëm.
Vetëm proceset e kthyeshme mund të përshkruhen grafikisht në diagramet e gjendjes, pasi në to secila pikë përfaqëson një gjendje ekuilibri.
Parimi i ruajtjes së energjisë, i formuluar nga ligji i parë i termodinamikës (formula (2.1) - (2.3)), përfundimisht çon në një bilanc energjetik që lidh ndryshimin e rezervës së energjisë së TS (energjia e brendshme) me energjinë që kalon kufijtë e sistemit kur procesi përfundon në formën e punës ose ngrohjes .
Një grup procesesh që, në kushte të caktuara, përgjithësohen për të gjitha proceset dhe karakterizohen nga një kapacitet termik konstant quhet politropik.
Për të gjitha proceset, vendoset një metodë e përgjithshme kërkimore, e cila është si më poshtë:
nxirret ekuacioni i procesit;
vendos marrëdhënien midis parametrave kryesorë të gjendjes së automjetit;
përcaktohet kapaciteti termik i procesit;
· Përcaktohen ndryshimet e funksioneve të gjendjes: energjia e brendshme, entalpia, entropia;
llogariten funksionet e procesit: nxehtësia dhe puna;
· jepet një interpretim grafik i proceseve termodinamike në koordinatat P – V dhe T – S.
Proceset e konsideruara konsiderohen të kthyeshme.
Raportet kryesore sipas pikave 1 - 5 jepen në tabelat nr. 2.1 - nr. 2.3.
Tabela nr. 2.1
Tabela nr 2.2
Tabela nr 2.3
Kapaciteti i nxehtësisë në një proces politropik është:
Figura më poshtë tregon proceset politropike në koordinatat P-V dhe T-S.

Shembull. Ajri me vëllim V = 0,01 m3, në P1 = 10 bar dhe T1 = 298 K, zgjerohet në një cilindër me një piston të lëvizshëm në një presion P2 = 1 bar. Përcaktoni vëllimin përfundimtar, temperaturën, punën e zgjerimit, hyrjen e nxehtësisë, ndryshimin e energjisë së brendshme, entalpinë dhe entropinë nëse zgjerimi ndodh: 1. në mënyrë izotermale; 2. adiabatikisht; 3. politropik me indeks politropik n = 1.3. Paraqisni procesin në koordinatat P - V dhe T - S.
Zgjerimi izotermik.
Vëllimi në fund të zgjerimit:
V2 = V1 × (P1/P2) = 0,01 × (10/1) = 0,1 m3.
Puna e zgjerimit:
L = P1 × V1 × ln(P1/P2) = 106 × 0,01 × ln(10/1) = 23 kJ.
QT = L = 23 kJ.
Meqenëse T1 = T2 = 298 K, atëherë Δh = 0 dhe Δu = 0.
Ndryshimi i entropisë:
ΔS \u003d Q / T \u003d 23/298 \u003d 0,07718 kJ / K.
zgjerim adiabatik.
Masa e gazit në cilindër:
m = (P1 × V1 × μ) / R × T1 = (106 × 0,01 × 2,896 × 10–2) / (8,314 × 298 K) = 0,117 kg.
Vëllimi përfundimtar:
V2 = V1 × (P1/P2) 1/k = 0,01 × (10/1) 1/1,4 = 0,0518 m3.
Temperatura e ajrit në fund të procesit:
T2 = T1 × (P2/P1) (k – 1) /k = 298 × (1/10) (1,4 – 1) /1,4 = 154,35 K.
Puna e gazit gjatë zgjerimit:
L \u003d (P1 × V1 - P2 × V2) / (k - 1) \u003d (106 × 0,01 - 105 × 0,0518) / (1,4 - 1) \u003d 12 kJ.
Entalpia:
Δh \u003d CP × (T2 - T1) \u003d 1,0189 × (154,35 - 298) \u003d - 146,36 kJ / kg;
ΔH \u003d m × Δh \u003d 0,117 × (- 146,36) \u003d - 17,12 kJ.
Energjia e brendshme:
Δu \u003d CV × (T2 - T1) \u003d 0,7317 × (154,35 - 298) \u003d - 105,11 kJ / kg;
ΔU \u003d m × Δu \u003d 0,117 × (- 105,11) \u003d - 12,30 kJ.
Kur përcaktojmë ndryshimin e funksioneve të gjendjes, për shkak të një ndryshimi të rëndësishëm të temperaturës në proces (298 - 154,35 = 146,65 K), ne përdorim varësinë e kapacitetit të nxehtësisë nga temperatura C = f (T) (shih tabelën nr. 3 të Shtojca).
Zgjerim politropik me n = 1.3.
Vëllimi përfundimtar:
V2 = V1 × (P1/P2) 1/n = 0,01 × (10/1) 1/1,3 = 0,0588 m3.
Temperatura përfundimtare:
T2 = T1 × (V1/V2) n – 1 = 298 × (0,01/0,0588) 1,3 – 1 = 175,15 K.
Puna e gazit gjatë zgjerimit:
L \u003d (P1 × V1 - P2 × V2) / (n - 1) \u003d (106 × 0,01 - 105 × 0,0588) / (1,3 - 1) \u003d 13,7 kJ.
Sasia e nxehtësisë së dhënë:
qP = CV × [(n – k) /(n – 1)] × (T2 – T1) = 0,7317 × [(1,3 – 1,4) /(1,3 – 1)] × (175 ,15 – – 298) = 29,96 kJ/kg;
QP = m × qP = 0,117 × 29,96 = 3,51 kJ.
Ndryshimi në proces ishte:
Entalpia:
Δh \u003d CP × (T2 - T1) \u003d 1,0189 × (175,15 - 298) \u003d - 125,17 kJ / kg;
ΔH = m × Δh = 0,117 × (–125,17) = – 14,64 kJ.
Energjia e brendshme:
Δu \u003d CV × (T2 - T1) \u003d 0,7317 × (175,15 - 298) \u003d - 89,89 kJ / kg;
ΔU = m × Δu = 0,117 × (–89,89) = – 10,52 kJ.
Detyrat për zgjidhje të pavarur.
Detyra numër 2-1. Në një dhomë të mbyllur me vëllim V = 25 m3, ka ajër me presion P1 = 730 mmHg dhe temperaturë T1 = 283 K. Si rezultat i furnizimit me nxehtësi, presioni u rrit në P2 = 2,3 bar. Përcaktoni sasinë e nxehtësisë së furnizuar QV, ndryshimin në energjinë e brendshme ΔU dhe entalpinë ΔH.
Detyra numër 2-2.6. kg azot kryejnë punë LP = 343 kJ në procesin e zgjerimit izobarik. Përcaktoni ndryshimet në energjinë e brendshme të azotit, nëse temperatura e fillimitështë e barabartë me T1 = 373 K.
Detyra numër 2-3. Monoksidi i karbonit është në një presion të tepërt prej PM = 3,92 bar dhe zë një vëllim prej V = 5 m3, ndërsa presioni barometrik është i barabartë me RB = 755 mmHg. Përcaktoni ndryshimin në energjinë e brendshme dhe sasinë e punës së shpenzuar nëse monoksidi i karbonit ftohet në mënyrë izobare nga T1 = 573 K në T2 = 373 K.
Detyra numër 2-4. Si do të ndryshojë energjia e brendshme dhe entalpia e 20 nm3 oksigjen gjatë ngrohjes izobarike nga 373 K në 1173 K nëse presioni P = 9,8 bar. Cila është puna që bën gazi?
Detyra nr. 2-5.0.6 nm3 ajër me furnizim izobarik me nxehtësi funksionon LP = 15.68 kJ. Përcaktoni temperaturën T2 dhe vëllimin e ajrit V, nëse në gjendjen fillestare temperatura dhe presioni i tij ishin, përkatësisht, P1 = 4,42 bar dhe T1 = 293 K.
Detyra numër 2-6. Oksigjeni në një temperaturë T1 = 353 K dhe një presion PB të barabartë me 320 mmHg është i ngjeshur në T = Const në një mbipresion PM = 12 bar. Sa herë zvogëlohet vëllimi i oksigjenit nëse presioni barometrik РБ = 745 mmHg?
Detyra numër 2-7. 10 kg oksigjen zgjerohen në T = 423 K = Konstacion nga presioni fillestar Р1 = 14,7 bar dhe prodhojnë punë LT = 2969,4 kJ. Përcaktoni presionin në fund të zgjerimit dhe përshkruani procesin në koordinatat P - V dhe T - S.
Detyra numër 2-8. Një cilindër me piston të lëvizshëm përmban 3,5 m3 azot me presion P1 = 1,47 bar. Gjatë kompresimit izotermik largohen 461 kJ nxehtësi. Përcaktoni presionin P2 dhe vëllimin V2 të azotit në fund të ngjeshjes.
Detyra numër 2-9. 0,4 kg ajër në T1 = 573 K dhe P1 = 1,98 bar zgjerohet në mënyrë izotermale në V2 = 1,68 m3/kg, dhe më pas kompresohet në mënyrë izobare dhe, në fund, me ngrohje izokorike, kthehet sërish në gjendjen e tij origjinale. Përcaktoni për çdo proces ΔH, ΔS, ΔU, si dhe nxehtësinë dhe punën L. Përcaktoni gjithashtu parametrat (P, v, T) për të gjitha pikat dhe përshkruani proceset në koordinatat P - V dhe T - S.
Detyra numër 2-10. 0,3 Nm3 ajër është i ngjeshur në mënyrë izotermale nga gjendja fillestare P1 = 7,35 bar, T1 = 573K në një gjendje përfundimtare P2, V2. Përcaktoni vlerat e P2 dhe V2 nëse dihet se 167.6 kJ nxehtësi është hequr gjatë kompresimit izotermik. Përcaktoni gjithashtu ndryshimin në energjinë e brendshme dhe entalpinë e ajrit.
Detyra numër 2-11. 1. Nm3 e ajrit zgjerohet në mënyrë adiabatike nga gjendja fillestare 1 (P1 = 6 atm, t1 = 300 °C) në gjendjen ku V2 = 3V3; atëherë ngjeshet në mënyrë izotermale në vlerën fillestare të vëllimit specifik V3 = V1. Përcaktoni parametrat (P, v, T) të pikave 1, 2 dhe 3 dhe punën totale të bërë nga gazi. Paraqisni procesin në koordinatat P - V dhe T - S.
Detyra numër 2-12. Puna e shpenzuar në ngjeshjen adiabatike të 3 kg ajër është (- 471) kJ. Gjendja fillestare e ajrit karakterizohet nga parametrat T1 = 288 K dhe P1 = 1 bar. Përcaktoni temperaturën përfundimtare dhe ndryshimin e energjisë së brendshme.
Detyra numër 2-13. 1. kg ajër në presion P1 = 4 bar dhe temperaturë T1 = 373 K zgjerohet në presion P2 = 1 bar. Përcaktoni temperaturën përfundimtare, sasinë e nxehtësisë dhe punën e bërë nëse zgjerimi ndodh: a) në mënyrë izokorike, b) në mënyrë izotermike, c) në mënyrë adiabatike dhe d) në mënyrë politropike me eksponent n = 1.2. Paraqisni procesin në koordinatat P - V dhe T - S.
Problemi #2-14. Një cilindër me kapacitet 100 litra përmban ajër me presion P1 = 50 bar dhe temperaturë T1 = 293 K. Presioni i ambientit është P2 = 1 bar. Përcaktoni punën e dobishme që mund të bëhet nga ajri kur ai zgjerohet në presionin e ambientit përgjatë izotermës dhe adiabatik, si dhe temperaturën përfundimtare të ajrit në balon pas zgjerimit adiabatik.
Detyra numër 2-15. 1 kg ajër në një temperaturë T1 = 290 K ngjeshet në mënyrë adiabatike në një vëllim që është 1/5 e vëllimit fillestar dhe më pas zgjerohet në mënyrë izotermale deri në vëllimin fillestar. Përcaktoni punën e bërë nga ajri si rezultat i të dy proceseve. Paraqisni procesin në koordinatat P - V dhe T - S.
Problemi #2-16. Me zgjerimin politropik prej 1 kilomole gaz, vëllimi i tij u rrit me 20%, dhe temperaturë absoluteështë ulur me 12%. Përcaktoni indeksin politropik, vlerën e punës lP kJ/mol, nëse T1 = 490 K.
Problemi #2-17. 50 kJ/kg nxehtësi i jepet 1 kg ajër gjatë ngjeshjes së tij në procesin politropik. Përcaktoni indeksin politropik, ndryshimin e energjisë së brendshme dhe punën e ngjeshjes nëse temperatura e ajrit u rrit me 100 K gjatë procesit.
Problemi numër 2-18. 1 kg azot në gjendjen fillestare ka parametra P1 = 25 bar dhe T1 = 973 K. Pas zgjerimit politropik (n = 1,18), presioni i azotit bëhet i barabartë me P2 = 105 N/m2. Përcaktoni ΔU, ΔΝ në proces, si dhe sasinë e nxehtësisë qP dhe punën e zgjerimit lP.
1. Një proces që ndodh në një vëllim konstant quhet ___ izokorik ________
2. Një proces që ndodh me presion konstant quhet ___ izobarik ______
3. Një proces që zhvillohet në një temperaturë konstante quhet ___ izotermale ___
4. Një proces që vazhdon pa shkëmbim nxehtësie me mjedisin e jashtëm quhet _________________adiabatik __________________________
5. Një proces termodinamik gjeneralizues, në të cilin proporcioni i nxehtësisë së përdorur për të ndryshuar energjinë e brendshme të sistemit mbetet konstant, quhet _________politropik______________
6. Sasia e nxehtësisë që duhet t'i komunikohet një trupi për të ndryshuar temperaturën e tij me një kelvin ose gradë Celsius quhet ____ kapaciteti i nxehtësisë _______
7. Për një cikël të motorit me ngrohje, raporti i punës së bërë për cikël ndaj sasisë së nxehtësisë është ______ efikasiteti i ciklit ______
8. Sasia e nxehtësisë e nevojshme për të kthyer 1 kg lëng të nxehtë në pikën e vlimit me presion konstant në avull të thatë të ngopur quhet ________________ nxehtësia e avullimit ____________
9. Mënyra molekulare e transferimit të nxehtësisë në një mjedis të vazhdueshëm në prani të një gradienti të temperaturës quhet ____________ përçueshmëri termike ________________________________
10. Transferimi i nxehtësisë, i kryer nga veprimi i kombinuar i përcjelljes së nxehtësisë dhe konvekcionit, quhet ____________ transferim konvektiv i nxehtësisë ______________________
11. Sasia e nxehtësisë e transferuar nëpër çdo sipërfaqe për njësi të kohës quhet ____________ fluksi i nxehtësisë __________
12. Fluksi i nxehtësisë për njësi sipërfaqeje të sipërfaqes nëpër të cilën kalon quhet _____ fluksi i nxehtësisë_densiteti _________________________
13. Parametrat e gjendjes së një sistemi termodinamik janë
15. Një sistem që mund të shkëmbejë me mjedisin dhe materien dhe energjinë quhet
|
1) hapur |
3) adiabatike |
|
2) e mbyllur |
4) e mbyllur |
16. Një sistem që mund të shkëmbejë energji por jo lëndë me mjedisin quhet
18. Ekuacioni i gjendjes për një sasi arbitrare të gazit ideal ka formën
Emërtimet e mëposhtme pranohen në opsionet e përgjigjes:
p - presion
v- vëllim specifik
m është masa e gazit
T - temperatura termodinamike
t- temperatura në Celsius
M është numri i kilomoleve të gazit
R- konstante e gazit
Konstante universale e gazit
19. Transformimi i ndërsjellë ndodh në sistemet termomekanike
20. Një proces pa shkëmbim nxehtësie me mjedisin quhet
21. Një proces që zhvillohet në temperaturë konstante quhet
|
1) izokorik |
4) adiabatike |
|
2) izobarike |
5) isentropike |
|
3) izotermike |
22. Një proces që zhvillohet në një vëllim konstant quhet
24. Faktori që ka ndikimin më të madh në kapacitetin termik specifik të një gazi është
25. Karburanti i kushtëzuar quhet
1) karburanti më i përshtatshëm për kushte specifike të përdorimit
2) qymyr me cilësi të mesme
3) karburant me një vlerë kalorifike më të ulët prej 29.31 MJ / kg
4) karburant me vlerë kalorifike më të ulët 35.0 MJ/kg
26. Shifrat tregojnë diagramet e instalimit
1) a) fuqia me avull; b) turbinë me gaz; c) ftohje me kompresor avulli
2) a) ftohje me kompresor avulli; b) turbinë me gaz; c) fuqia me avull
3) a) ftohje përthithëse; b) turbinë me gaz; c) fuqia me avull
4) a) turbinë me gaz; b) ftohje me kompresor avulli; c) fuqia me avull
27. Një pompë nxehtësie është
1) një makinë ftohëse që përdoret për qëllime të furnizimit me ngrohje (ngrohje).
2) një pompë e çdo dizajni që përdoret për pompimin e lëngut
ftohës
3) një pajisje për transferimin e nxehtësisë nga një burim "i nxehtë" në një "të ftohtë".
4) një pajisje për pompimin e temperaturës nga një burim nxehtësie në
28. Dendësia e fluksit të nxehtësisë gjatë transferimit të nxehtësisë llogaritet me formulën
|
1)
|
3)
|
|
2)
|
4)
|
Shënimet e mëposhtme përdoren në opsionet e përgjigjeve të dhëna:
 -koeficienti i përçueshmërisë termike
-koeficienti i përçueshmërisë termike
 -koeficienti i transferimit të nxehtësisë
-koeficienti i transferimit të nxehtësisë
 - koeficienti i transferimit të nxehtësisë
- koeficienti i transferimit të nxehtësisë
 - trashësi muri
- trashësi muri
 dhe
dhe  – temperatura e bartësve të nxehtësisë
– temperatura e bartësve të nxehtësisë
 dhe
dhe  janë temperaturat e sipërfaqeve të murit
janë temperaturat e sipërfaqeve të murit
|
Përputhni përgjigjet |
29. Në ciklin Otto të treguar në diagrame
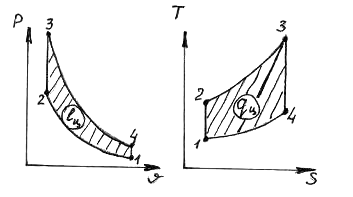
proceset e shënimeve
1) 1-2 A) furnizimi me nxehtësi izokorik
2) 2-3 B) furnizimi me nxehtësi izobarike
3) 3-4 V) largimi i nxehtësisë izokorik
4) 4-1 D) heqja e nxehtësisë izobarike
D) furnizimi izotermik me nxehtësi
E) heqja e nxehtësisë izotermike
G) zgjerim adiabatik
H) ngjeshje adiabatike
1.__z___; 2.__a___; 3.__f___; 4.__në___