Cilat substanca kanë një pikë shkrirjeje konstante. Shkrirja
ESE
"Trupat që shkrihen"
E kryer:
Prisyazhnyuk Olga 9-A
Kontrolluar:
Nevzorova Tatyana Igorevna
Prezantimi
1) Llogaritja e sasisë së nxehtësisë
2) Shkrirja
3) Nxehtësia specifike e shkrirjes
4) Shkrirja e metaleve
5) Pika e shkrirjes dhe pika e vlimit të ujit
6) Shkrihet
7) Interesante për shkrirjen
Përdorimi i njohurive në kontekste të tjera, kushte të lidhura
Vetitë e materies dhe veçanërisht të ujit luajnë një rol në shumë dukuri. Këtu, për shembull, duhet përmendur cikli meteorologjik i ujit dhe avullimi i organizmave të gjallë. Ajsbergët përbëhen nga uji i pastër, prandaj konsiderohen si burime të ujit të pijshëm. Por edhe prodhimi ujë të freskët nga uji i kripur në dete është teorikisht dhe teknikisht jo një vështirësi dhe është një procedurë e aplikuar shpesh në vendet me pak ujë të pijshëm, por me burime të pasura energjie. Problemi i vetëm është qëndrueshmëria ekonomike.
Përfundim (përfundime)
Prezantimi
Gjendja agregate - një gjendje materie e karakterizuar nga veti të caktuara cilësore: aftësia ose paaftësia për të ruajtur vëllimin dhe formën, praninë ose mungesën e rendit me rreze të gjatë dhe të shkurtër, dhe të tjera. Një ndryshim në gjendjen e grumbullimit mund të shoqërohet me një ndryshim të papritur energji e lirë, entropia, dendësia dhe vetitë e tjera themelore fizike.
Në internet do të gjeni shumë faqe që thonë shkrirje dhe avullim. Sigurisht, ka shumë të tjera. Por disa pyetje mbeten pa përgjigje si kurrë më parë. Pse disa substanca kanë një pikë shkrirjeje shumë të ulët, ndërsa të tjerat kanë një pikë shkrirjeje të lartë?
- Cilat procese ndodhin gjatë shkrirjes dhe avullimit?
- Pra, pse pëlhurat kanë të tilla pika të ndryshme duke vluar?
Cilat procese ndodhin gjatë shkrirjes?
Pse disa substanca nuk shkrihen ose vlojnë, por dekompozohen më herët? . Termat zierje dhe avullim përdoren në të njëjtën mënyrë në këtë faqe. Më shumë informacion mund të gjeni në këtë faqe.
Hapi i parë: si krijohet trupi i ngurtë
Çdo e ngurtë përbëhet nga grimca të vogla. Ka forca midis grimcave që i mbajnë ato së bashku. Ato janë gjithmonë elektrostatike. Natyra e grimcave dhe forca e forcave janë shumë të shumta. Ju mund ta gjeni koleksionin e saktë në faqen time Lidhjet. Këtu është një përmbledhje e shkurtër.Ekzistojnë tre gjendje kryesore të grumbullimit: të ngurtë, të lëngët dhe të gaztë. Ndonjëherë nuk është mjaft e saktë të klasifikohet plazma si një gjendje grumbullimi. Ka gjendje të tjera grumbullimi, për shembull, kristalet e lëngëta ose kondensata Bose-Einstein.
Ndryshimet në gjendjen e grumbullimit janë proceset termodinamike të quajtura tranzicione fazore. Dallohen varietetet e mëposhtme: nga të ngurta në të lëngshme - shkrirje; nga lëngu në të gaztë - avullimi dhe zierja; nga e ngurtë në të gaztë - sublimimi; nga i gaztë në të lëngët ose të ngurtë - kondensimi. Një tipar dallues është mungesa e një kufiri të mprehtë të kalimit në gjendjen plazmatike.
Hapi i dytë: çfarë ndodh kur një lëndë e ngurtë nxehet nën pikën e shkrirjes?
Nëse një substancë nxehet me ngrohje, grimcat më të vogla e thithin këtë energji. Ata thonë se energjia e tyre e brendshme po rritet. Energjia e brendshme mund të jetë e tre llojeve: energjia vibruese, energjia rrotulluese dhe energjia e elektroneve. Energjia e elektronit është e parëndësishme për shkrirjen dhe vlimin. Elektrone që arrijnë mbi nivel të lartë energji, qëndroni atje vetëm për një kohë dhe më pas kthehuni në nivelin origjinal. Energjia lirohet dhe lë një trup të fortë. Këtu ndodhin fenomene të tilla si fosforeshenca dhe fluoreshenca.
Për të përshkruar gjendje të ndryshme në fizikë, përdoret një koncept më i gjerë i një faze termodinamike. Dukuritë që përshkruajnë kalimet nga një fazë në tjetrën quhen dukuri kritike.
Solid: Një gjendje e karakterizuar nga aftësia për të ruajtur vëllimin dhe formën. Atomet e një trupi të ngurtë bëjnë vetëm dridhje të vogla rreth gjendjes së ekuilibrit. Ka porosi me rreze të gjatë dhe me rreze të shkurtër.
Le të shohim dridhjet, apo jo? dhe forca rrotulluese është pak më afër. Grimcat e vogla lëvizin në një mënyrë të caktuar. Disa nga mundësitë për këto lëvizje janë renditur tani. Shtrirja. 2 atomet e lidhur dridhen përgjatë boshtit të lidhjes në mënyrë që lidhja periodikisht të bëhet më e shkurtër dhe më e gjatë. Vetëm molekulat mund të kryejnë dridhje shtrirëse, pasi ato kanë vetëm një lidhje brenda grimcës. Dridhja e përkuljes. 3 atome të lidhur dridhen në mënyrë që këndi midis dy lidhjeve të jetë periodikisht më i vogël dhe më i madh. Molekulat me të paktën 3 atome mund të shkaktojnë dridhje përkulëse. Molekulat më të mëdha dhe më komplekse mund të kryejnë dridhje komplekse komplekse. Një shembull i thjeshtë është përmbysja e molekulës së amoniakut. E gjithë grimca mund të rrotullohet rreth qendrës së saj të gravitetit. Një pjesë e molekulës mund të rrotullohet rreth një lidhjeje.
- Dridhjet e një grimce rreth pozicionit të saj qendror.
- Kjo do të thotë, një jon ose molekulë lëkundet përpara dhe mbrapa si një lavjerrës.
- Secila nga grimcat më të vogla nga hapi i parë mund të kryejë dridhje të tilla.
Lëng: Gjendja e një lënde në të cilën ajo ka ngjyeshmëri të ulët, domethënë ruan mirë vëllimin, por nuk është në gjendje të ruajë formën e saj. Lëngu merr lehtësisht formën e enës në të cilën vendoset. Atomet ose molekulat e një lëngu dridhen pranë gjendjes së ekuilibrit, të bllokuar nga atome të tjera dhe shpesh hidhen në vende të tjera të lira. Ekziston vetëm porosi me rreze të shkurtër.
Në temperatura të ulëta, grimcat mbajnë vetëm lëkundje të ngadalta, me amplitudë të ulët dhe rrotullohen ngadalë. Nëse lënda e ngurtë nxehet, dridhjet dhe rrotullimet bëhen më të shpejta dhe vibrimet rriten në amplitudë. Prandaj, grimcat më të vogla thithin nxehtësinë e nxehtësisë dhe e shndërrojnë atë në energji të lëvizjes.
Hapi i tretë: Çfarë procesesh ndodhin gjatë shkrirjes?
A munden grimcat më të vogla të thithin një sasi të pakufizuar nxehtësie? Në dy paragrafët e mëparshëm, pamë dy veti të grimcave më të vogla në një trup të ngurtë. Tërheqësit elektrostatikë punojnë ndërmjet tyre. Ato çojnë në një energji të caktuar lidhëse. Nuk varet nga temperatura. Ne anen tjeter, energjia kinetike të përfshira në grimcat. Kjo është më shumë sa më e lartë të jetë temperatura.
Gaz: Një gjendje e karakterizuar nga kompresueshmëri e mirë, e mungesës së aftësisë për të ruajtur vëllimin dhe formën. Gazi tenton të zërë të gjithë vëllimin e dhënë për të. Atomet ose molekulat e një gazi sillen relativisht lirshëm, distancat midis tyre janë shumë më të mëdha se madhësia e tyre.
Gjendje të tjera: Pas ftohjes së thellë, disa (jo të gjitha) substanca kalojnë në një gjendje superpërçuese ose superfluide. Këto gjendje, natyrisht, janë faza të veçanta termodinamike, por vështirë se meritojnë të quhen gjendje të reja agregate të materies për shkak të jouniversalitetit të tyre. Substancat johomogjene të tilla si pastat, xhelat, suspensionet, aerosolet, etj., të cilat në kushte të caktuara shfaqin vetitë si të lëndëve të ngurta ashtu edhe të lëngjeve dhe madje edhe të gazeve, zakonisht klasifikohen si materiale të shpërndara dhe jo në ndonjë specifik. gjendjet agregate substancave.
Nëse një trup i ngurtë nxehet, energjia kinetike e grimcave të tij më të vogla rritet. Në një moment, ajo është më e madhe se energjia e lidhjes. Mund të imagjinohet se forcat tërheqëse midis grimcave nuk janë më aq të forta sa të përballojnë forcat e shkaktuara nga luhatjet termike. Grimcat tani lëvizin në mënyrë të pavarur nga njëra-tjetra, dhe kjo është pikërisht karakteristikë e lëngut. E ngurta shkrihet.
Pse lëngjet janë të lëngshme?
Në një lëng, grimcat nuk mbahen më së bashku nga forcat e tërheqjes elektrostatike. Shigjeta e kuqe tregon se çfarë ndodh kur ju. lënda e ngurtë nxehet me presion të ulët. Ky proces quhet sublimim. Kjo është e lehtë për t'u kuptuar sepse linja e argumentit është e thjeshtë. Energjia e lidhjes është shumë e ulët, forcat tërheqëse janë shumë të dobëta për t'i mbajtur grimcat së bashku, kështu që ato shpërndahen. Megjithatë, nëse nuk i dini vetëm informacionet për librat shkollorë, do të gjeni një kontradiktë këtu dhe do t'i bëni vetes një pyetje.
Shkrirja
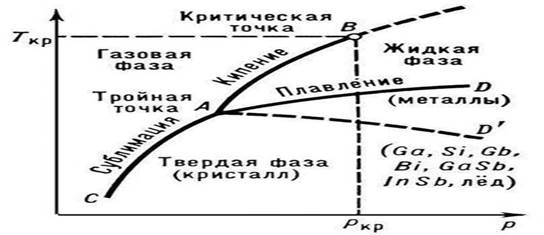
Oriz. 1. Gjendja e lëndës së pastër (diagrami)
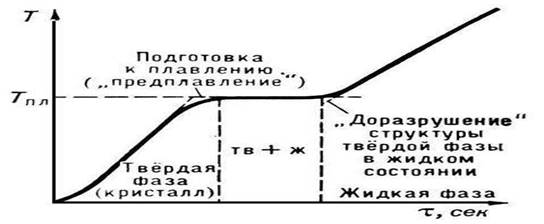
Oriz. 2. Temperatura e shkrirjes së një trupi kristalor
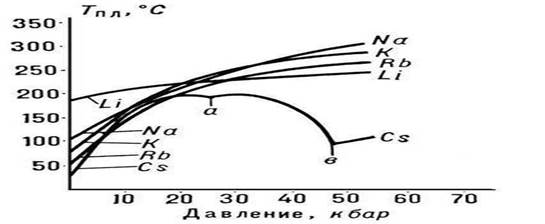
Oriz. 3. Pika e shkrirjes metalet alkali
Shkrirja - kalimi i një lënde nga një gjendje kristalore (e ngurtë) në një gjendje të lëngshme; ndodh me thithjen e nxehtësisë (kalimi fazor i rendit të parë). Karakteristikat kryesore të P. të substancave të pastra janë pika e shkrirjes (Tmelt) dhe nxehtësia që është e nevojshme për zbatimin e procesit P. (nxehtësia e shkrirjes Qmelt).
Në një lëng, grimcat pothuajse gjithmonë nuk janë të ndara nga njëra-tjetra, ato janë ende pothuajse aq afër sa në një të ngurtë. Pse nuk e filmojnë veten sikur janë në gaz? Me fjalë të tjera, pse trupi i ngurtë nuk kalon menjëherë në gjendje të gaztë gjatë shkrirjes?
Presioni luan një rol kyç
Ata e bëjnë atë me presion të ulët. Vetëm në presion të lartë ato bëhen të lëngshme. A është presioni që i pengon grimcat e ngurta të hyjnë drejtpërdrejt në gjendjen e gaztë? A është presioni arsyeja pse ekzistojnë fare lëngjet?
Temperatura e P. varet nga presioni i jashtëm p; në diagramin e gjendjes së një lënde të pastër, kjo varësi paraqitet nga kurba e shkrirjes (lakorja e bashkëjetesës së fazave të ngurta dhe të lëngshme, AD ose AD "në Fig. 1). Shkrirja e lidhjeve dhe tretësirave të ngurta ndodh, si një rregull, në intervalin e temperaturës (me përjashtim të eutektikës me një shkrirje konstante) Varësia e temperaturës së fillimit dhe mbarimit të P. të një aliazhi nga përbërja e tij në një presion të caktuar përshkruhet në diagramet e gjendjes me vija të veçanta ( lakoret likuidus dhe solidus, shih Sistemet binare) nga gjendja e ngurtë kristalore në një lëng izotropik ndodh në faza (në një interval të caktuar temperaturash), secila fazë karakterizon një fazë të caktuar të shkatërrimit struktura kristalore.
Le të hedhim një vështrim më të afërt në rolin e presionit. Grimcat brenda janë të rrethuara nga fqinjët. i rrethuar dhe i tërhequr prej tyre. Grimcat në sipërfaqe kanë disa fqinjë. Shikoni foton në të djathtë. Ai tregon një pjesë të lëngut, por raportet në trupat e ngurtë janë në thelb të njëjta.
Grimcat në imazh janë sferike, por raportet janë të njëjta për molekulat ose jonet me forma të ndryshme. Së pari, shikoni grimcën brenda. Ajo është e rrethuar nga grimca të tjera në të gjitha drejtimet. Ka tërheqës midis grimcave dhe të gjithë fqinjëve të saj. Këto janë forcat e Kulonit, të cilat u përshkruan në detaje në hapin e parë. Natyrisht, ato janë të pranishme si në të lëngshme ashtu edhe në të ngurta, dhe ato janë ende aq të forta sa ishin para shkrirjes. Ato përfaqësohen me vija të zeza në figurë. Theksohet një grimcë, ajo ka 7 fqinjë, të cilët preken nga forcat Kulomb.
Prania e një temperature të caktuar P. është një shenjë e rëndësishme e saktë struktura kristalore trupa të ngurtë. Mbi këtë bazë dallohen lehtë nga trupat e ngurtë amorfë, të cilët nuk kanë Tm fiks. Lëndët e ngurta amorfe kalojnë në gjendje të lëngët gradualisht, duke u zbutur me rritjen e temperaturës (shih Gjendja amorfe). Tungsteni ka temperaturën më të lartë midis metaleve të pastër (3410°C), dhe mërkuri ka temperaturën më të ulët (-38,9°C). Komponimet veçanërisht zjarrduruese përfshijnë: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), etj. Si rregull, për substancat me të lartë Tm karakterizohet nga vlera më të larta të Qm. Papastërtitë e pranishme në substanca kristalore ah, ulni Tm-në e tyre. Kjo përdoret në praktikë për të marrë lidhjet me shkrirje të ulët (shih, për shembull, aliazhin e drurit me shkrirje = 68 °C) dhe përzierjet ftohëse.
Njëri prej tyre tashmë ishte larguar prej tij. Nëse lëviz më tej, do të largohet plotësisht nga mediumi i grimcës së parë. Por është ende në lëng sepse do të afrohet me një grimcë tjetër dhe do të krijohet një lidhje mes tyre për një kohë të shkurtër. Grimcat brenda lëngut nuk mund t'i lënë ato, pasi ato mezi lëvizin nga një grimcë fqinje, ato tërhiqen nga një tjetër.
Në rastin e grimcave në sipërfaqen e lëngshme, situata është e ndryshme. Imazhi tregon dy grimca të tilla. Ata kanë fqinjë vetëm brenda lëngut, dhe vetëm për ta forcat Kulomb. Nga pamja e jashtme, nuk ka pothuajse asnjë fqinj. Ka ajër ose ndonjë gaz tjetër. Ka një densitet shumë të ulët në krahasim me një lëng, kështu që përmban shumë më pak grimca për njësi vëllimi. Do të zbuloni se duhet të shikoni më nga afër grimcat në sipërfaqe. Ka një çelës për përgjigjen.
P. fillon kur substanca kristalore arrin në Tpl. Nga fillimi i P. deri në përfundimin e tij, temperatura e substancës mbetet konstante dhe e barabartë me Tmelt, pavarësisht transferimit të nxehtësisë në substancë (Fig. 2). Në kushte normale, nuk është e mundur të nxehet një kristal në T > shkrihet (shiko Mbinxehja), ndërsa superftohja e konsiderueshme e shkrirjes është relativisht e lehtë për t'u arritur gjatë kristalizimit.
Grimcat me pak a shumë energji
Shpërndarja e energjisë e grimcave në një lëng. Gjithmonë kemi thënë se grimcat kanë një energji të caktuar për shkak të luhatjeve termike dhe mund të mendohet se të gjitha grimcat në një pikë lëngu kanë të njëjtën energji. Disa prej tyre kanë një energji më të lartë, të tjerët kanë një më të ulët. Kjo është e lehtë për t'u kuptuar duke pasur parasysh se grimcat përplasen. Në varësi të shpejtësisë dhe drejtimit në të cilin ato përplasen, energjia transferohet nga një grimcë në tjetrën. Meqenëse takimet janë mjaft të rastësishme, ka fitues, energjia e të cilëve rritet nga grushti në grusht, si dhe humbës.
Natyra e varësisë së Tm nga presioni p përcaktohet nga drejtimi i ndryshimeve vëllimore (DVm) në P. (shih ekuacionin Clapeyron-Clausius). Në shumicën e rasteve, P. e një lënde shoqërohet me një rritje të vëllimit të tyre (zakonisht me disa për qind). Nëse është kështu, atëherë një rritje e presionit çon në një rritje të Tm (Fig. 3). Megjithatë, në disa substanca (uji, një numër i metaleve dhe metalideve, shih Fig. 1), gjatë P., ndodh një rënie në vëllim. Temperatura e P. e këtyre substancave ulet me rritjen e presionit.
Shpërndarja e energjisë së grimcave në një. Të dy shpërndarjet ndryshojnë pak. Grimcat avullohen. Zona në të djathtë të vijës së kuqe në fund. Prandaj, në 20°C, më pak grimca kanë energjinë e nevojshme për të avulluar. mund të jetë edhe në 50 ° C, dhe në këtë temperaturë, avullimi është më i qëndrueshëm. Çfarë ndodh me fituesit? Energjia e tyre është aq e madhe sa mund të kapërcejnë forcat Kulomb të fqinjëve të tyre. Vetëm për shkak se ka kaq pak fqinjë, ata kanë një shans për të mposhtur atraktivitetin e të gjithë fqinjëve.
Dhe vetëm për shkak se energjia e tyre është kaq e madhe, ata jo vetëm që mund t'i kapërcejnë këto pamje për një kohë të shkurtër, por edhe t'i kapin përsëri, por përgjithmonë. Këto pak grimca me energji të lartë lënë pika të lëngshme. Ata lëvizin sa më shumë që të jetë e mundur dhe nuk kthehen kurrë në pikat e tyre. Të gjithë e dinë fenomenin e përshkruar më sipër.
P. shoqërohet me një ndryshim të vetive fizike të substancës: rritje të entropisë, e cila pasqyron çrregullimin e strukturës kristalore të substancës; një rritje në kapacitetin e nxehtësisë rezistenca elektrike[përjashtim bëjnë disa gjysmëmetale (Bi, Sb) dhe gjysmëpërçues (Ge), në gjendje e lëngshme me përçueshmëri më të lartë elektrike. Gjatë P., rezistenca në prerje bie pothuajse në zero (valët elastike tërthore nuk mund të përhapen në shkrirje shih Lëngu), zvogëlohet shpejtësia e përhapjes së zërit (valët gjatësore) etj.
Sapo keni mësuar pse bie një pikë uji. Energji termale disa grimca në sipërfaqe janë mjaft të mëdha për të lënë pika. Meqenëse po flasim vetëm për avullimin, mund të pastroni edhe shpejt, pasi varet nga temperatura. Tashmë direkt mbi pikën e shkrirjes do të ketë disa grimca që kanë energji të mjaftueshme për të lënë një pikë. Sa më e lartë të jetë temperatura, aq më e lartë është energjia mesatare e grimcave dhe gjithnjë e më shumë grimca do të kenë energjinë e nevojshme për të dalë nga sipërfaqja.
Sistemet e mbyllura sjellin më shumë qartësi
Si rezultat, pika avullohet më shpejt. Ilustrimi i mëposhtëm e ilustron këtë. Edhe një herë, ne ishim në gjendje të shpjegonim përvojat e përditshme. Një sistem i hapur është një sistem për shkëmbimin e materies dhe energjisë me mjedisi. Për shembull, një pikë uji është sistem i hapur. Kundër, sisteme të mbyllura dhe sistemet e mbyllura. Modeli i shishes së ujit mineral është shembull i mirë sistem i mbyllur. Është rreth një e treta e mbushur me lëng. Për të shmangur një argument të komplikuar të panevojshëm, duhet të mbushet me një lëng të pastër si uji, jo me një përzierje si uji mineral ose benzina.
Sipas paraqitjeve molekulare dhe kinetike, P. kryhet si më poshtë. Kur nxehtësia aplikohet në një trup kristalor, energjia e dridhjeve (amplituda e lëkundjes) e atomeve të tij rritet, gjë që çon në një rritje të temperaturës së trupit dhe kontribuon në formimin e llojeve të ndryshme të defekteve në kristal (nyjet e paplotësuara të rrjetës kristalore - vendet e lira; shkeljet e periodicitetit të grilës nga atomet e ngulitura midis nyjeve të saj, etj., shih Defektet në kristale). Në kristalet molekulare, çrregullimi i pjesshëm i orientimit të ndërsjellë të boshteve të molekulave mund të ndodhë nëse molekulat nuk kanë një formë sferike. Një rritje graduale e numrit të defekteve dhe shoqërimi i tyre karakterizon fazën e parashkrirjes. Kur arrihet Tmelt, krijohet një përqendrim kritik i defekteve në kristal, fillon kristalizimi - rrjeta kristalore shpërthen në rajone nën mikroskopike lehtësisht të lëvizshme. Nxehtësia e dhënë gjatë P. përdoret jo për të ngrohur trupin, por për të thyer lidhjet ndëratomike dhe për të shkatërruar rendin me rreze të gjatë në kristale (shih Rendi me rreze të gjatë dhe rend me rreze të shkurtër). Në vetë rajonet submikroskopike, nga ana tjetër, rendi me rreze të shkurtër në renditjen e atomeve nuk ndryshon ndjeshëm gjatë kristalizimit (numri i koordinimit të një shkrirjeje në Tm në shumicën e rasteve mbetet i njëjtë me atë të një kristali). Kjo shpjegon vlerat më të ulëta të nxehtësisë së shkrirjes së shkrirjes në krahasim me nxehtësinë e avullimit dhe ndryshimin relativisht të vogël në një sërë vetive fizike të substancave gjatë shkrirjes së tyre.
Procesi i pirolizës luan një rol të rëndësishëm në natyrë (piroliza e borës dhe akullit në sipërfaqen e tokës, mineralizimi i mineraleve në thellësitë e saj, etj.) dhe në teknologji (prodhimi i metaleve dhe lidhjeve, derdhja e mykut, etj.) .
Nxehtësia specifike e shkrirjes
Nxehtësia specifike e shkrirjes (gjithashtu: entalpia e shkrirjes; ekziston gjithashtu një koncept ekuivalent i nxehtësisë specifike të kristalizimit) - sasia e nxehtësisë që duhet t'i jepet një njësie të masës së një lënde kristaline në një proces ekuilibër izobar-izotermik në mënyrë për ta transferuar atë nga një gjendje e ngurtë (kristalore) në një lëng (e njëjtë sasia e nxehtësisë që çlirohet gjatë kristalizimit të një lënde). Nxehtësia e shkrirjes - rast i veçantë ngrohtësi tranzicioni fazor Unë i sjellshëm. Dalloni nxehtësinë specifike të shkrirjes (J/kg) dhe molare (J/mol).
Nxehtësia specifike e shkrirjes shënohet me shkronjë
(Greqishtja lambda) Formula për llogaritjen e nxehtësisë specifike të shkrirjes: , - nxehtësia specifike e shkrirjes, - sasia e nxehtësisë së marrë nga substanca gjatë shkrirjes (ose e lëshuar gjatë kristalizimit), - masa e substancës shkrirëse (kristalizuese). .
Shkrirja e metaleve
Gjatë shkrirjes së metaleve, duhet të respektohen disa rregulla. Supozoni se ata do të shkrijnë plumbin dhe zinkun. Plumbi do të shkrihet shpejt, duke pasur një pikë shkrirjeje prej 327°; zinku, nga ana tjetër, do të mbetet i fortë për një kohë të gjatë, pasi pika e tij e shkrirjes është mbi 419 °. Çfarë do të ndodhë me një mbinxehje të tillë? Do të fillojë të mbulohet me një film me ngjyrë të ylbertë, dhe më pas sipërfaqja e saj do të fshihet nën një shtresë pluhuri që nuk shkrihet. Plumbi digjet nga mbinxehja, oksidohet duke u kombinuar me oksigjenin në ajër. Ky proces, siç e dini, ndodh në temperaturë të zakonshme, por kur nxehet, shkon shumë më shpejt. Kështu, në kohën kur zinku fillon të shkrihet, do të ketë mbetur shumë pak plumb metalik. Lidhja do të rezultojë të jetë një përbërje krejtësisht e ndryshme, siç pritej, dhe një sasi e madhe plumbi do të humbasë në formën e mbeturinave. Është e qartë se fillimisht duhet të shkrijmë zinkun më zjarrdurues dhe më pas të hedhim plumbin në të. E njëjta gjë do të ndodhë nëse zinku lidhet me bakër ose bronz, duke ngrohur fillimisht zinkun. Zinku do të digjet në kohën kur bakri shkrihet. Kjo do të thotë që gjithmonë duhet të shkrini metalin me një pikë shkrirjeje më të lartë.
Por kjo nuk mund të shmangë furinë. Nëse një aliazh i ngrohur siç duhet mbahet në zjarr për një kohë të gjatë, një film përsëri formohet në sipërfaqen e metalit të lëngshëm si rezultat i tymit. Është e qartë se metali më i shkrirë do të kthehet përsëri në oksid dhe përbërja e prizës do të ndryshojë; Kjo do të thotë që metali nuk mund të mbinxehet për një kohë të gjatë pa nevojë. Prandaj, ata përpiqen në çdo mënyrë të mundshme të reduktojnë mbetjet e metalit, duke e vendosur atë në një masë kompakte; copa të vogla, tallash, ashkla fillimisht "paketohen", copa pak a shumë të së njëjtës madhësi shkrihen, nxehen në një temperaturë të mjaftueshme dhe sipërfaqja metalike mbrohet nga kontakti me ajrin. Për këtë qëllim, mjeshtri mund të marrë një boraks ose thjesht të mbulojë sipërfaqen e metalit me një shtresë hiri, e cila gjithmonë do të notojë sipër (për shkak të saj më të vogël gravitet specifik) dhe nuk do të dëmtojë kur derdhni metal. Kur metali ngurtësohet, ndodh një fenomen tjetër, ndoshta i njohur edhe për mjeshtrit e rinj. Metali, duke u ngurtësuar, zvogëlohet në vëllim, dhe kjo rënie ndodh për shkak të grimcave të brendshme të metalit, ende jo të ngurtësuara. Në sipërfaqen e derdhjes ose brenda saj formohet një depresion pak a shumë domethënës në formë hinke, e ashtuquajtura zgavra e tkurrjes. Zakonisht, myku bëhet në atë mënyrë që në ato vende të derdhjes të formohen vrima tkurrjeje, të cilat më pas hiqen, duke u përpjekur të mbrojnë sa më shumë vetë produktin. Është e qartë se vrimat e tkurrjes prishin derdhjen dhe ndonjëherë mund ta bëjnë atë të papërdorshëm. Pas shkrirjes, metali nxehet pak në mënyrë që të jetë më i hollë dhe më i nxehtë dhe për këtë arsye mbush më mirë detajet e mykut dhe nuk ngrin para kohe nga kontakti me një myk më të ftohtë.
Meqenëse pika e shkrirjes së lidhjeve është zakonisht më e ulët se pika e shkrirjes së metaleve më zjarrduruese të metaleve përbërëse të aliazhit, ndonjëherë është e dobishme të bëhet e kundërta: së pari shkrihet metali më i shkrirë, dhe më pas më refraktar. Megjithatë, kjo lejohet vetëm për metalet që nuk janë të oksiduara fort, ose me kusht që këto metale të mbrohen nga oksidimi i tepërt. Është e nevojshme të merret më shumë metal sesa kërkohet për vetë sendin, në mënyrë që të mbushë jo vetëm kallëpin, por edhe kanalin sprue. Është e qartë se së pari duhet të llogarisni sasinë e kërkuar të metalit.
Pika e shkrirjes dhe e vlimit të ujit
Vetia më befasuese dhe e lumtur e ujit për natyrën e gjallë është aftësia e tij për të qenë një lëng në kushte "normale". Molekulat e komponimeve shumë të ngjashme me ujin (për shembull, molekulat H2S ose H2Se) janë shumë më të rënda, por formojnë një gaz në të njëjtat kushte. Kështu, uji duket se kundërshton rregullsitë e tabelës periodike, e cila, siç e dini, parashikon kur, ku dhe cilat veti të substancave do të jenë afër. Në rastin tonë, nga tabela rezulton se vetitë komponimet e hidrogjenit Elementet (të quajtura hidride) të vendosura në të njëjtat kolona vertikale duhet të ndryshojnë në mënyrë monotonike me rritjen e masës së atomeve. Oksigjeni është një element i grupit të gjashtë të kësaj tabele. Në të njëjtin grup janë squfuri S (me peshë atomike 32), seleni Se (me peshë atomike 79), teluri Te (me peshë atomike 128) dhe polonium Po (me peshë atomike 209). Për rrjedhojë, vetitë e hidrideve të këtyre elementeve duhet të ndryshojnë në mënyrë monotone kur kalojnë nga elementët e rëndë në ato më të lehta, d.m.th. në sekuencën H2Po → H2Te → H2Se → H2S → H2O. Kjo është ajo që ndodh, por vetëm me katër hidridet e para. Për shembull, pikat e vlimit dhe shkrirjes rriten me rritjen e peshës atomike të elementeve. Në figurë, kryqet shënojnë pikat e vlimit të këtyre hidrideve, dhe rrathët shënojnë pikat e shkrirjes.

Siç shihet, me zvogëlimin e peshës atomike, temperaturat ulen në mënyrë mjaft lineare. Zona e ekzistencës së fazës së lëngshme të hidrideve bëhet gjithnjë e më e "ftohtë", dhe nëse hidridi i oksigjenit H2O do të ishte një përbërje normale, e ngjashme me fqinjët e tij në grupin e gjashtë, atëherë uji i lëngshëm do të ekzistonte në intervalin prej - 80 ° C deri -95 ° C. Në më shumë Në temperatura të larta, H2O do të ishte gjithmonë një gaz. Për fat të mirë për ne dhe gjithë jetën në Tokë, uji është anormal, nuk njeh një model periodik, por ndjek ligjet e veta.
Kjo shpjegohet mjaft thjesht - shumica e molekulave të ujit janë të lidhura me lidhje hidrogjeni. Janë këto lidhje që dallojnë ujin nga hidridet e lëngëta H2S, H2Se dhe H2Te. Nëse nuk do të ishin, atëherë uji do të vlonte tashmë në minus 95 ° C. Energjia e lidhjeve hidrogjenore është mjaft e lartë, dhe ato mund të thyhen vetëm në shumë më të larta temperaturë të lartë. Edhe ne gjendje e gaztë numër i madh Molekulat H2O ruajnë lidhjet e tyre hidrogjenore, duke u bashkuar në dimerë (H2O)2. Lidhjet plotësisht të hidrogjenit zhduken vetëm në një temperaturë të avullit të ujit prej 600 °C.
Kujtojmë se zierja konsiston në faktin se flluska avulli formohen brenda një lëngu të valë. Në presion normal, uji i pastër vlon në 100 "C. Nëse nxehtësia furnizohet përmes sipërfaqes së lirë, procesi i avullimit të sipërfaqes do të përshpejtohet, por avullimi vëllimor karakteristik i vlimit nuk ndodh. Zierja mund të kryhet edhe duke ulur pjesën e jashtme. presion, pasi në këtë rast avulli i presionit i barabartë me presionin e jashtëm arrihet në një temperaturë më të ulët. Në krye është shumë mal i lartë presioni dhe, në përputhje me rrethanat, pika e vlimit janë aq të ulëta saqë uji bëhet i papërshtatshëm për gatimin e ushqimit - temperatura e kërkuar e ujit nuk arrihet. Me një presion mjaft të lartë, uji mund të nxehet mjaftueshëm për të shkrirë plumbin (327°C) dhe ende të mos vlojë.
Përveç pikave super të larta të vlimit të shkrirjes (dhe procesi i fundit kërkon shumë nxehtësi shkrirjeje për një lëng kaq të thjeshtë), vetë diapazoni i ekzistencës së ujit është anormal - njëqind gradë, me të cilin këto temperatura ndryshojnë - a. diapazoni mjaft i madh për një lëng me peshë molekulare kaq të ulët si uji. Kufijtë e vlerave të lejuara të hipotermisë dhe mbinxehjes së ujit janë jashtëzakonisht të mëdha - me ngrohje ose ftohje të kujdesshme, uji mbetet i lëngshëm nga -40 ° C në +200 ° C. Kjo e zgjeron gamën e temperaturës në të cilën uji mund të mbetet i lëngshëm në 240 °C.
Kur akulli nxehet, temperatura e tij fillimisht rritet, por që nga momenti i formimit të përzierjes së ujit dhe akullit, temperatura do të mbetet e pandryshuar derisa i gjithë akulli të shkrihet. Kjo shpjegohet me faktin se nxehtësia e furnizuar me shkrirjen e akullit shpenzohet kryesisht vetëm në shkatërrimin e kristaleve. Temperatura e shkrirjes së akullit mbetet e pandryshuar derisa të gjitha kristalet të shkatërrohen (shih nxehtësinë latente të shkrirjes).
shkrihet
Shkrirja është një gjendje e shkrirë e lëngshme e substancave në temperatura brenda kufijve të caktuar larg pikë kritike pika e shkrirjes dhe ndodhet më afër pikës së shkrirjes. Natyra e shkrirjes përcaktohet në thelb nga lloji lidhjet kimike elementet në substancën e shkrirë.
Shkrirja përdoret gjerësisht në metalurgji, prodhimin e qelqit dhe fusha të tjera të teknologjisë. Shkrirja zakonisht ka një përbërje komplekse dhe përmban përbërës të ndryshëm ndërveprues (shih diagramin fazor).
Shkrihet janë
1. Metalike (Metalet (emri vjen nga latinishtja metallum - minierë, minierë) - grup elementësh me veti metalike karakteristike, si përçueshmëri e lartë termike dhe elektrike, koeficient pozitiv i temperaturës së rezistencës, duktilitet i lartë dhe shkëlqim metalik);
2. Jonik (Jon (greqishtja e lashtë ἰόν - duke shkuar) - grimcë monotomike ose poliatomike e ngarkuar elektrike e formuar si rezultat i humbjes ose shtimit të një ose më shumë elektroneve në një atom ose molekulë. Jonizimi (procesi i formimit të joneve) mund të ndodhin në temperatura të larta, nën ndikim fushe elektrike);
3.Gjysëmpërçues me lidhje kovalente ndërmjet atomeve (Gjysmëpërçuesit janë materiale që, për sa i përket përçueshmërisë së tyre specifike, zënë një pozicion të ndërmjetëm midis përçuesve dhe dielektrikëve dhe ndryshojnë nga përçuesit nga një varësi e fortë e përçueshmërisë specifike nga përqendrimi i papastërtive, temperatura dhe lloje te ndryshme rrezatimi. Vetia kryesore e këtyre materialeve është rritja e përçueshmërisë elektrike me rritjen e temperaturës);
4. Shkrirja organike me lidhjet van der Waals;
5. Polimer i lartë (Polymers (Greqisht shumë- - shumë; μέρος - pjesë) - substanca inorganike dhe organike, amorfe dhe kristalore të përftuara nga përsëritja e përsëritur e grupeve të ndryshme atomesh, të quajtura "njësi monomerike", të lidhura në makromolekula të gjata me anë kimike ose koordinimi. obligacione)
Shkrihet sipas llojit komponimet kimike atje jane:
1. Kripë;
2.Oksid;
3. Oksid-silikat (skorje) etj.
Shkrihet me veti të veçanta:
1.Eutektik
Interesante për shkrirjen
Kokrra akulli dhe yje.
Fut një copë akull i pastër në një dhomë të ngrohtë dhe shikoni atë të shkrihet. Do të bëhet shpejt e qartë se akulli, i cili dukej monolit dhe homogjen, ndahet në shumë kokrra të vogla - kristale individuale. Në vëllimin e akullit, ato janë të vendosura rastësisht. Jo më pak se foto interesante mund të shihet kur akulli shkrihet nga sipërfaqja.
Mbajeni një copë të lëmuar akulli pranë llambës dhe prisni derisa të fillojë të shkrihet. Kur shkrirja prek kokrrat e brendshme, aty do të fillojnë të shfaqen modele shumë të imta. Me një xham zmadhues të fortë, mund të shihni se ato kanë formën e flokeve gjashtëkëndore të borës. Në fakt, këto janë depresione të shkrira të mbushura me ujë. Forma dhe drejtimi i rrezeve të tyre korrespondojnë me orientimin e kristaleve të akullit. Këto modele quhen "yjet e Tyndall" sipas fizikanit anglez që i zbuloi dhe i përshkroi ato në 1855. "Yjet e Tyndall", të ngjashme me flokët e dëborës, janë në të vërtetë gropa në sipërfaqen e akullit të shkrirë, me madhësi rreth 1.5 mm, të mbushura me ujë. Në qendër të tyre janë të dukshme flluska ajri, të cilat kanë lindur për shkak të ndryshimit në vëllimet e akullit të shkrirë dhe ujit të shkrirë.
A E DINI?
Ekziston një metal, i ashtuquajturi aliazh i drurit, i cili mund të shkrihet lehtësisht edhe në ujë të ngrohtë (+68 gradë Celsius). Pra, kur përzieni sheqerin në një gotë, një lugë metalike e bërë nga kjo aliazh do të shkrihet më shpejt se sheqeri!
Substanca më zjarrduruese, karbidi i tantalit TaCO-88, shkrihet në një temperaturë prej 3990°C.
Në vitin 1987, studiuesit gjermanë ishin në gjendje ta ftohnin ujin në -700C duke e mbajtur atë në gjendje të lëngshme.
Ndonjëherë, që bora në trotuare të shkrihet më shpejt, spërkatet me kripë. Shkrirja e akullit ndodh sepse formohet një tretësirë kripe në ujë, pika e ngrirjes së së cilës është më e ulët se temperatura e ajrit. Zgjidhja thjesht rrjedh nga trotuari.
Është interesante se këmbët bëhen më të ftohta në trotuarin e lagësht, pasi temperatura e tretësirës së ujit të kripur është më e ulët se ajo e borës së pastër.
Nëse e derdhni çajin nga një çajnik në dy gota: me sheqer dhe pa sheqer, atëherë çaji në një filxhan me sheqer do të jetë më i ftohtë, sepse. shpërbërja e sheqerit (shkatërrimi i rrjetës së tij kristalore) gjithashtu konsumon energji.
Në ngricat e rënda, për të rivendosur butësinë e akullit, shesh patinazhi ujitet ujë i nxehtë.. Ujë i nxehtë shkrin një shtresë të lartë të hollë akulli, nuk ngrin aq shpejt, ka kohë të përhapet dhe sipërfaqja e akullit është shumë e lëmuar.
Përfundim (përfundime)
Shkrirja është kalimi i një lënde nga gjendje e ngurtë në lëng.
Kur nxehet, temperatura e substancës rritet, dhe shpejtësia e lëvizjes termike të grimcave rritet, ndërsa energjia e brendshme e trupit rritet.
Kur temperatura e një trupi të ngurtë arrin pikën e shkrirjes, rrjeta kristalore të ngurta fillon të prishet. Kështu, pjesa kryesore e energjisë së ngrohësit, e përcjellë në trupin e ngurtë, shpenzohet në zvogëlimin e lidhjeve midis grimcave të substancës, d.m.th., në shkatërrimin e rrjetës kristalore. Në këtë rast, energjia e ndërveprimit midis grimcave rritet.
Substanca e shkrirë ka një furnizim të madh energjia e brendshme sesa në gjendje të ngurtë. Pjesa e mbetur e nxehtësisë së shkrirjes shpenzohet për të bërë punë për të ndryshuar vëllimin e trupit gjatë shkrirjes së tij.
Kur shkrihet, vëllimi i shumicës trupa kristalorë rritet (me 3-6%), dhe zvogëlohet gjatë ngurtësimit. Por, ka substanca në të cilat, kur shkrihen, vëllimi zvogëlohet, dhe kur ngurtësohet, rritet. Këto përfshijnë, për shembull, ujin dhe gize, silikon dhe disa të tjerë. . Kjo është arsyeja pse akulli noton në sipërfaqen e ujit, dhe giza e ngurtë - në shkrirjen e tij.
Lëndët e ngurta të quajtura amorfe (qelibar, rrëshirë, qelqi) nuk kanë një pikë shkrirjeje specifike.
Sasia e nxehtësisë e nevojshme për të shkrirë një substancë është e barabartë me produktin e nxehtësisë specifike të shkrirjes shumëfishin e masës së substancës.
Nxehtësia specifike e shkrirjes tregon se sa nxehtësi është e nevojshme për shndërrimin e plotë të 1 kg të një lënde nga një gjendje e ngurtë në një gjendje të lëngshme, e marrë me shpejtësinë e shkrirjes.
Njësia e nxehtësisë specifike të shkrirjes në SI është 1J/kg.
Gjatë procesit të shkrirjes, temperatura e kristalit mbetet konstante. Kjo temperaturë quhet pika e shkrirjes. Çdo substancë ka pikën e vet të shkrirjes.
Pika e shkrirjes për një substancë të caktuar varet nga presioni atmosferik.
Lista e literaturës së përdorur
1) Të dhënat nga enciklopedia e lirë elektronike "Wikipedia"
http://ru.wikipedia.org/wiki/Main_page
2) Faqja "Klasa! Fizikë për kuriozët" http://class-fizika.narod.ru/8_11.htm
3) Vendi " Vetitë fizike ujë"
http://all-about-water.ru/boiling-temperature.php
4) Faqja e internetit "Metalet dhe strukturat"
http://metaloconstruction.ru/osnovy-plavleniya-metallov/
Nuk ka një gjë të tillë trup i fortë, e cila do t'i rezistonte rritjes së temperaturës aq sa duhet. Herët a vonë një pjesë e fortë kthehet në një lëng; e drejtë, në disa raste nuk do të arrijmë në pikën e shkrirjes - mund të ndodhë dekompozimi kimik.
Ndërsa temperatura rritet, molekulat lëvizin më shpejt dhe më shpejt. Më në fund, vjen një moment kur ruajtja e rendit "ndërmjet molekulave të lëkundura fort" bëhet e pamundur. E ngurta shkrihet. Tungsteni ka pikën më të lartë të shkrirjes: 3380 ° C. Ari shkrihet në 1063 ° C, hekuri në 1539 ° C. Megjithatë, atje janë edhe metale të shkrirë.Mërkuri, siç dihet, shkrihet tashmë në temperaturën -39 ° C. Substancat organike nuk kanë pika të larta shkrirjeje. Naftalina shkrihet në 80 ° C, tolueni - në -94.5 ° C.
Nuk është aspak e vështirë të matet pika e shkrirjes së një trupi, veçanërisht nëse ai shkrihet në intervalin e temperaturës që matet me një termometër të zakonshëm. Nuk është aspak e nevojshme të ndiqni me sy trupin e shkrirë. Mjafton të shikoni kolonën e merkurit të termometrit. Derisa të fillojë shkrirja, temperatura e trupit rritet (Fig. 4.5). Sapo të fillojë shkrirja, rritja e temperaturës ndalon dhe temperatura do të mbetet e pandryshuar derisa të përfundojë procesi i shkrirjes.
Ashtu si shndërrimi i një lëngu në avull, shndërrimi i një të ngurtë në një lëng kërkon nxehtësi. Nxehtësia e nevojshme për këtë quhet nxehtësi latente shkrirja. Për shembull, shkrirja e një kilogrami akulli kërkon 80 kcal.
Akulli është një nga trupat me nxehtësi të lartë të shkrirjes. Shkrirja e akullit kërkon, për shembull, 10 herë më shumë energji sesa shkrirja e së njëjtës masë plumbi. Sigurisht po flasim për vetë shkrirjen, nuk themi këtu që para se të fillojë shkrirja e plumbit, duhet të nxehet në + 327 ° C. Për shkak të nxehtësisë së lartë të shkrirjes së akullit, shkrirja e borës ngadalësohet. Imagjinoni që nxehtësia e shkrirjes do të ishte 10 herë më pak. Pastaj përmbytjet e pranverës do të sillnin çdo vit fatkeqësi të paimagjinueshme.
Pra, nxehtësia e shkrirjes së akullit është e madhe, por është gjithashtu e vogël kur krahasohet me ngrohje specifike avullimi në 540 kcal / kg (shtatë herë më pak). Megjithatë, ky ndryshim është mjaft i natyrshëm. Gjatë shndërrimit të një lëngu në avull, ne duhet t'i shkëpusim molekulat njëra nga tjetra, dhe gjatë shkrirjes, na mbetet vetëm të shkatërrojmë rendin në renditjen e molekulave, duke i lënë ato pothuajse në të njëjtat distanca. Është e qartë se në rastin e dytë kërkohet më pak punë.
Prania e një pike të caktuar shkrirjeje është një tipar i rëndësishëm i substancave kristalore. Është mbi këtë bazë që ato janë të lehta për t'u dalluar nga trupat e tjerë të ngurtë, të quajtur amorfe ose gota. Syzet gjenden midis substancave inorganike dhe organike. Xhamat e dritareve zakonisht bëhen nga silikate natriumi dhe kalciumi; shpesh në tavolinë vendoset xhami organik (quhet edhe pleksiglas).
Substancat amorfe, në ndryshim nga kristalet, nuk kanë një pikë të caktuar shkrirjeje. Xhami nuk shkrihet, por zbutet. Kur nxehet, një copë xhami fillimisht bëhet e butë nga e forta, mund të përkulet ose shtrihet lehtësisht; në një temperaturë më të lartë, pjesa fillon të ndryshojë formën e saj nën ndikimin e gravitetit të saj. Ndërsa nxehet, masa e trashë viskoze e qelqit merr formën e enës në të cilën shtrihet. Kjo masë në fillim është e trashë, si mjalti, më pas si kosi dhe, në fund, bëhet një lëng me viskozitet të ulët sa uji. Me gjithë dëshirën tonë, ne nuk mund të tregojmë këtu një temperaturë specifike për kalimin e një të ngurtë në një lëng. Arsyet për këtë qëndrojnë në ndryshimin themelor midis strukturës së qelqit dhe strukturës së trupave kristalorë. Siç u përmend më lart, atomet në trupa amorfë rregulluar në mënyrë të rastësishme. Syzet në strukturë i ngjajnë lëngjeve.Edhe në xhamin e ngurtë, molekulat janë të renditura në mënyrë të rastësishme. Kjo do të thotë se një rritje në temperaturën e qelqit vetëm sa rrit gamën e dridhjeve të molekulave të tij, duke u dhënë atyre gradualisht gjithnjë e më shumë liri lëvizjeje. Prandaj, xhami zbutet gradualisht dhe nuk tregon një tranzicion të mprehtë "të ngurtë" - "të lëngshëm", i cili është karakteristik për kalimin nga rregullimi i molekulave në një mënyrë strikte në një rregullim të rastësishëm.
Kur bëhej fjalë për kurbën e vlimit, thamë se lëngu dhe avulli, megjithëse në gjendje të paqëndrueshme, mund të jetojnë në rajone të huaja - avulli mund të superftohet dhe të transferohet në të majtë të kurbës së vlimit, lëngu mund të mbinxehet dhe tërhiqet në të djathtë. të kësaj kurbe.
A janë të mundshme dukuri të ngjashme në rastin e një kristali me një lëng? Rezulton se analogjia këtu është e paplotë.
Nëse ngrohni kristalin, ai do të fillojë të shkrihet në pikën e shkrirjes. Kristali nuk mund të mbinxehet. Përkundrazi, duke ftohur lëngun, është e mundur që, nëse merren masa të caktuara, të "rrëshqaset" relativisht lehtë në pikën e shkrirjes. Në disa lëngje, mund të arrihen nënftohje të mëdha. Madje ka lëngje që janë të lehta për t'u superftuar, por të vështira për t'u kristalizuar. Ndërsa një lëng i tillë ftohet, bëhet gjithnjë e më viskoz dhe në fund ngurtësohet pa u kristalizuar. I tillë është xhami.
Ju gjithashtu mund të rifreskoni ujin. Pikat e mjegullës mund të mos ngrijnë edhe në ngrica të forta. Nëse një kristal i një lënde, një farë, hidhet në një lëng të tejftohur, atëherë kristalizimi do të fillojë menjëherë.
Së fundi, në shumë raste kristalizimi i vonuar mund të inicohet me dridhje ose të tjera ngjarje të rastësishme. Dihet, për shembull, se glicerina kristaline u përftua për herë të parë gjatë transportit përmes hekurudhor. Syzet pas një qëndrimi të gjatë mund të fillojnë të kristalizohen (devitrohen, ose "kolapsohen", siç thonë në teknologji).






