Kako se zove proces koji se odvija pri konstantnoj zapremini? Šta je termodinamika
Skup promjena stanja termodinamičkog sistema tokom prelaska iz jednog stanja u drugo pod uticajem okoline naziva se termodinamički proces.
Stanje plina u kojem svaki njegov parametar u cijeloj masi ima istu vrijednost naziva se stanje ravnoteže.
Termodinamički procesi mogu biti ravnotežni i neravnotežni.
Ravnotežni proces je proces koji prolazi kroz ravnotežna stanja, tj. kada su parametri gasa (specifična zapremina, pritisak i temperatura) isti u svim tačkama zapremine. Ravnotežni procesi koji se odvijaju beskonačno sporo i sastoje se od beskonačno velikog broja ravnotežnih stanja, a u svakom trenutku između radnog tijela i okruženje uspostavlja se ravnoteža, odnosno između okoline i radnog fluida, razlika u temperaturi i pritisku je beskonačno mala. Ravnotežni procesi za bilo koji trenutak vremena imaju fiksne vrijednosti glavnih parametara, tako da se mogu grafički prikazati pomoću dijagrama (PV, TS-dijagrami).
Realni procesi su neravnotežni. Neujednačenost stvarnih procesa određena je, prije svega, činjenicom da se pod utjecajem vanjskih uvjeta odvijaju konačnim brzinama i da ravnotežno stanje nema vremena da se uspostavi u radnom tijelu (parametri stanja u cijelom mase gasa nisu iste).
Termodinamika prvenstveno razmatra ravnotežna stanja i ravnotežne procese promjene stanja plina. Ravnotežni procesi imaju svojstvo reverzibilnosti, što leži u činjenici da se mogu proći u suprotnom smjeru kroz sva stanja direktnog procesa.
Reverzibilni procesi su procesi koji se odvijaju i u naprijed i u suprotnom smjeru kroz ista ravnotežna stanja. Istovremeno, na kraju njih ne ostaju promjene ni u samom sistemu ni u okruženju.
Glavni uslovi za reverzibilnost procesa su:
Uslov za eksternu reverzibilnost je prisustvo termičke i mehaničke ravnoteže, tj. jednakost temperatura i pritisaka radnog fluida i okoline;
Uslov unutrašnje reverzibilnosti je odsustvo trenja, difuzije i drugih jednostrano usmjerenih procesa.
U toplotnim mašinama i aparatima procesi se odvijaju na konačnoj temperaturnoj razlici između izvora i radnog fluida, pa su takvi procesi nepovratni. Svi stvarni procesi u zemaljskim uslovima su nepovratni.
Sve analitičke zavisnosti u termodinamici, koje karakterišu procese promene stanja, odnose se na obrnute procese. Prelazak sa reverzibilnih procesa na realne, ireverzibilne, vrši se uvođenjem empirijskih koeficijenata koji uzimaju u obzir odstupanja stvarnih procesa od reverzibilnih.
Termodinamika je nauka koja proučava termalne pojave koji se javljaju u tijelima bez povezivanja s molekularnom strukturom materije.
U termodinamici se to smatra sve termičke procese u telima karakterišu samo makroskopski parametri- pritisak, zapreminu i temperaturu. A budući da se ne mogu primijeniti na pojedinačne molekule ili atome, onda se, za razliku od molekularno-kinetičke teorije, u termodinamici ne uzima u obzir molekularna struktura tvari u toplinskim procesima.
Svi koncepti termodinamike su formulisani kao generalizacija činjenica uočenih tokom eksperimenata. Zbog toga se naziva fenomenološka (deskriptivna) teorija topline.
Termodinamički sistemi

Termodinamika opisuje termičke procese koji se dešavaju u makroskopskim sistemima. Takvi sistemi se sastoje od ogromnog broja čestica - molekula i atoma, a nazivaju se termodinamičkim.
termodinamički sistem može se smatrati svakim objektom koji se može vidjeti golim okom ili uz pomoć mikroskopa, teleskopa i drugih optičkih instrumenata. Glavna stvar je da dimenzije sistema u prostoru i vrijeme njegovog postojanja omogućavaju mjerenje njegovih parametara - temperature, pritiska, mase, hemijski sastav elemenata itd., koristeći uređaje koji ne reaguju na djelovanje pojedinih molekula (manometri, termometri itd.).
Za hemičare, termodinamički sistem je mešavina hemikalija koje međusobno deluju u procesu. hemijska reakcija. Astrofizičari će nazvati takav sistem nebesko tijelo. Mešavina goriva i vazduha u automobilskom motoru, globus, naše telo, olovka za pisanje, sveska, alatna mašina itd., takođe su termodinamički sistemi.
Svaki termodinamički sistem je odvojen od okoline granicama. Mogu biti stvarne - staklene stijenke epruvete sa hemijski, tijelo cilindra u motoru itd. I mogu biti uslovne, kada, na primjer, proučavaju nastanak oblaka u atmosferi.
Ako se takav sistem ne zamijeni sa spoljašnje okruženje ni energija ni materija, to se zove izolovan ili zatvoreno .
Ako sistem razmjenjuje energiju sa vanjskim okruženjem, ali ne razmjenjuje materiju, onda se naziva zatvoreno .
otvoreni sistem razmenjuje energiju i materiju sa okolinom.
Termodinamička ravnoteža

Ovaj koncept se također uvodi u termodinamiku kao generalizacija eksperimentalnih rezultata.
Termodinamička ravnoteža naziva se takvo stanje sistema u kojem se sve njegove makroskopske veličine - temperatura, pritisak, zapremina i entropija - ne mijenjaju u vremenu ako je sistem izolovan. Svaki zatvoreni termodinamički sistem može spontano prijeći u takvo stanje ako svi vanjski parametri ostanu konstantni.
Najjednostavniji primjer sistema u termodinamičkoj ravnoteži je termos sa toplim čajem. Temperatura u njemu je ista u bilo kojoj tački tečnosti. Iako se termos može nazvati izolovanim sistemom samo približno.
Svaki zatvoreni termodinamički sistem spontano teži da prijeđe u termodinamičku ravnotežu ako se vanjski parametri ne mijenjaju.
Termodinamički proces

Ako se barem jedan od makroskopskih parametara promijeni, onda kažu da je sistem termodinamički proces . Takav proces može nastati ako se vanjski parametri promijene ili sistem počne primati ili prenositi energiju. Kao rezultat, prelazi u drugo stanje.
Razmotrimo primjer čaja u termosici. Ako umočimo komad leda u čaj i zatvorimo termosicu, odmah će doći do razlike u temperaturi u različitim dijelovima tekućine. Tečnost u termosici će težiti da izjednači temperature. Iz područja s višom temperaturom, toplina će se prenositi tamo gdje je temperatura niža. Odnosno, desiće se termodinamički proces. Na kraju će temperatura čaja u termosici ponovo postati ista. Ali već će biti drugačije od prvog početna temperatura s. Stanje sistema se promenilo jer se promenila njegova temperatura.
Termodinamički proces nastaje kada se pijesak zagrijan na plaži tokom vrućeg dana ohladi noću. Do jutra mu temperatura pada. Ali čim sunce izađe, proces grijanja će početi ponovo.
Unutrašnja energija

Jedan od glavnih pojmova termodinamike je unutrašnja energija .
Sva makroskopska tijela imaju unutrašnju energiju, koja je zbir kinetičke i potencijalne energije svih čestica (atoma i molekula) koje čine tijelo. Ove čestice djeluju samo jedna na drugu i ne stupaju u interakciju s česticama okoline. Unutrašnja energija zavisi od kinetičke i potencijalna energijačestica i ne zavisi od položaja samog tela.
U = E k + E p
Unutrašnja energija se mijenja sa temperaturom. Teorija molekularne kinetike to objašnjava promjenom brzine kretanja čestica materije. Ako temperatura tijela raste, tada se povećava brzina kretanja čestica, udaljenost između njih postaje veća. Posljedično se povećava njihova kinetička i potencijalna energija. Kada temperatura padne, dolazi do obrnutog procesa.
Za termodinamiku nije količina važnija unutrašnja energija, ali njegova promjena. A unutrašnju energiju možete promijeniti pomoću procesa prijenosa topline ili stvaranjem mehanički rad.
Promjena unutrašnje energije mehaničkim radom

Benjamin Rumford
Unutrašnja energija tijela može se promijeniti mehaničkim radom na njemu. Ako se rad vrši na tijelu, tada se mehanička energija pretvara u unutrašnju energiju. A ako tijelo obavlja rad, tada se njegova unutrašnja energija pretvara u mehaničku energiju.
Skoro do kasno XIX veka verovalo se da postoji bestežinska supstanca - kalorična, koja prenosi toplotu sa tela na telo. Što više kalorija ulazi u tijelo, to će biti toplije, i obrnuto.
Međutim, 1798. godine angloamerički naučnik grof Benjamin Rumford počeo je sumnjati u teoriju kalorija. Razlog tome je zagrijavanje cijevi topova tokom bušenja. On je sugerisao da je uzrok zagrijavanja mehanički rad koji se vrši prilikom trenja svrdla o bure.
I Rumford je napravio eksperiment. Da bi povećali silu trenja, uzeli su tupu bušilicu, a sama cijev je stavljena u bačvu s vodom. Do kraja trećeg sata bušenja voda u buretu je počela da ključa. To je značilo da je cijev dobivala toplinu kada se na njoj vršio mehanički rad.
Prijenos topline
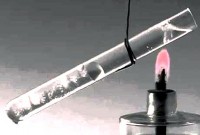
prijenos topline pozvao fizički proces prijenos toplinske energije (topline) s jednog tijela na drugo bilo direktnim kontaktom ili kroz razdjelnu pregradu. Toplota se po pravilu prenosi sa toplijeg tijela na hladnije. Ovaj proces se završava kada sistem dođe u stanje termodinamičke ravnoteže.
Energija koju tijelo prima ili odaje tokom prijenosa topline naziva se količinu toplote .
Prema načinu prijenosa topline prijenos topline se može podijeliti u 3 vrste: toplotna provodljivost, konvencija, toplotno zračenje.
Toplotna provodljivost

Ako postoji temperaturna razlika između tijela ili dijelova tijela, tada će se između njih dogoditi proces prijenosa topline. toplotna provodljivost naziva proces prijenosa unutrašnje energije sa više zagrijanog tijela (ili njegovog dijela) na manje zagrijano tijelo (ili njegov dio).
Na primjer, zagrijavanjem jednog kraja čelične šipke na vatri, nakon nekog vremena osjetit ćemo da se i njen drugi kraj zagrije.
Staklenu šipku, čiji je jedan kraj vruć, lako držimo za drugi kraj, a da se ne opečemo. Ali ako pokušamo napraviti isti eksperiment sa željeznom šipkom, nećemo uspjeti.
Različite tvari različito provode toplinu. Svaki od njih ima svoje koeficijent toplotne provodljivosti, ili provodljivost, numerički jednak količini topline koja prolazi kroz uzorak debljine 1 m, površine 1 m 2 u 1 sekundi. 1 K se uzima kao jedinica temperature.
Metali najbolje provode toplotu. To je njihovo svojstvo koje koristimo u svakodnevnom životu, kuhajući u metalnim loncima ili tavama. Ali njihove ručke ne bi trebale da se zagreju. Zbog toga su napravljeni od materijala sa slabom toplotnom provodljivošću.
Toplotna provodljivost tečnosti je manja. A plinovi imaju slabu toplinsku provodljivost.
Životinjsko krzno je takođe loš provodnik toplote. Zahvaljujući tome, ne pregrijavaju se na vrućem vremenu i ne smrzavaju se po hladnom vremenu.
konvencija
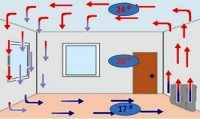
Konvencionalno, toplota se prenosi mlazovima i tokovima gasa ili tečnosti. Ne postoji konvencija u čvrstim materijama.
Kako nastaje konvencija u tečnosti? Kada stavite kotlić s vodom na vatru, donji sloj tekućine se zagrijava, gustoća mu se smanjuje, pomiče se prema gore. Njegovo mjesto zauzima hladniji sloj vode. Nakon nekog vremena, također će se zagrijati i zamijeniti mjesta hladnijim slojem. itd.
Sličan proces se dešava i u gasovima. Nije slučajno što su baterije za grijanje postavljene na dnu prostorije. Na kraju krajeva, zagrijani zrak se uvijek diže do vrha prostorije. A donji, hladni, naprotiv, pada. Zatim se takođe zagreva i ponovo diže, dok se gornji sloj za to vreme hladi i tone.
Konvencija je prirodna i iznuđena.
Prirodna konvencija se stalno odvija u atmosferi. Kao rezultat toga, dolazi do stalnih kretanja toplih zračnih masa prema gore, a hladnih - prema dolje. Rezultat su vjetar, oblaci i drugi prirodni fenomeni.
Kada prirodna konvencija nije dovoljna, koristim prisilnu konvenciju. Na primjer, topli zrak struji u prostoriji uz pomoć lopatica ventilatora.
termičko zračenje

Sunce greje zemlju. Ne postoji prijenos topline ili konvencija. Pa zašto se tijela zagrijavaju?
Činjenica je da je Sunce izvor toplotnog zračenja.
termičko zračenje - ovo je elektromagnetno zračenje koju stvara unutrašnja energija tijela. Sva tela oko nas zrače toplotnu energiju. To može biti vidljivo svjetlo iz stolne lampe ili izvori nevidljivih ultraljubičastih, infracrvenih ili gama zraka.
Ali tijela ne zrače samo toplinu. Oni ga takođe konzumiraju. Neki u većoj mjeri, drugi u manjoj mjeri. Štaviše, tamna tijela se zagrijavaju i hlade brže od svijetlih. Po vrućem vremenu trudimo se da nosimo odeću svetlih boja, jer ona manje upija toplotu od odeće tamne boje. Automobil tamne boje zagreva se na suncu mnogo brže od automobila svetle boje koji stoji pored njega.
Ovo svojstvo supstanci da apsorbuju i zrače toplotu na različite načine koristi se u kreiranju sistema za noćno osmatranje, sistema za navođenje projektila, itd.
Kao rezultat utjecaja na radni fluid (plin, para) vanjskog okruženja, na primjer, kompresija, ekspanzija, zagrijavanje itd., Parametri njegovog stanja se mijenjaju.
Svaka promjena parametara stanja radnog tijela naziva se termodinamički proces.
Kao što je gore navedeno, postoje ravnotežna i neravnotežna stanja radnog fluida. Termodinamički proces u kojem sistem prolazi kroz kontinuirani niz ravnotežnih stanja naziva se ravnoteža. Glavni uslov za ravnotežno stanje radnog fluida je jednakost temperature i pritiska u njegovoj masi. Ravnotežni procesi su reverzibilni.
Neravnotežni procesi nazivaju se realni procesi koji se odvijaju konačnom brzinom, dok će rad utrošen na kompresiju biti veći nego u ravnotežnom procesu (zbog sila trenja, inercije itd.).
Neravnotežni procesi su nepovratni.
Prilikom proučavanja termodinamičkih procesa oni se koriste grafičke slike, posebno u koordinatnom sistemu r i J, koji se naziva rJ-dijagram.
Apsolutni pritisci r su iscrtani duž ordinatne ose, a specifične zapremine gasa su nacrtane duž ose apscise. Za poznate vrijednosti r i J, ravnotežno stanje je predstavljeno tačkom.
Slika 1 prikazuje proizvoljni ravnotežni proces. Kada plin prijeđe iz početnog stanja 1 u konačno stanje 2, dolazi do smanjenja tlaka i povećanja specifične zapremine. Ovo je proces proširenja koji se smatra direktnim procesom. Proces kompresije (od tačke 2 do tačke 1) smatra se obrnutim.
Sve teme u ovoj sekciji:
TERMODINAMIKA I NJENI PROBLEMI
Procesi razmjene energije odvijaju se u bilo kojem fenomenu okolnog svijeta. Stoga, termodinamika, kao nauka o međusobnoj transformaciji toplote i rada, daje metode za proučavanje energetskih polja.
STANJA RADNOG TIJELA
Termodinamički sistem je skup materijalnih tijela koja su u mehaničkoj i toplinskoj interakciji jedno s drugim i sa okolnim tijelima. Thermody
I PRAVI GASOVI
Pravi gasovi na niske pritiske su blizu idealnim, jer se u ovom slučaju sile međumolekulske interakcije i zapremina molekula mogu zanemariti. Ovo se posebno odnosi na kiseonik, vazduh
GASNE SMEŠE
U praksi se kao radni fluid u pravilu ne koristi bilo koji homogeni plin, već mješavina plina: zraka, produkta sagorijevanja razne vrste goriva, prirodnog gasa itd.
PRAVI I PROSJEČNI TOPLOTNI KAPACITET
Toplotni kapaciteti mogu biti maseni, zapreminski, molarni. Toplotni kapacitet 1 kg plina naziva se masa: označava se slovom c i mjeri se u J/(kg. K). One
TOPLOTNI KAPACITETI IDEALNOG GASA
Kao što je već spomenuto, temperatura plina sa istom količinom dovedene topline q mijenja se različito ovisno o prirodi termodinamičkog procesa. To znači,
Vrijednosti molarnih toplotnih kapaciteta i koeficijenta k ovisno o atomičnosti
Plin msJ mav msJ mav k
TOPLOTNI KAPACITET GASNIH SMEŠA
Toplotni kapacitet gasne mešavine, kao i pojedinačnih gasova, može se odnositi na 1 kg, 1 m3 ili 1 kmol. Ako je smjesa data masenim udjelima, onda je njen maseni toplinski kapacitet
I UNUTRAŠNJA ENERGIJA
Rad se obavlja samo kada se promeni zapremina gasa. Ako se plin širi, tada se rad vrši protiv vanjskih sila; kada se kompresuje, naprotiv, gas preuzima rad
HEAT
Toplota je oblik kretanja najsitnijih čestica tijela. Prijenos topline s jednog tijela na drugo vrši se ili direktnim kontaktom između njih (toplotna provodljivost,
PRVI ZAKON TERMODINAMIJE
Prvi zakon termodinamike je poseban slučaj univerzalni zakon održanja i transformacije energije u odnosu na toplotne procese. Formulacija prvog zakona
TERMODINAMSKI PROCESI U GASOVIMA
Svaka promjena stanja radnog fluida (gasa) općenito je karakterizirana promjenom njegovih glavnih parametara: r, J, T. Stanje plina se mijenja na dva načina: govoreći mu one
ENTROPIJA GASA
U studiji se svi procesi smatraju ravnotežnim i reverzibilnim. Prije razmatranja procedure za proučavanje termodinamičkih procesa, uvodimo peti parametar
IZOHORNI PROCES
Proces koji se odvija pri konstantnoj specifičnoj zapremini naziva se izohoričan. Izohorni proces se posebno koristi u proračunima teorijski ciklusi motori sa karburatorom
ISOBAR PROCES
Proces koji se odvija pri konstantnom pritisku naziva se izobarski. Takav termodinamički proces može se odvijati u cilindru čiji se klip kreće bez trenja, tj
GAS ENTHALPY
U procesima vezanim za proračun kotlovskih postrojenja, parnih turbina, kao i za sušenje i hlađenje poljoprivrednih proizvoda, parametar stanja radnog fluida (ha
IZOTHERMIČKI PROCES
Proces koji se odvija u konstantna temperatura radni fluid se naziva izotermnim. Moguće je, na primjer, u cilindru klipne mašine, ako se kao toplota q dovede radnom
ADIABATSKI PROCES
Adijabatski proces je proces koji se odvija bez razmjene topline između plina i okoline (q = 0). Praktična upotreba ovog procesa je u mlaznicama pare t
POLITROPSKI PROCES
U svim pravim toplotnim motorima (motorima unutrašnjim sagorevanjem- motori sa unutrašnjim sagorevanjem, kompresori, gasnoturbinski agregati i dr.) procesi kompresije radnog fluida (gasa), sagorevanja goriva, ekspanzije
Rezultati analize politropskih procesa
Grupa Granice promjene politropskog indeksa Promjena unutrašnje energije Snabdijevanje (odvođenje) topline Toplo
KRUŽNI PROCESI
Zatvoreni proces, kao rezultat kojeg se plin, nakon što prođe kroz više različitih stanja, vraća u prvobitno stanje, naziva se kružni proces(ciklus). Hajde da objasnimo ovu definiciju.
DIREKTNI REVERZIBILNI CARNO CIKLUS
Godine 1824. S. Carnot je predložio ciklus koji je dobio njegovo ime. Direktno reverzibilni (to jest, koji se sastoji samo od ravnotežnih, reverzibilnih procesa) Carnotov ciklus je idealan ciklus
OBRATNI REVERZIBILNI CARNO CIKLUS
Ovaj ciklus je idealan ciklus rashladne mašine. Slika obrnutog Carnotovog ciklusa prikazana je na slici 10. Ciklus se sastoji od istih procesa kao i direktni ciklus, ali stanje p
DRUGI ZAKON TERMODINAMIJE
Prvi zakon termodinamike uspostavlja ekvivalenciju toplote i rada kao dva oblika prenosa energije. Međutim, ovaj zakon ništa ne govori o uslovima za transformaciju toplote i
KOMPRESORI
Motori sa unutrašnjim sagorevanjem (ICE) nazivaju se termičkim klipnim mašinama, u kojima se proizvodi sagorevanja tečnih ili gasovitih goriva koriste kao radni fluid koji sagoreva
MOTORI SA UNUTRAŠNJIM SAGOREVANJEM
Za analizu rada motora sa unutrašnjim sagorevanjem i određivanje glavnih pokazatelja (snaga indikatora, mehanička efikasnost) na radnom cilindru, dijagram indikatora se snima pomoću indikatora itd.
CIKLUSI PLINSKIH TURBINA
Gasnoturbinske jedinice (GTU) imaju značajnu prednost u odnosu na motore sa unutrašnjim sagorevanjem - odsustvo klipnih mehanizama u GTU-ovima omogućava njihovu izgradnju velikom brzinom.
KLIPNI KOMPRESORI
Komprimirani zrak ima široku primjenu u tehnološkim procesima, posebno za pogon pneumatskih mehanizama, čekića, vibratora, pneumatskih dizalica, za transport rasutih materijala.
VODENA PARA
Vodena para kao radni fluid ima široku primenu u parnim turbinama, koje su glavni toplotni motori u termo i nuklearnim elektranama. U kvaliteti
DIJAGRAM VODENE PARE RV- I Ts
Vaporizacija se može izvesti isparavanjem ili ključanjem. Isparavanje se naziva isparavanjem, a događa se samo s površine tekućine. Ovaj proces je oko
DIJAGRAM Hs-VODENE PARE
U inženjerskoj praksi termodinamički procesi s vodenom parom se izračunavaju pomoću hs dijagrama. Ovaj dijagram je izgrađen u SSSR-u do pritiska od 100,0 MPa i temperature od 1000
PARAMETRI VODE I VODENE PARE
U studijama je opšte prihvaćeno da su pri 0 0S i bilo kom pritisku entalpija h0, unutrašnja energija u0, entropija s0 vode jednake nuli. Na slici
CARNO CIKLUS ZA VODENU PARU
Najsavršeniji idealni ciklus parne elektrane je direktni reverzibilni Carnotov ciklus, čija je toplotna efikasnost, kao što je gore navedeno, maksimalna u datom temperaturnom opsegu i ne prelazi
RANKIN CYCLE
Glavni idealni ciklus parnih elektrana je Rankineov ciklus. Slika 24 prikazuje šematski dijagram parne elektrane koja radi po Rankineovom ciklusu, a slika 25 prikazuje rJ- i Ts-di
RANKIN CYCLE
Proučavanje izraza za toplinu efikasnost ciklusa Rankine na različitim početnim (na ulazu u parnu turbinu) i konačnim (na ulazu kondenzatora) parametrima pare nam omogućava da zaključimo da je u početku
WET AIR
Kao radni fluid, atmosferski vazduh se koristi za sušenje, grejanje, hlađenje raznih materijala, u klima uređajima itd. atmosferski vazduh co
VLAŽNI VAZDUH
Prema Daltonovom zakonu, pritisak mješavine plinova jednak je zbiru parcijalnih pritisaka njenih komponenti: pnl.v. = ps.v. + pv.p., (128) &nbs
HD-CHART VLAŽNI ZRAK
Ovaj grafikon vam omogućava da najjednostavnije i najbrže odredite parametre vlažnog zraka. Na Hd dijagramu (Sl. 27, a), sadržaj vlage d (g/kg suvog vazduha) je prikazan duž apscisne ose,
OSNOVNI POJMOVI I DEFINICIJE
Jedan od osnovnih pojmova toplotne provodljivosti je temperaturno polje. Temperatura je jedan od glavnih parametara koji karakterizira termičko stanje radnog fluida ili medija. Agregat
FOURIER ZAKON
Fourierov zakon uspostavlja kvantitativnu vezu između temperaturnog polja i intenziteta širenja topline u njemu kroz provođenje topline. Prema Fourierovom zakonu, ve
U STACIONARNOM REŽIMU
Toplotna provodljivost jednoslojnog ravnog zida. Shema širenja topline za ovaj slučaj prikazana je na slici 30. Neka se toplina širi u zidu omeđenom parom
KONVEKTIVNI PRIJENOS TOPLOTE
U praksi je najčešće potrebno izračunati konvektivni prijenos topline između tekućine (plina) i površine čvrsto telo ili kanal (cijev) kroz koji teče. Ako pr
KADA TEČNOST PROVRI
Prenos toplote tokom ključanja tečnosti je praćen promenom stanje agregacije radno tijelo. Ovaj fenomen ima specifične karakteristike i od velike je praktične važnosti za energetiku
I ZAKONI ZRAČENJA
Prijenos topline zračenjem je proces prijenosa topline u obliku elektromagnetnih valova (fotona). Ova vrsta prenosa toplote se odvija u tri faze: unutrašnja energija tela na početku
PRENOS TOPLOTE ZRAČENJEM
Poznavanje zakona zračenja omogućava da se dobiju proračunske formule za prijenos topline zračenja između tijela. Konkretno, formula (155) se koristi za određivanje emisivnosti
HEAT TRANSFER. OSNOVE ZA PRORAČUN IZMJENJIVAČA TOPLOTE
Podjela procesa prijenosa topline na toplinsku provodljivost, konvektivni prijenos topline i prijenos topline zračenjem pogodna je za njegovo proučavanje. U stvarnosti, postoji složena izmjena toplote,
PRIJENOS TOPLOTE KROZ RAVNI ZID
Neka jednoslojni ravan zid (slika 37) debljine d od materijala čiji koeficijent toplotne provodljivosti l s jedne strane opere vrela tečnost temperature tl1
PRIJENOS TOPLOTE KROZ CILINDRIČNI ZID
U praksi je najčešći element uređaja za izmjenu topline cijev. Dijagram procesa prijenosa topline kroz cilindrični zid (cijev) prikazan je na slici 38.
TOPLINSKA IZOLACIJA
Prilikom rješavanja praktičnih problema prijenosa topline potrebno je ili povećati intenzitet prijenosa topline sa medija za grijanje na grijani, ili, obrnuto, usporiti ovaj proces. Intensi
IZMJENJIVAČI TOPLOTE
Izmjenjivači topline (izmjenjivači topline) su uređaji dizajnirani za prijenos topline sa rashladnog sredstva za grijanje (sa višom temperaturom) na zagrijanu toplinu
ENERGETSKO GORIVO
Energetska goriva su takve zapaljive tvari koje su ekonomski izvodljive kada se spaljuju u tehničkim uređajima za proizvodnju topline. kao gorivo
KONCEPT KONVENCIONALNOG GORIVA
Kalorična vrijednost goriva pokazuje koliko se topline (u kilodžulima) oslobađa tokom potpunog sagorijevanja čvrstog, tekućeg ili plinovitog goriva u normalnim uvjetima.
GLAVNE KOMPONENTE GORIVA
Glavna komponenta zapaljivog dijela goriva je ugljik. Toplota sagorevanja ugljenika je 33.650 kJ/kg. Sadržaj ugljika u zapaljivoj masi goriva je: u antracitu - 87 ... 93%
VRSTE GORIVA
Drvo. Upotreba drveta kao goriva je ograničena. Kalorična vrijednost drva za ogrjev je u velikoj mjeri određena vlažnošću. Što je više vlage u drvetu, to je manje
SUŠTINA PROCESA SAGOREVANJA GORIVA
U zavisnosti od brzine sagorevanja, razlikuju se normalno sagorevanje i eksplozivno sagorevanje. Brzina gorenja je brzina širenja plamena. Tokom normalnog sagorevanja, brzina širenja
ZA POTPUNO SAGOREVANJE GORIVA
Ako je poznat sastav goriva, tada se količina zraka potrebna za potpuno sagorijevanje bilo koje njegove komponente može odrediti iz izraza C + O2 = CO2. E
VOLUME I SASTAV PROIZVODA GORENJA
Za ispravan proračun i odabir jedinica za toplinsku tehniku potrebno je znati količinu nastalih produkata izgaranja. U pravilu se količina produkata sagorijevanja odnosi na 1 kg TV-a
Numeričke vrijednosti entalpija sastavnih proizvoda izgaranja i zraka na različitim temperaturama
Temperatura, K NSO2, kJ/m3 NN2, kJ/m3 NO2, kJ/m3
REFERENTNI INDEKS
Alekseev G. N. Opća toplotna tehnika. - M .: postdiplomske škole, 1980. Andryushchenko AI Osnove termodinamike ciklusa termoelektrana - M., Viša škola. Ar
INSTITUT ZA ENERGETU I AUTOMATIZACIJU
Katedra za termotehniku
I energetski sistemi

TEHNIČKA TERMODINAMIKA
Magnitogorsk
| UVOD ................................................................ ................................................................ ......................... | |
| Tema 1. Predmet i metoda termodinamike ................................................ .. ...................... | |
| Termodinamički sistem ................................................................ ........................................................ | |
| Termodinamički parametri stanja ................................................. ................... ...... | |
| Jednačina stanja ................................................................. ................................................... ......... | |
| Termodinamički proces ................................................................ ........................................................ | |
| Toplotni kapacitet gasova ................................................................ ................................................................... .............. | |
| Tema 2. Mješavine idealnih gasova.................................................................................... | |
| Analitički izraz prvog zakona termodinamike .............................................. .... | |
| Tema 3. Unutrašnja energija ................................................. .. ................................................ | |
| Operacija ekstenzije ................................................................ ................................................................ ......... | |
| Toplota ................................................ ................................................. . ............ | |
| Entalpija................................................ ................................................. . ......... | |
| Entropija................................................ ................................................. . ......... | |
| Tema 4. Opšta formulacija drugog zakona........................................ ........... ................... | |
| Direktan Karnoov ciklus ................................................. ................................................................ ............ | |
| Obrnuti Carnotov ciklus ................................................. ................................................... ......... | |
| Promjena entropije u neravnotežnim procesima .............................................. .... | |
| Tema 5. Termodinamički procesi idealnih gasova u zatvoreni sistemi Oh......... | |
| Eksergija ................................................. ........................................................ ......... ............ | |
| Tema 6. Termodinamički procesi stvarnih gasova ........................................ ...... ..... | |
| Jednačina stanja realnih gasova.................................................. ................... ................. | |
| Tema 7. Jednačina prvog zakona termodinamike za strujanje................................. ........... | |
| Odliv konvergentne mlaznice ................................................. ................... ................... | |
| Glavne zakonitosti strujanja gasa u mlaznicama i difuzorima......................................... ......... | |
| Obračun procesa isteka sa h-s dijagrami ................................. | |
| Prigušivanje gasova i para.................................................. .............................. | |
| Tema 8. Termodinamička efikasnost ciklusa termoelektrana .......... | |
| Ciklusi klipni motori sa unutrašnjim sagorevanjem ................................................. | |
| Ciklusi gasnoturbinskih postrojenja ................................................. ............................................ | |
| Ciklusi parnih turbinskih postrojenja ................................................. ................... ................... | |
| Carnot i Rankine ciklus zasićena para. Rekuperacija topline ................................. | |
| Rankineov ciklus na pregrijanoj pari ............................................ ........................................ | |
| Toplotna efikasnost ciklusa ................................................. ................................................................ ................ | |
| Opskrba toplinom ................................................................ ................................................................ ................ .... |
Tema 9. Teorijski proces višestepeni kompresor
. Kontrolna pitanja za vođenje srednja certifikacija(ispit) na osnovu rezultata savladavanja discipline:
- Suština i formulacije prvog zakona termodinamike.
- Analitički izraz prvog zakona termodinamike.
- Pokažite na P - V dijagramu koristan rad i rad ekspanzije (kompresije) za proizvoljni termodinamički proces.
- Unutrašnja energija i entalpija kao funkcije stanja, njihova povezanost s toplinskim kapacitetom.
- Ono što se zove ukupni toplotni kapacitet.
- Specifični toplinski kapacitet - masa, volumen i molar, njihova oznaka i dimenzija.
- Koji je toplinski kapacitet veći - izobaričan ili izohoričan i zašto.
- Osnovni termodinamički procesi, njihov prikaz na P–V i T–S dijagramima.
- Odnos parametara za osnovne termodinamičke procese.
- Proračun adijabatskog procesa pomoću funkcija 0 i 0 .
- Reverzibilni i ireverzibilni procesi, glavni uzroci ireverzibilnosti.
- Nacrtajte na T - S dijagramu reverzibilni i nepovratni adijabatski proces širenja i kontrakcije.
- Suština i formulacije drugog zakona termodinamike.
- Analitički izraz drugog zakona termodinamike za reverzibilne i ireverzibilne procese.
- Entropija kao funkcija stanja, fizičko značenje entropija.
- Ono što se zove termodinamički ciklus.
- Direktno i obrnuto termodinamički ciklusi.
- Kako procijeniti efikasnost direktnog i obrnutog ciklusa.
- dijagram strujnog kola toplotni motor i rashladno postrojenje.
- Direktni Carnotov ciklus, njegova termička efikasnost, slika na dijagramima stanja.
- Realni plinovi, Van-der-Waalsova jednadžba stanja.
- Fazni P-T dijagram za normalnu i anomalnu materiju.
- Pokažite na T-S dijagramu toplinu utrošenu na isparavanje.
- Vodena para - zasićena (suha i mokra) i pregrijana - definicije.
- Dijagrami stanja vodene pare P - V, T - S, h - S.
- Kritički i trostruki poen.
- Termodinamički procesi vodene pare na dijagramima stanja.
28. Jednačina prvog zakona termodinamike za strujanje radnog fluida.
30.Kako definirati profil kanala.
31. Koja mlaznica je potrebna za postizanje nadzvučne brzine.
32. Koji se proces naziva prigušivanjem.
33. Opišite proces prigušivanja na h - s dijagramu.
34. Kako se mijenjaju parametri radnog fluida u procesu prigušivanja.
35. Koji je od tri procesa kompresije u kompresoru (izotermni, adijabatski, politropski) najkorisniji i zašto.
36. Višestepena kompresija, njene prednosti u odnosu na jednostepeni kompresor.
37. Ciklusi motora sa unutrašnjim sagorevanjem, njihovo poređenje.
38. Ciklusi gasnoturbinskih postrojenja, njihovo poređenje.
39. Metode za poboljšanje efikasnosti gasnoturbinskih postrojenja.
40. Carnotov ciklus za vodenu paru.
41. Šematski dijagram parnoturbinskog postrojenja.
42. Rankineov ciklus sa zasićena para, njegova termička efikasnost.
43. Rankineov ciklus sa pregrijanom parom, njegova termička efikasnost.
44. Realni Rankineov ciklus, definicija apsolutne interne efikasnosti.
45. Utjecaj početnih i konačnih parametara pare na termičku efikasnost.
46. Šema i ciklus parnoturbinskog postrojenja sa međuzagrevanjem pare.
47. Napišite formulu za termičku efikasnost ciklusa sa ponovnim zagrijavanjem.
48. Koji ciklus se naziva regenerativnim.
49. Šema i ciklus parnoturbinskog postrojenja sa regenerativnim ekstrakcijama.
50. Napišite formulu za termičku efikasnost regenerativnog ciklusa.
51. Termodinamičke osnove daljinskog grijanja.
52. Faktor iskorišćenja toplote (KIT).
53. Ciklusi nuklearnih elektrana, izgledi za korištenje atomske energije.
54. Binarni ciklusi (para - para i para - gas).
55. Proračun toplotne efikasnosti binarnih instalacija.
56. Bezmašinsko (direktno) pretvaranje toplotne energije u električnu energiju.
57. Šema, ciklus i termička efikasnost instalacije sa MHD generatorima.
58. Rashladni uređaji - kompresija plina i pare.
59. Šta se zove toplotna pumpa, kako proceniti njenu efikasnost.
60. Prvi i drugi zakon termodinamike za hemijske sisteme
TEMA 1
Predmet i metoda termodinamike
Termodinamikaproučava zakone konverzije energije u različitim procesima koji se odvijaju u makroskopskim sistemima i praćeni termičkim efektima. Makroskopski sistem je svaki materijalni objekat koji se sastoji od veliki brojčestice. Veličine makroskopskih sistema su neuporedivo veće od veličina molekula i atoma.
Ovisno o ciljevima studija, razmatraju tehničku ili hemijsku termodinamiku, termodinamiku bioloških sistema itd. Tehnička termodinamika proučava obrasce međusobne transformacije termičkih i mehanička energija i svojstva tijela koja su uključena u ove transformacije. Na osnovu njega se vrši proračun i projektovanje svih toplotnih motora, kao i svih vrsta tehnološke opreme.
Uzimajući u obzir samo makroskopske sisteme, termodinamika proučava pravilnosti termičkog oblika kretanja materije, zbog prisustva ogromnog broja mikrostrukturnih čestica koje se neprekidno kreću i međusobno deluju (molekula, atoma, jona).
Physical Properties makroskopski sistemi se proučavaju statističkim termodinamičkim metodama. Statistički metod se zasniva na korišćenju teorije verovatnoće i određenih modela strukture ovih sistema i sadržaj je statističke fizike. Termodinamička metoda ne zahtijeva uključivanje modelskih ideja o strukturi materije i jeste fenomenološki(tj. razmatra "fenomene" - fenomene u cjelini).
U ovom slučaju, svi glavni zaključci termodinamike mogu se dobiti dedukcijom, koristeći samo dva osnovna empirijska zakona termodinamike.
U budućnosti ćemo, na osnovu termodinamičke metode, za jasnoću koristiti molekularno-kinetičke ideje o strukturi materije.
Termodinamički sistem
Termodinamički sistem je skup materijalnih tijela koja su u mehaničkim i termičkim interakcijama jedno s drugim i sa vanjskim tijelima koja okružuju sistem(„eksterno okruženje“).
Izbor sistema je proizvoljan i diktiran je uslovima problema koji se rešava. Pozivaju se tijela koja nisu uključena u sistem okruženje. Sistem je odvojen od okoline kontrolna površina(ljuska). Tako, na primjer, za najjednostavniji sistem - plin zatvoren u cilindar ispod klipa, vanjsko okruženje je okolni zrak, a zidovi cilindra i klip služe kao kontrolne površine.
Mehaničke i termičke interakcije termodinamičkog sistema se izvode preko upravljačkih površina. Tokom mehaničke interakcije od strane samog sistema ili na sistemu, rad se obavlja. (U opštem slučaju na sistem mogu uticati i električne, magnetske i druge sile, pod čijim uticajem će sistem obavljati rad. Ove vrste rada se takođe mogu uzeti u obzir u okviru termodinamike, ali ćemo ne razmatrati ih dalje). U našem primjeru, mehanički rad se izvodi pomicanjem klipa i praćen je promjenom volumena. Toplotna interakcija se sastoji u prijenosu topline između pojedinačnih tijela sistema i između sistema i okoline. U primjeru koji se razmatra, toplina se plinu može dovesti kroz stijenke cilindra.
U najopštijem slučaju, sistem može da razmenjuje sa okolinom i materijom (interakcija prenosa mase). Takav sistem se zove otvoren. Tokovi plina ili pare u turbinama i cjevovodima - primjeri otvoreni sistemi. Ako supstanca ne prolazi kroz granice sistema, onda se naziva zatvorena. U nastavku, osim ako nije drugačije navedeno, razmatraćemo zatvorene sisteme.
Termodinamički sistem koji ne može da razmenjuje toplotu sa okolinom se naziva termoizolovano ili adijabatski. Primjer adijabatskog sistema je plin u posudi čiji su zidovi prekriveni idealnom toplinskom izolacijom, koja isključuje razmjenu topline između plina sadržanog u posudi i okolnih tijela. Takva izolacijska školjka naziva se adijabatskom. Sistem koji ne razmjenjuje energiju ili materiju sa svojom okolinom naziva se izolovan(ili zatvoreno).
Najjednostavniji termodinamički sistem je radni fluid koji vrši međusobnu transformaciju toplote i rada. U motoru sa unutrašnjim sagorevanjem, na primer, radni fluid je zapaljiva mešavina pripremljena u karburatoru, koja se sastoji od vazduha i benzinskih para.
Parametri termodinamičkog stanja
Svojstva svakog sistema karakteriše niz veličina, koje se obično nazivaju termodinamičkim parametrima. Razmotrimo neke od njih, koristeći molekularno-kinetičke koncepte poznate iz kursa fizike o idealnom gasu kao skupu molekula koje imaju nestajuće male veličine, nalaze se u nasumičnom toplotnom kretanju i međusobno deluju samo tokom sudara.
Pritisak zbog interakcije molekula radnog fluida s površinom i numerički je jednaka sili koja djeluje po jedinici površine površine tijela duž normale na potonju. U skladu s molekularno kinetičkom teorijom, tlak plina je određen relacijom
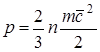 , (1.1)
, (1.1)
gdje je F sila; f-površina; n- broj molekula po jedinici zapremine;
t je masa molekula; od 2- RMS brzina kretanje napred molekule.
AT međunarodni sistem jedinica (SI) pritisak se izražava u pascalima (1 Pa = 1 N / m 2). Budući da je ova jedinica mala, pogodnije je koristiti 1 kPa = 1000 Pa i 1 MPa = 10 6 Pa.
Pritisak se mjeri pomoću manometara, barometara i vakuum mjerača.
Manometri za tečnost i opruge izmjerite manometarski tlak, koji je razlika između ukupnog ili apsolutnog tlaka R izmjereni srednji i atmosferski pritisak str bankomat, tj. ![]()
Uređaji za mjerenje tlakova ispod atmosferskog nazivaju se vakuum mjerači; njihova očitavanja daju vrijednost vakuuma (ili vakuuma):
![]() ,
tj. višak atmosferski pritisak preko apsoluta.
,
tj. višak atmosferski pritisak preko apsoluta.
Imajte na umu da je parametar stanja apsolutni pritisak. To je ono što ulazi u termodinamičke jednačine.
temperatura naziva se fizička veličina koja karakteriše stepen zagrevanja tela. Koncept temperature proizlazi iz sljedeće tvrdnje: ako su dva sistema u termičkom kontaktu, onda ako njihove temperature nisu jednake, oni će međusobno razmjenjivati toplinu, ali ako su im temperature jednake, onda neće biti izmjene topline.
Sa stanovišta molekularno-kinetičkih koncepata, temperatura je mjera intenzitet toplotnog kretanja molekula. Njegova numerička vrijednost povezana je s vrijednošću prosječne kinetičke energije molekula tvari:
U sistemu SI, jedinica temperature je kelvin (K); u praksi se široko koristi stepen Celzijus (°C). Odnos između apsolutnih T i Celzijus I temperature ima oblik
![]() .
.
U industrijskim i laboratorijskim uslovima temperatura se meri pomoću termometara za tečnost, pirometara, termoparova i drugih instrumenata.
Specifičan volumen v - je zapremina po jedinici mase supstance. Ako je homogeno tijelo mase M zauzima zapreminu v, onda po definiciji
v= V/M.
U SI sistemu jedinica specifične zapremine je 1 m 3 /kg. Postoji očigledan odnos između specifične zapremine supstance i njene gustine:
Da bismo uporedili veličine koje karakterišu sisteme u istim stanjima, uvodi se koncept "normalnih fizičkih uslova":
str\u003d 760 mm Hg \u003d 101,325 kPa; T=273,15 K.
U raznim granama tehnologije i različite zemlje uvode svoje “normalne uslove” nešto drugačije od onih datih, na primjer, “tehničke” ( str\u003d 735,6 mm Hg \u003d 98 kPa, t=15˚C) ili normalni uslovi za procenu performansi kompresora ( str=101,325 kPa, t=20˚S) itd.
Ako su svi termodinamički parametri konstantni u vremenu i isti u svim tačkama sistema, onda se ovo stanje sistema nazivaravnoteža.
Ako postoje razlike u temperaturi, pritisku i drugim parametrima između različitih tačaka u sistemu, onda jesteneravnoteža. U takvom sistemu, pod uticajem gradijenata parametara, nastaju tokovi toplote, supstanci i drugih, koji teže da ga vrate u stanje ravnoteže. Iskustvo to pokazuje izolovani sistem tokom vremena uvijek dolazi u stanje ravnoteže i nikada ne može spontano izaći iz njega. U klasičnoj termodinamici razmatraju se samo ravnotežni sistemi.
Jednačina stanja
Za ravnotežni termodinamički sistem postoji funkcionalni odnos između parametara stanja, koji se naziva jednačina stanja. Iskustvo pokazuje da su specifična zapremina, temperatura i pritisak najjednostavnijih sistema, a to su gasovi, pare ili tečnosti, povezani termička jednačina view states ![]() .
.
Jednačina stanja može dobiti drugi oblik: ![]()
Ove jednačine pokazuju da su od tri glavna parametra koja određuju stanje sistema, bilo koja dva nezavisna.
Za rješavanje problema termodinamičkim metodama apsolutno je neophodno poznavati jednačinu stanja. Međutim, on se ne može dobiti u okviru termodinamike i mora se pronaći bilo eksperimentalno ili metodama statističke fizike. Specifičan oblik jednačine stanja zavisi od individualnih svojstava supstance.
Jednačina stanja idealnih gasova
Jednačine (1.1) i (1.2) to impliciraju .
Uzmite u obzir 1 kg gasa. S obzirom da sadrži N molekule i, prema tome, dobijamo: ![]() .
.
Konstantna vrijednost nk, odnosi se na 1 kg gasa, označenog slovom R i nazovi gasna konstanta. Zbog toga
Ili . (1.3)
Rezultirajuća relacija je Clapeyronova jednačina.
Množenje (1.3) sa M, dobijamo jednačinu stanja za proizvoljnu masu gasa M:
Clapeyronova jednačina može dobiti univerzalni oblik ako se plinska konstanta odnosi na 1 kmol plina, odnosno na količinu plina čija je masa u kilogramima numerički jednaka molekulskoj masi μ. Stavljanje (1.4) M=μ i V=V μ, dobijamo za jedan mol Clapeyron - Mendelejev jednadžba:
Ovdje je zapremina kilomola gasa i univerzalna plinska konstanta.
U skladu sa Avogadrovim zakonom (1811), zapremina 1 kmola, koja je ista pod istim uslovima za sve idealne gasove, u normalnim fizičkim uslovima iznosi 22,4136 m 3 , dakle
Gasna konstanta 1 kg plina je .
Jednačina stanja realnih gasova
U pravim gasovima in razlika od idealnog su značajne sile međumolekulskih interakcija (privlačne sile kada su molekuli na znatnoj udaljenosti, a sile odbijanja kada su dovoljno blizu jedna drugoj) i ne može se zanemariti unutrašnji volumen molekula.
Prisutnost međumolekularnih odbojnih sila dovodi do činjenice da se molekule mogu približiti jedna drugoj samo do određene minimalne udaljenosti. Stoga možemo pretpostaviti da će volumen slobodan za kretanje molekula biti jednak , gdje b je najmanja zapremina do koje se gas može komprimovati. U skladu s tim, srednja slobodna putanja molekula se smanjuje i broj udaraca o zid u jedinici vremena, a samim tim i pritisak raste u odnosu na idealni gas u odnosu na , tj.
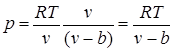 .
.
Privlačne sile djeluju u istom smjeru kao i vanjski pritisak i dovode do molekularnog (ili unutrašnjeg) pritiska. Sila molekularne privlačnosti bilo koja dva mala dijela plina proporcionalna je proizvodu broja molekula u svakom od ovih dijelova, odnosno kvadratu gustine, pa je molekulski pritisak obrnuto proporcionalan kvadratu specifična zapremina gasa: rmol= a/ v 2 , gdje a - koeficijent proporcionalnosti, u zavisnosti od prirode gasa.
Iz ovoga dobijamo van der Waalsovu jednačinu (1873):
![]() ,
,
Na slobodi specifične količine i relativno niskim pritiscima realnog gasa, van der Waalsova jednačina se praktično degeneriše u jednačinu stanja idealan gas Clapeyron, za veličinu a/v 2
(u odnosu na p) i b(u odnosu na v) postati zanemarljiv.
Kvalitativno, van der Waalsova jednadžba prilično dobro opisuje svojstva stvarnog plina, ali rezultati numeričkih proračuna se ne slažu uvijek s eksperimentalnim podacima. U velikom broju slučajeva ova odstupanja se objašnjavaju težnjom stvarnih molekula gasa da se udruže u zasebne grupe koje se sastoje od dva, tri ili više molekula. Asocijacija nastaje zbog asimetrije vanjskog električnog polja molekula. Dobijeni kompleksi se ponašaju kao nezavisne nestabilne čestice. Tokom sudara se raspadaju, zatim rekombinuju sa drugim molekulima, itd. Kako temperatura raste, koncentracija kompleksa sa veliki broj molekula se brzo smanjuje, dok se udio pojedinačnih molekula povećava. Polarne molekule vodene pare pokazuju veću sklonost ka asocijaciji.
Termodinamički proces
Promjena stanja termodinamičkog sistema s vremenom se naziva termodinamički proces. Dakle, kada se klip kreće u cilindru, zapremina, a sa njom i pritisak i temperatura gasa unutra, će se promeniti, odvijaće se proces širenja ili kompresije gasa.
Kao što je već napomenuto, sistem, izveden iz stanja ravnoteže, i prepušten sam sebi pri konstantnim parametrima okoline, nakon nekog vremena će ponovo doći u stanje ravnoteže koje odgovara ovim parametrima. Takav spontani (bez spoljašnjeg uticaja) povratak sistema u stanje ravnoteže
pozvao opuštanje, i naziva se vremenski interval tokom kojeg se sistem vraća u ravnotežu vrijeme opuštanja. Za različiti procesi drugačije je: ako je uvijek potrebno uspostaviti ravnotežni tlak u plinu, tada je potrebno deset za izjednačavanje temperature u zapremini istog plina; minuta, a u zapremini zagrijane čvrste supstance - ponekad i nekoliko sati.
Termodinamički proces se nazivaravnoteža, ako se svi parametri sistema tokom njegovog kursa menjaju prilično sporo u odnosu na odgovarajući proces relaksacije. U ovom slučaju, sistem je zapravo cijelo vrijeme u stanju ravnoteže sa okolinom, što određuje naziv procesa.
Da bi proces bio ravnotežan, brzina promjene parametara sistema mora zadovoljiti relaciju
gdje ALI- parametar koji se najbrže mijenja u procesu koji se razmatra; With rel - brzina promjene ovog parametra u procesu relaksacije; τ rel - vrijeme opuštanja.
Razmotrimo, na primjer, proces kompresije plina u cilindru. Ako vrijeme pomaka klipa iz jednog položaja u drugi značajno premašuje vrijeme opuštanja, tada će u procesu pomicanja klipa tlak i temperatura imati vremena da se izjednače u cijelom volumenu cilindra.
Ovo poravnanje je osigurano kontinuiranim sudarom molekula, zbog čega se energija dovedena od klipa do plina prilično brzo i ravnomjerno raspoređuje između njih. Ako se naknadni pomaci klipa dešavaju na sličan način, tada će stanje sistema u svakom trenutku biti praktično ravnotežno. Na ovaj način, ravnotežni proces se sastoji od kontinuiranog niza uzastopnih ravnotežnih stanja, stoga se u svakoj njegovoj tački stanje termodinamičkog sistema može opisati jednačinom stanja datog radnog fluida. Zato klasična termodinamika u svojim istraživanjima operiše samo sa ravnotežnim procesima. Oni su pogodna idealizacija stvarnih procesa, omogućavajući u mnogim slučajevima da se značajno pojednostavi rješenje problema. Ova idealizacija je sasvim opravdana, jer je uslov (1.8) prilično često zadovoljen u praksi. Budući da se mehanički poremećaji šire u plinovima brzinom zvuka, proces kompresije plina i cilindara će biti u ravnoteži ako je brzina klipa mnogo manja od brzine zvuka.
Procesi koji ne zadovoljavaju uslov, nastaviti sa neravnotežom, tj. suneravnoteža. Ako, na primjer, brzo poveća temperaturu okoline, tada će se plin u cilindru postupno zagrijavati kroz njegove zidove, opuštajući se do ravnotežnog stanja koje odgovara novim parametrima okoline. U procesu relaksacije, gas nije u ravnoteži sa okolinom i ne može se okarakterisati jednačinom stanja, makar samo zato što u različite tačke zapremina temperature gasa ima različite vrednosti.
Toplotni kapacitet gasova
Omjer količine topline koju primi tijelo s beskonačno malom promjenom svog stanja i promjenom tjelesne temperature koja je povezana s tim naziva se toplotni kapacitet tijela u ovom procesu:
Obično se toplinski kapacitet odnosi na jedinicu količine tvari i, ovisno o odabranoj jedinici, razlikuju se:
specifični maseni toplotni kapacitetc , odnosi se na 1 kg plina,
J/(kg K);
specifični zapreminski toplotni kapacitetc´, odnosi se na količinu gasa sadržanu u 1 m 3 zapremine u normalnim fizičkim uslovima, J / (m 3 ·K);
specifični molarni toplotni kapacitet , odnosi se na jedan kilomol, J / (kmol K).
Odnos između specifični toplotni kapaciteti uspostavlja se očiglednim odnosima: ;
Evo gustine gasa u normalnim uslovima.
Promjena tjelesne temperature sa istom količinom dovedene topline ovisi o prirodi procesa koji se odvija toplinski kapacitet je funkcija procesa. To znači da isti radni fluid, u zavisnosti od procesa, zahteva različitu količinu toplote za zagrevanje za 1 K. Numerički, vrijednost c varira od +∞ do -∞.
U termodinamičkim proračunima od velikog su značaja:
toplotni kapacitet pri konstantnom pritisku
jednak omjeru količine topline prenesene tijelu u procesu pri konstantnom pritisku i promjene tjelesne temperature dT
toplotni kapacitet pri konstantnoj zapremini
, (1.5)
jednak omjeru količine topline , doveden u tijelo u procesu na konstantan volumen, do promjene tjelesne temperature .
U skladu sa prvim zakonom termodinamike za zatvorene sisteme u kojima se odvijaju ravnotežni procesi ![]() , i
, i
Za izohorni proces ( v=const) ova jednačina ima oblik ![]() , i, uzimajući u obzir (1.5), dobijamo da
, i, uzimajući u obzir (1.5), dobijamo da
![]() ,
,
tj. toplinski kapacitet tijela pri konstantnoj zapremini jednak je parcijalnom derivatu njegove unutrašnje energije u odnosu na temperaturu i karakteriše brzinu rasta unutrašnje energije u izohoričnom procesu sa porastom temperature.
Za idealan gas
Za izobarni proces iz jednačina (2.16) i (2.14) dobijamo
Ova jednačina pokazuje odnos između toplotnih kapaciteta sa str i životopis. Za idealan gas, to je znatno pojednostavljeno. Zaista, unutrašnja energija idealnog gasa određena je samo njegovom temperaturom i ne zavisi od zapremine, stoga i, pored toga, sledi iz jednačine stanja ![]() , gdje
, gdje
Ovaj omjer se zove Mayerova jednadžba i jedan je od glavnih idealnih plinova u tehničkoj termodinamici.
U procesu v\u003d const toplina koja se prenosi plinu ide samo na promjenu njegove unutrašnje energije, dok u tom procesu R= konstantna toplota se troši i na povećanje unutrašnje energije i na rad protiv spoljašnjih sila. Zbog toga sa str više životopis veličina ovog rada.
Za prave gasove, od kada se šire (at str= const) rad se vrši ne samo protiv vanjskih sila, već i protiv sila privlačenja koje djeluju između molekula, što uzrokuje dodatnu potrošnju topline.
Obično se toplinski kapaciteti određuju eksperimentalno, ali se za mnoge tvari mogu izračunati metodama statistička fizika.
Rezultati klasične teorije toplotnog kapaciteta dobro se slažu sa eksperimentalnim podacima u oblasti sobnih temperatura (tabela 2.1), ali eksperiment ne potvrđuje glavni zaključak o nezavisnosti od temperature. Neslaganja, posebno značajna u regionu niskih i dovoljnih visoke temperature, odnose se na kvantno ponašanje molekula i pronalaze objašnjenja u terminima kvantna teorija toplotni kapacitet.
Toplotni kapacitet nekih gasova pri t= 0°C u stanju idealnog gasa
Ova teorija utvrđuje, prije svega, nepravednost teoreme o ravnomjernoj raspodjeli energije po stepenu slobode u području niskih i visokih temperatura. Kako temperatura plina opada, broj stupnjeva slobode molekula se smrzava. Dakle, za dvoatomski molekul „smrzavaju“ se rotacioni stepeni slobode i umesto pet, on ima tri stepena slobode, a samim tim niži unutrašnji energetski i toplotni kapacitet. Sa povećanjem temperature, poliatomski molekuli pobuđuju unutrašnje stupnjeve slobode zbog pojave vibracijskog kretanja atoma molekula (molekul postaje oscilator). To dovodi do povećanja unutrašnje energije i, posljedično, toplinskog kapaciteta s povećanjem temperature.
Toplotni kapacitet pravog gasa zavisi od pritiska, međutim, veoma slabo.
Budući da toplinski kapacitet stvarnog plina ovisi o temperaturi, termodinamika razlikuje pravi i prosječni toplinski kapacitet.
Prosječan toplinski kapacitet With sri ovaj proces u temperaturnom opsegu od t1 prije t2 je omjer količine topline dovedene u plin i razlike između konačne i početne temperature:
![]()
Izraz
određuje toplotni kapacitet na datoj temperaturi ili tzv pravi toplotni kapacitet. Iz * slijedi da
 .
.
Za praktične proračune, toplotni kapaciteti svih supstanci su tabelarno, a kako bi se smanjio volumen tabela, u njima su dati prosječni toplinski kapaciteti za temperaturni raspon od 0 do t.
PREDAVANJE 2
Smjese idealnih plinova
Sve gore dobivene ovisnosti za idealne plinove vrijede i za njihove mješavine, ako se u njih zamjene plinska konstanta, molekulska težina i toplinski kapacitet smjese.
Daltonov zakon. U inženjerskoj praksi se često mora suočiti sa gasovitim supstancama koje su po svojstvima slične idealnim gasovima i predstavljaju mehaničku mešavinu pojedinačnih komponenti različitih gasova koji međusobno hemijski ne reaguju. To su tzv gasne mešavine. Primjeri uključuju produkte sagorijevanja goriva u motorima s unutarnjim sagorijevanjem, pećima i parnim kotlovima, vlažni zrak u postrojenjima za sušenje itd.
Glavni zakon koji određuje ponašanje mješavine plinova je Daltonov zakon: ukupni tlak mješavine idealnih plinova jednak je zbroju parcijalnih pritisaka svih njenih komponenti:
Parcijalni pritisak pi- pritisak koji bi gas imao da sam zauzima celu zapreminu smeše na istoj temperaturi.
Metode postavljanja smjese. Sastav plinske mješavine može se odrediti prema masi, zapremini ili molskim udjelima.
Maseni udio je omjer mase jedne komponente Mi, na masu smjese M:
Očigledno je da i .
Maseni udjeli se često daju u procentima. Na primjer, za suhi zrak; .
Volumetrijski frakcija je odnos redukovane zapremine gasa V, prema ukupnoj zapremini smeše V: .
Dato je zapremina koju bi komponenta gasa zauzela kada bi njen pritisak i temperatura bili jednaki pritisku i temperaturi smeše.
Da bismo izračunali smanjeni volumen, pišemo dvije jednačine stanja i-ta komponenta:
![]() ; (2.1)
; (2.1)
![]() .
.
Prva jednadžba se odnosi na stanje gasne komponente u smjesi kada ima parcijalni pritisak pi i zauzima puni volumen smjese, a druga jednadžba - do reduciranog stanja, kada su tlak i temperatura komponente jednaki, kao i za smjesu, R i T. Iz jednačina slijedi da
Sumirajući relaciju (2.2) za sve komponente smjese dobivamo, uzimajući u obzir Daltonov zakon, odakle . Zapreminski udjeli se također često daju u procentima. Za vazduh,.
Ponekad je prikladnije odrediti sastav smjese u molskim frakcijama. Mol frakcija naziva se odnos broja molova Ni komponente koja se razmatra na ukupan broj molova smjese N.
Neka se mešavina gasova sastoji od N1 molovi prve komponente, N2 mola druge komponente, itd. Broj molova smjese i molski udio komponente bit će jednaki .
U skladu sa Avogadrovim zakonom, zapremine mola bilo kog gasa su istovremeno R i T, posebno, na temperaturi i pritisku smeše, u stanju idealnog gasa oni su isti. Stoga se smanjeni volumen bilo koje komponente može izračunati kao proizvod zapremine mola sa brojem molova ove komponente, odnosno zapremine mješavine - po formuli. Onda ![]() , i, shodno tome, dodjela miješanja plinova po molskim udjelima jednaka je dodjeli po njegovim zapreminskim udjelima.
, i, shodno tome, dodjela miješanja plinova po molskim udjelima jednaka je dodjeli po njegovim zapreminskim udjelima.
Gasna konstanta mješavine plinova. Zbrajanjem jednačina (2.1) za sve komponente smjese dobijamo 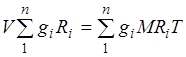 . S obzirom na , možemo pisati
. S obzirom na , možemo pisati
![]() , (2.3)
, (2.3)
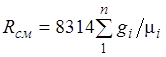 . (2.4)
. (2.4)
Jednačina (2.3) implicira da mješavina idealnih plinova također ispunjava Clapeyronovu jednačinu. Zbog ![]() onda iz (2.4) slijedi da plinska konstanta smjese [J/(kg-K)] ima oblik
onda iz (2.4) slijedi da plinska konstanta smjese [J/(kg-K)] ima oblik
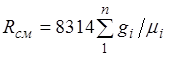 (2.5)
(2.5)
Prividna molekulska težina smjese. Izrazimo formalno plinsku konstantu smjese R, uvođenjem prividne očne mase mješavine: ![]() (2.6)
(2.6)
Upoređujući desne strane relacija (2.5) i (2.6), nalazimo
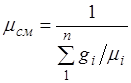 .
.
Iz definicije masenih udjela slijedi da
Sumirajući ovaj omjer za sve komponente i uzimajući u obzir to, dobivamo izraz za prividnu molekulsku težinu i masu smjese, date volumnim udjelima:
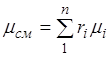 . (2.7)
. (2.7)
Odnos volumnog i masenog udjela. Uzimajući u obzir (2.7), dobijamo 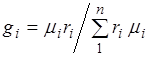 .
.
Zbog 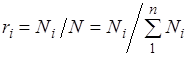 , onda
, onda
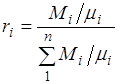
Podijelimo brojilac i imenilac ove formule masom smjese M, dobivamo
 .
.
Analitički izraz prvog zakona termodinamike
Prvi zakon termodinamike je poseban slučaj univerzalnog zakona održanja i transformacije energije primijenjenog na toplinske fenomene. Prema Ajnštajnovoj jednačini potrebno je razmotriti jedinstveni zakon održanja i transformacije mase i energije. Međutim, u tehničkoj termodinamici imamo posla sa tako malim brzinama objekta da je defekt mase jednak nuli, pa se stoga zakon održanja energije može posmatrati nezavisno.
Zakon održanja i transformacije energije je temeljni zakon prirode, koji se dobija na osnovu generalizacije ogromne količine eksperimentalnih podataka i primjenjiv je na sve prirodne pojave. On tvrdi da energija ne nestaje i ne nastaje ponovo, ona samo prelazi iz jednog oblika u drugi, a smanjenje energije jedne vrste daje ekvivalentnu količinu energije druge vrste.
Naš sunarodnik M. V. Lomonosov (1711 - 1765) bio je među prvim naučnicima koji su potvrdili princip očuvanja materije i energije.
Neka neko radno tijelo sa zapreminom V i težinu M, imaju temperaturu T i pritisak R, beskonačno mala količina toplote se prenosi izvana. Kao rezultat opskrbe toplinom, tijelo se zagrijava dT i povećava volumen dV.
Povećanje tjelesne temperature ukazuje na povećanje kinetičke energije njegovih čestica. Povećanje volumena tijela dovodi do promjene potencijalne energije čestica. Kao rezultat, unutrašnja energija tijela se povećava za dU. Pošto je radni fluid okružen medijumom koji vrši pritisak na njega, kada se širi, on vrši mehanički rad protiv sila spoljašnjeg pritiska. Pošto se u sistemu ne dešavaju nikakve druge promene, onda po zakonu održanja energije
![]() (2.8)
(2.8)
tj. toplota koja se prenosi sistemu ide na povećanje njegove unutrašnje energije i za obavljanje spoljašnjeg rada.
Rezultirajuća jednačina je matematički izraz prvog zakona termodinamike. Svaki od tri člana ovog omjera može biti pozitivan, negativan ili nula. Razmotrimo neke posebne slučajeve.
1. - nema razmene toplote između sistema i okoline, odnosno toplota se ne dovodi u sistem i ne odvodi se iz njega. Proces bez razmjene topline naziva se adijabatski. Za to, jednačina (2.8) ima oblik:
Dakle, rad na proširenju koji je obavio sistem u adijabatski proces, jednako je smanjenju unutrašnje energije datog sistema. Sa adijabatskom kompresijom radnog fluida, rad utrošen izvana u potpunosti ide na povećanje unutrašnje energije sistema.
2. - dok se volumen tijela ne mijenja, dV=0 . Takav proces se zove izohorni, za njega
tj. količina toplote koja se dovodi u sistem pri konstantnoj zapremini jednaka je povećanju unutrašnje energije ovog sistema.
3. dU=0– unutrašnja energija sistema se ne menja i
one. Toplota dostavljena sistemu pretvara se u vanjski rad koji je njemu ekvivalentan.
Za sistem koji sadrži 1 kg radnog fluida
![]() . (2.9)
. (2.9)
Integracijom jednadžbi (2.8) i (2.9) za neki proces dobijamo izraz za prvi zakon termodinamike u integralni oblik:
![]() ; .
; .
Unutrašnja energija
Unutrašnja energija sistema uključuje:
kinetička energija translacionog, rotacionog i vibracionog kretanja čestica;
potencijalna energija interakcije čestica;
energije elektronske ljuske atomi;
intranuklearna energija.
U većini toplotnih i energetskih procesa, posljednje dvije komponente ostaju nepromijenjene. Stoga, u budućnosti ispodunutrašnja energija razumjet ćemo energiju haotičnog kretanja molekula i atoma, uključujući energiju translacije, rotacije i oscilatorna kretanja molekularne i intramolekularne, kao i potencijalnu energiju sila interakcije između molekula.
Kinetička energija molekula je funkcija temperature, vrijednost potencijalne energije ovisi o prosječnoj udaljenosti između molekula i, prema tome, o zapremini koju zauzima plin V, tj. je funkcija v. Stoga unutrašnja energija U je funkcija stanja tijela.
Za složen sistem određen je zbirom energija pojedinih dijelova, tj. ima svojstvo aditivnosti. Vrijednost u=U/M, pozvao specifični interni energija (J/kg), je unutrašnja energija jedinice mase supstance.
U nastavku ćemo se, radi sažetosti, osvrnuti na količinu i samo unutrašnja energija. Budući da je unutrašnja energija funkcija stanja tijela, može se predstaviti kao funkcija bilo koja dva nezavisna parametra koja određuju ovo stanje:
; ; .
Njegova promjena u termodinamičkom procesu ne ovisi o prirodi procesa i određena je samo početnim i konačnim stanjima tijela:
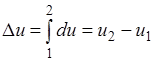 ;
;
Vrijednost unutrašnje energije u početnom stanju, i - u konačnom. Matematički to znači beskonačno malu promjenu unutrašnje energije du tu je totalni diferencijal i; ako unutrašnju energiju izrazimo kao funkciju specifične zapremine i temperature, onda
Unutrašnja energija idealnog gasa, u kojem nema interakcijskih sila između molekula, ne zavisi od zapremine ili pritiska gasa, a je određena samo njegovom temperaturom, pa je izvod unutrašnje energije idealnog gasa u odnosu na temperaturu ukupni izvod:
Za probleme tehničke termodinamike nije bitna apsolutna vrijednost unutrašnje energije, već njena promjena u različitim termodinamički procesi. Dakle, porijeklo unutrašnje energije može se birati proizvoljno. Na primjer, u skladu s međunarodnim sporazumom za vodu, vrijednost unutrašnje energije na temperaturi od 0,01 ° C i pritisku od 610,8 Pa uzima se kao nula, a za idealne plinove - na 0 ° C, bez obzira na pritisak.
Rad na proširenju
Rad u termodinamici, kao i u mehanici, određen je proizvodom sile koja djeluje na radno tijelo i putanjom njegovog djelovanja.
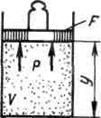
Zamislite gas sa masom M i volumen V, zatvoren u elastičnu ljusku površine F.
 |
Ako se plinu preda određena količina topline, on će se proširiti, dok radi protiv vanjskog pritiska R, koje na njega vrši okolina. Gas djeluje na svaki element ljuske dF sa silom jednakom pdf i pomerajući ga duž normale na površinu na daljinu dn, obavezuje elementarni rad pdfdn. Ukupan rad obavljen tokom infinitezimalnog procesa može se dobiti integracijom ovog izraza preko cijele površine Fškoljke: ![]() .
.
Sa slike se vidi da se jačina zvuka menja dV izraženo kao integral po površini: ![]() ,
Shodno tome
,
Shodno tome
Sa konačnom promjenom zapremine, rad protiv sila vanjskog pritiska, tzv rad na proširenju, je jednako
Iz (3.1) slijedi da i dV uvek imam identični znaci:
ako dV>0, tada i > 0, tj. tokom širenja, rad tijela je pozitivan, dok samo tijelo obavlja posao;
ako dV<0, zatim i<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
Pripisujući rad ekspanzije 1 kg mase radnog tijela, dobijamo
l = L/M; .
Vrijednost koja predstavlja specifičan rad koji obavlja sistem koji sadrži 1 kg plina jednaka je
Pošto uopšte R je varijabla, onda je integracija moguća samo kada je poznat zakon promjene pritiska p = p(v).
Formule (3.1) - (3.2) važe samo za ravnotežne procese u kojima je pritisak radnog fluida jednak pritisku okoline.
U termodinamici, ravnotežni procesi se široko koriste p, v- dijagram u kojem je osa apscisa specifična zapremina, a osa ordinate pritisak. Pošto je stanje termodinamičkog sistema određeno sa dva parametra, onda on p, v Na dijagramu je predstavljen tačkom. Tačka na slici 1 odgovara početnom stanju sistema, tačka 2 - finale, i linija 12 - proces širenja radnog fluida iz v1 prije v2. Uz beskonačno malu promjenu volumena, površina zasjenjene vertikalne trake je ; dakle rad procesa 12 je prikazan područjem ograničenim krivuljom procesa, osom apscisa i ekstremnim ordinatama.
Na ovaj način, rad promjene zapremine je ekvivalentan površini ispod krive procesa na p, v dijagramu (slika 3.1).
Slika 3.1 - Grafički prikaz rada u p, v- koordinate
Svaki put sistema prelazi iz stanja / u stanje 2 (na primjer, 12, 1a2 ili 1b2) odgovara njegovom radu na proširenju. rad zavisi od prirode termodinamičkog procesa, i nije funkcija samo početnog i krajnjeg stanja sistema. S druge strane, zavisi od puta integracije i stoga elementarni rad nije totalni diferencijal.
Rad je uvijek povezan s kretanjem makroskopskih tijela u prostoru, na primjer, kretanjem klipa, deformacijom školjke, pa karakterizira uređeni (makrofizički) oblik prijenosa energije s jednog tijela na drugo i mjera je prenesenu energiju. Budući da je vrijednost proporcionalna povećanju volumena, preporučljivo je odabrati one koji imaju mogućnost značajnog povećanja volumena kao radna tijela dizajnirana za pretvaranje toplinske energije u mehaničku. Ovaj kvalitet poseduju gasovi i pare tečnosti. Stoga, na primjer, u termoelektranama vodena para služi kao radni medij, a u motorima s unutarnjim sagorijevanjem plinoviti produkti sagorijevanja određenog goriva.
Toplota
Pored makrofizičkog oblika prenosa energije - rada, postoji i mikrofizički, odnosno oblik razmene energije koji se vrši na molekularnom nivou između sistema i okoline. U ovom slučaju, energija se može prenijeti u sistem bez obavljanja posla. Mjera količine energije koja se prenosi mikrofizičkim putem je toplota.
Toplota se može prenositi ili direktnim kontaktom između tijela (toplotna provodljivost, konvekcija), ili na daljinu (zračenjem), a u svim slučajevima ovaj proces je moguć samo ako postoji temperaturna razlika između tijela.
Kao što će biti prikazano u nastavku, elementarna količina toplote, kao i L nije totalni diferencijal, za razliku od diferencijala unutrašnje energije dU. Iza ove matematičke simbolike krije se duboko fizičko značenje razlike između pojmova unutrašnje energije, toplote i rada.
Unutrašnja energija- to je svojstvo samog sistema, karakteriše stanje sistema. Toplina i rad- to su energetske karakteristike mehaničkih i termičkih procesainterakcije sistema sa okruženjem. Oni karakterišu količine energije koje se prenose sistemu ili odaju od njega kroz njegove granice u određenom procesu.
Entalpija
U termodinamici važnu ulogu igra zbir unutrašnje energije sistema U i proizvodi sistemskog pritiska R na njenu zapreminu V, pozvao entalpija i označeno H:
Pošto su količine koje su uključene u njega funkcije stanja, onda je entalpija je funkcija stanja. Baš kao i unutrašnja energija, rad i toplota, mjeri se u džulima (J).
![]() ,
,
pozvao specifična entalpija(h = H/M), predstavlja entalpiju sistema koji sadrži 1 kg supstance i meri se u J/kg.
Budući da je entalpija funkcija stanja, može se predstaviti kao funkcija bilo koja dva parametra stanja:
![]() ;
; ![]() ;
; ![]() ,
,
i vrijednost dh je totalni diferencijal.
Promjena entalpije u bilo kojem procesu određena je samo početnim i konačnim stanjem tijela i ne ovisi o prirodi procesa.
Otkrijmo fizičko značenje entalpije koristeći sljedeći primjer. Razmotrimo prošireni sistem koji uključuje gas u cilindru i klip sa opterećenjem ukupne težine G.
 |
Energija ovog sistema je zbir unutrašnje energije gasa i potencijalne energije klipa sa opterećenjem u polju spoljnih sila: . U ravnoteži (G=pF) ova funkcija se može izraziti u smislu parametara plina: . Dobijamo to, tj. entalpija se može tumačiti kao energija proširenog sistema.






