Koja je formula supstance. Hemijske formule supstanci
2.1. Hemijski jezik i njegovi dijelovi
Čovječanstvo koristi mnogo različitih jezika. Osim prirodnim jezicima(japanski, engleski, ruski - više od 2,5 hiljade ukupno), postoje i veštački jezici npr. esperanto. Među veštačkim jezicima su jezicima razne nauke. Dakle, u hemiji se koristi sopstvena, hemijski jezik.
hemijski jezik- sistem simbola i koncepata dizajniranih za koncizno, sažeto i vizuelno snimanje i prenošenje hemijskih informacija.
Poruka napisana na većini prirodnih jezika podijeljena je na rečenice, rečenice na riječi, a riječi na slova. Ako rečenice, riječi i slova nazivamo dijelovima jezika, onda možemo razlikovati slične dijelove u hemijskom jeziku (tabela 2).
Tabela 2.dijelovi hemijski jezik
Nemoguće je savladati nijedan jezik odjednom, to se odnosi i na hemijski jezik. Stoga ćete se za sada samo upoznati sa osnovama ovog jezika: naučiti neka "slova", naučiti razumjeti značenje "riječi" i "rečenice". Na kraju ovog poglavlja bićete upoznati sa naslovi hemikalije su sastavni dio hemijskog jezika. Dok budete studirali hemiju, vaše znanje o hemijskom jeziku će se proširiti i produbiti.
HEMIJSKI JEZIK.
1. Koje veštačke jezike poznajete (osim onih navedenih u tekstu udžbenika)?
2. Po čemu se prirodni jezici razlikuju od umjetnih?
3. Mislite li da je moguće bez upotrebe hemijskog jezika pri opisivanju hemijskih pojava? Ako ne, zašto ne? Ako je tako, koje bi bile prednosti i nedostaci takvog opisa?
2.2. Simboli hemijskih elemenata
Simbol za hemijski element označava sam element ili jedan atom tog elementa.
Svaki takav simbol je skraćeni latinski naziv hemijskog elementa, koji se sastoji od jednog ili dva slova latiničnog alfabeta (vidi Dodatak 1 za latinično pismo). Simbol je napisan velikim slovima. Simboli, kao i ruski i latinski nazivi nekih elemenata, dati su u tabeli 3. Tu su dati i podaci o porijeklu latinskih imena. opšte pravilo izgovor simbola ne postoji, pa je u tabeli 3 prikazano i "čitanje" simbola, odnosno kako se ovaj simbol čita u hemijskoj formuli.
Nemoguće je zamijeniti naziv elementa simbolom u usmenom govoru, ali u rukopisnim ili štampanim tekstovima to je dozvoljeno, ali se ne preporučuje. hemijski elementi, njih 109 ima nazive i simbole odobrene od strane Međunarodne unije za čistu i primijenjenu hemiju (IUPAC).
Tabela 3 daje informacije o samo 33 elementa. Ovo su elementi sa kojima ćete se prvi susresti kada proučavate hemiju. Ruski nazivi (po abecednom redu) i simboli svih elemenata dati su u Dodatku 2.
Tabela 3Nazivi i simboli nekih hemijskih elemenata
Ime |
||||
latinski |
Pisanje |
|||
| - | Pisanje |
Porijeklo |
- | - |
| Nitrogen | N itrogenijum | Od grčkog. "rađanje šalitre" | "hr" | |
| Aluminijum | Al uminijum | Od lat. "stipsa" | "aluminijum" | |
| Argon | Ar gon | Od grčkog. "neaktivan" | "argon" | |
| Barijum | Ba rium | Od grčkog. "teška" | "barijum" | |
| Bor | B orum | Od arapskog. "bijeli mineral" | "bor" | |
| Brom | Br omum | Od grčkog. "zlomirni" | "brom" | |
| Vodonik | H hidrogenijum | Od grčkog. "rađanje vode" | "pepeo" | |
| Helijum | On lium | Od grčkog. " sunce " | "helijum" | |
| Iron | Fe rrum | Od lat. "mač" | "ferrum" | |
| Zlato | Au rum | Od lat. "gori" | "aurum" | |
| Jod | I odum | Od grčkog. "ljubičasta" | "jod" | |
| Kalijum | K alium | Od arapskog. "lužina" | "kalijum" | |
| Kalcijum | Ca cij | Od lat. "vapnenac" | "kalcijum" | |
| Kiseonik | O xygenium | Od grčkog. "proizvođač kiselina" | "o" | |
| Silicijum | Si licijum | Od lat. "kremen" | "silicijum" | |
| Krypton | kr ypton | Od grčkog. "skriveno" | "kripton" | |
| Magnezijum | M a g nezijum | Od imena poluostrva Magnezije | "magnezijum" | |
| Mangan | M a n ganum | Od grčkog. "pročišćavanje" | "mangan" | |
| Bakar | Cu prum | Od grčkog. ime o. Kipar | "kuprum" | |
| Natrijum | N / A trium | Sa arapskog, "deterdžent" | "natrijum" | |
| Neon | Ne on | Od grčkog. " novo" | "neon" | |
| Nikl | Ni kolum | Od njega. "bakar sv. Nikole" | "nikl" | |
| Merkur | H ydrar g yrum | Lat. "tečno srebro" | "hydrargyrum" | |
| Olovo | P lum b um | Od lat. naziv legure olova i kalaja. | "plumbum" | |
| Sumpor | S sumpor | Sa sanskrita "zapaljivi prah" | "es" | |
| Srebro | A r g entum | Od grčkog. "svetle boje" | "argentum" | |
| Karbon | C arboneum | Od lat. "ugalj" | "ce" | |
| Fosfor | P fosfor | Od grčkog. "donositelj svjetlosti" | "pe" | |
| Fluor | F luorum | Od lat. glagol "teči" | "fluor" | |
| Hlor | Cl orum | Od grčkog. "zelenkasto" | "hlor" | |
| Chromium | C h r omium | Od grčkog. "boja" | "hrom" | |
| cezijum | C ae s ium | Od lat. "nebo plavo" | "cezijum" | |
| Cink | Z i n cum | Od njega. "lim" | "cink" | |
2.3. Hemijske formule
Koristi se za označavanje hemikalija hemijske formule.
Za molekularne supstance, hemijska formula može označavati i jedan molekul ove supstance.
Informacije o supstanci mogu biti različite, pa su i različite vrste hemijskih formula.
U zavisnosti od potpunosti informacija, hemijske formule se dele u četiri glavna tipa: protozoa,
molekularni, strukturalni i prostorni.
Indeksi u najjednostavnijoj formuli nemaju zajednički djelitelj.
Indeks "1" se ne stavlja u formule.
Primjeri najjednostavnijih formula: voda - H 2 O, kisik - O, sumpor - S, fosforov oksid - P 2 O 5, butan - C 2 H 5, fosforna kiselina - H 3 PO 4, natrijum hlorid (kuhinjska so) - NaCl.
Najjednostavnija formula vode (H 2 O) pokazuje da voda sadrži element vodonik(H) i element kiseonik(O), i u bilo kojem dijelu (dio je dio nečega što se može podijeliti bez gubitka njegovih svojstava.) vode, broj atoma vodika je dvostruko veći više broja atomi kiseonika.
Broj čestica, uključujući broj atoma, označeno latiničnim slovom N. Označavanje broja atoma vodika - N H , a broj atoma kiseonika je N O, možemo to napisati
Or N H: N O=2:1.
Najjednostavnija formula fosforne kiseline (H 3 PO 4) pokazuje da fosforna kiselina sadrži atome vodonik, atomi fosfor i atomi kiseonik, a omjer broja atoma ovih elemenata u bilo kojem dijelu fosforne kiseline je 3:1:4, tj.
NH: N P: N O=3:1:4.

Najjednostavnija formula može se sastaviti za bilo koju pojedinačnu hemijsku tvar, a za molekularnu supstancu, osim toga, molekularna formula.
Primeri molekulskih formula: voda - H 2 O, kiseonik - O 2, sumpor - S 8, fosfor oksid - P 4 O 10, butan - C 4 H 10, fosforna kiselina - H 3 PO 4.
Nemolekularne supstance nemaju molekularne formule.
Redoslijed pisanja simbola elemenata u najjednostavnijim i molekularnim formulama određen je pravilima hemijskog jezika, koje ćete naučiti dok budete proučavali hemiju. Niz znakova ne utiče na informacije koje se prenose ovim formulama.
Od znakova koji odražavaju strukturu supstanci, koristićemo samo do sada valentni udar("crtica"). Ovaj znak pokazuje prisustvo između atoma tzv kovalentna veza(kakva je ovo veza i koje su njene karakteristike, uskoro ćete saznati).
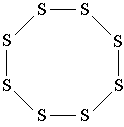
U molekuli vode atom kisika je povezan jednostavnim (jednostrukim) vezama sa dva atoma vodika, a atomi vodika nisu međusobno povezani. To je ono što jasno pokazuje strukturnu formulu vode. ![]()
Drugi primjer: molekul sumpora S 8 . U ovoj molekuli, 8 atoma sumpora formira osmočlani ciklus u kojem je svaki atom sumpora povezan sa dva druga atoma jednostavnim vezama. Uporedite strukturnu formulu sumpora sa trodimenzionalnim modelom njegove molekule prikazane na sl. 3. Imajte na umu da strukturna formula sumpora ne prenosi oblik njegove molekule, već samo pokazuje redoslijed povezivanja atoma kovalentnim vezama.
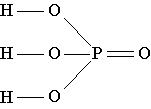
Strukturna formula fosforne kiseline pokazuje da je u molekuli ove tvari jedan od četiri atoma kisika povezan samo s atomom fosfora dvostrukom vezom, a atom fosfora je, zauzvrat, povezan s još tri atoma kisika jednostavnim vezama. . Svaki od ova tri atoma kisika, osim toga, povezan je jednostavnom vezom s jednim od tri atoma vodika prisutna u molekuli./p>
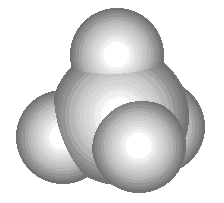
Uporedite sljedeći trodimenzionalni model molekule metana s njegovom prostornom, strukturnom i molekularnom formulom:
|
|
|
U prostornoj formuli metana, klinasti valentni potezi, kao u perspektivi, pokazuju koji nam je od atoma vodika „bliži“, a koji „dalji od nas“.
Ponekad prostorna formula ukazuje na dužine veza i vrijednosti uglova između veza u molekuli, kao što je prikazano na primjeru molekule vode.

Nemolekularne supstance ne sadrže molekule. Radi pogodnosti hemijski proračuni u nemolekularnoj tvari, tzv jedinica formule.
Primjeri sastava jedinica formule nekih tvari: 1) silicijum dioksid (kvarcni pijesak, kvarc) SiO 2 - jedinica formule sastoji se od jednog atoma silicija i dva atoma kiseonika; 2) natrijum hlorid (obična so) NaCl - jedinica formule sastoji se od jednog atoma natrijuma i jednog atoma hlora; 3) gvožđe Fe - jedinica formule sastoji se od jednog atoma gvožđa.Kao i molekula, jedinica formule je najmanji deo supstance koji zadržava svoja hemijska svojstva.
Tabela 4
Informacije koje se prenose različitim vrstama formula
Tip formule |
Informacija proslijeđena formulom. |
|
| Protozoa Molekularno Strukturno Spatial |
|
|
Razmotrimo sada, uz primjere, koje nam informacijske formule različitih tipova daju.
1. Supstanca: sirćetna kiselina. Najjednostavnija formula je CH 2 O, molekulska formula je C 2 H 4 O 2, strukturna formula
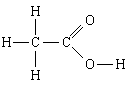
Najjednostavnija formula nam to govori
1) sirćetna kiselina sadrži ugljenik, vodonik i kiseonik;
2) u ovoj supstanci broj atoma ugljika je povezan sa brojem atoma vodika i brojem atoma kiseonika, kao 1:2:1, tj. N H: N C: N O = 1:2:1.
Molekularna formula dodaje to
3) u molekulu sirćetne kiseline - 2 atoma ugljika, 4 atoma vodika i 2 atoma kiseonika.
Strukturna formula dodaje to
4, 5) u molekulu su dva atoma ugljenika povezana jednom vezom; jedan od njih je, osim toga, povezan s tri atoma vodika, sa svakom jednostrukom vezom, a drugi sa dva atoma kisika, s jednom dvostrukom vezom, a s drugim jednostrukom vezom; posljednji atom kisika je također vezan jednostavnom vezom sa četvrtim atomom vodika.
2. Supstanca: natrijum hlorida.
Najjednostavnija formula je NaCl.
1) Natrijum hlorid sadrži natrijum i hlor.
2) U ovoj supstanci, broj atoma natrijuma jednak je broju atoma hlora.
3. Supstanca: gvožđe.
Najjednostavnija formula je Fe.
1) Sastav ove supstance uključuje samo željezo, odnosno to je jednostavna supstanca.
4. Supstanca: trimetafosforna kiselina . Najjednostavnija formula je HPO 3, molekulska formula je H 3 P 3 O 9, strukturna formula
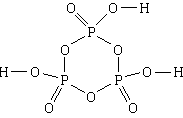
1) Sastav trimetafosforne kiseline uključuje vodonik, fosfor i kiseonik.
2) N H: N P: N O = 1:1:3.
3) Molekul se sastoji od tri atoma vodonika, tri atoma fosfora i devet atoma kiseonika.
4, 5) Tri atoma fosfora i tri atoma kiseonika, naizmenično, formiraju šestočlani ciklus. Sve veze u petlji su jednostavne. Svaki atom fosfora, osim toga, povezan je s još dva atoma kisika, s jednim - dvostrukom vezom, a drugim - jednostavnom. Svaki od tri atoma kisika povezana jednostavnim vezama za atome fosfora također je vezan jednostavnom vezom za atom vodika.
| Fosforna kiselina - H 3 PO 4(drugo ime je fosforna kiselina) - prozirno bezbojno kristalna supstanca molekularne strukture, topi se na 42 o C. Ova supstanca je vrlo rastvorljiva u vodi i čak upija vodenu paru iz vazduha (higroskopski). Fosforna kiselina se proizvodi u velikim količinama i koristi se prvenstveno u proizvodnji fosfatnih đubriva, kao i u hemijskoj industriji, u proizvodnji šibica, pa čak i u građevinarstvu. Osim toga, fosforna kiselina se koristi u proizvodnji cementa u stomatološkoj tehnologiji, dio je mnogih lijekova. Ova kiselina je dovoljno jeftina da se u nekim zemljama, kao što su Sjedinjene Američke Države, vrlo čista fosforna kiselina, jako razrijeđena vodom, dodaje osvježavajućim napitcima kako bi se zamijenila skupa limunska kiselina. |
| Metan - CH 4. Ako kod kuće imate plinski štednjak, onda se svakodnevno susrećete s ovom tvari: prirodni plin koji gori u gorionicima vaše peći je 95% metana. Metan je gas bez boje i mirisa sa tačkom ključanja od -161 o C. Kada se pomeša sa vazduhom, on je eksplozivan, što objašnjava eksplozije i požare koji se ponekad dešavaju u rudnicima uglja (drugi naziv za metan je vatra). Treći naziv metana - močvarni plin - nastaje zbog činjenice da se mjehurići ovog plina dižu sa dna močvara, gdje nastaje kao rezultat aktivnosti određenih bakterija. U industriji se metan koristi kao gorivo i sirovina za proizvodnju drugih supstanci.Metan je najjednostavniji ugljovodonik. Ova klasa supstanci takođe uključuje etan (C 2 H 6), propan (C 3 H 8), etilen (C 2 H 4), acetilen (C 2 H 2) i mnoge druge supstance. |
Tabela 5.Primjeri formula različitih vrsta za neke tvari-