Koje supstance imaju konstantnu tačku topljenja. Topljenje
ESSAY
"Tijela koja se tope"
Izvedeno:
Prisyazhnyuk Olga 9-A
Provjereno:
Nevzorova Tatyana Igorevna
Uvod
1) Proračun količine toplote
2) Topljenje
3) Specifična toplota fuzije
4) Topljenje metala
5) Tačka topljenja i ključanja vode
6) Topi se
7) Zanimljivo o topljenju
Upotreba znanja u drugim kontekstima, srodnim uslovima
Svojstva materije, a posebno vode, igraju ulogu u mnogim pojavama. Ovdje, na primjer, treba spomenuti meteorološki ciklus vode i evapotranspiraciju živih organizama. Ledeni bregovi se sastoje od čiste vode, zbog čega se smatraju izvorima vode za piće. Ali i proizvodnja svježa voda od slane vode u morima teoretski i tehnički nije teškoća i često se primjenjuje u zemljama s malo pitke vode, ali bogatim izvorima energije. Jedini problem je ekonomska održivost.
Zaključak (zaključci)
Uvod
Agregatno stanje - stanje materije koje karakteriziraju određena kvalitativne osobine: sposobnost ili nemogućnost održavanja volumena i oblika, prisustvo ili odsustvo reda dugog i kratkog dometa i dr. Promjena agregacijskog stanja može biti praćena naglom promjenom slobodna energija, entropija, gustina i druga osnovna fizička svojstva.
Na internetu ćete naći mnogo stranica na kojima piše topljenje i isparavanje. Naravno, ima ih mnogo više. Ali neka pitanja ostaju kao i uvijek bez odgovora. Zašto neke supstance imaju vrlo nisku tačku topljenja, dok druge imaju visoku tačku topljenja?
- Koji se procesi dešavaju tokom topljenja i isparavanja?
- Pa zašto tkanine imaju takve različite tačke ključanje?
Koji se procesi odvijaju tokom topljenja?
Zašto se neke tvari ne tope i ne ključaju, već se ranije raspadaju? . Izrazi ključanje i isparavanje koriste se na isti način na ovoj stranici. Više informacija možete pronaći na ovoj stranici.
Prvi korak: kako nastaje čvrsta masa
Svaka čvrsta materija se sastoji od sićušnih čestica. Između čestica postoje sile koje ih drže zajedno. Uvek su elektrostatički. Priroda čestica i snaga sila su veoma brojne. Tačnu kolekciju možete pronaći na mojoj stranici Vezovi. Evo kratkog sažetka.Postoje tri glavna agregatna stanja: čvrsto, tečno i gasovito. Ponekad nije sasvim ispravno klasifikovati plazmu kao stanje agregacije. Postoje i druga stanja agregacije, na primjer, tekući kristali ili Bose-Einstein kondenzat.
Promjene u agregacijskom stanju su termodinamički procesi nazivaju faznim prelazima. Razlikuju se sljedeće varijante: od čvrstog do tekućeg - topljenje; iz tečnog u gasovito - isparavanje i ključanje; od čvrstog do gasovitog - sublimacija; iz gasovitog u tečno ili čvrsto - kondenzacija. Posebnost je odsustvo oštre granice prijelaza u stanje plazme.
Drugi korak: šta se dešava kada se čvrsta materija zagreje ispod tačke topljenja?
Ako se tvar zagrijava zagrijavanjem, najmanje čestice apsorbiraju ovu energiju. Kažu da im raste unutrašnja energija. Unutrašnja energija može biti tri tipa: energija vibracija, energija rotacije i energija elektrona. Energija elektrona je irelevantna za topljenje i ključanje. Elektroni koji sežu visoki nivo energije, ostanite tu samo neko vrijeme, a zatim se vratite na prvobitni nivo. Energija se oslobađa i napušta čvrstu materiju. Ovdje se javljaju fenomeni kao što su fosforescencija i fluorescencija.
Za opisivanje različitih stanja u fizici koristi se širi koncept termodinamičke faze. Pojave koje opisuju prelaze iz jedne faze u drugu nazivaju se kritične pojave.
Čvrsto: Stanje koje karakteriše sposobnost održavanja volumena i oblika. Atomi čvrstog tijela prave samo male vibracije oko stanja ravnoteže. Postoji i poredak dugog i kratkog dometa.
Hajde da pogledamo vibracije, hoćemo li? a rotaciona sila je malo bliža. Male čestice se kreću na određeni način. Neke od mogućnosti za ova kretanja su sada navedene. Istezanje. 2 atoma povezana vezom vibriraju duž vezne ose tako da veza povremeno postaje kraća i duža. Samo molekuli mogu izvršiti vibracije istezanja, jer imaju vezu samo unutar čestice. Vibracija savijanja. 3 vezana atoma vibriraju tako da je ugao između dvije veze periodično manji i veći. Molekuli od najmanje 3 atoma mogu uzrokovati vibracije savijanja. Veći i složeniji molekuli mogu izvoditi složene kompleksne vibracije. Jednostavan primjer je inverzija molekule amonijaka. Cijela čestica može rotirati oko svog centra gravitacije. Dio molekula može rotirati oko jedne veze.
- Vibracije čestice oko njenog centralnog položaja.
- To jest, jon ili molekul oscilira naprijed-nazad poput klatna.
- Svaka od najmanjih čestica iz prvog koraka može izvršiti takve vibracije.
Tečnost: Stanje tvari u kojem ima nisku stišljivost, odnosno dobro zadržava volumen, ali nije u stanju zadržati svoj oblik. Tečnost lako poprima oblik posude u koju se nalazi. Atomi ili molekuli tečnosti vibriraju blizu ravnotežnog stanja, zarobljeni drugim atomima, i često skaču na druga slobodna mjesta. Postoji samo poredak kratkog dometa.
Na niskim temperaturama, čestice nose samo spore oscilacije male amplitude i sporo rotiraju. Ako se čvrsta materija zagrije, vibracije i rotacije postaju brže, a amplituda vibracija se povećava. Zbog toga i najmanje čestice apsorbuju toplotu toplote i pretvaraju je u energiju kretanja.
Treći korak: Koji se procesi odvijaju tokom topljenja?
Mogu li i najmanje čestice apsorbirati neograničenu količinu topline? U prethodna dva paragrafa vidjeli smo dva svojstva najmanjih čestica u čvrstoj tvari. Između njih rade elektrostatički atraktori. One dovode do određene energije vezivanja. Ne zavisi od temperature. S druge strane, kinetička energija sadržane u česticama. Ovo je više što je temperatura viša.
Gas: Stanje koje karakteriše dobra kompresibilnost, bez mogućnosti zadržavanja volumena i oblika. Plin ima tendenciju da zauzme cjelokupni volumen koji mu se daje. Atomi ili molekuli plina ponašaju se relativno slobodno, udaljenosti između njih su mnogo veće od njihove veličine.
Ostala stanja: Nakon dubokog hlađenja, neke (daleko ne sve) supstance prelaze u supravodljivo ili superfluidno stanje. Ova stanja su, naravno, odvojene termodinamičke faze, ali teško da zaslužuju da se nazivaju novim agregatnim stanjima materije zbog svoje neuniverzalnosti. Nehomogene supstance kao što su paste, gelovi, suspenzije, aerosoli itd., koje pod određenim uslovima ispoljavaju svojstva i čvrstih i tečnih, pa čak i gasova, obično se klasifikuju kao dispergovani materijali, a ne u neke posebne agregatna stanja supstance.
Ako se čvrsto tijelo zagrije, kinetička energija njegovih najmanjih čestica se povećava. U nekom trenutku je veća od energije veze. Može se zamisliti da privlačne sile između čestica više nisu dovoljno jake da izdrže sile uzrokovane toplinskim fluktuacijama. Čestice se sada kreću nezavisno jedna od druge, a to je upravo karakteristika tečnosti. Čvrsta materija se topi.
Zašto su tečnosti tečne?
U tekućini, čestice se stoga više ne drže zajedno silama elektrostatičke privlačnosti. Crvena strelica pokazuje šta se dešava kada vi. čvrsta materija se zagreva pod niskim pritiskom. Ovaj proces se naziva sublimacija. Ovo je lako razumjeti jer je argumentacija jednostavna. Energija vezivanja je preniska, sile privlačenja su preslabe da drže čestice zajedno, pa se one razmiču. Međutim, ako ne znate samo podatke o školskim udžbenicima, ovdje ćete pronaći kontradikciju i postaviti sebi pitanje.
Topljenje
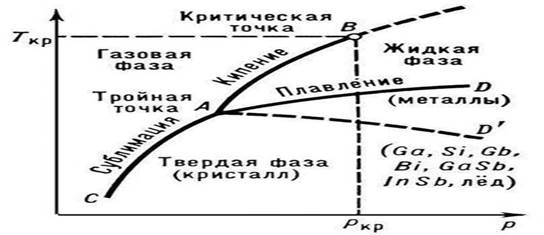
Rice. 1. Stanje čiste materije (dijagram)
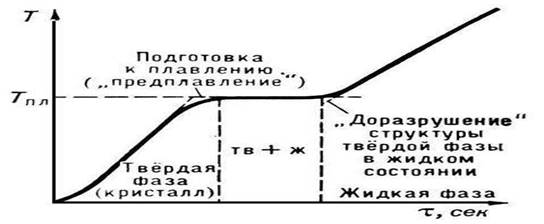
Rice. 2. Temperatura topljenja kristalnog tijela
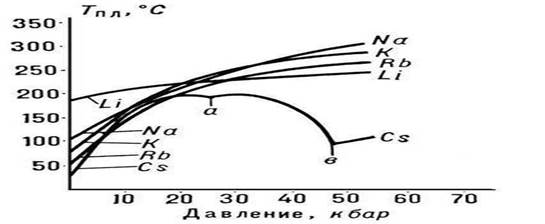
Rice. 3. Tačka topljenja alkalni metali
Topljenje - prijelaz tvari iz kristalnog (čvrstog) stanja u tekućinu; nastaje sa apsorpcijom toplote (fazni prijelaz prvog reda). Glavne karakteristike P. čistih supstanci su tačka topljenja (Tmelt) i toplota koja je neophodna za sprovođenje procesa P. (toplota topljenja Qmelt).
U tečnosti čestice skoro uvek nisu odvojene jedna od druge, i dalje su skoro isto tako blizu kao u čvrstom stanju. Zašto se ne snimaju kao da su u gasu? Drugim rečima, zašto čvrsta materija ne pređe odmah u gasovito stanje tokom topljenja?
Pritisak igra ključnu ulogu
Oni to rade pod niskim pritiskom. Samo pod visokim pritiskom postaju tečni. Da li je to pritisak koji sprečava čvrste čestice da direktno uđu u gasovito stanje? Da li je pritisak razlog zašto tečnosti uopšte postoje?
Temperatura P. zavisi od spoljašnjeg pritiska p; na dijagramu stanja čiste supstance ova zavisnost je prikazana krivuljom topljenja (kriva koegzistencije čvrste i tečne faze, AD ili AD" na slici 1). Topljenje legura i čvrstih rastvora se dešava, kao pravilo, u temperaturnom opsegu (sa izuzetkom eutektika sa konstantnim Tmelt) Ovisnost temperature početka i kraja P. legure od njenog sastava pri datom pritisku prikazana je na dijagramima stanja posebnim linijama ( krivulje likvidusa i solidusa, vidi Binarni sistemi) od čvrstog kristalnog stanja do izotropne tečnosti odvija se u fazama (u određenom temperaturnom opsegu), svaka faza karakteriše određeni stupanj razaranja kristalna struktura.
Pogledajmo pobliže ulogu pritiska. Čestice iznutra su okružene susjedima. okruženi i privučeni njima. Čestice na površini imaju nekoliko susjeda. Pogledajte sliku sa desne strane. Pokazuje dio tečnosti, ali su odnosi u čvrstim materijama u osnovi isti.
Čestice na slici su sferne, ali su omjeri isti za molekule ili ione različitih oblika. Prvo pogledajte česticu unutra. Okružen je drugim česticama u svim smjerovima. Između čestice i svih njenih susjeda postoje atraktori. To su Kulonove sile, koje su detaljno opisane u prvom koraku. Naravno, prisutni su iu tečnom i u čvrstom stanju, a i dalje su jaki kao i pre topljenja. Na slici su predstavljene crnim linijama. Jedna čestica je istaknuta, ima 7 susjeda na koje djeluju Kulonove sile.
Prisustvo određene temperature P. važan je znak ispravne kristalna strukturačvrsta tela. Na osnovu toga ih je lako razlikovati od amorfnih čvrstih materija koje nemaju fiksni Tm. Amorfne čvrste materije postepeno prelaze u tečno stanje, omekšavajući sa povećanjem temperature (vidi Amorfno stanje). Volfram ima najvišu temperaturu među čistim metalima (3410°C), a živa najnižu (-38,9°C). Posebno vatrostalna jedinjenja uključuju: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C) itd. Po pravilu, za supstance sa visokim Tm karakteriziraju veće vrijednosti Qm. Nečistoće prisutne u kristalne supstance ah, spusti njihov Tm. Ovo se u praksi koristi za dobijanje legura sa niskim Tmelt (vidi, na primer, Wood-ova legura sa Tmelt = 68 °C) i smeša za hlađenje.
Jedan od njih se već udaljio od njega. Ako se krene dalje, potpuno će napustiti medij prve čestice. Ali još uvijek je u tekućini jer će se približiti drugoj čestici i veza između njih će se formirati za kratko vrijeme. Čestice unutar tečnosti ih ne mogu napustiti, jer se jedva kreću od jedne susjedne čestice, privlače ih druga.
U slučaju čestica na površini tečnosti situacija je drugačija. Na slici su prikazane dvije takve čestice. Oni imaju susjede samo unutar tečnosti, i samo za njih Kulonove sile. Spolja, skoro da i nema komšija. Ima vazduha ili nekog drugog gasa. Ima vrlo nisku gustinu u odnosu na tečnost, tako da sadrži mnogo manje čestica po jedinici zapremine. Uvidjet ćete da trebate pažljivije pogledati čestice na površini. Postoji ključ za odgovor.
P. počinje kada kristalna supstanca dostigne Tpl. Od početka P. do njegovog završetka, temperatura supstance ostaje konstantna i jednaka Tmelt, uprkos prenosu toplote na supstancu (slika 2). U normalnim uslovima nije moguće zagrejati kristal do T > Tmelt (pogledajte Pregrevanje), dok je tokom kristalizacije relativno lako postići značajno prehlađenje taline.
Čestice sa više ili manje energije
Raspodjela energije čestica u tekućini. Uvek smo govorili da čestice imaju određenu energiju zbog termičkih fluktuacija, a moglo bi se pomisliti da sve čestice u kapi tečnosti imaju istu energiju. Neki od njih imaju višu energiju, drugi imaju nižu. Ovo je lako razumjeti s obzirom na to da se čestice sudaraju. Ovisno o brzini i smjeru u kojem se sudaraju, energija se prenosi s jedne čestice na drugu. Pošto su susreti prilično nasumični, postoje pobednici čija energija raste od udarca do udarca, kao i gubitnici.
Priroda zavisnosti Tm od pritiska p određena je smerom zapreminskih promena (DVm) na P. (vidi Clapeyron-Clausiusovu jednačinu). U većini slučajeva, P. supstance je praćen povećanjem njihovog volumena (obično za nekoliko posto). Ako je to slučaj, onda povećanje pritiska dovodi do povećanja Tm (slika 3). Međutim, u nekim supstancama (voda, brojni metali i metalidi, vidi sliku 1), tokom P. dolazi do smanjenja volumena. Temperatura P. ovih supstanci opada sa povećanjem pritiska.
Raspodjela energije čestica u jednom. Obje distribucije se neznatno razlikuju. Čestice isparavaju. Područje desno od crvene linije na dnu. Stoga, na 20°C, manje čestica ima energiju potrebnu za isparavanje. može biti i na 50°C, a na ovoj temperaturi isparavanje je stabilnije. Šta se dešava sa pobednicima? Njihova energija je toliko velika da mogu savladati Kulonove sile svojih susjeda. Samo zato što je tako malo komšija, oni imaju šansu da nadjačaju privlačnost svih komšija.
I baš zato što je njihova energija tako velika, oni ne samo da mogu savladati ove prizore na kratko, već ih i ponovo uhvatiti, ali zauvijek. Ovih nekoliko čestica visoke energije ostavljaju kapljice tekućine. Kreću se što je dalje moguće i nikada se ne vraćaju na svoje padove. Svima je poznat gore opisani fenomen.
P. je praćen promjenom fizičkih svojstava tvari: povećanje entropije, što odražava poremećaj kristalne strukture tvari; povećanje toplotnog kapaciteta električni otpor[izuzetak su neki polumetali (Bi, Sb) i poluvodiči (Ge), in tečno stanje sa većom električnom provodljivošću. Tokom P., otpor na smicanje pada na gotovo nulu (poprečni elastični valovi se ne mogu širiti u talini, vidi tekućina), smanjuje se brzina širenja zvuka (longitudinalni valovi), itd.
Upravo ste naučili zašto kap vode pada. Toplotna energija neke čestice na površini su dovoljno velike da ostave kapljice. Pošto govorimo samo o isparavanju, možete i brzo očistiti, jer to zavisi od temperature. Već direktno iznad tačke topljenja biće nekoliko čestica koje imaju dovoljno energije da ostave kap. Što je temperatura viša, to je veća prosječna energija čestica, a sve više i više čestica će imati energiju potrebnu za izlazak iz površine.
Zatvoreni sistemi donose više jasnoće
Kao rezultat, kap brže isparava. Ilustracija ispod to ilustruje. Još jednom smo mogli objasniti svakodnevna iskustva. Otvoreni sistem je sistem za razmjenu materije i energije okruženje. Na primjer, kap vode je otvoreni sistem. protiv, zatvoreni sistemi i zatvoreni sistemi. Uzorak boce mineralne vode je dobar primjer zatvoreni sistem. To je otprilike jedna trećina ispunjena tečnošću. Da biste izbjegli nepotrebno komplikovane argumente, treba ga napuniti čistom tekućinom poput vode, a ne mješavinom poput mineralne vode ili benzina.
Prema molekularnim i kinetičkim prikazima, P. se izvodi na sljedeći način. Kada se toplota primeni na kristalno telo, povećava se energija vibracija (amplituda oscilovanja) njegovih atoma, što dovodi do povećanja telesne temperature i doprinosi stvaranju raznih vrsta defekata u kristalu (neispunjeni čvorovi kristalne rešetke - slobodna mjesta; kršenje periodičnosti rešetke od strane atoma ugrađenih između njenih čvorova, itd., vidi Defekti u kristalima). U molekularnim kristalima može doći do djelomičnog poremećaja međusobne orijentacije osi molekula ako molekuli nemaju sferni oblik. Postepeno povećanje broja defekata i njihova povezanost karakterizira fazu prije topljenja. Kada se Tmelt postigne, u kristalu se stvara kritična koncentracija defekata i počinje kristalizacija; kristalna rešetka se raspada na lako pokretne submikroskopske regije. Toplota dovedena tokom P. ne koristi se za zagrijavanje tijela, već za razbijanje međuatomskih veza i uništavanje dugog dometa u kristalima (vidi Redosled dugog dometa i poredak kratkog dometa). U samim submikroskopskim područjima, s druge strane, poredak kratkog dometa u rasporedu atoma se ne mijenja značajno tokom kristalizacije (koordinacijski broj taline na Tm u većini slučajeva ostaje isti kao kod kristala). Ovo objašnjava niže vrijednosti topline fuzije Qm u odnosu na topline isparavanja i relativno malu promjenu brojnih fizičkih svojstava tvari tokom njihovog P.
Proces pirolize igra važnu ulogu u prirodi (piroliza snijega i leda na površini zemlje, mineralizacija minerala u njenim dubinama, itd.) i u tehnologiji (proizvodnja metala i legura, livenje u kalupe i sl.). tako dalje).
Specifična toplota fuzije
Specifična toplota fuzije (također: entalpija fuzije; postoji i ekvivalentan koncept specifične toplote kristalizacije) - količina toplote koja se mora preneti jednoj jedinici mase kristalne supstance u ravnotežnom izobarično-izotermnom procesu kako bi se da ga prevede iz čvrstog (kristalnog) stanja u tečno (ista količina toplote koja se oslobađa tokom kristalizacije supstance). Toplina topljenja - poseban slučaj toplina fazni prelaz I kind. Razlikovati specifičnu toplinu fuzije (J/kg) i molarnu (J/mol).
Specifična toplota fuzije je označena slovom
(grčko slovo lambda) Formula za izračunavanje specifične toplote fuzije: , - specifična toplota fuzije, - količina toplote koju je primila supstanca tokom topljenja (ili oslobođena tokom kristalizacije), - masa topljene (kristalizirajuće) supstance .
Topljenje metala
Prilikom topljenja metala moraju se poštovati određena pravila. Pretpostavimo da će otopiti olovo i cink. Olovo će se brzo otopiti, imajući tačku topljenja od 327°; cink će, s druge strane, dugo ostati čvrst, jer je njegova tačka topljenja iznad 419 °. Šta će dovesti do takvog pregrijavanja? Počet će biti prekriven filmom prelijepe boje, a zatim će njegova površina biti skrivena ispod sloja praha koji se ne topi. Olovo je izgorjelo od pregrijavanja, oksidiralo se spajanjem s kisikom u zraku. Ovaj proces, kao što znate, odvija se na običnoj temperaturi, ali kada se zagrije, ide mnogo brže. Dakle, dok se cink počne topiti, ostat će vrlo malo metalnog olova. Ispostavit će se da je legura potpuno drugačijeg sastava, kako se očekivalo, a velika količina olova će se izgubiti u obliku otpada. Jasno je da prvo moramo rastopiti vatrostalniji cink, a zatim u njega staviti olovo. Ista stvar će se dogoditi ako se cink legira sa bakrom ili mesingom, prvo zagrijavanjem cinka. Cink će izgorjeti do trenutka kada se bakar otopi. To znači da uvijek prvo morate rastopiti metal s višom tačkom topljenja.
Ali ovaj ne može izbjeći ludnicu. Ako se pravilno zagrijana legura dugo drži na vatri, na površini tekućeg metala se ponovo stvara film kao rezultat isparenja. Jasno je da će se topljiviji metal ponovo pretvoriti u oksid i sastav čepa će se promijeniti; To znači da se metal ne može pregrijati duže vrijeme bez potrebe. Stoga pokušavaju na sve moguće načine smanjiti otpad metala, polažući ga u kompaktnu masu; sitni komadići, piljevina, strugotine se prvo „pakuju“, tope se komadi manje-više iste veličine, zagrijavaju na dovoljnoj temperaturi, a metalna površina se štiti od kontakta sa zrakom. U tu svrhu majstor može uzeti boraks ili jednostavno prekriti površinu metala slojem pepela, koji će uvijek plutati na vrhu (zbog manjeg specifična gravitacija) i neće škoditi prilikom sipanja metala. Kada se metal stvrdne, javlja se još jedan fenomen, vjerovatno poznat i mladim majstorima. Metal se, skrućivanjem, smanjuje u volumenu, a to smanjenje nastaje zbog unutrašnjih, još ne očvrsnutih metalnih čestica. Na površini odljevka ili unutar njega formira se manje ili više značajno udubljenje u obliku lijevka, takozvana šupljina skupljanja. Obično se kalup izrađuje na način da se na tim mjestima odljevka formiraju rupe za skupljanje, koje se naknadno uklanjaju, pokušavajući zaštititi sam proizvod što je više moguće. Jasno je da rupe za skupljanje kvare odljevak i ponekad ga mogu učiniti neupotrebljivim. Nakon topljenja, metal se lagano pregrijava tako da je tanji i topliji i samim tim bolje ispunjava detalje kalupa i ne smrzava se prerano od kontakta sa hladnijim kalupom.
Budući da je tačka topljenja legura obično niža od tačke topljenja najvatrostalnijih metala koji čine leguru, ponekad je korisno učiniti suprotno: prvo otopiti topljiviji, a zatim vatrostalniji metal. Međutim, to je dopušteno samo za metale koji nisu jako oksidirani ili pod uvjetom da su ti metali zaštićeni od prekomjerne oksidacije. Potrebno je uzeti više metala nego što je potrebno za samu stvar, kako bi ispunio ne samo kalup, već i kanal za ulijevanje. Jasno je da prvo morate izračunati potrebnu količinu metala.
Tačka topljenja i ključanja vode
Najviše iznenađujuće i najblaženije svojstvo vode za živu prirodu je njena sposobnost da bude tečnost u "normalnim" uslovima. Molekuli jedinjenja veoma sličnih vodi (na primer, molekuli H2S ili H2Se) su mnogo teži, ali pod istim uslovima formiraju gas. Stoga se čini da voda proturječi pravilnostima periodnog sistema, koji, kao što znate, predviđa kada, gdje i koja svojstva supstanci će biti bliska. U našem slučaju iz tabele proizilazi da su svojstva jedinjenja vodonika elementi (zvani hidridi) koji se nalaze u istim vertikalnim stupovima trebali bi se monotono mijenjati s povećanjem mase atoma. Kiseonik je element šeste grupe ove tabele. U istoj grupi su sumpor S (atomske mase 32), selen Se (atomske mase 79), telur Te (atomske mase 128) i polonijum Po (atomske mase 209). Slijedom toga, svojstva hidrida ovih elemenata bi se trebala monotono mijenjati pri prelasku sa teških elemenata na lakše, tj. u nizu H2Po → H2Te → H2Se → H2S → H2O. Što se i događa, ali samo sa prva četiri hidrida. Na primjer, tačke ključanja i topljenja rastu kako se povećava atomska težina elemenata. Na slici, križići označavaju tačke ključanja ovih hidrida, a krugovi označavaju tačke topljenja.

Kao što se može vidjeti, kako se atomska težina smanjuje, temperature opadaju prilično linearno. Područje postojanja tekuće faze hidrida postaje sve "hladnije", a da je kisikov hidrid H2O normalno jedinjenje, slično njegovim susjedima u šestoj grupi, tada bi tekuća voda postojala u rasponu od - 80 °C do -95 °C. Na više Na visokim temperaturama, H2O bi uvijek bio plin. Na našu sreću i svu sreću na Zemlji, voda je anomalna, ne prepoznaje periodični obrazac, već slijedi svoje zakone.
To se objašnjava jednostavno - većina molekula vode povezana je vodikovim vezama. Upravo te veze razlikuju vodu od tečnih hidrida H2S, H2Se i H2Te. Da nisu, tada bi voda ključala već na minus 95°C. Energija vodoničnih veza je prilično visoka, a one se mogu prekinuti samo na mnogo većoj visoke temperature. Čak i unutra gasovitom stanju veliki broj Molekuli H2O zadržavaju svoje vodonične veze, ujedinjujući se u (H2O)2 dimere. Potpuno vodonične veze nestaju samo pri temperaturi vodene pare od 600 °C.
Podsjetimo da se ključanje sastoji u činjenici da se unutar kipuće tekućine formiraju mjehurići pare. Pri normalnom pritisku čista voda ključa na 100 "C. Ako se toplota dovodi kroz slobodnu površinu, proces površinskog isparavanja će se ubrzati, ali ne dolazi do volumetrijskog isparavanja karakterističnog za ključanje. Vrenje se može izvesti i spuštanjem spoljašnjeg pritisak, jer se u ovom slučaju pritisak pare jednak vanjskom pritisku postiže pri nižoj temperaturi. Na vrhu je vrlo visoka planina pritisak i, shodno tome, tačka ključanja su toliko niski da voda postaje neprikladna za kuvanje hrane - nije postignuta potrebna temperatura vode. Uz dovoljno visok pritisak, voda se može zagrijati dovoljno da otopi olovo (327°C), a da ne proključa.
Pored super velikih tačaka ključanja (a ovaj drugi proces zahteva previše toplote fuzije za tako jednostavnu tečnost), sam opseg postojanja vode je anomalan - sto stepeni po kojima se te temperature razlikuju - prilično veliki raspon za tako nisku molekularnu tečnost kao što je voda. Granice dopuštenih vrijednosti hipotermije i pregrijavanja vode su neobično velike - uz pažljivo zagrijavanje ili hlađenje, voda ostaje tečna od -40 ° C do +200 ° C. Ovo proširuje temperaturni raspon u kojem voda može ostati tečna na 240 °C.
Kada se led zagrije, njegova temperatura prvo raste, ali od trenutka formiranja mješavine vode i leda, temperatura će ostati nepromijenjena sve dok se sav led ne otopi. To se objašnjava činjenicom da se toplina koja se dovodi do topljenog leda prvenstveno troši samo na uništavanje kristala. Temperatura topljenja leda ostaje nepromijenjena sve dok se svi kristali ne unište (vidi latentnu toplinu fuzije).
topi se
Taline su tečno rastopljeno stanje tvari na temperaturama u određenim granicama udaljenim od kritična tačka tačka topljenja i nalazi se bliže tački topljenja. Priroda taljenja je inherentno određena tipom hemijske veze elemenata u rastopljenoj supstanci.
Taline se široko koriste u metalurgiji, staklarstvu i drugim oblastima tehnologije. Taline obično imaju složen sastav i sadrže različite komponente koje međusobno djeluju (vidi fazni dijagram).
Otopi se
1. Metalik (Metali (naziv dolazi od latinskog metallum - rudnik, rudnik) - grupa elemenata sa karakterističnim metalnim svojstvima, kao što su visoka toplotna i električna provodljivost, pozitivni temperaturni koeficijent otpora, visoka duktilnost i metalni sjaj);
2. Jonski (Ion (starogrčki ἰόν - trčanje) - jednoatomna ili poliatomska električno nabijena čestica nastala kao rezultat gubitka ili dodavanja jednog ili više elektrona atomu ili molekuli. Ionizacija (proces stvaranja jona) može nastaju na visokim temperaturama, pod udarom električno polje);
3.Poluprovodnik sa kovalentne veze između atoma (Poluprovodnici su materijali koji po svojoj specifičnoj vodljivosti zauzimaju srednju poziciju između vodiča i dielektrika i razlikuju se od provodnika po jakoj zavisnosti specifične provodljivosti o koncentraciji nečistoća, temperaturi i razne vrste radijacije. Glavno svojstvo ovih materijala je povećanje električne provodljivosti s povećanjem temperature);
4. Organske taline sa van der Waalsovim vezama;
5. Visoki polimeri (Polimeri (grč. πολύ- - mnogo; μέρος - deo) - anorganske i organske, amorfne i kristalne supstance dobijene uzastopnim ponavljanjem različitih grupa atoma, nazvane "monomerne jedinice", spojene u dugačke makromolekule hemijskim putem ili koordinacijom obveznice)
Topi se po vrsti hemijska jedinjenja oni su:
1. Sol;
2.Oxide;
3. Oksidno-silikatna (šljaka) itd.
Topi sa posebnim svojstvima:
1.Eutektički
Zanimljivo o topljenju
Zrnca leda i zvijezde.
Unesite komad čisti led u toplu sobu i gledajte kako se topi. Brzo će postati jasno da se led, koji je izgledao monolitan i homogen, raspada na mnogo malih zrnaca - pojedinačnih kristala. U zapremini leda, nalaze se nasumično. Ne manje od zanimljiva slika može se vidjeti kada se led otopi sa površine.
Donesite glatki komad leda na lampu i sačekajte dok se ne počne topiti. Kada topljenje dodirne unutrašnja zrna, tamo će se početi pojavljivati vrlo fini uzorci. Uz jaku lupu možete vidjeti da imaju oblik heksagonalnih pahuljica. U stvari, to su rastopljene udubine ispunjene vodom. Oblik i smjer njihovih zraka odgovaraju orijentaciji monokristala leda. Ovi uzorci se zovu "Tyndallove zvijezde" po engleskom fizičaru koji ih je otkrio i opisao 1855. godine. "Tyndallove zvijezde", slične pahuljama, zapravo su udubljenja na površini otopljenog leda, veličine oko 1,5 mm, ispunjena vodom. U njihovom središtu su vidljivi mjehurići zraka, koji su nastali zbog razlike u zapremini otopljenog leda i otopljene vode.
DA LI STE ZNALI?
Postoji metal, takozvana Vudova legura, koja se lako rastopi čak iu toploj vodi (+68 stepeni Celzijusa). Dakle, prilikom miješanja šećera u čaši, metalna kašika napravljena od ove legure će se otopiti brže od šećera!
Najvatrostalnija supstanca, tantal karbid TaCO-88, topi se na temperaturi od 3990°C.
1987. godine, njemački istraživači su uspjeli superohladiti vodu na -700C dok su je održavali u tečnom stanju.
Ponekad se, da bi se snijeg na trotoarima brže otopio, posipaju solju. Do topljenja leda dolazi jer nastaje rastvor soli u vodi, čija je tačka smrzavanja niža od temperature vazduha. Rješenje samo poteče s trotoara.
Zanimljivo je da stopala postaju hladnija na mokrom kolovozu, jer je temperatura rastvora slane vode niža od one u čistom snegu.
Ako čaj iz čajnika sipate u dve šolje: sa šećerom i bez šećera, onda će čaj u šolji sa šećerom biti hladniji, jer. otapanje šećera (uništenje njegove kristalne rešetke) također troši energiju.
U teškim mrazima, kako bi se povratila glatkoća leda, klizalište se zalijeva vruća voda.. Topla voda topi tanak gornji sloj leda, ne smrzava se tako brzo, ima vremena da se raširi, a površina leda je vrlo glatka.
Zaključak (zaključci)
Topljenje je prijelaz tvari iz čvrstom stanju u tečnost.
Kada se zagrije, temperatura tvari raste, a brzina toplinskog kretanja čestica raste, dok se unutarnja energija tijela povećava.
Kada temperatura čvrste supstance dostigne tačku topljenja, kristalna rešetka solidan počinje da se kvari. Dakle, glavni dio energije grijača, provedenog na čvrsto tijelo, troši se na smanjenje veza između čestica tvari, odnosno na uništavanje kristalne rešetke. U tom slučaju se povećava energija interakcije između čestica.
Rastopljena supstanca ima veliku zalihu unutrašnja energija nego u čvrstom stanju. Preostali dio topline fuzije troši se na rad na promjeni volumena tijela tokom njegovog topljenja.
Kada se otopi, volumen većine kristalna tela povećava se (za 3-6%), a smanjuje se tokom stvrdnjavanja. Ali, postoje tvari u kojima se, kada se otape, volumen smanjuje, a kada se stvrdne, povećava. To uključuje, na primjer, vodu i lijevano željezo, silicij i neke druge. . Zato led pliva na površini vode, a čvrsto liveno gvožđe - u sopstvenom topljenju.
Čvrste tvari koje se nazivaju amorfne (ćilibar, smola, staklo) nemaju određenu tačku topljenja.
Količina topline potrebna za otapanje tvari jednaka je proizvodu specifične topline fuzije pomnoženoj s masom tvari.
Specifična toplina fuzije pokazuje koliko je topline potrebno za potpunu transformaciju 1 kg tvari iz čvrstog u tekuće stanje, uzeto pri brzini topljenja.
Jedinica specifične topline fuzije u SI je 1J/kg.
Tokom procesa topljenja, temperatura kristala ostaje konstantna. Ova temperatura se naziva tačka topljenja. Svaka supstanca ima svoju tačku topljenja.
Tačka topljenja za datu supstancu zavisi od atmosferskog pritiska.
Spisak korišćene literature
1) Podaci iz elektronske slobodne enciklopedije "Wikipedia"
http://ru.wikipedia.org/wiki/Main_page
2) Sajt "Razred! Fizika za radoznale" http://class-fizika.narod.ru/8_11.htm
3) Sajt " Fizička svojstva voda"
http://all-about-water.ru/boiling-temperature.php
4) Web stranica "Metali i konstrukcije"
http://metaloconstruction.ru/osnovy-plavleniya-metallov/
Ne postoji tako nešto čvrsto telo, koji bi odolijevao porastu temperature koliko god je potrebno. Prije ili kasnije čvrsti komad se pretvara u tekućinu; dobro, u nekim slučajevima nećemo moći doći do tačke topljenja - može doći do hemijskog raspadanja.
Kako temperatura raste, molekuli se kreću sve brže i brže. Konačno, dolazi trenutak kada održavanje reda "među snažno" zamahnutim "molekulima postaje nemoguće. Čvrsto tijelo se topi. Volfram ima najvišu tačku topljenja: 3380 °C. Zlato se topi na 1063 °C, željezo na 1539 °C. Međutim, postoje i topljivi metali.Živa se kao što je poznato topi već na temperaturi od -39°C. Organske materije nemaju visoke tačke topljenja.Naftalen se topi na 80°C, toluen - na -94,5°C.
Nije nimalo teško izmjeriti tačku topljenja tijela, pogotovo ako se ono topi u temperaturnom rasponu koji se mjeri običnim termometrom. Uopšte nije potrebno očima pratiti tijelo koje se topi. Dovoljno je pogledati živin stupac termometra. Dok topljenje ne počne, telesna temperatura raste (slika 4.5). Čim topljenje počne, porast temperature prestaje i temperatura će ostati nepromijenjena sve dok se proces topljenja ne završi.
Kao i transformacija tečnosti u paru, transformacija čvrste supstance u tečnost zahteva toplotu. Toplina potrebna za to se zove latentna toplota topljenje. Na primjer, za otapanje jednog kilograma leda potrebno je 80 kcal.
Led je jedno od tijela s visokom toplinom fuzije. Za topljenje leda potrebno je, na primjer, 10 puta više energije nego za otapanje iste mase olova. Naravno mi pričamo o samom topljenju, ovdje ne kažemo da prije nego što počne topljenje olova, ono se mora zagrijati na +327 °C. Zbog visoke topline topljenja leda otapanje snijega se usporava. Zamislite da bi toplota topljenja bila 10 puta manja. Tada bi proljetne poplave svake godine donosile nezamislive katastrofe.
Dakle, toplota fuzije leda je velika, ali je i mala u poređenju sa njom specifična toplota isparavanje na 540 kcal / kg (sedam puta manje). Međutim, ova razlika je sasvim prirodna. Prilikom pretvaranja tekućine u paru moramo cijepati molekule jedan od drugog, a pri topljenju moramo samo uništiti red u rasporedu molekula, ostavljajući ih na gotovo istim udaljenostima. Jasno je da je u drugom slučaju potrebno manje posla.
Prisustvo određene tačke topljenja je važna karakteristika kristalnih supstanci. Na osnovu toga ih je lako razlikovati od drugih čvrstih materija, nazvanih amorfne ili staklene. Stakla se nalaze i među neorganskim i organskim supstancama. Prozorska stakla se obično izrađuju od natrijum i kalcijum silikata; često se organsko staklo stavlja na radni sto (zove se i pleksiglas).
Amorfne supstance, za razliku od kristala, nemaju određenu tačku topljenja. Staklo se ne topi, već omekšava. Kada se zagrije, komad stakla prvo postaje mekan od tvrdog, može se lako saviti ili rastegnuti; na višoj temperaturi, komad počinje mijenjati svoj oblik pod utjecajem vlastite gravitacije. Kako se zagrijava, gusta viskozna masa stakla poprima oblik posude u kojoj leži. Ova masa je u početku gusta, poput meda, zatim poput kisele pavlake, da bi na kraju postala tečnost skoro niskog viskoziteta kao voda. Uz svu našu želju, ovdje ne možemo naznačiti određenu temperaturu za prijelaz čvrstog u tekućinu. Razlozi za to leže u fundamentalnoj razlici između strukture stakla i strukture kristalnih tijela. Kao što je gore spomenuto, atomi u amorfna tela raspoređeni nasumično. Stakla po strukturi podsećaju na tečnosti, čak i u čvrstom staklu, molekuli su raspoređeni nasumično. To znači da povećanje temperature stakla samo povećava opseg vibracija njegovih molekula, dajući im postepeno sve više slobode kretanja. Zbog toga staklo postepeno omekšava i ne pokazuje oštar prelaz "čvrsto" - "tečno", što je karakteristično za prelazak sa rasporeda molekula po strogom redosledu na nasumični raspored.
Kada je riječ o krivulji ključanja, rekli smo da tekućina i para mogu, iako u nestabilnom stanju, živjeti u stranim regijama - para se može prehlađena i prenijeti lijevo od krive ključanja, tečnost se može pregrijati i povući udesno ove krive.
Jesu li slične pojave moguće u slučaju kristala s tekućinom? Ispada da je analogija ovdje nepotpuna.
Ako zagrijete kristal, on će se početi topiti na tački topljenja. Kristal se ne može pregrijati. Naprotiv, hlađenjem tečnosti moguće je, ako se preduzmu određene mere, relativno lako „provući“ kroz tačku topljenja. U nekim tečnostima mogu se postići velika pothlađivanja. Postoje čak i tečnosti koje je lako ohladiti, ali ih je teško učiniti da kristalizuju. Kako se takva tečnost hladi, postaje sve viskoznija i konačno se stvrdnjava bez kristalizacije. Takvo je staklo.
Takođe možete ponovo ohladiti vodu. Kapljice magle se ne smeju smrznuti čak ni pri jakom mrazu. Ako se kristal neke supstance, sjeme, baci u prehlađenu tekućinu, tada će odmah početi kristalizacija.
Konačno, u mnogim slučajevima odložena kristalizacija može biti pokrenuta mućkanjem ili drugim slučajni događaji. Poznato je, na primjer, da je kristalni glicerol prvi put dobiven tokom transporta željeznica. Čaše nakon dužeg stajanja mogu početi kristalizirati (devitrificirati, ili se "urušiti", kako se kaže u tehnici).






