Kako i kada se menja unutrašnja energija tela. Načini promjene unutrašnje energije
Saznajte kako možete izračunati promjenu unutrašnja energija tokom prenosa toplote. Da bi se to uradilo što preciznije, potrebno je minimizirati neobračunate gubitke toplote tokom razmene toplote. Stoga, kada naučno istraživanje prijenos topline se provodi u kalorimetru (slika 6.1), čija upotreba vam omogućava da precizno odredite toplinu koju tijelo daje ili prima u procesu prijenosa topline.
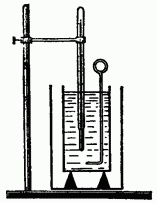
Kalorimetar se sastoji od dvije posude: vanjske i unutrašnje. Unutrašnja posuda je napravljena od dobrog provodnika toplote (mesing, bakar), jer njena temperatura mora biti ista kao i tečnosti koja se u nju sipa.
Vanjska posuda štiti unutrašnju posudu od gubitka topline konvekcijom i zračenjem. Stoga se najčešće farba bijelom bojom ili se pravi od sjajnog lima.
Da bi se unutrašnja posuda zaštitila od gubitka toplote provodljivošću, postavlja se na drvene nosače (drvo ima slabu toplotnu provodljivost). Stavite mješalicu (od istog materijala kao posuda) i termometar u unutrašnju posudu.
Izmjena topline se vrši na sljedeći način. Uz pomoć vaga određuje se masa unutrašnje posude kalorimetra i mješalice, a zatim masa tekućine koja se u nju ulijeva, na primjer vode. Nakon toga se izmjeri masa tijela, zagrije se na poznatu temperaturu i, uočava početna temperatura tečnost, spustite zagrijano tijelo u kalorimetar. Mjerenjem konačne temperature tekućine moguće je izračunati koliko je topline tijelo dalo u procesu prijenosa topline.
Uz pomoć ovakvih eksperimenata, lako je utvrditi da je promjena unutrašnje energije tijela direktno proporcionalna njegovoj masi i promjeni tjelesne temperature.
![]()
ovdje je c koeficijent proporcionalnosti. Pošto se promjena unutrašnje energije tokom prijenosa topline procjenjuje količinom toplote, imamo
Kao krajnja temperatura obično se označava početna temperatura tela, zatim u slučaju zagrevanja tela i u slučaju hlađenja.
Eksperimenti pokazuju da to zavisi od vrste supstance, od spoljni uslovi, iz agregatnog stanja materije. Ove zavisnosti su izražene koeficijentom c u formulama (6.1) i (6.2).
Vrijednost c koja karakterizira ovisnost promjene unutrašnje energije tijela tokom zagrijavanja ili hlađenja od vrste tvari i od vanjskih uslova naziva se specifična toplota supstance. Specifični toplinski kapacitet tvari mjeri se količinom topline koja je potrebna za zagrijavanje jedinice mase tvari po jediničnoj temperaturi:
![]()
Izvodimo jedinicu specifična toplota u SI:
U SI, jedinica specifičnog toplinskog kapaciteta je specifični toplinski kapacitet takve tvari za koju se 1 J energije troši na zagrijavanje mase od 1 kg po 1 K. Za male promjene temperature, specifični toplinski kapacitet se može smatrati konstantnim. Za rješavanje problema uzima se iz tabela.
Treba imati na umu da se prilikom određivanja količine toplote potrebne za zagrevanje ili oslobađanja prilikom hlađenja tela ponekad koristi toplotni kapacitet tela C - vrednost koja se meri količinom toplote koja je potrebna za zagrevanje tela po jedinici. temperatura. shodno tome,
Posebno je zgodno koristiti toplinski kapacitet cijelog tijela u proračunima kada su pojedini dijelovi tijela napravljeni od različitih tvari. U SI se uzima jedinica toplinskog kapaciteta tijela (Prikaži ovo pomoću formule (6.3).)
Također napominjemo da specifični toplinski kapacitet plina ovisi o prirodi procesa u kojem se zagrijava. Na primjer, specifični toplinski kapacitet plina pri konstantan pritisak veći od njegovog specifičnog toplotnog kapaciteta pri konstantan volumen budući da je u prvom slučaju potrebno ne samo povećati unutrašnju energiju gasa, već i potrošiti energiju da izvrši rad koji gas obavlja na spoljnim telima u procesu njegovog širenja (§ 5.10). U drugom slučaju, toplina dovedena u plin ide samo za povećanje njegove unutrašnje energije.
unutrašnja energija je zbir kinetičkih energija svih čestica koje čine tijelo, i potencijalne energije interakcije između ovih čestica. Ovo uključuje energiju interakcije elektrona sa jezgrima i energiju interakcije sastavni dijelovi jezgra.
Unutrašnja energija zavisi od njene temperature. Temperatura karakterizira prosječnu kinetičku energiju čestica tvari. Kada se temperatura promijeni, udaljenost između čestica se mijenja, stoga se mijenja i energija interakcije između njih.
Unutrašnja energija se također mijenja kada supstanca prijeđe iz jednog agregatnog stanja u drugo. Zovu se procesi povezani s promjenom temperature ili stanja agregacije tvari termalni. Toplotni procesi su praćeni promjenom unutrašnje energije tijela.
hemijske reakcije, nuklearne reakcije također su praćene promjenom unutrašnje energije tijela, tk. energija interakcije čestica uključenih u reakcije se mijenja. Unutrašnja energija se menja kada atomi emituju ili apsorbuju energiju tokom prelaska elektrona iz jedne ljuske u drugu.
Jedan od načini za promjenu unutrašnje energije je Posao. Dakle, pri trenju dvaju tijela njihova temperatura raste, tj. njihova unutrašnja energija se povećava. Na primjer, u obradi metala - bušenje, tokarenje, glodanje.
Kada dva tijela sa različitim temperaturama dođu u kontakt, energija se prenosi sa tijela sa visoke temperature na telo sa niskom temperaturom. Proces prijenosa energije s jednog tijela na drugo na nižoj temperaturi naziva se prijenos topline.
Dakle, u prirodi postoje dva procesa u kojima se mijenja unutrašnja energija tijela:
a) transformacija mehanička energija na unutrašnje i obrnuto; dok se posao obavlja;
b) prenos toplote; dok se ne radi.
Ako pomiješate toplu i hladnu vodu, onda iz iskustva možete vidjeti da je količina topline koja se odaje vruća voda, i količina toplote koju prima hladna voda jednake su jedna drugoj. Iskustvo pokazuje da ako dođe do razmene toplote između tela, onda se unutrašnja energija svih grejnih tela povećava za onoliko koliko se smanjuje unutrašnja energija rashladnih tela. Dakle, energija prelazi s jednog tijela na drugo, ali ukupna energija svih tijela ostaje nepromijenjena. to zakon održanja i transformacije energije.
U svim pojavama koje se dešavaju u prirodi energija ne nastaje i ne nestaje. Samo se mijenja iz jedne vrste u drugu, a njena vrijednost je očuvana.
Na primjer, olovni metak koji leti određenom brzinom udari u prepreku i zagrije se.
Ili se ledena ploha, koja pada iz snježnog oblaka, topi blizu tla.
Ili, kotlić vode se zagrije na plinskoj peći, dio vode ispari.
Zakon održanja energije je naučna osnova za proračune u svim oblastima nauke i tehnologije. Treba imati na umu da se potpuno unutrašnja energija ne može pretvoriti u mehaničku energiju.
Unutrašnja energija se može mijenjati na dva načina.
Ako se na tijelu vrši rad, povećava se njegova unutrašnja energija.
Unutrašnja energija tela(označeno kao E ili U) je zbir energija molekularnih interakcija i termičkih kretanja molekula. Unutrašnja energija je jednoznačna funkcija stanja sistema. To znači da kad god se sistem nađe u datom stanju, njegova unutrašnja energija poprima vrijednost inherentnu ovom stanju, bez obzira na historiju sistema. Shodno tome, promjena unutrašnje energije tokom prijelaza iz jednog stanja u drugo uvijek će biti jednaka razlici između njenih vrijednosti u konačnom i početnom stanju, bez obzira na put kojim je napravljen prijelaz.
Unutrašnja energija tijela ne može se izmjeriti direktno. Može se odrediti samo promjena unutrašnje energije:
Ova formula je matematički izraz prvog zakona termodinamike
Za kvazistatičke procese vrijedi sljedeći odnos:
Temperatura izmjerena u Kelvinima
Entropija, mjerena u džulima/kelvinima
Pritisak mjeren u paskalima
Broj čestica u sistemima
Toplota sagorevanja goriva. uslovno gorivo. Količina zraka potrebna za sagorijevanje goriva.
Kvalitet goriva se ocjenjuje prema njegovoj kalorijskoj vrijednosti. Indeks se koristi za karakterizaciju čvrstih i tečnih goriva. specifična toplota sagorijevanje, što je količina topline koja se oslobađa tijekom potpunog sagorijevanja jedinice mase (kJ/kg). Za gasovite vrste goriva, koristi se indikator zapreminske toplote sagorevanja, što je količina toplote koja se oslobađa tokom sagorevanja jedinice zapremine (kJ / m3). Osim toga, plinovito gorivo u nekim slučajevima se procjenjuje količinom topline koja se oslobađa tokom potpunog sagorijevanja jednog mola plina (kJ / mol).
Toplina sagorijevanja se određuje ne samo teoretski, već i empirijski, sagorijevanjem određene količine goriva u posebnim uređajima zvanim kalorimetri. Toplota sagorevanja se procenjuje povećanjem temperature vode u kolorimetru. Rezultati dobiveni ovom metodom su bliski vrijednostima izračunatim iz elementarnog sastava goriva.
Pitanje 14Promjena unutrašnje energije tokom grijanja i hlađenja. Rad gasa sa promjenom zapremine.
Unutrašnja energija tela zavisi na prosječnu kinetičku energiju njegovih molekula, a ta energija, zauzvrat, ovisi o temperaturi. Dakle, promjenom tjelesne temperature mijenjamo i njegovu unutrašnju energiju.Kada se tijelo zagrije unutrašnja energija mu se povećava, a kada se hladi, opada.
Unutrašnja energija tijela može se mijenjati bez obavljanja posla. Tako se, na primjer, može povećati zagrijavanjem kotlića vode na šporetu ili spuštanjem kašike u čašu toplog čaja. Zagreva se kamin u kome se loži vatra, krov kuće obasjan suncem itd. Povećanje temperature tela u svim ovim slučajevima znači povećanje njihove unutrašnje energije, ali to povećanje se dešava bez obavljanja posla. .
Promjena unutrašnje energije tijelo bez obavljanja rada naziva se prijenos topline. Prijenos topline se događa između tijela (ili dijelova istog tijela) koji imaju različite temperature.
Kako, na primjer, dolazi do prijenosa topline kada hladna kašika dođe u kontakt sa toplom vodom? Prvo, prosječna brzina i kinetička energija Molekuli tople vode premašuju prosječnu brzinu i kinetičku energiju metalnih čestica od kojih je napravljena žlica. Ali na onim mjestima gdje kašika dolazi u kontakt sa vodom, molekuli tople vode počinju da prenose deo svoje kinetičke energije na čestice kašike i one se kreću brže. U tom slučaju kinetička energija molekula vode opada, a kinetička energija čestica kašike raste. Zajedno sa energijom mijenja se i temperatura: voda se postepeno hladi, a kašika se zagrijava. Promjena njihove temperature događa se sve dok ne postane ista i za vodu i za žlicu.
Deo unutrašnje energije koji se prenosi sa jednog tela na drugo tokom razmene toplote označava se slovom i naziva se količina toplote.
Q je količina toplote.
Količina toplote ne treba mešati sa temperaturom. Temperatura se mjeri u stepenima, a količina toplote (kao i svaka druga energija) se mjeri u džulima.
Pri kontaktu tijela sa različite temperature toplije tijelo daje neku toplinu, a hladnije tijelo je prima.
Rad na izobaričnoj ekspanziji plina. Jedan od glavnih termodinamički procesi, koji se odvija u većini toplotnih motora, je proces ekspanzije gasa sa izvođenjem rada. Lako je odrediti rad obavljen tokom izobarnog širenja gasa.
Ako se pri izobaričnom širenju gasa od zapremine V1 do zapremine V2, klip pomera u cilindru na rastojanju l (slika 106), tada je rad A" koji obavlja gas jednak
Gdje je p tlak plina, promjena njegove zapremine.
Radite sa proizvoljnim procesom ekspanzije plina. Proizvoljni proces ekspanzije gasa od zapremine V1 do zapremine V2 može se predstaviti kao skup naizmeničnih izobaričnih i izohoričnih procesa.
Rad s izotermnom ekspanzijom plina. Upoređujući površine figura ispod presjeka izoterme i izobare, možemo zaključiti da je širenje plina iz zapremine V1 u zapreminu V2 pri istoj početnoj vrijednosti tlaka plina praćeno većim radom u slučaju izobarnog širenja.
Rad sa kompresijom gasa. Kada se plin širi, smjer vektora sile pritiska plina poklapa se sa smjerom vektora pomaka, stoga je rad A "koje ga obavlja plin pozitivan (A" > 0), a rad vanjskih sila A negativan: A \u003d -A "< 0.
Prilikom komprimiranja plina smjer vektora vanjske sile poklapa se sa smjerom kretanja, stoga je rad A vanjskih sila pozitivan (A > 0), a rad A "koje obavlja plin je negativan (A"< 0).
adijabatski proces. Pored izobarnog, izohornog i izotermni procesi, adijabatski procesi se često razmatraju u termodinamici.
adijabatski proces je proces koji se odvija u termodinamičkom sistemu u odsustvu razmene toplote sa okolnim telima, tj. pod uslovom Q = 0.
Pitanje 15 Uslovi za ravnotežu tela. Trenutak snage. Vrste balansa.
Ravnoteža, ili ravnoteža, brojnih srodnih fenomena u prirodnim i ljudskim naukama.
Smatra se da je sistem u stanju ravnoteže ako su svi uticaji na ovaj sistem nadoknađeni od strane drugih ili su potpuno odsutni. Sličan koncept je održivost. Ravnoteža može biti stabilna, nestabilna ili indiferentna.
Tipični primjeri ravnoteže:
1. Mehanička ravnoteža, poznata i kao statička ravnoteža, - stanje tijela koje miruje ili se kreće jednoliko, u kojem je zbir sila i momenata koji djeluju na njega jednak nuli.
2. Hemijska ravnoteža - pozicija u kojoj hemijska reakcija teče u istoj mjeri kao i obrnuta reakcija, i kao rezultat toga nema promjene u količini svake komponente.
3. Fizička ravnoteža ljudi i životinja, koja se održava razumijevanjem njene neophodnosti i, u nekim slučajevima, vještačkim održavanjem ove ravnoteže [izvor nije naveden 948 dana].
4. Termodinamička ravnoteža – stanje sistema u kojem njegovi unutrašnji procesi ne dovode do promena makroskopskih parametara (kao što su temperatura i pritisak).
R jednakost nuli algebarskog zbira momente sila takođe ne znači da je tijelo nužno u mirovanju. Nekoliko milijardi godina, rotacija Zemlje oko svoje ose nastavlja se sa konstantnim periodom upravo zato što je algebarski zbir momenata sila koje na Zemlju djeluju sa drugih tijela vrlo mali. Iz istog razloga, kotač bicikla koji se okreće nastavlja da se okreće stalnom frekvencijom, i to samo spoljne sile zaustavi ovu rotaciju.
Vrste balansa. U praksi važnu ulogu igra ne samo ispunjenje uslova ravnoteže za tijela, već i kvalitativna karakteristika ravnoteže, koja se zove stabilnost. Postoje tri vrste ravnoteže tijela: stabilna, nestabilna i indiferentna. Ravnoteža se naziva stabilnom ako se tijelo nakon malih vanjskih utjecaja vrati u prvobitno stanje ravnoteže. To se događa ako, uz neznatno pomicanje tijela u bilo kojem smjeru od početnog položaja, rezultanta sila koje djeluju na tijelo postane različita od nule i bude usmjerena prema ravnotežnom položaju. U stabilnoj ravnoteži je, na primjer, lopta na dnu udubljenja.
Opšti uslov za ravnotežu tela. Kombinirajući ova dva zaključka, možemo formulirati opći uvjet ravnoteže za tijelo: tijelo je u ravnoteži ako su geometrijski zbir vektora svih sila primijenjenih na njega i algebarski zbir momenata tih sila oko ose rotacije jednaki jednaka nuli.
Pitanje 16Isparavanje i kondenzacija. Isparavanje. Kipuća tečnost. Zavisnost ključanja tečnosti od pritiska.
isparavanje - svojstvo ispuštanja tečnosti da menja svoje stanje agregacije i pretvoriti u paru. Isparavanje koje se događa samo na površini tečnosti koja pada naziva se isparavanjem. Isparavanje po cijeloj zapremini tečnosti naziva se ključanje; javlja se na određenoj temperaturi, u zavisnosti od pritiska. Pritisak pri kojem tečnost ključa na datoj temperaturi naziva se pritisak. zasićene pare pnp, njegova vrijednost zavisi od vrste tečnosti i njene temperature.
Isparavanje je proces kojim se supstanca kreće iz tečno stanje u gasovitu (paru). Proces isparavanja je obrnut od procesa kondenzacije (prijelaz iz parnog u tečno stanje. Isparavanje (vaporizacija), prijelaz tvari iz kondenzirane (čvrste ili tekuće) faze u plinovitu (para); fazni prelaz prva vrsta.
Kondenzacija - to je obrnuti proces isparavanja. Tokom kondenzacije, molekuli pare se vraćaju u tečnost. U zatvorenoj posudi, tečnost i njena para mogu biti u stanju dinamičke ravnoteže kada je broj molekula koji izlaze iz tečnosti jednak broju molekula koji se vraćaju u tečnost iz pare, odnosno kada su brzine isparavanja i kondenzacija je ista. Takav sistem se naziva dvofazni sistem. Para koja je u ravnoteži sa svojom tečnošću naziva se zasićena. Broj molekula koji se emituju iz jedinice površine tekućine u jednoj sekundi ovisi o temperaturi tekućine. Broj molekula koji se vraćaju iz pare u tečnost zavisi od koncentracije molekula pare i od prosječna brzina njihovo toplotno kretanje, koje je određeno temperaturom pare.
Kipuće- proces isparavanja u tečnosti (prelazak supstance iz tečnosti u gasovitom stanju), sa pojavom granica razdvajanja faza. Tačka ključanja na atmosferski pritisak se obično navodi kao jedna od glavnih fizičko-hemijskih karakteristika hemijski čiste supstance.
Vrenje se razlikuje po vrsti:
1. ključanje sa slobodnom konvekcijom u velikoj zapremini;
2. ključanje pod prisilnom konvekcijom;
3. kao i u odnosu prosječna temperatura temperatura tečnosti do zasićenja:
4. ključanje tečnosti pothlađene do temperature zasićenja (površinsko ključanje);
5. ključanje tečnosti zagrijane do temperature zasićenja
Bubble
Kipuće , u kojem se para formira u obliku mjehurića koji se povremeno pojavljuju i rastu, naziva se nukleatno vrenje. Sa sporim ključanjem jezgara u tekućini (tačnije, po pravilu, na zidovima ili na dnu posude) pojavljuju se mjehurići ispunjeni parom. Zbog intenzivnog isparavanja tekućine unutar mjehurića, oni rastu, plutaju, a para se oslobađa u parnu fazu iznad tečnosti. U ovom slučaju, u sloju uz zid, tečnost je u malom pregrejanom stanju, tj. njegova temperatura prelazi nominalnu tačku ključanja. U normalnim uslovima, ova razlika je mala (od jednog stepena).
Film
Kada se toplinski tok poveća do određene kritične vrijednosti, pojedinačni mjehurići se spajaju, formirajući kontinuirani sloj pare u blizini stijenke posude, koji se povremeno probija u volumen tekućine. Ovaj način rada naziva se filmski način rada.
©2015-2017 site
Sva prava pripadaju njihovim autorima. Ova stranica ne tvrdi autorstvo, ali omogućava besplatno korištenje.






