Elektronska konfiguracija atoma svih elemenata. Elektronske ljuske atoma. Atomski Bohr modeli
Poznavanje mogućih stanja elektrona u atomu, pravilo Klečkovskog, Paulijev princip i Hundovo pravilo omogućavaju razmatranje elektronske konfiguracije atoma. Za to se koriste elektronske formule.
Elektronska formula označava stanje elektrona u atomu, označavajući glavno kvantni broj, karakterizira njegovo stanje, a slovo - orbitalni kvantni broj. Broj koji pokazuje koliko je elektrona u datom stanju ispisan je desno od vrha slova koji označava oblik elektronskog oblaka.
Za atom vodonika (n = 1, l = 0, m = 0), elektronska formula će biti: 1s 1. Oba elektrona sljedećeg elementa helija He karakteriziraju iste vrijednosti n, l, m i razlikuju se samo po spinovima. Elektronska formula atoma helijuma je ls 2 . Elektronska ljuska atoma helija je kompletna i vrlo stabilna. Helijum je plemeniti gas.
Za elemente 2. perioda (n = 2, l = 0 ili l = 1), prvo se popunjava 2s stanje, a zatim p-podnivo drugog energetskog nivoa.
Elektronska formula atoma litijuma je: ls 2 2s 1. Elektron 2s 1 je manje vezan za atomsko jezgro (slika 6), pa ga atom litija lako može odati (kao što se očito sjećate, ovaj proces se naziva oksidacija), pretvarajući se u Li + ion.
Rice. 6.
Poprečni presjeci 1s i 2s elektronskih oblaka ravninom koja prolazi kroz jezgro
U atomu berilijuma, četvrti elektron takođe zauzima 2s stanje: ls 2 2s 2 . Dva vanjska elektrona atoma berilija se lako odvajaju - u ovom slučaju Be oksidira u kation Be 2+.
Atom bora ima elektron u 2p stanju: ls 2 2s 2 2p 1 . Dalje, kod atoma ugljika, dušika, kisika i fluora (u skladu s Hundovim pravilom), popunjava se 2p podnivo, koji se završava na plemenitom plinu neonu: ls 2 2s 2 2p 6 .
Ako želimo da naglasimo da elektroni na datom podnivou zauzimaju kvantne ćelije jedan po jedan, u elektronskoj formuli oznaka podnivoa prati indeks. Na primjer, elektronska formula atoma ugljika
![]()
Za elemente 3. perioda popunjavaju se 3s-stanje (n = 3, l = 0) i 3p-podnivo (n = 3, l - 1). 3d-podnivo (n = 3, l = 2) ostaje slobodan:
Ponekad je u dijagramima koji prikazuju distribuciju elektrona u atomima naznačen samo broj elektrona na svakom energetskom nivou, odnosno zapisuju skraćene elektronske formule atoma hemijski elementi, za razliku od potpunih elektronskih formula iznad, na primjer:
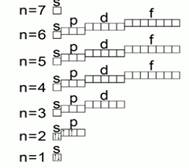
U elementima velikih perioda (4. i 5.), u skladu sa pravilom Klečkovskog, prva dva elektrona spoljašnjeg elektronskog sloja zauzimaju, respektivno, 4s-(n = 4, l = 0) i 5s-stanja (n = 5, l = 0):
Počevši od trećeg elementa svakog velikog perioda, sljedećih deset elektrona ulazi u prethodni 3d i 4d podnivo, respektivno (za elemente bočnih podgrupa):
Po pravilu, kada se popuni prethodni d-podnivo, tada će se početi puniti vanjski (odnosno 4p- i 5p) p-podnivo:
Za elemente velikih perioda - 6. i nepotpuni 7. - energetski nivoi i podnivoi su ispunjeni elektronima, po pravilu, na sljedeći način: prva dva elektrona ulaze u vanjski s-podnivo, na primjer:
sljedeći elektron (za La i Ac) - na prethodni d-podnivo:
Zatim sljedećih 14 elektrona ulazi u treći energetski nivo izvana na 4f- i 5f-podnivo, respektivno, za lantanide i aktinide:
Tada će drugi vanjski energetski nivo (d-podnivo) ponovo početi da se gradi za elemente bočnih podgrupa:
Tek nakon što je d-podnivo potpuno ispunjen sa deset elektrona, vanjski p-podnivo će biti ponovo ispunjen:
U zaključku ćemo još jednom razmotriti različite načine prikaza elektronskih konfiguracija atoma elemenata prema periodima tabele D. I. Mendeljejeva.
Razmotrite elemente 1. perioda - vodonik i helijum.

Elektronske formule atoma pokazuju distribuciju elektrona po energetskim nivoima i podnivoima.
Grafičke elektronske formule atoma pokazuju distribuciju elektrona ne samo po nivoima i podnivoima, već i po kvantne ćelije (atomske orbitale).

U atomu helija, prvi elektronski sloj je završen - ima 2 elektrona.
Vodik i helijum su s-elementi; ls-podnivo ovih atoma je ispunjen elektronima.
Za sve elemente 2. perioda, prvi elektronski sloj je popunjen, a elektroni ispunjavaju 2s- i 2p-stanja u skladu sa principom najmanje energije (prvo S-, a zatim p) i pravilima Paulija i Hunda ( Tabela 2).
U atomu neona, drugi elektronski sloj je završen - ima 8 elektrona.
tabela 2
Struktura elektronskih ljuski atoma elemenata 2. perioda

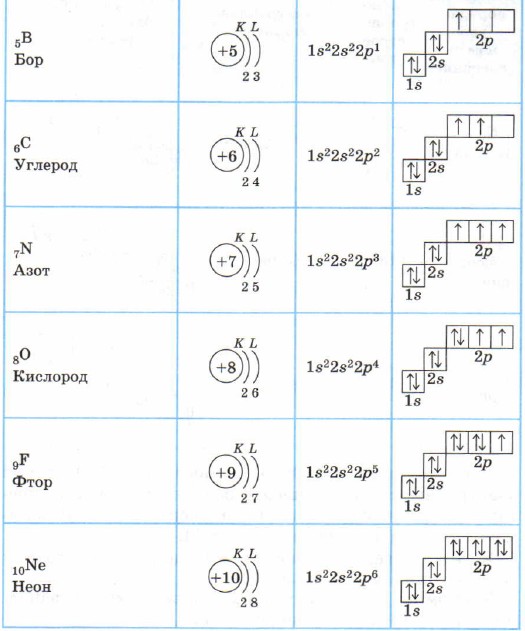
Litijum Li, berilijum Be - s-elementi.
Bor B, ugljenik C, azot N, kiseonik O, fluor F, neon Ne su p-elementi, p-podnivo ovih atoma je ispunjen elektronima.
Za atome elemenata 3. perioda, prvi i drugi elektronski sloj su završeni, pa je ispunjen treći elektronski sloj u kojem elektroni mogu zauzimati 3s, 3p i 3d stanja (tablica 3).
Tabela 3
Struktura elektronskih ljuski atoma elemenata 3. perioda
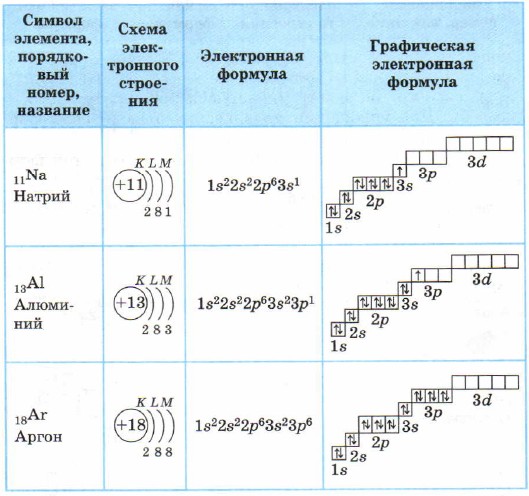
Na atomu magnezija, 3s podnivo je završen. Natrijum Na i magnezijum Mg su s-elementi.
Za aluminijum i elemente koji ga prate, 3p podnivo je ispunjen elektronima.
Postoji 8 elektrona u vanjskom sloju (treći elektronski sloj) u atomu argona. Kao vanjski sloj, on je kompletan, ali ukupno u trećem elektronskom sloju, kao što već znate, može biti 18 elektrona, što znači da elementi 3. perioda imaju prazno 3d stanje.
Svi elementi od aluminijuma Al do argona Ar su p-elementi.
s- i p-elementi čine glavne podgrupe u periodičnom sistemu.
Atomi elemenata 4. perioda - kalija i kalcija - imaju četvrti energetski nivo, 48-podnivo je ispunjen (tabela 4), budući da, prema pravilu Klečkovskog, ima manje energije od 3d-podnivoa.
Tabela 4
Struktura elektronskih ljuski atoma elemenata 4. perioda
![]()
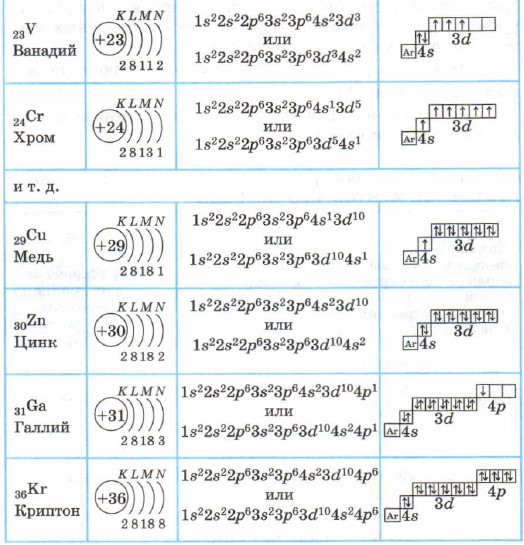
Da pojednostavimo grafičke elektronske formule atoma elemenata 4. perioda:
Kalijum K i kalcijum Ca su s-elementi uključeni u glavne podgrupe. U atomima od skandijuma Sc do cinka Zn, 3d podnivo je ispunjen elektronima. Ovo su 3d elementi. Uvršteni su u sekundarne podgrupe, imaju pred-eksterni elektronski sloj ispunjen, nazivaju se prijelaznim elementima.
Obratite pažnju na strukturu elektronskih ljuski atoma hroma i bakra. Kod njih dolazi do „otpada“ jednog elektrona sa 4s- na 3d-podnivo, što se objašnjava većom energetskom stabilnošću nastalih elektronskih konfiguracija 3d 5 i 3d 10:
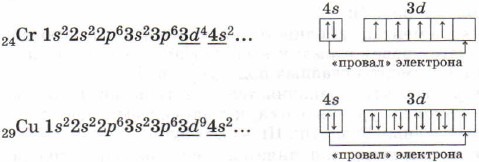
U atomu cinka, treći energetski nivo je završen, u njemu su ispunjeni svi podnivoi - 3s, 3p i 3d, ukupno imaju 18 elektrona.
U elementima nakon cinka, četvrti energetski nivo, 4p podnivo, nastavlja da se popunjava.
Elementi od galija Ga do kriptona Kr su p-elementi.
Vanjski sloj (četvrti) atoma kriptona Kr je potpun i ima 8 elektrona. Ali samo u četvrtom elektronskom sloju, kao što znate, može biti 32 elektrona; 4d i 4f stanja atoma kriptona i dalje ostaju nezauzeta.
Za elemente 5. perioda, u skladu sa pravilom Klečkovskog, podnivoi se popunjavaju sledećim redosledom: 5s ⇒ 4d ⇒ 5p. A tu su i izuzeci povezani sa "neuspjehom" elektrona u 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
U 6. i 7. periodu pojavljuju se f-elementi, odnosno elementi u kojima se popunjavaju 4f- i 5f-podnivo trećeg energetskog nivoa izvana.
4f elementi se nazivaju lantanidi.
5f-elementi se nazivaju aktinidi.
Redosled popunjavanja elektronskih podnivoa u atomima elemenata 6. perioda: 55 Cs i 56 Ba - bs-elementi; 57 La ...6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - 4f elementi; 72 Hf - 80 Hg - 5d elementi; 81 Tl - 86 Rn - br elementi. Ali i ovdje postoje elementi u kojima je „narušen“ redoslijed punjenja energetskih podnivoa, što je, na primjer, povezano sa većom energetskom stabilnošću polu i potpuno ispunjenih f-podnivoa, odnosno nf 7 i nf 14 .
Ovisno o tome koji je podnivo atoma posljednji ispunjen elektronima, svi elementi, kao što ste već shvatili, podijeljeni su na četiri elektronska porodica ili blok (slika 7):

Rice. 7.
Podjela periodnog sistema (tabela) na blokove elemenata
- s-elementi; s-podnivo vanjskog nivoa atoma je ispunjen elektronima; s-elementi uključuju vodonik, helijum i elemente glavnih podgrupa grupa I i II;
- p-elementi; p-podnivo vanjskog nivoa atoma je ispunjen elektronima; p-elementi obuhvataju elemente glavnih podgrupa III-VIII grupa;
- d-elementi; d-podnivo predspoljnog nivoa atoma je ispunjen elektronima; d-elementi obuhvataju elemente sekundarnih podgrupa grupa I-VIII, odnosno elemente interkalarnih decenija velikih perioda koji se nalaze između s- i p-elemenata. Oni se također nazivaju prijelaznim elementima;
- f-elementi; f-podnivo trećeg vanjskog nivoa atoma je ispunjen elektronima; tu spadaju lantanidi i aktinidi.
Pitanja i zadaci za § 3
- Napravite dijagrame elektronske strukture, elektronske formule i grafičke elektronske formule atoma sledećih hemijskih elemenata:
- a) kalcijum;
b) gvožđe;
c) cirkonijum;
d) niobijum;
e) hafnijum;
e) zlato. - Napišite elektronsku formulu za element #110 koristeći simbol za odgovarajući plemeniti plin.
- Šta je "dip" elektrona? Navedite primjere elemenata u kojima se uočava ova pojava, zapišite njihove elektronske formule.
- Kako se određuje pripadnost nekog hemijskog elementa određenoj elektronskoj porodici?
- Uporedite elektronske i grafičke elektronske formule atoma sumpora. Šta Dodatne informacije sadrži posljednju formulu?
U ovoj lekciji ćete naučiti o elektronskim omotačima atoma, šta su Borovi atomski modeli. Ponavljate strukturu atomsko jezgro, zatim preći na razmatranje modernih pogleda u proučavanju elektronskih ljuski atoma, uslovnih slika elektronskih nivoa i podnivoa. Također ćete razmotriti Borove atomske modele.
Tema: Periodični zakon i periodični sistem hemijskih elemenata D. I. Mendeljejeva
Lekcija: Elektronske ljuske atoma. Atomski Bohr modeli
1. Postulati N. Bohra
Atomsko jezgro se sastoji od protona - pozitivno nabijenih čestica i neutrona - čestica koje nemaju naboj. U ovoj lekciji ćemo pogledati strukturu elektronske ljuske atoma.
Rice. 1. Planetarni model atoma
1913. danski fizičar Niels Bohr sugerirao je da je atom po strukturi sličan strukturi Solarni sistem. Unutar atoma, kao i unutar Sunčevog sistema, Sunce je masivno jezgro, u kojem je koncentrisana cijela masa atoma. I oko ovog jezgra, poput planeta oko Sunca, kruže elektroni. Fig.1. Elektron ima masu 1832 puta manju od protona ili neutrona. Model Nielsa Bora bio je zasnovan na modelu njegovog učitelja Ernesta Rutherforda.
Niels Bohr je sugerirao da se elektroni u atomu ne kreću nasumično, već da se kreću određenim orbitama. On je pretpostavio, odnosno prihvatio bez dokaza, dvije tvrdnje.
Postulati Nielsa Bohra.
1. U atomu postoje orbite na kojima elektron ne zrači energiju. Ove orbite se nazivaju stacionarne.
2. Zračenje se javlja samo kada elektron skoči iz jedne stacionarne orbite u drugu.
2. Struktura elektronske ljuske atoma
Prema kvantna teorija strukture atoma, svi elektroni u atomu se kreću duž energetskih nivoa ili orbita. Ovi nivoi se sastoje od podnivoa. Zauzvrat, podnivoi se sastoje od atomskih orbitala. Takvu strukturu je lako zamisliti ako pretpostavimo da je elektronska ljuska atoma kuća koja stoji na jezgru. Kuća se sastoji od više etaža - nivoa. Svaki nivo ima podnivo - to su stanovi. Stanovi imaju atomske orbitale, odnosno sobe. Ne možemo odrediti specifičnu lokaciju elektrona u orbitalama, već odrediti vjerovatnoću da se nalazi u atomskim orbitalama.
Nivoi.
Elektronske orbite u Borovom modelu su označene cijelim brojevima: 1, 2, 3, 4, ... i tako dalje do n, ili latiničnim slovima po abecedi, počevši od slova K, L, M, N, O P, Q Počevši od nivoa najbližeg jezgru. U nastavku ćemo takve orbite zvati – nivoi.
Podnivoi.
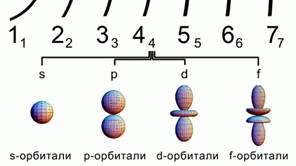
Rice. 2. Oblici atomskih orbitala
Nivoi se pak sastoje od podnivoa. Broj podnivoa na svakom nivou jednak je broju nivoa. Podnivoi imaju imena.
Prvi podnivo svakog nivoa naziva se S,
Drugi podnivo svakog nivoa naziva se P,
Treći podnivo svakog nivoa naziva se d,
Četvrti podnivo svakog nivoa naziva se f
Orbitale dolaze u različitim oblicima.
s - sferna orbitala, p-orbitala ima oblik zapremine osam. d i f orbitale su čak i više složenog oblika. Slika 2.
Sve ove brojke ocrtavaju područje najvjerovatnije pronalaženje elektrona u atomu.
Talasni model atoma nije fizički model, a uskoro i sažetak ili matematički model struktura atoma, raspored elektrona u njemu.
S - elementi.
To su elementi koji sadrže samo s-elektrone na vanjskom nivou.
Ako su to p - elektroni, onda je ovo p - element.
Što se energetski nivo nalazi dalje od jezgra, to može da primi više elektrona, jer svaki naredni energetski nivo ima veći broj podnivoa. Dakle, svaki N nivo može imati n2 podnivoa. Prema tome, elektroni mogu prihvatiti 2n2. Zašto smo n2 pomnožili sa 2? Zato što u svakoj atomskoj orbitali ne može biti više od 2 elektrona.
Najveći broj elektrona na svakom nivou dat je u tabeli 1.
Rice. 3. Orbitalni dijagram
Sve ove informacije su nam potrebne da bismo naučili kako da smestimo elektrone u atomske nivoe, podnivoe i orbitale.
3. Kvantni dijagram
Postoji uslovna slika elektronskih nivoa i podnivoa. Ovo je orbitalni ili kvantni dijagram. U takvom dijagramu, orbitale su konvencionalno prikazane kao kvadrati, a elektroni kao strelice. Rice. 3. Ako se u jednoj ćeliji nalaze dvije strelice, one će biti označene strelicama koje pokazuju u različitim smjerovima. Ovo svojstvo elektrona naziva se spin.
Nakon što ste ispunili sve atomske orbitale elektronima, morate napisati "elektronski pasoš" elementa ili njegovu elektronsku formulu. Da biste to učinili, svaki energetski nivo morate označiti brojem 1, 2, 3, ..., a podnivo slovom s, p, d ...
Kao stepen, izuzmite broj elektrona u datom podnivou.
4. Elektronska struktura atoma dušika
Primjer #1.

Rice. 4. Elektronska formula dušika
Zapišite elektronsku formulu hemijskog elementa sa atomskim brojem 7.
Atom takvog elementa trebao bi imati 7 elektrona. Napunimo orbitale elektronima, počevši od donjih 1s.
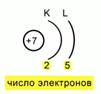
Rice. 5. Dijagram rasporeda elektrona u atomu
Dobija se sljedeća elektronska konfiguracija: 1s22s22p3.Sl.4.
Nakon toga, morate popraviti lokaciju elektrona u smislu energetskih nivoa. Da biste to učinili, trebate shematski prikazati jezgro, naznačiti njegov naboj i odrediti broj nivoi energije. Da vas podsjetim da ih dušik ima samo 2. Crtamo 2 luka, a ispod ovih lukova upisujemo broj elektrona koji se na njima nalaze. Tada dobijamo takvu šemu elektronskog rasporeda u atomu. Fig.5.
5. Elektronska struktura atoma argona
Primjer #2.
Zapišite elektronsku formulu hemijskog elementa sa atomskim brojem 18.
Postupajući na isti način kao u prvom slučaju, rasporedit ćemo elektrone u atomske orbitale. 1s22s22p63s23p6. Ovo je element argon. Fig.6. Prevedeno sa grčkog "neaktivan". Dobio je ovo ime jer ne stupa u interakciju ni sa jednim hemijskim elementom.
Elementi sa završenom vanjskom elektronskom ljuskom.
Uključeno u podgrupu plemenitih ili inertnih gasova. Njihova inertnost je uzrokovana strukturom njihovog atoma. Ovi plinovi imaju kompletnu vanjsku energetsku ljusku - ns2np6. Inertni plinovi formiraju jednoatomsku molekulu. Svi ostali plinovi u prirodi imaju samo dvoatomsku molekulu. Na primjer, O2, H2 Razlog stabilnosti hemijskih elemenata sa završenom elektronskom ljuskom još nije jasan. Ali hemičari to shvataju jednostavno kao zakon prirode. Svi ostali elementi će težiti da dovrše svoju vanjsku ljusku.
6. Etimologija oznaka elektronskih orbitala
Biće zanimljivo znati zašto se podnivoi određenih nivoa nazivaju određenim slovima. engleska abeceda. Svaki atom emituje energiju. Ova energija se može fiksirati u emisionim spektrima atoma. Različiti emisioni spektri atoma imaju različite vrste. Njihove linije su različite. Tako su najuže oštre linije nazvane slovom s. Od engleska riječ"lopta".
s - podnivo je nazvan po "oštroj" liniji
p - podnivo je nazvan po "glavnoj" liniji
d - podnivo je nazvan po "difuznoj", "zamućenoj" (difuznoj) liniji
f - podnivo je nazvan po "osnovnoj" liniji
7. Neke informacije o inertnim gasovima


Zbog svoje hemijske inertnosti, plemeniti gasovi dugo nisu bili poznati u hemiji. Tek 1892. godine dobijen je prvi inertni gas argon. Primio ga je D. Rayleigh. Dobio ga je tokom eksperimenata sa azotom. D. Rayleigh je primijetio da ako se dušik dobije iz zraka, onda će ovaj plin azota imati veću masu nego ako se dušik dobije u različitim kemijskim eksperimentima. Ako se iz vazduha dobije 1 litar azota, onda će imati masu od 1,2572 g, a ako se azot dobije razgradnjom azotnih jedinjenja, onda će masa biti 1,2505 g. Odakle tolika razlika? Mnogi naučnici su mislili da su upravo izveli eksperiment i prestali da vagaju vazduh dobijen na ovaj način. D. Rayleigh sa svojim prijateljem W. Ramsayem. Sproveli su mnoge eksperimente i potvrdili da gas azota dobijen iz vazduha u svom sastavu sadrži još neki gas, koji je bio 20 puta teži od vodonika. Tako je prvi put izolovan argon. Sve do 60-ih godina XX veka nije dobijeno nijedno jedinjenje inertnih gasova. Sada su naučili kako umjetno dobiti spojeve inertnih plinova s fluorom i kisikom. Ako rastavite običnu sijalicu sa žarnom niti, naići ćete na plin argon. Ali to ne bi trebalo da radite, jer se možete povrediti.
Sumiranje lekcije.
U ovoj lekciji naučili ste o elektronskim omotačima atoma, šta su Borovi atomski modeli. Ponovili ste strukturu atomskog jezgra, smatrate modernim pogledima u proučavanju elektronskih omotača atoma, uslovne slike elektronskih nivoa i podnivoa. Razmotrili su Borove atomske modele. Na časovima hemije u 11. razredu detaljnije ćemo razmotriti strukturu jezgra.
1. Rudzitis G. E. Neorganski i organska hemija. 8. razred: udžbenik za obrazovne institucije: osnovni nivo / G. E. Rudzitis, F. G. Feldman. M.: Prosvetljenje. 2011 176 str.: ilustr.
2. Popel P. P. Hemija: 8. razred: udžbenik za opšteobrazovne ustanove / P. P. Popel, L. S. Krivlya. - K.: Informativni centar "Akademija", 2008.-240 str.: ilustr.
3. Gabrielyan O. S. Hemija. 9. razred Udžbenik. Izdavač: Drofa.: 2001. 224s.
1. Chemport. ru.
1. br. 4-6 (str. 138) Rudzitis G. E. Neorganska i organska hemija. 8. razred: udžbenik za obrazovne ustanove: osnovni nivo / G. E. Rudzitis, F. G. Feldman. M.: Prosvetljenje. 2011 176 str.: ilustr.
2. Na osnovu strukture atoma objasniti razlog periodičnosti osobina hemijskih elemenata.
3. Pripremite kratak izvještaj o historiji otkrića inertnih plinova.
Atomsko jezgro se sastoji od protona - pozitivno nabijenih čestica i neutrona - čestica koje nemaju naboj. U ovoj lekciji ćemo pogledati strukturu elektronske ljuske atoma.
Rice. 1. Planetarni model atoma
1913. danski fizičar Niels Bohr sugerirao je da je atom po strukturi sličan strukturi Sunčevog sistema. Unutar atoma, kao i unutar Sunčevog sistema, Sunce je masivno jezgro, u kojem je koncentrisana cijela masa atoma. I oko ovog jezgra, poput planeta oko Sunca, kruže elektroni. Fig.1. Elektron ima masu 1832 puta manju od protona ili neutrona. Model Nielsa Bora bio je zasnovan na modelu njegovog učitelja Ernesta Rutherforda.
Niels Bohr je sugerirao da se elektroni u atomu ne kreću nasumično, već da se kreću određenim orbitama. On je pretpostavio, odnosno prihvatio bez dokaza, dvije tvrdnje.
Postulati Nielsa Bohra.
1. U atomu postoje orbite na kojima elektron ne zrači energiju. Ove orbite se nazivaju stacionarne.
2. Zračenje se javlja samo kada elektron skoči iz jedne stacionarne orbite u drugu.
Prema kvantnoj teoriji atomske strukture, svi elektroni u atomu kreću se duž energetskih nivoa ili orbita. Ovi nivoi se sastoje od podnivoa. Zauzvrat, podnivoi se sastoje od atomskih orbitala. Takvu strukturu je lako zamisliti ako pretpostavimo da je elektronska ljuska atoma kuća koja stoji na jezgru. Kuća se sastoji od više etaža - nivoa. Svaki nivo ima podnivo - to su stanovi. Stanovi imaju atomske orbitale, tj. sobe. Ne možemo odrediti specifičnu lokaciju elektrona u orbitalama, već odrediti vjerovatnoću da se nalazi u atomskim orbitalama.
Nivoi.
Elektronske orbite u Borovom modelu su označene cijelim brojevima: 1, 2, 3, 4, ... i tako dalje dok se n, ili latiničnim slovima po abecednom redu, počevši slovom K, L, M, N, O P, Q. Počevši od nivoa najbližeg jezgru. U nastavku ćemo takve orbite zvati – nivoi.
Podnivoi.

Rice. 2. Oblici atomskih orbitala
Nivoi se pak sastoje od podnivoa. Broj podnivoa na svakom nivou jednak je broju nivoa. Podnivoi imaju imena.
Prvi podnivo svakog nivoa naziva se S,
Drugi podnivo svakog nivoa naziva se P,
Treći podnivo svakog nivoa naziva se d,
Četvrti podnivo svakog nivoa naziva se f
Orbitale dolaze u različitim oblicima.
S-orbitala je sferna, p-orbitala ima oblik zapremine 8. d, a f-orbitale su još složenije. Slika 2.
Sve ove brojke ocrtavaju područje najveće vjerovatnoće pronalaženja elektrona u atomu.
Valni model atoma nije fizički model, već prije apstraktni ili matematički model strukture atoma, rasporeda elektrona u njemu.
S - elementi.
To su elementi koji sadrže samo s-elektrone na vanjskom nivou.
Ako su to p - elektroni, onda je ovo p - element.
Što se energetski nivo nalazi dalje od jezgra, to može da primi više elektrona, jer svaki naredni energetski nivo ima veći broj podnivoa. Dakle, na svakom n nivou može biti n 2 orbitale. Prema tome, elektroni mogu prihvatiti 2n 2 . Zašto smo n 2 pomnožili sa 2? Zato što u svakoj atomskoj orbitali ne može biti više od 2 elektrona.
Najveći broj elektrona na svakom nivou dat je u tabeli 1.

Rice. 3. Orbitalni dijagram
Sve ove informacije su nam potrebne da bismo naučili kako da smestimo elektrone u atomske nivoe, podnivoe i orbitale.
Postoji uslovna slika elektronskih nivoa i podnivoa. Ovo je orbitalni ili kvantni dijagram. U takvom dijagramu, orbitale su konvencionalno prikazane kao kvadrati, a elektroni kao strelice. Rice. 3. Ako se u jednoj ćeliji nalaze dvije strelice, one će biti označene strelicama koje pokazuju u različitim smjerovima. Ovo svojstvo elektrona naziva se spin.
Nakon što ste ispunili sve atomske orbitale elektronima, morate napisati "elektronski pasoš" elementa ili njegovu elektronsku formulu. Da biste to učinili, svaki energetski nivo morate označiti brojem 1, 2, 3, ..., a podnivo slovom s, p, d ...
Kao stepen, izuzmite broj elektrona u datom podnivou.
Primjer #1.

Rice. 4. Elektronska formula dušika
Zapišite elektronsku formulu hemijskog elementa sa atomskim brojem 7.
Atom takvog elementa trebao bi imati 7 elektrona. Napunimo orbitale elektronima, počevši od donjih 1s.

Rice. 5. Dijagram rasporeda elektrona u atomu
Dobija se sljedeća elektronska konfiguracija: 1s 2 2s 2 2p 3. Sl.4.
Nakon toga, morate popraviti lokaciju elektrona u smislu energetskih nivoa. Da biste to učinili, trebate shematski prikazati jezgro, naznačiti njegov naboj i odrediti broj energetskih nivoa. Da vas podsjetim da ih dušik ima samo 2. Crtamo 2 luka, a ispod ovih lukova upisujemo broj elektrona koji se na njima nalaze. Tada dobijamo takvu šemu elektronskog rasporeda u atomu. Sl.5.
Primjer #2.
Zapišite elektronsku formulu hemijskog elementa sa atomskim brojem 18.
Postupajući na isti način kao u prvom slučaju, rasporedit ćemo elektrone u atomske orbitale. 1s 2 2s 2 2p 6 3s 2 3p 6 . Ovo je element argon. Fig.6. Prevedeno sa grčkog "neaktivan". Dobio je ovo ime jer ne stupa u interakciju ni sa jednim hemijskim elementom.
Elementi sa završenom vanjskom elektronskom ljuskom.
Uključeno u podgrupu plemenitih ili inertnih gasova. Njihova inertnost je uzrokovana strukturom njihovog atoma. Ovi plinovi imaju kompletnu vanjsku energetsku ljusku - ns 2np 6 . Inertni plinovi formiraju jednoatomsku molekulu. Svi ostali plinovi u prirodi imaju samo dvoatomsku molekulu. Na primjer, O 2, H 2. Razlog stabilnosti hemijskih elemenata sa završenom elektronskom ljuskom još nije jasan. Ali hemičari to shvataju jednostavno kao zakon prirode. Svi ostali elementi će težiti da dovrše svoju vanjsku ljusku.
Biće zanimljivo znati zašto se podnivoi određenih nivoa nazivaju određenim slovima engleske abecede. Svaki atom emituje energiju. Ova energija se može fiksirati u emisionim spektrima atoma. Različiti emisioni spektri atoma imaju drugačiji oblik. Njihove linije su različite. Tako su najuže oštre linije nazvane slovom s. Od engleske riječi "lopta".
s- podnivo nazvan po "oštroj" liniji
p-podnivo je nazvan po "glavnoj" liniji
d- podnivo je nazvan po "difuznoj", "zamućenoj" (difuznoj) liniji
f-podnivo je nazvan po "osnovnoj" liniji


Zbog svoje hemijske inertnosti, plemeniti gasovi dugo nisu bili poznati u hemiji. Tek 1892. godine dobijen je prvi inertni gas argon. Primio ga je D. Rayleigh. Dobio ga je tokom eksperimenata sa azotom. D. Rayleigh je primijetio da ako se dušik dobije iz zraka, onda će ovaj plin azota imati veću masu nego ako se dušik dobije u različitim kemijskim eksperimentima. Ako se iz vazduha dobije 1 litar azota, onda će imati masu od 1,2572 g, a ako se azot dobije razgradnjom azotnih jedinjenja, onda će masa biti 1,2505 g. Odakle tolika razlika? Mnogi naučnici su mislili da su upravo izveli eksperiment i prestali da vagaju vazduh dobijen na ovaj način. D. Rayleigh sa svojim prijateljem W. Ramsayem. Sproveli su mnoge eksperimente i potvrdili da gas azota dobijen iz vazduha u svom sastavu sadrži još neki gas, koji je bio 20 puta teži od vodonika. Tako je prvi put izolovan argon. Sve do 60-ih godina XX veka nije dobijeno nijedno jedinjenje inertnih gasova. Sada su naučili kako umjetno dobiti spojeve inertnih plinova s fluorom i kisikom. Ako rastavite običnu sijalicu sa žarnom niti, naići ćete na plin argon. Ali to ne bi trebalo da radite, jer se možete povrediti.
Sumiranje lekcije.
U ovoj lekciji naučili ste o elektronskim omotačima atoma, šta su Borovi atomski modeli. Ponovili ste strukturu atomskog jezgra, smatrate modernim pogledima u proučavanju elektronskih omotača atoma, uslovne slike elektronskih nivoa i podnivoa. Razmotrili su Borove atomske modele. Detaljnije ćemo pogledati časove hemije u 11. razredu.
1. Rudžitis G.E. Neorganska i organska hemija. 8. razred: udžbenik za obrazovne ustanove: osnovni nivo / G. E. Rudzitis, F.G. Feldman. M.: Prosvetljenje. 2011 176 str.: ilustr.
2. Popel P.P. Hemija: 8. razred: udžbenik za opšteobrazovne ustanove / P.P. Popel, L.S. Krivlya. -K.: IC "Akademija", 2008.-240 str.: ilustr.
3. Gabrielyan O.S. hemija. 9. razred Udžbenik. Izdavač: Drofa.: 2001. 224s.
1. br. 4-6 (str. 138) Rudžitis G.E. Neorganska i organska hemija. 8. razred: udžbenik za obrazovne ustanove: osnovni nivo / G. E. Rudzitis, F.G. Feldman. M.: Prosvetljenje. 2011 176 str.: ilustr.
2. Na osnovu strukture atoma objasniti razlog periodičnosti osobina hemijskih elemenata.
3. Pripremite kratak izvještaj o historiji otkrića inertnih plinova.






