Ono što se zove zasićena para. Velika enciklopedija nafte i gasa
Prije nego odgovorimo na pitanje postavljeno u naslovu članka, hajde da shvatimo što je steam. Slike koje većina ljudi ima uz ovu riječ: kuhalo za vodu ili lonac, parna soba, topli napitak i još mnogo sličnih slika. Na ovaj ili onaj način, u našim idejama postoji tekućina i plinovita tvar koja se diže iznad njene površine. Ako se od vas zatraži da navedete primjer pare, odmah ćete se sjetiti vodene pare, isparenja alkohola, etra, benzina, acetona.

Postoji još jedna reč za gasovita stanja - gas. Ovdje obično mislimo na kisik, vodonik, dušik i druge plinove, a da ih ne povezujemo s odgovarajućim tekućinama. Poznato je da postoje i u tečno stanje. Na prvi pogled, razlike leže u činjenici da para odgovara prirodnim tečnostima, a gasovi se moraju namerno ukapljivati. Međutim, to nije sasvim tačno. Štaviše, slike koje nastaju uz riječ para nisu para. Da bismo dali precizniji odgovor, pogledajmo kako nastaje para.
Po čemu se para razlikuje od gasa?
Stanje agregacije tvari je određeno temperaturom, tačnije omjerom između energije s kojom su njeni molekuli u interakciji i energije njihovog toplinskog haotičnog kretanja. Približno, možemo pretpostaviti da ako je energija interakcije mnogo veća - čvrsto stanje, ako je energija toplotnog kretanja mnogo veća - gasovita, ako su energije uporedive - tečna.

Ispada da da bi se molekul odvojio od tečnosti i učestvovao u formiranju pare, vrednost toplotne energije mora biti veća od energije interakcije. Kako se ovo može dogoditi? Prosječna brzina toplinskog kretanja molekula jednaka je određenoj vrijednosti, ovisno o temperaturi. Međutim, pojedinačne brzine molekula su različite: većina njih ima brzine blizu prosječne vrijednosti, ali neke od njih imaju brzine veće od prosjeka, neke manje.
Brži molekuli mogu imati toplotnu energiju veća od energije interakcije, što znači da su, udarivši u površinu tekućine, u stanju da se odvoje od nje, formirajući paru. Ova vrsta isparavanja se naziva isparavanje. Zbog iste raspodjele brzina, dolazi do suprotnog procesa - kondenzacije: molekuli iz pare prelaze u tekućinu. Inače, slike koje se obično pojavljuju uz riječ para nisu para, već rezultat suprotnog procesa - kondenzacije. Ne možete vidjeti par.

Para pod određenim uslovima može postati tečnost, ali za to njena temperatura ne sme da pređe određenu vrednost. Ova vrijednost se naziva kritična temperatura. Para i gas su gasovita stanja koja se razlikuju po temperaturi na kojoj postoje. Ako temperatura ne prelazi kritičnu - para, ako prelazi - gas. Ako održavate konstantnu temperaturu i smanjite volumen, para se ukapljuje, plin se ne ukapljuje.
Šta je zasićena i nezasićena para
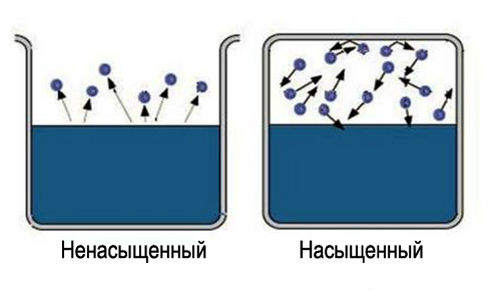
Sama riječ "zasićen" nosi određene informacije, teško je zasititi veliku površinu prostora. Tako da dobijem zasićena para, neophodno ograničiti prostor u kojem se tečnost nalazi. U tom slučaju temperatura bi trebala biti manja od kritične za datu supstancu. Sada ispareni molekuli ostaju u prostoru u kojem se nalazi tečnost. U početku će se većina prijelaza molekula dogoditi iz tekućine, dok će se gustina pare povećati. Ovo će zauzvrat uzrokovati više obrnuti prijelazi molekula u tekućinu, što će povećati brzinu procesa kondenzacije.
Konačno, uspostavlja se stanje za koje će prosječan broj molekula koji prelaze iz jedne faze u drugu biti jednak. Takvo stanje se zove dinamička ravnoteža. Ovo stanje karakterizira ista promjena veličine i smjera brzina isparavanja i kondenzacije. Ovo stanje odgovara zasićenoj pari. Ako se stanje dinamičke ravnoteže ne postigne, to odgovara nezasićenoj pari.
Oni započinju proučavanje nekog objekta, uvijek s njegovim najjednostavnijim modelom. U teoriji molekularne kinetike, ovo je idealan plin. Glavna pojednostavljenja ovdje su zanemarivanje unutrašnjeg volumena molekula i energije njihove interakcije. Ispostavilo se da ovaj model zadovoljavajuće opisuje nezasićena para. Štaviše, što je manje zasićen, to je njegova upotreba legitimnija. Idealan gas je gas; ne može postati ni para ni tečnost. Stoga, za zasićenu paru, takav model nije adekvatan.
Glavne razlike između zasićene i nezasićene pare
- Zasićen znači da dati objekat ima najveću moguću vrijednost nekih parametara. Za par jeste gustina i pritisak. Ovi parametri za nezasićenu paru imaju manje vrijednosti. Što je para dalje od zasićenja, to su ove vrijednosti manje. Jedno pojašnjenje: referentna temperatura mora biti konstantna.
- Za nezasićenu paru, boyle-mariotte zakon: ako su temperatura i masa gasa konstantne, povećanje ili smanjenje zapremine uzrokuje smanjenje ili povećanje pritiska za isti iznos, pritisak i zapremina su obrnuto povezani. Od maksimalne gustine i pritiska na konstantna temperatura slijedi njihova nezavisnost od zapremine zasićene pare, ispada da su za zasićenu paru pritisak i zapremina nezavisni jedan od drugog.
- Za nezasićenu paru gustina ne zavisi od temperature, a ako je volumen sačuvan, ni vrijednost gustine se ne mijenja. Za zasićenu paru, uz zadržavanje volumena, gustoća se mijenja ako se temperatura promijeni. U ovom slučaju, odnos je direktan. Ako se temperatura povećava, povećava se i gustina; ako se temperatura smanjuje, gustoća se također mijenja.
- Ako je zapremina konstantna, nezasićena para se ponaša u skladu sa Charlesovim zakonom: kako temperatura raste, pritisak raste za isti faktor. Ovaj odnos se naziva linearnim. Za zasićenu paru, kako temperatura raste, pritisak raste brže nego za nezasićenu paru. Ovisnost je eksponencijalna.
Sumirajući, možemo primijetiti značajne razlike u svojstvima upoređenih objekata. Glavna razlika je u tome što se para, u stanju zasićenja, ne može posmatrati odvojeno od tečnosti. To je dvokomponentni sistem na koji se većina zakona o plinu ne može primijeniti.
isparavanje - ovo je isparavanje koje se događa samo sa slobodne površine tekućine koja se nalazi u blizini plinovitog medija ili vakuuma.
Neravnomjerna raspodjela kinetičke energije toplinskog kretanja molekula dovodi do činjenice da na bilo kojoj temperaturi kinetička energija nekih molekula tekućine ili čvrste tvari može premašiti potencijalnu energiju njihove veze s ostatkom molekula.
Isparavanje je proces kojim se molekuli izbacuju s površine tekućine ili čvrste tvari kinetička energija koja premašuje potencijalnu energiju interakcije molekula. Isparavanje je praćeno hlađenjem tečnosti.
Razmotrimo proces isparavanja sa stanovišta molekularno-kinetičke teorije. Da bi napustili tečnost, molekuli moraju obaviti rad smanjujući svoju kinetičku energiju. Među nasumično pokretnim molekulima tečnosti u njenom površinskom sloju, uvek će postojati molekuli koji imaju tendenciju da izlete iz tečnosti. Kada takav molekul pređe dalje površinski sloj, tada se javlja sila koja povlači molekul nazad u tečnost. Zbog toga iz tečnosti izlete samo oni molekuli u kojima je kinetička energija veća od rada potrebnog da se savlada protivdejstvo molekularnih sila.
Brzina isparavanja zavisi od:
a) vrstu tečnosti;
b) na površini njegove slobodne površine. Što je ova površina veća, to brže isparava tečnost.
c) što je manja gustina pare tečnosti iznad njene površine, to je veća brzina isparavanja. Stoga će ispumpavanje para (vjetra) sa površine ubrzati njeno isparavanje.
d) sa povećanjem temperature, brzina isparavanja tečnosti se povećava.
isparavanje je prijelaz tvari iz tekućeg u plinovito stanje.
Kondenzacija - je transfer materije iz gasovitom stanju u tečno stanje.
Tokom isparavanja unutrašnja energija materija se povećava, a kada se kondenzuje - smanjuje.
Toplota isparavanja – je količina topline Q potrebna da se tekućina pretvori u paru na konstantnoj temperaturi.
Specifična toplota isparavanje L se mjeri količinom topline koja je potrebna da se jedinica mase tekućine pretvori u paru na konstantnoj temperaturi
Zasićena i nezasićena para. Isparavanje tekućine u zatvorenoj posudi na konstantnoj temperaturi dovodi do postepenog povećanja koncentracije molekula isparljive tvari u plinovitom stanju. Neko vrijeme nakon početka procesa isparavanja, koncentracija tvari u plinovitom stanju dostiže vrijednost pri kojoj broj molekula koji se vraćaju u tekućinu u jedinici vremena postaje jednak broju molekula koji napuštaju površinu tekućine u isto vrijeme. Uspostavlja se dinamička ravnoteža između procesa isparavanja i kondenzacije materije.
Članak govori o tome što je para, koje su to vrste i kako se koriste u industriji i svakodnevnom životu.
fizika
Jedna od glavnih nauka koja pomaže u otkrivanju strukture okolnog svijeta i nekih njegovih procesa je fizika. Svake sekunde oko nas se dešavaju mnoge zanimljive reakcije. Odavno smo navikli na mnoge od njih i ne obraćamo pažnju na njih. Štaviše, u Svakodnevni život malo ljudi razmišlja o prirodi sagorevanja Sunca, odnosno o pojavi vodene pare, koja ima ogroman uticaj na klimu. I iako su gore opisani procesi prilično dobro proučeni, ipak ćemo razmotriti pitanje što je para. Usput, može nastati kao rezultat ne samo ključanja ili drugih reakcija raznih tvari, već prije svega.
Definicija
Para je gasovito stanje supstance, pod uslovom da je ova njena faza u ravnoteži sa drugim agregatnim stanjima ove materije. Sam proces, uslijed kojeg nastaje para, obično se naziva vaporizacija, a obrnuti proces se naziva kondenzacija. Sada znamo šta je para. Inače, obično kada se spominje riječ "para", ljudi gotovo uvijek misle na paru koja se dobiva iz obične vode, iako, kao što je gore spomenuto, mnoge tvari mogu poprimiti ovo stanje agregacije.
Osim toga, uobičajeno je razlikovati dvije glavne vrste: zasićene i nezasićene. Ali ove definicije se odnose samo na supstance koje su hemijski čiste. Analizirajmo ih detaljnije.
Šta je nezasićena para?

Tako ga nazivaju kada nije mogao postići ravnotežu, nazvanu dinamičkom, u odnosu na fluid od kojeg je nastao. Često se takva definicija miješa s termodinamičkom, što je pogrešno. Ako uporedite pritisak nezasićene pare sa zasićenom, onda će on uvijek imati nižu vrijednost.
Kada se nezasićena para pojavi na površini tekućine, proces njenog formiranja teče brže i prevladava nad obrnutim procesom (kao što smo već rekli, naziva se kondenzacija). I kao rezultat, tečnost postepeno postaje sve manje i manje.
Pogledajmo sada šta je
Zasićena para

Zasićena para se naziva kada je bila u stanju da postigne dinamičku ravnotežu sa tečnošću iz koje je dobijena. Jednostavno rečeno, u ovom slučaju, isparavanje je jednako kondenzaciji, a za razliku od situacije sa nezasićenom parom, količina tekućine može ostati nepromijenjena. Sada znamo šta je para i njene vrste.
Ako, na primjer, komprimirate paru koja je u ravnoteži sa svojom tekućinom, tada će ta ravnoteža postupno nestati, a kondenzacija će postati jača sve dok se, zbog promjene gustoće plinovite tvari, ponovo ne uspostavi dinamička ravnoteža.
U zavisnosti od vrste tečnosti, dinamička ravnoteža sa parom se manifestuje na različitim vrednostima njene gustine. To je zbog činjenice da sve tvari imaju različitu silu međumolekularne privlačnosti.
vodena para

Pa ipak, najčešće ljudi ovu riječ razumiju kao plinovito stanje vode koje je svima poznato. Ako pogledate u enciklopediju, možete pronaći glavne karakteristike pare: odsustvo boje, mirisa i dobivanje, u stvari, iz vode.
Svi smo to više puta primjećivali, bilo da se radi o kipućoj vodi za kuhanje ili isparavanju vlage sa vrelog pločnika nakon kiše. Ali ako razmislite o tome i prisjetite se razdoblja industrijske i tehnološke revolucije, postaje jasno da veliki značaj u životu osobe ima pare. Fizika ovog fenomena je takva da zauzima deset puta veći volumen od svog izvornog tečnog oblika. Upravo je ovo zapažanje svojevremeno dalo poticaj razvoju tehnologije.
Sve je počelo s prvim i nešto kasnijim "samohodnim" kolicima, kako su se zvala vozila s takvim motorima. Ali takvi automobili su bili dovedeni u radno stanje veoma dugo, imali su malu brzinu i loše rukovanje. Sve se promijenilo tek izumom parnih lokomotiva.
Osim toga, voda je također dobro rashladno sredstvo i koristi se u mnogim rashladnim sistemima, a ako njihov krug nije zatvoren, onda se kao rezultat pojavljuje i para. U naše vrijeme ponekad se posebno dovodi u plinovito stanje, ali ne u primitivnim motorima, već u nuklearnim elektranama, gdje turbine električnih generatora rotiraju s parom.
Isparena voda je takođe od velike važnosti u klimi. Podignuvši se na visinu na kojoj je temperatura mnogo niža, para se kondenzira i pada na površinu zemlje u obliku kiše. Snijeg je skoro isti.
Pa, na kraju, kuhaju dijetalnu i jednostavno zdravu hranu za par.
Pod pravim uslovima, para stvara maglu na površini zemlje.
Sada znamo šta je para i kako se dešava.
Tema 2. FAZNI PRIJELAZI.
Fazna tranzicija ( fazna transformacija) je prijelaz tvari iz jedne faze u drugu s promjenom vanjskih uvjeta (na primjer, temperatura, pritisak, magnetna i električna polja, itd.), praćen promjenom fizička svojstva i parametre supstance.
Vrijednost temperature, pritiska ili neke druge fizička količina u kojoj dolazi do faznog prelaza naziva se prelazna tačka. Postoje dvije vrste faznog prijelaza.
FAZNI PRIJELAZI PRVE VRSTE
Tokom fazne tranzicije prve vrste, takva termodinamička
karakteristike supstance, kao što su gustina, koncentracija komponenti, specifičan volumen, količina uskladištene unutrašnje energije, tj. određena količina toplote se oslobađa ili apsorbuje, što se naziva toplota prelaza. Štaviše, ovo se odnosi na naglu promenu ovih veličina ne u vremenu, već sa promenom temperature, pritiska itd. Najčešći primeri faznih prelaza prvog reda su:
- topljenje i kristalizacija
- isparavanje i kondenzacija
- sublimacija i desublimacija
FAZNI PRIJELAZI DRUGE VRSTE
Tokom faznog prelaza drugog reda, gustina i unutrašnja energija se ne menjaju, tako da golim okom takav fazni prelaz može biti nevidljiv. Skok doživljavaju njihovi derivati u odnosu na temperaturu i pritisak: toplotni kapacitet, koeficijent toplotnog širenja, razne osetljivosti, itd. fazni prijelazi druge vrste praćeni su promjenom simetrije strukture tvari, a ne oslobađanjem ili apsorpcijom energije (topline). Najčešći primjeri faznih prijelaza drugog reda su:
- prolazak sistema kroz kritičnu tačku
- paramagnetno-feromagnetski prelaz
- prelazak metala i legura u stanje supravodljivosti
- prelazak tečnog helijuma u superfluidno stanje
- prelazak amorfnih materijala u staklasto stanje
Moderna fizika takođe istražuje sisteme koji imaju fazne prelaze trećeg ili višeg reda. Nedavno široku upotrebu dobio koncept kvantne fazne tranzicije, tj. fazne tranzicije kontrolisane ne klasičnim termičkim fluktuacijama, već kvantnim, koje postoje čak i pri apsolutna nula temperaturama, gdje se klasični fazni prijelaz ne može realizirati zbog Nernstove teoreme.
Razmotrimo detaljnije fenomene koji nas zanimaju, a koji su povezani s faznim prijelazima prvog reda.
ISPARIVANJE, KONDENZACIJA, KVANJE.
ZASIĆENI I NEZASIĆENI PAROVI.
Svaka tvar pod određenim uvjetima može biti u različitim agregacijskim stanjima - čvrstom, tekućem i plinovitom. Prijelazi iz jednog agregatnog stanja u drugo su fazni prijelazi prve vrste.
Isparavanje i kondenzacije su fazni prijelazi između tekuće i plinovite faze tvari.
Sve pravi gasovi(kiseonik, azot, vodonik itd.) pod određenim uslovima mogu da pređu u tečnost. Međutim, do takve transformacije može doći samo na temperaturama ispod određene, tzv kritična temperatura T cr. Na primjer, za vodu je kritična temperatura 647,3 K, za dušik 126 K, za kisik 154,3 K. Na sobnoj temperaturi (≈ 300 K), voda može biti u tekućem i plinovitom stanju, dok dušik i kisik postoje samo u obliku gasova.
isparavanjem naziva se fazni prijelaz iz tekućeg u plinovito stanje. Sa stajališta molekularne kinetičke teorije, isparavanje je proces u kojem najbrži molekuli izlete s površine tekućine, čija kinetička energija premašuje energiju njihovog vezivanja s ostatkom molekula tekućine. To dovodi do smanjenja prosječne kinetičke energije preostalih molekula, odnosno do hlađenja tekućine (ako nema opskrbe energijom iz okolnih tijela).
Kondenzacija je obrnuti proces isparavanja. Tokom kondenzacije, molekuli pare se vraćaju u tečnost.
U zatvorenoj posudi tečnost i njena para mogu biti u nekom stanju dinamička ravnoteža, kada je broj molekula koji izlaze iz tečnosti jednak broju molekula koji se vraćaju u tečnost iz pare, tj. kada su brzine isparavanja i kondenzacije iste. Takav sistem se zove dvofazni . Para u ravnoteži sa svojom tečnošću naziva se bogat.
Broj molekula koji se emituju iz jedinice površine tekućine u jednoj sekundi ovisi o temperaturi tekućine. Broj molekula koji se vraćaju iz pare u tečnost zavisi od koncentracije molekula pare i od prosječna brzina njihovo toplotno kretanje, koje je određeno temperaturom pare. Iz toga slijedi da je za datu supstancu koncentracija molekula pare u ravnoteži tečnosti i njene pare određena njihovom ravnotežnom temperaturom. Uspostavljanje dinamičke ravnoteže između procesa isparavanja i kondenzacije s povećanjem temperature događa se pri većim koncentracijama molekula pare. Kako je pritisak plina (pare) određen njegovom koncentracijom i temperaturom, možemo zaključiti: pritisak zasićena para str 0 date supstance zavisi samo od njene temperature i ne zavisi od zapremine. Dakle, izoterme realnih gasova na ravni ( str, V) sadrže horizontalne dijelove koji odgovaraju dvofaznom sistemu (slika 3.4.1).
Kako temperatura raste, pritisak zasićene pare i njena gustina se povećavaju, dok se gustina tečnosti smanjuje usled toplotnog širenja. Na temperaturi koja je jednaka kritičnoj temperaturi T kr za datu supstancu, gustine pare i tečnosti postaju iste. At T > T kr, fizičke razlike između tečnosti i njene zasićene pare nestaju.
Ako je nezasićena para izotermno komprimirana na T < T cr, tada će se njegov pritisak povećavati sve dok ne postane jednak pritisku zasićene pare. Daljnjim smanjenjem zapremine, na dnu posude se formira tečnost i uspostavlja se dinamička ravnoteža između tečnosti i njene zasićene pare. Sa smanjenjem volumena, sve veći dio pare se kondenzira, a njen tlak ostaje nepromijenjen (horizontalni presjek na izotermi). Kada se sva para pretvori u tečnost, pritisak naglo raste sa daljim smanjenjem zapremine zbog niske kompresibilnosti tečnosti.
Moguće je preći iz gasovitog stanja u tečno zaobilazeći dvofazno područje. Da biste to učinili, morate dovršiti proces zaobilazeći kritičnu tačku K. Jedan od mogućih procesa ove vrste prikazan je na slici 1 isprekidanom linijom ABC.
AT atmosferski vazduh vodena para je uvijek prisutna kod nekih parcijalni pritisak str, što je obično manje od pritiska pare zasićenja str 0 . Stav str / str 0, izraženo u procentima, se poziva relativna vlažnost zrak.
| |
Nezasićena para se teoretski može opisati pomoću jednačine stanja idealan gas pod uobičajenim ograničenjima za stvarne plinove: tlak pare ne bi trebao biti previsok (praktično str≤ (10 6 –10 7) Pa), a njegova temperatura je viša od neke vrijednosti definisane za svaku supstancu. Zakoni idealnog gasa mogu se približno primijeniti i na zasićenu paru, pod uvjetom da za svaku temperaturu T pritisak str 0 zasićena para je određena sa kriva ravnotežestr 0 (T) za datu supstancu.
Pritisak str 0 zasićene pare raste vrlo brzo s povećanjem temperature T. Ovisnost str 0 (T) ne može se dobiti iz zakona idealnog gasa. Pritisak plina pri konstantnoj koncentraciji molekula raste direktno proporcionalno temperaturi. U zasićenoj pari, kako temperatura raste, raste ne samo prosječna kinetička energija molekularnog kretanja, već i njihova koncentracija. Prema tome, pritisak zasićene pare raste brže sa porastom temperature od pritiska idealnog gasa pri konstantnoj koncentraciji molekula.
Isparavanje se može dogoditi ne samo s površine, već iu masi tekućine. Tečnosti uvek sadrže sitne mehuriće gasa. Ako je pritisak pare zasićenja tečnosti jednak ili veći od spoljašnjeg pritiska (tj. pritiska gasa u mjehurićima), tečnost će ispariti u mjehuriće. Mjehurići ispunjeni parom se šire i isplivaju na površinu. Ovaj proces se zove ključanje . Dakle, ključanje tečnosti počinje na temperaturi na kojoj je njen pritisak zasićene pare postaje jednak vanjskom pritisku.
Konkretno, pod normalnim atmosferski pritisak voda ključa na 100°C. To znači da je na ovoj temperaturi pritisak zasićene pare vode 1 atm. Prilikom penjanja na planine, atmosferski pritisak se smanjuje, a samim tim i tačka ključanja vode (otprilike 1 °C na svakih 300 metara visine). Na visini od 7 km, pritisak je približno 0,4 atm, a tačka ključanja pada na 70 °C.
U hermetički zatvorenoj posudi tečnost ne može da ključa, jer se pri svakoj vrednosti temperature uspostavlja ravnoteža između tečnosti i njene zasićene pare. Duž krive ravnoteže str 0 (T) moguće je odrediti tačku ključanja tečnosti pri različitim pritiscima.
Slika realnih gasnih izotermi prikazana na slici 1 opisuje procese isparavanja i kondenzacije, odnosno fazni prelaz između gasovite i tečne faze supstance. Zapravo, ova slika je nepotpuna, jer svaka tvar može prijeći iz plinovitog i tekućeg u čvrsto stanje. Na datoj temperaturi T termodinamička ravnoteža između dve faze iste supstance moguća je samo pri određenom pritisku u sistemu. Zavisnost ravnotežnog pritiska o temperaturi naziva se kriva fazne ravnoteže . Primjer je kriva ravnoteže str 0 (T) zasićena para i tečnost. Ako se krivulje ravnoteže između različitih faza date supstance nacrtaju na ravni ( str, T), zatim ovu ravan dijele na odvojene oblasti u kojima supstanca postoji u homogenom agregacijskom stanju - čvrstom, tekućem ili plinovitom (slika 2). Prikazano u koordinatnom sistemu ( str, T) ravnotežne krive se nazivaju fazni dijagram .
Kriva 0 T, što odgovara ravnoteži između čvrste i gasovite faze, naziva se kriva sublimacije. Curve TK ravnoteža između tečnosti i pare naziva se krivulja isparavanja, prekida se u kritična tačka K. Curve TM balans između solidan i zove se tečnost kriva topljenja.
Ravnotežne krive konvergiraju u tački T, u kojoj sve tri faze mogu koegzistirati u ravnoteži. Ova tačka se zove trostruki poen.
Za mnoge supstance pritisak str tr u trostrukoj tački je manji od 1 atm ≈ 10 5 Pa. Takve tvari se tope kada se zagrijavaju na atmosferskom tlaku. Na primjer, trostruki poen voda (slika 3) ima koordinate T tr = 273,16 K, str tr \u003d 6,02 10 2 Pa i koristi se kao referenca za kalibraciju apsolutne temperaturne skale Kelvina.
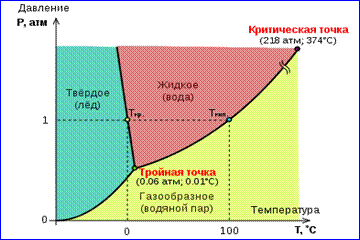 Ima, međutim, i takvih 3 Fazni dijagram vode
Ima, međutim, i takvih 3 Fazni dijagram vode
supstance koje imaju str tr
prelazi 1 atm. Dakle za
pritisak ugljičnog dioksida (CO 2).
str tr = 5,11 atm i temperatura
T tr = 216,5 K. Dakle, na atmosfer
pritisak, čvrsti ugljen dioksid može
postoje samo na niskim temperaturama, a u tečnom stanju na str= 1 atm uopšte ne postoji. U čvrstom stanju, ugljen dioksid je u ravnoteži sa svojom parom na atmosferskom pritisku na temperaturi od 173 K ili -80 °C. Ovo je široko rasprostranjen "suhi led" koji se nikada ne topi, već samo isparava (sublimira).






