Ispod tačke ključanja tečnosti dolazi do isparavanja. Rastvori ključaju na višoj temperaturi od čistih rastvarača. Teorijski i realni rashladni ciklus
KVANJE, proces isparavanja u tečnosti, uključujući rađanje mehurića pare, njihov rast, kretanje i interakciju; neravnotežni fazni prelaz 1. vrste.
Ključanje je uzrokovano pregrijavanjem tečnosti čije stanje pada u područje iznad linije ravnoteže tečnost-para (binodal 1, slika), ili smanjenjem pritiska ispod njegove vrednosti na liniji ravnoteže. Na faznom dijagramu proces ključanja je opisan putanjom ili tačkom unutar područja metastabilnog (pregrijanog) stanja, ograničenom s jedne strane binodalom (ovisnost ravnotežne temperature ključanja od pritiska), s druge strane , spinodalom (granica termodinamičke stabilnosti tečnosti). Ravnotežna tačka ključanja na atmosferskom pritisku obično se navodi kao jedna od glavnih fizičko-hemijskih karakteristika hemijski čiste supstance. Kada se tečnost rasteže, uočava se fenomen kavitacije, sličan ključanju.
Pritisak pare u kvazi-ravnotežnom mjehuru p p uravnotežen je pritiskom tekućine p l i međufaznom napetošću σ i povezan je s pritiskom zasićena para preko horizontalne površine na istoj Kelvinskoj temperaturi prema jednačini. Kritični radijus balona u skladu sa Laplasovim zakonom je jednak
R cr = 2σ/(r p −r w),
i za R< R кp пузырьки схлопываются, при R >R kp - raste.
Proces rađanja mjehurića pare u volumenu homogene pročišćene tekućine nastaje uslijed termodinamičkih fluktuacija gustine tekućine. Ovaj proces se razvija pri velikom pregrijavanju tečnosti. U zapremini sirove tečnosti i na granicama sa čvrstom fazom (blizu zidova posude), obično postoje (ili se privremeno pojavljuju) zone preferencijalnog rađanja mjehurića - centara ključanja, koji mogu biti i fluktuirajući (slabo navlaženi). područja, zone povećane koncentracije komponente laganog ključanja, zone egzotermne reakcije itd.), i gotove, već prisutne u tekućini (mjehurići neotopljenog plina, plinoviti ili parni mjehurići u mikropukotinama sa nepotpunim vlaženjem čvrste tvari površina). Kod razvijenog ključanja, centri ključanja se obnavljaju kada se para zahvati mikroudubinama (porama) na zagrijanoj površini.
U industrijskim aparatima ključanje se obično obezbjeđuje gotovim centrima, a pregrijavanje iznad ravnotežne tačke ključanja je malo (pri atmosferskom pritisku manjem od 10 K). Pri velikoj snazi oslobađanja topline u eksplozivnim procesima, dostižno pregrijavanje tekućine je mnogo veće, a ostvaruju se režimi proizvodnje fluktuacijskih mjehurića.
Razlikovati volumetrijsko i površinsko (zidno) ključanje. Kod površinskog ključanja, glavni izvor mjehurića pare je sloj tekućine u blizini zagrijane površine. Ako zapremina tečnosti ima temperaturu ispod ravnotežne temperature na binodalu (tzv. ključanje sa pothlađivanjem), tada se mjehurići pare formirani u blizini zagrijane površine, koji tokom migracije padaju u hladne slojeve tekućine, kolabiraju. Masovno vrenje nastaje kada se tečnost pregreje u celoj zapremini (ili kada se pritisak smanji). U tom slučaju, mjehurići pare se rađaju u cijeloj zapremini tečnosti.
Rast mehurića tokom ključanja ima mehanički (hidrodinamički) efekat na sistem u celini. Konkretno, u zatvorenom volumenu pregrijane tekućine, kako se sadržaj pare povećava, pritisak raste. U podzvučnim tokovima kipuće tekućine ograničene čvrstim zidovima (na primjer, u cijevima), povećanje sadržaja pare nizvodno je praćeno smanjenjem tlaka. Kako mjehurići pare rastu i kolabiraju, zrače akustične valove - javlja se buka ključanja. Brzo povećanje tlaka tijekom ključanja, koje se javlja kada se tekućina dovoljno brzo pregrije (režim eksplozivnog ključanja), može dovesti do takozvane parne eksplozije s uništavanjem konstrukcija. Mjehurići pare koji lebde u gravitacionom polju uzrokuju dodatna konvektivna strujanja koja doprinose miješanju tekućine, a površinsko ključanje uzrokuje turbulentno kretanje prizidnog sloja tekućine.
Kod površinskog nukleatnog ključanja, s povećanjem temperature grijača, odvođenje topline sa površine se povećava sve dok ne dođe do krize ključanja. Kriza ključanja je posljedica prijelaza ključanja jezgrica u filmsko ključanje, kada se mjehurići na zagrijanoj površini zamjenjuju slojem pare. Kriza ključanja dovodi do pogoršanja odvođenja topline i opasna je za brojne energetske uređaje.
Upotreba procesa ključanja u svakodnevnom životu, nauci i tehnologiji je raznolika. Površinsko ključanje se široko koristi za intenzivno površinsko hlađenje - odvođenje topline (na primjer, u nuklearnim reaktorima, mlazni motori, kod hlađenja elemenata elektronske opreme). Vrenje se koristi za povećanje površine isparavanja u postrojenjima za desalinizaciju, u parnim kotlovima u termoelektranama, mjehurastim komorama za vizualizaciju kolosijeka elementarne čestice, u hlađenju, procesima rektifikacije, raznim hemijskim tehnologijama, prehrambenoj industriji itd.
Lit .: Skripov V.P. Metastabilna tečnost. M., 1972; Prisnyakov VF Kipljenje. K., 1988; Labuntsov D. A. Fizičke osnove energije. M., 2000.
Poznato je da svaka tvar ključa na određenim vrijednostima temperature i vanjskog pritiska.
Vrenje je proces isparavanja tečnosti, praćen brzim stvaranjem i rastom mjehurića pare koji probijaju površinu tekućine prema van.
Razmotrite uslove pod kojima se odvija proces ključanja.
Mjehur pare u tekućini može se formirati ako se u nekom trenutku u tekućini formira područje male gustine. U principu, takvo područje se može formirati, jer su zbog haotične prirode toplinskih kretanja slučajna odstupanja od prosječne ravnomjerne raspodjele čestica u volumenu ne samo moguća, već su i neizbježna. Takva odstupanja od srednje vrijednosti, kao što je već spomenuto, nazivaju se fluktuacijama. Mjehurići u pari i nastaju po redoslijedu fluktuacija. Međutim, treba imati na umu sljedeće.
Gustoća pare na temperaturi daleko od kritične je hiljadama puta manja od gustine tečnosti. Stoga, da bi nastao mehur, potrebna je veoma značajna fluktuacija: slučajno se mora formirati oblast u kojoj je gustina čestica hiljadama puta manja nego u ostatku zapremine! Jasno je da je vjerovatnoća takve fluktuacije vrlo mala. Štaviše, malo je vjerovatno da će pokriti bilo kakav značajniji obim. U velikoj većini slučajeva, mjehurići su, ako se formiraju, vrlo male veličine. Ali u ovom slučaju nemaju uslove za rast. Na kraju krajeva, mehur je posuda sa zasićena para(jer je posuda zatvorena), a zidovi posude su konkavna površina tečnosti koja okružuje mehur. Zbog zakrivljenosti površine, postoji sila usmjerena prema centru zakrivljenosti. Ova sila će zdrobiti mehur, jer je pri malim veličinama mehurića veoma velik.
Čini se da se u takvim uslovima mjehurići pare u tekućini uopće ne mogu stvoriti, što znači da je i ključanje nemoguće. Međutim, situacija se značajno mijenja ako se u samoj tekućini ili u stijenkama posude u kojoj je zatvorena nalazi otopljeni ili apsorbirani (adsorbirani) zrak (ili neki drugi plin). U ovom slučaju, kada se tečnost zagrije, formiraju se mjehurići plina, a njihovo stvaranje nije povezano s fluktuacijama gustoće tekućine. Stoga ne moraju biti premali od samog početka, a pritisak povezan sa zakrivljenošću površine ih ne mora gnječiti.
Mjehurići plina, dakle, imaju istu ulogu u fenomenu isparavanja (ključanja) kao što čestice prašine ili joni igraju u fenomenu kondenzacije, odnosno ulozi jezgara.
Dakle, neka se, iz ovog ili onog razloga, u tečnosti formira mehur gasa. Nakon formiranja, on se odmah napuni zasićenom parom okolne tečnosti i biće u ravnoteži sa njom. Pritisak pare unutar mehurića očigledno je određen temperaturom tečnosti. Sve dok je temperatura tečnosti takva da je pritisak zasićene pare unutar mehurića manji od spoljašnjeg pritiska iznad tečnosti, mehur ne može rasti, jer ni sada ne nedostaje sila koje nastoje da ga zgnječe. Još uvijek postoji sila povezana sa zakrivljenošću površine tekućine u mjehuru. Osim toga, na mjehur utiče hidrostatički pritisak kolone tečnosti iznad njega. Konačno, na mjehur, ispod kojeg se nalazi cijela tekućina, djeluje vanjski pritisak i upravo taj pritisak igra glavnu ulogu. Preostale dvije sile samo olakšavaju drobljenje mjehurića vanjskim pritiskom.
Ali kada temperatura tečnosti dostigne vrijednost pri kojoj elastičnost njene zasićene pare postane jednaka vanjskom pritisku, tlak pare unutar mjehurića će također biti jednak vanjskom pritisku (ako ne uzmemo u obzir hidrostatički pritisak i pritisak uzrokovan zakrivljenošću površine). Tada je i najmanji porast temperature dovoljan da pritisak pare unutar mehurića premaši spoljašnji: pod uticajem ove razlike pritiska, mehur će početi da se brzo naduvava i na kraju će isplivati i izbiti;
To znači da pri ključanju tečnost isparava ne samo sa površine tečnosti, već i sa površine mehurića unutar tečnosti. Da bi tečnost proključala, potrebno je njenu temperaturu dovesti do vrednosti na kojoj je elastičnost zasićene pare ove tečnosti jednak je spoljašnjem pritisku (tačnije, nešto više).
Jasno je da što je niži spoljni pritisak, to je niža tačka ključanja tečnosti. Ovo dobro objašnjava poznata činjenica da na velikim visinama gde Atmosferski pritisak niske, tečnosti ključaju na temperaturama nižim nego na nivou mora. Mjerenjem tačke ključanja tečnosti možete odrediti barometarski pritisak, a time i visinu iznad nivoa mora. Odgovarajući uređaj se naziva hipsotermometar.
Voda, koja normalno (tj. pri vanjskom pritisku od 1 atm) ključa na 100 °C (na toj temperaturi je elastičnost zasićene vodene pare 1 atm), može ključati i na sobnoj temperaturi, ako se intenzivno pumpa zrak i pare iznad njegove površine dovoljno smanjuju vanjski pritisak iznad nje.
Lako je ustanoviti zavisnost tačke ključanja tečnosti od spoljašnjeg pritiska. Zaista, gore imamo
formula (105.6), koja određuje zavisnost elastičnosti zasićenih para tečnosti od temperature:
(Clapeyron-Clausiusova formula). Budući da je pri ključanju vanjski pritisak upravo jednak elastičnosti zasićene pare tekućine, jasno je da ako obrnemo Clausius-Clapeyronovu jednačinu, onda ćemo dobiti ovisnost točke ključanja tekućine od spoljni pritisak. Stoga ova zavisnost izgleda ovako:
![]()
Pregrijavanje tečnosti. Iz prethodno rečenog jasno je da se fenomen ključanja može javiti samo ako se u tečnosti mogu formirati mjehurići plina, a za to tekućina mora sadržavati plinove otopljene u njoj. Može se reći da, kao što je kondenzacija moguća samo u prisustvu kondenzacionih centara (čestica prašine, jona), ključanje, odnosno intenzivno isparavanje, zahteva prisustvo centara isparavanja, a to su mehurići gasa. (Fazni prijelazi koji se javljaju samo u prisustvu jezgara nazivaju se fazni prelazi prva vrsta.)
U odsustvu kondenzacionih centara, moguće je, kao što smo videli, dobiti prezasićenu paru. Na isti način, u nedostatku rastvorenih gasova u tečnosti koji mogu da formiraju mehuriće, može se dobiti pregrejana tečnost, odnosno tečnost čija je temperatura viša od tačke ključanja pri datom spoljašnjem pritisku, ali koja, ipak, čini ne prokuhati.
Mogućnost pregrijavanja tekućine povezana je s dodatnim pritiskom koji tečnost doživljava ispod zakrivljene površine. Zaista, sferna površina tečnosti koja okružuje mehur ima tendenciju da se skupi. Rezultirajući pritisak
usmjerena ka centru mjehura, tj. dodaje se vanjskom pritisku koji drobi mehur. A pri malim veličinama mjehurića dostiže vrlo značajnu vrijednost. Stoga, ako se tekućina koja se zagrijava i stijenke posude u kojoj se nalazi pažljivo očiste od otopljenih plinova, stvaranje mjehurića u tekućini je toliko teško da se može zagrijati bez ključanja do temperature mnogo veće od tačka ključanja. Tačnije, tekućina se može pregrijati do temperature na kojoj je elastičnost
zasićene pare u mjehurićima ne prelazi vanjski pritisak plus pritisak uzrokovan zakrivljenošću površine najmanjih mjehurića.
Kao što smo vidjeli, stvaranje mjehurića pare na niskim temperaturama je praktično nemoguće zbog činjenice da su za to potrebne velike fluktuacije gustine, čija je vjerovatnoća vrlo mala. Ali kako temperatura raste, razlika u gustoći tekućine i pare se smanjuje (na kritičnoj temperaturi ona potpuno nestaje). Zbog toga fluktuacije gustine neophodne za formiranje mehurića postaju sve manje značajne. Shodno tome, njihova vjerovatnoća raste. Kad dosta visoke temperature(visoka znači blizu kritične temperature) mjehurići se mogu formirati i rasti čak i u odsustvu jezgara u obliku mjehurića plina. To znači da je u ovom slučaju moguće i ključanje tečnosti, ali samo pregrijane. I što se tečnost temeljitije čisti, to se jače može pregrijati.
Kada pregrijana tečnost ipak, na kraju proključa, zatim ključanje nastaje vrlo burno, nalik na eksploziju. U ovom slučaju, tečnost se brzo hladi do normalne tačke ključanja pri datom pritisku.
Pregrijavanje tečnosti i kasnije burno ključanje predstavljaju veliku opasnost za posudu u kojoj je tečnost zatvorena. Stoga se poduzimaju posebne mjere kako bi se spriječilo pregrijavanje. Da bi se to postiglo, porozna tijela se stavljaju u tečnost, iz koje se prilikom zagrijavanja oslobađa zrak u izobilju. Takva tijela su keramičke cijevi (na primjer, nepečeni porculan) ili ukrasi kapilarnih cijevi.
Nije teško odrediti veličinu mjehurića, koji jamče vidljivo pregrijavanje tekućine. Hajde da napravimo takvu procjenu za vodu. U ovom slučaju, pretpostavit ćemo da je dopušteno pregrijavanje vode pri normalnom vanjskom pritisku za 0,1 stepen.
Koja bi trebala biti veličina mjehurića da pregrijavanje ne pređe ovu vrijednost?
Da biste to učinili, potrebno je odrediti za koliko će se tlak pare povećati kada temperatura poraste od 100 do. To se može učiniti korištenjem krivulje temperaturne ovisnosti tlaka vodene pare. Iz ove krive može se utvrditi da promjena temperature za 0,1° uzrokuje promjenu tlaka pare za . Stoga, kako pregrijavanje ne bi prešlo 0,1°, potrebno je da prosječni radijus mjehurića ne bude manji od
![]()
Procijenimo i utjecaj hidrostatskog tlaka koji doživljavaju mjehurići na pregrijavanje tečnosti.
Na dubini ispod površine tečnosti, mehur gasa doživljava pritisak
On se dodaje vanjskom pritisku (kao i pritisku zbog zakrivljenosti površine mjehura), a za tu količinu mora se povećati tlak pare unutar mjehura da bi on isplivao. Iz iste krivulje može se naći koliko se mijenja temperatura vode pri ključanju sa dubinom ispod površine. Vidi, na primjer,
Ovo odgovara povećanju tačke ključanja za
Temperatura kipuće vode nije, kao što vidimo, dobro definisana vrijednost. Zbog razloga koje smo upravo razmotrili, ona varira u malim granicama. Ne sama kipuća voda, već vodena para iznad nje, ima sasvim određenu temperaturu, jer, bez obzira šta se dešava unutar tečnosti, para koja izlazi iz mjehurića koji pucaju na njenoj površini ima sasvim određenu temperaturu - temperaturu na kojoj elastičnost zasićenih para jednak je vanjskom pritisku. Zato se pri kalibraciji termometara ne stavljaju u kipuću vodu, već u pare iznad nje.
komora sa mjehurićima. U komori oblaka, kao što smo vidjeli, koriste se prezasićenje pare i kondenzacija prezasićene pare na jone kao kondenzacijski centri. Slično, iu iste svrhe, odnosno za detekciju brzih čestica, može se koristiti i fenomen pregrijavanja tekućine s naknadnim stvaranjem mjehurića u njoj. Ovaj princip je osnova za rad takozvane mjehuraste komore, koja je u posljednje vrijeme postala rasprostranjena u istraživanjima u oblasti nuklearna fizika i fiziku čestica visoke energije.
Komora s mjehurićima je posuda s tekućinom koja se može pregrijati pomoću grijača. Ova posuda je povezana sa uređajem koji vam omogućava da stvorite povećan pritisak iznad tečnosti i brzo uklonite ovaj pritisak. Ako prvo zagrijete tekućinu i komprimirate je vanjskim pritiskom, a zatim uklonite vanjski tlak, tada će se tekućina, naravno, pregrijati, ali za vrijeme dovoljno za eksperiment (nekoliko desetina sekundi) ne proključa . Ako u ovom trenutku brza čestica uleti u komoru, tada će na svom putu u tekućinu izgubiti dio svoje energije, koja će se uglavnom pretvoriti u toplinu. Pošto je tečnost pregrejana, ova dodatna toplota je dovoljna za intenzivno stvaranje mehurića na putu čestice. Rezultirajući mjehurići brzo rastu do veličine na kojoj su
postanu vidljivi, tako da se lanac mehurića - trag čestice - može fotografisati.
Ako oblačna komora ispunjena labavom parom može prodrijeti kroz česticu, onda u komori s mjehurićima ispunjenoj gustom tvari - tekućinom, čestica prolazi cijelim svojim putem ne napuštajući komoru, što olakšava proučavanje svojstava ove čestice. Ovo je jedna od važnih prednosti mjehuraste komore.
Detalji Kategorija: Molekularno-kinetička teorija Objavljeno 09.11.2014. 21:08 Pregledi: 8345U tekućem stanju, tvar može postojati u određenom temperaturnom rasponu. Na temperaturi ispod donje vrijednosti ovog intervala, tečnost se pretvara u čvrstu supstancu. A ako vrijednost temperature prelazi gornju granicu intervala, tekućina prelazi u gasovitom stanju.
Sve ovo možemo posmatrati na primeru vode. U tečnom stanju, vidimo ga u rijekama, jezerima, morima, okeanima, na slavini. Čvrsto stanje voda je led. U njega se pretvara kada mu pri normalnom atmosferskom pritisku temperatura padne na 0 o C. A kada temperatura poraste na 100 o C, voda ključa i pretvara se u paru, što je njeno gasovito stanje.
Proces pretvaranja tvari u paru naziva se isparavanje. Obrnuti proces prelaska iz pare u tečnost je kondenzacije .
Isparavanje se dešava u dva slučaja: tokom isparavanja i tokom ključanja.
Isparavanje
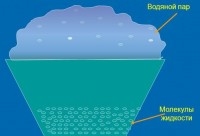
Isparavanje je fazni proces prijelaza tvari iz tečno stanje u gasovito ili parno stanje na površini tečnosti .
Kao i kod topljenja, supstanca apsorbuje toplotu tokom isparavanja. Troši se na savladavanje kohezivnih sila čestica (molekula ili atoma) tečnosti. Kinetička energija molekuli sa najvećom brzinom premašuju njihovu potencijalna energija interakcije sa drugim molekulima tečnosti. Zbog toga savladavaju privlačenje susjednih čestica i izlete s površine tekućine. Prosječna energija preostalih čestica postaje manja, a tekućina se postepeno hladi ako se ne zagrijava izvana.
Pošto su čestice u pokretu na bilo kojoj temperaturi, dolazi i do isparavanja. na bilo kojoj temperaturi. Znamo da se bare suše nakon kiše, čak i po hladnom vremenu.
Ali brzina isparavanja ovisi o mnogim faktorima. Jedan od najvažnijih - temperatura supstance. Što je veća, veća je brzina čestica i njihova energija, a veći njihov broj napušta tečnost u jedinici vremena.
Napunite 2 čaše istom količinom vode. Jednu stavimo na sunce, a drugu u hladovinu. Nakon nekog vremena vidjet ćemo da u prvoj čaši ima manje vode nego u drugoj. Zagrijali su ga sunčevi zraci i brže je ispario. Lokve nakon kiše se također suše mnogo brže ljeti nego u proljeće ili jesen. Pri ekstremnim vrućinama dolazi do brzog isparavanja vode sa površina rezervoara. Bare i jezera presušuju, korita plitkih rijeka presušuju. Što je temperatura viša okruženje, što je veća stopa isparavanja.
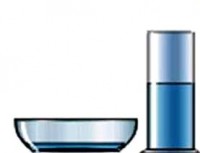
Sa istom zapreminom, tečnost u širokom tanjiru će ispariti mnogo brže od tečnosti koja se sipa u čašu. To znači da brzina isparavanja ovisi o površini isparavanja . Što je ova površina veća, to veći broj molekula izleti iz tečnosti u jedinici vremena.
Sa istim spoljni uslovi brzina isparavanja ovisi o vrsti tvari . Staklene tikvice napunite istom količinom vode i alkohola. Nakon nekog vremena vidjet ćemo da je ostalo manje alkohola nego vode. Isparava brže. To se događa zato što molekuli alkohola slabije međusobno djeluju od molekula vode.
utiču na brzinu isparavanja i prisustvo vetra . Znamo da se stvari nakon pranja mnogo brže suše kada ih duva vjetar. Mlaz vrućeg zraka u fenu može brzo osušiti našu kosu.
Vjetar odnosi molekule koji su izletjeli iz tečnosti i oni se ne vraćaju nazad. Njihovo mjesto zauzimaju novi molekuli koji napuštaju tečnost. Stoga ih u samoj tečnosti postaje manje. Zbog toga brže isparava.
Sublimacija

Isparavanje se odvija u čvrste materije Oh. Vidimo kako se smrznuta, ledom prekrivena posteljina postepeno suši na hladnoći. Led se pretvara u paru. Osjetimo oštar miris koji nastaje isparavanjem čvrsta materija naftalin.
Neke supstance uopšte nemaju tečnu fazu. Na primjer, elementarni jodI 2 - jednostavna supstanca, koja je crno-sivi kristali sa ljubičastim metalnim sjajem, u normalnim uslovima se odmah pretvara u gasoviti jod - ljubičasta para sa oštrim mirisom. Tečni jod koji kupujemo u apotekama nije u tečnom stanju, već rastvor joda u alkoholu.
Proces tranzicije čvrstih materija u gasovito stanje, zaobilazeći tečni stupanj, naziva se sublimacija, ili sublimacija .
Kipuće

Kipuće Ovo je takođe proces pretvaranja tečnosti u paru. Ali isparavanje tokom ključanja se događa ne samo na površini tekućine, već u cijelom njenom volumenu. Štaviše, ovaj proces je mnogo intenzivniji nego tokom isparavanja.
Stavite čajnik vode na vatru. Budući da je u vodi uvijek otopljen zrak, pri zagrijavanju se pojavljuju mjehurići na dnu kotla i na njegovim stijenkama. Ovi mjehurići sadrže zrak i zasićenu vodenu paru. Prvo se pojavljuju na zidovima čajnika. Količina pare u njima se povećava, a oni sami povećavaju veličinu. Tada će se pod uticajem Arhimedove uzgonske sile otrgnuti od zidova, podići i izbiti na površinu vode. Kada temperatura vode dostigne 100°C, mjehurići će se formirati po cijeloj zapremini vode.
Isparavanje se događa na bilo kojoj temperaturi, a ključanje se događa samo na određenoj temperaturi, koja se naziva tačka ključanja .
Svaka supstanca ima svoju tačku ključanja. Zavisi od količine pritiska.
Pri normalnom atmosferskom pritisku voda ključa na temperaturi od 100 o C, alkohol - na 78 o C, gvožđe - na 2750 o C. A tačka ključanja kiseonika je minus 183 o C.
Kako pritisak opada, temperatura ključanja se smanjuje. U planinama, gde je atmosferski pritisak niži, voda ključa na temperaturi manjoj od 100°C. A što je iznad nivoa mora, to će biti niža tačka ključanja. A u ekspres loncu, gde se stvara povećan pritisak, voda ključa na temperaturi iznad 100 o C.
Zasićena i nezasićena para
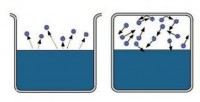
Ako supstanca može istovremeno postojati u tečnoj (ili čvrstoj) fazi i u gasovitoj, tada se njeno gasovito stanje naziva trajekt . Para se sastoji od molekula koji izlaze iz tečnosti ili čvrste supstance tokom isparavanja.
Ulijte tečnost u posudu i dobro je zatvorite poklopcem. Nakon nekog vremena, količina tekućine će se smanjiti zbog njenog isparavanja. Molekuli koji napuštaju tečnost će se koncentrirati iznad njene površine u obliku pare. Ali kada gustina pare postane prilično visoka, neki od njih će se ponovo početi vraćati u tečnost. I takvih molekula će biti sve više. Konačno, doći će trenutak kada će broj molekula koji napuštaju tekućinu i broj molekula koji se vraćaju u nju biti jednaki. U ovom slučaju to kažu tečnost je u dinamičkoj ravnoteži sa svojom parom . Ovaj par se zove bogat .
Ako tokom isparavanja više molekula izleti iz tečnosti nego što se vrati, tada će takva para biti nezasićeni . nezasićena para nastaje kada se tečnost koja isparava nalazi u otvorenom sudu. Molekuli koji ga napuštaju raspršeni su u prostoru. Ne vraćaju se svi u tečnost.
Kondenzacija pare

Obrnuti prijelaz tvari iz plinovitog u tekuće stanje naziva se kondenzacije. Tokom kondenzacije, neki od molekula pare se vraćaju u tečnost.
Para počinje da se pretvara u tečnost (kondenzira) pri određenoj kombinaciji temperature i pritiska. Ova kombinacija se zove kritična tačka . Maksimalna temperatura , ispod kojeg počinje kondenzacija naziva se kritičan temperatura. Iznad kritične temperature, gas se nikada neće pretvoriti u tečnost.
AT kritična tačka interfejs tečnost-para je zamućen. nestaje površinski napon tečnosti, gustine tečnosti i njene zasićene pare su izjednačene.
U dinamičkoj ravnoteži, kada je broj molekula koji izlaze iz tečnosti i vraćaju se u nju jednak, procesi isparavanja i kondenzacije su uravnoteženi.
Kada voda isparava, formiraju se njeni molekuli vodena para , koji je pomešan sa vazduhom ili drugim gasom. Temperatura na kojoj takva para u zraku postaje zasićena, počinje kondenzirati pri hlađenju i pretvara se u kapljice vode, naziva se tačka rose .

Kada je u vazduhu velika količina vodene pare, kaže se da je njegova vlažnost povećana.
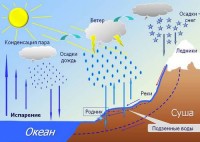
U prirodi vrlo često opažamo isparavanje i kondenzaciju. Jutarnja magla, oblaci, kiša - sve je to rezultat ovih pojava. OD zemljine površine vlaga isparava kada se zagrije. Molekuli nastale pare se podižu. Nailazeći na hladno lišće ili vlati trave na svom putu, para se kondenzuje na njima u obliku kapi rose. Malo više, u površinskim slojevima, postaje magla. A visoko u atmosferi na niskim temperaturama, ohlađena para se pretvara u oblake koji se sastoje od kapljica vode ili kristala leda. Nakon toga, kiša ili grad će padati iz ovih oblaka na zemlju.
Ali kapljice vode nastaju tokom kondenzacije samo kada su u vazduhu najmanje čvrste ili tečne čestice, koje se tzv. jezgra kondenzacije . To mogu biti proizvodi sagorevanja, prskanja, čestice prašine, morska so iznad okeana, čestice nastale kao rezultat hemijske reakcije u atmosferi itd.
desublimacija

Ponekad supstanca može odmah preći iz gasovitog stanja u čvrsto stanje, zaobilazeći tečno stanje. Takav proces se zove desublimacija .
Uzorci leda koji se pojavljuju na čašama po hladnom vremenu primjer su desublimacije. Za vrijeme mrazeva tlo je prekriveno injem - tankim kristalima leda u koje se pretvorila vodena para iz zraka.
Iz Raoultovog zakona slijede dvije važne posljedice:
1) Rastvori ključaju na višoj temperaturi od čistog rastvarača;
2) Rastvori se smrzavaju na nižoj temperaturi od čistog rastvarača.
Razmotrimo ih detaljnije.
Vrenje je fizički proces kojim tečnost prelazi u gasovito stanje ili paru, pri čemu se mjehurići plina formiraju u cijeloj zapremini tečnosti.
Tečnost ključa pod pritiskomzasićena para postaje jednaka vanjskom pritisku. Ako se vanjski tlak (na primjer, atmosferski) ne promijeni, atečnost je individualna i hemijski čista tvar, tada se njeno ključanje u otvorenoj zagrijanoj posudi odvija na konstantnoj temperaturi sve dok tečna faza potpuno ne nestane.
Dakle, pri atmosferskom pritisku od 101,325 kPa, tačka ključanja prečišćene (destilovane) vode je 100 o C ili 373,16 K.
Ako se neka nehlapljiva tvar otopi u H 2 O, tada će se smanjiti pritisak njene zasićene pare. Da bi dobijeni rastvor proključao, potrebno ga je zagrejati na temperaturu veću od 373,16 K, jer će samo pod takvim uslovima pritisak zasićene pare rastvarača ponovo postati jednak atmosferskom.
Zamrzavanje ili kristalizacijaje fizička pojava, praćena transformacijom tečnosti u čvrstu materiju. Štaviše, kristalne strukture se formiraju u cijelom volumenu tekućine.
Proces zamrzavanja počinje ako tlak zasićene pare nad tekućinom postane jednak tlaku zasićene pare nad njenim čvrstim kristalima.
Ako vanjski (atmosferski) tlak ostane konstantan, itečnost ne sadrži strane nečistoće, tada će tokom procesa kristalizacije temperatura ohlađene tečnosti ostati konstantna sve dok tečna faza potpuno ne pređe u čvrstu materiju.
Pri atmosferskom pritisku od 101,325 kPa, destilovana voda se smrzava na 0°C (273,16K). Pritisak zasićene vodene pare iznad leda i tečnosti u ovom slučaju iznosi 613,3 Pa.
Za vodeni rastvor, pritisak zasićene pare rastvarača na 0 °C biće manji od 613,3 Pa, ali preko leda ostaje nepromenjen. Led spušten u takvu otopinu brzo će se otopiti zbog kondenzacije viška pare iznad njega.
Tek kada se temperatura spusti može se ponovo izjednačiti pritisak zasićene pare nad tečnom i čvrstom fazom i započeti proces kristalizacije.
Empirijski je utvrđeno da povećanje tačke ključanja ( t bale ) i snižavanje tačke smrzavanja rješenje ( t zamjenik ) u poređenju sa čistim rastvaračem, direktno je proporcionalna molarnoj koncentraciji otopljene supstance. Matematički, ovo se može napisati na sljedeći način:
t b.p. p-ra –t kip. p-tele \u003d t kip. =em
t r-tel -t zamjenik. p-ra \u003d t zamjenik. =Km
gdjem– molalna koncentracijarastvorena materija;EiK, odnosno ebulioskopski (lat.ebbulio- prokuhati) i krioskopske (grčki "cryos" - hladno) konstante čije vrijednosti zavise samo od priroderastvarač (tabela 7).
Tabela 7 Ebulioskopske E i krioskopske K konstante nekih otapala (deg/mol)
Ebulioskopske i krioskopske konstante rastvarač pokazuju za koliko stepeni raste tačka ključanja i tačka smrzavanja otopina dobivena otapanjem jednog mola neelektrolita u jednom kilogramu rastvarača ( m = 1 mol/kg).
Da biste odredili vrijednosti E i K, prvo eksperimentalno odredite Dt kip. andDt zamjenik. jako razrijeđene otopine (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
gdjeRje univerzalna plinska konstanta;Tje tačka ključanja rastvarača; je specifična toplota isparavanja rastvarača.
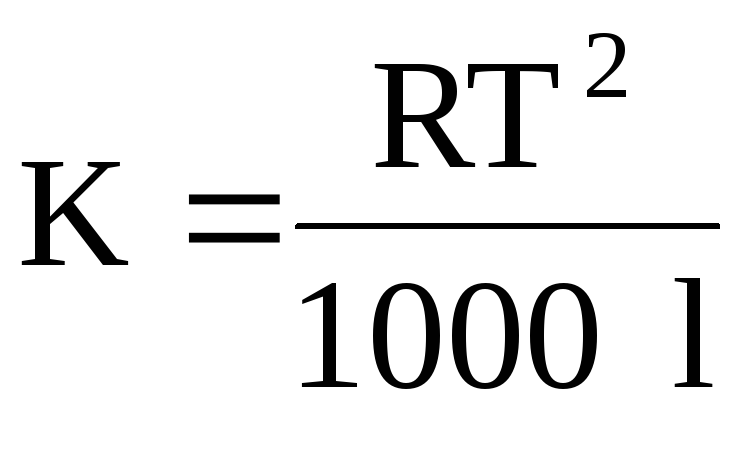
gdjeT- temperatura topljenjarješenjeklijent;l– specifična toplota fuzijerastvarač.
Na ovaj način, otopine tvari različite prirode, ali s istom molarnom koncentracijom, ključaće i smrzavati se u isto vrijemetemperatura.
Treba obratiti pažnju na važnu razlikurastvor iz čistog rastvarača. Ako potonji ključa i smrzava se na konstantitemperatura, daklerješenja to rade u intervalutemperature, tj. u procesu njihovog ključanja temperatura stalno raste, a kada se smrzava opada. To je zbog činjenice da je uklanjanje iz tekuće fazeotapalo u obliku pare ili čvrstih kristala dovodi do povećanja molarne koncentracije otopine, tk. otopljena tvar u procesu ključanja i smrzavanja ostaje nepromijenjena u tečnoj fazi (do njenog potpunog ključanja ili smrzavanja), a masa tekućeg otapala se smanjuje.
U praktičnim mjerenjima tačka smrzavanja ili ključanja rastvora, fiksiran je trenutak pojave prvih čvrstih kristala u njemu (za t zamjenik ) ili mjehurića plina (za t bale ).
Svojstvo rastvora da snižava tačku smrzavanja omogućava im da se koriste kao rashladne tečnosti.
Dakle, otopine nekih organskih i neorganskih tvari koriste se kao antifrizi za hlađenje motora s unutarnjim sagorijevanjem kada rade u različitim klimatskim uvjetima.
downgrade temperatura smrzavanja rješenja je od velikog značaja za žive organizme. Dakle, tekućina u njihovim stanicama je otopina raznih neorganskih i organskih tvari. Njegovotemperatura smrzavanja je ispod 0 o C (273.16 K ), tako da ćelije ne umiru u uslovima prehlađenja.
Zahvaljujući ovoj pojavi, biljke se čuvaju i zimi. Štoviše, što je veća koncentracija tvari u ćelijskoj tekućini, to biljka može podnijeti niže vanjske temperature.
Istovremeno, da bi se snizila tačka smrzavanja rastvora u ohlađenim ćelijama, pojačava se proces hidrolize jedinjenja veće molekularne težine do jedinjenja male molekulske mase (na primer, ugljenih hidrata do glukoze).






