Izračun entalpije. Entalpija. fizička svojstva
Grana hemije koja se bavi proučavanjem promena entalpije tokom hemijskih reakcija i fazne transformacije naziva se termohemija. Eksperimentalna tehnika koja se koristi za određivanje entalpije naziva se kalorimetrija.
PROMJENA ENTALPIJE TOKOM HEMIJSKE REAKCIJE
Mnoge hemijske reakcije su praćene promjenom entalpije. To znači da je ukupna entalpija produkta reakcije različita od ukupne entalpije reaktanata. Promjena entalpije određena je relacijom
gdje je entalpija reaktanata i entalpija proizvoda. Količina se ponekad naziva toplota reakcije.
Ako je entalpija proizvoda manja od entalpije reaktanata, reakcija se naziva egzotermna (slika 5.4). Smanjenje entalpije tokom reakcije odgovara negativnoj vrijednosti. Energija izgubljena tokom egzotermne reakcije prvo ulazi u reakcionu smjesu. Kao rezultat, temperatura reakcione smjese raste. Tada se ova energija prenosi u okolinu i, konačno, kada se reakcija u potpunosti završi, temperatura reakcione smjese ponovo opada.
Ako je entalpija proizvoda veća od entalpije reaktanata, kaže se da je reakcija endotermna. Povećanje entalpije tokom reakcije odgovara pozitivnoj vrijednosti AH. Energija apsorbirana tokom reakcije prvo se uzima iz reakcione smjese. Kao rezultat, temperatura reakcione smjese se smanjuje. Pošto je temperatura okoline sada viša od temperature reakcione smeše, toplotna energija se prenosi iz okoline u reakcionu smešu, i na kraju, kada je reakcija završena, temperatura reakcione smeše ponovo raste.
Standardna entalpija (toplina) stvaranja supstance je termički efekat reakcije stvaranja 1 mol hemijskog jedinjenja iz jednostavnih supstanci u standardnim uslovima: T=289 K, P=1 atm=101325 Pa.
Topline formiranja jednostavne supstance jednaki su nuli.
ν i , ν j – stehiometrijski koeficijenti ispred odgovarajućih supstanci u jednadžbi reakcije.
Prema standardnim entalpijama (toplinama) sagorijevanja tvari
Standardna entalpija (toplina) sagorevanja neke supstance je toplotni efekat reakcije potpunog sagorevanja 1 mol hemijskog jedinjenja u standardnim uslovima.
![]()
Pretpostavlja se da su topline sagorijevanja viših oksida (uključujući CO 2 i H 2 O) jednake nuli.
Drugi zakon termodinamike utvrđuje mogućnost, pravac i dubinu spontanog procesa.
Spontani proces - proces koji se odvija bez ikakvih spoljnih uticaja, i dovodi sistem bliže stanju ravnoteže.
Termodinamički reverzibilni proces - proces koji se odvija u smjeru naprijed i nazad bez promjena u sistemu i okruženju, tj. tokom prelaska iz početnog stanja u konačno stanje, sva međustanja su u ravnoteži.
U prisustvu neravnotežnih međustanja razmatra se procestermodinamički nepovratan.
U prirodi su sistemi sa minimalnom energijom stabilni. Tada bi samo egzotermni procesi trebali biti spontani. Ali nije. To znači da postoji još jedan kriterijum za spontani tok procesa - entropija (S).
Entropija -mjera energetskog poremećaja u sistemu, mjera haosa, mjera energije koja se raspršuje u obliku topline i ne pretvara se u rad.
Drugi zakon termodinamike (drugi zakon termodinamike):
Procesi se javljaju spontano, što dovodi do povećanja ukupne entropije sistema i okoline
Δ S syst + Δ S okruženja ≥ 0 ili Δ S ≥ 0
Fizičko značenje entropije:
entropija je količina energije koju raspršuje 1 mol supstance po 1 stepenu.
S 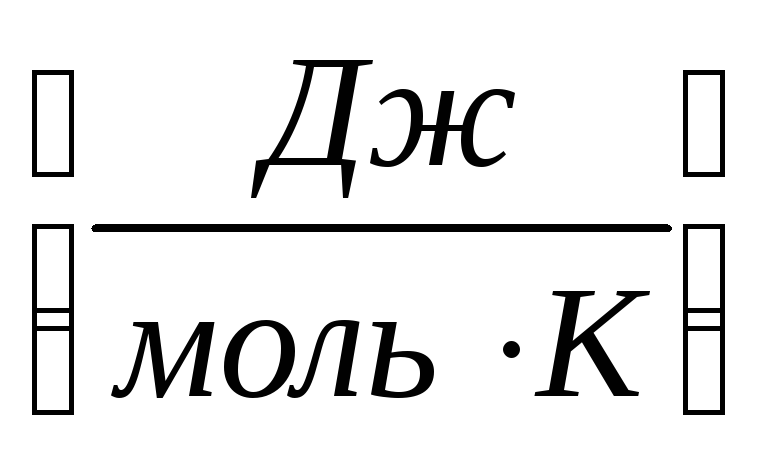
Entropija je opsežna funkcija. Entropija je proporcionalna masi, odnosi se na 1 mol ili 1 gram supstance. To znači da je entropija sistema jednaka zbiru entropija njegovih sastavnih delova:
S= 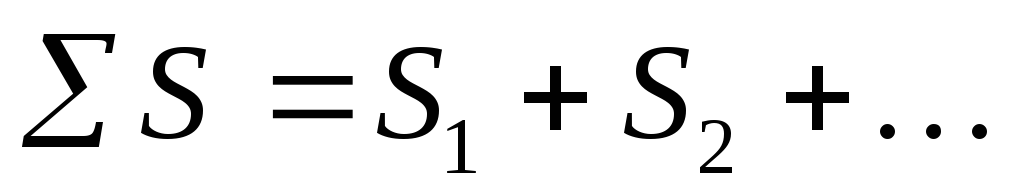
Entropija je funkcija stanja sistema. To znači da  karakteriše sistem, nije proces. Njegova promjena zavisi samo od početnog i konačnog stanja sistema i ne zavisi od putanje tranzicije:
karakteriše sistem, nije proces. Njegova promjena zavisi samo od početnog i konačnog stanja sistema i ne zavisi od putanje tranzicije:
Za hemijsku reakciju, promena entropije je: 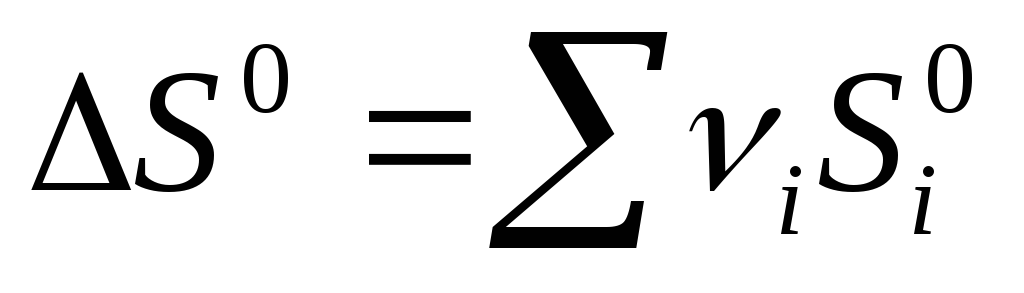 prod -
prod - 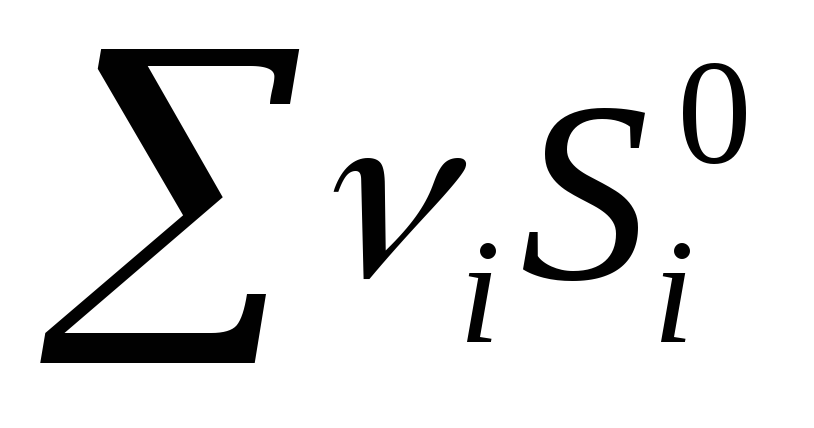 ref
ref
Probabilističko značenje entropije
Za svaki termodinamički sistem razlikuju se makrostanje i mikrostanje. Makrostanje sistema karakterišu makroparametri (T, P, V, U, itd.). Istovremeno, sistem se sastoji od beskonačnog broja mikročestica. Mikrostanje je raspored i energija pojedinačnih molekula u njemu ovog trenutka vrijeme.
Jedno makroskopsko stanje sistema može se realizovati sa nekoliko različitih mikrostanja. Za svako mikrostanje postoji vjerovatnoća (P) da se sistem nalazi u ovom konkretnom mikrostanju. Stoga su svi procesi u termodinamici vjerovatnoće ili statističke prirode, što određuje prijelaz sistema iz manje vjerovatnog u vjerovatnije stanje.
Boltzmann je 1896. pretpostavio da je entropija povezana s termodinamičkom vjerovatnoćom logaritamskom ovisnošću
S = klnW Boltzmannova jednadžba
k– Boltzmannova konstanta: k= 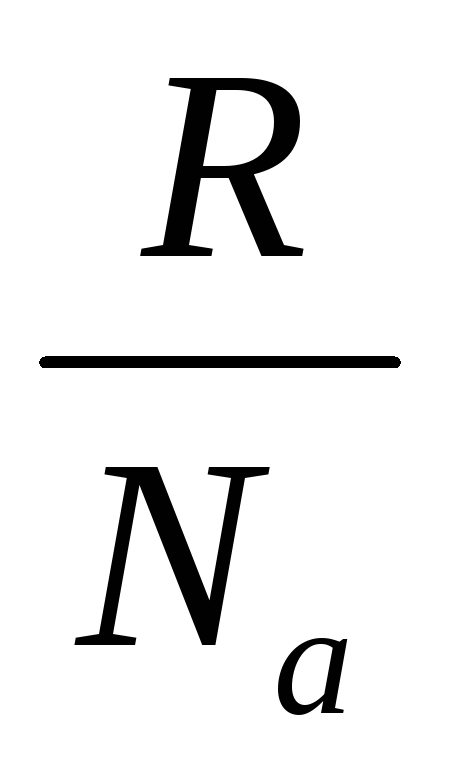 = 1,38∙10 -23 J/stepen;
= 1,38∙10 -23 J/stepen;
W je broj mikrostanja uz pomoć kojih se ovo makrostanje može realizovati: W=1/R;
P je vjerovatnoća da je sistem u ovom konkretnom mikrostanju.
Sa povećanjem reda u sistemu, broj mikrostanja koji se mogu koristiti za realizaciju ovog stanja opada, a entropija opada.
Kada tvar prijeđe iz plinovitog u tekuće stanje, a zatim u kristalno stanje, entropija se smanjuje. Prema Boltzmannovoj jednačini, entropija može biti jednaka nuli samo u jednom stanju.
Godine 1911. Planck je formulirao postulat poznat kao treći zakon termodinamike:
entropija idealno konstruisanog kristala čiste supstance (bez defekata i nečistoća) na apsolutnoj nuli je nula.
Ovaj zakon postavlja referentnu nulu za entropiju, što omogućava izračunavanje njene apsolutne vrijednosti, jer
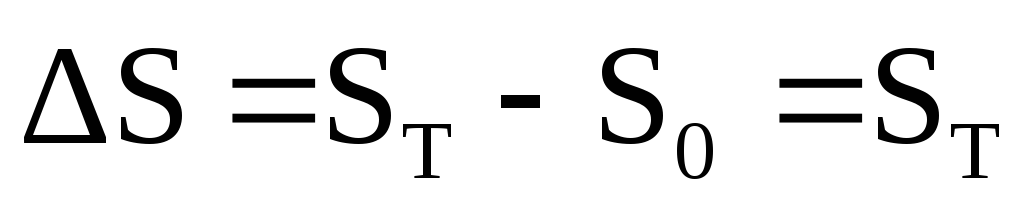
U izolovanom sistemu (U,V=const), entropija raste u spontanom procesu. U stanju ravnoteže, entropija je maksimalna i konstantna.
U zatvorenom i otvoreni sistem Kriterijum za spontani tok procesa je redukcija Gibbsova energija ( G ).
H - entalpija
T - temperatura
S - entropija
Koristeći Gibbsovu energiju, drugi zakon termodinamike može se izraziti kao:
Pri konstantnoj temperaturi i pritisku u sistemu spontano se odvijaju samo procesi koji dovode do smanjenja Gibsove energije. U ravnoteži, Gibbsova energija je nula.
∆G≤0 (p, T=konst)
Na ∆G<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 u obrnutom smjeru
∆G=0 reakcija je u ravnoteži.
Promjena Gibbsove energije je data sa
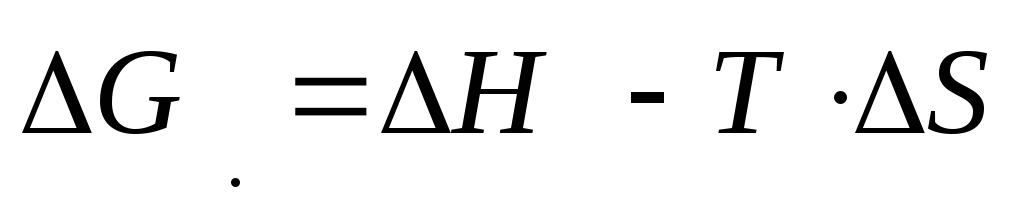
Prvi termin se zove faktor entalpije, drugi - faktor entropije. Smanjenje Gibbsove energije, a samim tim i spontani tok procesa, olakšano je smanjenjem ∆H (procesi sa oslobađanjem toplote) i povećanjem entropije (procesi sa povećanjem nereda u sistemu).
Gibbsova standardna energija hemijska reakcija izračunato po formuli koristeći tabelarne podatke:
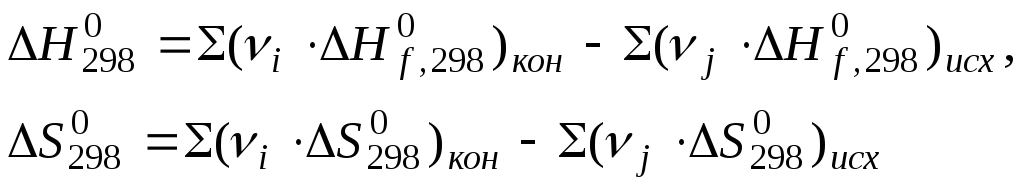
Eksergonski procesi - hemijske reakcije, usled kojih se Gibsova energija smanjuje i sistem radi.
Endergonski procesi - hemijske reakcije, usled kojih se povećava Gibbsova energija i vrši se rad na sistemu.
Na primjer, oksidacija glukoze u krvi je eksergonski proces, jer je praćena smanjenjem Gibbsove energije, a kao rezultat ove reakcije moguće je obavljati različite vrste rada u tijelu.
Aplikacija 2: Pitanja za samokontrolu
Šta proučava hemijska termodinamika?
Šta su parametri stanja?
Koja je razlika između intenzivnih i ekstenzivnih parametara?
Koja se funkcija može nazvati funkcijom stanja?
Dajte definicije unutrašnja energija, toplina, posao.
Koje vrste termodinamičkih sistema poznajete? Koja je razlika?
Koje su vrste termodinamičkih procesa?
Navedite prvi zakon termodinamike.
Definirajte pojmove entalpija, standardna entalpija stvaranja tvari, standardna entalpija sagorijevanja tvari.
Kolika je standardna entalpija reakcije? Koje metode njegovog izračunavanja su poznate?
Formulirajte Hessov zakon.
Navedite drugi zakon termodinamike. Šta predviđa?
Reverzibilni i ireverzibilni procesi u termodinamičkom smislu.
Definirajte pojam entropije.
Gibbsova energija. Predviđanje pravca spontanih procesa u izolovanom i zatvoreni sistemi; uloga faktora entalpije i entropije.
Uslovi termodinamičke ravnoteže.
Kolika je standardna Gibbsova energija formiranja materije, standardne energije Gibbsova biološka oksidacija tvari, standardna Gibbsova energija reakcije?
Objasniti pojam eksergonijskih i endergonijskih procesa koji se odvijaju u tijelu, princip energetske konjugacije.
Aplikacija 3: praktični test
Termodinamičke studije:
a) odnos toplote i energije;
b) brzinu hemijskih procesa;
c) svojstva glavnih klasa hemijskih jedinjenja;
Entropija je...
b) sposobnost za rad;
c) mjera poremećaja u sistemu;
3) Prvi zakon termodinamike opisuje:
a) entropija termodinamičkog sistema;
b) odnos između unutrašnje energije, toplote i rada;
c) dinamički viskozitet supstanci.
4) Procesi se odvijaju spontano, praćeni:
a) smanjenje energije;
b) smanjenje entropije;
c) povećanje entropije.
5) Zatvoreni sistem karakteriše:
a) nedostatak razmene materije i energije;
b) nedostatak razmene energije;
c) nedostatak metabolizma;
odgovori: 1a, 2c, 3b, 4c, 5c
Aplikacija 4: Situacioni zadaci
Izračunajte toplinski efekat reakcije
Entalpija
ili du + pdv = di - vdp .
dq = di - vdp
dq p = di . (86)
Promjena entalpije u bilo kojem procesu određena je samo početnim i konačnim stanjem tijela i ne ovisi o prirodi procesa.
Entropija je funkcija stanja, stoga je njena promjena u termodinamičkom procesu određena samo početnim i konačnim vrijednostima parametara stanja. Promjena entropije u osnovnim termodinamičkim procesima:
u izohornom
u izobarskom
vizotermni
u adijabatskom
u politropskom
UNUTRAŠNJA ENERGIJA RADNOG TIJELA, FIZIČKO ZNAČENJE I DIMENZIONALNOST.
Unutrašnja energija- ovo je sva energija sadržana u tijelu ili sistemu tijela.Ova energija se može predstaviti kao zbir određene vrste energije: kinetička energija molekula, uključujući energiju translacije i rotaciono kretanje molekule, i oscilatorno kretanje atomi u samoj molekuli; energija elektrona; intranuklearna energija; energije interakcije između jezgra molekula i elektrona; potencijalna energija ili energija položaja molekula u bilo kojem vanjskom polju sila; energija elektromagnetnog zračenja.
Obično se označava ukupna unutrašnja energija tijela U (J), i specifičnu unutrašnju energiju u (J/kg).
Unutrašnja energija je:
Gdje je unutrašnja kinetička energija molekula, unutrašnja potencijalna energija molekula, je konstanta integracije.
U tehničkoj termodinamici razmatraju se samo oni procesi u kojima se mijenjaju kinetička i potencijalna komponenta unutrašnje energije.
Promjena unutrašnje energije idealnog plina za bilo koji proces s beskonačno malom promjenom stanja (za 1 kg)
U termičkim proračunima se obično traži promjena unutrašnje energije, a ne njena apsolutna vrijednost; dakle, referentna tačka (0 K ili 0 0 C) za krajnji rezultat() irelevantno.
gdje je prosječni maseni toplotni kapacitet pri konstantan volumen unutar
Dakle, promjena unutrašnje energije idealnog plina za bilo koji proces jednaka je proizvodu prosječnog toplotnog kapaciteta pri konstantnoj zapremini i temperaturne razlike gasa.
PROCESI SU REVERZIBILNI I NEPOVRATNI. RAVNOTEŽA I NEravnoteža
Termodinamički proces je sekvencijalna promjena stanja tijela koja nastaje kao rezultat energetske interakcije radnog fluida sa okruženje.
Koncepti reverzibilnog i ireverzibilnog termodinamičkog procesa usko su povezani sa ravnotežom sistema. Razmotrimo takav termodinamički sistem u kome nema razmene toplote sa okolinom (adijabatski termodinamički sistem). Termodinamički procesi koji se odvijaju u takvom sistemu nazivaju se reverzibilnim ako se sistem vraća u prvobitno stanje tokom direktnih i reverznih procesa bez ikakvog dodatnog toplotnog uticaja okoline na sistem. Ako se sistem ne može vratiti u prvobitno stanje tokom reverznog procesa ili je za to potrebno dovod topline, onda se takav proces naziva nepovratnim.
Proces sa svakom promjenom tlaka i temperature može biti reverzibilan samo ako je tijekom cijelog procesa od tačke do tačke termodinamičkog sistema pritisak konstantan i temperatura u svakoj tački jednaka temperaturi okoline ili je njihova razlika beskonačno mala. .
reverzibilni termodinamički procesi su idealan ili teoretski slučaj. Svi stvarni procesi su nepovratni, jer je u praksi teško ispuniti ispunjenje kvazistatičkog uslova. Osim toga, nepovratnost procesa uzrokovana je prisustvom unutrašnjeg trenja u radnom fluidu i površinskog trenja u tehničkoj opremi (protok u mlaznici, trenje površine klipa o zid cilindra itd.). Da bi se savladalo trenje, uvijek je potrebno potrošiti određenu količinu mehaničkog rada, koji se u toku procesa pretvara u toplinu.
TOPLOTNI KAPACITET RADNOG MEDIJELA
toplotni kapacitet nazovite količinu toplote koja se mora preneti telu (gas) da bi se temperatura bilo koje kvantitativne jedinice podigla za 1°C.
Da biste odredili gore navedene vrijednosti toplinskih kapaciteta, dovoljno je znati vrijednost jednog od njih. Najpogodnije je imati vrijednost molarnog toplotnog kapaciteta, zatim masenog toplotnog kapaciteta:
i volumetrijski toplotni kapacitet:
Zapreminski i maseni toplotni kapaciteti su međusobno povezani zavisnošću:
gdje je gustina gasa u normalnim uslovima.
Toplotni kapacitet gasa zavisi od njegove temperature. Na osnovu toga se razlikuje prosječni i pravi toplinski kapacitet.
Ako q- količina toplote koja je prijavljena jedinici količine gasa (ili joj je oduzeta) kada se temperatura gasa promeni od t1 prije t2 onda
Predstavlja prosečan toplotni kapacitet unutar . Granica ovog omjera, kada temperaturna razlika teži nuli, naziva se pravi toplotni kapacitet.
IZOHORNI PLINSKI PROCES
Izohorni proces- proces komunikacije ili odvođenja toplote pri konstantnoj zapremini gasa (v= const).
Pri konstantnoj zapremini, pritisak gasa se menja direktno proporcionalno apsolutnim temperaturama:
Vanjski rad plina na v= const je nula l=0.
količina toplote ili promena unutrašnje energije gasa:
Izohorni proces pv - dijagram prikazano ravnom vertikalnom linijom - izohorom. Uz pozitivnu količinu topline, linija ide odozdo prema gore.
Promjena entropije je:
IZOBARNI PLINSKI PROCES.
Izobarski proces - proces komunikacije ili odvođenja toplote pri konstantnom pritisku (R = const)
Kriva procesa se naziva izobara.
Jer u izobaričnom procesu dp=0 tada se u sistemu ne obavlja tehnički rad, a količina toplote potrebna za prelazak tela iz stanja 1 u stanje 2 određuje se kao:
Dakle, u izobaričnom termodinamičkom procesu, količina toplote koja se dovodi (odvodi) telu je proporcionalna promeni entalpije u ovom procesu.Ovaj zaključak važi i za reverzibilne i za ireverzibilne procese, pod uslovom da je sistem u termodinamičkoj ravnoteži na početak i kraj procesa.
Za reverzibilni proces:
izobarni proces pv- dijagram je prikazan kao ravna horizontalna linija. Kada se procesu doda toplina, linija se proteže s lijeva na desno.
Mehanički rad u takvom procesu:
Specifični jednokratni (korisni) vanjski radovi:
Promjena specifične unutrašnje energije:
Iz jednadžbe stanja idealnog plina može se dobiti sljedeći odnos za izobarični proces:
Dakle, u izobaričnom procesu, zapremina idealnog gasa je proporcionalna apsolutna temperatura. Kada se plin širi, temperatura raste, a kada je komprimiran, opada.
Promjena entropije u izobarnom procesu može se izračunati na sljedeći način:
ADIABATSKI PLINSKI PROCES.
Proces koji se odvija bez dovoda i odvođenja toplote, tj. u odsustvu razmene toplote sa okolinom, naziva se adijabatskom, a kriva ovog procesa naziva se adijabatskom. Uslovi procesa: dq=0 , q=0.
Jer dq=0, tada prema prvom zakonu termodinamike:
Dakle, mehanički rad koji obavlja radno tijelo u adijabatskom termodinamičkom procesu jednak je smanjenju unutrašnje energije tijela, dok je tehnički rad proporcionalan promjeni (smanjenju) entalpije. U reverzibilnom dijabatskom procesu, entropija termodinamičkog tijela se ne mijenja: S=Konst.
Adijabatska jednadžba u koordinatnom sistemu pv- dijagrami pri konstantnom toplinskom kapacitetu () za idealni plin: gdje je adijabatski eksponent
Zavisnosti između početnih i konačnih parametara procesa: između R i v ,
između T i v
između R i T
Rad 1 kg plina nalazi se prema sljedećim formulama
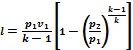
Promjena unutrašnje energije plina i rad adijabatskog procesa jednaki su po veličini i suprotnog predznaka. .
Promjena unutrašnje energije idealnog plina u adijabatskom procesu također se može izraziti jednadžbom
Drugi zakon termodinamike
Drugi zakon termodinamike utvrđuje pravac toka spontanih toplotnih procesa u prirodi i određuje uslove za transformaciju toplote u rad. Zakon kaže da toplota u prirodi spontano prelazi samo sa tela koja su toplija na manje vrela.
U skladu sa drugim zakonom termodinamike, da bi se toplota pretvorila u rad u bilo kojoj toplotnoj mašini, potrebno je imati dva tela sa različite temperature. Toplije tijelo će biti izvor toplote za rad, manje zagrijano tijelo će biti hladnjak. Istovremeno, efikasnost toplotni motor uvijek će biti manji od jedan.
Drugi zakon dinamike može se matematički izraziti:
Gdje dS- beskonačno mali prirast entropije sistema;
dQ- beskonačno mala količina toplote koju sistem prima iz izvora toplote;
T- apsolutna temperatura izvora toplote.
Znak nejednakosti odgovara ireverzibilnim procesima, a jednak je reverzibilnim. Stoga, analitički izraz za drugi zakon termodinamike za beskonačno mali reverzibilni proces ima oblik
i od tada prema prvom zakonu termodinamike
dQ=dU+pdV
TdS=dU+pdV.
Carnotov ciklus i njegova svojstva.
Carnot ciklus. Sastoji se od dvije izoterme i dvije adijabate. Ovaj ciklus je zatvoreni proces koji obavlja radni fluid u idealnoj toplotnoj mašini u prisustvu dva izvora toplote: grejača i frižidera.
Carnotov ciklus pv-dijagram
Procesi 1-2 i 3-4 su izotermni, dok su procesi 2-3 i 4-1 adijabatski. Pretpostavlja se da je početna temperatura radnog fluida u ciklusu jednaka temperaturi grijača T1. Tokom izotermnog širenja iz stanja 1 u stanje 2, radni fluid prima od grijača količinu toplote q 1 na temperaturi T1. U sekciji 2-3 radni fluid se adijabatski širi. Istovremeno, temperatura radnog fluida opada od T1 prije T2, a pritisak pada od p2 prije p 3. Kada se komprimuje duž izoterme 3-4, količina toplote se uklanja iz radnog fluida u frižider q2 na temperaturi T2.Dalja adijabatska kompresija4-1 dovodi do povećanja temperature radnog fluida od T2 prije T1, a radni fluid se vraća u prvobitno stanje.
Totalni ciklus rada l c grafički predstavljeno površinom od 12341.
Efikasnost termičkog ciklusa:
Rad Carnotovog ciklusa
Termička efikasnost ciklus:
Ciklus sa dovodom toplote pri konstantnoj zapremini sastoji se od dve adijabate i dve izohore
Karakteristike ciklusa:
Omjer kompresije
Odnos pritiska
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
Ciklus sa dovodom toplote pri konstantnom pritisku sastoji se od dve adijabate, jedne izobare i jedne izohore.
Karakteristike ciklusa:
Omjer kompresije
Stepen pred-ekspanzije.
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
Ciklus sa kombinovanim snabdevanjem toplotom sastoji se od dvije adijabate, dvije izohore i jedne izobare
Karakteristike ciklusa
Količina isporučene topline
Količina uklonjene topline
Termička efikasnost ciklus
Tablice vodene pare.
pregrijana para ili zasićena para po svojim svojstvima značajno se razlikuju od idealnih gasova. Jednačine za stanje para su veoma složene i ne koriste se u računarskoj praksi. U praktične svrhe koriste se tabele i dijagrami, sastavljeni na osnovu eksperimentalnih i teorijskih podataka. Tabele su sastavljene sa visokim stepenom tačnosti za pregrejane i zasićene pare do temperature od 1000 0 C i pritiska od 98,0 MPa.
U tabelama za zasićena para temperature zasićenja, pritisci, vrijednosti specifične količine, entalpija i entropija tečne i suve pare, toplota isparavanja. U tabelama pregrijane pare date su vrijednosti glavnih parametara za različite pritiske i temperature: specifičan volumen, entalpija i entropija.
i - dijagram vodene pare.
veliko dostojanstvo je dijagram je da su tehnički rad i količina topline uključene u procese predstavljeni segmentima linija, a ne površinama. Prilikom izgradnje is-dijagrami iscrtano duž y-ose specifična entalpija par, a duž apscise je specifična entropija. Podrijetlo koordinata se uzima da je stanje vode u trostrukoj tački, gdje je , .
Koristeći podatke tablica vodene pare, granične krive tečnosti i pare su ucrtane na dijagram, konvergirajući u kritična tačka K. Granična kriva tečnosti napušta ishodište, jer. u ovoj tački, entropija i entalpija se uzimaju jednakima nuli. Stanje vode je označeno tačkama na odgovarajućim izobarama. Linije izobare u području vlažne pare su ravne nagnute linije koje se šire od granične krivulje tekućine. U izobaričnom procesu:
Nagib nagib izobare prema osi apscise u svakoj tački dijagrama je numerički jednak apsolutnoj temperaturi datog stanja. Jer u području mokre pare, izobara se poklapa sa izotermom, tada su prema posljednjoj jednadžbi izobara mokre pare ravne linije:
A ovo je jednačina prave linije. U području pregrijane pare, izobare imaju zakrivljenost s konveksnošću usmjerenom prema dolje. U području vlažne pare primjenjuje se mreža linija konstantne suhoće pare (x=const), koje se konvergiraju u kritičnoj tački K.
Izoterme u području vlažne pare poklapaju se sa izobarama. U području pregrijane pare, oni se razilaze: izobare se uzdižu, a izoterme su zakrivljene linije s konveksnošću prema gore. Na dijagram je primijenjena mreža izohora, koje imaju oblik krivulja koje se strmije uzdižu u odnosu na izobare. Reverzibilni adijabatski proces je predstavljen vertikalnom ravnom linijom. Područje ispod izobare trostruki poen prikazuje stanje mješavine pare + leda.
Adijabatski proces vodene pare. Obradite sliku u p–V , i-S i T–S dijagrami.
Adijabatski proces se odvija bez dovoda i odvođenja toplote, a entropija radnog fluida u reverzibilnom procesu ostaje konstantna vrijednost: s=konst. Stoga, na je i Ts- adijabatski dijagrami su prikazani vertikalnim pravim linijama: sl. a i b
Tokom adijabatskog širenja, pritisak i temperatura pare se smanjuju; pregrijana para prelazi u suhu, a zatim u mokra para. Iz uslova konstantnosti entropije moguće je odrediti konačne parametre pare ako su poznati parametri početnog i jednog parametra krajnjeg stanja.
Na pv- na dijagramu je reverzibilni adijabatski proces prikazan određenom krivom (sl. c)
Specifičan rad u adijabatskom procesu određuje se iz jednačine:
Promjena specifične unutrašnje energije:
Višestepena kompresija u kompresoru.
Višestepeni kompresori se koriste za proizvodnju gasa pod visokim pritiskom
u kojoj se plin komprimira politropski u nekoliko cilindara povezanih u seriju sa svojim međuhlađenjem nakon svake kompresije.
Upotreba kompresije plina u nekoliko cilindara smanjuje omjer tlaka u svakom od njih i povećava volumetrijsku efikasnost. kompresor. Osim toga, međuhlađenje plina nakon svake faze poboljšava uvjete podmazivanja klipa u cilindru i smanjuje potrošnju energije za pogon kompresora.
idealni indikatorski dijagram trostepenog kompresora, gdje je 0-1 usisni vod do prvog stupnja;
1-2 - proces politropske kompresije u prvoj fazi; 2-a - vod za ubrizgavanje od prvog stepena do prvog hladnjaka; a-3 - usisni vod do drugog stepena; 3-4 - proces politropske kompresije u drugoj fazi; 4-c - ispusni vod od drugog stepena do drugog hladnjaka; c-5 - usisni vod do trećeg stepena; 5-6 - proces politropske kompresije u trećoj fazi; 6-c - linija za ubrizgavanje od treće faze do rezervoara ili do proizvodnje. Segmenti 2-3, 4-5 prikazuju smanjenje zapremine gasa u procesu na konstantan pritisak od hlađenja u prvom i drugom hladnjaku. Hlađenje radnog fluida u svim hladnjacima vrši se na istu temperaturu jednaku početnoj T 1, stoga su temperature gasa u tačkama 1, 3 i 5 iste i leže na izotermi 1 - 7.
Odnos pritisaka u svim fazama obično se uzima isti:
Uz iste omjere tlaka u svim stupnjevima, jednakost početnih temperatura i jednakost politropskih pokazatelja, konačne temperature plina u pojedinim fazama kompresora jednake su jedna drugoj: l k = 3l 1
Pod istim uvjetima kompresije plina, količine topline koje se uklanjaju iz plina u pojedinim fazama jednake su jedna drugoj:
Toplota koja se uklanja iz plina u bilo kojem hladnjaku tokom procesa izobarnog hlađenja nalazi se po formuli:
AT Ts- Na dijagramima su procesi adijabatske kompresije prikazani pravim linijama 1-2, 3-4, 5-6, a procesi hlađenja krivuljama 2-3, 4-5, 6-7.
Procesi politropske kompresije prikazani su krivuljama 1-2, 3-4, 5-6, a procesi hlađenja u rashladnim uređajima - linijama 2-3, 4-5, 6-7.
ICE ciklus sa sagorevanjem na V=konst
Na slici je prikazan dijagram indikatora motora koji radi sa gorivom koji brzo gori pri konstantnoj zapremini. Kao gorivo koriste se benzin, rasvjetni ili generatorski plin, alkoholi itd.
Kada se klip pomakne iz lijevog mrtvog položaja u krajnji desni, zapaljiva smjesa se usisava kroz usisni ventil. Ovaj proces je prikazan krivuljom 0-1, koja se zove usisna linija, nije termodinamički proces, jer. u njemu se ne mijenjaju glavni parametri, već se mijenjaju samo masa i volumen smjese u cilindru. Kada se klip pomeri unazad, usisni ventil se zatvara, a zapaljiva smeša se komprimira. Prikazana krivuljom 1-2, koja se zove linija kompresije. U tački 2, zapaljiva smjesa se zapali od električne iskre. Sagorevanje zapaljive smeše se dešava skoro trenutno, tj. pri skoro konstantnoj zapremini. Ovaj proces je prikazan krivom 2-3. Kao rezultat sagorijevanja goriva, temperatura plina naglo raste, a tlak raste (tačka 3). Tada se proizvodi sagorevanja šire. Klip se pomera u pravi mrtvi položaj, a gasovi obavljaju koristan posao. Na dijagramu indikatora, proces ekspanzije je prikazan krivuljom 3-4, koja se naziva ekspanzijska linija. U tački 4, izduvni ventil se otvara i tlak u cilindru pada na gotovo vanjski tlak. Daljnjim kretanjem klipa s desna na lijevo, proizvodi izgaranja se uklanjaju iz cilindra kroz ispušni ventil pod tlakom nešto višim od atmosferskog. Prikazana je kao kriva 4-0 i naziva se izduvna linija. Takav radni tok se završava u četiri hoda klipa ili u dva okretaja osovine. Takvi motori se nazivaju četverotaktni.
Ciklus sa dovodom toplote pri konstantnoj zapremini sastoji se od dve adijabate i dve izohore
Karakteristike ciklusa su:
- omjer kompresije
– stepen povećanja pritiska
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
ICE ciklus sa sagorevanjem na p=konst
Proučavanje ciklusa s dovodom topline pri konstantnoj zapremini pokazalo je da je za povećanje efikasnosti motora koji radi po ovom ciklusu potrebno koristiti visoke omjere kompresije. Vazduh pri visokoj kompresiji ima tako visoku temperaturu da se gorivo koje se dovodi u cilindar spontano zapali bez palitelja. Odvojena kompresija zraka i goriva omogućava korištenje bilo kojeg tečnog teškog i jeftinog goriva - ulja, lož ulja, smole, ugljena ulja.
Ovu prednost imaju motori koji rade sa postepenim sagorevanjem goriva pri konstantnom pritisku. Kod njih se zrak komprimira u cilindru motora, a tekuće gorivo se raspršuje komprimiranim zrakom iz kompresora.
Idealan ciklus motora sa postepenim sagorevanjem goriva pri konstantnom pritisku, tj. ciklus sa dovodom toplote pri konstantnom pritisku izvodi se na sledeći način.
Plinoviti radni fluid sa početnim parametrima p 1 , v 1 , T 1 skuplja se duž adijabatskog 1-2; tada se određena količina toplote prenosi na tijelo duž 2-3 izobare q 1. Od tačke 3, radno tijelo se širi duž adijabatskog 3-4. Prema 4-1 izohori, radni fluid se vraća u prvobitno stanje, dok se toplota odvodi do hladnjaka q2.
Karakteristike ciklusa:
Odnos toplotnog kapaciteta
gdje k je adijabatski indeks.
Koncept "koeficijenta hlađenja"
Koeficijent performansi je bezdimenzionalna vrijednost (obično veća od jedan) koja karakterizira energetsku efikasnost rada rashladna mašina; jednak je omjeru rashladnog kapaciteta i količine energije (rada) utrošene po jedinici vremena za implementaciju ciklus hlađenja. Određeno je tipom rashladnog ciklusa u kojem mašina radi, savršenstvom njenih glavnih elemenata, a za istu mašinu zavisi od temperaturnih uslova njenog rada.
Koeficijent performansi idealne rashladne mašine koja radi na obrnutom Carnot ciklusu:
gdje T min i Tmax su, respektivno, niže i viša temperatura u ciklusu.
Koeficijent hlađenja hladnjaka zraka (slika),
gdje T1 i T2 su temperature početka i kraja adijabatske kompresije, respektivno;
T3 i T4 su temperature početka i kraja adijabatskog širenja u ekspanderu.
Zagrevanje pare
Studija rada parnoturbinskog postrojenja pokazuje da povećanje početnog pritiska i smanjenje konačnog pritiska dovodi do povećanja efikasnost ciklusa. Međutim, jedno povećanje početnog pritiska povećava konačni sadržaj vlage u pari. Za smanjenje vlažnosti pare na kraju ekspanzije povećajte početna temperatura njegov. Jedan od načina da se poveća stepen suhoće pare na izlazu iz turbine je njeno sekundarno pregrijavanje. Pregrijana para iz kotla sa početnim pritiskom i temperaturom ulazi u prvi turbinski cilindar, koji se sastoji od nekoliko stupnjeva, gdje se adijabatski širi do određenog tlaka. p1. Nastala para se odvodi u poseban pregrijač, gdje se podvrgava sekundarnom pregrijavanju pri konstantnom pritisku. Zatim se ponovo vraća u turbinu, gdje se para nastavlja širiti do tlaka kondenzatora.
Tačka 1 odgovara početnom stanju pare; tačka 2 - konačno stanje pare nakon turbine nakon sekundarnog pregrijavanja. Konačni stepen suhoće kao rezultat uvođenja podgrijavanja raste od x2 prije x 1. Osim toga, sekundarno pregrijavanje pare daje neki ekonomski efekat (2-3%) ako je prosječna temperatura dovoda topline u dodatnom ciklusu 7-2-2 '-6-7 viša od prosječne temperature dovoda topline u ciklusu sa jedno pregrijavanje, a efekat će biti veći što je temperatura na početnoj i krajnjoj tački međupregrijavanja viša. Pri pritiscima blizu kritičnog i superkritičnog ponekad se koriste dva ili više međupregrijavanja. Zatim termička efikasnost ciklusa
Gdje je adijabatski pad topline u prvom i drugom cilindru turbine;
- količinu topline dovedene u kotao i prvi pregrijač;
Količina topline dovedena u drugi pregrijač.
Specifična potrošnja pare
Entalpija
Entalpija termodinamičkog tijela je zbir unutrašnje energije u i proizvoda pv.
Diferencirajući ovu relaciju, dobijamo: di = du + pdv + vdp ,
ili du + pdv = di - vdp .
Na osnovu prvog zakona termodinamike, dq = du + pdv, posljednja relacija će se prepisati kao:
dq = di - vdp , ili dq = dh + dl t ,
gdje je dl t diferencijal tehničkog rada (dl t = - vdp).
Rezultirajuća jednačina je također druga formulacija prvog zakona termodinamike, koristeći koncepte entalpije i tehničkog rada.
Vrijednost i se također može smatrati parametrom stanja termodinamičkog tijela, zajedno sa prethodno uvedenim p, v, T i. fizičko značenje mogu se objasniti na osnovu jednačine dq = di - vdp, što će za proces p =const biti zapisano kao:
dq p = di . (86)
Odatle slijedi da je di elementarna količina topline dovedena termodinamičkom tijelu u procesu konstantnog pritiska.
POGLAVLJE 3. Termodinamički potencijali
§ 3.2. Entalpija
Rad u termodinamici. Termodinamičko pravilo znakova. Termički izolirana tijela. Statusne funkcije.
Termodinamički potencijali.
Izohorni i izobarični procesi. Sadržaj topline ili entalpija.
Upotreba maksimuma entropije kao kriterijuma za ravnotežu zatvorenih sistema prvi je predložio J. Gibbs u svojim termodinamičkim radovima 1875-1878. Štaviše, pored uvođenja strogog logičkog razmatranja stanja termodinamičke ravnoteže, on je takođe predložio metode praktičnih matematičkih proračuna, uopštavajući metod poznat iz mehanike potencijali . Učiti idemo dalje.
Vanjske sile primijenjene na tijelo mogu proizvesti na njega rad , koji je određen prema općim pravilima mehanike kao skalarni proizvod vektora sile i pomaka. U termodinamici će nas zanimati slučaj kada sav rad ide samo na promjenu volumena, a samim tim i na promjenu unutrašnje energije (vidi formulu (2.5.8)). Rad utrošen na promjenu ukupne energije tijela - njegove kinetičke ili potencijalne energije u cjelini - u termodinamici, kao što je gore navedeno, ne uzima se u obzir.
U termodinamici je to prihvaćeno znak pravilo , prema kojem se rad vanjskih sila na tijelu smatra pozitivnim – odnosno kada se povećava unutrašnja energija tijela. Ako tijelo radi na okolini zbog svoje unutrašnje energije, onda se taj rad smatra negativnim. Slično tome, toplina koju tijelo primi izvana smatra se pozitivnom, a toplota koju predaje negativnom.
Pritisak je sila koja djeluje po jedinici površine površine. Zatim za malu količinu posla δR , koji se izvodi pomicanjem površinskog elementa dσ na kratkoj udaljenosti dr može se napisati:
Prilikom kompresije tijela dV < 0, так что δR > 0.
Ako tijelo termoizolovano , tada je cjelokupna promjena energije povezana s energijom proizvedenom na njoj mehanički rad. U opštem slučaju, pored rada, telo prima (ili daje) energiju ili direktnim prenosom sa tela koja dodiruju, ili razmenom zračenja od tela koja nisu u direktnom kontaktu sa našim telom. Ovaj dio promjene unutrašnje energije naziva se količinu toplote δQ . Dakle, promjena tjelesne energije može se zapisati kao:
Gore je dobijena relacija (2.5.8) za ukupni diferencijal unutrašnje energije:
Drugim riječima, ekvivalentnost empirijske, fenomenološke definicije entropije kao smanjena toplota i njegovu kvantnomehaničku, probabilističku interpretaciju.
Elementarni radovi δR i količinu toplote δQ dobijeno od tijela s beskonačno malom promjenom njegovog stanja, Uglavnom nisu kompletni diferencijali . Samo iznos δR + δQ , tj. promena unutrašnje energije dU , uvijek postoji potpuni diferencijal. Drugim riječima, energija tijela ne može se striktno podijeliti na mehaničku i toplinsku. Potreba za takvom podjelom javlja se samo pri određivanju načina za promjenu raspoložive količine energije. Ratio nastale količine toplote i rada nije definisano samo primarni i final stanje tela i u potpunosti zavisi od putanje. tranzicije, tj. priroda procesa. Ovo svojstvo se najjasnije vidi u zatvorenim procesima (ciklusima) koji počinju i završavaju u istom stanju. Ovdje je promjena unutrašnje energije nula, a tijelo može primati ili odavati toplinu ili raditi.
Funkcije čija je promjena u zatvorenom ciklusu nula (tj. njegov diferencijal je kompletan ), su pozvani državne funkcije ili potencijali . U mehanici, iz koje je ovaj koncept pozajmljen, jedini potencijal je Hamiltonova funkcija - zbir kinetičke i potencijalne energije. Budući da postoji mnogo više termodinamičkih varijabli nego mehaničkih - postoji više stupnjeva slobode u termodinamici - onda može postojati nekoliko potencijala. Naravno, u termodinamici se nazivaju termodinamički potencijali . Na osnovu oblika ukupnog diferencijala za unutrašnju energiju, može se vidjeti da U je termodinamički potencijal u vezi sa varijablama S i V .
Da bismo nakratko pojednostavili proračune, odstupili smo od činjenice da se prava tijela sastoje od čestica različitih tipova. Tada će biti samo termodinamičke varijable od kojih zavisi unutrašnja energija četiri . Ovo je volumen V , pritisak P , temperatura T i entropija S . Bilo koji njihov par bit će nezavisan od njih (imajte na umu da ako uzmemo u obzir sastav, tada će postojati tri nezavisne varijable). Dakle, poznavajući neki termodinamički potencijal na vrijednostima dvije odgovarajuće varijable, i koristeći svojstva potencijala, moguće je izračunati (u smislu parcijalnih izvoda) vrijednosti druge dvije varijable i svih ostalih potencijala. Ova činjenica određuje metodologiju pronalaženja i korišćenja termodinamičkih potencijala u praksi, u primenjenim proračunima.
Na primjer, pronađimo funkciju stanja koja je matematički potencijalna (otuda naziv potencijal ) u odnosu na varijable S i P . Gore je utvrđeno da količina toplote koju tijelo primi zavisi od uslova procesa. U praksi, procesi sa konstantnim volumenom ( izohorni , koji se izvode u zatvorenoj zapremini), ili procesi sa konstantnim pritiskom ( izobaričan izvode, recimo, u instalacijama koje komuniciraju sa atmosferom). Ako je proces izohoričan, onda tijelo nije mehanički posao ( dV =0 ), a iz relacije je očito da sva primljena toplina ide na promjenu energije: δQ = dU . VdP
Iz ovoga odmah slijedi da je za proces koji se izvodi pod konstantnim pritiskom R i entropija S , količina primljene toplote dH postoji potpuni diferencijal . Dakle, sama funkcija H - entalpija - je željeni termodinamički potencijal u odnosu na varijable R i S .
Termodinamičkim metodama nemoguće je pronaći apsolutne vrijednosti entalpija i unutrašnjih energija, već se mogu odrediti samo njihove promjene. Istovremeno, u termodinamičkim proračunima hemijski reagujućih sistema, zgodno je koristiti jedan referentni okvir. U ovom slučaju, pošto su entalpija i unutrašnja energija povezane relacijom , dovoljno je uvesti referentni okvir samo za jednu entalpiju. Pored toga, u cilju poređenja i sistematizacije termičkih efekata hemijskih reakcija, koji zavise od fizičkog stanja reagujućih supstanci i uslova za nastanak XP, uvodi se koncept standardnog stanja materije. Po preporuci komisije za termodinamiku Međunarodne unije za čistu i primijenjenu hemiju (IUPAC) 1975. standardno stanje definiran na sljedeći način:
“Standardno stanje za plinove je stanje hipotetičkog idealnog plina pri pritisku od 1 fizičke atmosfere (101325 Pa). Za tečnosti i čvrste materije standardno stanje je stanje čiste tečnosti ili, respektivno, čistog kristalna supstanca pri pritisku od 1 fizičke atmosfere. Za tvari u otopinama, standardno stanje se uzima kao hipotetičko stanje u kojem bi entalpija jednomolarne otopine (1 mol tvari u 1 kg otapala) bila jednaka entalpiji otopine pri beskonačnom razrjeđenju. Svojstva supstanci u standardnim stanjima označena su superskriptom 0. (Čista supstanca je supstanca koja se sastoji od identičnih strukturnih čestica (atoma, molekula, itd.)).
Ova definicija se odnosi na hipotetička stanja gasa i rastvorene supstance, budući da se u realnim uslovima stanja gasova u većoj ili manjoj meri razlikuju od idealnih, a stanja rešenja od idealnog rešenja. Zbog toga se pri korištenju termodinamičkih svojstava tvari u standardnim stanjima za realne uvjete uvode korekcije za odstupanje ovih svojstava od stvarnih. Ako su ova odstupanja mala, onda se korekcije mogu izostaviti.
U priručnicima se termodinamičke veličine obično daju pod standardnim uslovima: pritiskom R 0 =101325Pa i temperatura T 0 =0K ili T 0 = 298,15 K (25 0 C). Prilikom kreiranja tablica ukupnih entalpija tvari, njihovo standardno stanje na temperaturi T 0 =0K ili T 0 = 298,15 hiljada.
Supstance, koji su cisto hemijski elementi u najstabilnijoj fazi stanje na R 0 \u003d 101325 Pa i temperaturu referentne tačke entalpija T 0, uzmite vrijednost entalpija jednaka nuli: . (Na primjer, za supstance u gasovitom stanju: O 2, N 2, H 2, Cl 2, F 2, itd., za C (grafit) i metale (čvrsti kristali)).
Za hemijska jedinjenja (CO 2, H 2 O, itd.) i za supstance koje su, kao čisti hemijski elementi, nije u najstabilnijem stanju(O, N, itd.) entalpija at R 0 =101325Pa i T 0 nije jednako nuli: .






