trostruki bod
Tačka odgovara nizak pritisak, pri kojem je još uvijek moguća transformacija tvari iz čvrstog u tekuće stanje i obrnuto, odnosno stanje ravnoteže između čvrste i tekuće faze; pri nižim pritiscima tečno stanje ne postoji. Na istom crtežu je ucrtana kriva zavisnosti od pritiska zasićena para o temperaturi, koja je pomenuta u § 13, deo II (vidi sliku 11.25) i u § 17 (vidi formulu (3.32)). Levo od ove krive, supstanca je na temperaturama koje su niže od tačke ključanja, tj. tečno stanje; tačke desno od ove krive odgovaraju više visoke temperature i, shodno tome, države nezasićena para. Duž same krivulje, tečnost i zasićena para postoje istovremeno, tj. svaka tačka ove krive odgovara ravnotežnom stanju između kipuće tečnosti i njene zasićena para. Tačka na ovoj krivulji odgovara najnižoj temperaturi i najnižem pritisku na kojima tekućina još uvijek može postojati u ravnoteži sa svojom zasićenom parom. Tačka se naziva trostruka tačka date supstance. U ovom trenutku, sve tri faze ili agregatna stanja supstance istovremeno postoje u međusobnoj ravnoteži: čvrsta, tečna i gasovita (zasićena para). Za svaku supstancu postoje
vrijednosti pritiska i temperature trostruke tačke. Pri nižim pritiscima samo čvrsti i gasovitom stanju. Kriva pokazuje odnos između pritiska i temperature zasićene pare u ravnoteži sa čvrstom fazom.
Direktno isparavanje čvrstih tvari (zvano "sublimacija" ili sublimacija) događa se na temperaturama nižim od temperature trostruke tačke.
Za mnoge supstance (metale, itd.) normalna temperatura (15°C) je mnogo niža od temperature njihovih trostrukih tačaka. Prema krivulji, ove tvari pri normalnoj temperaturi imaju vrlo mali pritisak zasićene pare. Očigledno nego veći pritisak zasićene pare iznad površine čvrstog tijela, to intenzivnije može teći proces isparavanja ovih tijela. Na primjer, jod lako isparava, koji na svojoj trostrukoj tački (114 ° C) ima pritisak zasićene pare od 90 mm Hg. Art. Sušenje mokrog veša na mrazu objašnjava se činjenicom da se voda u njemu prvo smrzava, a nastali led potom isparava, jer je u mrazu temperatura leda niža od temperature trostruke tačke vode i pritiska zasićene vode. para doseže nekoliko milimetara žive (na -10 ° ovaj pritisak je jednak
primeti, to specifična toplota sublimacija, tj. toplina potrebna za transformaciju tvari iz čvrstog stanja direktno u plinovito stanje, ispada jednak zbiru specifične toplote topljenja i isparavanja.
Trostruka temperatura vode koristi se kao referentna temperatura Kelvinove termodinamičke skale. Pretpostavimo da idealan radni fluid, koji obavlja idealan Carnotov ciklus, prima toplotu na temperaturi i daje toplotu na temperaturi. Mjerenjem je moguće, prema §, pronaći temperaturni odnos. Da bi se izgradio temperaturnoj skali, potrebno je dati određene („referentne“) vrijednosti. Kao takve referentne temperature mogu se uzeti temperature kipuće vode i topljenja leda u normalnim uslovima, uzimajući njihovu razliku kao 100°C. Zatim se iz izmjerenog omjera i odabrane razlike može odrediti cijela temperaturna skala. Očigledno je da se referentne tačke moraju reprodukovati sa veoma velikom tačnošću, pošto one određuju veličinu stepena. Stoga su V. Thomson (Kelvin) i, nezavisno od njega, D. I. Mendeleev predložili stvaranje skale s jednom referentnom temperaturom, koja je odabrana kao vrlo precizno reproducibilna (sa greškom koja ne prelazi stupanj) trostruka tačka vode. AT međunarodni sistem jedinice fizičke veličine data je sljedeća definicija stepena: kelvin je jedinica temperature na termodinamičkoj temperaturnoj skali, u kojoj je temperatura trostruke tačke vode postavljena na 273,16° (tačno).
Pretpostavimo da je broj faza hemijski homogene supstance koje su u ravnoteži jedna s drugom tri. Primer je sistem koji se sastoji od čvrste faze, tečnosti i njene pare. Za ravnotežu moraju biti ispunjena tri uslova:
j 1 (P,T) =j 2 (P,T),
j 2 (P,T) =j 3 (P,T), (2)
j 3 (P,T) =j 1 (P,T).
Prvi je uslov ravnoteže između tečnosti i njene pare; drugi - između tečne i čvrste faze; treći je između čvrste faze i pare. Ova tri uslova nisu nezavisna. Svaki od njih je posljedica druge dvije. Prva jednačina sistema (2) prikazuje na avion T-R kriva ravnoteže između gasa i tečnosti, tj. kriva isparavanja 1-2 na sl. 2. Drugi prikazuje krivu ravnoteže čvrste i tečne faze 2-3. To se zove krivulja topljenja. Kriva topljenja siječe se sa krivom isparavanja u tački A, koja se naziva trostruka tačka. 3-1 kriva sublimacije također mora proći kroz trostruku tačku, tj. kriva ravnoteže između čvrste i gasovite faze. Ovo direktno proizilazi iz treće jednačine sistema (2).
Dakle, tri faze mogu biti u ravnoteži jedna sa drugom u jednoj tački, odnosno trostrukoj tački, tj. na dobro definisanim temperaturama i pritiscima.
Sl.2 Dijagram stanja tri faze materije
Za vodu, trostruka tačka leži približno 0,008 0 C iznad tačke topljenja u normalnom atmosferski pritisak. Pritisak u trostrukoj tački je oko 4,58 mm. rt. Art. Trostruka tačka vode je glavna referentna tačka u konstrukciji apsolutne termodinamičke Kelvinove temperaturne skale, kao i praktična međunarodne skale Celzijusove temperature.
Krivulje isparavanja, topljenja i sublimacije dijele T-P ravan na tri regije (slika 2). Tačke oblasti 1 odgovaraju gasovitom, oblasti 2 - tečnom, oblasti 3 - čvrsto stanje supstance. T-P ravan sa naznačene tri krive ravnoteže naziva se dijagram stanja.
Dijagram stanja vam omogućava da prosudite šta će se dogoditi fazne transformacije u jednom ili drugom procesu. Pretpostavimo, na primjer, da se grijanje vrši na konstantan pritisak. Na dijagramu stanja takav proces je predstavljen horizontalnom ravnom linijom. Ako ova prava linija prolazi iznad trostruke tačke, tada u tački B (slika 2) siječe krivu topljenja, a u tački C siječe krivu isparavanja. Dakle, kada se zagreje solidan prvo se topi, a zatim tečnost ispari.
U slučaju četiri faze, ravnoteža zahtijeva ispunjenje šest jednačina tipa (2), od kojih su, međutim, samo tri nezavisne. Geometrijski, problem se svodi na pronalaženje zajedničke tačke preseka tri fazne ravnotežne krive. Ali tri krive se seku, uopšteno govoreći, u tri, a ne u jednoj tački. Raskrsnica u jednom trenutku je izuzetan slučaj, koji se praktično može zanemariti. Fizički, to znači da četiri i više faze hemijski homogene supstance ne mogu biti u ravnoteži jedna sa drugom pri bilo kom pritisku i temperaturi. Maksimalan broj faza u ravnoteži jedna s drugom ne može biti veći od tri.
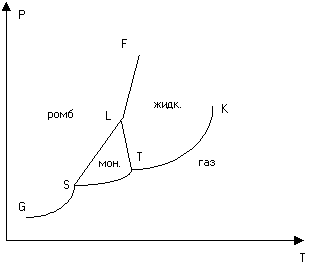
Rice. 3. Dijagram stanja sumpora
Ako broj faza u kojima se hemijski homogena supstanca može locirati na svim mogućim temperaturama i pritiscima prelazi tri, tada se T-P ravan deli na veći broj regiona (slika 3). Svaka tačka T-P ravni, ako ne leži na granici regiona, prikazuje jednofazno stanje materije. Regije se graniče jedna s drugom duž krivih, od kojih je svaka kriva ravnoteže odgovarajućih dviju faza. Bilo koja tačka koja leži na krivulji ravnoteže prikazuje dvofazno stanje materije i u tom stanju faze mogu biti predstavljene u bilo kojoj proporciji. Krive fazne ravnoteže mogu se ukrštati trostruko u odvojenim tačkama. To su trostruke tačke u kojima su tri susjedne faze u ravnoteži.
Kao primjer, na sl. 3 je pojednostavljeni dijagram stanja sumpora. Sumpor može postojati u dvije kristalne modifikacije - monoklinskoj i rombičnoj. U skladu s tim, na dijagramu stanja postoje tri trostruke tačke S, T i L. Područje monoklinske modifikacije ograničeno je trouglom STL. Područje rombičke modifikacije leži iznad GSLF krive.
TEST PITANJA
1. Definirajte fazu materije i faznu transformaciju.
2. Formulirajte uslove ravnoteže za nekoliko faza.
3. Kako se konstruiše dijagram faznih stanja supstance? Razmotrite fazni dijagram za proces isparavanja-kondenzacije i dijagram stanja tri faze materije.
4. Koliki je maksimalni broj faza koje mogu biti u ravnoteži jedna s drugom?
Od datih odgovora na ovo pitanje odaberite tačan odgovor.
1. Koliko je dostupno agregatna stanja supstance?
d) četiri.
2. Koja su stanja materije kondenzovana?
a) čvrsti i gasoviti,
b) tečni i gasoviti,
c) čvrsta i tečna
d) čvrsti, tečni i gasoviti.
3. Koja je mjerna jedinica termodinamičkog potencijala u SI?
a) džul
- (za element koji je vrsta Dewar posude) [A.S. Goldberg. Engleski ruski energetski rječnik. 2006] Energetske teme općenito EN trostruka tačka vodeTPW … Priručnik tehničkog prevodioca
trostruki poen- voda; p pritisak; t temperatura. TROJNA TAČKA, stanje ravnoteže koegzistencije tri faze materije, obično čvrste, tečne i gasovite. Temperatura trostruke tačke vode (tačka koegzistencije leda, vode i pare) 0,01 °C (273,16 K) na ... ... Ilustrovani enciklopedijski rječnik
Stanje ravnoteže koegzistencije. Trostruka tačka vode su tri faze materije, obično čvrsta, tečna i gasovita. Temperatura trostruke tačke vode (tačke koegzistencije leda, vode i pare, sl.) je 0,01 .C (273,16 K) pri pritisku od 6,1 hPa ... ... Veliki enciklopedijski rječnik
trostruki poen- tačka na dijagramu termodinamičkog stanja koja odgovara ravnoteži tri faze razmatranog termodinamičkog sistema. Na primjer, trostruka tačka vode odgovara ravnoteži sistema koji se sastoji od leda, vode i vodene pare. Temperatura… …
TRIPLE POINT- tačka na dijagramu termodinamičkog stanja koja odgovara ravnoteži tri faze razmatranog termodinamičkog sistema. Na primjer, trostruka tačka vode odgovara ravnoteži sistema koji se sastoji od leda, vode i vodene pare. Temperatura… … Metalurški rječnik
Stanje ravnoteže koegzistencije tri faze materije, obično čvrste, tečne i gasovite. Temperatura trostruke tačke vode (tačka koegzistencije leda, vode i pare, sl.) je 0,01 °C (273,16 K) pri pritisku od 6,1 hPa (4,58 mmHg). * * * … enciklopedijski rječnik
Tipične vrste faznih dijagrama. Zelena isprekidana linija pokazuje anomalno ponašanje vode Trostruka tačka je tačka na faznom dijagramu u kojoj se konvergiraju tri fazne linije ... Wikipedia
trostruki poen- tačka na dijagramu stanja koja odgovara koegzistenciji tri faze materije. Iz pravila faza proizilazi da hemijski pojedinačna supstanca (jednokomponentni sistem) u ravnoteži ne može imati više od tri faze. Ova tri...... Enciklopedijski rečnik metalurgije
U termodinamici, tačka na dijagramu stanja koja odgovara ravnotežnom koegzistenciji tri faze u va. Iz Gibbsovog pravila faza slijedi da hemijski pojedinac u (jednokomponentnom sistemu) u ravnoteži ne može imati više od tri faze. Physical Encyclopedia
TROJNA TAČKA, temperatura i pritisak na kojima mogu istovremeno postojati sva tri stanja materije (čvrsto, tečno, gasovito). Za vodu, trostruka tačka je na temperaturi od 273,16 K i pritisku od 610 Pa ... Naučno-tehnički enciklopedijski rečnik






