Termička entropija. Entropija. Drugi zakon termodinamike. Termičke i rashladne mašine. Carnotov ciklus i njegova efikasnost
Glavni procesi u termodinamici su:
· izohorni, teče konstantnom zapreminom;
· izobaričan, teče u konstantan pritisak;
· izotermni, koji se dešava u konstantna temperatura;
· adijabatski, pri čemu se vrši izmjena toplote sa okruženje nedostaje.
Izohorni proces
Ako se obrnuti mehanički proces, kao što je kretanje klatna ili sudar bilijarskih lopti, snimi i zatim ponovi, slika će izgledati prilično uvjerljivo. Istovremeno, ireverzibilni procesi koji prate porast entropije govore da se izgaranje sparklera, rđanje eksera, čini malo vjerojatnim s takvim pogledom. Dakle, entropija omogućava razlikovanje prošlosti od budućnosti.
Uređaj koji pokazuje količinu entropije ne postoji. Istovremeno se može izračunati entropija ili njena promjena. Ovdje imamo ovu reakciju gdje ako imamo jedan mol metana i on reagira s dva mola kisika, proizvešćemo jedan mol ugljičnog dioksida i dva mola vode. U ovom videu želimo odgovoriti na pitanje da li je ova reakcija spontana. A u posljednjem snimku smo naučili da se, da bismo odgovorili na ovo pitanje, moramo pozvati na Gibbsovu slobodnu energiju, ili preciznije, na promjenu Gibbsove slobodne energije.
U izohoričnom procesu, uslov V= konst.
Iz jednačine stanja idealnog gasa ( strV = RT) slijedi:
str/ T = R/V= const,
tj. pritisak gasa je direktno proporcionalan tome apsolutna temperatura:
p2 / p1 = T2/T 1 .
Promjena entropije u izohoričnom procesu određena je formulom:
A promjena slobodne energije jednaka je promjeni entalpije reakcije minus temperatura na kojoj se događa, a sve se množi promjenom entropije. A ako je manji od nule, dolazi do spontane reakcije. Ovo smo radili prije nekoliko klipova. Možete vidjeti samo temperaturu uzrokovanu svakim od ovih proizvoda. Voda će ga pomnožiti sa 2 ako ima 2 mjeseca. Dakle, imamo toplinu generiranu iz ovih proizvoda, uklanjamo istu iz drugih reaktanata. A to sugerira da imamo egzotermnu reakciju.
Da ova strana jednačine sadrži manje energije - možemo nekako razmisliti o tome - sa ove strane. Tako malo energije treba da se oslobodi. Dozvolite mi da napišem kao i energiju koju treba osloboditi. Zato je to egzotermna reakcija. Ali naše pitanje je: spontano? Da bismo saznali da li je to spontano, moramo pronaći naše delte. I da bismo nam pomogli da pronađemo delte, s vremenom smo pogledali standardnu molarnu entropiju za svaki od ovih molekula. Standard je da se ovde doda nulti znak - standardna molarna entropija - a "standard" znači 298 stepeni Kelvina.
s 2 -s 1 = Δ s = životopis ln( str2/str 1 ) = životopis ln( T2/T 1 )
izobarni proces
Izobarični proces je onaj koji se odvija pod konstantnim pritiskom. str= konst.
Iz jednadžbe stanja idealnog plina slijedi:
V/T = R/p= konst.
Promjena entropije će biti:
s 2 – s 1 = Δ s = k.č ln( T 2 / T 1 ).
Zapravo, ne treba da pričam o Kelvinovim stepenima. Ovo je 298 Kelvina, ne morate ovdje koristiti riječ "stepeni" kada govorimo o Kelvinu. Dakle, to je 298 kelvina, što je 25 stepeni Celzijusa, tako da je to sobna temperatura. Stoga se smatra standardnom temperaturom. Dakle, ako imamo 1 mol metana, imamo 186 džula Kelvinove entropije. Dakle, ukupna promjena entropije ove reakcije je razlika u ukupnoj standardna entropija proizvoda i ukupne standardne entropije reaktanata.
Izotermni proces
At izotermni proces temperatura radnog fluida ostaje konstantna T= const, dakle:
strV = RT= konst
Promjena entropije je:
s 2 -s 1 = Δ s = R ln( str1/p 2 ) = R ln( V2/V 1 ).
adijabatski proces
Adijabatski proces je promena stanja gasa koja se dešava bez razmene toplote sa okolinom ( Q = 0).
Isto smo uradili i sa entalpijom. A pošto smo ovo već vidjeli, ovaj broj je blizu ovom broju, ali je mnogo više. Čista voda je mnogo niža - ovo je entropija čiste vode. Ima mnogo nižu entropiju od gasa kiseonika. Pošto je tečnost formirana, postoji vrlo malo stanja. Sva tečnost pada na dno posude, kao da se oblikuje i širi. Drugim rečima, jedan gas će imati mnogo veću entropiju od tečnosti. Samo gledajući ovo, već možemo vidjeti da će naši proizvodi imati nižu entropiju od reaktanata.
Curve Equation adijabatski proces(adijabatika) u p-V dijagram izgleda ovako:
strV k= konst.
U ovom izrazu k se zove adijabatski eksponent(koji se naziva i Poissonov omjer).
Promjena entropije je:
Δ S = S 2 – S 1 = 0, one.S 2 = S 1 .
I vjerovatno će to biti negativan broj. Sada vam ove jedinice možda nemaju smisla, a vi zaista znate da su to konvencionalne jedinice. Ali možemo reći, hej, postaje sve teže. I ima smisla, jer ima tona gasa. Imamo 3 odvojena molekula, 1 ovdje i 2 molekule kisika. I opet idemo na 3 molekula, ali sada je voda bistra. I ima smisla, po mom mišljenju, u gubitku entropije. Postoji nekoliko uslova u kojima tečnost, pre svega, može biti.
Ali hajde da saznamo da li je ova reakcija spontana. Ne moramo biti tako precizni. Pretpostavljamo da smo na sobnoj temperaturi, odnosno 298 stepeni Kelvina. Što je 25 stepeni Celzijusa puta promena entropije. Ovo će biti minus. Sada možemo reći, pa, minus 242, možda bismo želeli da to stavimo tamo. Ali moramo biti veoma, veoma, veoma oprezni. A ako želimo sve da zapišemo u kilodžulima nakon što smo to već zapisali, zapišimo to u kilodžulima.
Fazni prelazi
U reverzibilnom faznom prijelazu, temperatura ostaje konstantna, a toplina fazni prelaz pri konstantnom pritisku je H fp, pa je promjena entropije:
 .
.
Prilikom topljenja i ključanja toplina se apsorbira, pa se entropija u ovim procesima povećava: S tv< S i< S d. U ovom slučaju, entropija okoline se smanjuje za vrijednost S f.p. , tako da je promjena entropije Univerzuma 0, kako se očekuje za reverzibilni proces u izolovanom sistemu.
Tako će naša Gibbsova besplatna energija ovdje biti minus 890 kilodžula minus 290, od čega minus ovdje i još jedan minus plus plus. I ima smisla - entropija će Gibsovu energiju učiniti pozitivnijom. Što, kao što znamo, kada želimo da ga spustimo ispod 0, boriće se spontano. Ali hajde da vidimo da li se stvarna entalpija, njena egzotermna priroda, može nadmašiti. Čini se mogućim jer ovim pomnožimo razlomak i dobijemo manje. Ovo je naša promjena entropije puta 298, temperatura minus.
I ovaj koncept postaje - stavlja minus - i postaje plus 72. To je entropija na standardnoj temperaturi. Već možemo vidjeti da je entalpija mnogo negativniji broj od pozitivnog temperaturnog termina pomnoženog s promjenom entropije. Dakle, ovaj put pobjednik. I iako gubimo entropiju u ovoj reakciji, ona oslobađa toliko energije da će biti spontana. Što je definitivno manje od 0, tako da će doći do spontane reakcije. Kao što vidimo, ovi problemi Gibbsove besplatne energije nisu tako teški.
Drugi zakon termodinamike i "toplotna smrt svemira"
Klauzijus je, razmatrajući drugi zakon termodinamike, došao do zaključka da entropija Univerzuma kao zatvorenog sistema teži maksimumu i da će se na kraju svi makroskopski procesi u Univerzumu završiti. Ovo stanje Univerzuma naziva se "termalna smrt" - globalni haos, u kojem više nije moguć nikakav proces. S druge strane, Boltzmann je izrazio mišljenje da je trenutno stanje Univerzuma gigantska fluktuacija, što implicira da je Univerzum većinu vremena još uvijek u stanju termodinamičke ravnoteže (“termalna smrt”).
Samo trebate pronaći te dimenzije. Gledamo samo temperature formiranja svih proizvoda, vadimo reagense i naravno čekamo šanse. A onda, da pronađemo promjenu entropije, radimo isto. Moramo pogledati standardnu masenu molarnu entropiju proizvoda po koeficijentima, ukloniti reaktante, a zatim je samo zamijeniti ovdje, nakon čega smo u suštini dobili slobodna energija Gibbs. I u ovom slučaju je bio negativan. Sada možemo zamisliti situaciju u kojoj smo na mnogo više visoke temperature.
Prema Landauu, ključ za rješavanje ove kontradikcije leži u polju opšte relativnosti: budući da je Univerzum sistem u promjenljivom gravitacionom polju, zakon povećanja entropije nije primjenjiv na njega.
Pošto je drugi zakon termodinamike (u Klauzijevoj formulaciji) zasnovan na pretpostavci da je univerzum zatvoren sistem, moguće su i druge vrste kritike ovog zakona. U skladu sa savremenim fizičkim konceptima, možemo govoriti samo o vidljivom delu Univerzuma. U ovoj fazi, čovječanstvo nema priliku da dokaže da je svemir zatvoreni sistem, niti obrnuto.
Onda odjednom stvari postanu zanimljive. Dakle, ovaj pozitivni izraz će premašiti ovaj i možda neće biti spontana reakcija na vrlo, vrlo, vrlo, vrlo visoku temperaturu. I razmislite o tome drugačije. Reakcija koja proizvodi temperaturu koja se odvaja - toplinu koja se oslobađa - nije tako velika kada se već nalazi velika količina topline u sredini ili kinetička energija. Da je temperatura dovoljno visoka, ova reakcija ne bi bila spontana, jer bi vjerovatnoća entropije bila premašena.
Sve možete pogledati na internetu i naučiti nešto spontano. Uz istovremenu promjenu dvije ili tri od ovih vrijednosti, gasni proces. Idealni plin je model fizičkog plina u kojem su napravljene sljedeće aproksimacije. Pravi plinovi se ne razlikuju po svojstvima od idealnog plina na sobnoj temperaturi i normalnoj atmosferski pritisak. Razlike su važne pri vrlo niskim temperaturama i pritiscima stotinama puta većim od atmosferskih.
Merenje entropije
U stvarnim eksperimentima veoma je teško izmeriti entropiju sistema. Tehnike mjerenja temelje se na termodinamičkom određivanju entropije i zahtijevaju izuzetno preciznu kalorimetriju.
Radi jednostavnosti, istražit ćemo mehanički sistem, čija će termodinamička stanja biti određena kroz njen volumen V i pritisak P. Da bismo izmjerili entropiju određenog stanja, prvo moramo izmjeriti toplinski kapacitet pri konstantan volumen i pritisak (označeno ŽIVOTOPIS i C P odnosno) za uspješan skup stanja između početnog i željenog stanja.
Pod ovim uslovima mogu se izvesti tri izomera, izotermni i izobarični. Zakoni izolacije se primjenjuju na stvarne plinove koji ispunjavaju zahtjeve modela idealnog plina. Zakon su prvi uveli Britanac Robert Boyle i Francuz Edme Marriot. U izotermnom procesu, proizvod pritiska i zapremine date količine gasa je konstantna vrijednost. Grafikon procesa na p-dijagramu je kriva koja se zove izoterma.
Zakon je donio Francuz Jacques Charles. Tokom procesa izolacije, odnos pritiska i temperature ostaje konstantan. Grafikon procesa na p-dijagramu je prava linija koja se zove izohora. Animacija prikazuje ciklus koji uključuje dva procesa konstantnog pritiska i dva procesa kontinuiranog volumena. Horizontalne stranice pravougaonika su ravne linije - slike, a vertikalne stranice - ravne linije - izohori. Ponašanje plinova u izokratskom procesu lako objašnjava zabranu ostavljanja boca i plinskih boca na direktnoj sunčevoj svjetlosti.
Toplotni kapaciteti su povezani sa entropijom S i sa temperaturom T prema formuli:

gdje je indeks X odnosi se na konstantnu zapreminu i pritisak. Možemo integrirati da dobijemo promjenu entropije:
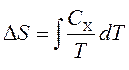
Zakon je izdao Francuz Joseph Gauss-Lusak. U modificiranom procesu, omjer volumena i temperature ostaje konstantan. Grafikon procesa na p-dijagramu je prava linija, koja se naziva slika. Boyle-Marriott, Charles i Gay-Lusak zakoni su samo idealni plin. Model idealnog gasa ne uzima u obzir zapreminu i interakciju molekula.
Na vrlo niskim temperaturama, stvarni plinovi se ukapljuju i na njih više ne vrijede zakoni idealnog plina. Kao mjeru nepovratne disipacije energije, Clausius je uveo pojam entropije. Entropija je funkcija stanja sistema, odnosno u svakom stanju može se porediti potpuno definisana vrednost entropije.
Dakle, možemo dobiti vrijednost entropije bilo kojeg stanja ( P,V) u odnosu na početno stanje ( P 0 ,V 0). Tačna formula ovisi o našem izboru međustanja. Na primjer, ako početno stanje ima isti pritisak kao i konačno stanje, onda
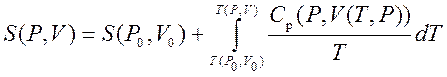 .
.
Na primjer, za reverzibilne procese, njegova promjena se izražava na sljedeći način. promjena entropije u različiti procesi u sistemima. Entropija je mjera vjerovatnoće ili poremećaja u fizički sistem. On izražava broj mogućih konfiguracija ili rasporeda sastavnih elemenata sistema u kojem se nalazi opšti oblik, oblik i fizičke karakteristike, ne mijenja se.
Fizički smisao povećanja entropije je da sistem sa izolovanom česticom mora preći u stanje najmanjeg reda kretanja čestice. Ovo je najjednostavnije stanje sistema ili termodinamička ravnoteža, u kojem je kretanje čestica haotično. Nepovratni pravac procesa konverzije energije u izolovanim sistemima pre ili kasnije dovodi do transformacije svih vrsta energije u toplotu. Biće rasuto i ravnomerno raspoređeno na sve elemente sistema. Maksimalna entropija znači potpunu termodinamičku ravnotežu, bez zaustavljanja pomaka atoma i molekula, prekid razmjene energije između oba dijela sistema i okoline – postoji statistički ili termodinamički haos.
Osim toga, ako je put između prvog i posljednjeg stanja kroz bilo koji fazni prijelaz prvog reda, latentna toplota vezano za tranziciju također se mora uzeti u obzir.
Entropija početnog stanja mora se odrediti nezavisno. U idealnom slučaju, početno stanje se bira kao stanje na izuzetno visokoj temperaturi, na kojoj sistem postoji u obliku gasa. Entropija u ovom stanju je slična onoj kod klasičnog idealnog gasa, plus doprinosi molekulskih rotacija i vibracija, koji se mogu odrediti spektroskopski.
Ako je svemir zatvoren, čeka ga vruća smrt. Stari Grci tvrde da je nastao iz haosa, a pod pretpostavkom klasične termodinamike, tamo će se i vratiti. Ako je svemir evoluirao samo do haosa, kako je mogao nastati i dostići svoje trenutno strukturirano stanje?
Klasična termodinamika, nastala u eri kada niko nije postavljao pitanje o stacionarnoj prirodi svemira. U to vrijeme, jedina senka na zakone termodinamike bila je izbačena iz Darwinove teorije evolucije. Prema njenim riječima, proces razvoja flore i faune karakteriše stalno usložnjavanje, uz rast organizacije i reda. Živa priroda se opire termodinamičkoj ravnoteži i haosu. Očigledno je da su zakoni razvoja nežive i žive prirode u suprotnosti jedni s drugima.
Teorija laboratorijski rad
Teorijske informacije
U ovom radu potrebno je izmjeriti temperaturu faznog prijelaza – tačku topljenja kalaja, što će nam omogućiti da odredimo prirast entropije.
Budući da je za reverzibilne procese povećanje entropije d S=d Q/T, i promjena entropije tokom tranzicije sistema iz stanja a u stanje b
 ,
,
tada se promjena entropije pri zagrijavanju i taljenju kalaja definira kao zbir promjene entropije za vrijeme zagrijavanja do tačke topljenja i tokom topljenja kalaja:
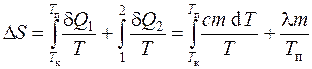 ili
ili
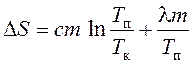 , (10)
, (10)
gdje d Q je beskonačno mala količina toplote koja se prenosi na sistem na temperaturi T;
d Q 1 i d Q 2 - beskonačno male količine toplote koje prima kalaj tokom zagrevanja i tokom topljenja;
T k je početna (sobna) temperatura;
T n je temperatura topljenja;
l \u003d 59 10 -3 J / kg - specifična toplota topljenje;
c = 0,23 10 -3 J/(kg K) – specifična toplota,
m = 0,20 kg je masa kalaja.
Neke formulacije drugog zakona termodinamike
1. Svaki sistem, prepušten sam sebi, u prosjeku se mijenja u pravcu stanja sa maksimalnom vjerovatnoćom (G. Lewis).
2. Stanje sa maksimalnom entropijom je najstabilnije stanje za izolovani sistem(E. Fermi).
3. U toku bilo kog stvarnog procesa, nemoguće je obezbediti sredstva za vraćanje svakog od sistema koji u njemu učestvuju u prvobitno stanje (H. Lewis).
4. Svaki pojedinac ili hemijski proces u prirodi teče tako da raste zbir entropije svih tijela koja učestvuju u ovom procesu (M. Planck).
5. Spontani prijenos toplote sa hladnijeg na toplije tijelo je nemoguć.
6. Primanje informacija je smanjenje entropije (G. Lewis).
7. Entropija je strela vremena* (A. Eddington).
Entropijske promjene u kemijskim reakcijama
Entropija jednog mola supstance u njenom standardno stanje na odgovarajućoj temperaturi naziva se standardna molarna entropija. Standardna molarna entropija je označena simbolom S" i ima dimenziju JK-1 mol-1. Tabela 5.12 prikazuje standardne molarne entropije određenog broja elemenata i jedinjenja na temperaturi od 25°C. Imajte na umu da standardna molarna entropija gasova, po pravilu, ima mnogo veće vrednosti u odnosu na entropiju čvrste materije. Entropija bilo koje fiksne količine materije raste u sljedećem nizu:
Čvrsta materija = Tečnost = Gas
Standardne molarne entropije se ponekad nazivaju apsolutnim entropijama. To nisu promjene entropije koje prate nastanak spoja iz njegovih slobodnih elemenata. Također treba napomenuti da su standardne molarne entropije slobodnih elemenata (u obliku jednostavne supstance) nisu jednaki nuli.
Treći zakon termodinamike kaže da je entropija idealnog ionskog kristala na temperaturi apsolutne nule (O K) nula.
Tabela 5.12. Standardne molarne entropije S°(298 K) (J/(K mol))
Promjena standardne molarne entropije u hemijska reakcija je određena jednačinom
Treba napomenuti da je promjena entropije u razmatranom primjeru negativna. Ovo bi se moglo očekivati ako se uzme u obzir da je, prema jednadžbi reakcije koja se razmatra, ukupna količina gasovitih reaktanata 1,5 mol, a ukupna količina gasovitih produkata samo 1 mol. Dakle, kao rezultat reakcije dolazi do smanjenja ukupne količine plinova. Istovremeno, znamo da su reakcije sagorevanja egzotermne reakcije. Posljedično, rezultat njihovog protoka je disipacija energije, što nas tjera da očekujemo povećanje entropije, a ne njeno smanjenje. Nadalje, treba uzeti u obzir da se sagorijevanje plinovitog vodonika na 25°C, uzrokovano početnim inicijacijom, zatim odvija spontano i velikim intenzitetom. Ali zar promjena entropije u ovoj reakciji u ovom slučaju ne bi trebala biti pozitivna, kako to zahtijeva drugi zakon termodinamike? Ispostavilo se - ne, ili barem ne nužno. Drugi zakon termodinamike zahtijeva da se kao rezultat spontanog procesa poveća ukupna entropija sistema i njegovog okruženja. Gore izračunata promena entropije karakteriše samo razmatrani hemijski sistem koji se sastoji od reaktanata i produkata koji učestvuju u sagorevanju gasovitog vodonika na 25°C. Ali kako izračunati promjenu entropije za okruženje ovog sistema?






