Kako se entropija mijenja? Termodinamička entropija. kružni proces. Carnot ciklus
U većini hemijskih procesa istovremeno se dešavaju dve pojave: prenos energije i promena uređenog rasporeda čestica jedna u odnosu na drugu. Sve čestice (molekuli, atomi, joni) imaju tendenciju da se kreću nasumično, tako da sistem teži da se kreće iz uređenijeg stanja u manje uređeno. Kvantitativna mjera nereda (haotičnosti, nereda) sistema je entropija S . Na primjer, ako je plinska boca spojena na praznu posudu, tada će plin iz cilindra biti raspoređen po cijelom volumenu posude. Sistem će preći iz uređenijeg stanja u manje uređeno, što znači da će se entropija povećati (ΔS > 0).
Malo je vjerovatno da se koncept fizike tako često koristi izvan fizike - i stoga često odstupa od svog stvarnog značenja - kao entropija. Koncept ima veoma usko značenje. Konkretna definicija ovoga fizička količina je napravio austrijski fizičar Ludwig Boltzmann u drugoj polovini godine. Fokusirao se na mikroskopsko ponašanje fluida, odnosno gasa ili tečnosti. Nesređeno kretanje atoma ili molekula shvaćeno je kao toplota, što je bilo odlučujuće za njegovu definiciju.
AT zatvoreni sistem sa fiksnim volumenom i fiksnim brojem čestica, istakao je Boltzmann, entropija je proporcionalna logaritmu broja mikrostepena u sistemu. U mikrostanjima je shvatio sve mogućnosti slaganja molekula ili atoma tečnosti zatvorenih u tečnost. Njegova formula definira entropiju kao mjeru "slobode rasporeda" molekula i atoma: ako se broj prihvatljivih mikrostanja povećava, entropija se povećava. Manje je mogućnosti za formiranje čestica fluida, manje je entropije.
Entropija se uvek povećava (ΔS > 0) pri prelasku sistema iz uređenijeg u manje uređeno stanje: pri prelasku supstance iz kristalnog stanja u tečno i iz tečnog u gasovito stanje, sa povećanjem na temperaturi, sa otapanjem i disocijacijom kristalna supstanca itd.
Tokom prelaska sistema iz manje uređenog stanja u uređenije stanje, entropija sistema opada (ΔS< 0), например при конденсации, кристаллизации, понижении температуры и т.д.
Boltzmannova formula se često tumači kao da je entropija ekvivalentna "poremećaju". Međutim, ova pojednostavljena slika lako dovodi u zabludu. Pjena za kupanje je primjer ovoga: kada mjehurići popucaju i površina vode postane glatka, čini se da se uznemirenost smanjuje. Ali entropija ne! Zapravo, čak se povećava jer nakon pucanja pjene mogući prostor za molekule tekućine više nije ograničen vanjskim membranama vezikula, pa se povećao broj unesenih mikrostanja.
Šta je entropija
Boltzmanova definicija nam omogućava da razumijemo jednu stranu pojma, ali entropija ima i drugi makroskopski aspekt, koji je njemački fizičar Rudolf Clausius već otkrio prije nekoliko godina. Izumljena je parna mašina, klasična toplotna mašina. Toplotni motori pretvaraju temperaturnu razliku u mehanički rad. Fizičari su tada pokušali da shvate principe koji upravljaju ovim mašinama. Istraživači su otkrili da se samo nekoliko posto toplinske energije može pretvoriti u mehaničku energiju.
U termodinamici, promjena entropije povezana je s toplinom izrazom:
dS = δQ/T ili ΔS=ΔH / T
Entropije supstanci, kao i njihove entalpije formiranja, nazivaju se standardnim uslovima. standardna entropija 1 mol je označen S 0 298 , ovo je referentna vrijednost, mjerena u J / (K mol) (Dodatak 2).
Na primjer, standardna entropija
Ostalo je nekako izgubljeno - bez razumijevanja razloga. Teorija termodinamike, očigledno, nije imala fizički koncept koji bi uzimao u obzir različite valencije energije i ograničavao mogućnost pretvaranja toplotne energije u mehaničku. Rješenje je dobilo oblik entropije. Clausius je uveo pojam kao termodinamičku varijablu i definirao ga kao makroskopsku mjeru svojstva koje ograničava upotrebljivost energije.
Prema Klauzijusu, promena entropije sistema zavisi od dovedene toplote i temperature. Zajedno sa toplotom, uvek se prenosi entropija, pa tako i njeno izvođenje. Osim toga, Clausius je došao do zaključka da entropija u zatvorenim sistemima, za razliku od energije, nije faktor očuvanja. Ovo je bio drugi veliki trenutak termodinamike u fizici.
led……………..S 0 298 = 39,7 J/(K mol);
voda…………….S 0 298 = 70,08 J/(K mol);
vodena para ... ..S 0 298 \u003d 188,72 J / (K mol),
one. entropija raste - stepen neuređenosti supstance u gasovitom stanju više.
Za grafit S 0 298 = 5,74 J / (K mol), za dijamant S 0 298 = 2,36 J / (K mol), jer tvari s amorfnom strukturom imaju veću entropiju nego s kristalnom.
"U zatvorenom sistemu, entropija se nikada ne smanjuje." Stoga se entropija uvijek povećava ili ostaje konstantna. Ovo uvodi vremensku liniju u fiziku zatvorene petlje, budući da termodinamički procesi u zatvorenim sistemima su ireverzibilni sa povećanjem entropije.
Teorija laboratorijskog rada
Proces bi bio reverzibilan ako bi entropija ostala konstantna. Ali to je samo teoretski moguće. Svi stvarni procesi su nepovratni. Prema Boltzmannu, također se može reći da se broj mogućih mikrostanja povećava u svakom trenutku. Ovo mikroskopsko tumačenje proširuje termodinamičko-makroskopsko tumačenje Klauzija. Entropija je konačno rešila misteriju nestajanja energije u toplotnim mašinama. Deo toplotne energije se konačno uklanja iz mehaničke upotrebljivosti i ponovo oslobađa, jer entropija u zatvorenim sistemima ne bi trebalo da se smanji.
Entropija S 0 298, J / (K mol) raste sa komplikacijama molekula, na primjer:
U toku hemijskih reakcija menja se i entropija, pa sa povećanjem broja molekula gasovitih materija entropija sistema raste, a sa smanjenjem opada.
Promjena entropije sistema kao rezultat procesa određena je jednadžbom:
Opće informacije o termodinamici
Od rezultata Clausiusa i Boltzmanna, entropija se takođe preselila u druge oblasti fizike. Čak i izvan fizike, oni su napadnuti, barem kao matematički koncept. Ovom veličinom okarakterizirao je gubitak informacija u telefonskim prijenosima.
Idealan ciklus Carnot toplotnog motora
Entropija također igra ulogu u hemiji i biologiji: u nekima otvoreni sistemi nove strukture se mogu formirati sve dok se entropija oslobađa. To bi trebali biti takozvani disipativni sistemi u kojima se energija pretvara u toplinsku energiju. Ova teorija formiranja strukture potiče od belgijskog fizičara-hemičara Ilje Prigožina. Do danas je objavljen rad u kojem su dodani novi aspekti fizičkoj sferi koncepta.
∆S 0 = ∑ ∆S 0 nast. - ∑ ΔS 0 ref.
Na primjer: u reakciji
C (grafit) + CO 2 (g) \u003d 2CO (g); ΔS 0 298 = 87,8 J/K
Na lijevoj strani jednačine nalazi se 1 mol gasovite supstance CO 2 (g), a na desnoj - 2 mola gasovite supstance 2CO (g), što znači da se zapremina sistema povećava, a entropija ( ΔS > 0).
Sa povećanjem entropije (ΔS > 0), javljaju se i reakcije:
![]()
Zašto je efikasnost toplotnih motora ograničena? Rudolf Clausius je riješio ovu zagonetku uvođenjem koncepta entropije. Fizičar je razmatrao kružni proces idealiziranog toplotnog motora u kojem se ekspanzija i kontrakcija izmjenjuju u izotermnim i izentropskim uvjetima. Korelirajući očuvanje energije u drugom osnovnom skupu termodinamike, sljedeća nejednakost za efikasnost dovodi do ovog takozvanog Carnotovog procesa.
Dakle, maksimalna dostižna efikasnost toplotnog motora ograničena je termodinamičkim zakonima. Na primjer, ako mašina radi na temperaturi između 100 i 200 stepeni Celzijusa, maksimalna dostižna efikasnost je oko 21 posto. Dva dodatna korisna uvida mogu se matematički izvući iz očuvanja energije i drugog osnovnog skupa termodinamike: kada se radi, toplota može putovati samo od hladnog do toplog tela - frižiderima i toplotnim pumpama je potrebno napajanje.
2 H 2 O (g) \u003d 2 H 2 (g) + O 2 (g)
2 H 2 O 2 (g) \u003d 2 H 2 O (g) + O 2 (g)
CaCO 3 (c) \u003d CaO (c) + CO 2 (g), ΔS 0 298 = 160,48 J / K
U reakciji stvaranja amonijaka
N 2 (g) + 3 H 2 (g) \u003d 2 NH 3 (g); ΔS 0 298 \u003d - 103,1 J / K
Volumen sistema se smanjuje, a samim tim i entropija (ΔS< 0).
Sa opadajućom entropijom (ΔS< 0) протекают реакции:
3 H 2 (g) + N 2 (g) \u003d 2 NH 3 (g)
2 H 2 (g) + O 2 (g) \u003d 2 H 2 O (g)
Drugo, sa zagrijanim rezervoarom se ne može raditi nikakav posao konstantna temperatura. U tu svrhu uvijek je neophodan protok topline između rezervoara. različite temperature. Termin entropija je nova formacija Rudolfa Klauzija od grčkih riječi i grubo se prevodi u "sadržaj konverzije".
Formula kaže da se entropija uvijek prenosi zajedno s toplinom. Definicija Boltzmannove entropije zasniva se na razumijevanju topline kao nesređenog kretanja atoma ili molekula. Mikrostanja su mogućnosti kako se molekuli ili atomi blokirane tekućine mogu rasporediti. Entropija je velika jedna od njih. Svakom ravnotežnom stanju termodinamičkog sistema može se jednoznačno dodijeliti vrijednost entropije. AT statistička fizika entropija je mjera količine faznog prostora koji sistem može doseći.
U reakcijama između čvrste materije a u procesima u kojima se količina plinovitih tvari ne mijenja, entropija se praktički ne mijenja i njena promjena je određena strukturom molekula ili strukturom kristalne rešetke, na primjer:
C (grafit) + O 2 (g) \u003d CO 2 (g), ΔS 0 298 \u003d 2,9 J / K
Al (c) + Sb (c) \u003d AlSb (c), ΔS 0 298 \u003d - 5,01 J / K
Primjer #1. Izračunajte i objasnite promjenu entropije za proces
U okviru klasične termodinamike, entropija je mjera za. Ova promena entropije je pozitivna kada se toplota uvodi, negativna kada se toplota ukloni. Clausius je također opisao množenje entropije bez prijenosa topline ireverzibilnim procesima u izolovanom slučaju s nejednakošću.
Istorija pojma "entropija"
![]()
Jednačina je oblik drugog glavnog skupa termodinamike. Sa procesom prikazanim na slici u adijabatskom sistemu, gdje se mogu specificirati samo početno i konačno stanje, to nije slučaj. Međutim, za idealan gas, razlika entropije se može izračunati na jednostavan način kroz proces reverzibilnog izotermnog pomaka kao što je opisano u odjeljku Primjeri. Pored energije, entropija je najvažniji pojam, te je korisno ići na polazište ove nauke radi boljeg razumijevanja i ponavljanja razvoja.
2SO 2 (g) + O 2 (g) \u003d 2SO 2 (g)
Rješenje.
ΔS 0 = 2 S 0 SO 3 (g) - (2 S 0 SO2 (g) + S 0 O 2 (g)) = 2 256,23 - (2 248,1 + 205,04) \u003d - 188 ,78 J/ .
Pošto ΔS< 0, энтропия уменьшается вследствии уменьшения объема системы, т.е. уменьшения числа молей газообразных веществ (в левой части 3 моль газообразных веществ, в правой – 2 моль).
Primjer #2. Izračunajte i objasnite promjenu entropije za proces:
Mašina je uspjela izvršiti svoj zadatak, ali je trebalo puno goriva. U to vrijeme, veza između energije i topline bila je potpuno nejasna, a Julius Mayer je to ipak morao objaviti više od 130 godina kasnije. Inspiriran očevim radom u mlinovima, Carnot je opisao parnu mašinu u cikličnom procesu u kojem toplota teče od toplog izvora do hladnog izlaza i na taj način obavlja posao.
U svom originalnom djelu, Carnot je izrazio stav da je toplina neka vrsta nemjerljive tvari koja uvijek teče od toplijeg ka hladnijem tijelu, budući da se voda uvijek kreće naniže. I baš kao voda koja pada, toplota i dalje može da radi, što je veći gradijent, posebno mašina ne može da radi više nego što je toplota isporučena. Karno se kasnije ispravio i već je prepoznao ekvivalenciju toplote i energije deset godina prije Mayera, Joulea i Thomsona. On je u međuvremenu bio ispred svog vremena, ali je, nažalost, umro mlad, a njegov rad je na prvi pogled prošao nezapaženo.
Rješenje. Hajde da pišemo iz aplikacije. 2 vrijednosti standardne entropije supstance
Prema posledicama Hesovog zakona,
ΔS 0 \u003d (2 S 0 CuO (c) + S 0 SO 2 (g)) - (S 0 Cu2S (c) + 2 S 0 O 2 (g)) = (2 42,64 + 248,1) – (119,24 + 205,04) = 9,1 J/K.
Entropija se neznatno povećava, to je zbog komplikacije strukture molekula SO 2 (g) u odnosu na molekul O 2 (g).
Primjer #3. Odredite promjenu entropije za proces:
Jedino je Klauzijus formulisao vezu između temperaturne razlike - izvora i ponora - sa efikasnošću izmenjivača toplote i da tu efikasnost ne može premašiti drugi toplotni motor, jer bi inače toplota spontano prešla iz hladnog u toplo telo. Nemogućnost takvog procesa u prirodi sada se naziva Clausius, što je ona formulirala kružnim procesom.
Ne postoji biciklistička mašina čiji je jedini efekat prenos toplote sa hladnjaka na topliji rezervoar. Jednostavno rečeno, glavna tvrdnja kaže da se temperaturne razlike ne mogu spontano povećati u prirodi. Clausius bi mogao tražiti ponudu s ovim.
C (grafit) + O 2 (g) \u003d CO 2 (g)
Rješenje: Hajde da pišemo iz aplikacije. 2 standardne vrijednosti entropije
ΔS 0 = S 0 CO2 (g) - (S 0 C (g) + S 0 O2 (g)) = 213,68 - (5,74 + 205,04) \u003d 2,9 J / K.
Pošto je ΔS > 0, entropija se blago povećava tokom reakcije. Zapremina sistema se ne menja, ali entropija raste zbog složenosti strukture molekula CO 2 u odnosu na molekul O 2.
Termodinamika kao funkcija stanja
Za bilo koji kružni proces. Znak ekvivalencije se odnosi samo na reverzibilne procese. Sa ovom Clausiusovom teoremom veličina je očigledna. Klauzijus je ovu količinu nazvao entropijom, a vremenom je postalo uobičajeno da se glavna rečenica formuliše direktno entropijom, što nikako ne vodi ka dubljem razumevanju. Tek decenijama kasnije, sa svojom statističkom mehanikom, moglo se pronaći objašnjenje entropije kao mere dostižnih mikrostanja sistema. Toplota se nasumično raspoređuje kroz atome i molekule, raspoređujući energiju i prelazeći od toplog do hladnog, jer je put nazad jednostavno previše malo verovatan.
Gibbsova energija
Spontano, tj. bez trošenja energije izvana, sistem može samo prijeći iz manje stabilnog stanja u stabilnije.
AT hemijski procesi dva faktora u isto vreme:
Tendencija sistema da pređe u stanje sa najnižom unutrašnjom energijom, što smanjuje entalpiju sistema ( ∆H → min);
Tendencija sistema da pređe u neuređenije stanje, što povećava entropiju ( ∆S → max).
Promena energije sistema se naziva faktor entalpije , kvantitativno se izražava u terminima toplotnog efekta reakcije ΔH. Odražava tendenciju stvaranja veza i povećanja čestica.
Povećanje entropije u sistemu se naziva faktor entropije , izražava se kvantitativno u jedinicama energije (J) i izračunava se kao T ΔS. Odražava tendenciju ka nasumičnijem rasporedu čestica, ka dezintegraciji supstanci na jednostavnije čestice.
Ukupan učinak ove dvije suprotne tendencije u procesima koji se odvijaju pri konstantnim T i P , se odražava promjenom izobarično-izotermnog potencijala ili slobodna energija Gibbs ΔG a izražava se jednadžbom:
∆G = ∆H – T ∆S
Pri konstantnom pritisku i temperaturi (izobarično-izotermni proces), reakcije se odvijaju spontano u smjeru smanjenja Gibbsove energije.
Po prirodi promjene Gibbsove energije može se suditi o fundamentalnoj mogućnosti ili nemogućnosti implementacije procesa.
Ako a ΔG< 0 , reakcija se može odvijati spontano smjer naprijed. Što je veći pad faktora entalpije i povećanje faktora entropije, to je jača tendencija sistema da nastavi reakciju. Gibbsova energija u početnom stanju sistema je veća nego u konačnom stanju.
Ako je Gibbsova energija ∆G > 0, reakcija se ne može odvijati spontano u smjeru naprijed.
Ako a ∆G=0, sistem je u stanju hemijske ravnoteže, faktori entalpije i entropije su jednaki (ΔH=T ΔS). Temperatura na kojoj ∆G = 0, zove se temperatura početka reakcije : T = ∆H/∆S. Na ovoj temperaturi, i prednja i obrnuta reakcija su podjednako vjerovatne. Mogućnost (ili nemogućnost) spontane reakcije kod razni omjeri vrijednosti ΔH i ΔS prikazane su u tabeli.
Primjer #1.
Cu 2 S (c) + 2 O 2 (g) \u003d 2 CuO (c) + SO 2 (g)
Navedite mogućnost njegovog pojavljivanja u standardni uslovi in zatvoreni sistem.
Rješenje: Gibbsova slobodna promjena energije hemijska reakcija u standardnim uvjetima (T = 298 K, P = 101325 Pa) izračunava se jednadžbom ΔG 0 = ΔH 0 - T ΔS 0.
Toplotni efekat hemijske reakcije ΔH 0 = - 545,5 kJ (vidi proračun iznad). Promjena entropije u kemijskoj reakciji ΔS 0 = -9,1 J/K (vidi proračun iznad).
Prilikom izračunavanja ΔG 0, mora se uzeti u obzir da je ΔH 0 izražen u kJ, a ΔS 0 u J/K, za to se ΔS 0 mora pomnožiti sa 10 -3.
Gibbsova promjena slobodne energije u kemijskoj reakciji
ΔG 0 = ΔH 0 - T ΔS 0 = - 545,5 - \u003d -548,21 kJ.
Pošto je ΔG 0< 0, следовательно, в стандартных условиях самопроизвольное протекание данной химической реакции в прямом направлении возможно.
Primjer #2. Na osnovu vrijednosti ∆H 0 i ∆S 0, izračunajte ∆G 0 reakcije
MgCO 3 (c) \u003d MgO (c) + CO 2 (g)
Ukazati na mogućnost njegovog protoka u standardnim uslovima u zatvorenom sistemu. Na kojoj temperaturi će kalcijum karbonat početi da se razgrađuje?
Rješenje: Iz Dodataka 1 i 2 ispisujemo vrijednosti standardnih etalpija ∆H0f, kJ/mol i entropija S 0 , J/(K mol):
Izračunajte promjenu entalpije i entropije
∆H0= (∆H0f, MgO(c) + ∆H0f, CO 2 (g)) - ∆H0f, MgSO 3 (k) \u003d [-601,24 + (-393,5)] - (-1096,21) = 101,46 kJ;
ΔS 0 = - S 0 MgSO 3 (k) = - 112,13 = 128,41 J / K.
ΔG 0 = ΔH 0 - T ΔS 0 = 101,46 - 298 128,41 10 -3 = 63,19 kJ.
Kako je ΔG 0 > 0, tok ove reakcije u standardnim uslovima je nemoguć. Pošto je ΔH > 0 i ΔS > 0, može se zaključiti da reakcija može teći spontano na dovoljno visokoj temperaturi.
Izračunajte temperaturu na kojoj počinje raspadanje magnezijevog karbonata:
T \u003d ΔH 0 / ΔS 0 = 101,46 / (128,41 10 -3) = 790,12 K (517,12 0 C).
Na temperaturi od 790,12 K, i prednja i obrnuta reakcija su podjednako vjerovatne. Na temperaturama iznad 790,12 K će se odvijati direktna reakcija, odnosno doći će do raspadanja magnezijum karbonata.
§6 Entropija
Obično svaki proces u kojem sistem prelazi iz jednog stanja u drugo teče na takav način da je nemoguće izvršiti ovaj proces u suprotnom smjeru tako da sistem prolazi kroz ista međustanja bez ikakvih promjena u okolnim tijelima. To je zbog činjenice da se dio energije raspršuje u procesu, na primjer, zbog trenja, zračenja i tako dalje. Gotovo svi procesi u prirodi su nepovratni. U svakom procesu se gubi nešto energije. Za karakterizaciju disipacije energije uvodi se koncept entropije. ( Vrijednost entropije karakterizira termičko stanje sistema i određuje verovatnoću implementacije ovog stanja tela. Što je verovatnije dato stanje, to je veća entropija.) Svi prirodni procesi su praćeni povećanjem entropije. Entropija ostaje konstantna samo u slučaju idealizovanog reverzibilnog procesa koji se odvija u zatvorenom sistemu, odnosno u sistemu u kojem nema razmene energije sa tijelima izvan ovog sistema.
Entropija i njeno termodinamičko značenje:
Entropija- to je takva funkcija stanja sistema čija je beskonačno mala promjena u reverzibilnom procesu jednaka odnosu beskonačno male količine topline unesene u ovaj proces i temperature na kojoj je uvedena.
U konačnom reverzibilnom procesu, promjena entropije se može izračunati pomoću formule:
![]()
gdje se integral preuzima iz početnog stanja 1 sistema u konačno stanje 2.
Pošto je entropija funkcija stanja, onda je svojstvo integralaje njegova nezavisnost od oblika konture (putanja) duž koje se računa, dakle, integral je određen samo početnim i konačnim stanjem sistema.
- U bilo kojem reverzibilnom procesu promjene entropije je 0
(1)
- Termodinamika to dokazujeSsistem koji stvara nepovratni ciklus se povećava
Δ S> 0 (2)
Izrazi (1) i (2) važe samo za zatvorene sisteme, ako sistem sa njima razmenjuje toplotu spoljašnje okruženje, onda jeSmože se ponašati na bilo koji način.
Relacije (1) i (2) se mogu predstaviti kao Clausiusova nejednakost
∆S ≥ 0
one. entropija zatvorenog sistema može se ili povećati (u slučaju ireverzibilnih procesa) ili ostati konstantna (u slučaju reverzibilnih procesa).
Ako sistem napravi ravnotežni prijelaz iz stanja 1 u stanje 2, onda se entropija mijenja
![]()
gdje dU i δAnapisan za određeni proces. Prema ovoj formuli, ΔSodređuje se do aditivne konstante. fizičko značenje nema samu entropiju, već razliku entropija. Nađimo promjenu entropije u procesima idealnog plina.
![]()
one. promene entropijeS Δ S 1→2 idealnog gasa tokom njegovog prelaska iz stanja 1 u stanje 2 ne zavisi od tipa procesa.
Jer za adijabatski proces δQ = 0, tada ∆ S= 0 => S= konst , odnosno, adijabatski reverzibilni proces se odvija pri konstantnoj entropiji. Stoga se naziva izentropskim.
At izotermni proces (T= const ; T 1 = T 2 : )
![]()
U izohoričnom procesu (V= const ; V 1 = V 2 ; )
![]()
Entropija ima svojstvo aditivnosti: entropija sistema jednaka je zbiru entropija tijela uključenih u sistem.S = S 1 + S 2 + S 3 + ... Kvalitativna razlika između toplotnog kretanja molekula i drugih oblika kretanja je u njegovoj nasumičnosti, neuređenosti. Stoga je za karakterizaciju termičkog kretanja potrebno uvesti kvantitativnu mjeru stepena molekularnog poremećaja. Ako uzmemo u obzir bilo koje dato makroskopsko stanje tijela s određenim prosječnim vrijednostima parametara, onda je to nešto drugo od kontinuirane promjene bliskih mikrostanja koja se međusobno razlikuju po distribuciji molekula u različitim dijelovima volumena i u energija raspoređena između molekula. Broj ovih mikrostanja koja se kontinuirano menjaju karakteriše stepen poremećenosti makroskopskog stanja čitavog sistema,wnaziva se termodinamička vjerovatnoća datog mikrostanja. Termodinamička vjerovatnoćawstanja sistema je broj načina na koje se dato stanje makroskopskog sistema može realizovati, ili broj mikrostanja koja implementiraju dato mikrostanje (w≥ 1, i matematička vjerovatnoća ≤ 1 ).
Dogovorili smo se da uzmemo logaritam njegove vjerovatnoće, uzet sa predznakom minus, kao meru neočekivanosti događaja: neočekivanost stanja je jednaka =-
Prema Boltzmannu, entropijaSsistemi i termodinamička vjerovatnoća su povezani na sljedeći način:
S=
gdje - Boltzmannova konstanta (![]() ). Dakle, entropija je određena logaritmom broja stanja sa kojima se dato mikrostanje može realizovati. Entropija se može smatrati mjerom vjerovatnoće stanja t/d sistema. Boltzmannova formula nam omogućava da entropiji damo sljedeću statističku interpretaciju. Entropija je mjera poremećaja sistema. Zaista, nego više broja mikrostanja koja ostvaruju dato mikrostanje, to je veća entropija. U ravnotežnom stanju sistema – najvjerovatnijem stanju sistema – broj mikrostanja je maksimalan, dok je i entropija maksimalna.
). Dakle, entropija je određena logaritmom broja stanja sa kojima se dato mikrostanje može realizovati. Entropija se može smatrati mjerom vjerovatnoće stanja t/d sistema. Boltzmannova formula nam omogućava da entropiji damo sljedeću statističku interpretaciju. Entropija je mjera poremećaja sistema. Zaista, nego više broja mikrostanja koja ostvaruju dato mikrostanje, to je veća entropija. U ravnotežnom stanju sistema – najvjerovatnijem stanju sistema – broj mikrostanja je maksimalan, dok je i entropija maksimalna.
Jer stvarni procesi su nepovratni, onda se može tvrditi da svi procesi u zatvorenom sistemu dovode do povećanja njegove entropije - princip povećanja entropije. U statističkom tumačenju entropije to znači da procesi u zatvorenom sistemu idu u pravcu povećanja broja mikrostanja, drugim rečima, od manje verovatnih stanja do verovatnijih, sve dok verovatnoća stanja ne postane maksimalna.
§7 Drugi zakon termodinamike
Prvi zakon termodinamike, koji izražava zakon održanja energije i transformacije energije, ne dozvoljava da se utvrdi pravac toka t/d procesa. Osim toga, moguće je zamisliti skup procesa koji nisu u suprotnostiIpočetak m/d, u kojem se energija skladišti, ali se u prirodi ne ostvaruje. Moguće formulacije drugog početka t/d:
1) zakon povećanja entropije zatvorenog sistema tokom ireverzibilnih procesa: svaki ireverzibilni proces u zatvorenom sistemu odvija se na način da se entropija sistema povećava ΔS≥ 0 (nepovratan proces) 2) ΔS≥ 0 (S= 0 za reverzibilno i ΔS≥ 0 za nepovratan proces)
U procesima koji se odvijaju u zatvorenom sistemu, entropija se ne smanjuje.
2) Iz Boltzmannove formule S = , stoga povećanje entropije znači prelazak sistema iz manje vjerovatnog stanja u vjerovatnije.
3) Prema Kelvinu: kružni proces nije moguć, čiji je jedini rezultat pretvaranje topline primljene od grijača u njemu ekvivalentan rad.
4) Po Klauzijusu: nije moguć kružni proces čiji je jedini rezultat prenošenje toplote sa manje zagrejanog tela na više zagrejano.
Za opisivanje t/d sistema pri 0 K, koristi se Nernst-Planckova teorema (treći zakon t/d): entropija svih tijela u ravnoteži teži nuli kako se temperatura približava 0 K
Iz teoreme Nernst-Planck to slijediC p= C v = 0 na 0 To
§8 Termalne i rashladne mašine.
Carnotov ciklus i njegova efikasnost
Iz formulacije drugog zakona t/d prema Kelvinu slijedi da je vječni motor druge vrste nemoguć. (Mašina s perpetual motorom je motor koji periodično radi i radi hlađenjem jednog izvora topline.)
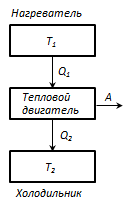 Termostat- ovo je t/d sistem koji može razmjenjivati toplinu s tijelima bez promjene temperature.
Termostat- ovo je t/d sistem koji može razmjenjivati toplinu s tijelima bez promjene temperature.
Princip rada toplotnog motora: od termostata s temperaturom T 1 - grijač, količina topline se oduzima po ciklusuQ 1 , i termostat sa temperaturom T 2 (T 2 < T 1) - frižider, količina toplote koja se prenosi po ciklusuQ 2 , dok obavljate posao ALI = Q 1 - Q 2
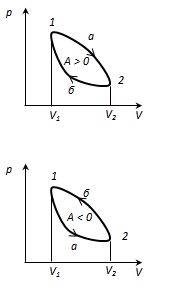 Kružni proces ili ciklus je proces u kojem se sistem, nakon što je prošao niz stanja, vraća u prvobitno stanje. Na dijagramu stanja ciklus je predstavljen zatvorenom krivom. Ciklus koji idealan gas, može se podijeliti na procese ekspanzije (1-2) i kompresije (2-1), rad ekspanzije je pozitivan ALI 1-2 > 0, jerV 2
>
V 1
, rad kompresije je negativan ALI 1-2 < 0, т.к.
V 2
<
V 1
. Dakle, rad koji gas obavi po ciklusu je određen površinom pokrivenom zatvorenom krivom 1-2-1. Ako se pozitivan rad obavlja u ciklusu (ciklus kazaljke na satu), onda se ciklus naziva direktnim, ako je obrnuti ciklus (ciklus se odvija u smjeru suprotnom od kazaljke na satu).
Kružni proces ili ciklus je proces u kojem se sistem, nakon što je prošao niz stanja, vraća u prvobitno stanje. Na dijagramu stanja ciklus je predstavljen zatvorenom krivom. Ciklus koji idealan gas, može se podijeliti na procese ekspanzije (1-2) i kompresije (2-1), rad ekspanzije je pozitivan ALI 1-2 > 0, jerV 2
>
V 1
, rad kompresije je negativan ALI 1-2 < 0, т.к.
V 2
<
V 1
. Dakle, rad koji gas obavi po ciklusu je određen površinom pokrivenom zatvorenom krivom 1-2-1. Ako se pozitivan rad obavlja u ciklusu (ciklus kazaljke na satu), onda se ciklus naziva direktnim, ako je obrnuti ciklus (ciklus se odvija u smjeru suprotnom od kazaljke na satu).
direktni ciklus koristi se u toplotnim motorima - motorima koji rade povremeno i koji obavljaju rad zbog topline primljene izvana. Obrnuti ciklus se koristi u rashladne mašine- periodično operativne instalacije, u kojima zbog radova spoljne sile toplota se prenosi na tijelo sa višom temperaturom.
Kao rezultat kružnog procesa, sistem se vraća u prvobitno stanje i, posljedično, potpuna promjena unutrašnja energija jednako nuli. OndaІ start t/d za kružni proces
Q= Δ U+ A= A,
To jest, rad obavljen po ciklusu jednak je količini topline primljene izvana, ali
Q= Q 1 - Q 2
Q 1 - količina toplotu koju sistem primi,
Q 2 - količina toplotu koju odaje sistem.
Termička efikasnost za kružni proces jednak je omjeru rada sistema i količine topline dovedene sistemu:
![]()
Za η = 1, uslovQ 2 = 0, tj. toplotni stroj mora imati jedan izvor toplineQ 1 , ali to je u suprotnosti sa drugim zakonom t/d.
Proces obrnut od onoga što se dešava u toplotnom stroju koristi se u rashladnoj mašini.
 Od termostata sa temperaturom T 2 količina toplote se oduzimaQ 2
i prenosi se na termostat sa temperaturomT 1
, količina toploteQ 1
.
Od termostata sa temperaturom T 2 količina toplote se oduzimaQ 2
i prenosi se na termostat sa temperaturomT 1
, količina toploteQ 1
.
Q= Q 2 - Q 1 < 0, следовательно A< 0.
Bez obavljanja posla, nemoguće je uzeti toplotu od manje zagrejanog tela i dati je toplijem.
Na osnovu drugog zakona t/d, Carnot je izveo teoremu.
Carnotova teorema: svih toplotnih motora koji rade povremeno sa istim temperaturama grijača ( T 1) i frižideri ( T 2), najveća efikasnost. imaju reverzibilne mašine. K.P.D. reverzibilne mašine za jednake T 1 i T 2 su jednake i ne zavise od prirode radnog fluida.
Radno tijelo je tijelo koje vrši kružni proces i razmjenjuje energiju sa drugim tijelima.
Carnotov ciklus je najekonomičniji reverzibilni ciklus, koji se sastoji od 2 izoterme i 2 adijabate.
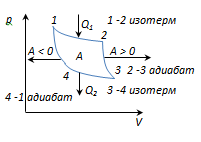 1-2-izotermna ekspanzija pri T 1 grijač; toplota se dovodi do gasaQ 1
i posao je obavljen
1-2-izotermna ekspanzija pri T 1 grijač; toplota se dovodi do gasaQ 1
i posao je obavljen![]()
2-3 - adijabat. ekspanzija, gas radiA 2-3 >0 preko vanjskih tijela.
3-4 izotermna kompresija pri T 2 frižidera; toplota se oduzimaQ 2
i posao je obavljen![]() ;
;
4-1-adijabatska kompresija, rad se obavlja na gasu A 4-1 <0 внешними телами.
U izotermnom procesuU= const , dakle Q 1 = A 12
![]() 1
1
Sa adijabatskom ekspanzijomQ 2-3 = 0, i rad na plin A 23 urađeno unutrašnjom energijom A 23 = - U
![]()
Količina toploteQ 2 , koji plin daje hladnjaku za vrijeme izotermne kompresije jednak je radu kompresije ALI 3-4
![]() 2
2
Rad adijabatske kompresije
![]()
Rad se obavlja kružnim procesom
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
i jednaka je površini krivulje 1-2-3-4-1.
Termička efikasnost Carnot ciklus
![]()
Iz adijabatske jednačine za procese 2-3 i 3-4 dobijamo
Onda ![]()
![]()
one. efikasnost Carnotov ciklus je određen samo temperaturama grijača i hladnjaka. Za povećanje efikasnosti treba povećati razliku T 1 - T 2 .
******************************************************* ******************************************************






