Termodinamički procesi u p v koordinatama. Ciklus hlađenja parnog kompresora. Adijabatski gasni proces
Svaka od ovih jednačina sadrži dva faktora. Jedan karakteriše kvalitet ili intenzitet energije ( ω2− kvadrat brzine, H- visina dizanja, T-temperatura, str−pritisak), a drugi izražava količinu ili kapacitet tijela u odnosu na datu energiju ( m – tjelesna masa, V − specifičan volumen, S – entropija). Prvi faktor je intenzivan faktor, a drugi ekstenzivni faktor. To jest, entropija je kapacitet termodinamičkog sistema u odnosu na termičku napetost.
Clausius je formulirao prvi i drugi zakon termodinamike.
Energija univerzuma je konstantna.
Entropija univerzuma teži maksimumu.
Dakle, to bi trebalo dovesti do toplotne smrti svemira kada se temperatura izjednači. Ali to je u suprotnosti sa činjenicom da je zakon povećanja entropije dobijen za izolovani sistem.
TS - dijagram.
U ovom dijagramu, temperatura je iscrtana duž ordinatne ose, a entropija je prikazana duž ose apscise.
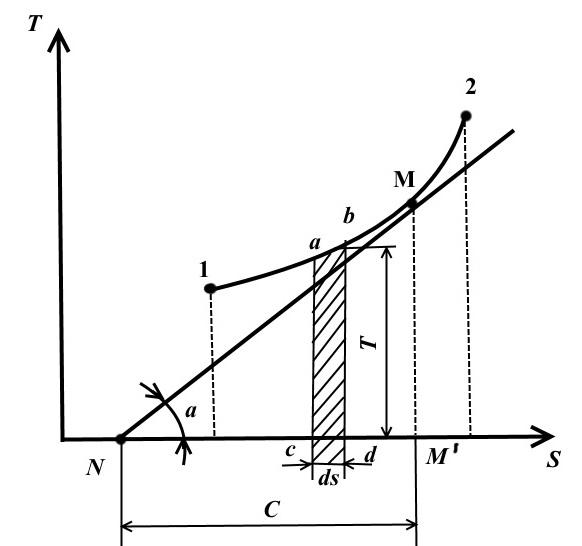
Stanje ravnoteže u TS - dijagramu predstavljeno je tačkama sa koordinatama koje odgovaraju vrijednostima temperature i entropije.
Reverzibilni termodinamički proces promjene stanja radnog fluida iz početnog stanja 1 u konačno stanje 2 prikazan je u TS − dijagram neprekidne krive koja prolazi između ovih tačaka.
Square abdc je jednako TdS = dq , one. izražava elementarnu količinu toplote koju sistem prima ili odaje u reverzibilnom procesu.
Površina ispod krive 1-2 je
To jest, površina ispod krive u TS − dijagram, predstavlja toplotu koja se dovodi u sistem ili odvodi iz njega.
Zbog toga TS − dijagram se zove termalni.
Crtajte u proizvoljnoj tački M na krivulji 1-2 tangenta na ovu krivu
Vrijednost predstavlja pravi toplinski kapacitet procesa.
![]()
Gasni procesi uTS − dijagram.
Izotermni proces.
U izotermnom procesu T= konst. Zbog toga TS- na dijagramu je prikazan ravnom linijom paralelnom sa x-osi.
Uzimajući u obzir činjenicu da dT=0 , ovisnosti promjene entropije idealnog plina u izotermnom procesu imat će oblik
(izraz sa desne strane ostavlja)
Proces 1-2 je proces u kojem se entropija povećava, pa se stoga toplina dovodi u plin i plin obavlja rad ekspanzije ekvivalentan ovoj toplini.
Proces 2-1 je proces kompresije u kojem se iz plina uklanja toplina koja je ekvivalentna radu kompresije i entropija se smanjuje
područje figure S 1 12 S 2 odgovara količini toplote q na isporučeni plin, a ujedno rade l (izotermni proces)
adijabatski proces
U adijabatskom procesu q=0 i dq=0, i shodno tome dS=0.
Dakle, u adijabatskom procesu S= konst i u TS− na dijagramu je adijabatski proces predstavljen pravom linijom paralelnom osi T.
Jer u adijabatskom procesu S= konst, tada se adijabatski reverzibilni procesi nazivaju i izentropski.
Tokom adijabatske kompresije temperatura radnog fluida raste, a tokom ekspanzije opada. Stoga je proces 1-2 proces kontrakcije, a proces 2-1 je proces ekspanzije.
Iz jednadžbe
![]() (3)
(3)
At k= konst dobijamo
![]()
Za reverzibilni adijabatski proces S 1 = S 2 = konst, zatim od (*)
− adijabatska jednačina u koordinatama str i V.
Izohorni proces
Za izohorni proces V= konst, dV=0.
Pri konstantnom toplotnom kapacitetu (iz jednačine (1))
− pogled na TS - grafikon
Subtangenta na krivu procesa u bilo kojoj tački određuje vrijednost pravog toplotnog kapaciteta C V .
Subtangenta će biti pozitivna samo ako je kriva konveksna prema dolje.
Područje ispod krivulje procesa 1-2 TS - dijagram daje skaliranu količinu dovedene topline (ili uklonjene u procesu 2-1) q, jednako promjeni unutrašnja energija U 2 - U 1 .
izobarni proces
U izobaričnom procesu pritisak je konstantan. str= konst
U ovom slučaju
![]() od (2)
od (2)
Stoga, na str= konst kao i sa V= konst izobara je logaritamska kriva, trag se diže udesno i konveksan je prema dolje.
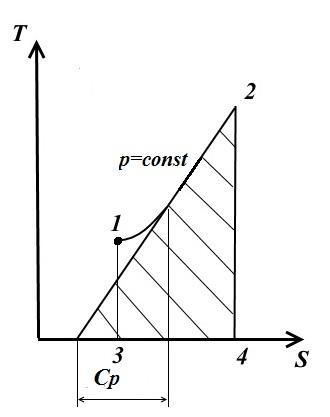
Tangenta na krivulju 1-2 u bilo kojoj tački daje vrijednosti pravog toplotnog kapaciteta C str .
Područje ispod krive daje količinu topline q, koji je prijavljen gasu na str= konst, jednak promjeni entalpije i 2 - i 1 .
Politropni proces
U politropnom procesu Toplotni kapacitet u ovom procesu
![]()
Dakle, za konačnu promenu stanja gasa
![]()
Politropni proces TS - dijagram je prikazan krivuljom, čija lokacija ovisi o indikatoru n.
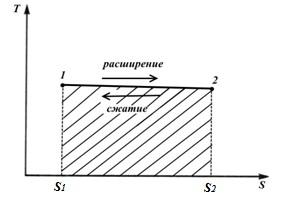
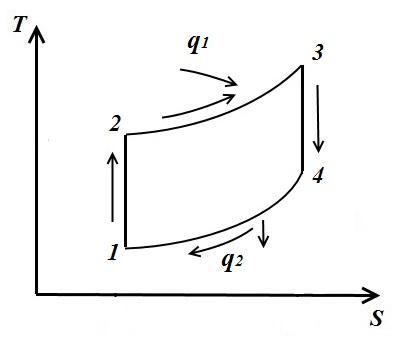
kružni proces. Carnot ciklus.
Hajde da predstavimo unutra TS – dijagram proizvoljnog reverzibilnog ciklusa 1 a2 b1 .

U procesu 1 a2 radno tijelo prima količinu toplote q 1 , numerički jednak površini ispod krive 1 a2, a u procesu 2- b-1 daje količinu toplote q 2 , numerički jednak površini ispod krive 2- b-1.
Dio topline
prelazi u ciklus l (∆ u=0 u petlji).
Rad ciklusa je pozitivan ako ciklus prolazi u smjeru kazaljke na satu i negativan ako je u smjeru suprotnom od kazaljke na satu (smjer ciklusa je u pViTS− dijagrami su isti).
Termička efikasnost kružni proces
Promjena entropije u bilo kojem ciklusu je nula.
Carnotov ciklus se sastoji od dvije izoterme i dvije adijabate. AT TS- na dijagramu će biti prikazan kao pravougaonik (horizontalne linije su izoterme, vertikalne su adijabate)
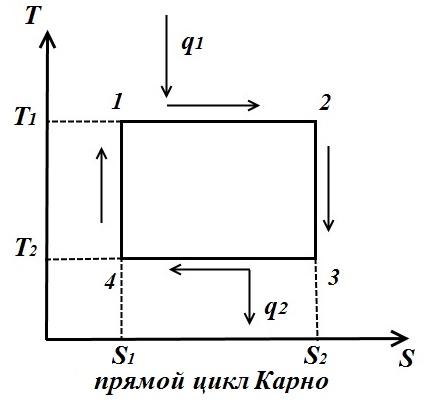
Količina topline koja se dovodi radnom fluidu numerički je jednaka površini pravokutnika 12 S 2 S 1 :
Količina toplote koja se prenosi u frižider odgovara površini pravougaonika 34 S 1 S 2 :
Toplota je ekvivalentna radu ciklusa, jednaka površini ciklusa
Termička efikasnost ciklus
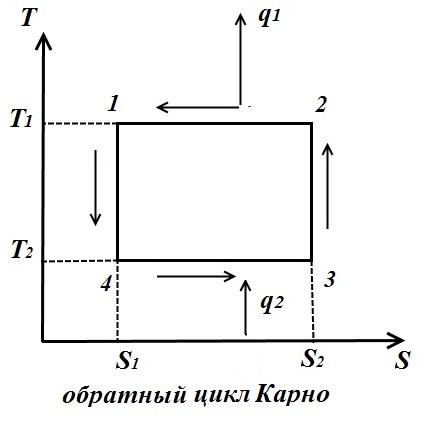
Za obrnuti ciklus (sl. desno)
Koeficijent performansi obrnutog ciklusa
![]()
Prosječna integralna temperatura
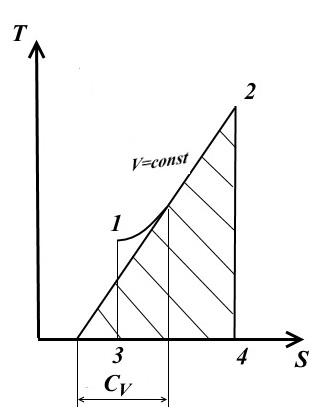
U proizvoljnom reverzibilnom ciklusu, toplina se dovodi i uklanja na promjenjivim temperaturama. Da bi se pojednostavile termodinamičke studije, uvodi se koncept srednje integralne temperature.
Razmotrimo proizvoljan politropni proces u TS- dijagram u kojem se toplota dovodi do radnog fluida q(proces 1-2).
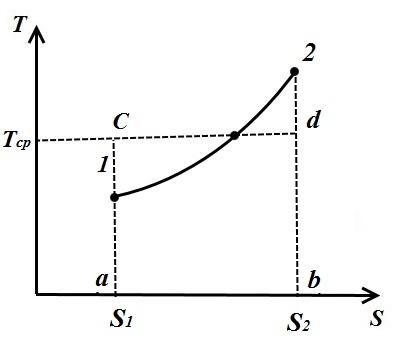
Pod prosečnom integralnom temperaturom radnog fluida u procesu 1-2 podrazumeva se temperatura koja je jednaka visini pravougaonika. abdc jednaka površina a12 b ispod krivulje procesa 1-2, tj.
![]()
Zbog
i segment
Dakle, prosječna integralna temperatura plina za bilo koji proces jednaka je odnosu količine, topline, dovedene u plin ili uzete iz njega, i promjene entropije.
Za bilo koji politropni proces
![]()
i srednja integralna temperatura (od (*))

Ovo pokazuje da prosječna integralna temperatura u bilo kojem politropnom procesu ovisi samo o početnoj T 1 i konačno T 2 temperature i ne zavisi od prirode procesa.
U proizvoljnom ciklusu u kojem su kompresija i ekspanzija plina adijabatski (odjeljci 1-2, 3-4), količina topline dovedena u odjeljak 2-3
i povučen u odjeljku 4-1
Zatim termička efikasnost ciklus
![]() ,
,
odnosno termička efikasnost proizvoljni ciklus je jednak termalnoj efikasnosti. Carnotov ciklus, izveden između prosječnih integralnih temperatura procesa, sumirajući T 1 k.č i uzimanje T 2 k.č toplina.
Generalizirani Carnotov ciklus
Carnotov ciklus ima najveću termičku efikasnost. međutim, mogući su i drugi ciklusi, koji pod određenim dodatnim uslovima mogu imati toplotnu efikasnost jednaku efikasnosti. Carnotov ciklus.
Razmotrimo primjer takvog ciklusa na Sl. prikazuje Carnotov ciklus 1-2-3-4, koji se sastoji od dvije adijabate 2-3, 4-1 i dvije izoterme 1-2, 3-4.
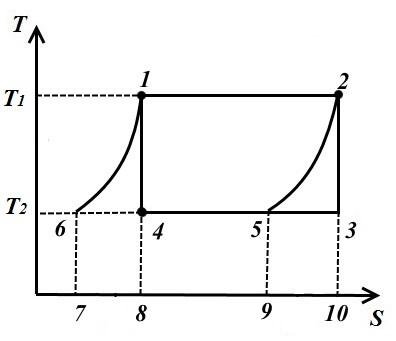
Nacrtajte dvije jednako udaljene krive 1-6 i 2-5 iz tačaka 1 i 2 dok se ne sijeku sa izotermom T 2 = konst i razmotrimo inverzni ciklus 1-2-5-6, koji se sastoji od dvije izoterme i dvije ekvidistantne krive 6-1 (politropi) i 2-5.
U procesu 1-2 do radnog fluida na temperaturi T 1 = konst količinu dovedene toplote
U procesu 2-5, količina topline jednaka površini slike 9-5-2-10 uklanja se iz radnog fluida.
U procesu 5-6 iz radnog fluida na T 2 = konst količina uklonjene toplote
U procesu 6-1, količina toplote se dovodi do radnog fluida q 6-1 , jednako površini 7-6-1-8.
Pošto su krive 1-6, 2-5 jednako udaljene, onda sq. 7618 = pl. 952-10 stoga je i količina toplote ista.
Ovo pokazuje da su srednji hladnjaci i uređaji za prenos toplote samo regeneratori toplote, koji uzimaju toplotu od radnog fluida u procesu 2-5, a daju je u istoj količini radnom fluidu u procesu 6-1. Dakle, 1-2-5-6 važeći vanjski izvori su uređaj za prijenos topline s temperaturom T 1 i hladnjak sa temperaturom T 2 .
Toplota se pretvara u rad u ciklusu
Termička efikasnost određuje se formulom
Odnosno, termička efikasnost razmatrani ciklus je jednak efikasnosti. Carnotov ciklus.
Termodinamički ciklus u kojem se toplina uklanja iz radnog fluida u jednom ili više procesa ciklusa za dovod u jednom ili više procesa naziva se regenerativni ciklus.
Za razliku od Carnotovog ciklusa, regenerativni ciklus zahtijeva srednji izvor topline.
Termodinamička temperaturna skala
Kada se koriste različita termodinamička tijela, skala je neujednačena zbog posebnosti toplinskog širenja ovih tvari.
Drugi zakon termodinamike omogućava vam da izgradite temperaturnu skalu koja ne ovisi o svojstvima termometričkog tijela (predlaže Kelvin)
U Carnot ciklusu, termička efikasnost ne zavisi od svojstava radnog fluida, već je u funkciji temperature toplog i hladnog izvora.
Termička efikasnost
Dakle, omjer temperatura radnog fluida može se odrediti omjerom topline. Iz toga slijedi da ako se Carnotovi ciklusi (slika) formiraju korištenjem ekvidistantnih izotermi, tada se u tim ciklusima ista količina topline pretvara u rad.

Neka temperaturne izoterme T 0 i T k odgovaraju temperaturama leda koji se topi (0 °C) i kipuće vode (100 °C).
U Carnot ciklusu 1234 toplota se pretvara u rad q jednaka površini figure 1234 . Ako se ovo područje podijeli mrežom ekvidistantnih izotermi na 100 jednakih dijelova, u svakom od rezultirajućih Carnotovih ciklusa, količina topline će se pretvoriti u rad 0,01 q. Temperaturni interval između izotermi će biti 1 °S.
Slično, može se konstruirati skala koja leži ispod izoterme s temperaturom T 0 (0 °C).
Za donju tačku termodinamičke skale uzima se temperatura na kojoj je toplinska efikasnost Carnot ciklus =1. Prema
at T 2 =0 . Niža temperatura ne može postojati, jer je u ovom slučaju , što je u suprotnosti sa drugim zakonom termodinamike.
Shodno tome T=0 (-273.15 ) je najniža moguća temperatura i može se uzeti kao početna konstantna prirodna tačka na temperaturnoj skali. Dakle, apsolutna temperatura ne može imati negativne vrijednosti.
Termodinamička temperaturna skala je dobivena za idealni plin.
U termodinamici se proučava širok spektar procesa. Međutim, razlikuju četiri glavna procesa koji se smatraju reverzibilnim:
izohorni, teče u konstantan volumen;
izobaričan, teče u konstantan pritisak;
izotermni, teče u konstantna temperatura(naziv procesa dolazi od kombinacije grčkih riječi "isos" - jednak i "terme" - toplina);
adijabatski, koji teče bez dovoda i odvođenja toplote (na grčkom "adiabatos" - neprobojan).
Pored navedena četiri osnovna procesa u termodinamici, tzv politropna procesi (na grčkom "poli" - mnogo, "tropos" - način). U ovim procesima, svi parametri radnog fluida se mogu mijenjati istovremeno i, osim toga, toplina se dovodi ili odvodi. Kao što će biti objašnjeno u nastavku, četiri osnovna procesa su posebni slučajevi politropskog procesa.
Metodologija za proučavanje termodinamičkih procesa
Prije svega, treba napomenuti da svaki plinski proces u kojem
c = const se poziva politropna sa opštom jednačinom pvn= konst.
n naziva se politropski indeks.
Tehnika proučavanja termodinamičkih procesa je sljedeća:
1. Postavite jednačinu za ovaj proces i izradite je grafička slika in pv i Ts koordinatni sistemi (o ovom drugom se govori u nastavku).
2. Podesite odnos između p,v i T.
3. Prema proračunskoj formuli zajedničkoj za sve procese određujemo promjenu unutrašnje energije ( du= c v dT).
4. By opšta jednačina rad određuje rad datog termodinamičkog procesa.
5. Toplina ovog procesa određena je formulom q = .
Izohorni proces
1. Politropska jednadžba pv n= const se može napisati kao p v=const, što pokazuje da je za izohorični proces n uzima vrijednost.
2. Iz jednačina stanja str 1 v = RT 1 i str 2 v = RT 2 dobijamo.
U praksi se ovaj proces odvija kao komponenta procesi koji se javljaju u motorima sa unutrašnjim sagorevanjem (formiranje eksplozije (sagorevanje goriva) u karburatorskim motorima) i tokom hlađenja ili zagrevanja gasa u cilindru (slika 9, a).
5.q = u one. sva isporučena toplota ide na povećanje unutrašnje energije. Koeficijent pokazuje udio topline koji se koristi za promjenu unutrašnje energije; 1 –z pokazuje koliko se toplotne energije koristi za obavljanje posla. Isochora in T-s koordinate (slika 9, b) prikazane su logaritamskom krivom (vidi 6.5).
izobarni proces
1. Iz politropske jednadžbe pv n= const, može se vidjeti da se pretvara u jednadžbu izobarnog procesa ( R= const) kada n= 0.
2. Iz jednačina stanja pv 1 = RT 1 i pv 2 = RT 2 imamo
3. u= sa v(T 2 – T 1). (47)
4. tj. . (48)
5.dq = du + d . (49)
Odredimo kako se isporučena toplina distribuira:
z = = ,
one. od sve isporučene toplote.
Ovaj proces je sastavni dio ICE ciklusi i gasne turbine (Sl. 10). Isobar in T-s koordinate su prikazane logaritamskom krivom koja je ravnija od izohore (jer sa str > sa v, vidi 6.5).
Izotermni proces
1.T= konst , pvn = konst . Od jednačine stanja pv=RT slijedi da za ovaj proces n treba da bude jednak 1, tj. pv= konst. Izoterma u p-v koordinate su prikazane jednakokračnom hiperbolom (slika 11, a), a u T-s koordinate - prava linija (slika 11, b).
2. str 1 v 1 = str 2 v 2 ; . (50)
3. du=0, t .to. dT= 0.
5. q= , u ovom procesu sva toplota ide u rad.
Ovo je najpovoljniji proces za komprimiranje kompresora, kao temperatura kompresije je konstantna
z= 1 – z= 1.
adijabatski proces
Adijabatski proces je proces koji ne razmjenjuje toplinu sa okolinom. Svi brzi procesi (pucanje, eksplozija, strujanje pare kroz protočni dio turbine, itd.) dolaze vrlo blizu adijabatskim.
Zbog toga će se u nastavku stvarni toplinski procesi koji se odvijaju prilično brzo, uz prihvatljivu inženjersku grešku, smatrati adijabatskim procesima (npr. procesi kompresije i ekspanzije u toplinskim mašinama).
1. dq = sa v dT + pdv; dq= 0, onda
sa v dT + pdv = 0. (52)
Razlikovati pv=R.T. Get pdv+vdp=RdT, gdje . Zamenimo primljeno dT u (52): . Podijeli po i dobiti pdv= 0. Međutim, = k-1, onda pdv + vdp + (k– 1)pdv = 0.
pdv + vdp + kpdv – pdv= 0. Podijeliti sa p v: . Integrišemo se i dobijamo ln str+ln v k= const ili ln( p.v.k) = konst. AT konačni oblik dobija se adijabatska jednadžba:
pv k = konst . (53)
AT p-v adijabatske koordinate su nejednakostrana hiperbola koja ide strmijom od izoterme ( n=k= 1.4, sl. 12a).
2. Iz adijabatske jednačine p 1 v 1 k = p 2 v 2 k. . Odavde
Pišemo karakterističnu jednačinu za tačke 1 i 2: str 1 v 1 =RT 1 i str 2 v 2 =RT 2 i prvo podijelite sa drugim. Get
Sada upotrijebimo izraz (54), zamjenjujući ga izrazom (55):
Da bismo dobili odnos između temperatura i pritisaka, zamjenjujemo u (55) , izraženo kroz omjer tlaka iz (54):
3, 4. U adijabatskom procesu, promjena unutrašnje energije se koristi za rad: O = d + du, dakle d = -du ili .
Nakon integracije dobijamo ili (jer sa proširenjem )
Iz Mayerove jednadžbe c p – c v = R. c p = kc v. Odavde kcv – cv = R i .
Zamijenite rezultirajuću vrijednost c v u formulu (58):
Iz Clapeyronove jednadžbe ( pv=RT) može se zapisati i uzeti p 1 v 1 izvan zagrada, dobijamo
5. q= 0.
U adijabatskom procesu, entropija ostaje konstantna ( s= const), pa se ovaj proces ponekad naziva izentropskim (vidjeti 5.6).
Koeficijent z nema smisla.
Politropni proces
Svi gore razmatrani procesi imali su svoju osobinu: u svakom od njih je nametnuto ograničenje na bilo koju od veličina ( R= const, t= const, v= const, dq= 0). Stoga se ovi procesi mogu smatrati posebnim slučajevima promjene stanja plina.
Osim toga, posljedica ovih ograničenja je ulazna ili izlazna toplina q raspoređeno između i na takav način da poprima određenu vrijednost.
Međutim, očigledno je da mogu postojati procesi u kojima nema ovih ograničenja i z može poprimiti druge vrijednosti. Jedino ograničenje za takve procese će biti upornost z, tj. i konstantnost toplotnog kapaciteta (jer, q = With ).
Integracijom sa n= const, dobijamo politropsku jednačinu
pvn= konst. (65)
Kao što je gore navedeno, indikator n poprima određenu vrijednost za svaki proces.
Budući da se politropska jednadžba ne razlikuje po obliku od adijabatske jednadžbe, svi odnosi između glavnih parametara su predstavljeni formulama sličnim adijabatskom procesu
Isto se može reći i za izraze za određivanje rada politropnog procesa
n1.docx
*Prvi zakon dinamike.
Parametri radnog tijela str, V, T, U, i, S.
Unutrašnja energija radnog tijela
Unutrašnja energija radnog tijela. fizičko značenje i dimenzija.
Procesi su reverzibilni i nepovratni. Ravnoteža i neravnoteža.
Entalpija. fizička svojstva.
Toplotni kapacitet radnog fluida
Proces izohornog gasa
Proces izobarnog gasa.
Izotermni gasni proces.
adijabatski gasni proces.
Drugi zakon termodinamike
Formulacije drugog zakona termodinamike.
Carnotov ciklus i njegova svojstva.
Tablice vodene pare.
i – S dijagram vodene pare.
adijabatski proces str – V , i – S i T – S dijagrami.
Višestepena kompresija u kompresoru.
ICE ciklus sa sagorevanjem na V= konst
ICE ciklus sa sagorevanjem na str= konst
ICE ciklus sa dovodom toplote na Vistr = konst
ICE ciklus sa mješovitim dovodom topline.
Ciklus gasnoturbinskog postrojenja
Ciklus parne snage. Rankineov ciklus.
Ciklus hlađenja vazdušnog kompresora.
Ciklus hlađenja parnog kompresora.
Proces isparavanja u str – V dijagram.
Proces str = konst vodena para. Obradite sliku u str – V , i – S i T – S dijagrami.
Zagrevanje pare.
Proces T= konst vodena para. Obradite sliku u str – V , i – S i T – S dijagrami.
Tabele prosječnih toplotnih kapaciteta. Određivanje topline pomoću tablica.
Specifična potrošnja pare i toplote u termoelektranama
Ciklus plinskih turbina sa regeneracijom.
Jednačina stanja radnog fluida.
Majerova formula.
Koncept "Koeficijenta hlađenja".
Prvi zakon termodinamike je poseban slučaj opšteg zakona održanja i transformacije energije u odnosu na procese međusobne transformacije toplote i rada. Zakon kaže da zbir svih vrsta energije u izolovanom sistemu ostaje konstantan za sve procese koji se dešavaju u sistemu:
Tokom sprovođenja termodinamičkog procesa, toplota se dovodi do tela Q mijenja svoju unutrašnju energiju i vrši mehanički rad:
Za 1 kg radnog fluida
PARAMETRI RADNOG TIJELAP , V , T , U , I , S .
Količine koje karakterišu tijelo u datom stanju nazivaju se parametri države. Najčešće se stanje tijela određuje sljedećim parametrima: specifični volumen, pritisak, entalpija i temperatura.
Specifičan volumen (v) tijelo je zapremina jedinice njegove mase. U tehničkoj termodinamici, kilogram (kg) se uzima kao jedinica mase, a kubni metar (m 3) kao jedinica zapremine. Ako a V - zapremina u m 3 koju zauzima tjelesna masa M u kg, zatim specifičnu zapreminu
Gustina je recipročna vrijednost specifičnog volumena
pritisak str in međunarodni sistem jedinice (SI) se mjere u paskalima. Paskal (Pa) - pritisak uzrokovan silom od 1 njutn (N), ravnomjerno raspoređen na površinu normalnu na nju s površinom od 1 m 2. Dakle, u SI jedinicama, paskal se mjeri u njutnima po kvadratnom metru (N / m 2).
Temperatura karakteriše stepen zagrejanosti tela. Mjeri se ili na termodinamičkoj temperaturnoj skali ili na međunarodnoj praktičnoj temperaturnoj skali. Jedinica za termodinamičku temperaturu je kelvin (K), što je 1/273,16 termodinamičke temperature trostruke tačke vode.
Entalpija
u i radi pv .
Gdje dl t ( dl t = - vdp ).
Vrijednost i str , v , T , i. Fizičko značenje količine i može se objasniti na osnovu jednačine dq = di - vdp, što za proces str = const će biti napisan kao:
dq p = di . (86)
Odakle to sledi di
Promjena entalpije u bilo kojem procesu određena je samo početnim i konačnim stanjem tijela i ne ovisi o prirodi procesa.
Entropija je funkcija stanja, stoga je njena promjena u termodinamičkom procesu određena samo početnim i konačnim vrijednostima parametara stanja. Promjena entropije u osnovnim termodinamičkim procesima:
u izohornom
u izobarskom
u izotermnom
u adijabatskom
u politropskom
UNUTRAŠNJA ENERGIJA RADNOG TIJELA, FIZIČKO ZNAČENJE I DIMENZIONALNOST.
Unutrašnja energija- ovo je sva energija sadržana u tijelu ili sistemu tijela. Ova energija se može predstaviti kao zbir određene vrste energije: kinetička energija molekula, uključujući energiju translacije i rotaciono kretanje molekule, i oscilatorno kretanje atomi u samoj molekuli; energija elektrona; intranuklearna energija; energije interakcije između jezgra molekula i elektrona; potencijalna energija ili energija položaja molekula u bilo kojem vanjskom polju sila; energija elektromagnetnog zračenja.
Obično se označava ukupna unutrašnja energija tijela U(J) i specifičnu unutrašnju energiju u (j/kg) .
Unutrašnja energija je:
Gdje je unutrašnja kinetička energija molekule, unutrašnje potencijalna energija molekula, je konstanta integracije.
U tehničkoj termodinamici razmatraju se samo oni procesi u kojima se mijenjaju kinetička i potencijalna komponenta unutrašnje energije.
Promjena unutrašnje energije idealnog plina za bilo koji proces s beskonačno malom promjenom stanja (za 1 kg)
U termičkim proračunima obično je potrebno znati promjenu unutrašnje energije, a ne njenu apsolutnu vrijednost; dakle, referentna tačka (0 K ili 0 0 C) za krajnji rezultat() irelevantno.
gdje je prosječni maseni toplinski kapacitet pri konstantnoj zapremini unutar
Dakle, promjena unutrašnje energije idealnog plina za bilo koji proces jednaka je proizvodu prosječnog toplotnog kapaciteta pri konstantnoj zapremini i temperaturne razlike gasa.
PROCESI SU REVERZIBILNI I NEPOVRATNI. RAVNOTEŽA I NEravnoteža
Termodinamički proces je sekvencijalna promjena stanja tijela koja nastaje kao rezultat energetske interakcije radnog tijela sa okolinom.
Koncepti reverzibilnog i ireverzibilnog termodinamičkog procesa usko su povezani sa ravnotežom sistema. Razmotrimo takav termodinamički sistem u kome nema razmene toplote sa okolinom (adijabatski termodinamički sistem). Termodinamički procesi koji se dešavaju u takvom sistemu nazivaju se reverzibilnim ako se sistem vraća u prvobitno stanje tokom direktnog i reverznog procesa bez ikakvog dodatnog toplotnog efekta. okruženje sistemu. Ako se sistem ne može vratiti u prvobitno stanje tokom reverznog procesa ili je za to potrebno dovod topline, onda se takav proces naziva nepovratnim.
Proces sa svakom promjenom tlaka i temperature može biti reverzibilan samo ako je tijekom cijelog procesa od tačke do tačke termodinamičkog sistema pritisak konstantan i temperatura u svakoj tački jednaka temperaturi okoline ili je njihova razlika beskonačno mala. .
Reverzibilni termodinamički procesi su idealan ili teoretski slučaj. Svi realni procesi su nepovratni, jer je u praksi teško zadovoljiti kvazistatički uslov. Osim toga, nepovratnost procesa uzrokovana je prisustvom unutrašnjeg trenja u radnom fluidu i površinskog trenja u tehničkoj opremi (protok u mlaznici, trenje površine klipa o zid cilindra itd.). Da bi se savladalo trenje, uvijek je potrebno potrošiti određenu količinu mehaničkog rada, koji se u toku procesa pretvara u toplinu.
ENTHALPIJA. FIZIČKA SVOJSTVA
Entalpija termodinamičkog tijela je zbir unutrašnje energije u i radi str v .
Gdje dl t - postoji razlika u tehničkom radu ( dl t = - vdp ).
Rezultirajuća jednačina je ujedno i druga formulacija prvog zakona termodinamike, koristeći koncepte entalpije i tehničkog rada. 
Vrijednost i se također može smatrati parametrom stanja termodinamičkog tijela uz prethodno uvedeno str , v , T , u . Fizičko značenje količine i može se objasniti na osnovu jednačine ( dq = di - vdp), što za proces str = const će biti zapisan kao: dq p = di .
Odakle to sledi di
je elementarna količina topline dovedena termodinamičkom tijelu u procesu konstantnog pritiska.
Promjena entalpije u bilo kojem procesu određena je samo početnim i konačnim stanjima tijela i ne ovisi o međustanjima i prirodi procesa.
TOPLOTNI KAPACITET RADNOG MEDIJELA
toplotni kapacitet nazovite količinu toplote koja se mora preneti telu (gas) da bi se temperatura bilo koje kvantitativne jedinice podigla za 1°C.
Da biste odredili gore navedene vrijednosti toplinskih kapaciteta, dovoljno je znati vrijednost jednog od njih. Najpogodnije je imati vrijednost molarnog toplotnog kapaciteta, zatim masenog toplotnog kapaciteta:
i volumetrijski toplotni kapacitet:
Zapreminski i maseni toplotni kapaciteti su međusobno povezani zavisnošću:
gdje je gustina gasa u normalnim uslovima.
Toplotni kapacitet gasa zavisi od njegove temperature. Na osnovu toga se razlikuje prosječni i pravi toplinski kapacitet.
Ako aq-
količina toplote koja je prijavljena jedinici količine gasa (ili joj je oduzeta) kada se temperatura gasa promeni od t 1
prije t 2
onda
Predstavlja prosečan toplotni kapacitet unutar. Granica ovog omjera, kada temperaturna razlika teži nuli, naziva se pravi toplotni kapacitet.
IZOHORNI PLINSKI PROCES
Izohorni proces- proces komunikacije ili odvođenja toplote pri konstantnoj zapremini gasa (
v
=
const).
Pri konstantnoj zapremini, pritisak gasa se menja direktno proporcionalno apsolutnim temperaturama:
Eksterni rad gas at v
=
const je nula l=0.
količina toplote ili promena unutrašnje energije gasa:
Izohorni proces pv- grafikon prikazano ravnom vertikalnom linijom - izohorom. Uz pozitivnu količinu topline, linija ide odozdo prema gore.
Promjena entropije je:
IZOBARNI PLINSKI PROCES.
Izobarski proces - proces komunikacije ili odvođenja toplote pri konstantnom pritisku (R
= const)
Kriva procesa se naziva izobara.
Jer u izobaričnom procesu dp=0
tada se u sistemu ne obavlja tehnički rad, a količina toplote potrebna za prelazak tela iz stanja 1 u stanje 2 određuje se kao:
Dakle, u izobaričnom termodinamičkom procesu, količina topline koja se dovodi (odvodi) tijelu je proporcionalna promjeni entalpije u ovom procesu. Ovaj zaključak važi i za reverzibilne i za ireverzibilne procese, pod uslovom da je sistem u termodinamičkoj ravnoteži na početku i na kraju procesa.
Za reverzibilni proces:
izobarni proces pv –
dijagram je prikazan kao ravna horizontalna linija. Kada se procesu doda toplina, linija se proteže s lijeva na desno.

Mehanički rad u takvom procesu:
Specifični jednokratni (korisni) vanjski radovi:
Iz jednadžbe stanja idealnog plina može se dobiti sljedeći odnos za izobarični proces:
Dakle, u izobaričnom procesu, zapremina idealnog gasa je proporcionalna apsolutna temperatura. Kada se plin širi, temperatura raste, a kada je komprimiran, opada.
Promjena entropije u izobarnom procesu može se izračunati na sljedeći način:
IZOTHERMIČNI PLINSKI PROCES.
Izotermni proces - proces komunikacije ili. odvođenje toplote na konstantnoj temperaturi (
t
-
const)
Za izotermni proces idealnog plina, odnos između početnih i konačnih parametara određuje se formulama:
Pri konstantnoj temperaturi, zapremina gasa se menja obrnuto sa njegovim pritiskom.
Na pv-
dijagrami izoterme idealnog gasa predstavljeni su jednakostraničnom hiperbolom. Površina ispod krivulje procesa numerički izražava mehanički rad u datom procesu. 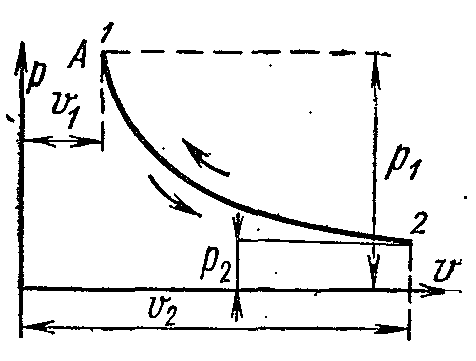
Rad 1 kg idealnog gasa nalazi se iz jednadžbi:
Pošto u izotermnom procesu t
= const, tada za idealan gas
Promjena entropije u izotermnom procesu
Izraženo sljedećom formulom:
ADIABATSKI PLINSKI PROCES.
Proces koji se odvija bez dovoda i odvođenja toplote, tj. u odsustvu razmene toplote sa okolinom, naziva se adijabatskom, a kriva ovog procesa naziva se adijabatskom. Uslovi procesa: dq=0 , q=0.
Jer dq=0 , tada prema prvom zakonu termodinamike:
Tako obavlja radno tijelo mehanički rad u adijabatskom termodinamičkom procesu jednak je smanjenju unutrašnje energije tijela, dok je tehnički rad proporcionalan promjeni (smanjenju) entalpije. U reverzibilnom dijabatskom procesu, entropija termodinamičkog tijela se ne mijenja: S= Konst.
Adijabatska jednadžba u koordinatnom sistemu pv – dijagrami pri konstantnom toplinskom kapacitetu () za idealni plin: gdje je adijabatski eksponent
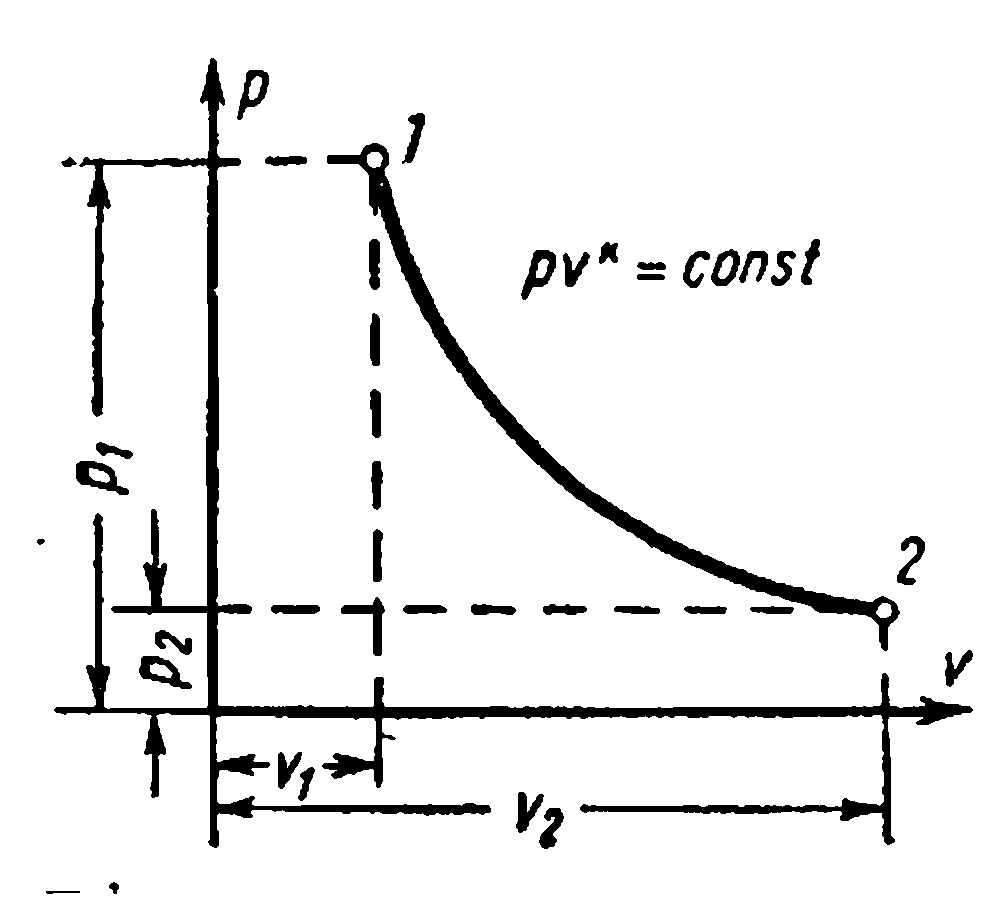
Zavisnosti između početnih i konačnih parametara procesa: između R i v ,
između T i v
između R i T
Rad 1 kg plina nalazi se prema sljedećim formulama
Promjena unutrašnje energije plina i rad adijabatskog procesa jednaki su po veličini i suprotnog predznaka. .
Promjena unutrašnje energije idealnog plina u adijabatskom procesu također se može izraziti jednadžbom
Drugi zakon termodinamike
Drugi zakon termodinamike utvrđuje pravac toka spontanih toplotnih procesa u prirodi i određuje uslove za transformaciju toplote u rad. Zakon kaže da toplota u prirodi spontano prelazi samo sa tela koja su toplija na manje vrela.
U skladu sa drugim zakonom termodinamike, da bi se toplota pretvorila u rad u bilo kojoj toplotnoj mašini, potrebno je imati dva tela sa različite temperature. Toplije tijelo će biti izvor toplote za rad, manje zagrijano tijelo će biti hladnjak. U ovom slučaju, efikasnost toplotnog motora uvijek će biti manja od jedinice.
Drugi zakon dinamike može se matematički izraziti:
Gdje dS –
beskonačno mali prirast entropije sistema;
dQ – beskonačno mala količina toplote koju sistem prima iz izvora toplote;
T - apsolutna temperatura izvora toplote.
Znak nejednakosti odgovara ireverzibilnim procesima, a jednak je reverzibilnim. Stoga, analitički izraz za drugi zakon termodinamike za beskonačno mali reverzibilni proces ima oblik
dQ= TdS
i od tada prema prvom zakonu termodinamike
dQ=dU+pdV
TdS=dU+pdV.
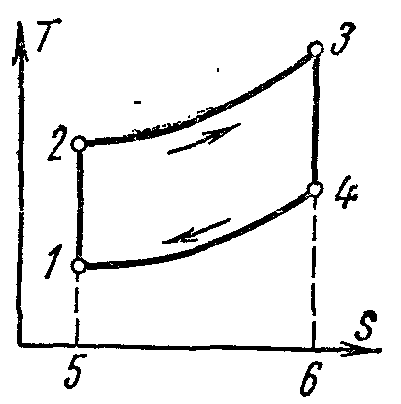
Carnotov ciklus i njegova svojstva.
Carnot ciklus. Sastoji se od dvije izoterme i dvije adijabate. Ovaj ciklus je zatvoreni proces koji obavlja radni fluid u idealnom toplotnom motoru u prisustvu dva izvora toplote: grejača i frižidera.

Carnotov ciklus pv-dijagram
Procesi 1-2 i 3-4 su izotermni, dok su procesi 2-3 i 4-1 adijabatski. Uzima se početna temperatura radnog fluida u ciklusu jednaka temperaturi grijačT 1 . Tokom izotermnog širenja iz stanja 1 u stanje 2, radni fluid prima od grijača količinu toploteq 1 na temperaturiT 1 . U sekciji 2-3 radni fluid se adijabatski širi. Istovremeno, temperatura radnog fluida opada odT 1 prije T 2 i pritisak pada od str 2 prije str 3 . Kada se komprimuje duž izoterme 3-4, količina toplote se uklanja iz radnog fluida u frižiderq 2 na temperaturiT 2 . Dalja adijabatska kontrakcija4-1 dovodi do povećanja temperature radnog fluida odT 2 prije T 1 , a radni fluid se vraća u prvobitno stanje.
Totalni ciklus radal c grafički predstavljeno površinom od 12341.
Efikasnost termičkog ciklusa:
Rad Carnotovog ciklusa
Termička efikasnost ciklus:

Karakteristike ciklusa:
Omjer kompresije
Odnos pritiska
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
Ciklus sa dovodom toplote pri konstantnom pritisku sastoji se od dve adijabate, jedne izobare i jedne izohore.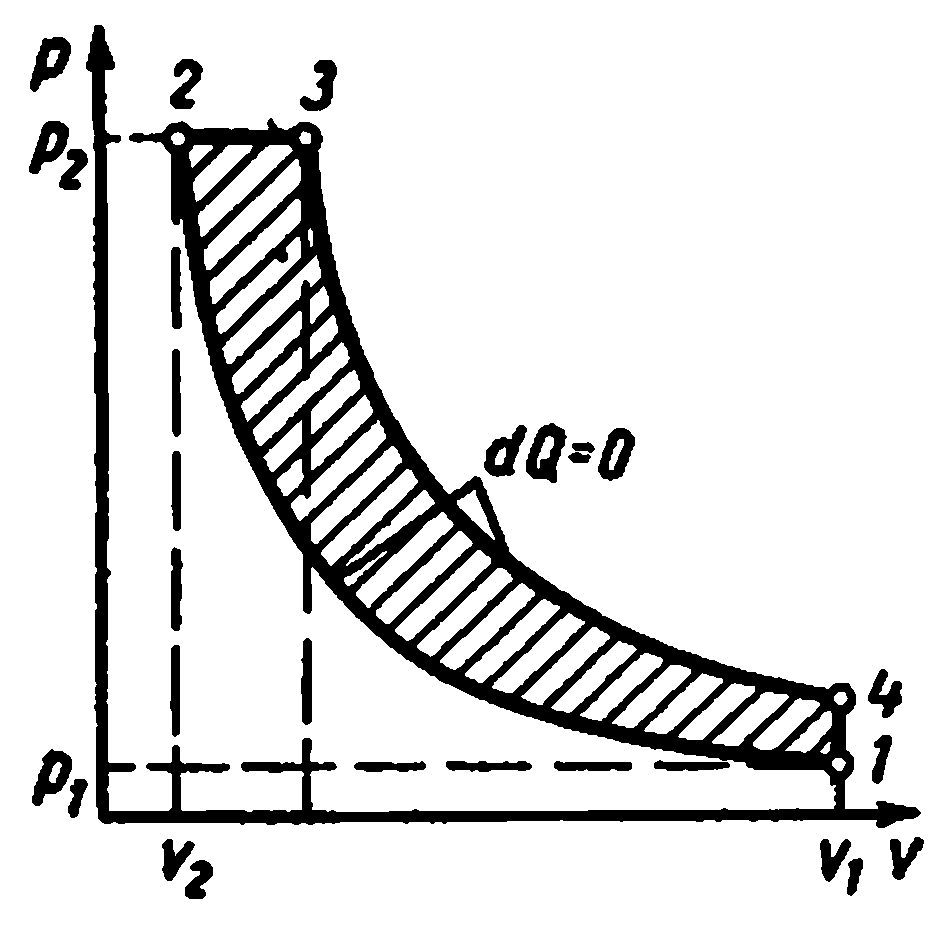
Karakteristike ciklusa:
Omjer kompresije
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
Ciklus sa kombinovanim snabdevanjem toplotom sastoji se od dvije adijabate, dvije izohore i jedne izobare

Karakteristike ciklusa
Količina isporučene topline
Količina uklonjene topline
Termička efikasnost ciklus
Tablice vodene pare.
pregrijana para ili zasićene pare po svojim svojstvima značajno se razlikuju od idealnih gasova. Jednačine za stanje para su veoma složene i ne koriste se u računarskoj praksi. U praktične svrhe koriste se tabele i dijagrami, sastavljeni na osnovu eksperimentalnih i teorijskih podataka. Tabele su sastavljene sa visokim stepenom tačnosti za pregrejane i zasićene pare do temperature od 1000 0 C i pritiska od 98,0 MPa.
U tabelama za zasićena para temperature zasićenja, pritisci, vrijednosti specifične količine, entalpija i entropija tečne i suve pare, toplota isparavanja. U tablicama pregrijane pare date su vrijednosti glavnih parametara za različite pritiske i temperature: specifičnu zapreminu, entalpiju i entropiju.
i – S dijagram vodene pare.
veliko dostojanstvo je dijagram je da su tehnički rad i količina topline uključene u procese predstavljeni segmentima linija, a ne površinama. Prilikom izgradnje je- grafikoni iscrtano duž y-ose specifična entalpija par, a duž apscise je specifična entropija. Za ishodište koordinata se uzima stanje vode trostruki poen, gdje, .
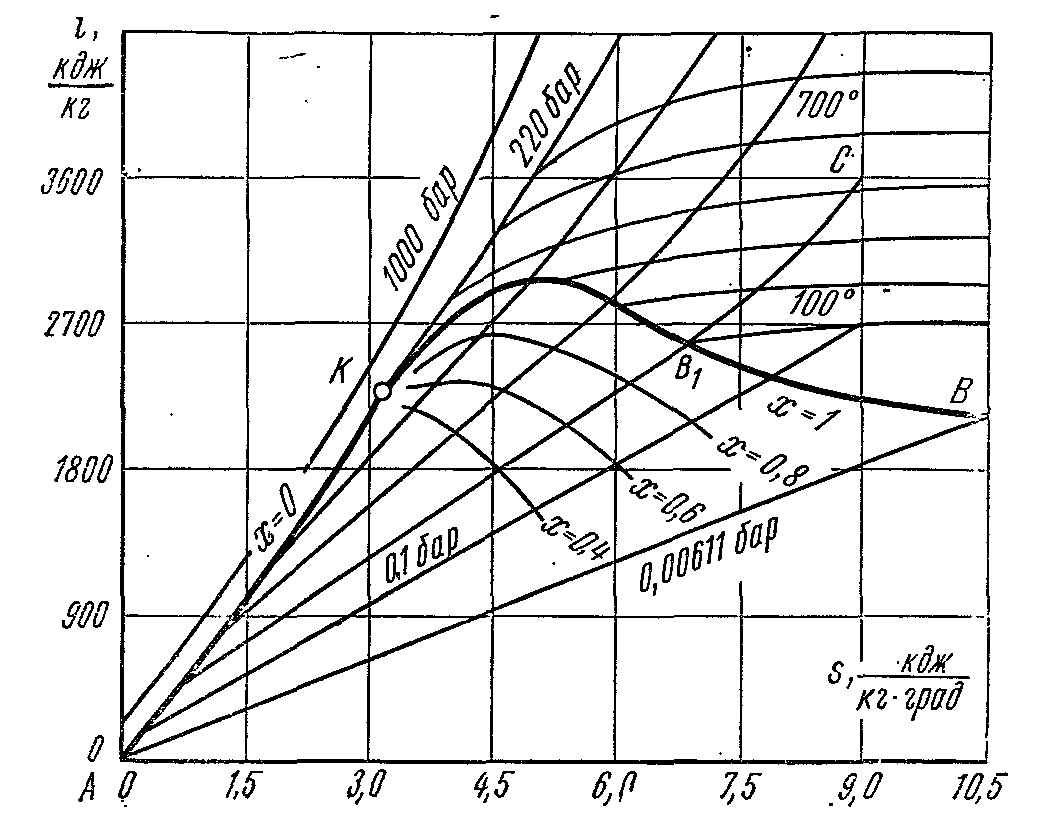
Koristeći podatke tablica vodene pare, granične krive tečnosti i pare su ucrtane na dijagram, konvergirajući u kritičnoj tački K. Granična kriva tečnosti napušta ishodište, jer u ovoj tački, entropija i entalpija se uzimaju jednakima nuli. Stanje vode je označeno tačkama na odgovarajućim izobarama. Isobar linije u tom području mokra para su ravne nagnute linije koje se šire od granične krivulje fluida. U izobaričnom procesu:
Nagib izobare prema apscisi u svakoj tački dijagrama numerički je jednak apsolutnoj temperaturi datog stanja. Jer u području mokre pare, izobara se poklapa sa izotermom, tada su prema posljednjoj jednadžbi izobara mokre pare ravne linije:
A ovo je jednačina prave linije. U području pregrijane pare, izobare imaju zakrivljenost s konveksnošću usmjerenom prema dolje. U području vlažne pare primjenjuje se mreža linija konstantne suhoće pare (x=const), koje se konvergiraju u kritičnoj tački K.
Izoterme u području vlažne pare poklapaju se sa izobarama. U području pregrijane pare, oni se razilaze: izobare se uzdižu, a izoterme su zakrivljene linije s konveksnošću prema gore. Na dijagram je primijenjena mreža izohora, koje imaju oblik krivulja koje se strmije uzdižu u odnosu na izobare. Reverzibilni adijabatski proces je predstavljen vertikalnom ravnom linijom. Područje ispod izobare trostruke tačke prikazuje stanja mješavine para + led.
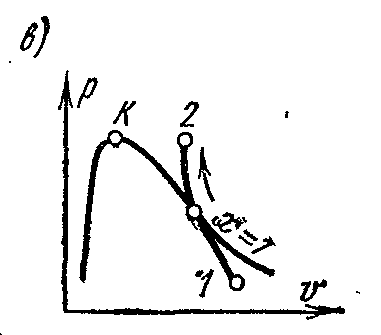
adijabatski processtr – V , i – S iT – S dijagrami.
Adijabatski proces se odvija bez dovoda i odvođenja toplote, a entropija radnog fluida u reverzibilnom procesu ostaje konstantna vrijednost: s=konst. Stoga, na je
i
Ts-
adijabatski dijagrami su prikazani vertikalnim pravim linijama: sl. a i b 

Tokom adijabatskog širenja, pritisak i temperatura pare se smanjuju; pregrijana para se pretvara u suhu pa u mokru paru. Iz uslova konstantnosti entropije moguće je odrediti konačne parametre pare ako su poznati parametri početnog i jednog parametra krajnjeg stanja.
Na pv- na dijagramu je reverzibilni adijabatski proces prikazan određenom krivom (sl. c)
Specifičan rad u adijabatskom procesu određuje se iz jednačine:
Promjena specifične unutrašnje energije:
Višestepena kompresija u kompresoru.
Višestepeni kompresori se koriste za proizvodnju gasa pod visokim pritiskom
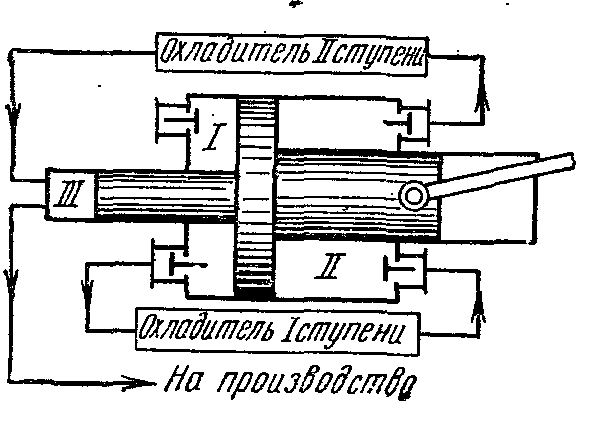
Kod kojih se kompresija plina vrši politropski u nekoliko cilindara povezanih u seriju s njegovim međuhlađenjem nakon svake kompresije.
Upotreba kompresije plina u nekoliko cilindara smanjuje omjer tlaka u svakom od njih i povećava volumetrijsku efikasnost. kompresor. Osim toga, međuhlađenje plina nakon svake faze poboljšava uvjete podmazivanja klipa u cilindru i smanjuje potrošnju energije za pogon kompresora.

Idealan indikatorski dijagram trostepenog kompresora, gde je 0-1 usisni vod do prvog stepena;
1-2 - proces politropske kompresije u prvoj fazi; 2-a - vod za ubrizgavanje od prvog stepena do prvog hladnjaka; a-3 - usisni vod do drugog stepena; 3-4 - proces politropske kompresije u drugoj fazi; 4-c - ispusni vod od drugog stepena do drugog hladnjaka; c-5 - usisni vod do trećeg stepena; 5-6 - proces politropske kompresije u trećoj fazi; 6-c - linija za ubrizgavanje od treće faze do rezervoara ili do proizvodnje. Segmenti 2-3, 4-5 prikazuju smanjenje zapremine gasa u procesu pri konstantnom pritisku od hlađenja u prvom i drugom hladnjaku. Hlađenje radnog fluida u svim hladnjacima vrši se na istu temperaturu jednaku početnoj T 1, stoga su temperature gasova u tačkama 1, 3 i 5 iste i leže na izotermi 1 - 7.
Odnos pritisaka u svim fazama obično se uzima isti:
Sa istim omjerima tlaka u svim stupnjevima, jednakošću početnih temperatura i jednakošću politropnih pokazatelja, konačne temperature plina u pojedinačnim stupnjevima kompresora su međusobno jednake:
Stepen povećanja pritiska u svakoj fazi ili na z stepena
Stepen povećanja pritiska u svakoj fazi jednak je korijenu z-ti stepen od konačnih omjera tlaka
Povratak na početni
Sa jednakim temperaturama gasa na ulazu u svaki stepen i jednakim odnosima pritiska u svim cilindrima, dobijamo jednakost rada utrošenog u svim fazama kompresora:
U drugom koraku
Rad u trećoj fazi
Gdje l 1
=l 2
=l 3
Ukupan specifični rad u džulima utrošen na kompresiju gasa u tri stepena kompresora: l to =3 l 1
Pod istim uvjetima kompresije plina, količine topline koje se uklanjaju iz plina u pojedinim fazama jednake su jedna drugoj:
Toplota koja se uklanja iz plina u bilo kojem hladnjaku tokom procesa izobarnog hlađenja nalazi se po formuli:

AT Ts- Na dijagramima su procesi adijabatske kompresije prikazani pravim linijama 1-2, 3-4, 5-6, a procesi hlađenja krivuljama 2-3, 4-5, 6-7.
Procesi politropske kompresije prikazani su krivuljama 1-2, 3-4, 5-6, a procesi hlađenja u rashladnim uređajima - linijama 2-3, 4-5, 6-7.
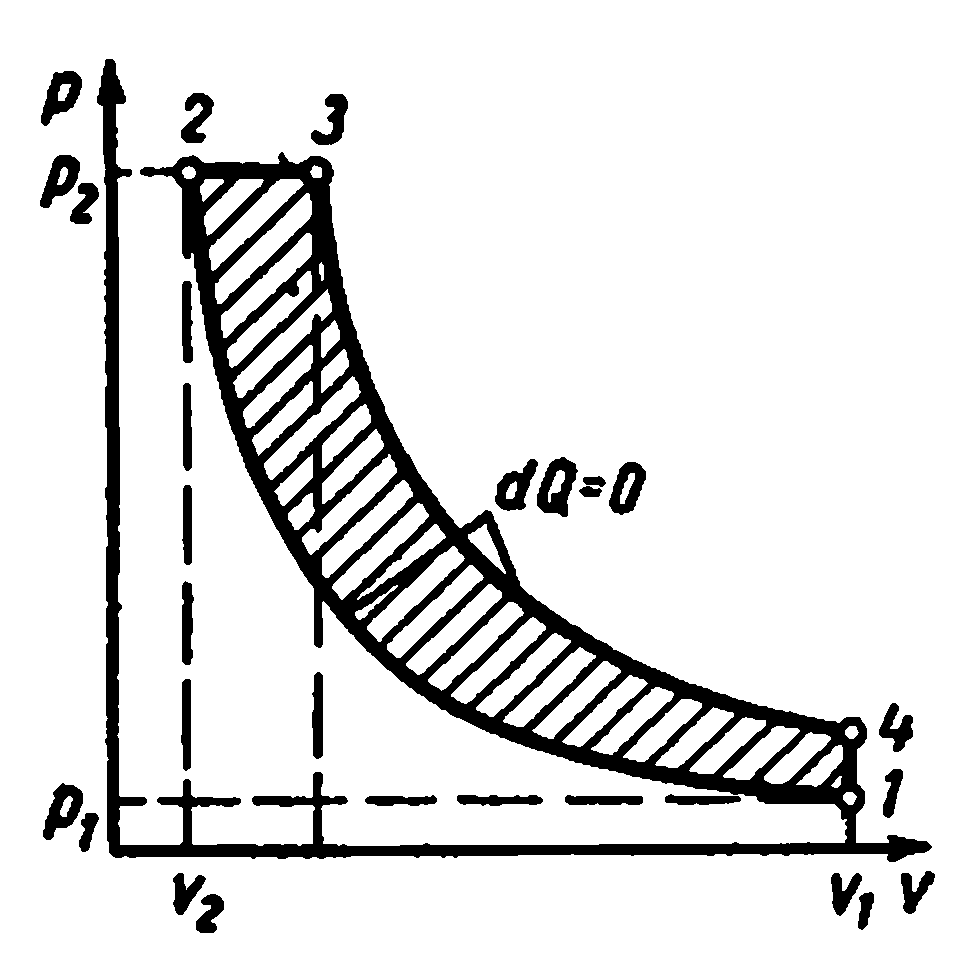
ICE ciklus sa sagorevanjem naV = konst
![]()
Na slici je prikazan dijagram indikatora motora koji radi sa gorivom koji brzo gori pri konstantnoj zapremini. Kao gorivo koriste se benzin, rasvjetni ili generatorski plin, alkoholi itd.
Kada se klip pomakne iz lijevog mrtvog položaja u krajnji desni, zapaljiva smjesa se usisava kroz usisni ventil. Ovaj proces je prikazan krivuljom 0-1, koja se zove usisna linija, nije termodinamički proces, jer. u njemu se ne mijenjaju glavni parametri, već se mijenjaju samo masa i volumen smjese u cilindru. Kada se klip pomeri unazad, usisni ventil se zatvara, a zapaljiva smeša se komprimira. Prikazana krivuljom 1-2, koja se zove linija kompresije. U tački 2, zapaljiva smjesa se zapali od električne iskre. Sagorevanje zapaljive smeše se dešava skoro trenutno, tj. pri skoro konstantnoj zapremini. Ovaj proces je prikazan krivom 2-3. Kao rezultat sagorijevanja goriva, temperatura plina naglo raste, a tlak raste (tačka 3). Tada se proizvodi sagorevanja šire. Klip se pomera u pravi mrtvi položaj, a gasovi obavljaju koristan posao. Na dijagramu indikatora, proces ekspanzije je prikazan krivuljom 3-4, koja se naziva ekspanzijska linija. U tački 4, izduvni ventil se otvara i tlak u cilindru pada na gotovo vanjski tlak. Daljnjim kretanjem klipa s desna na lijevo, proizvodi izgaranja se uklanjaju iz cilindra kroz ispušni ventil pod pritiskom koji neznatno prelazi Atmosferski pritisak. Prikazana je kao kriva 4-0 i naziva se izduvna linija. Takav radni tok se završava u četiri hoda klipa ili u dva okretaja osovine. Takvi motori se nazivaju četverotaktni.
Ciklus sa dovodom toplote pri konstantnoj zapremini sastoji se od dve adijabate i dve izohore
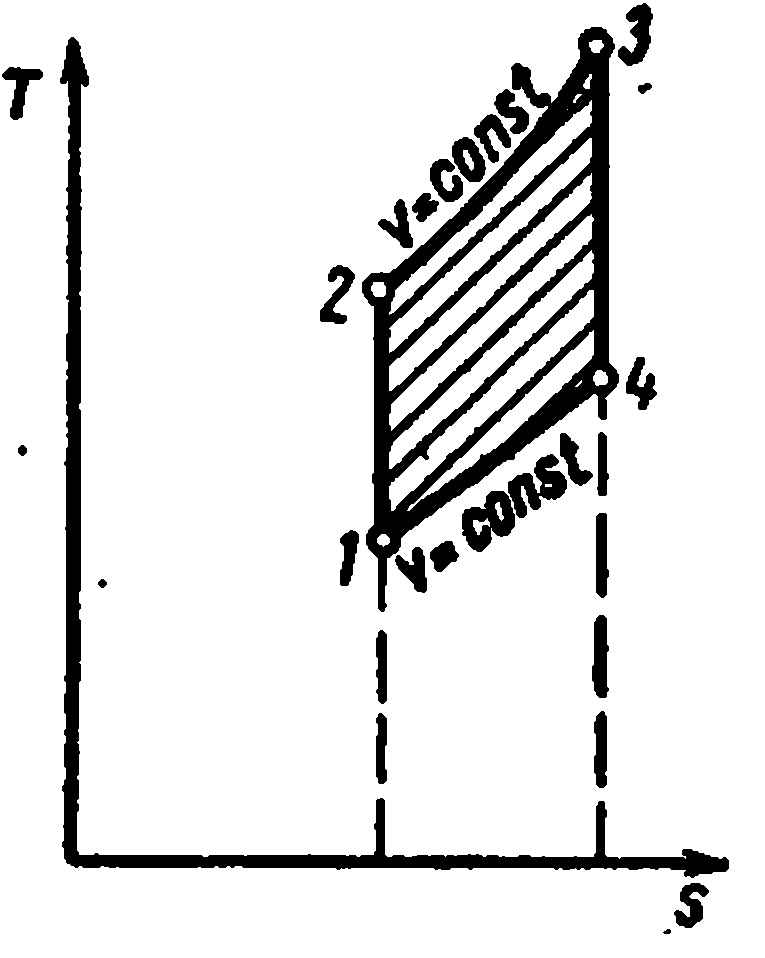
Karakteristike ciklusa su:
- omjer kompresije
– stepen povećanja pritiska
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
ICE ciklus sa sagorevanjem nastr = konst
Proučavanje ciklusa sa dovodom toplote pri konstantnoj zapremini pokazalo je da je za povećanje efikasnosti motora koji radi po ovom ciklusu potrebno primeniti visoke kompresije. Vazduh pri visokoj kompresiji ima tako visoku temperaturu da se gorivo koje se dovodi u cilindar spontano zapali bez palitelja. Odvojena kompresija zraka i goriva omogućava korištenje bilo kojeg tečnog teškog i jeftinog goriva - ulja, lož ulja, smole, ugljena ulja.
Ovu prednost imaju motori koji rade sa postepenim sagorevanjem goriva pri konstantnom pritisku. Kod njih se zrak komprimira u cilindru motora, a tekuće gorivo se raspršuje komprimiranim zrakom iz kompresora.
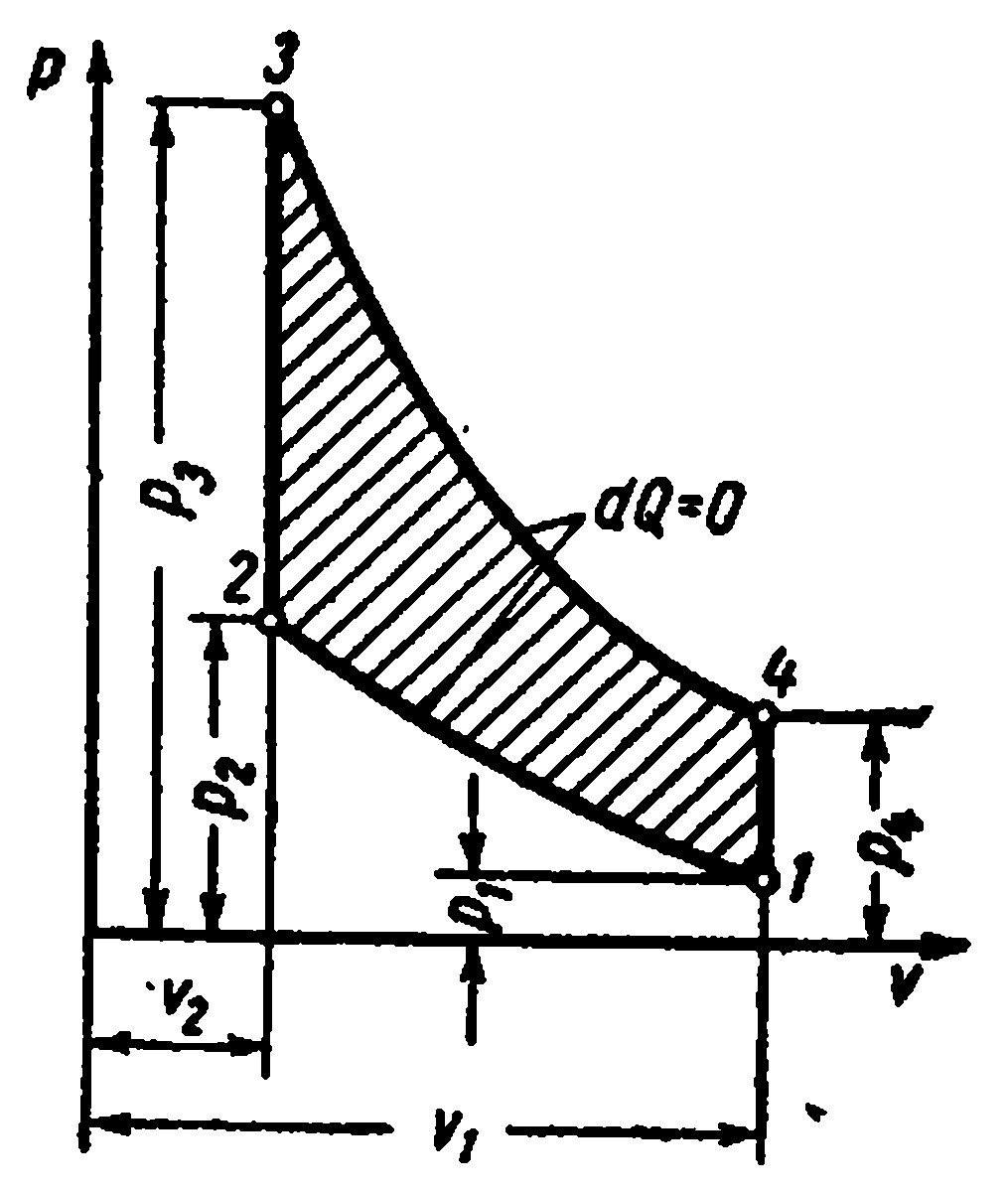
Idealan ciklus motora sa postepenim sagorevanjem goriva pri konstantnom pritisku, tj. ciklus sa dovodom toplote pri konstantnom pritisku izvodi se na sledeći način.

Plinoviti radni fluid sa početnim parametrima str 1 , v 1 , T 1 skuplja se duž adijabatskog 1-2; tada se određena količina toplote prenosi na tijelo duž 2-3 izobare q 1 . Od tačke 3, radno tijelo se širi duž adijabatskog 3-4. Prema 4-1 izohori, radni fluid se vraća u prvobitno stanje, dok se toplota odvodi do hladnjaka q 2 .
Karakteristike ciklusa:
Omjer kompresije
Stepen pred-ekspanzije.
Količina isporučene toplote:
Količina uklonjene toplote:
Rad u ciklusu
Termička efikasnost ciklus:
ICE ciklus sa dovodom toplote naV i str = konst
U motoru visoke kompresije bez kompresora sa mješovitim unosom topline, tekuće gorivo se opskrbljuje pumpom za gorivo kroz injektor za gorivo do glave cilindra u obliku sitnih kapljica. Ulaskom u zagrijani zrak gorivo se spontano pali i sagorijeva tijekom cijelog perioda dok je mlaznica otvorena: prvo pri konstantnoj zapremini, a zatim pri konstantnom pritisku.

Idealan ciklus motora sa mješovitim unosom topline prikazan je u pv- iTs- dijagrami.
Radno tijelo sa početnim parametrima str 1 , v 1 , T 1 je komprimiran duž adijabate 1-2 do tačke 2. Prvi dio topline se dovodi do radnog fluida duž izohore 2-3. Drugi dio topline se dovodi duž izobare 3-4. Od tačke 4, radno tijelo se širi duž adijabatskog 4-5. Duž izohore 5-1 radni fluid se vraća u prvobitno stanje - u tačku 1, dok se toplina odvodi do hladnjaka.
Karakteristike ciklusa su:
Omjer kompresije
– stepen povećanja pritiska
Stepen pred-ekspanzije.
Definirajte termičku efikasnost ciklusa pod uslovom da je toplotni kapacitet c str ,
c v
i adijabatski eksponent k=
c str /
c v
konstanta:
Prvi udio isporučene topline:
Drugi dio isporučene količine topline:
Količina uklonjene toplote:
Efikasnost termičkog ciklusa
Ciklus gasnoturbinskog postrojenja
Radni fluid u gasnoturbinskim postrojenjima su produkti sagorevanja tečnih ili gasovitih goriva.

Na slici je prikazan dijagram najčešćeg tipa gasnoturbinskog postrojenja sa sagorevanjem goriva pri konstantnom pritisku.
Kompresor K, koji se nalazi na istoj osovini sa gasnom turbinom T, usisava vazduh iz atmosfere i komprimira ga do određenog pritiska. Komprimovani vazduh ulazi u komoru za sagorevanje KS; ista pumpa za gorivo TN isporučuje se tečno gorivo. Sagorevanje se odvija pod konstantnim pritiskom. Iz komore za sagorijevanje plinovi ulaze u mlaznice OD, od kojih su oni velika brzina uđite u radne oštrice L turbine i postaviti rotor u rotaciju. Izduvni gasovi kroz izduvnu cev P pušten u atmosferu.
Gasnoturbinski ciklus sa dovodom toplote u procesustr
=
konst
.
Idealan ciklus gasnoturbinskog postrojenja na pv- iTs- dijagrami sa unosom toplote na str=
konst.
Ciklus se sastoji od dvije adijabate i dvije izobare.
Toplina se uklanja iz radnog fluida ne duž izohore, kao u motoru sa unutrašnjim sagorevanjem, već duž izobare. Radno tijelo sa početnim parametrima str 1 , v 1 , T 1 komprimuje se duž adijabatskog 1-2 do tačke 2. Od tačke 2, određena specifična količina toplote se dovodi do radnog fluida q 1 duž izobare 2-3. Zatim se radni fluid širi duž adijabatskog 3-4 do početnog pritiska i vraća se duž izobare 4-1 u prvobitno stanje, dok se specifična količina toplote uklanja q 2 .
Karakteristike ciklusa su stepen pritiska u kompresoru i stepen izobarične ekspanzije.
Količina unesene toplote:
Količina uklonjene toplote:
Efikasnost termičkog ciklusa
Ciklus parne snage. Rankineov ciklus.
Idealni Rankineov ciklus uzima se kao glavni ciklus u postrojenju parnih turbina. U ovom ciklusu radni fluid se potpuno kondenzira u kondenzatoru, zbog čega se umjesto glomaznog neefikasnog kompresora koristi pumpa napojne vode za dovod vode u kotao, koji ima male dimenzije i visoku efikasnost.
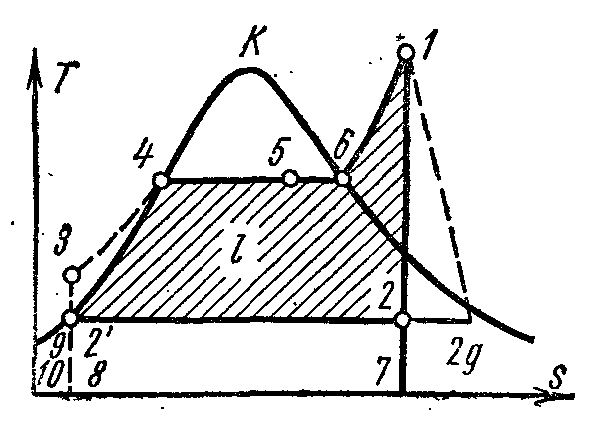
Na pv- tačka 4 na dijagramu karakteriše stanje ključale vode u kotlu pod pritiskom str 1 . Red 4-5 prikazuje proces stvaranja pare u kotlu; zatim se para suši u pregrijaču pod pritiskom str 1 . Nastala para se širi duž adijabatskog 1-2 u cilindru parne mašine do pritiska str 2 u kondenzatoru. U procesu 2, para se potpuno kondenzira do stanja kipuće tekućine pod pritiskom str 2 prenošenjem toplote isparavanja na rashladnu vodu. Proces kompresije vode vrši se u pumpi; rezultirajuće povećanje temperature vode je zanemarljivo, a zanemaruje se u studijama pri pritiscima do 3,0–4,0 MPa. Linija 3-4 prikazuje promjenu volumena vode pri zagrijavanju od temperature u kondenzatoru do točke ključanja. Rad pumpe je prikazan kao osenčeni kvadrat. 03 7. Entalpija pare na izlazu pregrijača u tački 1 jednaka je i 1 i dalje Ts–dijagram prikazana pl. 9 34617109. Entalpija pare na ulazu u kondenzator u tački 2 jednaka je i 2 i dalje Ts–dijagram prikazana pl. 9 . Entalpija vode pri izlasku iz kondenzatora u tački je jednaka i 1 i dalje Ts–dijagram prikazana pl. 9 8109. Korisni rad pare u Rankineovom ciklusu l prikazano na pv- kvadratni dijagram. .
Ako Rankineov ciklus uzme u obzir rad pumpe, tada će proces adijabatske kompresije vode u njoj biti predstavljen kao Ts- dijagram adijabatski, a izobara 3-4 odgovara zagrijavanju vode u kotlu na pritisak str 1 do odgovarajuće tačke ključanja.
Toplinska efikasnost Rankineovog ciklusa određena je formulom:
Specifična količina toplote u ciklusu se isporučuje na str=
konst
u procesima 3-4 (zagrijavanje vode do tačke ključanja), 4-6 (isparavanje) i 6-1 (pregrijavanje pare) i jednaka je razlici između entalpija početne i završne točke procesa:
Ova specifična količina toplote je prikazana u Ts–dijagram sq. osam . Uklanjanje određene količine toplote q 2
vrši se u kondenzatoru duž izobare 2-, dakle
Toplota uklonjena prikazano na Ts–dijagram sq.
Toplotna efikasnost Rankineovog ciklusa:
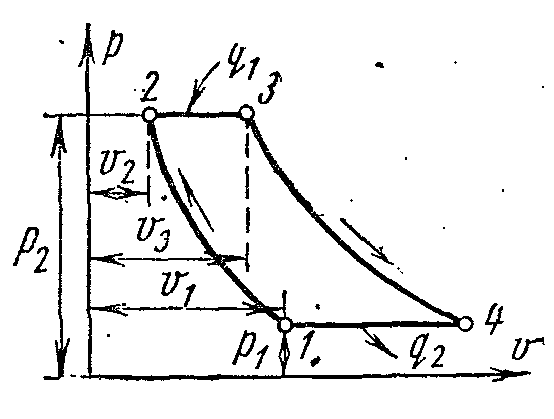
Ciklus hlađenja zračnog kompresora
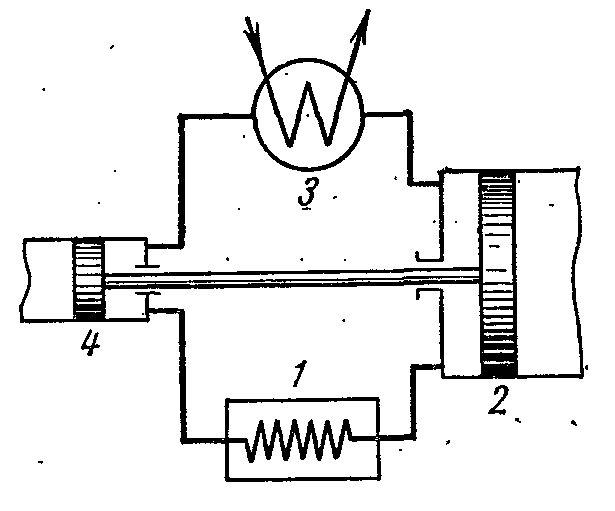
Na slici je prikazan dijagram zračnog rashladnog postrojenja, gdje se kao radni fluid koristi zrak, koji je najprikladniji, bezopasan i pristupačniji radni fluid. Zračna rashladna jedinica radi na sljedeći način.
Zrak koji hladi prostoriju 1 se komprimira u kompresoru 2, zbog čega se njegova temperatura povećava. Komprimirani zrak pod konstantnim pritiskom se ubrizgava u izmjenjivač topline 3, u kojem se hladi vodom do temperature okoline. Nakon toga komprimirani zrak ulazi u ekspanzioni cilindar, odnosno ekspander 4, gdje se širi do početnog tlaka. Prilikom širenja temperatura zraka pada na -60 ili -70 0 C i rashladni zrak se šalje na hlađenje prostorije, gdje, zagrijan, ponovo ulazi u kompresor.

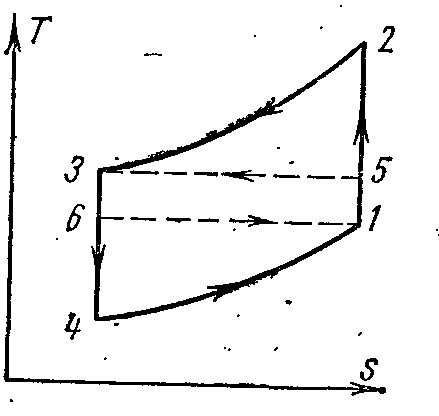
AT pv- iTs– dijagrami:
Vazduh u procesu 1-2 se adijabatski komprimira pritiskom str 1 prije str 2 . U izobaričnom procesu 2-3, specifična količina topline se odvodi iz zraka u vanjski izvor i njegova temperatura opada od T 2 do T 3 . Kod adijabatskog širenja u procesu 3-4, zrak se dodatno hladi od temperature T 3 do T 4 . Nadalje, u izobaričnom procesu 4-1, toplina se odvodi iz hlađene prostorije (predajnik topline), uslijed čega se zrak zagrijava iz T 4 do T 1 .
Rad utrošen na realizaciju ciklusa jednak je razlici specifičnih količina toplote q 1 i q 2. Uz pretpostavku da je toplotni kapacitet konstantan, imamo:
Zatim koeficijent hlađenja ciklusa:
=
Iz adijabatskih procesa 1-2 i 3-4
I
Ali str 2
=
str 3
, a str 1
=
str 4
onda
Konačno imamo
Gdje T 1
je temperatura prostorije koja se hladi ili temperatura zraka usisanog u kompresor.
T 2 je temperatura komprimovanog vazduha.
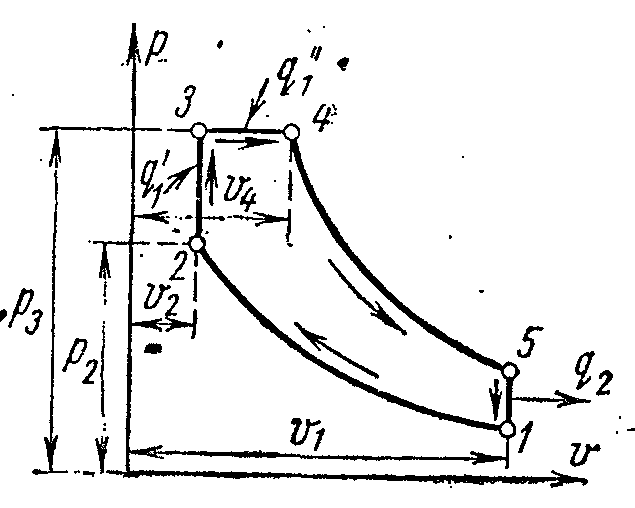
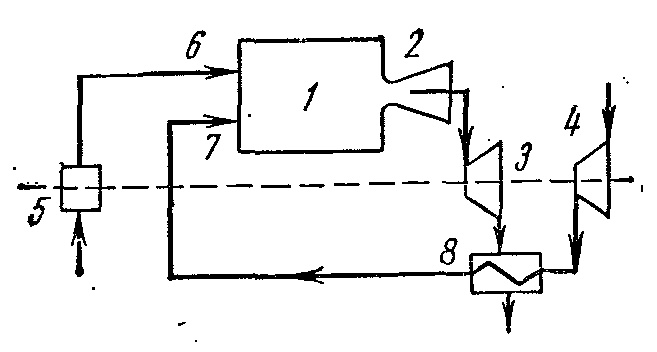
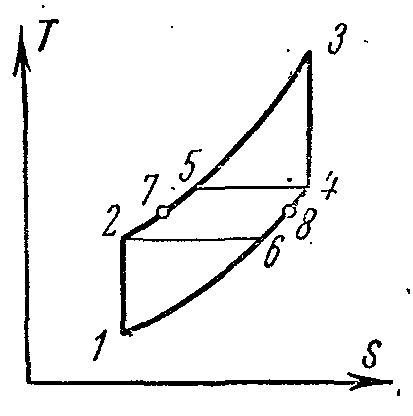
Ciklus hlađenja parnog kompresora
Najrasprostranjenije za hlađenje tijela na temperaturu od -20 0 C su rashladni uređaji u kojima su rashladno sredstvo tekućine niskog ključanja - amonijak, freoni, sumpor-dioksid i druge pri niskim pritiscima (po mogućnosti blizu atmosferskog).
Na slici je prikazan dijagram kompresorske jedinice koja radi na pari amonijaka NH 3 .
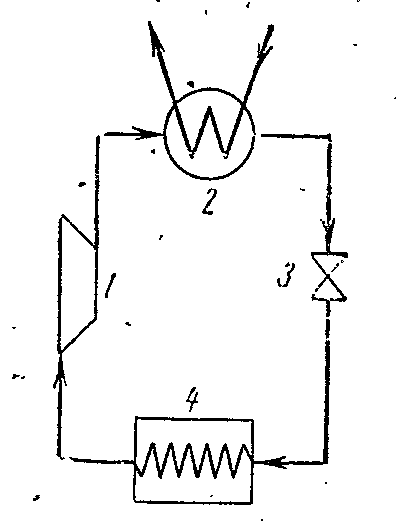

1- kompresor; 2- kondenzator; 3- prigušni ventil; 4 - hlađena prostorija (isparivač)
Kompresor komprimira amonijačnu suhu zasićenu paru ili mokru paru sa visokim stepenom suvoće duž adijabatskog 1-2 do stanja pregrejane pare u tački 2. Iz kompresora se para ubrizgava u kondenzator, gde se potpuno pretvara u tečnost. (proces 2-3-4). Iz kondenzatora tečni amonijak prolazi kroz prigušni ventil, gdje se prigušuje, što je praćeno smanjenjem temperature i tlaka. Zatim tečni amonijak niske temperature ulazi u hladnjak, gdje, primajući količinu topline (u postupku 5-1), isparava i hladi slanu otopinu, koja cirkulira u hlađenim komorama. Proces prigušivanja kao ireverzibilan proces prikazan je na dijagramu uslovne krive 4-5.
U instalaciji parnog kompresora ne koristi se ekspanzioni cilindar (ekspander), a radni fluid se prigušuje u kontrolnom ventilu. Zamjena ekspanzijskog cilindra sa prigušivačem je praćena povećanjem entropije, što uzrokuje određeni gubitak rashladnog kapaciteta, ali ova zamjena uvelike pojednostavljuje instalaciju i omogućava lako reguliranje tlaka pare i postizanje nepovratne temperature u hladnjaku.
Konkretan rad utrošen na ciklus: =
Rashladni koeficijent kompresora amonijaka:
Gdje je specifična količina topline koju percipira para amonijaka u hladnjaku.
Faktor hlađenja instalacije
Vrijednosti entalpije u jednadžbi su određene pomoću je-dijagram ili prema tabeli amonijaka.
Parne rashladne jedinice imaju veliku prednost u odnosu na hlađenje na zrak. Oni su kompaktni, jeftini i imaju veći COP.
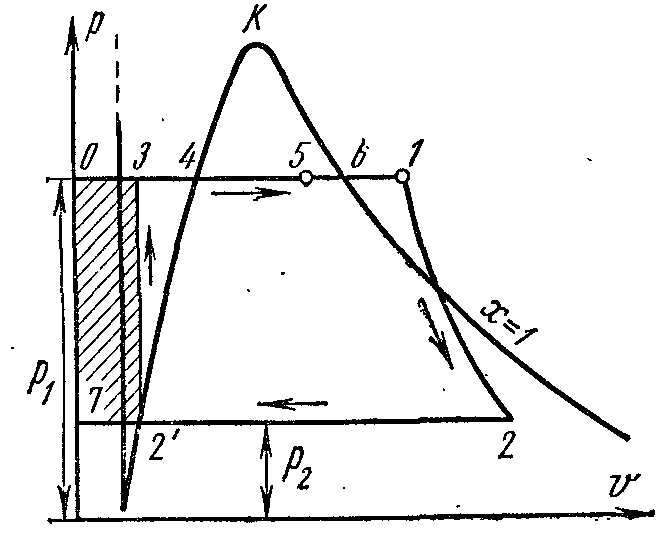
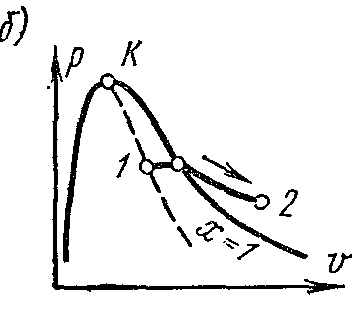
Proces isparavanja ustr – V dijagram
Faza pv- grafikon sistema koji se sastoji od tečnosti i pare je grafik zavisnosti specifičnih zapremina vode i pare od pritiska.
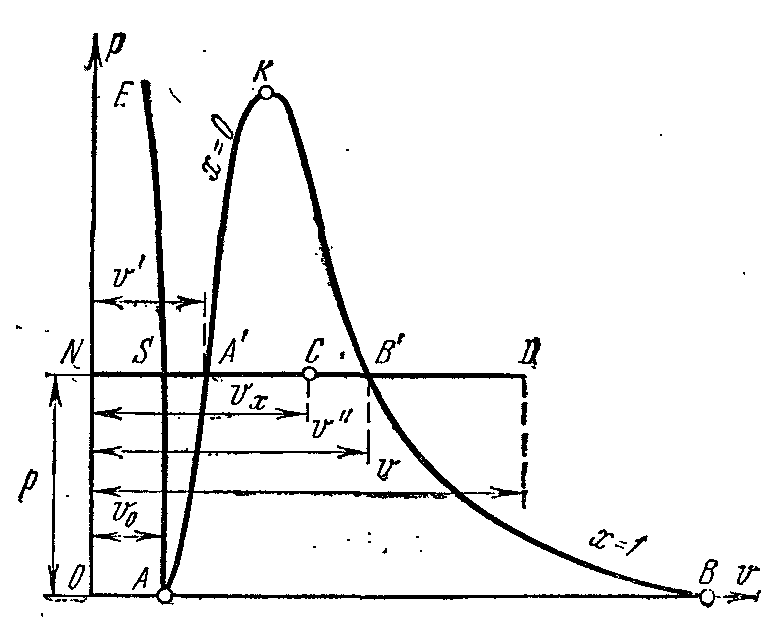
Pustite vodu na temperaturi 0 0 OD i neki pritisak? zauzima određeni volumen v 0 (segment NS) . Whole Curve AE izražava zavisnost specifične zapremine vode od pritiska na temperaturi 0 0 OD. Jer voda je supstanca gotovo nestišljiva od krive AE skoro paralelno sa y-osom. Ako se toplina predaje vodi pod konstantnim pritiskom, tada će njena temperatura porasti i specifični volumen će se povećati. Na nekoj temperaturi t s voda proključa, i njena specifična zapremina v’ u tački ALI' dostiže svoju maksimalnu vrijednost pri datom pritisku. Kako pritisak raste, temperatura tečnosti koja ključa raste. t s i volumen v’ takođe povećava. graf zavisnosti v’ AK koja se naziva granična kriva fluida. Karakteristika krivulje je stepen suvoće x=0 . U slučaju daljeg dovoda toplote pri konstantnom pritisku, započinje proces isparavanja. Istovremeno, količina vode se smanjuje, količina pare se povećava. Na kraju isparavanja u tački AT' para će biti suha i zasićena. Specifičan volumen suva zasićena para se označava v’’ .
Ako se proces isparavanja odvija pri konstantnom pritisku, tada se njegova temperatura ne mijenja i proces A’ B’ je i izobaričan i izotermičan. U tačkama A’ i B’ supstanca je u jednofaznom stanju. U srednjim točkama, tvar se sastoji od mješavine vode i pare. Ova mješavina tijela se zove dvofazni sistem.
Grafikon specifičnog volumena v’’ od pritiska je predstavljen krivom KV, koja se naziva granična kriva pare.
Ako se toplota dovodi do suhe zasićene pare pod konstantnim pritiskom, tada će se njena temperatura i zapremina povećati i para će preći iz suhe zasićene u pregrejanu (tačka D). Obe krive AK i HF podijelite dijagram na tri dijela. Lijevo od granične krivulje fluida AK tečno područje se nalazi prije nulte izoterme. Između krivina AK i HF postoji dvofazni sistem koji se sastoji od mješavine vode i suhe pare. desno od HF i gore od tačke To postoji područje pregrijane pare ili gasovitom stanju tijelo. Obe krive AK i HF konvergiraju u jednoj tački To nazvana kritična tačka.
Kritična tačka je krajnja tačka fazni prelaz tečnost - para, počevši od trostruke tačke. Iznad kritična tačka postojanje materije u dvofaznom stanju je nemoguće. Nijedna količina pritiska ne može pretvoriti gas u tečno stanje na temperaturama iznad kritičnih.
Parametri kritične tačke za vodu:
t to =374,12 0 IZ;v to =0,003147 m 3 /kg;
? to =22,115 MPa;i to =2095,2 kJ/kg
s to =4,424 kJ/(kg K).
Processtr = konst vodena para. Obradite sliku ustr – V , i – S iT – S dijagrami.
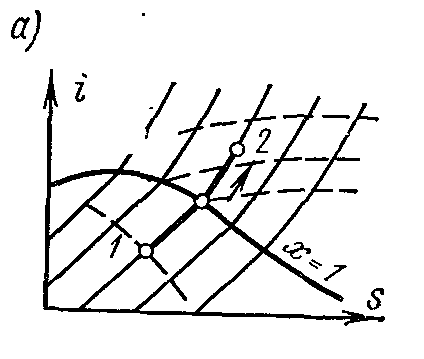
Na je- grafikon izobara u području zasićene pare predstavljena je pravom linijom koja prelazi granične krivulje parne tekućine. Kada se toplota dovede mokroj pari, njen stepen suvoće se povećava i (pri konstantnoj temperaturi) prelazi u suvu, a daljim dovodom toplote - u pregrijanu paru. Izobara u području pregrijane pare je kriva sa konveksnošću prema dolje.
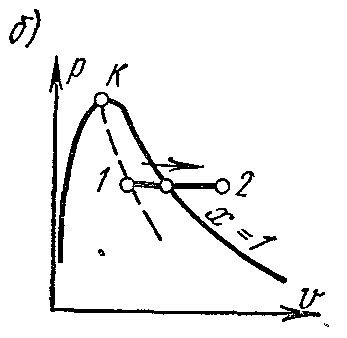
Na pv- grafikon izobarični proces je predstavljen segmentom horizontalne prave linije, koja u području vlažne pare istovremeno prikazuje i izotermni proces.
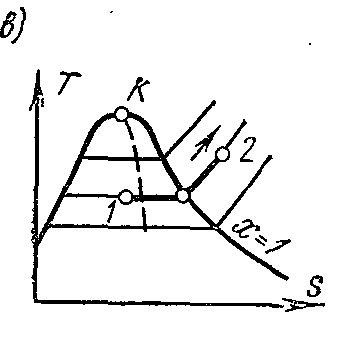
Na Ts- grafikon u području vlažne pare, izobara je prikazana ravnom horizontalnom linijom, a u području pregrijane pare krivuljom sa konveksnom tačkom prema dolje. Vrijednosti svih potrebnih količina za proračun uzimaju se iz tablica zasićenih i pregrijanih para.
Promjena specifične unutrašnje energije pare:
Vanjski rad:
Isporučena specifična količina topline:
U tom slučaju kada q dato i potrebno je pronaći parametre druge tačke, koja se nalazi u području dvofaznih stanja, primjenjuje se formula za entalpiju vlažne pare:
Proces T = konst vodena para. Obradite sliku ustr – V , i – S iT – S dijagrami.
izotermni proces.

Na je- grafikon u području vlažne pare, izoterma se poklapa sa izobarom i ravna je nagnuta linija. U području pregrijane pare, izoterma je predstavljena krivuljom s konveksnošću prema gore.
Na pv- grafikon u području vlažne pare, izotermni proces je predstavljen horizontalnom ravnom linijom. Za zasićenu paru ovaj proces se poklapa sa izobaričnim. U području pregrijavanja tlak pare opada, a proces je prikazan krivuljom s konveksnošću na os apscise.
![]()
Na Ts- grafikon izotermni proces je predstavljen horizontalnim segmentom.
Specifična unutrašnja energija vodene pare, za razliku od unutrašnje energije idealnog gasa, menja se kao rezultat promene potencijalne komponente, dakle, kada T=
konst
Zbrojna specifična količina toplote u procesu:
Vanjski rad je određen iz prvog zakona termodinamike:
Majerova formula.
Od posebnog značaja u termodinamici su toplotni kapaciteti gasa pri konstantnom pritisku, tj. u izobarnom procesu - i pri konstantnoj zapremini, tj. u izohornom procesu. Ovi toplotni kapaciteti povezani su Majerovom formulom
Odnos toplotnog kapaciteta
Gdje k je adijabatski indeks.
Koncept "koeficijenta hlađenja"
COP bezdimenzionalna količina (obično više od jednog), karakterišući energetsku efikasnost radarashladna mašina; jednak je omjerukapacitet hlađenjana količinu energije (rada) utrošene po jedinici vremena na implementaciju ciklus hlađenja. Određeno je tipom rashladnog ciklusa po kojem mašina radi, savršenstvom njenih glavnih elemenata, a za istu mašinu zavisi od temperaturnih uslova njenog rada.
Koeficijent performansi idealne rashladne mašine koja radi na obrnutom Carnot ciklusu:
gdje T min i T Max su, respektivno, niže i viša temperatura u ciklusu.
Koeficijent performansi zračnog hladnjaka (slika),
gdje T 1 i T 2 su temperature početka i kraja adijabatske kompresije, respektivno;
T 3
i T 4
su temperature početka i kraja adijabatskog širenja u ekspanderu.
str n i T n)
prema formuli
Ciklus gasnoturbinskog postrojenja sa regeneracijom
Toplotna efikasnost gasnih turbina sa sagorevanjem goriva pri str= konst povećava sa povećanjem pritiska. Međutim, s rastom se povećava i temperatura plinova na kraju sagorijevanja goriva. T 3 kao rezultat toga, lopatice i mlaznice turbine se brzo uništavaju, čije je hlađenje teško. Da bi povećali efikasnost gasnih turbina, delimično su promenili uslove rada. Instalacije su počele da koriste rekuperaciju toplote, višestepenu kompresiju vazduha u kompresoru, višestepeno sagorevanje itd. To je dalo značajan efekat i povećalo stepen savršenstva pretvaranja rada u toplotu u instalacijama.
Komprimovani vazduh iz turbopunjača 4 šalje se u regenerator 8 gde prima toplotu pod konstantnim pritiskom od gasova koji izlaze iz komore za sagorevanje 1 kroz mlaznicu 2 u turbinu 3. Zagrejani vazduh iz regeneratora 8 kroz mlaznicu 7, a gorivo iz pumpe za gorivo 5 kroz mlaznicu 6 šalje se u komoru za sagorevanje 1.
Idealan ciklus takve instalacije na dijagramima:

1-2 adijabatska kompresija zraka u kompresoru;
2-5 izobarično snabdevanje toplotom u regeneratoru;
5-3 dovod toplote pri konstantnom pritisku u komori za sagorevanje;
3-4 adijabatsko širenje produkata sagorevanja u mlaznicama turbine;
4-6 izobarično odvođenje toplote iz gasova u regeneratoru;
6-1 izobarično odvođenje topline iz plinova na izlazu iz regeneratora u hladnjak.
Ako pretpostavimo da se hlađenje gasova u regeneratoru dešava na temperaturu vazduha koji ulazi u njega, tj. od T 4 do T 6 =T 2 regeneracija je završena.
Termička efikasnost ciklusa pri punoj regeneraciji kada T 4
-T 6
=T 5
-T 2
nalazi se:
gdje
Temperature u glavnim tačkama ciklusa:
efikasnost ciklusa
Specifična potrošnja pare i toplote u termoelektranama
Prilikom proračuna parnoturbinskih postrojenja i pojedinih elemenata u njima potrebno je znati specifičnu potrošnju pare, označenu d.
Teoretska specifična potrošnja pare i toplote u kilogramima po 1 MJ:
Gdje i 1
i i 2
–entalpija, kJ/kg.
Teoretska specifična potrošnja pare i topline u kilogramima po 1 kWh:
Zagrevanje pare
Studija rada parnoturbinskog postrojenja pokazuje da povećanje početnog pritiska i smanjenje konačnog pritiska dovodi do povećanja efikasnosti ciklusa. Međutim, jedno povećanje početnog pritiska povećava konačni sadržaj vlage u pari. Za smanjenje vlažnosti pare na kraju ekspanzije povećajte početna temperatura njegov. Jedan od načina da se poveća stepen suhoće pare na izlazu iz turbine je njeno sekundarno pregrijavanje. Pregrijana para iz kotla sa početnim pritiskom i temperaturom ulazi u prvi turbinski cilindar, koji se sastoji od nekoliko stupnjeva, gdje se adijabatski širi do određenog tlaka. str 1 . Nastala para se odvodi u poseban pregrijač, gdje se podvrgava sekundarnom pregrijavanju pri konstantnom pritisku. Zatim se ponovo vraća u turbinu, gdje se para nastavlja širiti do tlaka kondenzatora.

Tačka 1 odgovara početnom stanju pare; tačka 2 - konačno stanje pare nakon turbine nakon sekundarnog pregrijavanja. Konačni stepen suhoće kao rezultat uvođenja podgrijavanja raste od x 2 prije x 1 . Osim toga, sekundarno pregrijavanje pare daje izvestan ekonomski efekat (2-3%) ako je prosječna temperatura dovoda topline u dodatnom ciklusu 7-2-2 '-6-7 viša prosječna temperatura dovod topline u ciklusu s jednim pregrijavanjem, a efekat će biti veći što je temperatura na početnoj i krajnjoj tački međupregrijavanja veća. Pri pritiscima blizu kritičnog i superkritičnog ponekad se koriste dva ili više međupregrijavanja. Zatim termička efikasnost ciklusa
Gdje je adijabatski pad topline u prvom i drugom cilindru turbine;
- količinu topline dovedene u kotao i prvi pregrijač;
Količina topline dovedena u drugi pregrijač.
Specifična potrošnja pare






