Udaljenost između molekula čvrstog stanja. Agregatna stanja materije. stanje agregacije u drugo
Pretraživanje cijelog teksta:
Fizika->Laboratorijski rad
Ako ste ikada pravili kolačiće i ostavili vrata svoje kuhinje otvorena, vjerovatno znate da se miris širi po cijeloj kući. Najjače je u kuhinji u kojoj se peku kolačići, nešto manje u trpezariji ili dnevnoj sobi, a najmanje u spavaćoj sobi na spratu. A ako su vrata u ugaonoj spavaćoj sobi zatvorena, miris kolačića je još slabiji.
Šta uzrokuje nasumično molekularno kretanje?
Kada se molekule kreću iz područja visoke koncentracije u područje niske koncentracije. utiče na brzinu difuzije. Kristali čvrste soli rastvoreni u vodi u cevima i šire se prema rezervoaru. Protok slatke vode istisnuo je slanu vodu iz rezervoara. U ovom mlazu vode pohranjena je sol.
Proučavanje procesa u električni krug With paralelna veza prijemnici koji sadrže induktivne i kapacitivne elemente, sa različitim omjerom...full>>
Fizika->Laboratorijski rad
Istraživanje utjecaja induktivnosti zavojnice na električne parametre jednofaznog sinusoidnog naponskog kola koje se sastoji od serijskog ... u potpunosti>>
U prirodi se supstance nalaze u
Kada je rastvoren u vodi, helijum ima veću difuziju od vazduha. 
Tečnosti nastaju kada se energija sistema poveća i kruta struktura čvrstog stanja se uništi. U tečnostima, molekuli se mogu kretati jedan za drugim i sudarati se sa drugim molekulima; međutim, oni ostaju relativno blizu jedno drugom, kao čvrsta tela. Često u tekućinama, međumolekularne sile drže molekule zajedno i brzo se razgrađuju. Kako temperatura tekućine raste, povećava se i broj kretanja pojedinih molekula.
Početna > Sažetak >Fizika
1 Održavanje……………………………………………………………………..2
2 Glavno tijelo
2.1 Struktura tečnosti. Kretanje molekula tečnosti………3
2.2 Pritisak u tečnosti………………………………………….4
2.3 Arhimedov zakon ……………………………………………….5
2.4 Isparavanje…………………………………………………………………6
Kao rezultat toga, tekućine mogu "teći" da poprime oblik svog spremnika, ali se ne mogu lako komprimirati jer su molekuli već blizu jedan drugom. Dakle, tekućine imaju neodređeni oblik, ali određeni volumen. U primjeru animacije u nastavku vidimo da se tekuća voda sastoji od molekula koje se mogu slobodno kretati jedna pored druge, ali ostaju relativno blizu na udaljenosti jedna od druge.

Gasovi nastaju kada energija u sistemu premašuje sve privlačne sile između molekula. Dakle, molekuli plina malo komuniciraju jedni s drugima, osim što se povremeno sudaraju. U plinovitom stanju, molekuli se brzo kreću i kreću se slobodno u bilo kojem smjeru, šireći se na velike udaljenosti. Kako temperatura plina raste, povećava se i broj kretanja pojedinih molekula. Plinovi se šire kako bi napunili svoje posude i imaju nisku gustinu.
2.5 Kuvanje………………………………………………………….7
2.6 Površinski napon tečnosti………………………………….8
2.7 Tečni filmovi………………………………………………………9
2.8 Vlaženje i nekvašenje………………………………….10
2.9. Kapilarni fenomeni…………………………………………..12
2.10 Struja u tečnostima…………………………..13
3 Zaključak…………………………………………………………………..14
Koeficijent proporcionalnosti k naziva se elektrohemijski ekvivalent supstance. Numerički je jednaka masi supstance koja se oslobađa tokom prolaska jednog električnog naboja kroz elektrolit, a zavisi od hemijske prirode supstance.
Pošto su pojedinačni molekuli široko razdvojeni i mogu se lako kretati u gasovitom stanju, gasovi se lako kompresuju i imaju neodređeni oblik. Čvrste materije, tečnosti i gasovi su najčešća stanja materije koja postoje na našoj planeti. Obratite pažnju na razlike u molekularnom kretanju molekula vode u ova tri stanja.
Reference………………………………………………………16
1. Uvod
AT Svakodnevni život obično se susrećemo sa tri fazna stanja materije – čvrsto, tečno i gasovito. Imamo prilično jasnu ideju o strukturi plinova i čvrstih kristalnih tijela. Gas je skup molekula koji se nasumično kreću u svim smjerovima neovisno jedan o drugom. U čvrstom tijelu, svi molekuli zadržavaju svoj međusobni raspored dugo vremena, praveći samo male oscilacije oko određenih ravnotežnih položaja.

Plazma je vrući jonizovani gasovi. Plazma se formira u uslovima izuzetno visoke energije, toliko visoke da se molekuli raspadaju i postoje samo slobodni atomi. Što je još upečatljivije, plazma ima toliko energije da se vanjski elektroni zapravo odvajaju od pojedinačnih atoma, formirajući tako plin visokoenergetskih nabijenih jona. Budući da atomi u plazmi postoje kao nabijeni joni, plazma se ponaša drugačije od plinova, što je četvrto stanje materije.
U ovom eseju fokusiraću se na detaljnije razmatranje tečnog stanja materije. Glavna karakteristika Ovo stanje agregacije je da tečno stanje, koje zauzima međupoziciju između gasova i kristala, kombinuje neka svojstva oba ova stanja. Konkretno, za tekućine, kao i za kristalna tijela, karakteristično je prisustvo određenog volumena, a istovremeno tekućina, poput plina, poprima oblik posude u kojoj se nalazi. Većina ljudi misli da tečnosti nemaju svoj oblik. Ali to nije istina. Prirodni oblik bilo koje tečnosti je kugla. Obično gravitacija sprječava tečnost da poprimi ovaj oblik, tečnost se ili širi u tankom sloju po površini, ili pak poprima oblik posude ako se ulije u nju.
Plazma se može pogledati jednostavnim pogledom prema gore; uslovi visoke energije koji postoje u zvijezdama kao što je naše Sunce tjeraju pojedinačne atome u stanje plazme. Imaju neodređeni oblik i šire se kako bi ispunili svoj spremnik.
Kao što smo vidjeli, povećanje energije rezultira više molekularnog kretanja. Suprotno tome, smanjenje energije dovodi do manjeg kretanja molekula. Kao rezultat, jedno predviđanje kinetike molekularna teorija je da ako nastavimo da smanjujemo energiju materije, doći ćemo do tačke u kojoj prestaje svako molekularno kretanje. Temperatura na kojoj prestaje kretanje molekula naziva se apsolutna nula i izračunava se kao -15 stepeni Celzijusa. Dok naučnici hlade supstance na temperature blizu apsolutna nula, nikada nisu dostigli apsolutnu nulu.
Srednji položaj tečnosti je zbog činjenice da je tečno stanje posebno složeno po svojim svojstvima. Iako su tečnosti bile predmet naučnog proučavanja još od vremena Arhimeda, odnosno pre 2200 godina, analiza ponašanja tečnosti i dalje je jedno od najtežih oblasti primenjene nauke. Do sada ne postoji potpuno potpuna i opšteprihvaćena teorija tečnosti.
Poteškoća sa posmatranjem materije na apsolutnoj nuli je u tome što je potrebna svetlost da bi "videla" materiju, a sama svetlost prenosi energiju materiji, podižući na taj način temperaturu. Uprkos ovim izazovima, naučnici su nedavno uočili peto stanje materije koje postoji samo na temperaturama vrlo blizu apsolutne nule.
Bose-Einstein kondenzati predstavljaju peto stanje materije, prvi put uočeno u B-E kondenzatima, su plinovite superfluidne tekućine ohlađene na temperature vrlo blizu apsolutne nule. U ovom čudnom stanju, svi atomi kondenzata dostižu isto kvantno mehaničko stanje i mogu teći jedan protiv drugog bez trenja.
2 .Glavni dio.
Da bi se razumjela osnovna svojstva i zakonitosti tečnog stanja tvari, potrebno je razmotriti sljedeće aspekte:
2.1 Struktura tečnosti. Kretanje molekula tečnosti.
Tečnost je nešto što može da teče.
U rasporedu tečnih čestica primećuje se takozvani poredak kratkog dometa. To znači da je u odnosu na bilo koju česticu uređena lokacija njenih najbližih susjeda. Međutim, kako se neko udaljava od date čestice, raspored ostalih čestica u odnosu na nju postaje sve manje uređen i vrlo brzo red u rasporedu čestica potpuno nestaje. Molekuli tekućine kreću se mnogo slobodnije od čvrstih molekula, iako ne tako slobodno kao molekuli plina. Svaki molekul tečnosti se neko vreme kreće ovamo i tamo, ne udaljujući se, međutim, od svojih suseda. Ali s vremena na vrijeme molekul tekućine izbije iz svog okruženja i odlazi na drugo mjesto, upadajući u novo okruženje, gdje opet neko vrijeme čini pokrete slične oscilaciji. Značajne zasluge u razvoju niza problema u teoriji tečnog stanja pripadaju sovjetskom naučniku Ya. I. Frenkelu. Prema Frenkelu, toplotno kretanje u tečnostima ima sledeći karakter. Svaki molekul neko vrijeme oscilira oko određene ravnotežne pozicije. S vremena na vrijeme, molekul mijenja svoje mjesto ravnoteže, skačući na novu poziciju, odvojenu od prethodne udaljenosti reda veličine samih molekula. Odnosno, molekuli se samo polako kreću unutar tečnosti, zadržavajući se deo vremena u blizini određenih mesta.Tako je kretanje molekula tečnosti nešto poput mešavine kretanja u čvrstom i u gasu: oscilatorno kretanje na jednom mestu se zamenjuje slobodnim prelaskom sa jednog mesta na drugo.
Nekoliko drugih manje uobičajenih stanja materije je također bilo opisano ili stvarno opaženo. Neka od ovih stanja uključuju tekuće kristale, fermionske kondenzate, superfluide, superčvrste tvari i prikladno nazvanu čudnu supstancu. Pročitajte više o ovim fazama u odjeljku Faze naših resursa za ovaj modul.
Transformacija jednog stanja materije u drugo stanje se naziva fazni prelaz. Voda se ponaša drugačije od većine drugih hemijska jedinjenja. U gotovo svim supstancama, atomi i molekuli se približavaju jedni drugima kako postaju hladniji. Voda, međutim, dostiže najveću gustinu na četiri stepena Celzijusa jer se molekuli vode najbliže zbijaju na toj temperaturi. Mnoga slatkovodna jezera imaju četiri stepena Celzijusa na najdubljoj tački jer teška voda tone na dno.
2.2 Pritisak u tečnosti
Svakodnevno iskustvo nas uči da tečnosti djeluju poznatim silama na površini. čvrste materije u kontaktu sa njima. Ove sile se nazivaju sile pritiska fluida.
Prekrivajući prstom otvor otvorene slavine, osjećamo snagu pritiska tečnosti na prst. Bol u ušima kod plivača koji roni na velike dubine uzrokovan je silama pritiska vode na bubnu opnu. Dubinski termometri moraju biti vrlo jaki da ih pritisak vode ne može zgnječiti.
Ima oblik posude i potpuno se ispunjava
Ali iznenađujuće, da bi došli do čvrste faze leda, molekuli vode se ponovo kreću dalje. Ovaj fenomen se naziva anomalija vode. Led je lakši i lebdi na površini. To se može vidjeti u velikim oceanskim područjima na polarnim geografskim širinama, djelomično prekrivenim ledom. Razlog za ovu anomaliju leži u neobičnim svojstvima molekule vode. Njegov atom kisika i dva atoma vodika su raspoređeni asimetrično. Ovo stvara dipol, molekul s jednim negativnim i jednim pozitivnim krajem. Ovisno o temperaturi, ovi dipoli se redaju u agregate u skladu sa svojim nabojem, na primjer, tokom formiranja kristala leda.
Pritisak u tekućini nastaje zbog promjene njenog volumena - kompresije. U odnosu na promjenu zapremine, tečnosti imaju elastičnost. Sile elastičnosti u fluidu su sile pritiska. Dakle, ako fluid djeluje silama pritiska na tijela u dodiru s njom, to znači da je sabijena. Budući da se gustina supstance povećava tokom kompresije, može se reći da tečnosti imaju elastičnost u odnosu na promenu gustine.
Dipolna priroda vode je kritičan faktor za klimu. Budući da vodeni dipoli imaju tendenciju da se drže zajedno kao mali magneti, voda sporo reaguje na zagrijavanje ili hlađenje. U stvari, voda ima najveći toplinski kapacitet od svih tekućina i čvrste materije osim amonijaka. To znači da voda može apsorbirati mnogo topline prije nego što proključa. I tačke smrzavanja i ključanja vode, tako veliki dio našeg svakodnevnog života, zaista su prilično neobične.
Ako bi molekul vode bio simetričan, tada se voda topi na minus 110 stepeni Celzijusa i ključa na minus 80 stepeni. Klimatska inercija je rezultat pre svega velikog toplotnog kapaciteta vode. Voda utiče na klimu ne samo u tekućem i čvrstom stanju. Osim toga, pojačava utjecaj drugih tvari na klimu. Na primjer, ako temperatura poraste kao rezultat više visoki nivoi ugljičnog dioksida, sadržaj vodene pare se također povećava jer toplija atmosfera može održivo zadržati više vodene pare.
Pritisak u tečnosti je okomit na bilo koju površinu koja se nalazi u tečnosti. Pritisak u tečnosti na dubini h jednak je zbiru pritiska na površini i vrednosti proporcionalne dubini:
Zbog činjenice da tekućine mogu prenijeti statički pritisak, praktički ne manji od svoje gustine, mogu se koristiti u uređajima koji daju dobitak u čvrstoći: hidrauličnoj presi.
Zbog svoje dipolne molekule, voda veoma efikasno apsorbuje infracrveno zračenje. Kao rezultat, ovo otprilike udvostručuje curenje koje je izvorno uzrokovano ugljičnim dioksidom. Još jedno važno svojstvo vode je njena sposobnost rastvaranja soli, što značajno mijenja njenu gustinu. Prosječan salinitet okeana je 7 promila. Sa ovom mineralizacijom, voda ima najveća gustina minus 8 stepeni Celzijusa, što je ispod tačke smrzavanja morske vode srednjeg saliniteta. Ovo je, u stvari, minus 9 stepeni Celzijusa.
Stoga, površinsko hlađenje može uzrokovati konvekciju da formira led. Ova karakteristika gustine je motor konvekcije, jedan od najvažnijih elemenata klimatskog sistema; hladna, slana voda je teška i tone na velike dubine.
2.3. Arhimedov zakon
Na površinu čvrstog tijela uronjenog u tekućinu djeluju sile pritiska. Pošto pritisak raste sa dubinom, sile pritiska prema gore na dnu fluida su veće od sila koje se spuštaju na vrh, i možemo očekivati da će rezultanta sila pritiska biti nagore. Rezultirajuća sila pritiska na tijelo uronjeno u tekućinu naziva se sila potpore tekućine.
Zamijenjuje ga voda koja teče po površini mora. 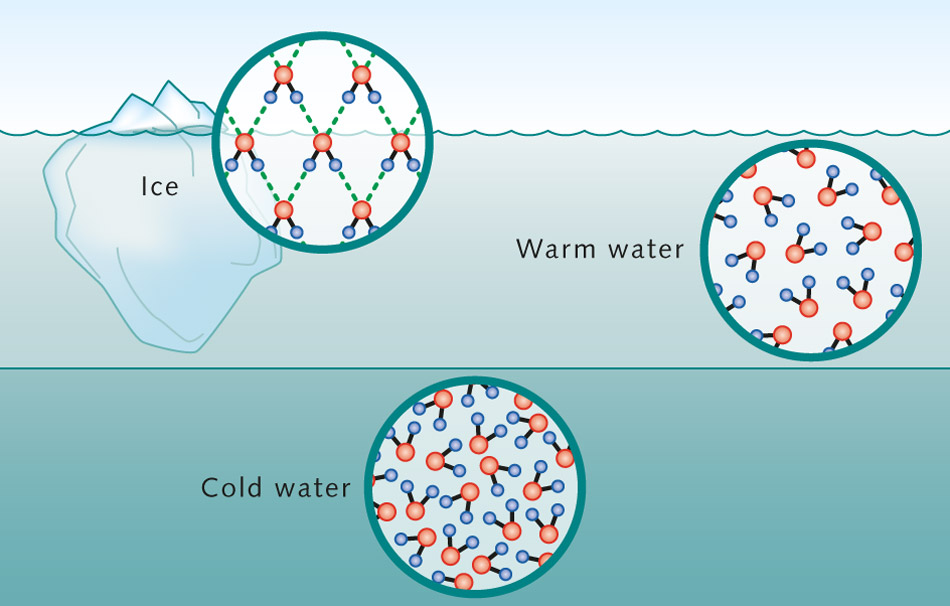
Zbog toga se ponaša drugačije od ostalih supstanci. Led je manje gust i lebdi na površini. Svježa voda ima najveću gustinu od četiri stepena i tone na dno. Zatim se prelije toplom vodom. Slana voda ima različite karakteristike.
Agregatno stanje u drugo
Stari vitraji su deblji nego gore. Vjekovima staklo polako teče, turiste su poučavali turisti širom svijeta. Na kraju krajeva, čaše su u osnovi tekućine, iako vrlo viskozne. Od objavljivanja u majskom izdanju American Journal of Physics, ova tvrdnja je sada opovrgnuta. Iako se staklo proizvodi vekovima, još uvek ga nema kompletna teorija, što konačno objašnjava razvoj stakla. Prije svega, tvornice stakla koriste iskustvo i metode koje su usavršene pokušajima i greškama.
Ako je tijelo uronjeno u tekućinu prepušteno samo sebi, ono će potonuti, ostati u ravnoteži ili isplivati na površinu tekućine, ovisno o tome da li je potporna sila manja od sile gravitacije koja djeluje na tijelo, jednaka ili veće od njega.
Arhimedov princip kaže da je tijelo u fluidu izloženo sili uzgona koja je jednaka težini istisnutog fluida. Telo uronjeno u tečnost podleže sili uzgona (koja se zove Arhimedova sila)
Naučnici se tek nekoliko decenija zanimaju za svojstva naočara. Nema deformacije Za provjeru složena istorija spuštajući crkvene prozore, brazilski fizičar Edgar Dutra Zanotto proučavao je ponašanje starih i novih naočara kada različite temperature. Njegov rezultat: srednjovjekovni spektakli mogli su pobjeći tokom posljednjih 800 godina, što sugerira da su se u to vrijeme crkve neprekidno zagrijavale na 400 stepeni Celzijusa. Na sobnoj temperaturi, čaše traju milionima godina. Stoga ni najstarije vaze u muzejima ne pokazuju deformacije.
Staklo, ovaj jedva istražen materijal, razlikuje se od većine drugih čvrstih materijala po svom "amorfnom" stanju. Atomi nisu raspoređeni u pravilnu rešetku kao kristal. Umjesto toga, oni čine haotičnu trodimenzionalnu mrežu. Ovo takozvano staklasto stanje nastaje kada je tekućina, vruća vruća mješavina kvarcnog pijeska i soli alkalni metali brzo se hladi znatno ispod svoje tačke topljenja. Za razliku od stakla, molekuli većine tečnosti spontano se ređaju na tački topljenja u kristalnu rešetku.
gdje je ρ gustina tečnosti (gasa), je ubrzanje slobodan pad, a V- zapremina potopljenog tijela (ili dio zapremine tijela ispod površine).
Ako je tijelo uronjeno u tekućinu okačeno na vagu, tada vaga pokazuje razliku između težine tijela u zraku i težine istisnute tekućine. Stoga se Arhimedovom zakonu ponekad daje sljedeća formulacija: tijelo uronjeno u tečnost gubi na svojoj težini onoliko koliko teži tečnost koju istisne.
Zanimljivo je primijetiti takvu eksperimentalnu činjenicu da je unutar druge tekućine veće specifična gravitacija, tečnost prema Arhimedovom zakonu "gubi" svoju težinu i poprima svoj prirodni, sferni oblik.
2.4 Isparavanje
U površinskom sloju i blizu površine tečnosti deluju sile koje obezbeđuju postojanje površine i ne dozvoljavaju molekulima da napuste zapreminu tečnosti. Zbog termičkog kretanja, neki od molekula imaju dovoljno velike brzine da savladaju sile koje drže molekule u tekućini i napuste tekućinu. Ova pojava se zove isparavanje. Uočava se na bilo kojoj temperaturi, ali njegov intenzitet raste s porastom temperature.
Ako se molekuli koji su napustili tečnost uklone iz prostora blizu površine tečnosti, tada će na kraju sva tečnost ispariti. Ako se molekuli koji su napustili tečnost ne uklone, formiraju paru. Molekuli pare koji su pali u područje blizu površine tečnosti uvlače se u tečnost silama privlačenja. Ovaj proces se naziva kondenzacija.
Dakle, ako se molekuli ne uklone, brzina isparavanja se smanjuje s vremenom. Daljnjim povećanjem gustine pare dolazi se do situacije da će broj molekula koji napuštaju tečnost u određenom vremenu biti jednak broju molekula koji se u isto vreme vraćaju u tečnost. Dolazi do stanja dinamičke ravnoteže. Para u stanju dinamičke ravnoteže s tekućinom naziva se zasićena.
Sa povećanjem temperature, gustine i pritiska zasićena para povećati. Što je temperatura viša, veći broj molekula tečnosti ima dovoljno energije da ispari, a gustina pare mora biti veća da bi kondenzacija bila jednaka isparavanju.
2.5 Kuvanje
Kada se tečnost zagreje na temperaturu na kojoj je pritisak zasićene pare jednak vanjskom pritisku, uspostavlja se ravnoteža između tečnosti i njenog zasićena para. Kada se tečnosti prenese dodatna količina toplote, odgovarajuća masa tečnosti se odmah pretvara u paru. Ovaj proces se zove ključanje.
Vrenje je intenzivno isparavanje tečnosti, koje se dešava ne samo sa površine, već u celom njenom volumenu, unutar nastalih mjehurića pare. Da bi prešli iz tečnosti u paru, molekuli moraju steći energiju potrebnu da savladaju privlačne sile koje ih drže u tečnosti. Na primjer, za isparavanje 1 g vode na temperaturi od 100 ° C i tlaku koji odgovara atmosferskom tlaku na nivou mora, potrebno je potrošiti 2258 J, od čega 1880 odlazi na odvajanje molekula od tekućine, a ostatak odlazi da radi na povećanju zapremine koju zauzima sistem, protiv sila atmosferskog pritiska (1 g vodene pare na 100°C i normalnom pritisku zauzima zapreminu od 1,673 cm 3, dok je 1 g vode pod istim uslovima samo 1,04 cm 3 ).
Tačka ključanja je temperatura na kojoj tlak pare postaje jednak vanjskom pritisku. Kako pritisak raste, tačka ključanja se povećava, a kako se pritisak smanjuje, ona se smanjuje.
Usled promene pritiska u tečnosti sa visinom njenog stuba, ključanje na različitim nivoima u tečnosti nastaje, strogo govoreći, na različitim temperaturama. Samo zasićena para iznad površine kipuće tekućine ima određenu temperaturu. Njegova temperatura je određena samo vanjskim pritiskom. Na ovu temperaturu se misli kada se govori o tački ključanja.
Tačke ključanja različitih tekućina međusobno su vrlo različite, a to se široko koristi u tehnologiji, na primjer, u destilaciji naftnih derivata.
Količina topline koja se mora unijeti da bi se određena količina tekućine izotermno pretvorila u paru, pri vanjskom pritisku jednakom pritisku njenih zasićenih para, naziva se latentna toplina isparavanja. Obično se ova vrijednost odnosi na jedan gram ili jedan mol. Količina topline potrebna za izotermno isparavanje mola tekućine naziva se molarna latentna toplota isparavanje. Ako se ova vrijednost podijeli s molekulskom težinom, onda će se dobiti specifična latentna toplina isparavanja.
2.6 Površinski napon tečnosti
Svojstvo tečnosti da svoju površinu svede na minimum naziva se površinska napetost. Površinska napetost je fenomen molekularnog pritiska na tečnost, uzrokovan privlačenjem molekula površinskog sloja na molekule unutar tečnosti. Na površini tekućine, molekuli doživljavaju sile koje nisu simetrične. Na molekul unutar tečnosti, u prosjeku, sila privlačenja, kohezije, djeluje u prosjeku jednoliko sa svih strana. Ako se površina tekućine poveća, tada će se molekuli kretati protiv djelovanja sila zadržavanja. Dakle, sila koja teži skraćivanju površine tekućine djeluje u suprotnom smjeru od vanjske vlačne sile na površini. Ova sila se naziva sila površinskog napona i izračunava se po formuli:
 - koeficijent površinskog napona
- koeficijent površinskog napona
 (
( )
)
 - dužina granice površine tečnosti
- dužina granice površine tečnosti
Imajte na umu da lako isparljive tekućine (etar, alkohol) imaju nižu površinsku napetost od nehlapljivih tekućina (živa). Površinski napon tečnog vodonika i posebno tečnog helijuma je veoma nizak. Za tečne metale površinski napon naprotiv, veoma je velika. Razlika u površinskom naponu tečnosti objašnjava se razlikom u kohezionim silama različitih molekula.
Mjerenja površinskog napona tekućine pokazuju da površinski napon ne ovisi samo o prirodi tekućine, već i o njenoj temperaturi: s povećanjem temperature razlika u gustoći tekućine opada, a samim tim i koeficijent površinske napetosti smanjuje - .
Zbog površinske napetosti, bilo koji volumen tekućine teži smanjenju površine, čime se smanjuje potencijalna energija. Površinska napetost je jedna od elastičnih sila odgovornih za kretanje talasa na vodi. U ispupčenjima, površinska gravitacija i površinska napetost povlače čestice vode prema dolje, težeći da površina ponovo bude glatka.
2.7 Tečne folije
Svi znaju kako je lako izvući pjenu iz vode sa sapunom. Pjena je skup mjehurića zraka ograničenih najtanjim filmom tekućine. Od tečnosti koja stvara pjenu lako se može dobiti poseban film.
Ovi filmovi su veoma interesantni. Mogu biti izuzetno tanke: u najtanjim dijelovima njihova debljina ne prelazi stohiljaditi dio milimetra. Uprkos svojoj mršavosti, ponekad su veoma stabilne. Film sapuna se može rastegnuti i deformirati, a mlaz vode može teći kroz film sapuna, a da ga ne uništi.
Kako se može objasniti stabilnost filmova? Neophodan uslov za formiranje filma je dodavanje u čistu tečnost u njemu rastvorljivih supstanci, štoviše, onih koje uvelike smanjuju površinsku napetost
U prirodi i tehnologiji obično se ne susrećemo sa pojedinačnim filmovima, već sa kolekcijom filmova - penom. Često možete vidjeti u potocima, gdje mali potoci padaju u mirnu vodu, obilno stvaranje pjene. U ovom slučaju, sposobnost vode da se pjeni povezana je s prisutnošću u vodi posebne organske tvari koja se oslobađa iz korijena biljaka. U građevinskoj opremi koriste se materijali koji imaju ćelijsku strukturu, poput pjene. Takvi materijali su jeftini, lagani, ne provode dobro toplinu i zvuk i dovoljno su jaki. Za njihovu proizvodnju otopinama od kojih se formiraju građevinski materijali dodaju se tvari koje potiču pjenjenje.
2.8 Vlaženje
Male kapljice žive stavljene na staklenu ploču poprimaju sferni oblik. To je rezultat molekularnih sila koje teže smanjenju površine tekućine. Živa postavljena na površinu čvrste tvari ne formira uvijek okrugle kapljice. Širi se po cinčanoj ploči, a ukupna površina kapi će se nesumnjivo povećati.
Kap anilina je također sferna samo kada ne dodiruje zid staklene posude. Čim dodirne zid, odmah se zalijepi za staklo, protežući se duž njega i dobivajući veliku zajedničku površinu.
To se objašnjava činjenicom da u slučaju kontakta s čvrstim tijelom, sile adhezije molekula tekućine s molekulima čvrstog tijela počinju igrati značajnu ulogu. Ponašanje tekućine ovisit će o tome što je veće: adhezija između tekućih molekula ili adhezija molekula tekućine na čvrsti molekul. U slučaju žive i stakla, kohezivne sile između žive i staklenih molekula su male u poređenju sa silama kohezije između molekula žive, a živa se skuplja u kapi. Takva tečnost se zove nekvašenje solidan. U slučaju žive i cinka, kohezivne sile između molekula tečnosti i čvrste supstance premašuju kohezione sile koje deluju između molekula tečnosti, a tečnost se širi preko čvrste supstance. U ovom slučaju, tečnost se zove vlaženje solidan.
Iz ovoga proizilazi da, govoreći o površini tečnosti, treba imati u vidu ne samo površinu na kojoj tečnost graniči sa vazduhom, već i površinu koja graniči sa drugim tečnostima ili sa čvrstim telom.
U zavisnosti od toga da li tečnost vlaži zidove posude ili ne, oblik površine tečnosti na mestu kontakta sa čvrstim zidom i gasom ima ovaj ili onaj oblik. U slučaju nekvašenja, oblik površine tekućine na rubu je okrugao, konveksan. U slučaju vlaženja, tečnost na ivici poprima konkavni oblik.
2.9.Kapilarni fenomeni.
U životu se često suočavamo s tijelima probijenim mnogim malim kanalima (papir, pređa, koža, razni građevinski materijali, zemlja, drvo). Dolazeći u kontakt sa vodom ili drugim tečnostima, takva tela ih često apsorbuju. To je osnova za djelovanje peškira pri sušenju ruku, djelovanje fitilja u petrolejskoj lampi itd. Slične pojave se mogu uočiti i u uskim staklenim cijevima. Uske cijevi se nazivaju kapilarne ili dlake.
Kada se takva cijev jednim krajem uroni u široku posudu u široku posudu, događa se sljedeće: ako tečnost navlaži zidove cijevi, tada će se ona podići iznad nivoa tekućine u posudi i, osim toga, što je više, što je cijev uža; ako tečnost ne vlaži zidove, tada je, naprotiv, nivo tečnosti u cevi niži nego u širokoj posudi. Promena visine nivoa tečnosti u uskim cevima ili prazninama naziva se kapilarnost. U širem smislu, pod kapilarnim fenomenima se podrazumijevaju sve pojave zbog postojanja površinske napetosti.
Visina podizanja tečnosti u kapilarnim cevima zavisi od radijusa kanala u cevi, površinskog napona i gustine tečnosti. Između tečnosti u kapilari i u širokoj posudi uspostavlja se takva razlika nivoa h tako da hidrostatički pritisak gh uravnotežuje kapilarni pritisak:
gdje je površinski napon tečnosti
R je radijus kapilare.
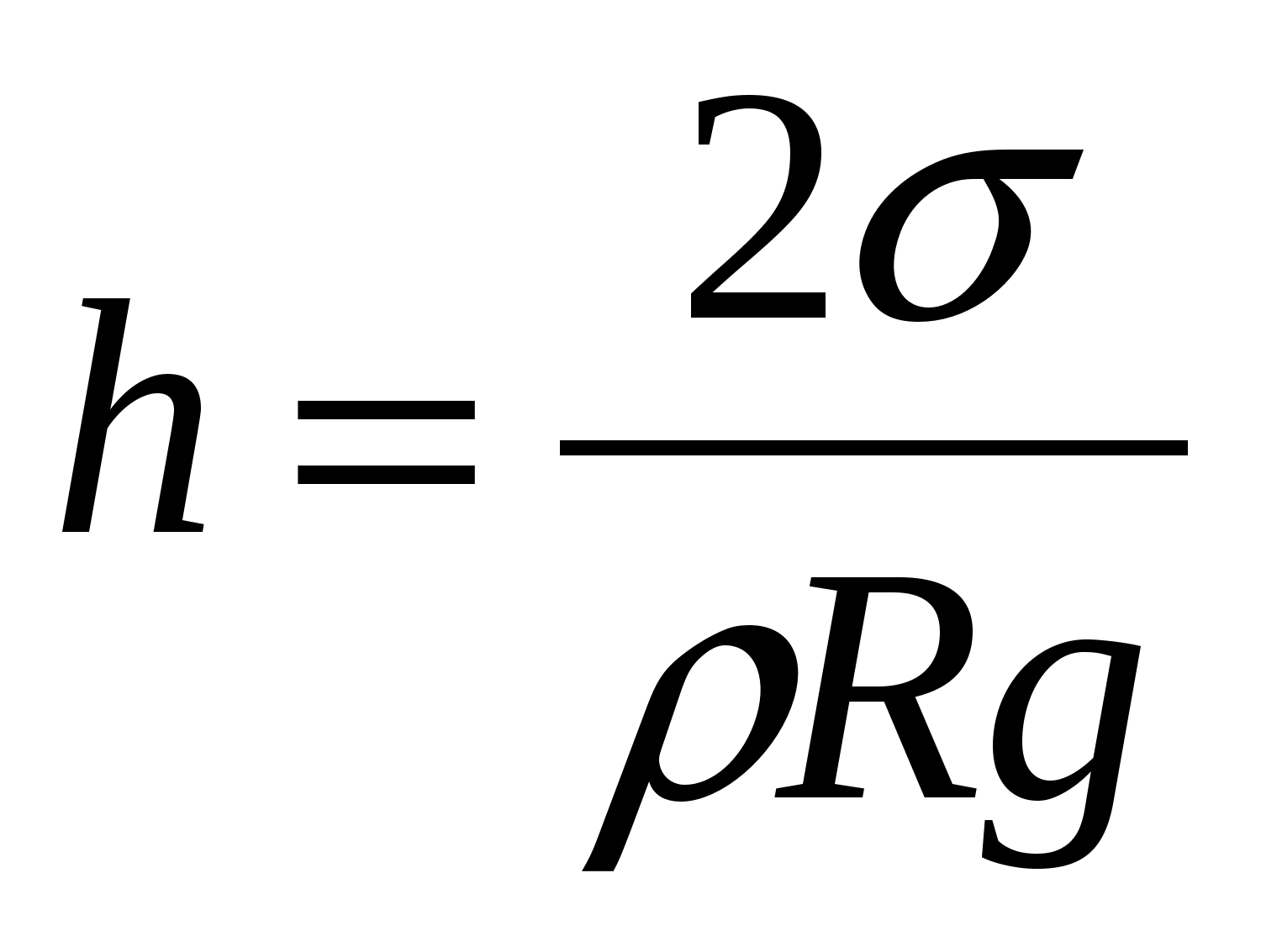
Visina podizanja tečnosti u kapilari proporcionalna je njenoj površinskoj napetosti i obrnuto proporcionalna poluprečniku kapilarnog kanala i gustini tečnosti (Jurinov zakon)
2.10 Električna struja u tekućinama.
Čiste tekućine ne provode električnu struju, odnosno one su dielektrici, jer je svaki od molekula tekućine neutralan i ne kreće se u električnom polju.
Tečnosti koje provode električnu energiju nazivaju se elektroliti. Električna struja u tekućinama nastaje kao rezultat usmjerenog kretanja iona soli. Fenomen oslobađanja tvari na elektrodama kada struja prođe kroz elektrolit naziva se elektroliza. Na negativno nabijenoj elektrodi katoda dolazi do elektrohemijske redukcije čestica (atoma, molekula, katjona), a na pozitivno naelektrisanoj elektrodi - anoda dolazi do elektrohemijske oksidacije čestica (atoma, molekula, anjona). Godine 1832. Faraday je otkrio da je masa M tvari oslobođene na elektrodi direktno proporcionalna električnom naboju Q koji je prošao kroz elektrolit:
ako se propušta kroz elektrolit neko vrijeme t D.C. sa strujom I.
Koeficijent proporcionalnosti k naziva se elektrohemijski ekvivalent supstance. Numerički je jednaka masi supstance koja se oslobađa tokom prolaska jednog električnog naboja kroz elektrolit, a zavisi od hemijske prirode supstance.
Drugi Faradejev zakon kaže: Elektrohemijski ekvivalenti različitih supstanci tretiraju se kao njihovi hemijski ekvivalenti. Hemijski ekvivalent jona je omjer molarne mase A jona i njegove valencije z. Dakle, elektrohemijski ekvivalent je:
![]() ,
,
gdje je F Faradejeva konstanta
Fenomen elektrolize se široko koristi u modernoj industriji. Konkretno, elektroliza je jedna od metoda za industrijsku proizvodnju vodika, kao i natrijum hidroksida, hlora, organoklornih jedinjenja, mangan-dioksida i vodikovog peroksida. Veliki broj metala se ekstrahuje iz ruda i obrađuje elektrolizom (elektroekstrakcija, elektrorafinacija). Elektroliza se koristi za tretman otpadnih voda (elektrokoagulacija, elektroekstrakcija, elektroflotacija).
3. Zaključak
Prema tome, tečnost je međustanje materije između čvrstog i gasovitog stanja. To uzrokuje da tekućine imaju svojstva karakteristična i za čvrsta i za plinovita stanja. Upečatljiv primjer stanja materije, kombinujući svojstva tečnosti i čvrsta stanja, su tekući kristali koji se široko koriste u industriji i tehnologiji (displeji s tekućim kristalima). S tim u vezi, opis stanja tečnosti zahteva sintezu matematičkih metoda koje se koriste za opisivanje čvrstog i gasovitog stanja, što otežava i otežava detaljno opisivanje mnogih fizičkih i hemijskih pojava.
Danas se mnoga svojstva tečnosti široko koriste u industriji i tehnologiji. Na primjer, svojstvo tekućine da povećava tlak u cijeloj svojoj zapremini koristi se u hidrauličnim strojevima za dizanje. Ali potrebno je i dalje duboko proučavanje teorije tekućeg stanja materije. Dakle, relevantnost proučavanja toka kipuće tekućine povezana je sa zahtjevima nuklearne energije, sa problemom sigurnosti elektrana.
Posebno interesovanje za proučavanje fizičko-hemijskih procesa u tečno stanje zbog činjenice da smo sami 90% voda, najčešća tečnost na Zemlji. I svi vitalni procesi u životinji i flora nastaju u tečnosti, odnosno vodi. Stoga je proučavanje ovog stanja materije važno i relevantno za sve ljude.
Bibliografija:
I.V. Savelyev "Kurs opšte fizike"
Cl.E. Swartz "Izvanredna fizika običnih pojava"
Osnovni udžbenik fizike, priredio akademik G.S. Landsberg
T.I. Trofimov "Kurs fizike"
JA I. Perelman "Zabavna fizika"
Raspored molekula u čvrstim materijama. U čvrstim tijelima, udaljenosti između molekula jednake su veličini molekula, tako da čvrste tvari zadržavaju svoj oblik. Molekuli su raspoređeni u određenom redoslijedu, koji se naziva kristalna rešetka, tako da u normalnim uvjetima čvrste tvari zadržavaju svoj volumen.
Slika 5 iz prezentacije "3 stanja materije" na časove fizike na temu " termalne pojave»Dimenzije: 960 x 720 piksela, format: jpg. Za besplatno preuzimanje slike čas fizike, kliknite desnim tasterom miša na sliku i kliknite na "Sačuvaj sliku kao...". Da biste prikazali slike u lekciji, takođe možete besplatno preuzeti prezentaciju “3 stanja materije.ppt” sa svim slikama u zip arhivi. Veličina arhive je 2714 KB.
Preuzmite prezentacijutermalne pojave
"Difuzija u prirodi" - Široko se koristi u prehrambenoj industriji pri konzerviranju povrća i voća. Prilikom topljenja čelika. Primjer difuzije je miješanje plinova ili tekućina. Šta je difuzija? Difuzija u disanju. Fenomen difuzije ima značajne manifestacije u prirodi, koristi se u nauci i proizvodnji.
"Promjena agregatnih stanja materije" - Agregatne transformacije materije. Specifična toplota isparavanje. Temperatura ključanja. Kipuće. Temperaturni graf promjena agregatnih stanja vode. Temperatura topljenja i kristalizacije. uslovi isparavanja. agregatne transformacije. Vaporizacija. Proračun količine topline. proces topljenja i očvršćavanja.
"3 stanja materije" - Riješite ukrštenicu. Kristalizacija. Raspored molekula u čvrstim materijama. Primjeri procesa. države. Supstanca. Svojstva gasova. Vaporizacija. Pitanja za ukrštenicu. Svojstva tečnosti. Raspored molekula u tečnostima. Ice. Svojstva čvrstih materija. Kondenzacija. Karakter kretanja i interakcija čestica.
"Difuzija supstanci" - Mirisno lišće. Tamna boja. Izreke. Tales iz Mileta. Heraklit. Mi rješavamo probleme. Naučnici Ancient Greece. Difuzija u tehnologiji i prirodi. Zadaci za ljubitelje biologije. Difuzija. Fenomen difuzije. Demokrit. Zapažanja. Difuzija u gasovima.
"Termičke pojave tokom rastvaranja" - D.I. Mendeljejev. Brifing. Otapanje kalijum permanganata u vodi. egzotermni proces. Provjerite svog cimera. Želimo Vam uspjeh u daljem poznavanju zakona fizike i hemije. brzina difuzije. Ono što se zove toplotno kretanje. Međusobno prodiranje molekula. Vrijednost rješenja. Praktični zadaci.
"Interakcija molekula" - Da li je moguće spojiti dva komada željeznog eksera? Privlačenje drži čestice zajedno. Opcija I. Prirodne mješavine ne uključuju: a) glinu; b) cement; c) tlo. gasovite materije. Opcija II Veštačka mešavina je: a) glina; b) cement; c) tlo. Udaljenost između molekula plina više veličina samih molekula.
Ukupno u temi 23 prezentacije






