Vodena para se naziva zasićena ako. Zasićena i nezasićena para
Zasićena para je para koja je u ravnoteži sa tečnom ili čvrstom materijom. Pritisak pare zasićenja supstance zavisi od njene prirode i temperature.
Ravnoteža između tečnosti i pare je dinamička: između njih postoji kontinuirana izmjena čestica (atoma, molekula), a u jedinici vremena kroz jedinice međupovršine, onoliko čestica izleti u paru dok se vraćaju.
Pritisak zasićene pare raste sa porastom temperature. Kvantitativno, ova zavisnost je izražena Clausius-Clapeyron jednačinom
gdje je R pritisak zasićene pare; T je apsolutna temperatura;
ΔN je molarna toplota isparavanja; R je univerzalna plinska konstanta.
Integracijom ove jednačine, uz pretpostavku ΔN=f(T), dobijamo
lnP = - + const(2)
ln = - ( - ). (3)
Jednačina (2) odgovara pravolinijskoj zavisnosti u koordinatama lnP – . Tangentom nagiba prave linije može se odrediti toplina isparavanja ΔN, jer je ΔN = -Rtgα, gdje je α ugao koji čine prava linija i osa apscise. Vrijednost integracijske konstante ovisi o dimenziji u kojoj je pritisak izražen i može se naći iz bilo koje vrijednosti lnP na rezultirajućoj pravoj liniji.
U skladu sa Gibbsovim faznim pravilom, ravnotežni sistem tečnost-para ima jedan stepen slobode. To znači da tlak pare zasićenja tvari ovisi samo o temperaturi. U ovom radu nezavisna varijabla je vanjski tlak, koji postavlja eksperimentator, a zavisna varijabla je tačka ključanja.
Cilj- upoznati se sa dinamičkom metodom merenja pritiska zasićene pare, odrediti zavisnost pritiska zasićene pare od temperature za datu supstancu i iz grafikona izračunati toplotu isparavanja.
POSTUPAK RADA
Dinamička metoda se zasniva na određivanju tačaka ključanja tečnosti pri različitim pritiscima. Kako se ključanje događa na temperaturi na kojoj je tlak zasićene pare jednak vanjskom pritisku, mjerenja temperatura ključanja pri različitim pritiscima daju ovisnost tlaka zasićene pare o temperaturi.
Instalacija za izvođenje radova prikazana je na slici.
Sastoji se od radne posude 1, u kojoj tečnost isparava; refluks kondenzator 2 gdje se para kondenzira; manometar 3; grijač 4 sa vodenim kupatilom 5. U radnu posudu sa ispitnom tečnošću kroz čep se ubacuje termometar 6, čiji je kraj vezan vatom za
mjerite tačku ključanja direktno na površini i izbjegavajte greške zbog pregrijavanja tekućine.
|

Rad se svodi na to da se u prostoru iznad ispitivane tekućine komovskom pumpom 7 sukcesivno stvaraju različiti stupnjevi razrjeđivanja i određuju tačke ključanja. U toku eksperimenta, vakuum se smanjuje otvaranjem ventila 9. Posuda 8 je dodatni kontejner koji omogućava relativno sporo punjenje evakuisanog sistema vazduhom. Pritisak pod kojim dolazi do ključanja određuje se očitavanjem manometra.
Zatvorite slavinu, evakuirajte sistem do pritiska koji je odredio menadžer. Provjerite nepropusnost sistema. Smatra se dovoljnim ako za 10 minuta pritisak poraste ne više od 2,6·10 -3 atm. Pustite vodu u frižider tako što ćete pažljivo otvoriti slavinu za vodu. Uključite grijač i gledajte kako temperatura tekućine raste. Prestanak porasta žive u termometru ukazuje na ključanje tečnosti. Snimite očitavanja
termometar i manometar. Koristeći slavinu, komunicirajući uređaj sa atmosferom, povećajte pritisak za 0,04 atm. U tom slučaju, živa u termometru raste i zaustavlja se na tački ključanja koja odgovara novom pritisku. Ponovite operacije onoliko puta koliko je potrebno da se pritisak u sistemu podigne na barometarski pritisak.
Zapišite rezultate mjerenja u tabelu:
Na osnovu dobijenih podataka: 1) nacrtati zavisnost pritiska pare ispitivane tečnosti od temperature u koordinatama R – T, 0 C i lnP – , K; 2) grafički i prema jednačini (3) odrediti toplotu isparavanja tečnosti za tri temperaturna opsega; 3) odrediti promenu entropije pri isparavanju 1 mol supstance.
TEST PITANJA
na temu "Fazne ravnoteže u jednokomponentnom sistemu"
1. Fazni prijelazi prve i druge vrste.
2. Uslov ravnotežne koegzistencije faza.
3. Clausius-Clapeyronova jednadžba (derivacija).
4. Kakav je odnos između temperature i pritiska tipičan za ravnotežu tečnost-para? Zašto?
5. Koji je odnos između pritiska i tačke topljenja najtipičniji za većinu supstanci? Zašto je ovaj odnos drugačiji za vodu?
6. Kako i zašto toplota isparavanja zavisi od temperature?
7. U kojim koordinatama je odnos između pritiska zasićene pare i temperature izražen pravolinijom i kako se u tom slučaju može odrediti srednja vrednost toplote isparavanja?
8. Šta je dinamička ravnoteža i pritisak zasićene pare?
9. Dijagram stanja vode. Kako radi Atmosferski pritisak tačka ključanja vode? Zašto?
10. Postoje zavisnosti lnP - za različite supstance. Šta određuje nagib ovih linija?
Tema 2. FAZNI PRIJELAZI.
Fazna tranzicija ( fazna transformacija) je prijelaz tvari iz jedne faze u drugu s promjenom vanjskih uvjeta (na primjer, temperatura, pritisak, magnetna i električna polja, itd.), praćen promjenom fizička svojstva i parametre supstance.
Vrijednost temperature, pritiska ili neke druge fizička količina u kojoj dolazi do faznog prelaza naziva se prelazna tačka. Postoje dvije vrste faznog prijelaza.
FAZNI PRIJELAZI PRVE VRSTE
Tokom fazne tranzicije prve vrste, takva termodinamička
karakteristike supstance, kao što su gustina, koncentracija komponenti, specifičan volumen, količina uskladištene unutrašnje energije, tj. određena količina toplote se oslobađa ili apsorbuje, što se naziva toplota prelaza. Štaviše, ovo se odnosi na naglu promenu ovih veličina ne u vremenu, već sa promenom temperature, pritiska itd. Najčešći primeri faznih prelaza prvog reda su:
- topljenje i kristalizacija
- isparavanje i kondenzacija
- sublimacija i desublimacija
FAZNI PRIJELAZI DRUGE VRSTE
Tokom faznog prelaza drugog reda, gustina i unutrašnja energija ne menjaj, dakle golim okom takav fazni prelaz može biti nevidljiv. Skok doživljavaju njihovi derivati u odnosu na temperaturu i pritisak: toplotni kapacitet, koeficijent toplotnog širenja, razne osetljivosti, itd. fazni prijelazi druge vrste praćeni su promjenom simetrije strukture tvari, a ne oslobađanjem ili apsorpcijom energije (topline). Najčešći primjeri faznih prijelaza drugog reda su:
- prolazak sistema kroz kritičnu tačku
- paramagnetno-feromagnetski prelaz
- prelazak metala i legura u stanje supravodljivosti
- prelazak tečnog helijuma u superfluidno stanje
- prelazak amorfnih materijala u staklasto stanje
Moderna fizika takođe istražuje sisteme koji imaju fazne prelaze trećeg ili višeg reda. Nedavno široku upotrebu dobio koncept kvantne fazne tranzicije, tj. fazne tranzicije kontrolisane ne klasičnim termičkim fluktuacijama, već kvantnim, koje postoje čak i pri apsolutna nula temperaturama, gdje se klasični fazni prijelaz ne može realizirati zbog Nernstove teoreme.
Razmotrimo detaljnije fenomene koji nas zanimaju, a koji su povezani s faznim prijelazima prvog reda.
ISPARIVANJE, KONDENZACIJA, KVANJE.
ZASIĆENI I NEZASIĆENI PAROVI.
Svaka tvar pod određenim uvjetima može biti u različitim agregacijskim stanjima - čvrstom, tekućem i plinovitom. prelazi iz jednog stanje agregacije u drugi su fazni prelazi prvog reda.
Isparavanje i kondenzacije su fazni prijelazi između tekuće i plinovite faze tvari.
Sve pravi gasovi(kiseonik, azot, vodonik itd.) pod određenim uslovima mogu da pređu u tečnost. Međutim, do takve transformacije može doći samo na temperaturama ispod određene, tzv kritična temperatura T cr. Na primjer, za vodu je kritična temperatura 647,3 K, za dušik 126 K, za kisik 154,3 K. Na sobnoj temperaturi (≈ 300 K), voda može biti u tekućem i plinovitom stanju, dok dušik i kisik postoje samo u obliku gasova.
isparavanjem naziva se fazni prijelaz iz tekućeg u plinovito stanje. Sa stanovišta molekularne kinetičke teorije, isparavanje je proces u kojem najbrži molekuli izlete s površine tekućine, kinetička energijašto premašuje energiju njihovog vezivanja sa ostatkom molekula tečnosti. To dovodi do smanjenja prosječne kinetičke energije preostalih molekula, odnosno do hlađenja tekućine (ako nema opskrbe energijom iz okolnih tijela).
Kondenzacija je obrnuti proces isparavanja. Tokom kondenzacije, molekuli pare se vraćaju u tečnost.
U zatvorenoj posudi tečnost i njena para mogu biti u nekom stanju dinamička ravnoteža, kada je broj molekula koji izlaze iz tečnosti jednak broju molekula koji se vraćaju u tečnost iz pare, tj. kada su brzine isparavanja i kondenzacije iste. Takav sistem se zove dvofazni . Para u ravnoteži sa svojom tečnošću naziva se bogat.
Broj molekula koji se emituju iz jedinice površine tekućine u jednoj sekundi ovisi o temperaturi tekućine. Broj molekula koji se vraćaju iz pare u tečnost zavisi od koncentracije molekula pare i od prosječna brzina njihovo toplotno kretanje, koje je određeno temperaturom pare. Iz toga slijedi da je za datu supstancu koncentracija molekula pare u ravnoteži tečnosti i njene pare određena njihovom ravnotežnom temperaturom. Uspostavljanje dinamičke ravnoteže između procesa isparavanja i kondenzacije s povećanjem temperature događa se pri većim koncentracijama molekula pare. Kako je pritisak plina (pare) određen njegovom koncentracijom i temperaturom, možemo zaključiti: pritisak zasićena para str 0 date supstance zavisi samo od njene temperature i ne zavisi od zapremine. Dakle, izoterme realnih gasova na ravni ( str, V) sadrže horizontalne dijelove koji odgovaraju dvofaznom sistemu (slika 3.4.1).
Kako temperatura raste, pritisak zasićene pare i njena gustina se povećavaju, dok se gustina tečnosti smanjuje usled toplotnog širenja. Na temperaturi koja je jednaka kritičnoj temperaturi T kr za datu supstancu, gustine pare i tečnosti postaju iste. At T > T cr nestaju fizičke razlike između tečnosti i njene zasićena para.
Ako je izotermno komprimiran zasićena para at T < T cr, tada će se njegov pritisak povećavati sve dok ne postane jednak pritisku zasićene pare. Daljnjim smanjenjem zapremine, na dnu posude se formira tečnost i uspostavlja se dinamička ravnoteža između tečnosti i njene zasićene pare. Sa smanjenjem volumena, sve veći dio pare se kondenzira, a njen tlak ostaje nepromijenjen (horizontalni presjek na izotermi). Kada se sva para pretvori u tečnost, pritisak naglo raste sa daljim smanjenjem zapremine zbog niske kompresibilnosti tečnosti.
Moguće je preći iz gasovitog stanja u tečno zaobilazeći dvofazno područje. Da biste to učinili, morate dovršiti proces zaobilazeći kritičnu tačku K. Jedan od mogućih procesa ove vrste prikazan je na slici 1 isprekidanom linijom ABC.
AT atmosferski vazduh vodena para je uvek prisutna pri nekom parcijalnom pritisku str, što je obično manje od pritiska pare zasićenja str 0 . Stav str / str 0, izraženo u procentima, se poziva relativna vlažnost zrak.
| |
Nezasićena para se teoretski može opisati pomoću jednačine stanja idealan gas pod uobičajenim ograničenjima za stvarne plinove: tlak pare ne bi trebao biti previsok (praktično str≤ (10 6 –10 7) Pa), a njegova temperatura je viša od neke vrijednosti definisane za svaku supstancu. Zakoni idealnog gasa mogu se približno primijeniti i na zasićenu paru, pod uvjetom da za svaku temperaturu T pritisak str 0 zasićena para je određena sa kriva ravnotežestr 0 (T) za datu supstancu.
Pritisak str 0 zasićene pare raste vrlo brzo s povećanjem temperature T. Ovisnost str 0 (T) ne može se dobiti iz zakona idealnog gasa. Pritisak plina pri konstantnoj koncentraciji molekula raste direktno proporcionalno temperaturi. U zasićenoj pari, kako temperatura raste, raste ne samo prosječna kinetička energija molekularnog kretanja, već i njihova koncentracija. Prema tome, pritisak zasićene pare raste brže sa povećanjem temperature od pritiska idealnog gasa pri konstantnoj koncentraciji molekula.
Isparavanje se može dogoditi ne samo s površine, već iu masi tekućine. Tečnosti uvek sadrže sitne mehuriće gasa. Ako je tlak pare zasićenja tekućine jednak ili veći od vanjskog tlaka (tj. tlaka plina u mjehurićima), tečnost će ispariti u mjehuriće. Mjehurići ispunjeni parom se šire i isplivaju na površinu. Ovaj proces se zove ključanje . Dakle, ključanje tečnosti počinje na temperaturi na kojoj je njen pritisak zasićene pare postaje jednak vanjskom pritisku.
Konkretno, pri normalnom atmosferskom pritisku voda ključa na 100°C. To znači da je na ovoj temperaturi pritisak zasićene pare vode 1 atm. Prilikom penjanja na planine, atmosferski pritisak se smanjuje, a samim tim i tačka ključanja vode (otprilike 1 °C na svakih 300 metara visine). Na visini od 7 km, pritisak je približno 0,4 atm, a tačka ključanja pada na 70 °C.
U hermetički zatvorenoj posudi tečnost ne može da ključa, jer se pri svakoj vrednosti temperature uspostavlja ravnoteža između tečnosti i njene zasićene pare. Duž krive ravnoteže str 0 (T) moguće je odrediti tačku ključanja tečnosti pri različitim pritiscima.
Slika realnih gasnih izotermi prikazana na slici 1 opisuje procese isparavanja i kondenzacije, odnosno fazni prelaz između gasovite i tečne faze supstance. Zapravo, ova slika je nepotpuna, jer svaka tvar može preći iz plinovitog i tekućeg u čvrstom stanju. Na datoj temperaturi T termodinamička ravnoteža između dve faze iste supstance moguća je samo pri određenom pritisku u sistemu. Zavisnost ravnotežnog pritiska o temperaturi naziva se kriva fazne ravnoteže . Primjer je kriva ravnoteže str 0 (T) zasićena para i tečnost. Ako se krivulje ravnoteže između različitih faza date supstance nacrtaju na ravni ( str, T), zatim ovu ravan dijele na odvojene oblasti u kojima supstanca postoji u homogenom agregacijskom stanju - čvrstom, tekućem ili plinovitom (slika 2). Prikazano u koordinatnom sistemu ( str, T) ravnotežne krive se nazivaju fazni dijagram .
Kriva 0 T, što odgovara ravnoteži između čvrste i gasovite faze, naziva se kriva sublimacije. Curve TK ravnoteža između tečnosti i pare naziva se krivulja isparavanja, završava na kritičnoj tački K. Curve TM ravnoteža između čvrstog i tečnog se naziva kriva topljenja.
Ravnotežne krive konvergiraju u tački T, u kojoj sve tri faze mogu koegzistirati u ravnoteži. Ova tačka se zove trostruki bod.
Za mnoge supstance pritisak str tr u trostrukoj tački je manji od 1 atm ≈ 10 5 Pa. Takve tvari se tope kada se zagrijavaju na atmosferskom tlaku. Na primjer, trostruki bod voda (slika 3) ima koordinate T tr = 273,16 K, str tr \u003d 6,02 10 2 Pa i koristi se kao referenca za kalibraciju apsolutne temperaturne skale Kelvina.
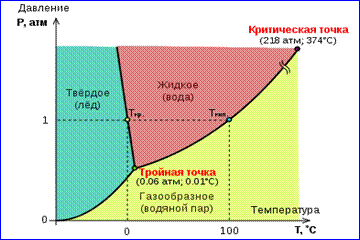 Ima, međutim, i takvih 3 Fazni dijagram vode
Ima, međutim, i takvih 3 Fazni dijagram vode
supstance koje imaju str tr
prelazi 1 atm. Dakle za
pritisak ugljičnog dioksida (CO 2).
str tr = 5,11 atm i temperatura
T tr = 216,5 K. Dakle, na atmosfer
pritisak, čvrsti ugljen dioksid može
postoje samo na niskim temperaturama, i to u tečno stanje at str= 1 atm uopšte ne postoji. U čvrstom stanju, ugljen dioksid je u ravnoteži sa svojom parom na atmosferskom pritisku na temperaturi od 173 K ili -80 °C. Ovo je široko rasprostranjen "suhi led" koji se nikada ne topi, već samo isparava (sublimira).
Nakon ključanja, temperatura vode prestaje da raste i ostaje nepromijenjena do potpunog isparavanja. Vaporizacija je proces prelaska iz tečnog stanja u paru, koja ima isti temperaturni indeks kao tečnost koja ključa. Ovo isparavanje se naziva zasićena para. Kada sva voda ispari, svako naknadno dodavanje topline povećava temperaturu. Zagrijana para iznad nivoa zasićenja naziva se pregrijana. U industriji, zasićena para se obično koristi za grijanje, kuhanje, sušenje ili druge primjene. Pregrijan se koristi isključivo za turbine. Različite vrste pare imaju različite potencijalne energije izmjene i to opravdava njihovu upotrebu u potpuno različite svrhe.
Para kao jedno od tri fizička stanja
Razumijevanje opće molekularne i atomske strukture materije i primjena ovog znanja na led, vodu i paru može vam pomoći da bolje razumijete svojstva pare. Molekul je najmanja jedinica bilo kojeg elementa ili spoja. On se, pak, sastoji od još manjih čestica zvanih atomi, koji definiraju osnovne elemente kao što su vodonik i kisik. Specifične kombinacije ovih atomskih elemenata daju kombinaciju supstanci. Jedno od ovih jedinjenja je hemijska formula H 2 O, čiji se molekuli sastoje od 2 atoma vodika i 1 atoma kisika. Ugljika također ima u izobilju, on je ključna komponenta svih organskih tvari. Većina minerala može postojati u tri fizička stanja ( solidan tečnost i para), koje se nazivaju faze.
Proces stvaranja pare
Kako se voda približava tački ključanja, neki molekuli dobijaju dovoljno kinetičke energije da dostignu brzine koje im omogućavaju da se na trenutak odvoje od tečnosti u prostoru iznad površine prije nego što se vrate. Dalje zagrijavanje uzrokuje više uzbuđenja i povećava se broj molekula spremnih da napuste tekućinu. Pri atmosferskom pritisku temperatura zasićenja je 100 °C. Para sa tačkom ključanja na ovom pritisku naziva se suva zasićena para. Kao i fazni prijelaz iz leda u vodu, proces isparavanja je također reverzibilan (kondenzacija). Kritična tačka je najviša temperatura na kojoj voda može biti u tečnom stanju. Iznad ove tačke para se može smatrati gasom. Gasno stanje je slično difuznom stanju, u kojem molekuli imaju gotovo neograničenu mogućnost kretanja.
Odnos varijabli
Na datoj temperaturi postoji određeni pritisak pare koji postoji u ravnoteži sa tekućom vodom. Ako se ovaj indikator poveća, para se pregrijava i naziva se suhom. Postoji veza između pritiska i temperature: znajući jednu vrijednost, možete odrediti drugu. Stanje pare određuju tri varijable: pritisak, temperatura i zapremina. Suva zasićena para je stanje u kojem para i voda mogu biti prisutne u isto vrijeme. Drugim riječima, ovo se događa kada je stopa isparavanja jednaka stopi kondenzacije.
Zasićena para i njena svojstva
Kada se raspravlja o svojstvima zasićene pare, često se upoređuje sa idealnim gasom. Imaju li nešto zajedničko ili je to samo zabluda? Prvo, na konstantnom nivou temperature, gustina ne zavisi od zapremine. Vizualno se to može zamisliti na sljedeći način: morate vizualno smanjiti volumen parnog spremnika bez promjene indikatora temperature. Broj kondenzovanih molekula će premašiti broj onih koji isparavaju, a para će se vratiti u stanje ravnoteže. Kao rezultat toga, gustina će biti konstantan parametar. Drugo, karakteristike kao što su pritisak i zapremina su nezavisne jedna od druge. Treće, s obzirom na nepromjenjivost volumetrijskih karakteristika, gustoća molekula raste kada temperatura raste, a postaje manja kada se smanjuje. Zapravo, kada se zagrije, voda počinje brže isparavati. Ravnoteža će u ovom slučaju biti poremećena i neće se vratiti sve dok se gustina pare ne vrati na svoje prethodne pozicije. Suprotno tome, tokom kondenzacije, gustina zasićene pare će se smanjiti. Za razliku od idealnog gasa, zasićena para se ne može nazvati zatvoreni sistem jer je stalno u kontaktu sa vodom.

Prednosti u oblasti grijanja
Zasićena para je čista para u direktnom kontaktu sa tekućom vodom. Ima mnoge karakteristike koje ga čine odličnim izvorom toplotne energije, posebno visoke temperature(iznad 100 °C). Neki od njih:

Razne vrste pare
Para je gasovita faza vode. Koristi toplotu tokom svog formiranja i nakon toga oslobađa veliku količinu toplote. Stoga, on
može se koristiti kao radna tvar za toplinske motore. Poznata su sljedeća stanja: vlažno zasićeno, suho zasićeno i pregrijano. Zasićena para je poželjnija u odnosu na pregrijanu paru kao medij za prijenos topline u izmjenjivačima topline. Kada se ispusti u atmosferu iz cijevi, dio se kondenzira, formirajući oblake bijelog, vlažnog isparavanja koji sadrži sitne kapljice vode. pregrijana para neće biti podložan kondenzaciji, čak ni kada dođu u direktan kontakt sa atmosferom. AT pregrejanom stanju imat će veći prijenos topline zbog ubrzanja kretanja molekula i manje gustine. Prisustvo vlage uzrokuje taloženje, koroziju i smanjenje vijeka trajanja kotlova ili druge opreme za izmjenu topline. Stoga se preferira suha para jer stvara više energije i nije korozivna.

Suvo i zasićeno: u čemu je kontradikcija
Mnogi ljudi se zbune sa terminima "suvo" i "bogato". Kako nešto može biti oboje u isto vrijeme? Odgovor leži u terminologiji koju koristimo. Izraz "suho" povezuje se s odsustvom vlage, odnosno "nije mokro". "Zasićeno" znači "natopljeno", "mokro", "poplavljeno", "zasuto" i tako dalje. Čini se da sve ovo potvrđuje kontradikciju. Međutim, u parnoj tehnici, izraz "zasićen" ima drugačije značenje i u ovom kontekstu označava stanje u kojem dolazi do ključanja. Dakle, temperatura na kojoj se događa ključanje je tehnički poznata kao temperature zasićenja. Suha para u ovom kontekstu ne sadrži vlagu. Ako gledate kako ključa kotlić, možete vidjeti bijelu paru koja izlazi iz grla kotla. U stvari, to je mješavina suhe bezbojne pare i mokra para koji sadrži kapljice vode koje reflektiraju svjetlost i obojene su Bijela boja. Stoga, izraz "suha zasićena para" znači da je para dehidrirana, a ne pregrijana. Bez tečnih čestica, to je supstanca u gasovitom stanju koja ne prati opšte zakone o gasu.
Tečnosti imaju tendenciju da ispare. Kad bismo na sto ispustili kap vode, etra i žive (samo nemojte to raditi kod kuće!), mogli bismo gledati kako kapi postepeno nestaju – isparavaju. Neke tečnosti isparavaju brže, druge sporije. Proces isparavanja tečnosti naziva se i vaporizacija. Obrnuti proces pretvaranja pare u tečnost je kondenzacija.
Ova dva procesa ilustruju fazni prelaz- proces prijelaza tvari iz jednog agregatnog stanja u drugo:
- isparavanje (prelazak iz tečnog u gasovitom stanju);
- kondenzacija (prelazak iz gasovitog u tečno stanje);
- desublimacija (prijelaz iz plinovitog u čvrsto stanje, zaobilazeći tečnu fazu);
- sublimacija, ona je takođe sublimacija (prelazak iz čvrstog u gasovito stanje, zaobilazeći tečnost).
Sada je, inače, pravo godišnje doba za promatranje procesa desublimacije u prirodi: mraz i mraz na drveću i predmetima, smrznuti uzorci na prozorima su njegov rezultat.
Kako nastaje zasićena i nezasićena para?
Ali da se vratimo na isparavanje. Nastavit ćemo eksperimentirati i sipati tekućinu - vodu, na primjer, u otvorenu posudu i na nju priključiti manometar. Nevidljivo oku, isparavanje se odvija u posudi. Sve molekule tečnosti su u stalnom kretanju. Neki se kreću tako brzo da je njihova kinetička energija jača od one koja povezuje molekule tečnosti.
Nakon napuštanja tečnosti, ovi molekuli nastavljaju da se nasumično kreću u prostoru, velika većina ih se raspršuje u njemu - ovako nezasićena para. Samo se mali dio njih vraća nazad u tečnost.
Ako zatvorimo posudu, molekula pare će postepeno postajati sve više i više. I sve više njih će se vraćati u tečnost. Ovo će povećati pritisak pare. To će biti zabilježeno pomoću manometra spojenog na posudu.
Nakon nekog vremena, broj molekula koji napuštaju tekućinu i vraćaju se u nju bit će jednak. Pritisak pare će prestati da se menja. Kao rezultat zasićenje parom uspostavlja se termodinamička ravnoteža sistema tečnost-para. To jest, isparavanje i kondenzacija će biti jednake.
Svojstva zasićene pare
Da bismo ih jasno ilustrirali, koristimo još jedan eksperiment. Pozovite svu snagu svoje mašte da to zamislite. Dakle, uzmimo živin manometar, koji se sastoji od dva koljena - komunikacione cijevi. U oba je ulivena živa, jedan kraj je otvoren, drugi zapečaćen, a iznad žive sadrži još nešto etera i njegove zasićene pare. Ako spustite i podignete nezalemljeno koleno, nivo žive u zalemljenom će takođe rasti i pasti.
U tom slučaju će se promijeniti i količina (volumen) zasićene eterske pare. Razlika između nivoa živinih stubova u oba koljena manometra pokazuje pritisak zasićene pare etra. Ostaće nepromenjena u svakom trenutku.
To implicira svojstvo zasićene pare - njen pritisak ne zavisi od zapremine koju zauzima. Pritisak pare zasićenja različitih tekućina (voda i eter, na primjer) je različit na istoj temperaturi.
Međutim, temperatura zasićene pare je bitna. Što je temperatura viša, to je veći pritisak. Tlak zasićene pare raste brže s povećanjem temperature nego kod nezasićene pare. Temperatura i pritisak nezasićene pare povezani su linearnim odnosom.
Može se izvesti još jedan zanimljiv eksperiment. Uzmite praznu tikvicu bez tečnih para, zatvorite je i spojite manometar. Postepeno, kap po kap, sipajte tečnost u tikvicu. Kako tečnost ulazi i isparava, uspostavlja se pritisak zasićene pare, koji je najveći za datu tečnost na datoj temperaturi.
Više o temperaturi i zasićenoj pari
Temperatura pare takođe utiče na brzinu kondenzacije. Baš kao što temperatura tečnosti određuje brzinu isparavanja – drugim riječima, broj molekula koji pobjegnu s površine tekućine u jedinici vremena.
Zasićena para ima istu temperaturu kao i tečnost. Što je viša temperatura zasićene pare, što je veći njen pritisak i gustina, to je manja gustina tečnosti. Kada se dostigne kritična temperatura za supstancu, gustina tečnosti i pare je ista. Ako je temperatura pare iznad kritične temperature za supstancu, fizičke razlike između tečne i zasićene pare se brišu.
Određivanje pritiska zasićene pare u smešama sa drugim gasovima
Razgovarali smo o konstanti konstantna temperatura pritisak zasićene pare. Odredili smo pritisak pod "idealnim" uslovima: kada posuda ili boca sadrži tečnost i paru samo jedne supstance. Razmotrite i eksperiment u kojem se molekuli neke supstance raspršuju u prostoru u mješavini s drugim plinovima.
Da bismo to učinili, uzmemo dva otvorena staklena cilindra i stavimo ih u obje zatvorene posude s etrom. Kao i obično, povezujemo manometare. Otvaramo jednu posudu sa etrom, nakon čega manometar bilježi porast tlaka. Razlika između ovog pritiska i pritiska u cilindru sa zatvorenom posudom etra omogućava vam da saznate pritisak zasićene pare etra.
O pritisku i ključanju
Isparavanje je moguće ne samo s površine tekućine, već i u njenoj zapremini - tada se to naziva ključanjem. Kako temperatura tečnosti raste, formiraju se mjehurići pare. Kada je pritisak zasićene pare veći ili jednak pritisku gasa u mjehurićima, tečnost isparava u mjehuriće. I šire se i izdižu na površinu.
Tečnosti ključaju na različite temperature. U normalnim uslovima voda ključa na 100 0 C. Ali sa promjenom atmosferskog pritiska mijenja se i tačka ključanja. Dakle, u planinama, gde je vazduh veoma razređen i atmosferski pritisak niži, kako se penjete na planine, takođe se smanjuje tačka ključanja vode.
Inače, u hermetički zatvorenoj posudi, ključanje je uopšte nemoguće.
![]()
Još jedan primjer odnosa između tlaka pare i isparavanja pokazuje takva karakteristika sadržaja vodene pare u zraku kao što je relativna vlažnost zrak. Predstavlja odnos parcijalni pritisak vodene pare na pritisak zasićene pare i određuje se formulom: φ \u003d p / p oko * 100%.
Kada se temperatura vazduha smanji, koncentracija vodene pare u njemu raste, tj. postaju intenzivniji. Ova temperatura se naziva tačka rose.
Sažimanje
Na jednostavnim primjerima analizirali smo suštinu procesa isparavanja i rezultirajuće nezasićene i zasićene pare. Sve ove pojave možete posmatrati oko sebe svaki dan: na primer, možete videti lokve kako se suše nakon kiše na ulicama ili ogledalo u kupatilu zamagljeno od pare. U kupatilu možete čak i posmatrati kako prvo dolazi do isparavanja, a zatim se vlaga nakupljena na ogledalu ponovo kondenzuje u vodu.
Također možete koristiti ovo znanje da svoj život učinite ugodnijim. Na primjer, zimi je u mnogim stanovima zrak vrlo suh, a to loše utiče na dobrobit. Možete koristiti moderni ovlaživač da biste ga učinili vlažnijim. Ili, na starinski način, stavite posudu s vodom u prostoriju: postepeno isparavajući, voda će zasititi zrak svojim parama.
www.site, uz potpuno ili djelomično kopiranje materijala, obavezan je link na izvor.









