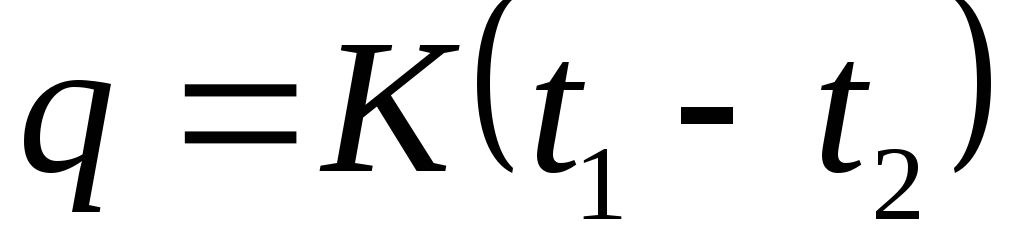Koji gasni proces se odvija pri konstantnom pritisku. Toplotni kapacitet. Termodinamički procesi sa idealnim gasom
Osnovna termodinamička svojstva idealnih gasova
U proučavanju termodinamičkih procesa koristi se jednačina stanja
i matematički izraz prvog zakona termodinamike
Prilikom proučavanja termodinamičkih procesa idealnih gasova, u opštem slučaju, potrebno je odrediti jednadžbu krivulje procesa u PV , PT , VT dijagram, uspostaviti odnos između termodinamičkih parametara i odrediti sljedeće veličine:
− promjena unutrašnja energija radno tijelo
![]()
(formula ne važi samo za V = konst, ali i za bilo koji proces)
− odrediti eksterni (termodinamički) specifični rad
i dostupnim konkretnim radovima
je količina topline uključena u termodinamički proces
Gdje je toplinski kapacitet procesa
– promjena entalpije u termodinamičkom procesu
(formula ne važi samo za str = konst, ali i u bilo kom procesu)
- udio topline koji se troši na promjenu unutrašnje energije u ovom procesu:
je udio topline pretvoren u koristan rad u ovom procesu
U opštem slučaju, bilo koja dva od tri termodinamička parametra ( P , V , T) može se proizvoljno mijenjati. Za praksu su od najvećeg interesa slijedeći procesi:
Procesi na konstantan volumen (V = konst) je izohoričan.
Pri konstantnom pritisku ( P = konst) je izobaričan.
At konstantna temperatura (T = konst) je izotermna.
Proces dq =0 (teče bez razmene toplote radnog fluida sa okolinom) je adijabatski proces.
Politropni proces, koji se pod određenim uslovima može smatrati generalizujućim u odnosu na sve glavne procese.
U budućnosti ćemo razmatrati 1. zakon termodinamike i količine koje su u njemu uključene u odnosu na 1 kg mase.
Obraditi pri konstantnoj zapremini
(izohorni proces)
Takav proces može se izvesti radni fluid, na primjer, smješten u posudi koja ne mijenja svoju zapreminu, ako se toplota dovede radnom fluidu iz izvora toplote ili se toplota odvodi iz radnog fluida u frižider.
U izohoričnom procesu V = konst i dV =0 . Jednačina izohornog procesa se dobija iz jednačine stanja pri V = konst .
– Charlesov zakon (*)
To jest, u V = konst pritisak gasa je proporcionalan apsolutnoj temperaturi. Kada se toplota dovodi, pritisak raste, a kada se toplota odvodi, opada.
Hajde da opišemo proces na V = konst in pV , pT i VT dijagrami.


AT str V - dijagram izohore 1-2 - vertikalna ravna linija paralelna osi str . U procesu 1-2, toplina se dovodi do plina, pritisak raste, a prema tome, iz jednačine (*), raste temperatura. U obrnutom procesu 2-1, toplina se uklanja iz plina, uslijed čega se smanjuje unutrašnja energija plina i smanjuje njegova temperatura, tj. proces 1-2 - grijanje, 2-1 - hlađenje plinom.
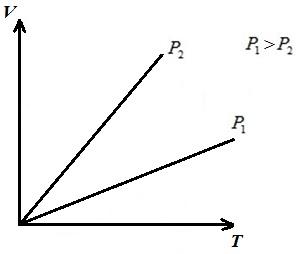
AT str T - dijagram izohore - prave linije koje izlaze iz ishodišta sa nagibom (faktor proporcionalnosti)
Štaviše, što je jači nivo jačine zvuka, to je niža izohora.
U VT - izohor dijagramu - ravne linije paralelne sa T osom.
Vanjski rad plina u izohornom procesu:
zbog
Dostupan konkretan rad
![]()
Promjena unutrašnje energije gasa u izohornom procesu, ako
![]()
Specifična toplota dovedena radnom fluidu, at
![]()
Od u V = konst gas ne radi dl =0 ), tada će jednadžba prvog zakona termodinamike imati oblik:
![]()
Odnosno, u procesu V = konst sva toplota dovedena radnom fluidu troši se na povećanje unutrašnje energije, odnosno na podizanje temperature gasa. Kada se gas ohladi, njegova unutrašnja energija se smanjuje za količinu odvedene toplote.
Udio topline utrošen za promjenu unutrašnje energije
Udio topline utrošen na obavljanje posla
Proces pod konstantnim pritiskom
(izobarni proces)
Izobarski proces, na primjer, može se odvijati u cilindru ispod klipa koji se kreće bez trenja, tako da pritisak u cilindru ostaje konstantan.
Izobarnim procesom str = konst , dp =0
Jednačina izobarnog procesa se dobija kada str = konst iz jednadžbe stanja:
– Gay-Lussac zakon (*)
U procesu na str = konst Volumen gasa je proporcionalan temperaturi, odnosno kada se gas širi, temperatura, a time i unutrašnja energija, raste, a kada se kompresuje, smanjuje.
Hajde da opišemo proces pV , pT , VT - dijagrami.
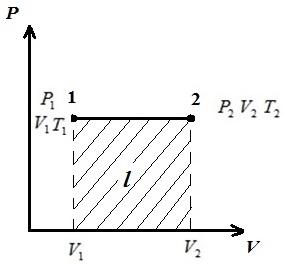

AT pV-dijagram procesa na str = konst prikazane kao prave linije paralelne sa osom V . Površina pravougaonika 12 daje, na odgovarajućoj skali, rad gasa l. U procesu 1-2, toplota se dodaje gasu kako se specifična zapremina povećava, a prema tome, prema jednačini (*), temperatura raste. U obrnutom procesu 2-1, toplina se uklanja iz plina, zbog čega se smanjuje unutrašnja energija i temperatura plina, tj. proces 1-2 je zagrijavanje, a 2-1 hlađenje plina.
AT VT- izobarski dijagram je prava linija koja izlazi iz ishodišta koordinata, sa nagibom .
AT pT- izobar dijagram je prava linija paralelna sa osom T .
Rad gasa u izobaričnom procesu ( str = konst )
![]()
Od tada
To jest, ako se temperatura plina poveća, tada je rad pozitivan.
Dostupan posao
zbog ,.
Promjena unutrašnje energije plina, ako
![]()
Količina toplote koja se javlja gasu kada se zagreje (ili odaje kada se ohladi), ako
![]()
Odnosno, toplota koja se dovodi do radnog fluida u izobarnom procesu ide na povećanje njegove entalpije, tj. u izobarnom procesu je totalni diferencijal.
Jednačina prvog zakona termodinamike ima oblik
![]()
Udio topline utrošen za promjenu unutrašnje energije u izobaričnom procesu,
![]()
gdje k je adijabatski indeks.
Udio topline utrošene za obavljanje posla str = konst ,
![]()
u MKT, n je broj stepeni slobode.
Za jednoatomni gas n =3 i onda φ=0,6, ψ=0,4, odnosno 40% toplote prenešene gasu ide za obavljanje spoljašnjeg rada, a 60% za promenu unutrašnje energije tela.
Za dvoatomski gas n =5 i onda φ=0,715, ψ=0,285, to jest, ≈28,5% topline dovedene u plin ide za obavljanje vanjskog rada, a 71,5% ide za promjenu unutrašnje energije.
Za troatomski gas n =6 i onda φ=0,75, ψ=0,25, odnosno 25% toplote (parna mašina) ide za obavljanje spoljnih radova.
Proces na konstantnoj temperaturi
(izotermni proces)
Takav termodinamički proces može se odvijati u cilindru klipne mašine ako se, kako se toplota dovodi do radnog fluida, klip mašine pomera, povećavajući zapreminu toliko da temperatura radnog fluida ostane konstantna.
At izotermni proces T = konst , dT =0.
Iz jednadžbe stanja
− Boyle-Mariotteov zakon.
Dakle, u procesu na konstantnoj temperaturi, pritisak gasa je obrnuto proporcionalan zapremini, tj. Sa izotermnim širenjem, pritisak opada, a sa kompresijom se povećava.
Prikazujemo izotermni proces u pV , pT , VT − dijagrami.
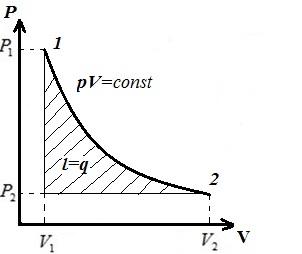
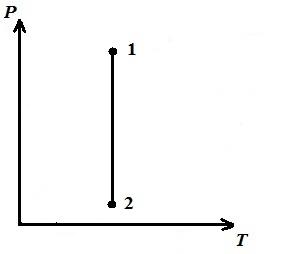
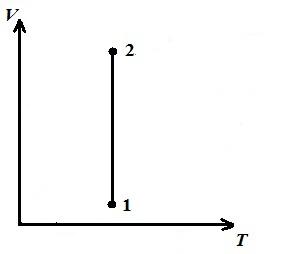
AT pV- dijagram - izotermni proces je predstavljen jednakostraničnom hiperbolom, a što je temperatura viša, to je izoterma veća.
AT pT − dijagram - izoterme - ravno, paralelno sa osom str .
AT VT − dijagram - prave linije, paralelne osi V .
dT =0, onda
To je U = konst , i = konst – unutrašnja energija i entalpija se ne mijenjaju.
Jednačina prvog zakona termodinamike ima oblik ( T = konst)
Odnosno, sva toplina koja se prenosi plinu u izotermnom procesu troši se na rad ekspanzije. U obrnutom procesu, u procesu kompresije, iz plina se oduzima toplina jednaka eksterni rad kompresija.
Specifičan rad u izotermnom procesu
Specifičan rad za jednokratnu upotrebu
Iz posljednje dvije jednačine slijedi da je u izotermnom procesu za idealni plin, raspoloživi rad jednak radu procesa.
Toplota koja se prenosi gasu u procesu 1-2,
1. zakon termodinamike
Iz ovoga proizilazi da kada T = konst l = l 0= q , one. rad, raspoloživi rad i količina toplote koju sistem prima su jednaki.
Jer u izotermnom procesu dT =0, q = l = neka konačna vrijednost, zatim od
![]()
to dobijamo u izotermnom procesu C =∞. Stoga, da bi se odredila količina toplote koja je data gasu u izotermnom procesu, korišćenjem specifična toplota nemoguće.
Udio topline utrošen za promjenu unutrašnje energije na T = konst
i udio topline utrošene na obavljanje posla,
Proces bez razmene toplote sa okolinom
(adijabatski proces)
U adijabatskom procesu razmjena energije radnog fluida sa okolinom odvija se samo u obliku rada. Pretpostavlja se da je radni fluid termički izolovan okruženje, tj. nema prijenosa topline između njega i okoline;
q =0, i shodno tome dq =0
Tada će jednadžba prvog zakona termodinamike poprimiti oblik
Dakle, promjena unutrašnje energije i rad u adijabatskom procesu su ekvivalentne po veličini i suprotnog predznaka.
Stoga, radi adijabatski proces ekspanzija nastaje zbog smanjenja unutrašnje energije plina i, posljedično, temperatura plina će se smanjiti. Rad adijabatske kompresije u potpunosti ide na povećanje unutrašnje energije, tj. da poveća svoju temperaturu.
Dobijamo adijabatsku jednačinu za idealni gas. Iz prvog zakona termodinamike
at dq =0 dobijamo ( du = životopis dT )
Toplotni kapacitet , gdje
Diferenciranje jednadžbe stanja pV = RT dobijamo
Zamena RdT od do (*)
ili dijeljenje po pV ,
Integrating at k = konst , dobijamo
![]()
Posljednja jednačina se zove Poissonova jednačina i adijabatska je jednačina za .
Iz Poissonove jednadžbe slijedi da
odnosno pri adijabatskom širenju pritisak opada, a pri kompresiji raste.
Predstavljamo izohorni proces u pV , pT i VT - dijagrami
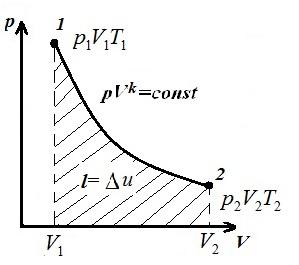
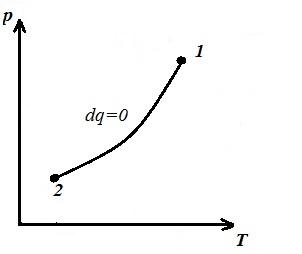
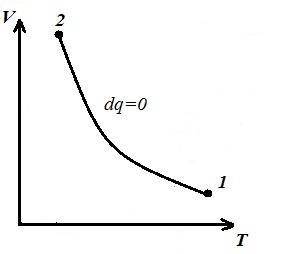
Square V 1 12 V 2 pod adijabatskim 1-2 dalje pV – dijagram daje rad l jednaka promeni unutrašnje energije gasa
Poređenje adijabatske jednačine sa Boyle-Mariotteovim zakonom ( T = konst ) možemo zaključiti da, pošto k >1, tada, pri širenju duž adijabate, pritisak pada jače nego duž izoterme, tj. in pV – adijabatski dijagram je veći od izoterme, tj. adijabat je nejednaka hiperbola koja ne siječe koordinatne osi.
Dobijamo adijabatsku jednačinu u pT i VT − dijagrami. U adijabatskom procesu sva tri parametra se mijenjaju ( str , V , T ).
Dobijamo odnos između T i V . Jednačine stanja za tačke 1 i 2
odakle se druga jednačina dijeli sa prvom
Zamjena omjera tlaka iz Poissonove adijabatske jednadžbe
ili TVk -1= konst je adijabatska jednačina u VT - dijagram.
Zamjena u (*) (3) omjera volumena iz adijabatske jednadžbe (Poisson)
ili − adijabatska jednačina u pT - dijagram. Ove jednačine su dobijene pod pretpostavkom da k = konst .
Rad u adijabatskom procesu na životopis = konst
S obzirom na odnos između temperature T i V
![]()
S obzirom na odnos između T i str

Promjena unutrašnje energije u=- l.
Dostupan posao, s obzirom na to
![]() ,
,
One. dostupan rad u k puta više rada adijabatskog procesa l .
φ i ψ ne nalazimo.
Politropni proces
Politropni proces je svaki proizvoljni proces koji se odvija pri konstantnom toplotnom kapacitetu, tj.
Tada će jednadžba 1. zakona termodinamike poprimiti oblik
![]() (*)
(1)
(*)
(1)
Dakle, ako C = konst i životopis = konst , tada kvantitativna raspodjela topline između unutrašnje energije i rada u politropskom procesu ostaje konstantna (na primjer, 1:2).
Udio topline utrošen za promjenu unutrašnje energije radnog fluida
![]()
Udio topline utrošen na vanjski rad,
![]()
Dobijamo jednačinu politropnog procesa. Da bismo to učinili, koristimo jednačinu 1. zakona termodinamike (*)
Odavde, od (*) i (**)
Dijeljenje druge jednačine (4) sa prvom (3)
Uvodimo veličinu koja se zove politropni eksponent. onda,
Integracijom ovog izraza dobijamo
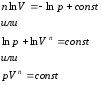
Ova jednadžba je politropska jednadžba u pV − dijagram. Potlitrope index n je konstantan za određeni proces i može varirati od -∞ do +∞.
Koristeći jednadžbu stanja, možemo dobiti politropsku jednačinu u VT i pT- dijagrami.
Od ![]() - politropska jednačina u VT -
dijagram.
- politropska jednačina u VT -
dijagram.
Od ![]()
− politropska jednačina u pT - dijagram.
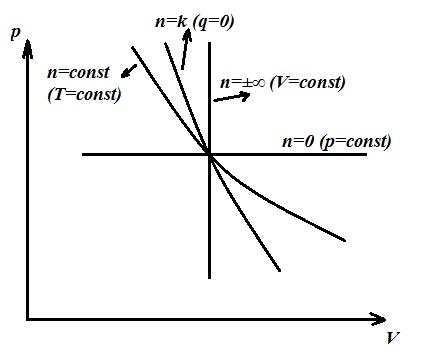
Politropski proces je generalizirajući, a glavni procesi (izohorni, izotermni, adijabatski) su posebni slučajevi politropskog procesa, od kojih svaki ima svoju vrijednost. n . Dakle, za svaki izohorni proces n =±∞, izobaričan n =0, izotermni n =1, adijabatski n = k .
Pošto su politropska i adijabatska jednadžba iste po obliku i razlikuju se samo po veličini n(politropski eksponent umjesto k − adijabatski eksponent), možemo napisati
rad politropnog procesa
![]()
jednokratni rad politropnog procesa
Toplotni kapacitet gasa iz , odakle
![]()
Štaviše, u zavisnosti od n toplinski kapacitet procesa može biti pozitivan, negativan, jednak nuli i varira od -∞ do +∞.
U C procesima<0 всегда l> q one. za obavljanje rada ekspanzije, osim dovedene topline, troši se i dio unutrašnje energije plina.
Promjena unutrašnje energije politropnog procesa
![]()
Toplota koja se prenosi plinu u politropnom procesu
![]()
Promjena entalpije radnog fluida
![]()
Drugi zakon termodinamike
Prvi zakon termodinamike karakteriše procese konverzije energije sa kvantitativne tačke gledišta, tj. on tvrdi da se toplota može pretvoriti u rad, a rad u toplotu, bez utvrđivanja uslova pod kojima su te transformacije moguće. Dakle, samo uspostavlja ekvivalenciju različitih oblika energije.
Drugi zakon termodinamike utvrđuje pravac i uslove procesa
Kao prvi zakon termodinamike, drugi zakon je izveden iz eksperimentalnih podataka.
Iskustvo pokazuje da do pretvaranja toplote u koristan rad može doći samo kada toplota prelazi sa zagrejanog tela na hladno, tj. kada postoji temperaturna razlika između hladnjaka i hladnjaka. Moguće je promijeniti prirodni smjer prijenosa topline u suprotan samo na račun troškova rada (na primjer, u frižiderima).
Prema 2. zakonu termodinamike
Nemoguć je proces u kojem bi se toplota spontano prenosila sa hladnih na zagrejana tela.
Ne može sva toplina primljena od prijenosa topline ići u rad, već samo dio. Dio toplote mora ići na hladnjak.
Dakle, stvaranje uređaja koji bi, bez naknade, u potpunosti pretvorio toplinu bilo kojeg izvora u rad, i tzv vječni motor druge vrste, nemoguće!
Reverzibilni i ireverzibilni procesi
Za svaki termodinamički sistem mogu se zamisliti dva stanja između kojih će se odvijati dva procesa (slika 1): jedan iz prvog stanja u drugo i drugi obrnuto, iz drugog stanja u prvo.
Prvi proces se zove direktno proces, i drugi obrnuto.
Ako nakon direktnog procesa slijedi obrnuti proces i termodinamički sistem se vrati u prvobitno stanje, onda se takvi procesi smatraju reverzibilan.
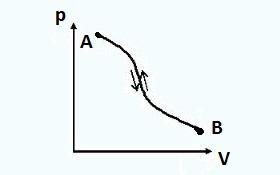
U reverzibilnim procesima, sistem u obrnutom procesu prolazi kroz ista ravnotežna stanja kao i u direktnom procesu. U ovom slučaju, ni u okruženju ni u samom sistemu, nema rezidualnih efekata (nema promjene parametara, obavljenog posla itd.). Kroz direktan proces AB , a zatim obrnuto BA konačno stanje sistema će biti identično početnom stanju.
Slika prikazuje mehanički reverzibilnu postavku procesa. Instalacija se sastoji od cilindra 1, klipa 2 sa stolom 3 i pijeska na njemu. Ispod klipa, cilindar sadrži gas, koji je pod pritiskom peska na stolu.
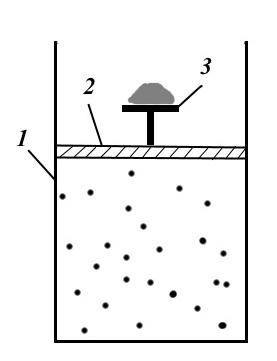
Za stvaranje reverzibilnog procesa potrebno je beskonačno polako uklanjati jedno zrno pijeska za drugim. Tada će proces biti izotermičan, a pritisak će biti jednak vanjskom pritisku, a sistem će biti stalno u ravnotežnom stanju. Ako se proces odvija u suprotnom smjeru, tj. beskonačno polako bacati zrnca pijeska na sto 3, tada će sistem sekvencijalno proći kroz ista ravnotežna stanja i vratiti se u prvobitno stanje (ako nema trenja).
Prilikom širenja, radno tijelo u reverzibilnom procesu proizvodi maksimalan rad.
Kratak teorijski dio
Omjer topline δq koju primi jedinična količina tvari i promjene temperature dt naziva se specifična toplina.
(1.1)Kako količina toplote δq zavisi od prirode procesa, toplotni kapacitet sistema CX takođe zavisi od uslova procesa.
Toplotni kapacitet, ovisno o količini tvari, može biti maseni - C, volumetrijski - C" i molarni µC. Odnos između njih:
Fizičko značenje toplotnih kapaciteta idealne supstance pri V = const i P = const proizlazi iz razmatranja diferencijalnih termodinamičkih odnosa oblika:
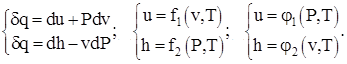 (1.3)
(1.3)
Nakon odgovarajućih transformacija, uzimajući u obzir svojstva idealnog gasa, dobijamo:
(1.4)Ovo ukazuje da su promjene unutrašnje energije i entalpije definirane kao:
(1.5)one. bez obzira na prirodu procesa.
Odnosi između CP i CV:
U skladu sa molekularno-kinetičkom teorijom gasova, molarni toplotni kapacitet pri V = Const je proporcionalan broju njihovih stepena slobode, izražen u Joule ekvivalentu, a za jedan mol gasa je µSV = 3 × 4,19 = 12,5 J/ (mol×K). Zatim, u skladu s Mayerovim zakonom, µSP = 5 × 4,19 = 20,8 J / (mol × K), što omogućava, ovisno o atomičnosti plina i njihovim stupnjevima slobode, da predstavimo vrijednosti molarnih toplotnih kapaciteta u sljedeći obrazac:
Tabela br. 1.1.
Toplotni kapacitet određen jednadžbom (4.1) za date parametre stanja (P, v, T) naziva se istinitim i može se izraziti kao:
CX = CX0 + ΔCX, (1.7)
gde je SX0 toplotni kapacitet gasa u ispražnjenom stanju (pri P " 0) i zavisi samo od temperature, a ΔSX određuje zavisnost toplotnog kapaciteta od pritiska i zapremine.
Prosječni toplinski kapacitet CXm u temperaturnom rasponu od T1 do T2 izražava se kao:
 (1.8)
(1.8)
Ako prihvatimo da je jedna od granica, na primjer T1 = 273,15 K, onda možemo izračunati prosječne toplinske kapacitete plinova u temperaturnom rasponu od t1 = 0 °C do t2 = x °C i prikazati njihove vrijednosti u tabeli. obrazac, vidi Prilog, tabele br. 2 - br. 4.
Količina toplote koja se prenosi u sistem prema jednačini (4.8) i na osnovu podataka o toplotnom kapacitetu, tabele br. 2 - br. 4, uzimajući u obzir (4.2), u zavisnosti od procesa, izračunava se po formulama:
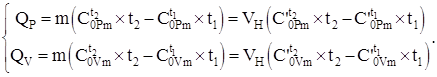 (1.9)
(1.9)
Za približne proračune količine topline na ne baš visoke temperature možemo uzeti C = Const i onda jednačine (1.14) uzimajući u obzir (1.2) - (1.4) i vrijednosti tabele br. 4.1. izgledat će ovako:
 (1.15)
(1.15)
Zadatak broj 1-1. Vazduh zapremine V = 15 m3 na temperaturi t1 = 1500 °C i pritisku P = 760 mmHg se izobarično hladi do temperature t2 = 250 °C. Odredite odvedenu toplotu QP ako: a) uzmete u obzir konstantu toplotnog kapaciteta, b) koristite formulu µSP = 6,949 + + 0,000576×t.
Zadatak broj 1-2. Protok zraka se mjeri pomoću električnog grijača ugrađenog u zračni kanal. Temperatura zraka prije i poslije grijača mjeri se pomoću dva termometra. Odredite satni protok zraka G kg / h, ako je, kada je uključen električni grijač snage 0,75 kW, temperatura zraka ispred grijača T1 = 288 K, a iza grijača T2 = 291,1 K. Odredite i brzinu protoka zraka iza grijača, ako je njegov tlak (prihvaćen kod nas nepromijenjen) P = 870 mmHg, a prečnik vazdušnog kanala d = 90 mm.
Zadatak broj 1-3. Kao rezultat potpunog sagorevanja ugljika u atmosferi čistog kiseonika, u posudi je nastao ugljen-dioksid CO2 pri pritisku od P = 6,04 bara i temperaturi od T1 = 1673 K. Koliko će se toplote osloboditi kada se CO2 ohladi na temperaturu od T2 = 293 K. Odredite i koliki će se pritisak istovremeno uspostaviti u posudi i koji pritisak je kiseonik imao u posudi pre sagorevanja, ako je njegova temperatura bila 10°C. Volumen posude se uzima nepromijenjen i jednak je 5 litara.
Zadatak broj 1-4. Odrediti količinu topline koja je potrebna za zagrijavanje 1 Nm3 plinske mješavine sastava τ(CO2) = 14,5%; τ(O2) = 6,5%; τ(N2) = 79,0% od 200 do 1200 °C pri P = Const i nelinearnoj zavisnosti toplotnog kapaciteta od temperature.
Primjer. Vazduh u količini od 6 m3 pri pritisku P1 = 3 bara i temperaturi t1 = 25 °C zagrijava se u procesu P = Const na t2 = 130 °C. Odredite količinu dovedene topline, uzimajući u obzir C = Const i C = f (T).
QP \u003d m × CP × (t2 - t1) \u003d VH × C "P × (t2 - t1);
QP \u003d m × (CPm × t2 - CPm × t1) \u003d VH × (C "Pm × t2 - C" Pm × t1).
m = (P1 × V1 × µ) / (R × T1) = (3 × 105 × 6 × 2,896 × 10–2) / (8,314 × 298,15) = 21,03 kg.
VN = (R1 × V1 × TN) / (RN × T1) = (3 × 105 × 6 × 273,15) / (101325 Pa × 298,15) = 16,28 nm3.
QP = 21,03 × (29,33/2,896 × 10–2) × (130 – 25) = 16,28 × (29,33/2,24 × 10–2) × (130 – 25) = 2236, 4 kJ.
QP = 21,03 kg × (1,0079 × 130 - 1,0042 × 25) = 16,28 × (1,3026 × 130 - 1,298 × 25) = 2227,5 kJ.
Odstupanje 0,40%.
Zadatak broj 1-5. Zatvorena posuda kapaciteta V = 0,5 m5 sadrži ugljični dioksid na P = 6 bara i T = 800 K. Kako će se promijeniti pritisak plina ako se od njega oduzme 100 kcal? Prihvatiti zavisnost C = f(T) kao linearnu.
Zadatak broj 1-6. Posuda zapremine 90 litara sadrži vazduh pod pritiskom od 8 bara i temperaturom od 303 K. Odredite količinu toplote koja se mora preneti vazduhu da bi se njegov pritisak pri V = Const povećao na 16 bara. Prihvatiti zavisnost C = f(T) kao nelinearnu. Odgovor dajte u kcal.
Zadatak broj 1-7. Koju količinu toplote treba utrošiti da bi se zagrejalo 2 m3 vazduha pri konstantnom nadpritisku PM = 2 bara od t1 = 100 °C do t2 = 500 °C? koliko posla obavlja vazduh? Pritisak vazduha na barometru je uzet jednak 760 mmHg.
Zadatak broj 1-8. Pod izobaričnim zagrevanjem od T1 = 313 K do T2 = 1023 K, homogeni gas radi l = 184 kJ/kg. Odredite o kakvoj se vrsti gasa radi, koliko toplote mu se prenosi i kako se njegov pritisak u ovom slučaju promenio.
Zadatak broj 1-9. U procesu dovoda toplote pri konstantnom pritisku, temperatura od 0,9 nm3 azota raste sa T1 = 288 K na T2 = 1873 K. Odrediti promene entalpije azota i udela toplote utrošene na povećanje unutrašnje energije.
Zadatak broj 1-10. Cilindar sa pokretnim klipom sadrži kiseonik u količini VH = 0,3 nm3 pri T1 = 318 K i P1 = 776 mmHg. Određena količina toplote se prenosi kiseoniku pri P = Const, a zatim se hladi na početnu temperaturu (318 K) pri V = Const. Odrediti količinu unesene topline, promjenu entalpije, unutrašnju energiju i rad oba procesa ako je poznato da je na kraju izohornog hlađenja tlak kisika P3 = 0,588 bara. Nacrtajte gasna stanja u P-V i T-S koordinatama.
Termodinamički procesi sa idealnim gasom.
Kratak teorijski dio
Pod termodinamičkim procesom podrazumeva se interakcija vozila sa okolinom, usled čega vozilo prelazi iz određenog početnog stanja u određeno konačno stanje.
Ako se vozilo u kojem se odvija proces može vratiti u početno stanje tako da se tokom spoljašnje okruženje ne dolazi do promjene, kaže se da je proces reverzibilan. Ako je početno stanje vozila bez promjena u vanjskom okruženju nepovratno, tada se proces naziva nepovratnim.
Na dijagramima stanja mogu se grafički prikazati samo reverzibilni procesi, jer na njima svaka tačka predstavlja stanje ravnoteže.
Princip očuvanja energije, formulisan prvim zakonom termodinamike (formule (2.1) - (2.3)), na kraju dovodi do energetskog bilansa koji povezuje promenu energetske rezerve TS (unutrašnje energije) sa energijom koja prelazi granice sistema kada se proces završi u vidu rada ili toplote.
Grupa procesa koja se pod određenim uslovima generalizuje za sve procese i karakteriše je konstantan toplotni kapacitet naziva se politropska.
Za sve procese uspostavljena je opšta metoda istraživanja, koja glasi:
izvedena je jednačina procesa;
uspostavlja odnos između glavnih parametara stanja vozila;
utvrđuje se toplotni kapacitet procesa;
· Određuju se promjene funkcija stanja: unutrašnja energija, entalpija, entropija;
izračunavaju se procesne funkcije: toplota i rad;
· data je grafička interpretacija termodinamičkih procesa u P – V i T – S koordinatama.
Razmatrani procesi se smatraju reverzibilnim.
Glavni odnosi prema tačkama 1 - 5 dati su u tabelama br. 2.1 - br. 2.3.
Tabela br. 2.1
Tabela br. 2.2
Tabela br. 2.3
Toplotni kapacitet u politropskom procesu je:
Na slici ispod prikazani su politropski procesi u P–V i T–S koordinatama.

Primjer. Vazduh zapremine V = 0,01 m3, pri P1 = 10 bara i T1 = 298 K, širi se u cilindru sa pokretnim klipom do pritiska P2 = 1 bar. Odrediti konačnu zapreminu, temperaturu, rad ekspanzije, unos toplote, promjenu unutrašnje energije, entalpiju i entropiju ako do širenja dođe: 1. izotermno; 2. adijabatski; 3. politropni sa politropnim indeksom n = 1,3. Opišite proces u P - V i T - S koordinatama.
Izotermna ekspanzija.
Volumen na kraju proširenja:
V2 = V1 × (P1/P2) = 0,01 × (10/1) = 0,1 m3.
Produžni rad:
L = P1 × V1 × ln(P1/P2) = 106 × 0,01 × ln(10/1) = 23 kJ.
QT = L = 23 kJ.
Pošto je T1 = T2 = 298 K, tada je Δh = 0 i Δu = 0.
Promjena entropije:
ΔS \u003d Q / T \u003d 23/298 = 0,07718 kJ / K.
adijabatsko širenje.
Masa gasa u cilindru:
m = (P1 × V1 × μ) / R × T1 = (106 × 0,01 × 2,896 × 10–2) / (8,314 × 298 K) = 0,117 kg.
Konačni volumen:
V2 = V1 × (P1/P2) 1/k = 0,01 × (10/1) 1/1,4 = 0,0518 m3.
Temperatura zraka na kraju procesa:
T2 = T1 × (P2/P1) (k – 1) /k = 298 × (1/10) (1,4 – 1) /1,4 = 154,35 K.
Rad gasa tokom ekspanzije:
L \u003d (P1 × V1 - P2 × V2) / (k - 1) = (106 × 0,01 - 105 × 0,0518) / (1,4 - 1) = 12 kJ.
entalpija:
Δh \u003d CP × (T2 - T1) = 1,0189 × (154,35 - 298) = - 146,36 kJ / kg;
ΔH \u003d m × Δh = 0,117 × (- 146,36) = - 17,12 kJ.
unutrašnja energija:
Δu \u003d CV × (T2 - T1) = 0,7317 × (154,35 - 298) = - 105,11 kJ / kg;
ΔU \u003d m × Δu = 0,117 × (- 105,11) = - 12,30 kJ.
Prilikom određivanja promjene funkcija stanja, zbog značajne promjene temperature u procesu (298 - 154,35 = 146,65 K), koristimo ovisnost toplinskog kapaciteta od temperature C = f(T) (vidi tabelu br. 3. Dodatak).
Politropska ekstenzija sa n = 1.3.
Konačni volumen:
V2 = V1 × (P1/P2) 1/n = 0,01 × (10/1) 1/1,3 = 0,0588 m3.
Konačna temperatura:
T2 = T1 × (V1/V2) n – 1 = 298 × (0,01/0,0588) 1,3 – 1 = 175,15 K.
Rad gasa tokom ekspanzije:
L \u003d (P1 × V1 - P2 × V2) / (n - 1) = (106 × 0,01 - 105 × 0,0588) / (1,3 - 1) = 13,7 kJ.
Količina isporučene toplote:
qP = CV × [(n – k) /(n – 1)] × (T2 – T1) = 0,7317 × [(1,3 – 1,4) /(1,3 – 1)] × (175 ,15 – – 298) = 29,96 kJ/kg;
QP = m × qP = 0,117 × 29,96 = 3,51 kJ.
Promjena u procesu je bila:
entalpija:
Δh \u003d CP × (T2 - T1) = 1,0189 × (175,15 - 298) = - 125,17 kJ / kg;
ΔH = m × Δh = 0,117 × (–125,17) = – 14,64 kJ.
unutrašnja energija:
Δu \u003d CV × (T2 - T1) = 0,7317 × (175,15 - 298) = - 89,89 kJ / kg;
ΔU = m × Δu = 0,117 × (–89,89) = – 10,52 kJ.
Zadaci za samostalno rješavanje.
Zadatak broj 2-1. U zatvorenoj prostoriji zapremine V = 25 m3 nalazi se vazduh pod pritiskom P1 = 730 mmHg i temperaturom od T1 = 283 K. Kao rezultat dovoda toplote, pritisak je porastao na P2 = 2,3 bara. Odrediti količinu dovedene topline QV, promjenu unutrašnje energije ΔU i entalpije ΔH.
Zadatak broj 2-2.6. kg azota obavljaju rad LP = 343 kJ u procesu izobarnog širenja. Odredite promjene unutrašnje energije dušika, ako početna temperatura jednak je T1 = 373 K.
Zadatak broj 2-3. Ugljenmonoksid je na viškom pritiska od PM = 3,92 bara i zauzima zapreminu od V = 5 m3, dok je barometarski pritisak jednak RB = 755 mmHg. Odredite promjenu unutrašnje energije i količinu utrošenog rada ako se ugljični monoksid izobarično ohladi sa T1 = 573 K na T2 = 373 K.
Zadatak broj 2-4. Kako će se unutrašnja energija i entalpija 20 nm3 kiseonika promeniti pri izobaričnom zagrevanju sa 373 K na 1173 K ako je pritisak P = 9,8 bara. Koliki je rad koji obavlja gas?
Zadatak br. 2-5.0.6 nm3 vazduha sa izobaričnim dovodom toplote radi LP = 15.68 kJ. Odredite temperaturu T2 i zapreminu vazduha V, ako su u početnom stanju njegova temperatura i pritisak bili P1 = 4,42 bara, odnosno T1 = 293 K.
Zadatak broj 2-6. Kiseonik na temperaturi T1 = 353 K i pritisku PB jednakom 320 mmHg se komprimira pri T = Const do nadpritiska PM = 12 bara. Koliko puta se smanjuje zapremina kiseonika ako je barometarski pritisak RB = 745 mmHg?
Zadatak broj 2-7. 10 kg kiseonika se širi pri T = 423 K = Const od početnog pritiska R1 = 14,7 bara i proizvodi rad LT = 2969,4 kJ. Odredite pritisak na kraju ekspanzije i oslikajte proces u P - V i T - S koordinatama.
Zadatak broj 2-8. Cilindar sa pokretnim klipom sadrži 3,5 m3 azota pri pritisku P1 = 1,47 bara. Tokom izotermne kompresije, uklanja se 461 kJ topline. Odrediti pritisak P2 i zapreminu V2 dušika na kraju kompresije.
Zadatak broj 2-9. 0,4 kg zraka pri T1 = 573 K i P1 = 1,98 bara izotermno se širi do V2 = 1,68 m3/kg, a zatim se izobarično komprimira i, konačno, izohoričnim zagrijavanjem se ponovo vraća u prvobitno stanje. Odrediti za svaki proces ΔH, ΔS, ΔU, kao i toplinu i rad L. Također odrediti parametre (P, v, T) za sve tačke i prikazati procese u P - V i T - S koordinatama.
Zadatak broj 2-10. 0,3 Nm3 zraka je izotermno komprimirano iz početnog stanja P1 = 7,35 bara, T1 = 573K do nekog konačnog stanja P2, V2. Odrediti vrijednosti P2 i V2 ako je poznato da je tokom izotermne kompresije uklonjeno 167,6 kJ topline. Odrediti i promjenu unutrašnje energije i entalpije zraka.
Zadatak broj 2-11. 1. Nm3 vazduha adijabatski se širi iz početnog stanja 1 (P1 = 6 atm, t1 = 300 °C) do stanja u kojem je V2 = 3V3; tada se izotermno sabija na početnu vrijednost specifične zapremine V3 = V1. Odrediti parametre (P, v, T) tačaka 1, 2 i 3 i ukupan rad koji je izvršio gas. Predstavite proces u P - V i T - S koordinatama.
Zadatak broj 2-12. Rad utrošen na adijabatsku kompresiju 3 kg zraka je (- 471) kJ. Početno stanje zraka karakteriziraju parametri T1 = 288 K i P1 = 1 bar. Odredite konačnu temperaturu i promjenu unutrašnje energije.
Zadatak broj 2-13. 1. kg vazduha pri pritisku P1 = 4 bara i temperaturi T1 = 373 K širi se do pritiska P2 = 1 bar. Odrediti konačnu temperaturu, količinu topline i obavljeni rad ako do proširenja dođe: a) izohorično, b) izotermno, c) adijabatski i d) politropski sa eksponentom n = 1,2. Opišite proces u P - V i T - S koordinatama.
Problem #2-14. Boca kapaciteta 100 litara sadrži vazduh pod pritiskom P1 = 50 bara i temperaturom od T1 = 293 K. Pritisak okoline je P2 = 1 bar. Odrediti koristan rad koji zrak može obaviti kada se širi na pritisak okoline duž izoterme i adijabatski, kao i konačnu temperaturu zraka u balonu nakon adijabatskog širenja.
Zadatak broj 2-15. 1 kg zraka na temperaturi T1 = 290 K komprimuje se adijabatski do zapremine koja iznosi 1/5 početne zapremine, a zatim se izotermno širi do početne zapremine. Odredite rad koji vazduh obavlja kao rezultat oba procesa. Opišite proces u P - V i T - S koordinatama.
Problem #2-16. S politropskom ekspanzijom od 1 kilomola plina, njegov volumen se povećao za 20%, i apsolutna temperatura smanjen za 12%. Odrediti politropni indeks, vrijednost rada lP kJ/mol, ako je T1 = 490 K.
Problem #2-17. 50 kJ/kg toplote se dovodi do 1 kg vazduha prilikom njegovog kompresije u politropskom procesu. Odrediti politropni indeks, promjenu unutrašnje energije i rad kompresije ako se temperatura zraka poveća za 100 K tokom procesa.
Problem broj 2-18. 1 kg dušika u početnom stanju ima parametre P1 = 25 bara i T1 = 973 K. Nakon politropske ekspanzije (n = 1,18), tlak dušika postaje jednak P2 = 105 N/m2. Odrediti ΔU, ΔN u procesu, kao i količinu topline qP i rad ekspanzije lP.
1. Proces koji se odvija pri konstantnoj zapremini naziva se ___ izohorni ________
2. Proces koji se odvija pri konstantnom pritisku naziva se ___ izobarični ______
3. Proces koji se odvija na konstantnoj temperaturi naziva se ___ izotermni ___
4. Proces koji se odvija bez razmjene topline sa vanjskom okolinom naziva se _______________adijabatski ___________________________
5. Generalizirajući termodinamički proces, u kojem udio topline korišten za promjenu unutrašnje energije sistema ostaje konstantan, naziva se _________politropni______________
6. Količina toplote koju je potrebno preneti telu da bi se njegova temperatura promenila za jedan kelvin ili stepen Celzijusa naziva se ____ toplotni kapacitet _______
7. Za ciklus toplotnog motora, odnos rada obavljenog po ciklusu i količine unesene toplote je ______ efikasnost ciklusa ______
8. Količina toplote potrebna da se 1 kg tečnosti zagrijane do tačke ključanja pri konstantnom pritisku pretvori u suhu zasićenu paru naziva se ________________ toplota isparavanja ____________
9. Molekularna metoda prijenosa topline u kontinuiranom mediju u prisustvu temperaturnog gradijenta naziva se ____________ toplotna provodljivost ______________________________
10. Prijenos topline, koji se vrši kombinovanim djelovanjem provođenja topline i konvekcije, naziva se ___________ konvektivni prijenos topline ___________________________
11. Količina toplote koja se prenosi kroz bilo koju površinu u jedinici vremena naziva se ____________ toplotni tok __________
12. Toplotni tok po jedinici površine površine kroz koju prolazi naziva se _____ gustina toplotnog toka __________________________
13. Parametri stanja termodinamičkog sistema su
15. Sistem koji može da razmenjuje sa okolinom i materijom i energijom se naziva
|
1) otvoren |
3) adijabatski |
|
2) zatvoreno |
4) zatvoreno |
16. Sistem koji može da razmenjuje energiju, ali ne i materiju sa okolinom, naziva se
18. Jednačina stanja za proizvoljnu količinu idealnog gasa ima oblik
Sljedeće oznake su prihvaćene u opcijama odgovora:
p - pritisak
v- specifična zapremina
m je masa gasa
T - termodinamička temperatura
t- temperatura u Celzijusima
M je broj kilomola gasa
R- gasna konstanta
Univerzalna plinska konstanta
19. Međusobna transformacija se dešava u termomehaničkim sistemima
20. Proces bez razmene toplote sa okolinom se naziva
21. Proces koji se odvija na konstantnoj temperaturi naziva se
|
1) izohorni |
4) adijabatski |
|
2) izobarski |
5) izentropski |
|
3) izotermni |
22. Proces koji se odvija konstantnom zapreminom naziva se
24. Faktor koji ima najveći uticaj na specifični toplotni kapacitet gasa je
25. Uslovno gorivo se zove
1) gorivo najpogodnije za specifične uslove upotrebe
2) ugalj srednjeg kvaliteta
3) gorivo sa nižom toplotnom vrednošću od 29,31 MJ/kg
4) gorivo sa nižom toplotnom vrednošću od 35,0 MJ/kg
26. Slike pokazuju instalacijske dijagrame
1) a) snaga pare; b) gasna turbina; c) hlađenje parnog kompresora
2) a) hlađenje parnog kompresora; b) gasna turbina; c) snaga pare
3) a) apsorpciono hlađenje; b) gasna turbina; c) snaga pare
4) a) gasna turbina; b) hlađenje parnog kompresora; c) snaga pare
27. Toplotna pumpa je
1) rashladna mašina koja se koristi za opskrbu (grijanje) toplinom
2) pumpa bilo koje izvedbe koja se koristi za pumpanje tečnosti
rashladne tečnosti
3) uređaj za prenos toplote sa "vrućeg" izvora na "hladni".
4) uređaj za pumpanje temperature sa jednog izvora toplote na
28. Gustina toplotnog fluksa tokom prenosa toplote izračunava se po formuli
|
1)
|
3)
|
|
2)
|
4)
|
U datim opcijama odgovora koriste se sljedeće oznake:
 -koeficijent toplotne provodljivosti
-koeficijent toplotne provodljivosti
 -koeficijent prolaza toplote
-koeficijent prolaza toplote
 – koeficijent prolaza toplote
– koeficijent prolaza toplote
 - debljina zida
- debljina zida
 i
i  – temperatura nosača toplote
– temperatura nosača toplote
 i
i  su temperature zidnih površina
su temperature zidnih površina
|
Spojite odgovore |
29. U Otto ciklusu prikazanom na dijagramima
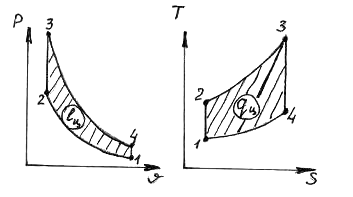
procesi notacije
1) 1-2 A) izohorno snabdevanje toplotom
2) 2-3 B) izobarično snabdevanje toplotom
3) 3-4 V) izohorično odvođenje toplote
4) 4-1 D) izobarično odvođenje toplote
D) izotermno snabdevanje toplotom
E) izotermno odvođenje toplote
G) adijabatsko širenje
H) adijabatska kompresija
1.__z___; 2.__a___; 3.__f___; 4.__u___