Naftalin, erime noktası olan kristal bir maddedir. Maddenin yapısına dayalı termal olayları inceleme yöntemleri
Naftalinin erimesi ve kristalleşmesi grafiğine dönelim (Şekil 198) ve bunun naftalinin soğumasıyla ilgili kısmını ele alalım.
Erimiş naftalin soğutulduğunda sıcaklığı düşer. Ama nasıl naftalin sertleşmeye başlar başlamaz sıcaklıktaki düşüş durur naftalin iç enerjisini çevreleyen cisimlere vermeye devam etse de. Sonuçta, sıcaklığı bu cisimlerin sıcaklığından daha yüksektir. Ve tüm naftalin sertleşene kadar sıcaklığı değişmez. Ancak hepsi sertleşir sertleşmez, sıcaklık tekrar düşmeye başlayacaktır.
Bu fenomen her yerde görülür. kristal gövde. Kristal bir cismin sıcaklığı katılaşması sırasında neden azalmaz?
Katılaşma sıcaklığında, sıvı haldeki bir cismin iç enerjisinin kendisinden daha büyük olduğunu zaten biliyoruz. içsel enerji katı halde. Tüm kürleme süreci boyunca, fazla iç enerji açığa çıkar ve soğutma nedeniyle kaybedilen enerjiyi yeniler. Bu nedenle, moleküllerin ortalama enerjisi ve sonuç olarak vücudun sıcaklığı değişmeden kalır. sertleştirme işlemi tamamlanana kadar. Bu andan itibaren, içindeki iç enerji kaybı artık yenilenemeyeceğinden katı cismin sıcaklığı düşmeye başlayacaktır.
Dikkatle yürütülen deneyler, kristal bir maddenin katılaşması sırasında, erimesi sırasında emilen ısının tam olarak aynı miktarda açığa çıktığını göstermektedir. Yani, 0 ° C sıcaklıkta 1 kg ağırlığındaki suyu katılaştırırken 3.4 106 J serbest bırakılır, ancak 0 °C sıcaklıkta 1 kg ağırlığındaki buzun erimesi için tam olarak aynı miktarda ısı gereklidir.
Sorular.
- Bir maddenin katılaşma sürecinde sıcaklığının 0 sabit kalması nasıl açıklanır?
- 1 kg su katılaştığında ne kadar enerji açığa çıkar?
Egzersizler.
- Eriyen buz, 0°C sıcaklıktaki bir odaya getirildi. Bu odadaki buz erimeye devam edecek mi?
- Buz parçaları bir kova su içinde yüzer. Su ve buzun toplam sıcaklığı 0°C'dir. Buz eriyecek mi yoksa su donacak mı? Bu neye bağlıdır?
- 0°C'de 4 kg buzu eritmek için ne kadar enerji gerekir?
- 20 kg kurşunu erime noktasında eritmek için ne kadar enerji gerekir? Bunun için ne kadar enerji gerekli ise başlangıç sıcaklığı 27°C?
Görevler.
- Sobanın üzerine iki özdeş kutu yerleştirin. Birine 0,5 kg su, diğerine 0,5 kg kar dökün. Suyun ne kadar sürdüğünü not edin. her iki bankada kaynatılır. Deneyiminizin kısa bir hesabını yazın ve sonuçları açıklayın.
- Ders kitabının sonunda böyle bir paragraf okuyarak "Metal Döküm" konusunda bir rapor hazırlayın.
Sıvıların ve gazların karşılıklı dönüşümlerine çok dikkat edildi. Şimdi katıların sıvılara ve sıvıların katılara dönüşümünü düşünün.
Kristal cisimlerin erimesi
Erime, bir maddenin katı halden sıvı hale geçmesidir.
Kristal ve amorf cisimlerin erimesi arasında önemli bir fark vardır. Kristal bir cismin erimeye başlaması için, erime noktası adı verilen her madde için oldukça spesifik bir sıcaklığa ısıtılması gerekir.
Örneğin, normalin altında atmosferik basınç buzun erime noktası 0 °C, naftalin - 80 °C, bakır - 1083 °C, tungsten - 3380 °C'dir.
Vücudun erimesi için erime noktasına kadar ısıtmak yeterli değildir; ona ısı sağlamaya devam etmek, yani iç enerjisini arttırmak gerekir. Erime sırasında kristal gövdenin sıcaklığı değişmez.
Vücut eridikten sonra ısınmaya devam ederse, eriyiğinin sıcaklığı artacaktır. Yukarıdakiler, vücut sıcaklığının ısınma zamanına bağımlılığının bir grafiği ile gösterilebilir (Şekil 8.27). Komplo AB katı bir cismin ısınmasına karşılık gelir, yatay bölüm Güneş- eritme işlemi ve arsa CD - eriyiği ısıtmak. Parsel bölümlerinin eğriliği ve eğimi AB ve CD proses koşullarına bağlıdır (ısıtılan gövdenin kütlesi, ısıtıcı gücü vb.).
Kristal bir cismin katı halden sıvı hale geçişi aniden, aniden gerçekleşir - ya sıvı ya da katı cisim.
Amorf cisimlerin erimesi
Amorf cisimler tamamen farklı davranırlar. Isıtıldıklarında, sıcaklık arttıkça yavaş yavaş yumuşarlar ve sonunda sıvı hale gelirler, tüm ısıtma süresi boyunca homojen kalırlar. Katıdan sıvıya kesin bir geçiş sıcaklığı yoktur. Şekil 8.28, amorf bir cismin katı halden sıvı hale geçişi sırasında sıcaklığa karşı zamana karşı bir grafiği göstermektedir.

Kristal ve amorf cisimlerin katılaşması
Maddenin aktarılması sıvı hal bir katı haline katılaşma veya kristalleşme denir(kristal cisimler için).
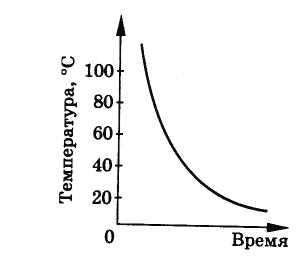
Kristal ve amorf cisimlerin katılaşması arasında da önemli bir fark vardır. Erimiş kristal bir cisim (eriyik) soğutulduğunda, sıcaklığı belirli bir değere düşene kadar sıvı halde kalmaya devam eder. Kristalleşme sıcaklığı olarak adlandırılan bu sıcaklıkta vücut kristalleşmeye başlar. Katılaşma sırasında kristal gövdenin sıcaklığı değişmez. Çok sayıda gözlem göstermiştir ki kristal cisimler, her madde için belirlenen aynı sıcaklıkta erir ve katılaşır. Vücudun daha fazla soğutulmasıyla, tüm eriyik katılaştığında vücut sıcaklığı tekrar düşecektir. Yukarıdakiler, vücut sıcaklığının soğuma zamanına bağımlılığının bir grafiği ile gösterilmektedir (Şekil 8.29). Komplo ANCAK 1 AT 1 sıvı soğutmaya karşılık gelir, yatay kesit AT 1 İTİBAREN 1 - kristalizasyon süreci ve arsa C 1 D 1 - kristalizasyondan kaynaklanan katı gövdenin soğutulması.

Kristalleşme sırasında sıvı halden katı hale geçen maddeler de ara durumlar olmadan aniden geçer.
Reçine gibi amorf bir cismin katılaşması, tüm parçalarında kademeli ve eşit olarak gerçekleşir; reçine homojen kalır, yani sertleşir amorf cisimler- sadece kademeli olarak kalınlaşması. Belirli bir sertleşme sıcaklığı yoktur. Şekil 8.30, zamana karşı kürleme reçinesi sıcaklığının bir grafiğini göstermektedir.
Böylece, amorf maddelerin belirli bir sıcaklığı, erimesi ve katılaşması yoktur.
Erime - vücudun kristalden geçişi katı hal sıvı içine. Erime, özgül füzyon ısısının emilmesiyle gerçekleşir ve faz geçişi ilk tür.
Erime yeteneği anlamına gelir fiziksel özellikler maddeler
Normal basınçta tungsten metaller arasında en yüksek erime noktasına sahiptir (3422°C), basit maddeler genel olarak - karbon (çeşitli kaynaklara göre 3500 - 4500 ° C) ve keyfi maddeler arasında - hafniyum karbür HfC (3890 ° C). Helyumun en düşük erime noktasına sahip olduğunu varsayabiliriz: normal basınçta, keyfi olarak düşük sıcaklıklarda sıvı kalır.
Normal basınçta birçok maddenin sıvı fazı yoktur. Isıtıldıklarında hemen süblimleşmeden geçerler. gaz hali.
Şekil 9 - Eriyen buz
Kristalizasyon, bir maddenin kristallerin oluşumu ile sıvı halden katı kristal haline faz geçişi sürecidir.
Bir faz, termodinamik bir sistemin, sistemin diğer kısımlarından (diğer fazlar) bir ara yüzey ile ayrılan homojen bir parçasıdır. kimyasal bileşim, atlamalarda maddenin yapısı ve özellikleri değişir.
Şekil 10 - Suyun buz oluşumuyla kristalleşmesi
Kristalizasyon, kristal formundaki katı bir fazı çözeltilerden veya eriyiklerden ayırma işlemidir; kimya endüstrisinde, kristalizasyon işlemi maddeleri saf halde elde etmek için kullanılır.
Kristalleşme, örneğin bir sıvının aşırı soğutulması veya bir buharın aşırı doygunluğu gibi belirli bir sınırlama koşuluna ulaşıldığında, neredeyse anında birçok küçük kristal ortaya çıktığında başlar - kristalleşme merkezleri. Kristaller, bir sıvı veya buhardan atomlar veya moleküller ekleyerek büyürler. Kristal yüzlerin büyümesi katman katman gerçekleşir, tamamlanmamış atomik katmanların (basamakların) kenarları büyüme sırasında yüz boyunca hareket eder. Büyüme hızının kristalleşme koşullarına bağımlılığı, çeşitli büyüme biçimlerine ve kristal yapılara (çokyüzlü, katmanlı, iğnemsi, iskelet, dendritik ve diğer biçimler, kalem yapıları vb.) yol açar. Kristalleşme sürecinde, kaçınılmaz olarak çeşitli kusurlar ortaya çıkar.
Kristalizasyon merkezlerinin sayısı ve büyüme hızı, aşırı soğutmanın derecesinden önemli ölçüde etkilenir.
Aşırı soğutma derecesi, sıvı bir metalin kristal (katı) bir modifikasyona geçiş sıcaklığının altındaki soğuma seviyesidir. Enerjiyi telafi etmek gerekiyor gizli ısı kristalizasyon. Birincil kristalleşme, bir sıvıdan katı bir duruma geçiş sırasında metallerde (ve alaşımlarda) kristallerin oluşmasıdır.
Özısı erime (ayrıca: erime entalpisi; eşdeğer bir kristalleşme ısısı kavramı da vardır) - bir denge izobarik-izotermal sürecinde kristal bir maddenin bir birim kütlesine aktarılması için verilmesi gereken ısı miktarı katı (kristal) halden sıvıya (bir maddenin kristalleşmesi sırasında aynı miktarda ısı açığa çıkar).
Erime veya kristalleşme sırasındaki ısı miktarı: Q=ml
> Buharlaşma ve kaynama. Özgül buharlaşma ısısı
Buharlaşma, bir maddenin sıvı halden gaz haline (buhar) geçiş sürecidir. Buharlaşma işlemi, yoğuşma işleminin tersidir (buhardan sıvı hale geçiş. Buharlaşma (buharlaşma), bir maddenin yoğun (katı veya sıvı) fazdan gaz (buhar) haline geçişi; birinci derece faz geçiş.
Daha yüksek fizikte daha ayrıntılı bir buharlaşma kavramı vardır.
Buharlaşma, bir sıvının yüzeyinin veya sağlam vücut parçacıklar (moleküller, atomlar) uçar (ayır), Ek > Ep.
Şekil 11 - Bir fincan çay üzerinde buharlaşma
Özgül buharlaşma ısısı (buharlaşma) (L) -- fiziksel miktar Kaynama noktasında alınan 1 kg cismin sıvı halden gaz hale geçmesi için verilmesi gereken ısı miktarını gösterir. Buharlaşmanın özgül ısısı J/kg olarak ölçülür.
Kaynama, faz ayırma sınırlarının görünümü ile bir sıvıda (bir maddenin sıvıdan gaz haline geçişi) buharlaşma sürecidir. Atmosferik basınçta kaynama noktası genellikle kimyasal olarak saf bir maddenin ana fizikokimyasal özelliklerinden biri olarak verilir.
Kaynama birinci dereceden bir faz geçişidir. Kaynama, buharlaşma odaklarının oluşması nedeniyle yüzeyden buharlaşmaya göre çok daha yoğun gerçekleşir. ulaşılan sıcaklık kaynama ve safsızlıkların varlığı.
Kabarcık oluşumu süreci basınçtan etkilenebilir, ses dalgaları, iyonlaşma. Özellikle, kabarcık odasının çalıştığı yüklü parçacıkların geçişi sırasında iyonizasyondan mikro hacimlerde sıvının kaynatılması ilkesine dayanmaktadır.
Şekil 12 - Kaynar su
Kaynama, sıvı buharlaşma ve buhar yoğunlaşması sırasındaki ısı miktarı: Q=mL






