Suyun erime ve kaynama noktaları sırasıyla eşittir. Bir katının özgül gizli ergime ısısı
1. SUYUN ÖZELLİKLERİ VE YAPISI
1.1. Su özelliklerinin anomalisi
Sadece 18. yüzyılın sonunda ve 19. yüzyılın başında. su denilen bir maddeyi neyin oluşturduğunun farkına vardı. G. Cavendish, A. Lavoisier, A. Humboldt, J.L.'nin deneyleri. Gay-Lussac, suyun iki hacim hidrojen ve bir hacim oksijenden oluştuğunu kanıtladı. kimyasal formülü var H 2 Ö ve moleküler ağırlık 18. Bununla birlikte, yavaş yavaş, neredeyse tüm fiziko-kimyasal parametrelerde bu maddenin benzersiz olduğu, diğer doğal bileşiklerden keskin bir şekilde farklı olduğu ortaya çıktı.
Suyun erime ve kaynama noktaları
Kabul edilen sıcaklık referans sistemlerine dayanmaktadırlar.
Sıcaklık ölçekleri oluşturmak için su seçimi.
Santigrat(1701-44). Santigrat ölçeği -1741 Suyun kaynama ve erime noktaları de atmosferik basınç sırasıyla 100 o C ve 0 o C'ye eşit,
Réaumur(1683-1757). 1730 Réaumur ölçeği. Suyun kaynama noktası 80 o (1 o C \u003d 5/4 o R) olarak alınır.
Fahrenhayt(1686-1736). Buzun erime noktası 32 o F olarak alınır, suyun kaynama noktası 180 o F'dir (t o C \u003d 5/9 t o F - 32).
Periyodik yasanın keşfiD.I. Mendeleyev (1869). Suyun fiziksel parametreleri ile periyodik yasa arasındaki tutarsızlık.
Periyodik yasa ile tutarsızlık, oksijen grubu elementlerinin hidrojen bileşiklerinin kaynama ve erime noktalarının karşılaştırılmasından görülebilir. H 2 Se için veriler grafikten alınmıştır. Su için, periyodik yasaya göre, suyun erime noktasının yaklaşık eksi 90 o ve kaynama noktasının yaklaşık -70 o olacağı görülebilir. "Normal" koşullar altında su zehirli, kötü kokulu bir gaz olacaktır. Dünya'da yaşam imkansız olurdu.
Bu "anormal" özellikler sayesinde su, yaşamı korur ve gezegenimizin termal ve gaz rejimini düzenler.
Suyun ısı kapasitesi
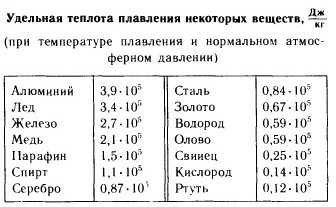
Suyun özgül ısı kapasitesi tüm sıvıların en yükseğidir. Ve burada su standart olarak alınır: 1 g suyu 1 o C ısıtmak için 1 kalori termal enerji harcamak (kalor - ısı, lat.). Karşılaştırma için: alçı - 0.27, kuru kil 0.22 cal. (1 kal = 4.187 J.). Buzun ve buharın özgül ısı kapasitesi, 0,5 cal/g'ın yarısı kadardır. derece Suyun gizli erime ve buharlaşma ısıları da alışılmadık derecede büyüktür - 79 ve 539 cal. Böylece 0°C sıcaklıktaki 1 gr buzu buhara dönüştürmek için 79 + 100 + 539 = 718 kalorilik ısı harcamanız gerekir. Son derece yüksek bir ısı kapasitesi nedeniyle su, gezegenimizdeki termal rejimin ana düzenleyicisidir. Dünya Okyanusu'nun etkisi, karasal iklim olarak adlandırılan, deniz kıyılarından en uzak olanlar dahil, Dünya'nın neredeyse tüm noktalarını etkiler. Büyük su kütleleri ve hepsinden önemlisi Dünya Okyanusu, Dünya'nın termal rejiminin düzenleyicileridir. Toprak tabakası için yıllık ısı cirosu, örneğin Baltık ve Karadeniz 48-52 için 1.5-3 kcal / cm2'dir. Rezervuarların yokluğunda, sıcaklık yazın yükselir ve kışın birkaç yüz derece düşer ve dünyadaki yaşam olurduimkansız; aksine, Dünya tamamen okyanusla kaplı olsaydı, yıllık hava genliği ekvatorda 0'dan kutuplarda 5-6 o C'ye değişirdi. Okyanusun etkisi, Antarktika'daki soğuk kutuplar da dahil olmak üzere tüm gezegene uzanır.
Suyun yüksek ısı kapasitesi, aşağıdaki gibi göstergelerle ilişkilidir. gizli füzyon ısısı, bileşen 333.7 10 3 J/kg, ve gizli buharlaşma ısısı, bileşen 2258.10 3 J/kg, yani. 1 kg buzu sıvıya ve 1 kg sıvı suyu buhara dönüştürmek için büyük miktarda enerji gerekir. Bu, doğal süreçler sırasında bir enerji akümülatörü olarak özel rolünü önceden belirleyen suyun yüksek enerji yoğunluğunun kanıtıdır.
Dielektrik sabiti su ( )
Değer dielektrik sabiti çünkü su tüm sıvıların en yükseğidir ve 20°C sıcaklıkta 80.1'e eşittir. Yaklaşık 0°C sıcaklıkta yaklaşık 82'dir. Bu, tuzlar suda çözündüğünde, arasındaki elektriksel etkileşimin gücünün zıt yüklü parçacıklar 80 kat azalır ve tuzların iyonlara ayrışmasına neden olur. Çoğu çözücü 50'den fazla, polar olmayan sıvılar (benzin, kerosen) 3'ten fazla değildir. Suyun bu özelliği fenomeni önceden belirler. elektrolitik ayrışma, yani tuzların, asitlerin, alkalilerin sulu çözeltilerde zıt yüklü iyonlara ayrışma yeteneği. Su çözücü olarak inerttir. Besinleri canlı organizmalara getirir ve toksinleri çıkarır ve yerini alacak hiçbir şey yoktur. O. ve suyun bu özelliği olmadan dünyadaki yaşam olurduimkansız.
Su mineralleri çözer, ancak su buharlaşırsa yeniden doğarlar. Bu özellik, birkaç saat içinde (canlı organizmalarda) meydana gelen ve Dünya'nın bağırsaklarında (jeolojik) milyonlarca yıl süren çeşitli düzenlerin su döngülerini önceden belirleyen devasa jeolojik ve biyolojik öneme sahiptir. Görünüşe göre, Dünya'da yaşamın ortaya çıkması, büyük ölçüde suyun bu şaşırtıcı özelliğinden kaynaklanmaktadır.
su yoğunluğu .
Su hariç tüm maddelerin erime noktasında bir maksimum yoğunluğu vardır. Maksimum su yoğunluğu(1.0 g/cm3) t-re 3.98 o'ya karşılık gelir; buz yoğunluğu 0.918 g/cm3; sadece su kendi eriyiğinde batmaz; Miletoslu Thales buna dikkat çekmiştir. Su donduğunda, gezegenin hava rejiminin ana düzenleyicisi olan başta Dünya Okyanusu olmak üzere su kütlelerinin korunmasını sağlayan ince bir koruyucu buz kabuğu oluşur. Ve suyun bu özelliği olmadan hayat tamamen farklı bir şekle bürünecekti.
1.2. Suyun gizli yapısı hakkında fikirler
Suyun yapısı. Yirminci yüzyılın otuzlu yılları, su çalışmasıyla ilgili yeni bir büyük keşif getirdi: İngiliz fizikçiler J. Bernal ve R. Fowler, X-ışını ve spektroskopik çalışmalara dayanarak, su moleküllerinin belirli bir şekilde sıralandığını belirlediler. , her su molekülü bir tetrahedron içinde diğer dört su molekülü ile çevrilidir. Böylece 18. yüzyılın sonunda yapılan açıklama doğrulanmış oldu. V. Röntgen, sıvı suyun karmaşık yapısını ve tek tek moleküller arasında ek bağların varlığını düşündü. Bilim adamları bu fenomeni su yapısı, Sıvı su, monomerik ve polimerik moleküllerin bir karışımı olduğundan, katıların kristal kafesi ile tamamen özdeşleşmenin imkansız olduğu açık olsa da, tek tek monomerler arasındaki bağlar dinamiktir: sürekli görünürler, bozulurlar, güçlenirler, zayıflarlar.
Su yapısının varlığının ana nedeni, bireysel atomlar - hidrojen arasındaki özel bir bağ türüdür. Bu bağ doğada elektrostatiktir, ancak normalden daha zayıftır. değerlik bağı Ayrı monomerler oluşturan hidrojen ve oksijen atomları arasında. Her bir H2O monomerinde, hidrojen ve oksijen atomları arasındaki mesafe 0.1 nm'dir ve değerlik bağları arasında oluşan açı yaklaşık 105º'dir. Bir hidrojen bağında, atomlar arasındaki mesafe 0.176 nm'ye çıkar ve kesinlikle sabit değildir.
Tek tek monomerleri hidrojen bağı ile bağlama fikrine dayanan suyun yapısının birkaç modeli vardır. J. Bernal ve R. Fowler, üç tip moleküler düzenlemenin varlığını öne sürdüler: a) kristal buz kafesine yaklaşan yapılar 0 ila 4ºº arasındaki sıcaklıklarda bulunur; b) kuvars gibi yapılar 4-200ºС sıcaklıkta hakimdir; c) normal sıvılar için tipik olan (neredeyse hidrojen bağlarından yoksun) sıkı paketlenmiş yapılar 200 ºС'nin üzerindeki sıcaklıklarda ortaya çıkar [Blokh A.M. Suyun yapısı ve jeolojik süreçler.L., 1969, s.216].
Suyun yapısal özelliklerinin yorumlanmasına ilginç bir yaklaşım İtalyan fizikçi M. Angeno (1967) tarafından önerildi. Fikirlerine göre, her su molekülü ikiden fazla değil, sözde kolektif hidrojen bağlarına katılabilir, bunun sonucunda değerlik ve hidrojen bağlarının kombinasyonu bağlantılar oluşturur. farklı şekiller(Şek. 1).
Pirinç. 1. Sıvı sudaki moleküler agregalar (M. Ajendo'ya göre).
Bu bağlantılar zincirler, halkalar ve sürekli oluşan, yok edilen ve molekül alışverişi yapan daha karmaşık sistemler oluşturabilir. nerede toplam sayısı sistemdeki hidrojen köprüleri sabit kalır ve olası agrega türleri, sıcaklık tarafından belirlenen statik bir dengede suda farklı oranlarda bulunur. Altı molekülden oluşan halkalar buzun yapısına yaklaşıyor gibi görünüyor.
Sıvı suyun yapısal yapısı açısından, tüm anormal özellikler. Hidrojen bağlarını yok etme ihtiyacı, suyun yüksek enerji yoğunluğunu önceden belirler, bunun sonucunda erime ve kaynama noktaları, ısı kapasitesi ve erime ve buharlaşma gizli ısıları anormal derecede yükselir. Su 4 ila 0ºº sıcaklık aralığında soğutulduğunda, yapı daha yoğun tetragonalden altıgen buz paketine yeniden yapılandırılır. Su molekülleri arasındaki güçlü bağ, onu çözünen maddelere karşı etkisiz hale getirir. Suyun yapısı elektrostatik bağlardan oluştuğu için çeşitli alanlardan (sıcaklık, jeodinamik, manyetik, elektrik) etkilenir.
Sıcaklık arttıkça suyun yapısı bozulmaya başlar. Hidrojen bağları korunmuş moleküllerin yüzdesini hesaplayan farklı yazarların tahminleri birbirine yakındır: moleküllerin yaklaşık yarısı soğuk suda yapılandırılır, 100°C sıcaklığa ulaştıktan sonra yapısal bağlar moleküllerin yaklaşık %30'unda korunur ve kritik sıcaklığa yaklaşıldığında (374°C) yapılandırılmış moleküller kaybolur.
Basınç uygulandığında sıvı molekülleri birbirine yaklaşır ve viskoziteleri artar. Su oldukça farklı davranır. Yüklerin ilk aşamaları, su yapısının yeniden yapılandırılmasına, moleküller arası boşlukların doldurulmasına, viskozitesinde bir azalmanın eşlik etmesine yol açar ve sadece yaklaşık 100 MPa'lık (doğal koşullar için yeterince yüksek) basınçlardan başlayarak viskozitede kademeli bir artış başlar.
1.3. Su çeşitleri
Suyun yapısal özellikleri ve çeşitli oksijen ve hidrojen izotoplarının varlığı, suyun birçok fizikokimyasal tür oluşturabilmesinin nedenidir. İşte onlardan bazıları.
Aktif su hakkında fikirler
Novosibirsk bilim adamlarının (F.A. Letnikov ve diğerleri) 300-400 ºС sıcaklıklarda ve 100 MPa'ya kadar olan basınçlarda otoklavlarda su arıtımı üzerine yaptıkları deneyler, bunun birçok mineral için (sülfürler, alçıtaşı, kuvars) suyun çözünme gücünü arttırdığını gösterdi. pH düşer, elektriksel iletkenlik artar. Sıcaklığın ve basıncın su yapılarındaki değişim üzerindeki etkisi, uzmanları büyük derinliklerde (yani yüksek sıcaklık ve basınçlarda) bulunan suyun özelliklerini simüle etme olasılığı fikrine götürdü ve bunun keşfine yol açtı. aranan aktif su . Otoklavlarda su arıtılmasından sonra Termal mineral kaynakların suyunda aktif bir durumun tespiti, bazı maden sularının iyileştirici özelliklerinin sadece kimyasal bileşimleriyle değil, aynı zamanda suyun biyolojik aktivitesinde bir artışla da ilişkili olabileceğini düşündürmektedir. etkinleştirildiğinde. Aktivasyon olgusunun keşfi, yalnızca hidrotermal çözeltilerin bazı özelliklerini açıklamayı mümkün kılmakla kalmaz, aynı zamanda maden sularının yapay olarak hazırlanması için umutlar da açar.
Elektrik alanının etkisi
İçine su konulduğunda Elektrik alanı yapısında bazı değişiklikler olabilir. Böylece, elektrik akımı yapısal bağları zayıflatır ve suyun alternatif bir elektrik akımı ile arıtılmasından sonra, mevcut birkaç veriye göre buharlaşma oranı% 11-18 oranında artar. Elektrik alanlarının su tarafından ışık ışınlarının absorpsiyonunun yoğunluğu üzerindeki etkisi not edilmiştir.
Manyetik alanın etkisi
Suyun insan vücudu üzerindeki olumlu etkisi manyetik alan, Orta Çağ'da fark edildi. 1945'te Belçikalı mühendis T. Vermayern, ön manyetik su arıtma kullanarak buhar kazanlarında kireç oluşumunun yoğunluğunu azaltmanın basit bir yolunun patentini aldı. Şu anda, ölçekle uğraşmanın bu yöntemi çok yaygın olarak kullanılmaktadır. Birçok termik santralin (Rostovskaya, Astrakhanskaya, vb.), Eyalet bölgesi enerji santrallerinin (Simferopolskaya, Saratovskaya), fabrikaların, madenlerin ve diğer işletmelerin deneyimine atıfta bulunmak yeterlidir.
Birçok tarım ürününün, çiçeklerinin ve meyvelerinin tohumlarını manyetize su ile ıslatırken, çimlenmeleri önemli ölçüde artar. Şu anda, yerli sanayi, tarım işletmeleri ve bahçıvanlar için önerilen su manyetizasyonu için özel cihazlar bile üretiyor.
Su- II . XX yüzyılın 60'larının başında. N.N. Fedyakin son derece ilginç bir fenomen keşfetti: su buharı ince kuvars kılcal damarlarında (5-20 mikron çapında) yoğunlaştığında, özellikleri normal sudan önemli ölçüde farklı olan bir sıvı oluşur. Daha sonra, su-II olarak adlandırılan bu sıvı, büyük Rus ve yabancı araştırmacılar, özellikle B.V. Deryagin. Su-II'nin yaklaşık 1 g/cm3 yoğunluğa ve 1.49 kırılma indisine (sıradan su için 1.33'e karşılık) sahip viskoz bir sıvı olduğu bulundu. Bu sıvı eksi 35÷40 ºС'ye soğutulduğunda hacim atlaması olmadan katı hale geçer. Atmosferik basınçta su-II'nin kaynama noktası yaklaşık 250 ºС'dir. Water-II, aşağıdakilerden hiçbirine karşılık gelmeyen benzersiz bir kızılötesi absorpsiyon spektrumuna sahiptir. bilinen maddeler. Elde edilen maddenin değiştirilmiş hali stabildir ve damıtma sırasında korunur (bu prosedür, su-II'nin kısımlarını irileştirmek için kullanılmıştır). Yeni elde edilen maddenin kesinlikle H2O formülüne tekabül ettiği kanıtlandı; Görünüşe göre kuvars, su-II'nin sentezinde bir katalizör rolü oynuyor.
Su-II'nin çalışması, B.V. Deryagin ve işbirlikçileri, hidrojen ve oksijen arasında, 6-10 H2O monomerik moleküllerden oluşan polimerleri oluşturan özel bir güçlü moleküler bağın var olabileceği sonucuna vardılar.Su-II'nin doğal sistemlerdeki rolünü belirlemek hala zor, ancak Çalışmasının derin jeolojik süreçlerin incelenmesinde belirli umutlar vaat ettiği açıktır.
Ağır su. Şu anda, hidrojenin üç izotopu (1 H-protium, 2H-döteryum D, 3H-trityum T) ve üç oksijen izotopu (16 O, 17 O, 18 O) bilinmektedir. Bu, farklı izotop kombinasyonlarına sahip önemli sayıda su çeşidi olabileceği anlamına gelir. Bunların en kararlısı, sıradan suda safsızlık olarak yüzde yüzde bir oranında bulunan ağır su D 2 O'dur. Ağır su, özelliklerine göre sıradan sudan önemli ölçüde farklıdır: maksimum yoğunluk t=11.2 ºС'de not edilir ve 1.056 g/cm3'tür; viskozite %20 daha yüksektir; dielektrik sabiti %0.3-0.5 daha düşüktür. Ağır suyun erime noktası 3.8 ºС'dir; kaynama noktası 101.4 ºС. Verilen verilere ve bir dizi başka verilere bakılırsa, döteryum bağı hidrojen bağından bile daha güçlüdür.Nükleer reaktörlerde nötron moderatörü olarak ağır su kullanılır. Ağır su zehirlidir, içinde canlılar ve bitkiler ölür. Bazı bilim adamları, gezegenimizdeki yaşamın evrimini sudaki döteryum konsantrasyonundaki değişikliklerle ilişkilendirir: özellikle, sudaki modern döteryum konsantrasyonuna kıyasla sudaki daha düşük döteryum konsantrasyonu, Mesozoyik'te dev otçulların varlığını açıklar. Ancak bu hükümler tartışmalıdır.
Karmaşık yapısı ve izotopu ile önceden belirlenmiş su çeşitlerine ilişkin burada verilen örnekler, su gibi şaşırtıcı bir maddenin incelenmesinde yeni keşiflerin ortaya çıkma ihtimalinin ne kadar tükenmez olduğunu göstermektedir.
MAKALE
"eriyen cisimler"
Gerçekleştirilen:
Prisyazhnyuk Olga 9-A
Kontrol:
Nevzorova Tatyana İgorevna
giriiş
Isı miktarının hesaplanması
Erime
Özgül füzyon ısısı
Metallerin eritilmesi
Suyun erime ve kaynama noktası
erir
Erime hakkında ilginç
Sonuç (sonuçlar)
kullanılmış literatür listesi
giriiş
Toplam durum - belirli niteliksel özelliklerle karakterize edilen bir madde durumu: hacmi ve şekli koruma yeteneği veya yetersizliği, uzun menzilli ve kısa menzilli düzenin varlığı veya yokluğu ve diğerleri. Toplama durumundaki bir değişikliğe, serbest enerji, entropi, yoğunluk ve diğer temel fiziksel özelliklerde sıçrama benzeri bir değişiklik eşlik edebilir.
Üç ana kümelenme durumu vardır: katı, sıvı ve gaz. Bazen plazmayı bir kümelenme durumu olarak sınıflandırmak tam olarak doğru değildir. Sıvı kristaller veya Bose-Einstein yoğuşması gibi başka kümelenme durumları da vardır.
Toplama durumundaki değişiklikler, faz geçişleri olarak adlandırılan termodinamik süreçlerdir. Aşağıdaki çeşitler ayırt edilir: katıdan sıvıya - erime; sıvıdan gaza - buharlaşma ve kaynama; katıdan gaza - süblimleşme; gazdan sıvıya veya katıya - yoğuşma. Ayırt edici bir özellik, plazma durumuna geçişin keskin bir sınırının olmamasıdır.
Fizikteki çeşitli durumları tanımlamak için daha geniş bir termodinamik faz kavramı kullanılır. Bir fazdan diğerine geçişleri tanımlayan olaylara kritik olaylar denir.
Katı: Hacmi ve şekli koruma yeteneği ile karakterize edilen bir durum. Katı bir cismin atomları, denge durumu etrafında sadece küçük titreşimler yapar. Hem uzun menzilli hem de kısa menzilli düzen vardır.
Sıvı: Bir maddenin sıkıştırılabilirliğinin düşük olduğu, yani hacmini iyi koruduğu ancak şeklini koruyamadığı durumu. Sıvı, yerleştirildiği kabın şeklini kolaylıkla alır. Bir sıvının atomları veya molekülleri, denge durumuna yakın titreşir, diğer atomlar tarafından kilitlenir ve genellikle diğer serbest yerlere atlar. Sadece kısa menzilli düzen var.
Gaz: İyi sıkıştırılabilirlik ile karakterize edilen, hem hacmi hem de şekli koruma yeteneğinden yoksun bir durum. Gaz, kendisine sağlanan tüm hacmi işgal etme eğilimindedir. Bir gazın atomları veya molekülleri nispeten serbest davranır, aralarındaki mesafeler boyutlarından çok daha fazladır.
Diğer durumlar: Derin soğutma üzerine, bazı maddeler (hepsi değil) süper iletken veya süper akışkan duruma geçer. Bu durumlar, elbette, ayrı termodinamik fazlar, ancak evrensel olmamaları nedeniyle, maddenin yeni toplu halleri olarak adlandırılmayı pek hak etmiyorlar. Macunlar, jeller, süspansiyonlar, aerosoller, vb. gibi belirli koşullar altında hem katıların hem de sıvıların ve hatta gazların özelliklerini sergileyen homojen olmayan maddeler, genellikle maddenin herhangi bir belirli agrega durumuna göre değil, dağılmış malzemeler olarak sınıflandırılır.
Erime
Pirinç. 1. Saf maddenin durumu (şema)

Pirinç. 2. Kristal bir cismin erime sıcaklığı

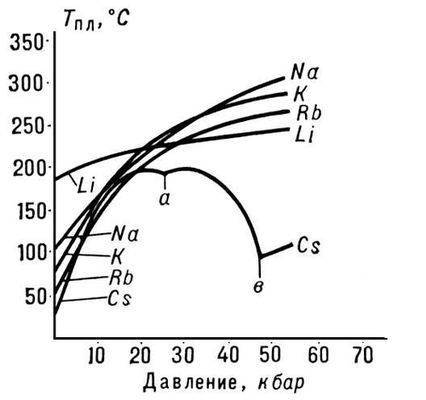
Pirinç. 3. Alkali metallerin erime noktası
Erime - bir maddenin kristal (katı) halden sıvıya geçişi; ısının emilmesiyle oluşur (birinci dereceden faz geçişi). Saf maddelerin P.'sinin temel özellikleri, erime noktası (Tmelt) ve P. işleminin uygulanması için gerekli olan ısıdır (erime ısısı Qmelt).
P.'nin sıcaklığı, p dış basıncına bağlıdır; saf bir maddenin durum diyagramında, bu bağımlılık erime eğrisi (şekil 1'de katı ve sıvı fazların bir arada bulunma eğrisi, AD veya AD ") ile gösterilir. Alaşımların ve katı çözeltilerin erimesi, bir kural, sıcaklık aralığında (sabit bir Tmelt ile ötektik hariç) Bir alaşımın P. başlangıcının ve bitişinin sıcaklığının, belirli bir basınçta bileşimine bağımlılığı, durum diyagramlarında özel çizgilerle gösterilir ( Liquidus ve solidus eğrileri, bkz. Binary sistemler) katı kristal halden izotropik sıvıya aşamalar halinde (belirli bir sıcaklık aralığında) meydana gelir, her aşama kristal yapının yok edilmesinde belirli bir aşamayı karakterize eder.
Belirli bir P sıcaklığının varlığı, katıların doğru kristal yapısının önemli bir işaretidir. Bu temelde, sabit bir Tm'ye sahip olmayan amorf katılardan ayırt etmek kolaydır. Amorf katılar, kademeli olarak sıvı hale geçer, artan sıcaklıkla yumuşar (bkz. Amorf hal). Saf metaller arasında en yüksek sıcaklığa (3410°C), cıva ise en düşük sıcaklığa (-38.9°C) sahiptir. Özellikle refrakter bileşikler şunları içerir: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), vb. Kural olarak, yüksek Tm, daha yüksek Qm değerleri ile karakterize edilir. Kristalli maddelerde bulunan safsızlıklar Tm'lerini azaltır. Bu, pratikte düşük Tmelt'li alaşımlar (örneğin bakınız, Tmelt = 68 °C'ye sahip Wood alaşımı) ve soğutma karışımları elde etmek için kullanılır.
P., kristalli madde Tpl'ye ulaştığında başlar. P.'nin başlangıcından tamamlanmasına kadar, maddenin sıcaklığı, maddeye ısı transferine rağmen, sabit ve Tmelt'e eşit kalır (Şekil 2). Normal koşullar altında bir kristali T > Tmelt'e ısıtmak mümkün değildir (bkz. Aşırı Isınma), kristalizasyon sırasında eriyiğin önemli bir aşırı soğuması nispeten kolay bir şekilde elde edilir.
Tm'nin p basıncına bağımlılığının doğası, P'deki hacimsel değişikliklerin (DVm) yönü ile belirlenir (bkz. Clapeyron-Clausius denklemi). Çoğu durumda, bir maddenin P.'sine hacimlerinde bir artış eşlik eder (genellikle yüzde birkaç). Bu durumda, basınçtaki bir artış Tm'de bir artışa yol açar (Şekil 3). Bununla birlikte, bazı maddelerde (su, bir takım metaller ve metalitler, bkz. Şekil 1), P. sırasında hacimde bir azalma meydana gelir. Bu maddelerin P. sıcaklığı artan basınçla azalır.
P.'ye maddenin fiziksel özelliklerinde bir değişiklik eşlik eder: maddenin kristal yapısının bozukluğunu yansıtan entropide bir artış; ısı kapasitesinde, elektrik direncinde artış [sıvı halde daha yüksek bir elektrik iletkenliğine sahip olan bazı yarı metaller (Bi, Sb) ve yarı iletkenler (Ge) hariç]. P. sırasında, kesme direnci neredeyse sıfıra düşer (enine elastik dalgalar eriyikte yayılamaz, bkz. Sıvı), sesin yayılma hızı (boyuna dalgalar), vb. azalır.
Moleküler ve kinetik temsillere göre, P. aşağıdaki gibi gerçekleştirilir. Kristal bir gövdeye ısı uygulandığında, atomlarının titreşimlerinin enerjisi (salınım genliği) artar, bu da vücut sıcaklığında bir artışa yol açar ve kristalde (kristal kafesin doldurulmamış düğümleri) çeşitli kusurların oluşumuna katkıda bulunur. - boşluklar; düğümleri arasına gömülü atomlar tarafından kafesin periyodikliğinin ihlali vb., bkz. Kristallerdeki kusurlar). Moleküler kristallerde, moleküller küresel bir şekle sahip değilse, molekül eksenlerinin karşılıklı yöneliminde kısmi düzensizlik meydana gelebilir. Kusur sayısındaki kademeli bir artış ve bunların birlikteliği, ön eritme aşamasını karakterize eder. Tmelt'e ulaşıldığında, kristalde kritik bir kusur konsantrasyonu oluşur ve kristalleşme başlar; kristal kafes kolayca mobil mikroskobik bölgelere ayrılır. P. sırasında verilen ısı, vücudu ısıtmak için değil, atomlar arası bağları kırmak ve kristallerdeki uzun menzilli düzeni yok etmek için kullanılır (bkz. Uzun menzilli düzen ve kısa menzilli düzen). Öte yandan, mikroskobik bölgelerin kendisinde, atomların dizilişindeki kısa menzilli düzen, erime noktasında önemli ölçüde değişmez (çoğu durumda Tmelt'teki eriyiğin koordinasyon sayısı, kristalinkiyle aynı kalır). Bu, buharlaşma ısılarına kıyasla Qm füzyon ısılarının daha düşük değerlerini ve P sırasında maddelerin bir dizi fiziksel özelliğindeki nispeten küçük değişimi açıklar.
Piroliz işlemi doğada (yeryüzünde karın ve buzun pirolizi, derinliklerinde minerallerin mineralleşmesi vb.) ve teknolojide (metal ve alaşımların üretimi, kalıp dökümü vb.) .
Özgül füzyon ısısı
Özgül füzyon ısısı (ayrıca: füzyon entalpisi; eşdeğer bir özgül kristalleşme ısısı kavramı da vardır) - denge izobarik-izotermal bir süreçte kristal bir maddenin bir birim kütlesine verilmesi gereken ısı miktarı. katı (kristal) halden sıvıya aktarmak (bir maddenin kristalleşmesi sırasında açığa çıkan ısı miktarıyla aynı). Füzyon ısısı, birinci dereceden faz geçişinin ısısının özel bir halidir. Özgül füzyon ısısını (J/kg) ve moları (J/mol) ayırt edin.
Özgül füzyon ısısı harfle gösterilir (Yunanca harf lambda) Hesaplama formülü özısı erime noktası:
füzyonun özgül ısısı nerede, maddenin erime sırasında aldığı (veya kristalleşme sırasında açığa çıkardığı) ısı miktarıdır, eriyen (kristalleşen) maddenin kütlesidir.
Metallerin eritilmesi
Metalleri eritirken belirli kurallara uyulmalıdır. Kurşun ve çinkoyu eriteceklerini varsayalım. Kurşun, 327°'lik bir erime noktasına sahip olarak hızla erir; çinko ise erime noktası 419 ° 'nin üzerinde olduğu için uzun süre katı kalacaktır. Böyle bir aşırı ısınmaya yol açacak ne olacak? Yanardöner renkli bir film ile kaplanmaya başlayacak ve daha sonra yüzeyi erimeyen bir toz tabakasının altına gizlenecektir. Kurşun, aşırı ısınmadan yanmış, havadaki oksijenle birleşerek oksitlenmiştir. Bu işlem, bildiğiniz gibi, normal sıcaklıkta gerçekleşir, ancak ısıtıldığında çok daha hızlı ilerler. Böylece çinko erimeye başladığında çok az metalik kurşun kalmış olacaktır. Alaşım beklendiği gibi tamamen farklı bir bileşime sahip olacak ve atık şeklinde büyük miktarda kurşun kaybolacaktır. Açıktır ki, önce daha dirençli çinkoyu eritmeli, sonra içine kurşun koymalıyız. Aynı şey, çinko bakır veya pirinç ile alaşımlanırsa, önce çinkoyu ısıtırsa olur. Bakır eridiğinde çinko yanacaktır. Bu, her zaman önce daha yüksek bir erime noktasına sahip metali eritmeniz gerektiği anlamına gelir.
Ama bu çılgınlıktan kaçınamaz. Uygun şekilde ısıtılmış bir alaşım uzun süre ateşte tutulursa, sıvı metalin yüzeyinde dumanların bir sonucu olarak tekrar bir film oluşur. Daha eriyebilir metalin tekrar okside dönüşeceği ve tapanın bileşiminin değişeceği açıktır; Bu, metalin gereksiz yere uzun süre aşırı ısınamayacağı anlamına gelir. Bu nedenle, metal israfını azaltmak için mümkün olan her şekilde, onu kompakt bir kütleye yerleştirerek denerler; küçük parçalar, talaş, talaşlar önce “paketlenir”, aşağı yukarı aynı boyuttaki parçalar eritilir, yeterli sıcaklıkta ısıtılır ve metal yüzey hava ile temastan korunur. Bu amaçla, usta bir boraks alabilir veya metalin yüzeyini, her zaman üstte yüzen (düşük özgül ağırlığı nedeniyle) ve metali dökerken müdahale etmeyecek bir kül tabakası ile kaplayabilir. Metal katılaştığında, muhtemelen genç ustaların da aşina olduğu başka bir fenomen meydana gelir. Katılaşan metalin hacmi azalır ve bu azalma iç, henüz katılaşmamış metal parçacıklar nedeniyle oluşur. Döküm yüzeyinde veya içinde, büzülme boşluğu olarak adlandırılan aşağı yukarı önemli bir huni şeklinde çöküntü oluşur. Genellikle kalıp, ürünün kendisini mümkün olduğunca korumaya çalışarak, daha sonra çıkarılan döküm yerlerinde büzülme delikleri oluşturacak şekilde yapılır. Büzülme deliklerinin dökümü bozduğu ve bazen kullanılamaz hale getirebildiği açıktır. Eritmeden sonra metal biraz aşırı ısıtılır, böylece daha ince ve daha sıcak olur ve bu nedenle kalıbın ayrıntılarını daha iyi doldurur ve daha soğuk bir kalıpla temastan erken donmaz.
Alaşımların erime noktası genellikle alaşımı oluşturan metallerin en refrakterinin erime noktasından daha düşük olduğundan, bazen bunun tersini yapmak faydalıdır: önce daha eriyebilir metali ve sonra daha refrakter olanı eritin. Bununla birlikte, buna yalnızca güçlü bir şekilde oksitlenmeyen metaller için veya bu metallerin aşırı oksidasyondan korunması şartıyla izin verilir. Sadece kalıbı değil, aynı zamanda ladin kanalını da doldurması için, şeyin kendisi için gerekenden daha fazla metal almak gerekir. Öncelikle gerekli metal miktarını hesaplamanız gerektiği açıktır.
Suyun erime ve kaynama noktası
Suyun canlı doğa için en şaşırtıcı ve mutluluk verici özelliği, "normal" koşullarda sıvı olabilme özelliğidir. Suya çok benzeyen bileşiklerin molekülleri (örneğin, H2S veya H2Se molekülleri) çok daha ağırdır, ancak aynı koşullar altında bir gaz oluşturur. Böylece su, bildiğiniz gibi, maddelerin ne zaman, nerede ve hangi özelliklerinin yakın olacağını tahmin eden periyodik tablonun yasalarıyla çelişiyor gibi görünüyor. Bizim durumumuzda, tablodan, aynı dikey sütunlarda yer alan elementlerin (hidrürler olarak adlandırılan) hidrojen bileşiklerinin özelliklerinin, artan atom kütlesi ile monoton olarak değişmesi gerektiği sonucu çıkar. Oksijen, bu tablonun altıncı grubunun bir elementidir. Aynı grupta kükürt S (atom ağırlığı 32), selenyum Se (atom ağırlığı 79), tellür Te (128 atom ağırlığı ile) ve pollonyum Po (209 atom ağırlığı ile) bulunur. Sonuç olarak, bu elementlerin hidritlerinin özellikleri, ağır elementlerden daha hafif elementlere geçerken monoton bir şekilde değişmelidir, yani. H2Po → H2Te → H2Se → H2S → H2O sırasında. Olan budur, ancak yalnızca ilk dört hidritle. Örneğin, elementlerin atom ağırlığı arttıkça kaynama ve erime noktaları yükselir. Şekilde, çarpılar bu hidritlerin kaynama noktalarını, daireler ise erime noktalarını göstermektedir.

Görüldüğü gibi atom ağırlığı azaldıkça sıcaklıklar oldukça lineer olarak azalmaktadır. Hidritlerin sıvı fazının varlık alanı giderek daha fazla "soğuk" hale gelir ve oksijen hidrit H2O, altıncı gruptaki komşularına benzer normal bir bileşik olsaydı, sıvı su şu aralıkta olurdu - 80 °C ila -95 °C. Daha yüksek sıcaklıklarda, H2O her zaman bir gaz olacaktır. Neyse ki biz ve dünyadaki tüm yaşam için su anormaldir, periyodik bir kalıp tanımaz, ancak kendi yasalarını takip eder.
Bu oldukça basit bir şekilde açıklanır - su moleküllerinin çoğu hidrojen bağlarıyla bağlanır. Suyu sıvı hidritler H2S, H2Se ve H2Te'den ayıran bu bağlardır. Olmasaydı, su zaten eksi 95 ° C'de kaynardı. Hidrojen bağlarının enerjisi oldukça yüksektir ve ancak çok daha yüksek bir sıcaklıkta kırılabilirler. Gaz halinde bile, çok sayıda H2O molekülü hidrojen bağlarını koruyarak (H2O)2 dimerleri oluşturmak üzere birleşir. Tamamen hidrojen bağları sadece 600 °C'lik bir su buharı sıcaklığında kaybolur.
Kaynamanın, kaynayan bir sıvının içinde buhar kabarcıklarının oluşması gerçeğinden oluştuğunu hatırlayın. Normal basınçta saf su 100 "C'de kaynar. Serbest yüzeyden ısı verilirse yüzey buharlaşma süreci hızlanır, ancak kaynamanın hacimsel buharlaşma özelliği oluşmaz. basınç, çünkü bu durumda dış basınca eşit basınçlı buhar daha düşük bir sıcaklıkta elde edilir. Çok yüksek bir dağın tepesinde, basınç ve buna bağlı olarak kaynama noktası o kadar düşüktür ki, su pişirme için uygun olmaz - suyun istenilen sıcaklığına ulaşılamıyor. Yeterince yüksek bir basınçla su, içinde kurşunu eritebilecek kadar ısıtılabilir (327°C) ve yine de kaynamaz.
Süper büyük erime kaynama noktalarına ek olarak (ve ikinci işlem böyle basit bir sıvı için çok fazla füzyon ısısı gerektirir), suyun varlığının aralığı anormaldir - bu sıcaklıkların farklı olduğu yüz derece - oldukça geniş bir aralık su gibi düşük moleküler ağırlıklı bir sıvı için. İzin verilen hipotermi değerlerinin sınırları ve suyun aşırı ısınması alışılmadık derecede büyüktür - dikkatli ısıtma veya soğutma ile su -40 ° C ila +200 ° C arasında sıvı kalır. Bu, suyun sıvı kalabileceği sıcaklık aralığını 240 °C'ye kadar uzatır.
Buz ısıtıldığında önce sıcaklığı yükselir, ancak su ve buz karışımı oluştuğu andan itibaren tüm buz eriyene kadar sıcaklık değişmeden kalacaktır. Bu, eriyen buza sağlanan ısının öncelikle yalnızca kristallerin yok edilmesi için harcanması gerçeğiyle açıklanır. Eriyen buzun sıcaklığı, tüm kristaller yok olana kadar değişmeden kalır (bkz. gizli füzyon ısısı).
erir
Erimeler, kritik erime noktasından uzak ve erime noktasına daha yakın bir yerde bulunan belirli sınırlar içindeki sıcaklıklarda maddelerin sıvı halde erimiş halidir. Eriyiklerin doğası, doğal olarak erimiş maddedeki elementlerin kimyasal bağlarının türü tarafından belirlenir.
Eriyikler metalurji, cam yapımı ve diğer teknoloji alanlarında yaygın olarak kullanılmaktadır. Eriyikler genellikle karmaşık bir bileşime sahiptir ve çeşitli etkileşimli bileşenler içerir (faz diyagramına bakın).
Erimeler
1. Metalik (Metaller (adı Latin metalinden gelir - maden, maden) - yüksek termal ve elektriksel iletkenlik, pozitif sıcaklık direnci katsayısı, yüksek süneklik ve metalik parlaklık gibi karakteristik metalik özelliklere sahip bir grup element);
2. İyonik (İyon (eski Yunanca ἰόν - gidiyor) - bir atoma veya moleküle bir veya daha fazla elektronun kaybı veya eklenmesi sonucu oluşan tek atomlu veya çok atomlu elektrik yüklü bir parçacık. İyonizasyon (iyon oluşum süreci) bir elektrik alanının etkisi altında yüksek sıcaklıklarda meydana gelir);
3. Atomlar arasında kovalent bağlara sahip yarı iletkenler (Yarı iletkenler - iletkenlikleri açısından iletkenler ve dielektrikler arasında bir ara yer işgal eden ve iletkenliğin kirlilik konsantrasyonuna, sıcaklığa ve çeşitli radyasyon türlerine güçlü bir şekilde bağlı olarak iletkenlerden farklı olan malzemeler. bu malzemelerin ana özelliği, artan sıcaklıkla elektriksel iletkenlikte bir artıştır);
4. Van der Waals bağları ile organik erir;
5. Yüksek polimer (Polimerler (Yunanca πολύ- - çok; μέρος - kısım) - "monomerik birimler" olarak adlandırılan çeşitli atom gruplarının tekrar tekrar tekrarlanmasıyla elde edilen, kimyasal veya koordinasyonla uzun makromoleküllere bağlanan inorganik ve organik, amorf ve kristal maddeler tahviller)
Kimyasal bileşiklerin türüne göre erir:
1. Tuz;
2.Oksit;
3. Oksit-silikat (cüruf), vb.
Özel özelliklere sahip erir:
1. Ötektik
Erime hakkında ilginç
Buz taneleri ve yıldızlar.
Sıcak bir odaya bir parça saf buz alın ve erimesini izleyin. Monolitik ve homojen görünen buzun birçok küçük taneye - bireysel kristallere - ayrıldığı çabucak anlaşılacaktır. Buz hacminde rastgele bulunurlar. Buz yüzeyden eridiğinde eşit derecede ilginç bir resim görülebilir.
Lambaya pürüzsüz bir buz parçası getirin ve erimeye başlayana kadar bekleyin. Erime iç tanelere dokunduğunda, orada çok ince desenler ortaya çıkmaya başlayacaktır. Güçlü bir büyüteçle altıgen kar taneleri şeklinde olduklarını görebilirsiniz. Aslında, bunlar suyla dolu erimiş çöküntülerdir. Işınlarının şekli ve yönü, buz tek kristallerinin yönüne karşılık gelir. Bu desenler, 1855'te onları keşfeden ve tanımlayan İngiliz fizikçiden sonra "Tyndall yıldızları" olarak adlandırılıyor. Kar tanelerine benzeyen "Tyndall yıldızları" aslında erimiş buzun yüzeyindeki, yaklaşık 1,5 mm büyüklüğünde, suyla dolu çöküntülerdir. Merkezlerinde, erimiş buz ve erimiş su hacimlerindeki farktan dolayı ortaya çıkan hava kabarcıkları görülür.
BİLİYOR MUSUN?
Wood'un alaşımı olarak adlandırılan ve ılık suda (+68 santigrat derece) bile kolayca eritilebilen bir metal var. Yani bir bardakta şekeri karıştırırken, bu alaşımdan yapılmış metal bir kaşık şekerden daha hızlı erir!
En refrakter madde olan tantal karbür TaCO-88, 3990°C sıcaklıkta erir.
1987'de Alman araştırmacılar, suyu sıvı halde tutarken suyu -700C'ye kadar aşırı soğutmayı başardılar.
Bazen kaldırımlardaki karları daha hızlı eritmek için tuz serpilir. Buzun erimesi, donma noktası hava sıcaklığından daha düşük olan suda bir tuz çözeltisinin oluşması nedeniyle oluşur. Çözüm kaldırımdan akıp gidiyor.
İlginç bir şekilde, tuzlu su çözeltisinin sıcaklığı saf kardan daha düşük olduğundan, ıslak kaldırımda ayaklar daha fazla soğur.
Bir çaydanlıktan iki bardağa çay dökerseniz: şekerli ve şekersiz, o zaman şekerli bir bardağa çay daha soğuk olacaktır, çünkü. şekerin çözünmesi (kristal kafesinin yok edilmesi) de enerji tüketir.
Şiddetli donlarda buzun pürüzsüzlüğünü eski haline getirmek için buz pateni pisti sıcak su ile sulanır.Sıcak su buzun ince üst tabakasını eritir, çok çabuk donmaz, yayılma zamanı vardır ve buz yüzeyi çok düzgündür.
Sonuç (sonuçlar)
Erime, bir maddenin katı halden sıvı hale geçmesidir.
Isıtıldığında, maddenin sıcaklığı artar ve vücudun iç enerjisi artarken parçacıkların termal hareket hızı artar.
Bir katının sıcaklığı erime noktasına ulaştığında, katının kristal kafesi bozulmaya başlar. Böylece, katı gövdeye iletilen ısıtıcı enerjisinin ana kısmı, maddenin parçacıkları arasındaki bağları azaltmaya, yani kristal kafesin yok edilmesine harcanır. Bu durumda, parçacıklar arasındaki etkileşimin enerjisi artar.
Erimiş madde, katı halde olduğundan daha büyük bir iç enerji deposuna sahiptir. Füzyon ısısının geri kalan kısmı, erime sırasında vücudun hacmini değiştirmek için iş yapmak için harcanır.
Erime sırasında, çoğu kristal gövdenin hacmi artar (%3-6) ve katılaşma sırasında azalır. Ancak, eridiğinde hacminin azaldığı ve katılaştığında arttığı maddeler vardır. Bunlara örneğin su ve dökme demir, silikon ve diğerleri dahildir. . Bu nedenle buz, suyun yüzeyinde yüzer ve katı dökme demir - kendi eriyiğinde.
Amorf denilen katıların (kehribar, reçine, cam) belirli bir erime noktası yoktur.
Bir maddeyi eritmek için gerekli olan ısı miktarı, maddenin öz ısısı ile maddenin kütlesinin çarpımına eşittir.
Özgül füzyon ısısı, erime hızında alınan 1 kg'lık bir maddenin katı halden sıvı hale tamamen dönüştürülmesi için ne kadar ısı gerektiğini gösterir.
Özgül füzyon ısısının SI cinsinden birimi 1J/kg'dır.
Erime işlemi sırasında kristalin sıcaklığı sabit kalır. Bu sıcaklığa erime noktası denir. Her maddenin kendi erime noktası vardır.
Belirli bir maddenin erime noktası, atmosfer basıncına bağlıdır.
kullanılmış literatür listesi
Elektronik ücretsiz ansiklopedi "Wikipedia" dan veriler
tr./wiki/Main_page
Site "Sınıf! Meraklılar için Fizik" class-fizika.narod/8_11.htm
Web sitesi "Suyun fiziksel özellikleri"
her şey hakkında-water/boiling-temperature.php
Site "Metaller ve yapılar"
metal yapı/osnovy-plavleniya-metallov/
Benzer özetler:
Bir sıvının ana özelliği, mekanik etkinin etkisi altında şekil değişikliğidir. İdeal ve gerçek sıvılar. Newton akışkanları kavramı. Bir sıvının özelliklerini belirleme yöntemi. Serbest yüzey oluşumu ve yüzey gerilimi.
Kamçatka Devlet Akademisi balıkçı filosu ÖZET Konuyla ilgili: "Faz dengesi ve faz dönüşümleri"Yazan: Gönderen: IEF öğrencisi Isakov A.Ya.
Buna bazen gizli ısı denir (gizli ısı denir çünkü erime (ve katılaşma) süreci Sabit sıcaklık, ısıtma (soğutma) yok gibi görünüyor, ancak ısının emilmesi (salımı) devam ediyor). Özgül gizli füzyon ısısı —kütle birimini dönüştürmek için gereken ısı miktarıdır sağlam sıcaklık değişimi olmayan bir sıvıya. Aynı zamanda, bir sıvının birim kütlesi sıcaklıkta bir değişiklik olmaksızın katıya dönüştüğünde açığa çıkan ısı enerjisi miktarıdır.
Ders çalışma. Buzun erimesinin özgül gizli ısısını belirleyin
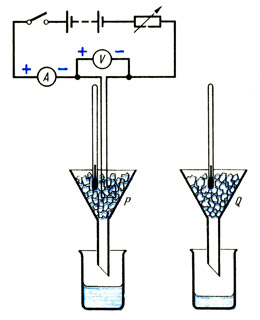 eşit miktarlar koyun kırık buz iki özdeş huniye P ve Q (bkz. Şek.) Buz dondurucudan alındıysa 0 o C sıcaklığa ulaşıp erimeye başlayana kadar beklemelisiniz. Ampermetre, voltmetre ve reostata bağlı olan rezistansı P hunisi içine tamamen buzla kaplanacak şekilde yerleştiriniz.
eşit miktarlar koyun kırık buz iki özdeş huniye P ve Q (bkz. Şek.) Buz dondurucudan alındıysa 0 o C sıcaklığa ulaşıp erimeye başlayana kadar beklemelisiniz. Ampermetre, voltmetre ve reostata bağlı olan rezistansı P hunisi içine tamamen buzla kaplanacak şekilde yerleştiriniz.
Isıtıcıyı açtıktan hemen sonra, P ve Q hunilerinin altına bilinen ağırlıktaki kuru beherleri yerleştirin. Ampermetre ve voltmetre okumalarını kaydedin ve gerekirse deney sırasında bunları sabit tutmak için bir reostat kullanın. Birkaç dakika sonra, P hunisinin altındaki beherde bir miktar su biriktiğinde, zamanı işaretleyin, beherleri çıkarın ve ısıtıcıyı kapatın. Bardakların kütlelerini içerikleriyle birlikte belirleyin.
Özgül gizli ısıda l, J x kg -1 birimine sahiptir. m kütleli bir madde oradan geçerse katı hal sıvıya dönüştürülür, daha sonra ısı ΔQ miktarının elde edilmesi ΔQ = mƖ formülü ile belirlenir.
Aşağıdaki sonuçları aldığımızı varsayalım:
deneyden önce P altındaki camın kütlesi = m 1 kg
deneyden sonra P altındaki camın kütlesi = m 2 kg
deney sırasında P'de eriyen buz kütlesi = (m 2 -m 1) kg
deneyden önce Q altında cam kütlesi = m 3 kg
deneyden sonra Q altında cam kütlesi = m 4 kg
deney sırasında Q'da eriyen buz kütlesi = (m 4 - m 3) kg
ampermetre okuması = I, A
voltmetre okuması = V, V
Isıtıcının açıldığı süre = t min = 60t s
Huni Q kontrolü. Deney sırasında oda sıcaklığında eriyen buz kütlesini belirlemenizi sağlar. Aynı kütleye sahip buzun P'de eriyeceğini varsaymak mantıklı olacaktır. Böylece, ısıtıcı tarafından eriyen ilave buz kütlesi:
(m 2 - m 1) - (m 4 - m 3) \u003d m.
Eğer Ɩ — özgül gizli füzyon ısısı buz, o zaman Termal enerji Buzun erimesi için gerekli olan, ml J olacaktır. elektrik enerjisi VI x 60t olan ısıtıcı tarafından iletilir. Dolayısıyla ml = VI x 60t Ɩ = Vl x 60t / m J x kg -1
Buzun erimesinin özgül ısısının değeri 336.000 J x kg -1 veya 0 °C'de 1 kg buzu eritmek için gereken 336.000 J termal enerjidir. 1 kg su 0°C'de donduğunda aynı miktarda ısı açığa çıkar.
Eğer bir ilk buz 0°C'nin altında, buz erimeye başlamadan önce sıcaklığı 0°C'ye yükseltmek için ek ısı gerekecektir.
Birçok evin mahzeni vardır ve sebzeler genellikle kış için orada saklanır. Toprağın yalıtkan özelliğinden dolayı kiler yazın nispeten soğuk, kışın nispeten sıcak kalır. Sert bir kış beklendiğinde, mahzene bir varil su yerleştirilir. Donduğunda açığa çıkan gizli ısı enerjisi, mahzendeki sıcaklığı 0 ° C'ye yakın tutmaya yardımcı olur, bu da sebzeleri donmaya karşı korur.






