Doimiy hajmda sodir bo'ladigan jarayon nima deyiladi? Termodinamika nima
Muhit ta'sirida termodinamik tizimning bir holatdan ikkinchi holatga o'tish davridagi o'zgarishlar yig'indisiga termodinamik jarayon deyiladi.
Gazning har bir parametri butun massa bo‘ylab bir xil qiymatga ega bo‘lgan gazning holati muvozanat holati deyiladi.
Termodinamik jarayonlar muvozanatli va muvozanatsiz bo'lishi mumkin.
Muvozanat jarayoni - muvozanat holatlaridan o'tadigan jarayon, ya'ni. gaz parametrlari (maxsus hajm, bosim va harorat) hajmning barcha nuqtalarida bir xil bo'lganda. Muvozanat jarayonlari cheksiz sekin davom etadi va cheksiz ko'p sonli muvozanat holatlaridan iborat bo'lib, har qanday vaqtda ishchi organ bilan muhit muvozanat o'rnatiladi, ya'ni atrof-muhit va ishchi suyuqlik o'rtasida harorat va bosim farqi cheksizdir. Har qanday vaqt uchun muvozanat jarayonlari asosiy parametrlarning qat'iy qiymatlariga ega, shuning uchun ularni diagrammalar (PV, TS-diagrammalar) yordamida grafik ravishda tasvirlash mumkin.
Haqiqiy jarayonlar muvozanatsizdir. Haqiqiy jarayonlarning bir xil bo'lmasligi, birinchi navbatda, tashqi sharoitlar ta'siri ostida ular cheklangan tezlikda borishi va muvozanat holatini ishchi organda o'rnatishga vaqt topa olmasligi bilan belgilanadi (holat parametrlari butun dunyo bo'ylab). gazning massasi bir xil emas).
Termodinamikada, birinchi navbatda, gaz holatini o'zgartirishning muvozanat holatlari va muvozanat jarayonlari ko'rib chiqiladi. Muvozanat jarayonlari teskarilik xususiyatiga ega, ya'ni ular bo'lishi mumkin teskari yo'nalish bevosita jarayonning barcha holatlari orqali.
Qaytariladigan jarayonlar bir xil muvozanat holatlari orqali ham oldinga, ham teskari yo'nalishda davom etadigan jarayonlardir. Shu bilan birga, ularning oxirida tizimning o'zida yoki muhitda hech qanday o'zgarishlar qolmaydi.
Jarayonlarning qaytarilishining asosiy shartlari quyidagilardir:
Tashqi qaytarilish sharti - bu termal va mexanik muvozanatning mavjudligi, ya'ni. ishchi suyuqlik va atrof-muhit harorati va bosimining tengligi;
Ichki qaytarilish sharti ishqalanish, diffuziya va boshqa bir tomonlama yo'naltirilgan jarayonlarning yo'qligi hisoblanadi.
Issiqlik dvigatellari va apparatlarida jarayonlar manba va ishchi suyuqlik o'rtasidagi cheklangan harorat farqida boradi, shuning uchun bunday jarayonlar qaytarib bo'lmaydi. Er sharoitidagi barcha real jarayonlar qaytarilmasdir.
Holat o'zgarishi jarayonlarini tavsiflovchi termodinamikadagi barcha analitik bog'liqliklar teskari jarayonlarga tegishli. Qaytariladigan jarayonlardan real, qaytarilmas jarayonlarga o'tish real jarayonlarning qaytariluvchi jarayonlardan og'ishlarini hisobga oladigan empirik koeffitsientlarni kiritish orqali amalga oshiriladi.
Termodinamika - bu o'rganadigan fan issiqlik hodisalari jismlarda ularni moddaning molekulyar tuzilishi bilan bog'lamasdan sodir bo'ladi.
Termodinamikada shunday deb qaraladi jismlardagi barcha issiqlik jarayonlari faqat makroskopik parametrlar bilan tavsiflanadi- bosim, hajm va harorat. Va ularni alohida molekulalarga yoki atomlarga qo'llash mumkin emasligi sababli, molekulyar-kinetik nazariyadan farqli o'laroq, termodinamikada issiqlik jarayonlarida moddaning molekulyar tuzilishi hisobga olinmaydi.
Termodinamikaning barcha tushunchalari tajribalar jarayonida kuzatilgan faktlarni umumlashtirish sifatida shakllantiriladi. Shuning uchun u issiqlikning fenomenologik (tasviriy) nazariyasi deb ataladi.
Termodinamik tizimlar

Termodinamika makroskopik tizimlarda sodir bo'ladigan issiqlik jarayonlarini tavsiflaydi. Bunday tizimlar juda ko'p sonli zarrachalar - molekulalar va atomlardan iborat bo'lib, ular termodinamik deb ataladi.
termodinamik tizim ko'rish mumkin bo'lgan har qanday ob'ekt deb hisoblash mumkin yalang'och ko'z yoki mikroskoplar, teleskoplar va boshqa optik asboblar yordamida. Asosiysi, tizimning kosmosdagi o'lchamlari va uning mavjud bo'lish vaqti uning parametrlarini - harorat, bosim, massa, kimyoviy tarkibi elementlar va boshqalar, alohida molekulalarning ta'siriga javob bermaydigan qurilmalar (bosim o'lchagichlar, termometrlar va boshqalar) yordamida.
Kimyogarlar uchun termodinamik tizim bu jarayonda bir-biri bilan o'zaro ta'sir qiluvchi kimyoviy moddalar aralashmasidir kimyoviy reaksiya. Astrofiziklar bunday tizimni chaqirishadi samoviy tana. avtomobil dvigatelidagi yoqilg'i va havo aralashmasi Yer, tanamiz, yozuvchi ruchka, daftar, dastgoh va boshqalar ham termodinamik tizimlardir.
Har bir termodinamik tizim atrof-muhitdan chegaralar bilan ajratilgan. Ular haqiqiy bo'lishi mumkin - probirkaning shisha devorlari kimyoviy, dvigateldagi silindr korpusi va boshqalar. Va ular shartli bo'lishi mumkin, masalan, ular atmosferada bulut paydo bo'lishini o'rganishadi.
Agar bunday tizim bilan almashtirilmasa tashqi muhit na energiya, na materiya, deyiladi izolyatsiya qilingan yoki yopiq .
Agar tizim tashqi muhit bilan energiya almashsa, lekin modda almashmasa, u deyiladi yopiq .
ochiq tizim atrof-muhit bilan energiya va moddalarni almashtiradi.
Termodinamik muvozanat

Bu tushuncha ham termodinamikaga tajriba natijalarini umumlashtirish sifatida kiritilgan.
Termodinamik muvozanat tizimning shunday holati deyiladiki, uning barcha makroskopik miqdorlari - harorat, bosim, hajm va entropiya - agar tizim izolyatsiya qilingan bo'lsa, vaqt o'tishi bilan o'zgarmaydi. Har qanday yopiq termodinamik tizim, agar barcha tashqi parametrlar doimiy bo'lib qolsa, o'z-o'zidan shunday holatga o'tishi mumkin.
Termodinamik muvozanatdagi tizimning eng oddiy misoli issiq choyli termosdir. Undagi harorat suyuqlikning istalgan nuqtasida bir xil bo'ladi. Garchi termosni faqat taxminan izolyatsiyalangan tizim deb atash mumkin.
Har qanday yopiq termodinamik tizim, agar tashqi parametrlar o'zgarmasa, o'z-o'zidan termodinamik muvozanatga kirishga intiladi.
Termodinamik jarayon

Agar makroskopik parametrlardan hech bo'lmaganda bittasi o'zgargan bo'lsa, ular tizimni shunday deyishadi termodinamik jarayon . Bunday jarayon tashqi parametrlar o'zgarganda yoki tizim energiya olishni yoki uzatishni boshlasa sodir bo'lishi mumkin. Natijada u boshqa holatga o'tadi.
Termosdagi choy misolini ko'rib chiqing. Agar choyga bir parcha muz botirib, termosni yopsak, darhol suyuqlikning turli qismlarida haroratlarda farq bo'ladi. Termosdagi suyuqlik haroratni tenglashtirishga moyil bo'ladi. Yuqori haroratli joylardan issiqlik harorat pastroq bo'lgan joyga o'tkaziladi. Ya'ni, termodinamik jarayon sodir bo'ladi. Oxir-oqibat, termosdagi choyning harorati yana bir xil bo'ladi. Lekin u allaqachon birinchisidan farq qiladi boshlang'ich harorat s. Tizimning holati o'zgargan, chunki uning harorati o'zgargan.
Termodinamik jarayon issiq kunda sohilda isitiladigan qum tunda soviganida sodir bo'ladi. Ertalab uning harorati pasayadi. Ammo quyosh chiqishi bilanoq isitish jarayoni yana boshlanadi.
Ichki energiya

Termodinamikaning asosiy tushunchalaridan biri ichki energiya .
Barcha makroskopik jismlar ichki energiyaga ega bo'lib, u tanani tashkil etuvchi barcha zarrachalarning (atom va molekulalarning) kinetik va potensial energiyalarining yig'indisidan iborat. Bu zarralar faqat bir-biri bilan o'zaro ta'sir qiladi va atrof-muhit zarralari bilan o'zaro ta'sir qilmaydi. Ichki energiya kinetik va ga bog'liq potentsial energiya zarralar va tananing o'zi holatiga bog'liq emas.
U = E k + E p
Ichki energiya harorat bilan o'zgaradi. Molekulyar kinetik nazariya buni modda zarrachalarining harakat tezligini o'zgartirish bilan izohlaydi. Agar tananing harorati ko'tarilsa, zarrachalarning harakat tezligi oshadi, ular orasidagi masofa katta bo'ladi. Binobarin, ularning kinetik va potentsial energiyasi ortadi. Harorat tushganda, teskari jarayon sodir bo'ladi.
Termodinamika uchun miqdor emas, balki muhimroqdir ichki energiya, lekin uning o'zgarishi. Va siz ichki energiyani issiqlik uzatish jarayoni yoki qilish orqali o'zgartirishingiz mumkin mexanik ish.
Mexanik ish orqali ichki energiyaning o'zgarishi

Benjamin Rumford
Jismning ichki energiyasini unga mexanik ishlarni bajarish orqali o'zgartirish mumkin. Agar tanada ish bajarilsa, mexanik energiya ichki energiyaga aylanadi. Va agar ish tana tomonidan bajarilsa, uning ichki energiyasi mexanik energiyaga aylanadi.
Deyarli kech XIX asrda vaznsiz modda - issiqlikni tanadan tanaga o'tkazadigan kaloriya borligiga ishonishgan. Vujudga qancha kaloriya oqsa, u issiqroq bo'ladi va aksincha.
Biroq, 1798 yilda ingliz-amerikalik olim Count Benjamin Ramford kaloriya nazariyasiga shubha qila boshladi. Buning sababi burg'ulash paytida qurol barrellarining isishi edi. U isitishning sababi bochkada matkapning ishqalanishi paytida bajariladigan mexanik ish ekanligini taklif qildi.
Va Rumfoord tajriba o'tkazdi. Ishqalanish kuchini oshirish uchun ular to'mtoq matkapni oldilar va barrelning o'zi bir barrel suvga joylashtirildi. Burg'ulashning uchinchi soati oxiriga kelib, bochkadagi suv qaynay boshladi. Bu barrelda mexanik ish olib borilganda issiqlik qabul qilinganligini anglatadi.
Issiqlik uzatish
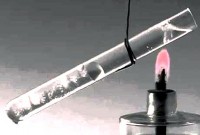
issiqlik uzatish chaqirdi jismoniy jarayon issiqlik energiyasini (issiqlik) bir tanadan boshqasiga to'g'ridan-to'g'ri aloqa yoki ajratuvchi qism orqali o'tkazish. Qoidaga ko'ra, issiqlik issiqroq tanadan sovuqroqqa o'tkaziladi. Bu jarayon tizim termodinamik muvozanat holatiga kelganda tugaydi.
Jismning issiqlik uzatish jarayonida oladigan yoki chiqaradigan energiya deyiladi issiqlik miqdori .
Issiqlik uzatish usuliga ko'ra, issiqlik uzatishni 3 turga bo'lish mumkin: issiqlik o'tkazuvchanligi, konventsiya, issiqlik nurlanishi.
Issiqlik o'tkazuvchanligi

Agar jismlar yoki jismlarning qismlari o'rtasida harorat farqi bo'lsa, ular o'rtasida issiqlik uzatish jarayoni sodir bo'ladi. issiqlik o'tkazuvchanligi ichki energiyani ko'proq qizdirilgan jismdan (yoki uning bir qismidan) kamroq isitiladigan jismga (yoki uning bir qismiga) o'tkazish jarayoni deb ataladi.
Misol uchun, po'lat barning bir uchini olovda qizdirsak, bir muncha vaqt o'tgach, uning ikkinchi uchi ham qizib ketishini his qilamiz.
Biz shisha tayoqchani osongina ushlab turamiz, uning bir uchi issiq, boshqa uchi bilan o'zimizni kuydirmasdan. Ammo xuddi shunday tajribani temir tayoq bilan amalga oshirishga harakat qilsak, muvaffaqiyatsiz bo'lamiz.
Turli moddalar issiqlikni boshqacha o'tkazadi. Ularning har biri o'ziga xos xususiyatlarga ega issiqlik o'tkazuvchanlik koeffitsienti, yoki o'tkazuvchanlik, 1 soniyada 1 m 2 maydoni bo'lgan 1 m qalinlikdagi namunadan o'tadigan issiqlik miqdori soniga teng. Harorat birligi sifatida 1 K qabul qilinadi.
Metall issiqlikni eng yaxshi o'tkazadi. Bu ularning mulki bo'lib, biz kundalik hayotda foydalanamiz, metall qozonlarda yoki kostryulkalarda pishiramiz. Ammo ularning tutqichlari qizib ketmasligi kerak. Shuning uchun ular issiqlik o'tkazuvchanligi past bo'lgan materiallardan tayyorlanadi.
Suyuqliklarning issiqlik o'tkazuvchanligi kamroq. Va gazlar yomon issiqlik o'tkazuvchanligiga ega.
Hayvonlarning mo'ynasi ham issiqlikni yomon o'tkazuvchi hisoblanadi. Buning yordamida ular issiq havoda qizib ketmaydi va sovuq havoda muzlamaydi.
Konventsiya
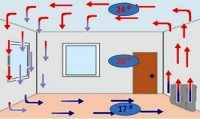
Konventsiyaga ko'ra, issiqlik oqimlari va gaz yoki suyuqlik oqimlari bilan uzatiladi. Qattiq jismlarda konventsiya yo'q.
Konventsiya suyuqlikda qanday paydo bo'ladi? Choynak suvini olovga qo'yganimizda, suyuqlikning pastki qatlami qiziydi, uning zichligi pasayadi, u yuqoriga ko'tariladi. Uning o'rnini sovuqroq suv qatlami egallaydi. Biroz vaqt o'tgach, u ham qiziydi va sovuqroq qatlam bilan joylarni o'zgartiradi. Va hokazo.
Xuddi shunday jarayon gazlarda ham sodir bo'ladi. Isitish batareyalari xonaning pastki qismiga joylashtirilishi tasodif emas. Axir, isitiladigan havo har doim xonaning yuqori qismiga ko'tariladi. Va pastki, sovuq, aksincha, tushadi. Keyin u ham qiziydi va yana ko'tariladi, yuqori qatlam esa bu vaqt ichida soviydi va cho'kadi.
Konventsiya tabiiy va majburiydir.
Atmosferada tabiiy konventsiya doimo sodir bo'ladi. Buning natijasida issiq havo massalarining doimiy ravishda yuqoriga, sovuqlari esa pastga siljishi kuzatiladi. Natijada shamol, bulutlar va boshqa tabiat hodisalari.
Agar tabiiy konventsiya etarli bo'lmasa, men majburiy konventsiyadan foydalanaman. Misol uchun, fan pichoqlari yordamida xonada iliq havo oqadi.
termal nurlanish

Quyosh yerni isitadi. Hech qanday issiqlik uzatish yoki konventsiya mavjud emas. Xo'sh, nima uchun tanalar isinadi?
Gap shundaki, Quyosh termal nurlanish manbai hisoblanadi.
termal nurlanish - bu elektromagnit nurlanish tananing ichki energiyasidan hosil bo'ladi. Atrofimizdagi barcha jismlar nur sochadi issiqlik energiyasi. Bu stol chiroqidan ko'rinadigan yorug'lik yoki ko'rinmas ultrabinafsha, infraqizil yoki gamma nurlarining manbalari bo'lishi mumkin.
Ammo tanalar shunchaki issiqlik chiqarmaydi. Ular ham iste'mol qiladilar. Ba'zilari ko'proq, boshqalari esa kamroq. Bundan tashqari, qorong'u jismlar yorug'likka qaraganda tezroq qiziydi va soviydi. Issiq havoda biz ochiq rangli kiyim kiyishga harakat qilamiz, chunki ular quyuq rangli kiyimlarga qaraganda kamroq issiqlikni o'zlashtiradi. To'q rangli mashina quyoshda yonida turgan ochiq rangli mashinaga qaraganda tezroq qiziydi.
Moddalarning issiqlikni turli yo'llar bilan yutish va tarqatish xususiyati tungi ko'rish tizimlarini, raketalarni aniqlash tizimlarini va boshqalarni yaratishda qo'llaniladi.
Tashqi muhitning ishchi suyuqlikka (gaz, bug ') ta'siri natijasida, masalan, siqilish, kengayish, isitish va boshqalar, uning holatining parametrlari o'zgaradi.
Ishchi organning holati parametrlarining har qanday o'zgarishi deyiladi termodinamik jarayon.
Yuqorida ta'kidlanganidek, ishchi suyuqlikning muvozanat va muvozanatsiz holatlari mavjud. Tizim uzluksiz bir qator muvozanat holatlaridan o'tadigan termodinamik jarayon deyiladi muvozanat. Ishchi suyuqlikning muvozanat holatining asosiy sharti uning massasi bo'ylab harorat va bosimning tengligidir. Muvozanat jarayonlari teskari.
Muvozanatsiz jarayonlar siqish uchun sarflangan ish muvozanat jarayonidagidan (ishqalanish kuchlari, inertsiya va boshqalar tufayli) kattaroq bo'lsa, ular cheklangan tezlikda davom etuvchi real jarayonlar deb ataladi.
Muvozanatsiz jarayonlar qaytarilmasdir.
Termodinamik jarayonlarni o'rganishda ular qo'llaniladi grafik tasvirlar, xususan, koordinatalar tizimida r va J, rJ-diagramma deb ataladi.
Absolyut bosimlar r ordinatalar o'qi bo'ylab, gazning o'ziga xos hajmlari abtsissa o'qi bo'ylab chizilgan. R va J ning ma'lum qiymatlari uchun muvozanat holati nuqta bilan ifodalanadi.
1-rasmda ixtiyoriy muvozanat jarayoni ko'rsatilgan. Gaz dastlabki holat 1 dan oxirgi holat 2 ga o‘tganda bosimning pasayishi va solishtirma hajmining ortishi kuzatiladi. Bu to'g'ridan-to'g'ri jarayon deb hisoblanadigan kengaytirish jarayoni. Siqish jarayoni (2-banddan 1-bandgacha) teskari hisoblanadi.
Ushbu bo'limdagi barcha mavzular:
TERMODİNAMIKA VA UNING MAMMALARI
Energiya almashinuvi jarayonlari atrofdagi dunyoning har qanday hodisalarida sodir bo'ladi. Shuning uchun termodinamika issiqlik va ishning o'zaro o'zgarishi haqidagi fan sifatida energiya maydonlarini o'rganish usullarini taqdim etadi.
Ishchi organning holati
Termodinamik tizim - bu bir-biri bilan va atrofdagi jismlar bilan mexanik va termal o'zaro ta'sirda bo'lgan moddiy jismlar to'plami. Termodiya
VA REAL GAZLAR
Haqiqiy gazlar past bosimlar idealga yaqin, chunki bu holda molekulalararo o'zaro ta'sir kuchlari va molekulalarning hajmini e'tiborsiz qoldirish mumkin. Bu, xususan, kislorod, havo uchun amal qiladi
GAZ ARALAMALARI
Amalda, qoida tariqasida, ishlaydigan suyuqlik sifatida har qanday bir hil gaz emas, balki gaz aralashmasi: havo, yonish mahsulotlari ishlatiladi. har xil turlari yoqilg'i, tabiiy gazlar va boshqalar.
HAQIQIY VA OʻRTA ISIQLIK SAKLIYATI
Issiqlik sig'imlari massa, hajm, molyar bo'lishi mumkin. 1 kg gazning issiqlik sig'imi massa deb ataladi: u c harfi bilan belgilanadi va J / (kg. K) bilan o'lchanadi. Bular
IDEAL GAZNING ISSIQLIK QUVVATLARI
Yuqorida aytib o'tilganidek, bir xil miqdorda berilgan issiqlik q bo'lgan gazning harorati termodinamik jarayonning tabiatiga qarab har xil o'zgaradi. Bu ... bildiradi,
Atomlikka qarab molyar issiqlik sig'imlari va k koeffitsientlarining qiymatlari
Gaz msJ mav msJ mav k
GAZ ARALAMALARINING ISSIQLIK SAKLIYATI
Gaz aralashmasining issiqlik sig'imi, shuningdek, alohida gazlar 1 kg, 1 m3 yoki 1 kmolga tegishli bo'lishi mumkin. Agar aralashma massa ulushlari bilan berilgan bo'lsa, u holda uning massa issiqlik sig'imi
VA ICHKI ENERGIYA
Ish faqat gaz hajmi o'zgarganda amalga oshiriladi. Agar gaz kengaytirilsa, u holda ish tashqi kuchlarga qarshi amalga oshiriladi; siqilganda, aksincha, gaz ish oladi
ISITISH
Issiqlik - bu tananing eng kichik zarralari harakatining bir shakli. Issiqlikni bir jismdan ikkinchisiga o'tkazish yoki ular orasidagi to'g'ridan-to'g'ri aloqa orqali amalga oshiriladi (issiqlik o'tkazuvchanligi,
TERMODİNAMIKANING BIRINCHI QONUNI
Termodinamikaning birinchi qonuni maxsus holat issiqlik jarayonlariga nisbatan energiyaning saqlanish va o'zgarishining universal qonuni. Birinchi qonunning shakllanishi
GAZLARDAGI TERMODINAMIK JARAYONLAR
Ishchi suyuqlik (gaz) holatining har qanday o'zgarishi umumiy holatda uning asosiy ko'rsatkichlarining o'zgarishi bilan tavsiflanadi: r, J, T. Gazning holati ikki yo'l bilan o'zgaradi: unga shuni aytish orqali.
GAZ ENTROPIYASI
Tadqiqotda barcha jarayonlar muvozanatli va qaytariladigan deb hisoblanadi. Termodinamik jarayonlarni o'rganish tartibini ko'rib chiqishdan oldin biz beshinchi parametrni kiritamiz
IZOHORIK JARAYON
Doimiy o'ziga xos hajmda sodir bo'ladigan jarayonga izoxorik deyiladi. Izoxorik jarayon, xususan, hisob-kitoblarda qo'llaniladi nazariy tsikllar karbüratörlü dvigatellar
ISOBAR JARAYONI
Jarayon sodir bo'ladi doimiy bosim, izobarik deyiladi. Bunday termodinamik jarayon pistoni ishqalanishsiz harakatlanadigan silindrda sodir bo'lishi mumkin, shuning uchun
GAZ ENTALPİYASI
Qozon qurilmalari, bug 'turbinalari, shuningdek, qishloq xo'jaligi mahsulotlarini quritish va sovutish bilan bog'liq jarayonlarda ishchi suyuqlik holatining parametri (ga.
IZOTERMAL JARAYON
Jarayon sodir bo'ladi doimiy harorat ishchi suyuqlik izotermik deb ataladi. Bu, masalan, pistonli mashinaning tsilindrida bo'lishi mumkin, agar ish joyiga issiqlik sifatida q berilsa.
ADIABATIK JARAYON
Adiabatik jarayon - gaz va atrof-muhit o'rtasida issiqlik almashinuvisiz amalga oshiriladigan jarayon (q = 0). Bu jarayondan amaliy foydalanish bug 'tning nozullarida
POLİTROPIK JARAYON
Barcha haqiqiy issiqlik dvigatellarida (dvigatellar ichki yonish- ichki yonuv dvigatellari, kompressorlar, gaz turbinali agregatlari va boshqalar) ishchi suyuqlikni (gazni) siqish, yoqilg'ini yoqish, kengaytirish jarayonlari
Politropik jarayonlarni tahlil qilish natijalari
Guruh Politropik indeksdagi o'zgarish chegaralari Ichki energiyaning o'zgarishi Issiqlik bilan ta'minlash (olib tashlash)
DAVLAMA JARAYONLAR
Yopiq jarayon, buning natijasida gaz bir qator turli holatlardan o'tib, asl holatiga qaytadi. dumaloq jarayon(tsikl). Keling, ushbu ta'rifni tushuntirib beraylik.
To'g'ridan-to'g'ri qaytariladigan karno sikli
1824 yilda S. Karno tsiklni taklif qildi, unga uning nomi berildi. To'g'ridan-to'g'ri qaytariladigan (ya'ni faqat muvozanatli, qaytariladigan jarayonlardan iborat) Karno sikli ideal sikldir.
teskari qaytariladigan karno sikli
Bu tsikl mukammal tsikldir sovutish mashinalari. Teskari Karno siklining tasviri 10-rasmda ko'rsatilgan. Tsikl to'g'ridan-to'g'ri sikl bilan bir xil jarayonlardan iborat, lekin holat p.
TERMODİNAMIKANING IKKINCHI QONUNI
Termodinamikaning birinchi qonuni energiya almashinuvining ikki shakli sifatida issiqlik va ishning ekvivalentligini belgilaydi. Biroq, bu qonun issiqlikni aylantirish shartlari haqida hech narsa aytmaydi va
KOMPRESSORLAR
Ichki yonuv dvigatellari (ICE) termal pistonli mashinalar deb ataladi, ularda suyuq yoki gazsimon yoqilg'ining yonish mahsulotlari ishlaydigan suyuqlik sifatida ishlatiladi, yonish.
ICHKI YONISH Dvigatellari
Tahlil qilish uchun ICE operatsiyasi va ish tsilindridagi asosiy ko'rsatkichlarni (ko'rsatkich kuchi, mexanik samaradorlik) aniqlash, indikator yordamida indikator diagrammasi yoziladi va hokazo.
GAZ TURBINASI ZAVODINI SIKLILARI
Gaz turbinali bloklari (GTU) ichki yonuv dvigatellari bilan solishtirganda muhim afzalliklarga ega - GTUlarda o'zaro harakatlanuvchi mexanizmlarning yo'qligi ularni yuqori tezlikda qurish imkonini beradi.
PISTON KOMPRESSORLARI
Siqilgan havo texnologik jarayonlarda, xususan, pnevmatik mexanizmlarni, bolg'alarni, vibratorlarni, pnevmatik ko'targichlarni haydashda, quyma materiallarni tashishda keng qo'llaniladi.
SUV BUG'I
Ishchi suyuqlik sifatida suv bug'i issiqlik va atom elektr stantsiyalarida asosiy issiqlik dvigatellari bo'lgan bug 'turbinalarida keng qo'llaniladi. Sifatida
RV- VA Ts-SUV BUG'I DIAGRAMASI
Bug'lanish bug'lanish yoki qaynatish yo'li bilan amalga oshirilishi mumkin. Bug'lanish faqat suyuqlik yuzasidan sodir bo'ladigan bug'lanish deb ataladi. Bu jarayon haqida
Hs-SUV BUG'I DIAGRAMASI
Muhandislik amaliyotida suv bug'lari bilan termodinamik jarayonlar hs diagrammasi yordamida hisoblanadi. Ushbu diagramma SSSRda 100,0 MPa bosim va 1000 haroratgacha qurilgan.
SUV VA SU BUG'I PARAMETRLARI
Tadqiqotlarda 0 0S va har qanday bosimda suvning entalpiyasi h0, ichki energiya u0, entropiya s0 nolga teng ekanligi umumiy qabul qilingan. Rasmda
SUV BUG'I UCHUN KARNO TIKLI
Bug 'elektr stantsiyasining eng mukammal ideal tsikli to'g'ridan-to'g'ri qaytariladigan Karno sikli bo'lib, uning issiqlik samaradorligi yuqorida ta'kidlanganidek, ma'lum bir harorat oralig'ida maksimal bo'ladi va dan oshmaydi.
RANKIN Tsikl
Bug 'elektr stansiyalarining asosiy ideal sikli Renkin sikli hisoblanadi. 24-rasmda Renkin sikli bo'yicha ishlaydigan bug' elektr stansiyasining sxematik diagrammasi, 25-rasmda rJ- va Ts-di ko'rsatilgan.
RANKIN Tsikl
Issiqlik ifodasini o'rganish sikl samaradorligi Turli xil boshlang'ich (bug 'turbinasi kirishida) va yakuniy (kondensator kirishida) bug' parametrlari darajasi bizga dastlab shunday xulosa chiqarishga imkon beradi.
HO'L HAV
Atmosfera havosi ishchi suyuqlik sifatida turli materiallarni quritish, isitish, sovutish, konditsioner qurilmalarda va hokazolarda ishlatiladi. atmosfera havosi co
NAMLI HAV
Dalton qonuniga ko'ra, gazlar aralashmasining bosimi uning tarkibiy qismlarining qisman bosimlari yig'indisiga teng: pnl.v. = ps.v. + pv.p., (128) &nbs
HD-CHART NOMLI HAVO
Ushbu jadval sizga nam havoning parametrlarini eng sodda va tez aniqlash imkonini beradi. Hd diagrammasida (27-rasm, a) namlik miqdori d (g / kg quruq havo) abscissa o'qi bo'ylab chizilgan,
ASOSIY TUSHUNCHALAR VA TA’RIFLAR
Issiqlik o'tkazuvchanligining asosiy tushunchalaridan biri harorat maydonidir. Harorat ishchi suyuqlik yoki muhitning termal holatini tavsiflovchi asosiy parametrlardan biridir. Agregat
FURYER QONUNI
Furye qonuni harorat maydoni va issiqlik o'tkazuvchanligi orqali undagi issiqlik tarqalish intensivligi o'rtasidagi miqdoriy bog'liqlikni o'rnatadi. Furye qonuniga ko'ra, ve
STATSION REJIMDA
Bir qatlamli tekis devorning issiqlik o'tkazuvchanligi. Bu holat uchun issiqlik tarqalish sxemasi 30-rasmda ko'rsatilgan. Issiqlik bug' bilan chegaralangan devorda tarqalsin.
KONVEKTIV ISIQLIKNI UZATISH
Amalda, ko'pincha suyuqlik (gaz) va sirt o'rtasidagi konvektiv issiqlik almashinuvini hisoblash kerak qattiq tana yoki u orqali oqadigan kanal (quvur). Agar pr
Suyuqlik qaynaganda
Suyuq qaynatish paytida issiqlik uzatish o'zgarish bilan birga keladi agregatsiya holati ishchi organ. Bu hodisa o'ziga xos xususiyatlarga ega va energiya uchun katta amaliy ahamiyatga ega
VA RADIATSIYA QONUNLARI
Radiatsiya orqali issiqlik uzatish elektromagnit to'lqinlar (fotonlar) shaklida issiqlik uzatish jarayonidir. Ushbu turdagi issiqlik uzatish uch bosqichda amalga oshiriladi: boshida tananing ichki energiyasi
ISILIKNI RADYASYON BO'LIB O'TKAZIShI
Nurlanish qonuniyatlarini bilish jismlar orasidagi radiatsion issiqlik almashinuvini hisoblash formulalarini olish imkonini beradi. Xususan, (155) formuladan emissiyani aniqlashda foydalaniladi
ISIQLIK O'TKAZISHI. ISSIQLIK ALMAGANCHILARNI HISOBLASH ASOSLARI
Issiqlik uzatish jarayonini issiqlik o'tkazuvchanligiga, konvektiv issiqlik uzatishga va radiatsiya orqali issiqlik uzatishga bo'linishi uni o'rganish uchun qulaydir. Aslida, murakkab issiqlik almashinuvi mavjud,
YASSI DEVOR ORQALI ISILIKNI UZATISH
Issiqlik o'tkazuvchanlik koeffitsienti l bo'lgan materialdan yasalgan qalinligi d bo'lgan bir qatlamli tekis devor (37-rasm) bir tomondan harorat tl1 bo'lgan issiq suyuqlik bilan yuvilsin.
SILINDRIK DEVOR ORQALI ISILIKNI UZATISH
Amalda issiqlik almashinuvi qurilmalarining eng keng tarqalgan elementi quvurdir. Silindrsimon devor (quvur) orqali issiqlik uzatish jarayonining diagrammasi 38-rasmda ko'rsatilgan.
Issiqlik izolyatsiyasi
Issiqlik uzatishning amaliy muammolarini hal qilishda isitish muhitidan qizdirilganga issiqlik uzatish intensivligini oshirish yoki aksincha, bu jarayonni sekinlashtirish kerak. Intensiv
ISITILIK OLMAYISHLAR
Issiqlik almashtirgichlar (issiqlik almashtirgichlar) issiqlikni isitish sovutgichidan (yuqori haroratli) isitiladigan issiqlikka o'tkazish uchun mo'ljallangan qurilmalardir.
ENERGIYA YONIGILI
Energiya yoqilg'isi issiqlik ishlab chiqarish uchun texnik qurilmalarda yondirilganda iqtisodiy jihatdan maqsadga muvofiq bo'lgan shunday yonuvchan moddalardir. yoqilg'i sifatida
AN'anaviy yoqilg'i TUSHUNCHASI
Yoqilg'ining kalorifik qiymati normal sharoitda qattiq, suyuq yoki gazsimon yoqilg'ining to'liq yonishi paytida qancha issiqlik (kilojoullarda) ajralib chiqishini ko'rsatadi.
ASOSIY YONIG'ILIGI KOMPONENTLARI
Yonilg'ining yonuvchi qismining asosiy komponenti ugleroddir. Uglerodning yonish issiqligi 33650 kJ/kg. Yonilg'ining yonuvchan massasidagi uglerod miqdori: antrasitda - 87 ... 93%
YONIlg'I TURLARI
Yog'och. Yog'ochdan yoqilg'i sifatida foydalanish cheklangan. O'tinning kalorifik qiymati asosan namlik bilan belgilanadi. Yog'ochda namlik qancha ko'p bo'lsa, shuncha kam bo'ladi
YONIG'I YONISH JARAYONINING MOHIYATI
Yonish tezligiga qarab, oddiy yonish va portlovchi yonish farqlanadi. Yonish tezligi - bu olovning tarqalish tezligi. Oddiy yonish paytida tarqalish tezligi
YONIGINI TO'LIQ YONISH UCHUN
Agar yoqilg'ining tarkibi ma'lum bo'lsa, u holda uning tarkibiy qismlaridan har qandayining to'liq yonishi uchun zarur bo'lgan havo miqdori C + O2 = CO2 ifodasidan aniqlanishi mumkin. E
YONISH MAHSULOTLAR HACMI VA TARKIBI
Issiqlik muhandislik birliklarini to'g'ri hisoblash va tanlash uchun hosil bo'lgan yonish mahsulotlarining miqdorini bilish kerak. Qoida tariqasida, yonish mahsulotlarining miqdori 1 kg televizorga tegishli
Turli haroratlarda yonish va havo tarkibidagi mahsulotlarning entalpiyalarining raqamli qiymatlari
Harorat, K NSO2, kJ/m3 NN2, kJ/m3 NO2, kJ/m3
MA'LUMOT INDEKSI
Alekseev G. N. Umumiy issiqlik muhandisligi. - M .: magistratura, 1980. Andryushchenko A.I. Issiqlik elektr stansiyalari davrlari termodinamikasining asoslari.- M., Oliy maktab. Ar
ENERGIYA VA AVTOMATIKA INSTITUTI
Issiqlik muhandisligi kafedrasi
Va energiya tizimlari

TEXNIK TERMODİNAMIKA
Magnitogorsk
| KIRISH ................................................... ................................................. ......................... | |
| Mavzu 1. Termodinamikaning predmeti va usuli ................................................ .. ................................. | |
| Termodinamik tizim ................................................... ................................................................ | |
| Holatning termodinamik parametrlari ............................................. ...................... | |
| Holat tenglamasi .............................................. ................................................................ ............ | |
| Termodinamik jarayon ................................................... ................................................................ | |
| Gazlarning issiqlik sig'imi ................................................ ................................................................ .............. | |
| Mavzu 2. Aralashmalar ideal gazlar.................................................................................... | |
| Termodinamikaning birinchi qonunining analitik ifodasi ............................................. .... | |
| Mavzu 3. Ichki energiya ................................................. .. ................................................. | |
| Kengaytma operatsiyasi ................................................. ................................................................ ......... | |
| Issiqlik................................................. ................................................ . ............ | |
| Entalpiya................................................. ................................................ . ............ | |
| Entropiya................................................. ................................................ . ............ | |
| Mavzu 4. Ikkinchi qonunning umumiy tahriri...................................... ............ ................... | |
| To'g'ridan-to'g'ri Karno tsikli ................................................... ................................................................ ............ | |
| Teskari Karno sikli ................................................ ................................................................ ............ | |
| Muvozanat bo'lmagan jarayonlarda entropiyaning o'zgarishi ................................... .... | |
| Mavzu 5. Ideal gazlarning termodinamik jarayonlari yopiq tizimlar Oh............ | |
| Eksergiya ................................................. ...................... ................................................. ............ ............. | |
| Mavzu 6. Haqiqiy gazlarning termodinamik jarayonlari ...................................... ......... ...... | |
| Haqiqiy gazlar holati tenglamasi........................................... ................... ................. | |
| Mavzu 7. Oqim uchun termodinamikaning birinchi qonuni tenglamasi...................................... ............ | |
| Birlashtiruvchi nozulning chiqishi ................................................ ................................................ | |
| Soplo va diffuzerlarda gaz oqimining asosiy qonuniyatlari...................................... ......... | |
| Bilan amal qilish muddatini hisoblash h-s diagrammalar .................................. | |
| Gazlar va bug'larni o'chirish ................................................... ............................................. | |
| Mavzu 8. Issiqlik elektr stansiyalari sikllarining termodinamik samaradorligi .......... | |
| Velosipedlar pistonli dvigatellar ichki yonish ............................................. | |
| Gaz turbinali qurilmalarning aylanish davrlari ................................................ ............. ......................... | |
| Bug 'turbinasi qurilmalarining aylanishlari ................................................ ............. ................... | |
| Karno va Renkin sikllari to'yingan bug '. Issiqlikni qayta tiklash ................................... | |
| Haddan tashqari qizdirilgan bug'da rankin sikli ................................................ ................................. | |
| Tsiklning issiqlik samaradorligi ................................................ ................................................................ ................ | |
| Issiqlik ta'minoti ................................................... ................................................................ ................. .... |
9-mavzu. Nazariy jarayon ko'p bosqichli kompressor
. O'tkazish uchun nazorat savollari oraliq sertifikatlash(imtihon) fanni o'zlashtirish natijalari bo'yicha:
- Termodinamikaning birinchi qonunining mohiyati va formulalari.
- Termodinamikaning birinchi qonunining analitik ifodasi.
- P - V diagrammada ixtiyoriy termodinamik jarayon uchun foydali ish va kengayish (siqilish) ishini ko'rsating.
- Ichki energiya va entalpiya holat funktsiyalari sifatida, ularning issiqlik sig'imi bilan bog'liqligi.
- Umumiy issiqlik sig'imi deb ataladigan narsa.
- Maxsus issiqlik sig'imi - massa, hajm va molyar, ularning belgilanishi va o'lchami.
- Qaysi issiqlik sig'imi katta - izobarik yoki izoxorik va nima uchun.
- Asosiy termodinamik jarayonlar, ularni P–V va T–S diagrammalarida tasvirlash.
- Asosiy termodinamik jarayonlar uchun parametrlarning aloqasi.
- 0 va 0 funksiyalari yordamida adiabatik jarayonni hisoblash.
- Qaytariladigan va qaytarilmas jarayonlar, qaytmaslikning asosiy sabablari.
- T - S diagrammasi bo'yicha kengayish va qisqarishning qaytar va qaytmas adiabatik jarayonini chizing.
- Termodinamikaning ikkinchi qonunining mohiyati va formulalari.
- Qaytariladigan va qaytmas jarayonlar uchun termodinamikaning ikkinchi qonunining analitik ifodasi.
- Entropiya davlat funktsiyasi sifatida, jismoniy ma'no entropiya.
- Termodinamik sikl deb ataladigan narsa.
- To'g'ridan-to'g'ri va teskari termodinamik sikllar.
- To'g'ridan-to'g'ri va teskari aylanishlarning samaradorligini qanday baholash mumkin.
- Issiqlik dvigateli va sovutish moslamasining sxematik diagrammasi.
- To'g'ridan-to'g'ri Karno aylanishi, uning issiqlik samaradorligi, holat diagrammalarida tasvir.
- Haqiqiy gazlar, Van-der-Vals holat tenglamasi.
- Oddiy va anomal moddalar uchun faza P-T diagrammasi.
- T-S diagrammasida bug'lanishga sarflangan issiqlikni ko'rsating.
- Suv bug'lari - to'yingan (quruq va nam) va qizib ketgan - ta'riflar.
- Suv bug'ining holati diagrammalari P - V, T - S, h - S.
- Tanqidiy va uch nuqta.
- Holat diagrammalarida suv bug'ining termodinamik jarayonlari.
28. Ishchi suyuqlik oqimi uchun termodinamikaning birinchi qonuni tenglamasi.
30.Kanal profilini qanday aniqlash mumkin.
31. Ovozdan tez tezlikni olish uchun qanday nozul kerak.
32. Qanday jarayon drossellash deyiladi.
33. h - s diagrammasida drossellash jarayonini tasvirlang.
34. Ishchi suyuqlikning parametrlari drossellash jarayonida qanday o'zgaradi.
35. Kompressordagi uchta siqish jarayonidan qaysi biri (izotermik, adiabatik, politropik) eng foydali va nima uchun.
36. Ko'p bosqichli siqish, uning bir bosqichli kompressorga nisbatan afzalliklari.
37. Ichki yonuv dvigatellarining sikllari, ularni solishtirish.
38. Gaz turbinali qurilmalarning aylanishlari, ularni taqqoslash.
39. Gaz turbinali qurilmalarning samaradorligini oshirish usullari.
40. Suv bug'lari uchun Karno aylanishi.
41. Bug 'turbinasi qurilmasining sxematik diagrammasi.
42. bilan Renkin sikli to'yingan bug ', uning issiqlik samaradorligi.
43. Qizigan bug 'bilan Rankin sikli, uning issiqlik samaradorligi.
44. Real Rankine sikli, absolyut ichki samaradorlikning ta'rifi.
45. Dastlabki va yakuniy bug’ parametrlarining issiqlik samaradorligiga ta’siri.
46. Oraliq bug'ni qayta isituvchi bug 'turbinasi qurilmasining sxemasi va sikli.
47. Qayta qizdirilgan siklning issiqlik samaradorligi formulasini yozing.
48. Qaysi sikl regenerativ deb ataladi.
49. Regenerativ ekstraktsiyali bug 'turbinasi qurilmasining sxemasi va sikli.
50. Regenerativ siklning issiqlik samaradorligi formulasini yozing.
51. Markaziy isitishning termodinamik asoslari.
52. Issiqlikdan foydalanish koeffitsienti (KIT).
53. Atom elektr stansiyalarining sikllari, atom energiyasidan foydalanish istiqbollari.
54. Ikkilik davrlar (bug '- bug' va bug' - gaz).
55. Binar qurilmalarning issiqlik samaradorligini hisoblash.
56. Issiqlik energiyasini elektr energiyasiga mashinasiz (to'g'ridan-to'g'ri) aylantirish.
57. MHD generatorlari bilan o'rnatishning sxemasi, aylanishi va issiqlik samaradorligi.
58. Sovutish moslamalari - gaz va bug'larni siqish.
59. Issiqlik nasosi nima deb ataladi, uning samaradorligini qanday baholash kerak.
60. Kimyoviy tizimlar uchun termodinamikaning birinchi va ikkinchi qonunlari
MAVZU 1
Termodinamikaning predmeti va usuli
Termodinamikamakroskopik tizimlarda sodir bo'ladigan va issiqlik effektlari bilan birga keladigan turli jarayonlarda energiyaning aylanish qonuniyatlarini o'rganadi. Makroskopik tizim - har qanday moddiy ob'ektdan iborat katta raqam zarralar. Makroskopik tizimlarning o'lchamlari molekulalar va atomlarning o'lchamlaridan beqiyos kattaroqdir.
Tadqiqot maqsadlariga qarab ular texnik yoki kimyoviy termodinamika, biologik tizimlar termodinamikasi va boshqalarni ko'rib chiqadilar. Texnik termodinamika issiqlik va ning o'zaro o'zgarishi qonuniyatlarini o'rganadi mexanik energiya va bu o'zgarishlarda ishtirok etadigan jismlarning xususiyatlari.. Uning asosida barcha issiqlik dvigatellarini, shuningdek, barcha turdagi texnologik uskunalarni hisoblash va loyihalash amalga oshiriladi.
Faqat makroskopik tizimlarni hisobga olgan holda, termodinamika doimiy harakatlanuvchi va o'zaro ta'sir qiluvchi juda ko'p miqdordagi mikrostruktura zarralari (molekulalar, atomlar, ionlar) mavjudligi sababli materiya harakatining termal shakli qonuniyatlarini o'rganadi.
Jismoniy xususiyatlar makroskopik tizimlar statistik termodinamik usullar bilan o'rganiladi. Statistik usul ehtimollar nazariyasi va ushbu tizimlar tuzilishining ma'lum modellaridan foydalanishga asoslanadi va statistik fizikaning mazmuni hisoblanadi. Termodinamik usul materiyaning tuzilishi haqidagi model g'oyalarni jalb qilishni talab qilmaydi va shunday bo'ladi fenomenologik(ya'ni, "hodisalar" - hodisalarni bir butun sifatida ko'rib chiqadi).
Bunda termodinamikaning barcha asosiy xulosalarini termodinamikaning faqat ikkita asosiy empirik qonunlaridan foydalangan holda deduksiya yo‘li bilan olish mumkin.
Kelajakda termodinamik usulga asoslanib, biz aniqlik uchun moddaning tuzilishi haqidagi molekulyar-kinetik g'oyalardan foydalanamiz.
Termodinamik tizim
Termodinamik tizim bir-biri bilan va tizimni o'rab turgan tashqi jismlar bilan mexanik va termal o'zaro ta'sirda bo'lgan moddiy jismlar to'plamidir.("tashqi muhit").
Tizimni tanlash o'zboshimchalik bilan va hal qilinayotgan muammoning shartlari bilan belgilanadi. Tizimga kiritilmagan organlar chaqiriladi muhit. Tizim atrof-muhitdan ajratilgan boshqaruv yuzasi(qobiq). Shunday qilib, masalan, eng oddiy tizim uchun - piston ostidagi silindrga o'ralgan gaz, tashqi muhit atrofdagi havo bo'lib, silindr devorlari va piston boshqaruv sirtlari bo'lib xizmat qiladi.
Termodinamik tizimning mexanik va issiqlik o'zaro ta'siri boshqaruv sirtlari orqali amalga oshiriladi. Tizimning o'zi yoki tizimning mexanik o'zaro ta'sirida ish bajariladi. (Umumiy holatda, tizimga elektr, magnit va boshqa kuchlar ham ta'sir qilishi mumkin, ularning ta'siri ostida tizim ish bajaradi. Bu turdagi ishlarni termodinamika doirasida ham hisobga olish mumkin, ammo biz ularni boshqa ko'rib chiqmang). Bizning misolimizda mexanik ish pistonni harakatlantirish orqali amalga oshiriladi va hajmning o'zgarishi bilan birga keladi. Issiqlik o'zaro ta'siri tizimning alohida jismlari va tizim va atrof-muhit o'rtasida issiqlik uzatishdan iborat. Ko'rib chiqilayotgan misolda silindrning devorlari orqali gazga issiqlik berilishi mumkin.
Eng umumiy holatda tizim atrof-muhit va materiya bilan almashishi mumkin (massa uzatish o'zaro ta'siri). Bunday tizim deyiladi ochiq. Turbinalar va quvurlarda gaz yoki bug 'oqimi - misollar ochiq tizimlar. Agar modda tizim chegaralaridan o'tmasa, u holda u yopiq deb ataladi. Keyinchalik, agar boshqacha ko'rsatilmagan bo'lsa, biz yopiq tizimlarni ko'rib chiqamiz.
Atrof-muhit bilan issiqlik almashtira olmaydigan termodinamik tizim deyiladi issiqlik izolyatsiyalangan yoki adiabatik. Adiabatik tizimga misol sifatida idishdagi gazni keltirish mumkin, uning devorlari ideal issiqlik izolyatsiyasi bilan qoplangan, bu idish ichidagi gaz va uning atrofidagi jismlar o'rtasidagi issiqlik almashinuvini istisno qiladi. Bunday izolyatsion qobiq adiabatik deb ataladi. Atrof-muhit bilan energiya yoki moddalar almashmaydigan tizim deyiladi izolyatsiya qilingan(yoki yopiq).
Eng oddiy termodinamik tizim issiqlik va ishning o'zaro o'zgarishini amalga oshiradigan ishchi suyuqlikdir. Masalan, ichki yonish dvigatelida ishchi suyuqlik havo va benzin bug'laridan tashkil topgan karbüratorda tayyorlangan yonuvchan aralashmadir.
Termodinamik holat parametrlari
Har bir tizimning xossalari odatda termodinamik parametrlar deb ataladigan bir qancha miqdorlar bilan tavsiflanadi. Keling, ularning ba'zilarini fizika kursidan ma'lum bo'lgan molekulyar-kinetik tushunchalardan foydalanib, ideal gaz g'oyib bo'ladigan darajada kichik o'lchamlarga ega bo'lgan, tasodifiy issiqlik harakatida bo'lgan va faqat to'qnashuv paytida bir-biri bilan o'zaro ta'sir qiladigan molekulalar to'plami sifatida ko'rib chiqaylik.
Bosim ishchi suyuqlik molekulalarining sirt bilan o'zaro ta'siri tufayli va son jihatdan tananing sirtining birlik maydoniga normal bo'ylab ikkinchisiga ta'sir qiluvchi kuchga teng. Molekulyar kinetik nazariyaga muvofiq gaz bosimi munosabat bilan aniqlanadi
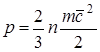 , (1.1)
, (1.1)
bu erda F - kuch; f-sirt; n- hajm birligidagi molekulalar soni;
t- molekulaning massasi; 2 dan beri- RMS tezligi oldinga harakat molekulalar.
DA xalqaro tizim birlik (SI) bosim paskallarda ifodalanadi (1 Pa \u003d 1 N / m 2). Ushbu birlik kichik bo'lgani uchun 1 kPa = 1000 Pa va 1 MPa = 10 6 Pa dan foydalanish qulayroqdir.
Bosim manometrlar, barometrlar va vakuum o'lchagichlar yordamida o'lchanadi.
Suyuqlik va prujinali bosim o'lchagichlari umumiy yoki mutlaq bosim o'rtasidagi farq bo'lgan o'lchov bosimini o'lchash R o'lchangan o'rta va atmosfera bosimi p atm, ya'ni. ![]()
Atmosfera ostidagi bosimni o'lchash uchun asboblar vakuum o'lchagichlar deb ataladi; ularning ko'rsatkichlari vakuum (yoki vakuum) qiymatini beradi:
![]() ,
ya'ni ortiqcha atmosfera bosimi mutlaqdan yuqori.
,
ya'ni ortiqcha atmosfera bosimi mutlaqdan yuqori.
E'tibor bering, davlat parametri mutlaq bosimdir. Bu termodinamik tenglamalarga kiradi.
harorat tananing isishi darajasini tavsiflovchi jismoniy miqdor deb ataladi. Harorat tushunchasi quyidagi bayonotdan kelib chiqadi: agar ikkita tizim termal aloqada bo'lsa, unda ularning harorati teng bo'lmasa, ular bir-biri bilan issiqlik almashadilar, lekin ularning harorati teng bo'lsa, issiqlik almashinuvi bo'lmaydi.
Molekulyar kinetik tushunchalar nuqtai nazaridan harorat o'lchovdir molekulalarning issiqlik harakati intensivligi. Uning raqamli qiymati modda molekulalarining o'rtacha kinetik energiyasining qiymatiga bog'liq:
SI tizimida harorat birligi kelvin (K); amalda Selsiy darajasi (°C) keng qo'llaniladi. Mutlaq o'rtasidagi nisbat T va santigrad I haroratlar shaklga ega
![]() .
.
Sanoat va laboratoriya sharoitida harorat suyuq termometrlar, pirometrlar, termojuftlar va boshqa asboblar yordamida o'lchanadi.
Maxsus hajm v - - moddaning massa birligiga to'g'ri keladigan hajm. Agar massaning bir hil tanasi bo'lsa M hajmni egallaydi v, keyin ta'rif bo'yicha
v= V/M.
SI tizimida o'ziga xos hajm birligi 1 m 3 / kg ni tashkil qiladi. Moddaning o'ziga xos hajmi va uning zichligi o'rtasida aniq bog'liqlik mavjud:
Xuddi shu holatlardagi tizimlarni tavsiflovchi miqdorlarni solishtirish uchun "normal jismoniy sharoitlar" tushunchasi kiritiladi:
p\u003d 760 mm Hg \u003d 101,325 kPa; T=273,15 K.
Texnologiyaning turli sohalarida va turli mamlakatlar o'zlarining "normal sharoitlarini" joriy qilish, masalan, "texnik" ( p\u003d 735,6 mm Hg \u003d 98 kPa, t=15˚C) yoki kompressor ish faoliyatini baholash uchun normal sharoitlar ( p=101,325 kPa, t=20˚S) va boshqalar.
Agar barcha termodinamik parametrlar vaqt bo'yicha doimiy bo'lsa va tizimning barcha nuqtalarida bir xil bo'lsa, tizimning bu holati deyiladi.muvozanat.
Agar tizimning turli nuqtalari o'rtasida harorat, bosim va boshqa parametrlarda farqlar mavjud bo'lsa, u holdamuvozanatsizlik. Bunday tizimda parametrlarning gradientlari ta'sirida issiqlik, moddalar va boshqalar oqimlari paydo bo'lib, uni muvozanat holatiga qaytarishga intiladi. Tajriba shuni ko'rsatadi izolyatsiya qilingan tizim vaqt o'tishi bilan u doimo muvozanat holatiga keladi va hech qachon o'z-o'zidan chiqib keta olmaydi. Klassik termodinamikada faqat muvozanat tizimlari ko'rib chiqiladi.
Davlat tenglamasi
Muvozanatli termodinamik tizim uchun holat parametrlari o‘rtasida funksional bog‘liqlik mavjud bo‘lib, u deyiladi. holat tenglamasi. Tajriba shuni ko'rsatadiki, gazlar, bug'lar yoki suyuqliklar bo'lgan eng oddiy tizimlarning o'ziga xos hajmi, harorati va bosimi o'zaro bog'liqdir. termal tenglama holatlarni ko'rish ![]() .
.
Holat tenglamasi boshqa shaklda berilishi mumkin: ![]()
Bu tenglamalar shuni ko'rsatadiki, tizimning holatini belgilovchi uchta asosiy parametrdan istalgan ikkitasi mustaqildir.
Masalalarni termodinamik usullar bilan yechish uchun holat tenglamasini bilish mutlaqo zarur. Biroq, uni termodinamika doirasida olish mumkin emas va uni eksperimental yoki statistik fizika usullari bilan topish kerak. Holat tenglamasining o'ziga xos shakli moddaning individual xususiyatlariga bog'liq.
Ideal gazlar uchun holat tenglamasi
(1.1) va (1.2) tenglamalar shuni bildiradi .
1 kg gazni hisobga oling. O'z ichiga olganligini hisobga olsak N molekulalar va shuning uchun biz quyidagilarni olamiz: ![]() .
.
Doimiy qiymat nk, 1 kg gazga ishora qilinadi, harf bilan belgilanadi R va qo'ng'iroq qiling gaz doimiy. Shunung uchun
Yoki . (1.3)
Olingan munosabat Klapeyron tenglamasidir.
(1.3) ga ko'paytirish M, gazning ixtiyoriy massasi uchun holat tenglamasini olamiz M:
Agar gaz konstantasini 1 kmol gazga, ya’ni massasi son jihatdan molekulyar massasi m ga teng bo‘lgan gaz miqdoriga aytsak, Klapeyron tenglamasiga universal ko‘rinish berilishi mumkin. O'rnatish (1.4) M= m va V=V m, bir mol uchun Klapeyron-Mendeleyev tenglamasini olamiz:
Bu erda, bir kilomol gazning hajmi va universal gaz doimiysi.
Avogadro qonuniga (1811) muvofiq, barcha ideal gazlar uchun bir xil sharoitda bir xil bo'lgan 1 kmolning hajmi normal jismoniy sharoitda 22,4136 m 3 ni tashkil qiladi, shuning uchun.
1 kg gazning gaz doimiysi .
Haqiqiy gazlar holati tenglamasi
Haqiqiy gazlarda ichida idealdan farqi molekulalararo o'zaro ta'sirlarning muhim kuchlari (molekulalar sezilarli masofada bo'lganda tortishish kuchlari va ular bir-biriga etarlicha yaqin bo'lganda itaruvchi kuchlar) va molekulalarning ichki hajmini e'tiborsiz qoldirib bo'lmaydi.
Molekulalararo itaruvchi kuchlarning mavjudligi molekulalarning bir-biriga faqat ma'lum bir minimal masofagacha yaqinlashishiga olib keladi. Shuning uchun molekulalarning harakati uchun bo'sh hajm teng bo'ladi deb taxmin qilishimiz mumkin , qayerda b gazni siqish mumkin bo'lgan eng kichik hajmdir. Shunga ko'ra, molekulalarning erkin yo'li va vaqt birligida devorga ta'sir qilish soni kamayadi va shuning uchun bosim ideal gazga nisbatan ortadi. , ya'ni
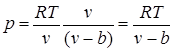 .
.
Jozibador kuchlar tashqi bosim bilan bir xil yo'nalishda harakat qiladi va molekulyar (yoki ichki) bosimni keltirib chiqaradi. Gazning har qanday ikkita kichik qismining molekulyar tortishish kuchi ushbu qismlarning har biridagi molekulalar sonining ko'paytmasiga, ya'ni zichlik kvadratiga proportsionaldir, shuning uchun molekulyar bosim kvadratiga teskari proportsionaldir. gazning o'ziga xos hajmi: rmol= a/ v 2, qayerda a - gazning tabiatiga qarab mutanosiblik koeffitsienti.
Bundan van der Vaals tenglamasini olamiz (1873):
![]() ,
,
Umuman olganda aniq hajmlar Haqiqiy gazning nisbatan past bosimi va van-der-Vaals tenglamasi amalda ideal gaz uchun Klapeyron holat tenglamasiga aylanadi, chunki miqdori a/v 2
(bilan solishtirganda p) va b(bilan solishtirganda v) ahamiyatsiz holga keladi.
Van der Waals tenglamasi sifat jihatidan haqiqiy gazning xususiyatlarini juda yaxshi tavsiflaydi, ammo raqamli hisoblar natijalari har doim ham eksperimental ma'lumotlarga mos kelmaydi. Bir qator hollarda bu og'ishlar haqiqiy gaz molekulalarining ikki, uch yoki undan ortiq molekulalardan iborat alohida guruhlarga birlashish tendentsiyasi bilan izohlanadi. Assotsiatsiya molekulalarning tashqi elektr maydonining assimetriyasi tufayli yuzaga keladi. Olingan komplekslar mustaqil beqaror zarrachalar kabi harakat qiladi. To'qnashuv vaqtida ular parchalanadi, so'ngra boshqa molekulalar bilan qayta birlashadi va hokazo. Harorat ko'tarilgach, komplekslarning konsentratsiyasi bilan katta raqam molekulalar tez kamayadi, bir molekulalarning ulushi ortadi. Qutbli suv bug'lari molekulalari birlashishga ko'proq moyillik ko'rsatadi.
Termodinamik jarayon
Vaqt o'tishi bilan termodinamik tizim holatining o'zgarishi deyiladi termodinamik jarayon. Shunday qilib, piston silindrda harakat qilganda, uning hajmi va u bilan birga ichidagi gazning bosimi va harorati o'zgaradi, gazning kengayish yoki siqilish jarayoni sodir bo'ladi.
Yuqorida ta'kidlab o'tilganidek, muvozanat holatidan chiqarilgan va atrof-muhitning doimiy parametrlarida o'z-o'zidan qolgan tizim bir muncha vaqt o'tgach, yana ushbu parametrlarga mos keladigan muvozanat holatiga keladi. Bunday o'z-o'zidan (tashqi ta'sirsiz) tizimning muvozanat holatiga qaytishi
chaqirdi dam olish, va tizim muvozanat holatiga qaytadigan vaqt oralig'i deyiladi dam olish vaqti. Uchun turli jarayonlar u boshqacha: agar doimo gazda muvozanat bosimini o'rnatish talab etilsa, u holda bir xil gaz hajmidagi haroratni tenglashtirish uchun o'nta kerak; daqiqa, va qizdirilgan qattiq hajmda - ba'zan bir necha soat.
Termodinamik jarayon deyiladimuvozanat, agar tizimning barcha parametrlari uning borishi davomida tegishli bo'shashish jarayoniga nisbatan ancha sekin o'zgarsa. Bunday holda, tizim haqiqatda doimo atrof-muhit bilan muvozanat holatida bo'ladi, bu jarayonning nomini belgilaydi.
Jarayon muvozanatli bo'lishi uchun tizim parametrlarining o'zgarish tezligi o'zaro bog'liqlikni qondirishi kerak.
qayerda LEKIN- ko'rib chiqilayotgan jarayonda eng tez o'zgaruvchan parametr; Bilan rel - gevşeme jarayonida ushbu parametrning o'zgarish tezligi; τ rel - dam olish vaqti.
Masalan, gazni silindrda siqish jarayonini ko'rib chiqaylik. Agar pistonning bir pozitsiyadan ikkinchisiga siljish vaqti bo'shashish vaqtidan sezilarli darajada oshsa, pistonni harakatlantirish jarayonida bosim va harorat silindrning butun hajmi bo'ylab tenglashishga vaqt topadi.
Bu hizalanish molekulalarning uzluksiz to'qnashuvi bilan ta'minlanadi, buning natijasida pistondan gazga etkazib beriladigan energiya ular o'rtasida juda tez va teng taqsimlanadi. Agar pistonning keyingi siljishi shunga o'xshash tarzda sodir bo'lsa, u holda tizimning har bir momentidagi holati amalda muvozanatli bo'ladi. Shunday qilib, muvozanat jarayoni ketma-ket muvozanat holatlarining uzluksiz qatoridan iborat; shuning uchun uning har bir nuqtasida termodinamik tizimning holatini berilgan ishchi suyuqlik holati tenglamasi bilan tasvirlash mumkin. Shuning uchun klassik termodinamika o'z tadqiqotida faqat muvozanat jarayonlari bilan ishlaydi. Ular real jarayonlarning qulay idealizatsiyasi bo'lib, ko'p hollarda muammoni hal qilishni sezilarli darajada soddalashtirishga imkon beradi. Bu ideallashtirish juda o'rinli, chunki (1.8) shart amalda tez-tez qondiriladi. Mexanik buzilishlar gazlarda tovush tezligida tarqalayotganligi sababli, piston tezligi tovush tezligidan ancha past bo'lsa, gaz va silindrni siqish jarayoni muvozanatda bo'ladi.
Shartni qoniqtirmaydigan jarayonlar, nomutanosiblik bilan davom eting, ya'ni. bormuvozanatsizlik. Agar, masalan, u atrof-muhit haroratini tezda oshirsa, silindrdagi gaz asta-sekin uning devorlari orqali qiziydi va atrof-muhitning yangi parametrlariga mos keladigan muvozanat holatiga bo'shashadi. Bo'shashish jarayonida gaz atrof-muhit bilan muvozanatda emas va uni holat tenglamasi bilan tavsiflab bo'lmaydi, faqat chunki turli nuqtalar gaz haroratining hajmi turli qiymatlarga ega.
Gazlarning issiqlik sig'imi
Holati cheksiz kichik o'zgargan jism olgan issiqlik miqdorining shu bilan bog'liq bo'lgan tana haroratining o'zgarishiga nisbati deyiladi. issiqlik sig'imi Ushbu jarayondagi organlar:
Odatda, issiqlik sig'imi moddaning miqdori birligiga aytiladi va tanlangan birlikka qarab ular quyidagilardan ajralib turadi:
o'ziga xos massa issiqlik sig'imic , 1 kg gazga nisbatan,
J/(kg K);
o'ziga xos hajmli issiqlik sig'imic´, oddiy jismoniy sharoitlarda 1 m 3 hajmdagi gaz miqdoriga ishora qilinadi, J / (m 3 · K);
o'ziga xos molyar issiqlik sig'imi , bir kilomol, J / (kmol K) deb ataladi.
O'rtasidagi munosabat o'ziga xos issiqlik sig'imlari yaqqol munosabatlar bilan belgilanadi: ;
Bu erda gazning normal sharoitdagi zichligi.
Tana haroratining bir xil miqdordagi issiqlik bilan o'zgarishi sodir bo'layotgan jarayonning tabiatiga bog'liq issiqlik sig'imi jarayonning funktsiyasidir. Bu shuni anglatadiki, bir xil ishchi suyuqlik, jarayonga qarab, uni 1 K ga qizdirish uchun har xil miqdordagi issiqlikni talab qiladi. Raqamli bo'lib, c qiymati +∞ dan -∞ gacha o'zgaradi.
Termodinamik hisoblarda quyidagilar katta ahamiyatga ega:
doimiy bosimdagi issiqlik sig'imi
doimiy bosimdagi jarayonda tanaga berilgan issiqlik miqdorining tana haroratining o'zgarishiga nisbatiga teng dT
doimiy hajmdagi issiqlik sig'imi
, (1.5)
issiqlik miqdori nisbatiga teng , jarayonida tanaga keltirildi doimiy hajm, tana haroratining o'zgarishiga .
Muvozanat jarayonlari sodir bo'ladigan yopiq tizimlar uchun termodinamikaning birinchi qonuniga muvofiq ![]() , va
, va
Izokorik jarayon uchun ( v=const) bu tenglama shaklni oladi ![]() , va (1.5) ni hisobga olgan holda, biz buni olamiz
, va (1.5) ni hisobga olgan holda, biz buni olamiz
![]() ,
,
ya'ni doimiy hajmdagi jismning issiqlik sig'imi uning ichki energiyasining haroratga nisbatan qisman hosilasiga teng va harorat ortishi bilan izoxorik jarayonda ichki energiyaning o'sish tezligini tavsiflaydi.
Ideal gaz uchun
Izobar jarayon uchun (2.16) va (2.14) tenglamalardan olamiz.
Bu tenglama issiqlik sig'imlari o'rtasidagi munosabatni ko'rsatadi bilan p va Rezyume. Ideal gaz uchun u juda soddalashtirilgan. Haqiqatan ham, ideal gazning ichki energiyasi faqat uning harorati bilan belgilanadi va hajmga bog'liq emas, shuning uchun va bundan tashqari, u holat tenglamasidan kelib chiqadi. ![]() , qayerda
, qayerda
Bu nisbat deyiladi Mayer tenglamasi va texnik termodinamikaning asosiy ideal gazlaridan biridir.
Jarayonda v\u003d gazga berilgan issiqlik faqat uning ichki energiyasini o'zgartirish uchun ketadi, bu jarayonda R= konst issiqlik ham ichki energiyani oshirishga, ham tashqi kuchlarga qarshi ishlarni bajarishga sarflanadi. Shunung uchun bilan p Ko'proq Rezyume bu ishning hajmi.
Haqiqiy gazlar uchun, ular kengaygan paytdan boshlab (da p= const) ish faqat tashqi kuchlarga qarshi emas, balki qo'shimcha issiqlik sarfini keltirib chiqaradigan molekulalar o'rtasida ta'sir qiluvchi tortishish kuchlariga qarshi ham bajariladi.
Odatda issiqlik sig'imlari eksperimental tarzda aniqlanadi, lekin ko'p moddalar uchun ularni usullar bilan hisoblash mumkin statistik fizika.
Issiqlik sig'imining klassik nazariyasi natijalari xona harorati mintaqasidagi eksperimental ma'lumotlarga yaxshi mos keladi (2.1-jadval), ammo tajriba haroratdan mustaqillik haqidagi asosiy xulosani tasdiqlamaydi. Kam va etarli mintaqada ayniqsa muhim nomuvofiqliklar yuqori haroratlar, molekulalarning kvant harakati bilan bog'liq va nuqtai nazardan tushuntirishlarni toping kvant nazariyasi issiqlik sig'imi.
Ideal gaz holatida t= 0°C da ba'zi gazlarning issiqlik sig'imi
Bu nazariya, birinchi navbatda, past va yuqori haroratlar mintaqasida erkinlik darajasi bo'yicha energiyaning bir xil taqsimlanishi haqidagi teoremaning adolatsizligini o'rnatadi. Gaz harorati pasayganda, molekulaning erkinlik darajalari soni muzlaydi. Shunday qilib, ikki atomli molekula uchun aylanish erkinlik darajalari "muzlaydi" va besh o'rniga u uchta erkinlik darajasiga ega va shuning uchun ichki energiya va issiqlik sig'imi kamayadi. Haroratning oshishi bilan ko'p atomli molekulalar molekula atomlarining tebranish harakati (molekula osilatorga aylanadi) tufayli ichki erkinlik darajalarini qo'zg'atadi. Bu ichki energiyaning oshishiga va natijada haroratning oshishi bilan issiqlik sig'imiga olib keladi.
Haqiqiy gazning issiqlik sig'imi bosimga bog'liq, ammo juda zaif.
Haqiqiy gazning issiqlik sig'imi haroratga bog'liq bo'lganligi sababli, termodinamika haqiqiy va o'rtacha issiqlik sig'imlarini ajratadi.
O'rtacha issiqlik quvvati Bilan Chorshanba dan harorat oralig'ida bu jarayon t1 oldin t2 - gazga berilgan issiqlik miqdorining oxirgi va dastlabki haroratlar orasidagi farqga nisbati:
![]()
Ifoda
ma'lum bir haroratda yoki shunday deb ataladigan issiqlik quvvatini aniqlaydi haqiqiy issiqlik sig'imi. * dan shundan kelib chiqadi
 .
.
Amaliy hisob-kitoblar uchun barcha moddalarning issiqlik sig'imlari jadvalga kiritilgan va jadvallar hajmini kamaytirish uchun ulardagi o'rtacha issiqlik sig'imlari 0 dan harorat oralig'ida berilgan. t.
2-MA'RUZA
Ideal gazlar aralashmalari
Ideal gazlar uchun yuqorida olingan barcha bog'liqliklar, agar aralashmaning gaz konstantasi, molekulyar og'irligi va issiqlik sig'imi ularga almashtirilsa, ularning aralashmalari uchun ham amal qiladi.
Dalton qonuni. Muhandislik amaliyotida ko'pincha xossalari bo'yicha ideal gazlarga o'xshash va bir-biri bilan kimyoviy reaksiyaga kirishmaydigan turli gazlarning alohida komponentlarining mexanik aralashmasi bo'lgan gazsimon moddalar bilan shug'ullanish kerak. Bular deyiladi gaz aralashmalari. Masalan, ichki yonuv dvigatellari, pechlar va bug 'qozonlarida yoqilg'ining yonish mahsulotlari, quritish zavodlarida nam havo va boshqalar.
Gaz aralashmasining harakatini belgilaydigan asosiy qonun Dalton qonunidir: ideal gazlar aralashmasining umumiy bosimi uning barcha tarkibiy qismlarining qisman bosimlari yig'indisiga teng:
Qisman bosim pi- agar u bir xil haroratda aralashmaning butun hajmini egallagan bo'lsa, gazning bosimi.
Aralashmani o'rnatish usullari. Gaz aralashmasining tarkibi massa, hajm yoki mol fraktsiyalari bilan aniqlanishi mumkin.
Massa ulushi bitta komponent massasining nisbati Mi, aralashmaning massasiga M:
Ko'rinib turibdiki, va.
Massa ulushlari ko'pincha foiz sifatida beriladi. Masalan, quruq havo uchun; .
Volumetrik kasr - V gazining kamaytirilgan hajmining aralashmaning umumiy hajmiga nisbati V:.
Berilgan gazning bosimi va harorati aralashmaning bosimi va haroratiga teng bo'lsa, uning tarkibiy qismi egallagan hajmdir.
Qisqartirilgan hajmni hisoblash uchun ikkita holat tenglamasini yozamiz i--chi komponent:
![]() ; (2.1)
; (2.1)
![]() .
.
Birinchi tenglama aralashmadagi gaz komponentining mavjud bo'lgan holatiga ishora qiladi qisman bosim pi va aralashmaning to'liq hajmini egallaydi va ikkinchi tenglama - aralashmaning bosimi va harorati teng bo'lganda, qisqartirilgan holatga, R va T. Bu tenglamalardan kelib chiqadi
Aralashmaning barcha komponentlari uchun yig'indisi munosabati (2.2) Dalton qonunini hisobga olgan holda, qayerdan olinganligini olamiz. Hajm kasrlari ham ko'pincha foiz sifatida beriladi. Havo uchun, .
Ba'zan aralashmaning tarkibini mol fraktsiyalarida ko'rsatish qulayroqdir. Mol fraktsiyasi mollar sonining nisbati deyiladi Ni ko'rib chiqilayotgan komponentning aralashmaning umumiy mollari soniga N.
Gaz aralashmasidan iborat bo'lsin N1 birinchi komponentning mollari, N2 ikkinchi komponentning mollari va boshqalar. Aralashmaning mollari soni va komponentning mol ulushi teng bo'ladi. .
Avogadro qonuniga ko'ra, har qanday gazning mol hajmlari bir vaqtning o'zida R va T, xususan, aralashmaning harorati va bosimida, ideal gaz holatida ular bir xil bo'ladi. Shuning uchun har qanday komponentning kamaytirilgan hajmini mol hajmining mahsuloti sifatida ushbu komponentning mollari soniga, ya'ni aralashmaning hajmiga - formula bo'yicha hisoblash mumkin. Keyin ![]() , va demak, aralashtirish gazlarini mol fraktsiyalari bo'yicha belgilash uning hajm ulushlari bo'yicha tayinlanishiga teng.
, va demak, aralashtirish gazlarini mol fraktsiyalari bo'yicha belgilash uning hajm ulushlari bo'yicha tayinlanishiga teng.
Gazlar aralashmasining gaz konstantasi. Aralashmaning barcha komponentlari uchun (2.1) tenglamalarni yig'ib, biz olamiz 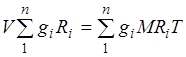 . Buni hisobga olsak, yozishimiz mumkin
. Buni hisobga olsak, yozishimiz mumkin
![]() , (2.3)
, (2.3)
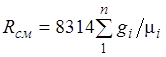 . (2.4)
. (2.4)
(2.3) tenglama ideal gazlar aralashmasi ham Klapeyron tenglamasiga bo'ysunishini bildiradi. Chunki ![]() u holda (2.4) dan aralashmaning gaz konstantasi [J/(kg-K)] shaklga ega ekanligi kelib chiqadi.
u holda (2.4) dan aralashmaning gaz konstantasi [J/(kg-K)] shaklga ega ekanligi kelib chiqadi.
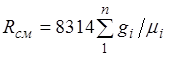 (2.5)
(2.5)
Aralashmaning ko'rinadigan molekulyar og'irligi. Aralashmaning gaz konstantasini formal ravishda ifodalaylik R, aralashmaning ko'rinadigan ko'z massasini kiritish orqali: ![]() (2.6)
(2.6)
(2.5) va (2.6) munosabatlarining o'ng tomonlarini taqqoslab, biz topamiz
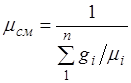 .
.
Massa ulushlarining ta'rifidan kelib chiqadiki
Ushbu nisbatni barcha komponentlar uchun jamlab, shuni hisobga olsak, aralashmaning ko'rinadigan molekulyar og'irligi va massasi uchun hajm ulushlari bilan berilgan ifodani olamiz:
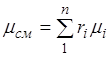 . (2.7)
. (2.7)
Hajmi va massa ulushlari o'rtasidagi nisbat.(2.7) ni hisobga olgan holda biz olamiz 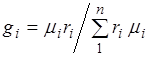 .
.
Chunki 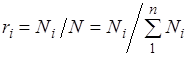 , keyin
, keyin
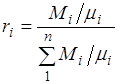
Ushbu formulaning numeratori va maxrajini aralashmaning M massasiga bo'lib, biz hosil bo'lamiz
 .
.
Termodinamikaning birinchi qonunining analitik ifodasi
Termodinamikaning birinchi qonuni issiqlik hodisalariga nisbatan qo'llaniladigan energiyaning saqlanish va o'zgarishining universal qonunining alohida holatidir. Eynshteyn tenglamasiga ko'ra massa va energiyaning saqlanish va o'zgarishining yagona qonunini ko'rib chiqish kerak. Biroq, texnik termodinamikada biz jismning shunday past tezliklari bilan shug'ullanamizki, massa nuqsoni nolga teng va shuning uchun energiyaning saqlanish qonunini mustaqil ravishda ko'rib chiqish mumkin.
Energiyaning saqlanish va o'zgarishi qonuni tabiatning asosiy qonuni bo'lib, u juda ko'p miqdordagi eksperimental ma'lumotlarni umumlashtirish asosida olinadi va barcha tabiat hodisalariga taalluqlidir. Uning ta'kidlashicha, energiya yo'qolmaydi va yana paydo bo'lmaydi, u faqat bir shakldan ikkinchisiga o'tadi va bir turdagi energiyaning kamayishi boshqa turdagi energiyaning ekvivalent miqdorini beradi.
Bizning vatandoshimiz M. V. Lomonosov (1711 - 1765) moddalar va energiyaning saqlanish tamoyilini tasdiqlagan birinchi olimlardan edi.
Hajmi bilan ishlaydigan tanaga ruxsat bering V va vazn M, haroratga ega T va bosim R, cheksiz miqdordagi issiqlik tashqaridan uzatiladi. Issiqlik bilan ta'minlash natijasida tana isitiladi dT va hajmi oshadi dV.
Tana haroratining oshishi uning zarrachalarining kinetik energiyasining ortishidan dalolat beradi. Tana hajmining oshishi zarrachalarning potentsial energiyasining o'zgarishiga olib keladi. Natijada, tananing ichki energiyasi tomonidan ortadi dU. Ishchi suyuqlik unga bosim o'tkazuvchi muhit bilan o'ralganligi sababli, u kengayganda, tashqi bosim kuchlariga qarshi mexanik ish bajaradi. Tizimda boshqa hech qanday o'zgarishlar sodir bo'lmagani uchun, energiya saqlanish qonuniga ko'ra
![]() (2.8)
(2.8)
ya'ni tizimga berilgan issiqlik uning ichki energiyasini oshirish va tashqi ishlarni bajarish uchun ketadi.
Olingan tenglama termodinamikaning birinchi qonunining matematik ifodasidir. Ushbu nisbatning uchta shartining har biri ijobiy, salbiy yoki nolga teng bo'lishi mumkin. Keling, ba'zi alohida holatlarni ko'rib chiqaylik.
1. - tizim va atrof-muhit o'rtasida issiqlik almashinuvi yo'q, ya'ni issiqlik tizimga berilmaydi va undan chiqarilmaydi. Issiqlik almashinuvisiz jarayon deyiladi adiabatik. Buning uchun (2.8) tenglama quyidagi shaklni oladi:
Shu sababli, tizim tomonidan amalga oshirilgan kengaytirish ishlari adiabatik jarayon, berilgan sistemaning ichki energiyasining kamayishiga teng. Ishchi suyuqlikning adiabatik siqilishi bilan tashqi tomondan sarflangan ish butunlay tizimning ichki energiyasini oshirishga ketadi.
2. - tananing hajmi o'zgarmagan holda, dV=0. Bunday jarayon deyiladi izoxorik, uning uchun
ya'ni doimiy hajmda tizimga beriladigan issiqlik miqdori ushbu tizimning ichki energiyasining ortishiga teng.
3. dU=0- tizimning ichki energiyasi o'zgarmaydi va
bular. Tizimga berilgan issiqlik unga ekvivalent tashqi ishga aylanadi.
1 kg ishchi suyuqlikni o'z ichiga olgan tizim uchun
![]() . (2.9)
. (2.9)
Ayrim jarayonlar uchun (2.8) va (2.9) tenglamalarni integrallash orqali termodinamikaning birinchi qonuni ifodasini olamiz. integral shakli:
![]() ; .
; .
Ichki energiya
Tizimning ichki energiyasiga quyidagilar kiradi:
zarrachalarning translatsiya, aylanish va tebranish harakatining kinetik energiyasi;
zarrachalarning o'zaro ta'sirining potentsial energiyasi;
energiya elektron qobiqlar atomlar;
yadro ichidagi energiya.
Ko'pgina issiqlik va quvvat jarayonlarida oxirgi ikki komponent o'zgarishsiz qoladi. Shuning uchun, kelajakda ostidaichki energiya Biz molekulalar va atomlarning xaotik harakati energiyasini, shu jumladan translatsiya, aylanish va aylanish energiyasini tushunamiz. tebranish harakatlari molekulyar va intramolekulyar, shuningdek, molekulalar orasidagi o'zaro ta'sir kuchlarining potentsial energiyasi.
Kinetik energiya molekulalar haroratning funktsiyasidir, potentsial energiyaning qiymati molekulalar orasidagi o'rtacha masofaga va shuning uchun gaz egallagan hajmga bog'liq. V, ya'ni funktsiyadir v. Shuning uchun ichki energiya U tananing holatining funktsiyasidir.
Uchun murakkab tizim u alohida qismlarning energiyalari yig'indisi bilan belgilanadi, ya'ni u qo'shilish xususiyatiga ega. Qiymat u=U/M, chaqirdi o'ziga xos ichki energiya (J / kg), - moddaning birlik massasining ichki energiyasi.
Quyida qisqachalik uchun miqdorga murojaat qilamiz va faqat ichki energiya. Ichki energiya tananing holatining funktsiyasi bo'lganligi sababli, uni ushbu holatni aniqlaydigan har qanday ikkita mustaqil parametr funktsiyasi sifatida ko'rsatish mumkin:
; ; .
Uning termodinamik jarayondagi o'zgarishi jarayonning tabiatiga bog'liq emas va faqat tananing boshlang'ich va oxirgi holatlari bilan belgilanadi:
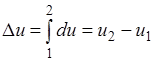 ;
;
Dastlabki holatda ichki energiya qiymati, va - yakuniy. Matematik jihatdan bu ichki energiyaning cheksiz kichik o'zgarishini anglatadi du u yerda umumiy farq va; ichki energiyani xususiy hajm va harorat funksiyasi sifatida ifodalasak, u holda
Molekulalar o'rtasida o'zaro ta'sir kuchlari bo'lmagan ideal gazning ichki energiyasi gaz hajmiga yoki bosimiga bog'liq emas. a faqat uning harorati bilan belgilanadi, shuning uchun ideal gazning ichki energiyasining haroratga nisbatan hosilasi umumiy hosiladir:
Texnik termodinamika muammolari uchun ichki energiyaning mutlaq qiymati emas, balki uning turli xildagi o'zgarishi muhim ahamiyatga ega. termodinamik jarayonlar. Shuning uchun ichki energiyaning kelib chiqishi o'zboshimchalik bilan tanlanishi mumkin. Masalan, suv bo'yicha xalqaro shartnomaga muvofiq, ichki energiyaning qiymati 0,01 ° C haroratda va 610,8 Pa bosimda nol, ideal gazlar uchun esa bosimdan qat'i nazar, 0 ° C da olinadi.
Kengaytirish ishlari
Termodinamikada ham, mexanikada ham ish ishchi jismga ta’sir etuvchi kuchning mahsuloti va uning ta’sir yo‘li bilan aniqlanadi.
Massasi bo'lgan gazni ko'rib chiqing M va hajmi V, yuzasi F bo'lgan elastik qobiq bilan o'ralgan.
 |
Agar gazga ma'lum miqdorda issiqlik berilsa, u tashqi bosimga qarshi ish olib borishda kengayadi R, atrof-muhit unga ta'sir qiladi. Gaz qobiqning har bir elementiga ta'sir qiladi dF ga teng kuch bilan pdf va uni normal bo'ylab masofadan sirtga ko'chirish dn, majburiyat oladi boshlang'ich ish pdfdn. Cheksiz kichik jarayon davomida bajarilgan umumiy ishni ushbu ifodani butun sirt bo'ylab integrallash orqali olish mumkin F qobiqlar: ![]() .
.
Rasmdan ko'rinib turibdiki, ovoz balandligi o'zgaradi dV sirt ustida integral sifatida ifodalanadi: ![]() ,
Natijada
,
Natijada
Hajmining cheklangan o'zgarishi bilan tashqi bosim kuchlariga qarshi ish deyiladi kengaytirish ishlari, ga teng
(3.1) dan shunday va dV har doim bor bir xil belgilar:
agar dV>0, keyin va > 0, ya'ni kengayish vaqtida tananing ishi ijobiy, tananing o'zi esa ishni bajaradi;
agar dV<0, keyin va<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
Kengayish ishini ishchi organning massasining 1 kg ga bog'lab, biz olamiz
l = L/M; .
1 kg gazni o'z ichiga olgan tizim tomonidan bajariladigan o'ziga xos ishni ifodalovchi qiymat tengdir
Umuman olganda R o'zgaruvchi bo'lsa, u holda integratsiya faqat bosim o'zgarishi qonuni ma'lum bo'lganda mumkin p = p (v).
Formulalar (3.1) - (3.2) faqat ishchi suyuqlik bosimi atrof-muhit bosimiga teng bo'lgan muvozanat jarayonlari uchun amal qiladi.
Termodinamikada muvozanat jarayonlari keng qo'llaniladi p,v- abscissa o'qi xususiy hajm, ordinata o'qi esa bosim bo'lgan diagramma. Termodinamik tizimning holati ikkita parametr bilan aniqlanganligi sababli, u holda p,v U diagrammada nuqta bilan ifodalangan. Rasmdagi nuqta 1 tizimning dastlabki holatiga, nuqtaga mos keladi 2 - yakuniy va chiziq 12 - dan ishchi suyuqlikni kengaytirish jarayoni v1 oldin v2. Hajmining cheksiz o'zgarishi bilan, soyali vertikal chiziqning maydoni; shuning uchun jarayonning ishi 12 jarayon egri chizig'i, abscissa o'qi va ekstremal ordinatalar bilan chegaralangan maydon bilan tasvirlangan.
Shunday qilib, hajmni o'zgartirish ishi p, v diagrammadagi jarayon egri chizig'i ostidagi maydonga ekvivalentdir (3.1-rasm).
3.1-rasm - dagi ishning grafik tasviri p, v- koordinatalar
Tizimning har bir yo'li davlatdan / holatga o'tadi 2 (masalan, 12, 1a2 yoki 1b2) kengaytirish ishiga mos keladi.Shuning uchun, ish termodinamik jarayonning tabiatiga bog'liq, va faqat tizimning boshlang'ich va oxirgi holatlarining funktsiyasi emas. Boshqa tomondan, integratsiya yo'liga bog'liq va shuning uchun elementar ish to'liq differentsial emas.
Ish har doim kosmosda makroskopik jismlarning harakati bilan bog'liq, masalan, pistonning harakati, qobiqning deformatsiyasi, shuning uchun u energiyani bir jismdan ikkinchisiga o'tkazishning tartibli (makrofizik) shaklini tavsiflaydi va uzatilgan energiya. Qiymat hajmning o'sishiga mutanosib bo'lganligi sababli, issiqlik energiyasini mexanik energiyaga aylantirish uchun mo'ljallangan ishchi organlar sifatida ularning hajmini sezilarli darajada oshirish qobiliyatiga ega bo'lganlarni tanlash tavsiya etiladi. Bu sifat gazlar va suyuqliklarning bug'lariga ega. Shuning uchun, masalan, issiqlik elektr stantsiyalarida suv bug'lari ish muhiti bo'lib xizmat qiladi, ichki yonuv dvigatellarida esa ma'lum bir yoqilg'ining yonishi gazsimon mahsulotlar.
Issiqlik
Energiya uzatishning makrofizik shakli - ish bilan bir qatorda, tizim va atrof-muhit o'rtasida molekulyar darajada amalga oshiriladigan mikrofizik, ya'ni energiya almashinuvi shakli ham mavjud. Bunday holda, energiya ish qilmasdan tizimga o'tkazilishi mumkin. Mikrofizik vositalar bilan uzatiladigan energiya miqdorining o'lchovi issiqlik.
Issiqlik jismlar orasidagi to'g'ridan-to'g'ri aloqa (issiqlik o'tkazuvchanligi, konveksiya) orqali yoki masofada (nurlanish orqali) o'tkazilishi mumkin va barcha hollarda bu jarayon faqat jismlar o'rtasida harorat farqi mavjud bo'lganda mumkin.
Quyida ko'rsatilgandek, issiqlikning elementar miqdori, shuningdek L ichki energiya differentsialidan farqli o'laroq, to'liq differentsial emas dU. Bu matematik simvolizm orqasida ichki energiya, issiqlik va ish tushunchalari orasidagi farqning chuqur jismoniy ma'nosi yashiringan.
Ichki energiya- bu tizimning o'ziga xos xususiyati bo'lib, u tizimning holatini tavsiflaydi. Issiqlik va ish- bu mexanik va termal jarayonlarning energiya xarakteristikalario'zaro ta'sirlar atrof-muhit bilan tizimlar. Ular ma'lum bir jarayonda uning chegaralari orqali tizimga uzatiladigan yoki u tomonidan berilgan energiya miqdorini tavsiflaydi.
Entalpiya
Termodinamikada tizimning ichki energiyasi yig'indisi muhim rol o'ynaydi U va tizim bosimi mahsulotlari R uning hajmiga V, chaqirdi entalpiya va belgilandi H:
Unga kiritilgan miqdorlar davlatning funktsiyalari bo'lganligi sababli, u holda entalpiya holat funksiyasidir. Xuddi ichki energiya, ish va issiqlik kabi, u joul (J) bilan o'lchanadi.
![]() ,
,
chaqirdi maxsus entalpiya(h = H/M), 1 kg moddani o'z ichiga olgan tizimning entalpiyasini ifodalaydi va J / kg bilan o'lchanadi.
Entalpiya holat funksiyasi bo'lgani uchun uni har qanday ikkita holat parametrining funktsiyasi sifatida ko'rsatish mumkin:
![]() ;
; ![]() ;
; ![]() ,
,
va qiymat dh umumiy farq hisoblanadi.
Har qanday jarayonda entalpiyaning o'zgarishi faqat tananing boshlang'ich va oxirgi holatlari bilan belgilanadi va jarayonning xususiyatiga bog'liq emas.
Keling, quyidagi misol yordamida entalpiyaning fizik ma'nosini bilib olaylik. Keling, silindrdagi gazni va umumiy og'irlikdagi yukga ega pistonni o'z ichiga olgan kengaytirilgan tizimni ko'rib chiqaylik G.
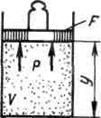 |
Ushbu tizimning energiyasi gazning ichki energiyasi va tashqi kuchlar sohasidagi yuk bilan pistonning potentsial energiyasining yig'indisidir: . Muvozanatda (G=pF) Bu funktsiyani gaz parametrlari bilan ifodalash mumkin: . Biz buni olamiz, ya'ni. entalpiya kengaytirilgan tizimning energiyasi sifatida talqin qilinishi mumkin.






