To'yingan bug' deb ataladigan narsa. Neft va gaz katta ensiklopediya
Maqolaning sarlavhasida berilgan savolga javob berishdan oldin, keling, bug' nima ekanligini aniqlaylik. Ko'pchilik bu so'z bilan bo'lgan tasvirlar: qaynab turgan choynak yoki kostryulka, bug 'xonasi, issiq ichimlik va shunga o'xshash ko'plab rasmlar. Qanday bo'lmasin, bizning g'oyalarimizda uning yuzasidan ko'tarilgan suyuqlik va gazsimon modda mavjud. Agar sizdan bug 'misolini berish so'ralsa, siz darhol suv bug'ini, spirtning bug'larini, efirni, benzinni, asetonni eslaysiz.

Gazsimon holatlar uchun yana bir so'z bor - gaz. Bu erda biz odatda kislorod, vodorod, azot va boshqa gazlarni tegishli suyuqliklar bilan bog'lamasdan o'ylaymiz. Ularning ichida ham borligi ma'lum suyuqlik holati. Bir qarashda, farqlar shundaki, bug 'tabiiy suyuqliklarga mos keladi va gazlar ataylab suyultirilishi kerak. Biroq, bu mutlaqo to'g'ri emas. Bundan tashqari, bug' so'zi bilan paydo bo'lgan tasvirlar bug' emas. Aniqroq javob berish uchun keling, bug'ning qanday yaratilganini ko'rib chiqaylik.
Bug 'gazdan qanday farq qiladi?
Moddaning yig'ilish holati harorat bilan, aniqrog'i uning molekulalari o'zaro ta'sir qiladigan energiya va ularning termal xaotik harakati energiyasi o'rtasidagi nisbat bilan belgilanadi. Taxminan, agar o'zaro ta'sir energiyasi ancha katta bo'lsa, deb taxmin qilishimiz mumkin - qattiq holat, agar issiqlik harakatining energiyasi ancha katta bo'lsa - gazsimon, energiyalari taqqoslanadigan bo'lsa - suyuqlik.

Ma’lum bo‘lishicha, molekula suyuqlikdan ajralib, bug‘ hosil bo‘lishida ishtirok etishi uchun issiqlik energiyasining qiymati o‘zaro ta’sir energiyasidan katta bo‘lishi kerak. Bu qanday sodir bo'lishi mumkin? Molekulalarning issiqlik harakatining o'rtacha tezligi haroratga qarab ma'lum bir qiymatga teng. Biroq, molekulalarning individual tezligi har xil: ularning ko'pchiligi o'rtacha qiymatga yaqin tezlikka ega, ammo ularning ba'zilari o'rtachadan kattaroq, ba'zilari esa kamroq tezlikka ega.
Tezroq molekulalar bo'lishi mumkin issiqlik energiyasi o'zaro ta'sir energiyasidan kattaroqdir, ya'ni ular suyuqlik yuzasiga tegib, undan ajralib chiqib, bug' hosil qilishlari mumkin. Ushbu turdagi bug'lanish deyiladi bug'lanish. Tezliklarning bir xil taqsimlanishi tufayli qarama-qarshi jarayon - kondensatsiya sodir bo'ladi: bug'dan molekulalar suyuqlikka o'tadi. Aytgancha, odatda bug 'so'zi bilan paydo bo'ladigan tasvirlar bug' emas, balki qarama-qarshi jarayonning natijasi - kondensatsiya. Siz juftlikni ko'ra olmaysiz.

Muayyan sharoitlarda bug 'suyuqlikka aylanishi mumkin, ammo buning uchun uning harorati ma'lum bir qiymatdan oshmasligi kerak. Bu qiymat kritik harorat deb ataladi. Bug 'va gaz gazsimon holat bo'lib, ular mavjud bo'lgan haroratda farqlanadi. Agar harorat kritik darajadan oshmasa - bug ', agar u oshsa - gaz. Haroratni doimiy ravishda ushlab tursangiz va hajmni kamaytirsangiz, bug 'suyuqlanadi, gaz suyultirilmaydi.
To'yingan va to'yinmagan bug' nima
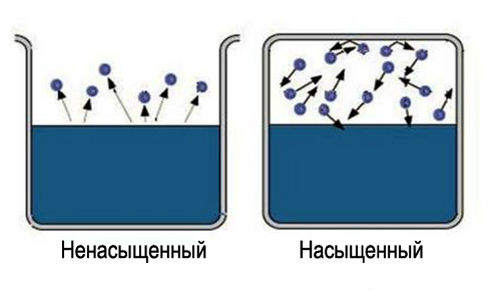
"To'yingan" so'zi ma'lum ma'lumotlarni o'z ichiga oladi, kosmosning katta maydonini to'ldirish qiyin. Shunday qilib, olish uchun to'yingan bug ', zarur suyuqlik joylashgan bo'shliqni cheklash. Bunday holda, harorat berilgan modda uchun kritik darajadan past bo'lishi kerak. Endi bug'langan molekulalar suyuqlik joylashgan bo'shliqda qoladi. Dastlab, molekulalarning ko'p o'tishlari suyuqlikdan sodir bo'ladi, bug 'zichligi esa ortadi. Bu o'z navbatida sabab bo'ladi Ko'proq molekulalarning suyuqlikka teskari o'tishi, bu kondensatsiya jarayonining tezligini oshiradi.
Nihoyat, bir fazadan ikkinchisiga o'tadigan molekulalarning o'rtacha soni teng bo'ladigan holat o'rnatiladi. Bunday davlat deyiladi dinamik muvozanat. Bu holat bug'lanish va kondensatsiya tezligining kattaligi va yo'nalishining bir xil o'zgarishi bilan tavsiflanadi. Bu holat to'yingan bug'ga mos keladi. Agar dinamik muvozanat holatiga erishilmasa, bu to'yinmagan bug'ga to'g'ri keladi.
Ular biron bir ob'ektni o'rganishni har doim uning eng oddiy modeli bilan boshlaydilar. Molekulyar kinetik nazariyada bu ideal gazdir. Bu erda asosiy soddalashtirishlar molekulalarning ichki hajmini va ularning o'zaro ta'sirining energiyasini e'tiborsiz qoldirishdir. Ma'lum bo'lishicha, ushbu model qoniqarli ta'riflaydi to'yinmagan bug '. Bundan tashqari, u qanchalik to'yingan bo'lsa, undan foydalanish qanchalik qonuniy bo'lsa. Ideal gaz gaz bo'lib, u bug'ga ham, suyuqlikka ham aylana olmaydi. Shuning uchun, to'yingan bug 'uchun bunday model etarli emas.
To'yingan va to'yinmagan bug'ning asosiy farqlari
- To'yingan degani, berilgan ob'ekt ba'zi parametrlarning mumkin bo'lgan eng katta qiymatiga ega ekanligini anglatadi. Er-xotin uchun bu zichlik va bosim. To'yinmagan bug 'uchun bu parametrlar kichikroq qiymatlarga ega. Bug 'to'yinganlikdan qanchalik uzoq bo'lsa, bu qiymatlar shunchalik kichik bo'ladi. Bir tushuntirish: mos yozuvlar harorati doimiy bo'lishi kerak.
- To'yinmagan bug 'uchun, Boyl-Mariot qonuni: agar gazning harorati va massasi doimiy bo'lsa, hajmning oshishi yoki kamayishi bosimning bir xil miqdorda kamayishiga yoki oshishiga olib keladi, bosim va hajm teskari bog'liqdir. Maksimal zichlik va bosimdan boshlab doimiy harorat ularning to'yingan bug' hajmidan mustaqilligi kelib chiqadi, ma'lum bo'lishicha, to'yingan bug' bosimi va hajmi bir-biriga bog'liq emas.
- To'yinmagan bug 'uchun zichligi haroratga bog'liq emas, va agar hajm saqlanib qolsa, zichlik qiymati ham o'zgarmaydi. To'yingan bug 'uchun, hajmni saqlab turganda, harorat o'zgarsa, zichlik o'zgaradi. Bunday holda, munosabatlar to'g'ridan-to'g'ri bo'ladi. Agar harorat ko'tarilsa, zichlik ham ortadi, agar harorat pasaysa, zichlik ham o'zgaradi.
- Agar hajm doimiy bo'lsa, to'yinmagan bug 'Charlz qonuniga muvofiq harakat qiladi: harorat oshishi bilan bosim bir xil omil bilan ortadi. Bu munosabat chiziqli deb ataladi. To'yingan bug 'uchun harorat oshishi bilan bosim to'yinmagan bug'ga qaraganda tezroq ortadi. Bog'liqlik eksponentdir.
Xulosa qilib aytganda, taqqoslanadigan ob'ektlarning xususiyatlarida sezilarli farqlarni qayd etishimiz mumkin. Asosiy farq shundaki, bug 'to'yingan holatda, uning suyuqligidan ajratilgan holda ko'rib chiqilishi mumkin emas. Bu gaz qonunlarining ko'pchiligini qo'llash mumkin bo'lmagan ikki komponentli tizim.
Bug'lanish - bu faqat gazsimon muhit yoki vakuumga ulashgan suyuqlikning erkin yuzasidan sodir bo'ladigan bug'lanishdir.
Molekulalarning issiqlik harakati kinetik energiyasining notekis taqsimlanishi har qanday haroratda suyuqlik yoki qattiq moddaning ba'zi molekulalarining kinetik energiyasi ularning qolgan molekulalar bilan bog'lanish potentsial energiyasidan oshib ketishiga olib keladi.
Bug'lanish suyuqlik yoki qattiq jism yuzasidan molekulalarni chiqarish jarayonidir kinetik energiya bu molekulalarning o'zaro ta'sirining potentsial energiyasidan oshadi. Bug'lanish suyuqlikni sovutish bilan birga keladi.
Bug'lanish jarayonini molekulyar-kinetik nazariya nuqtai nazaridan ko'rib chiqamiz. Suyuqlikni tark etish uchun molekulalar kinetik energiyasini kamaytirish orqali ishlashlari kerak. Suyuqlikning sirt qatlamidagi tasodifiy harakatlanuvchi molekulalari orasida doimo suyuqlikdan uchib ketishga moyil bo'lgan molekulalar bo'ladi. Bunday molekula chegarasidan chiqib ketganda sirt qatlami, keyin molekulani suyuqlikka qaytaradigan kuch paydo bo'ladi. Shuning uchun suyuqlikdan faqat molekulalar uchib chiqadi, ulardagi kinetik energiya molekulyar kuchlarning qarshi ta'sirini engish uchun zarur bo'lgan ishdan kattaroqdir.
Bug'lanish tezligi quyidagilarga bog'liq:
a) suyuqlik turi;
b) uning erkin yuzasi maydonida. Bu maydon qanchalik katta bo'lsa, suyuqlik tezroq bug'lanadi.
v) suyuqlikning bug 'zichligi uning yuzasidan qanchalik past bo'lsa, bug'lanish tezligi shunchalik yuqori bo'ladi. Shuning uchun sirtdan bug'larni (shamol) chiqarish uning bug'lanishini tezlashtiradi.
d) harorat oshishi bilan suyuqlikning bug'lanish tezligi ortadi.
bug'lanish moddaning suyuq holatdan gazsimon holatga o'tishidir.
Kondensatsiya - dan materiyaning uzatilishi hisoblanadi gazsimon holat suyuq holatga o'tadi.
Bug'lanish jarayonida ichki energiya materiya ko'payadi va zichlashganda - kamayadi.
Bug'lanish issiqligi – - doimiy haroratda suyuqlikni bug'ga aylantirish uchun zarur bo'lgan issiqlik miqdori Q.
Maxsus issiqlik bug'lanish L suyuqlikning birlik massasini doimiy haroratda bug'ga aylantirish uchun zarur bo'lgan issiqlik miqdori bilan o'lchanadi
To'yingan va to'yinmagan bug '. Yopiq idishdagi suyuqlikning doimiy haroratda bug'lanishi bug'langan moddaning gazsimon holatdagi molekulalari kontsentratsiyasining asta-sekin o'sishiga olib keladi. Bug'lanish jarayoni boshlanganidan bir muncha vaqt o'tgach, gazsimon holatdagi moddaning kontsentratsiyasi vaqt birligida suyuqlikka qaytadigan molekulalar soni suyuqlik yuzasida suyuqlik yuzasini tark etadigan molekulalar soniga teng bo'ladigan qiymatga etadi. bir vaqtda. Moddaning bug'lanish va kondensatsiya jarayonlari o'rtasida dinamik muvozanat o'rnatiladi.
Maqolada bug 'nima ekanligi, uning qanday turlari va sanoatda va kundalik hayotda qanday ishlatilishi haqida gapiriladi.
Fizika
Atrofdagi dunyoning tuzilishi va uning ayrim jarayonlarini aniqlashga yordam beradigan asosiy fanlardan biri fizikadir. Atrofimizda har soniyada ko'plab qiziqarli reaktsiyalar sodir bo'ladi. Biz ularning ko'plariga uzoq vaqtdan beri o'rganib qolganmiz va ularga e'tibor bermaymiz. Bundan tashqari, in Kundalik hayot Quyoshning yonish tabiati yoki iqlimga katta ta'sir ko'rsatadigan suv bug'ining paydo bo'lishi haqida kam odam o'ylaydi. Va yuqorida tavsiflangan jarayonlar juda yaxshi o'rganilgan bo'lsa-da, biz bug' nima degan savolni ko'rib chiqamiz. Aytgancha, u nafaqat turli moddalarning qaynashi yoki boshqa reaktsiyalari, balki birinchi navbatda birinchi narsa natijasida hosil bo'lishi mumkin.
Ta'rif
Bug 'moddaning gazsimon holatidir, agar uning ushbu bosqichi ushbu moddaning boshqa agregat holatlari bilan muvozanatda bo'lsa. Jarayonning o'zi, natijada bug' paydo bo'ladi, odatda bug'lanish deb ataladi va teskari jarayon kondensatsiya deb ataladi. Shunday qilib, endi biz bug' nima ekanligini bilamiz. Aytgancha, odatda "bug '" so'zi aytilganda, odamlar deyarli har doim oddiy suvdan olingan bug'ni nazarda tutadi, garchi yuqorida aytib o'tilganidek, ko'plab moddalar bu agregatsiya holatini olishi mumkin.
Bundan tashqari, ikkita asosiy turni ajratish odatiy holdir: to'yingan va to'yinmagan. Ammo bu ta'riflar faqat kimyoviy jihatdan toza bo'lgan moddalarga tegishli. Keling, ularni batafsil tahlil qilaylik.
To'yinmagan bug' nima?

Shuning uchun ular uni hosil bo'lgan suyuqlik bilan bog'liq holda dinamik deb ataladigan muvozanatga erisha olmaganida, uni chaqirishadi. Ko'pincha bunday ta'rif termodinamik bilan aralashtiriladi, bu noto'g'ri. Agar siz to'yinmagan bug'ning bosimini to'yingan bilan solishtirsangiz, u har doim pastroq qiymatga ega bo'ladi.
Suyuqlik yuzasida to'yinmagan bug' paydo bo'lganda, uning hosil bo'lish jarayoni tezroq boradi va teskari jarayondan ustun turadi (yuqorida aytganimizdek, bu kondensatsiya deb ataladi). Va natijada, asta-sekin suyuqlik kamroq va kamroq bo'ladi.
Endi nima ekanligini ko'rib chiqaylik
To'yingan bug '

To'yingan bug ', agar u olingan suyuqlik bilan dinamik muvozanatga erisha olgan bo'lsa, deyiladi. Oddiy qilib aytganda, bu holda bug'lanish kondensatsiyaga tengdir va to'yinmagan bug 'bilan vaziyatdan farqli o'laroq, suyuqlik miqdori o'zgarishsiz qolishi mumkin. Endi biz bug' nima ekanligini va uning turlarini bilamiz.
Agar, masalan, suyuqlik bilan muvozanatda bo'lgan bug'ni siqsangiz, bu muvozanat asta-sekin yo'qoladi va gazsimon moddaning zichligi o'zgarishi tufayli dinamik muvozanat tiklanmaguncha kondensatsiya kuchayib boradi. yana.
Suyuqlik turiga qarab, bug 'bilan dinamik muvozanat uning zichligining turli qiymatlarida namoyon bo'ladi. Bu barcha moddalarning molekulalararo tortishish kuchi har xil bo'lishi bilan bog'liq.
suv bug'i

Va shunga qaramay, ko'pincha odamlar bu so'zni hamma uchun tanish bo'lgan suvning gaz holati deb tushunishadi. Agar siz ensiklopediyaga qarasangiz, bug'ning asosiy belgilovchi xususiyatlarini topishingiz mumkin: rang, hid yo'qligi va uni aslida suvdan olish.
Biz hammamiz buni qayta-qayta payqaganmiz, xoh u pishirish uchun qaynayotgan suvmi yoki yomg'irdan keyin issiq yulka ustidagi namlikni bug'lashmi. Ammo bu haqda o'ylab, sanoat va texnologik inqilob davrlarini eslasangiz, ayon bo'ladiki, katta ahamiyatga ega inson hayotida bug 'bo'ladi. Ushbu hodisaning fizikasi shundayki, u o'zining dastlabki suyuq shaklidan o'n baravar katta hajmni egallaydi. Aynan mana shu kuzatish o'z vaqtida texnologiya rivojiga turtki bergan.
Hammasi birinchi va biroz keyinroq "o'ziyurar" aravalardan boshlandi, chunki bunday motorli transport vositalarini chaqirishdi. Ammo bunday mashinalar juda uzoq vaqt davomida ish holatiga keltirildi, past tezlik va yomon ishlov berish edi. Hamma narsa faqat bug 'lokomotivlari ixtirosi bilan o'zgardi.
Bundan tashqari, suv ham yaxshi sovutish suvi hisoblanadi va ko'plab sovutish tizimlarida qo'llaniladi va agar ularning davri yopiq bo'lmasa, natijada bug' ham paydo bo'ladi. Bizning davrimizda u ba'zan maxsus gaz holatiga keltiriladi, lekin ibtidoiy dvigatellarda emas, balki elektr generatorlarining turbinalari bug 'bilan aylanadigan atom elektr stantsiyalarida.
Iqlim sharoitida bug'langan suv ham katta ahamiyatga ega. Harorat ancha past bo'lgan balandlikka ko'tarilgan bug 'kondensatsiyalanadi va yomg'ir shaklida er yuzasiga tushadi. Qor deyarli bir xil.
Oxir-oqibat, ular er-xotin uchun parhez va oddiygina sog'lom taom tayyorlashadi.
To'g'ri sharoitlarda bug 'er yuzasida tuman hosil qiladi.
Endi biz bug' nima ekanligini va u qanday sodir bo'lishini bilamiz.
Mavzu 2. FAZA O'TISHLARI.
Fazali o'tish ( fazali transformatsiya) - moddaning bir fazadan ikkinchi fazaga o'zgarishi bilan birga tashqi sharoitlarning o'zgarishi (masalan, harorat, bosim, magnit va elektr maydonlari va boshqalar), o'zgarish bilan birga. jismoniy xususiyatlar va moddaning parametrlari.
Harorat, bosim yoki boshqa qiymatlar jismoniy miqdor fazali o'tish sodir bo'ladigan o'tish nuqtasi deb ataladi. Fazali o'tishning ikki turi mavjud.
BIRINCHI TURLI FAZA O'TISHLARI
Birinchi turdagi fazali o'tish paytida, bunday termodinamik
moddalarning zichligi, tarkibiy qismlarining konsentratsiyasi kabi xususiyatlari; muayyan hajm, saqlangan ichki energiya miqdori, ya'ni. ma'lum miqdorda issiqlik ajralib chiqadi yoki so'riladi, bu o'tish issiqligi deb ataladi. Bundan tashqari, bu vaqt ichida emas, balki harorat, bosim va boshqalarning o'zgarishi bilan bu miqdorlarning keskin o'zgarishini nazarda tutadi. Birinchi tartibli fazali o'tishlarning eng keng tarqalgan misollari:
- erish va kristallanish
- bug'lanish va kondensatsiya
- sublimatsiya va desublimatsiya
IKKINCHI TURLI FAZA O'TISHLARI
Ikkinchi tartibli fazali o'tish paytida zichlik va ichki energiya o'zgarmaydi, shuning uchun yalang'och ko'z shunday fazali o'tish ko'rinmas bo'lishi mumkin. O'tishni harorat va bosimga nisbatan ularning hosilalari boshdan kechiradi: issiqlik sig'imi, termal kengayish koeffitsienti, turli xil sezuvchanlik va boshqalar Ya'ni. ikkinchi turdagi fazaviy o'tishlar energiya (issiqlik) ning chiqishi yoki yutilishi bilan emas, balki moddaning strukturasining simmetriyasining o'zgarishi bilan birga keladi. Ikkinchi darajali fazali o'tishlarning eng keng tarqalgan misollari:
- tizimning muhim nuqtadan o'tishi
- paramagnit-ferromagnit o'tish
- metallar va qotishmalarning o'ta o'tkazuvchanlik holatiga o'tishi
- suyuq geliyning o'ta suyuqlik holatiga o'tishi
- amorf materiallarning shishasimon holatga o'tishi
Zamonaviy fizika uchinchi yoki undan yuqori darajadagi fazali o'tishlarga ega bo'lgan tizimlarni ham o'rganadi. Yaqinda keng foydalanish kvant fazasi o'tish kontseptsiyasini oldi, ya'ni. fazaviy o'tish klassik termal tebranishlar bilan emas, balki hatto mavjud bo'lgan kvantlar tomonidan boshqariladi. mutlaq nol Nernst teoremasi tufayli klassik fazaga o'tishni amalga oshirib bo'lmaydigan haroratlar.
Keling, birinchi darajali fazali o'tishlar bilan bog'liq bo'lgan bizni qiziqtiradigan hodisalarni batafsil ko'rib chiqaylik.
BUGLANISH, KONDENSATSIYA, QAYNASH.
TO'YINGAN VA TO'YINMAGAN JUFTLAR.
Har qanday modda ma'lum sharoitlarda turli agregatsiya holatida bo'lishi mumkin - qattiq, suyuq va gazsimon. Bir agregat holatidan ikkinchi holatga o'tish birinchi turdagi fazali o'tishlardir.
Bug'lanish va kondensatsiya moddaning suyuq va gazsimon fazalari orasidagi fazaviy oʻtishlardir.
Hammasi haqiqiy gazlar(kislorod, azot, vodorod va boshqalar) muayyan sharoitlarda suyuqlikka aylana oladi. Biroq, bunday o'zgarish faqat ma'lum bir haroratdan past haroratlarda sodir bo'lishi mumkin kritik harorat T cr. Masalan, suv uchun kritik harorat 647,3 K, azot uchun 126 K, kislorod uchun 154,3 K. Xona haroratida (≈ 300 K) suv ham suyuq, ham gazsimon holatda bo'lishi mumkin, azot va kislorod faqat suvda mavjud. gazlar shakli.
bug'lanish orqali suyuq holatdan gazsimon holatga o'tish fazasi deyiladi. Molekulyar kinetik nazariya nuqtai nazaridan bug'lanish - bu suyuqlik yuzasidan eng tez molekulalarning uchib chiqishi, kinetik energiyasi ularning suyuqlik molekulalarining qolgan qismi bilan bog'lanish energiyasidan yuqori bo'lgan jarayondir. Bu qolgan molekulalarning o'rtacha kinetik energiyasini pasayishiga olib keladi, ya'ni suyuqlikning sovishi (agar atrofdagi jismlardan energiya ta'minoti bo'lmasa).
Kondensatsiya bug'lanishning teskari jarayonidir. Kondensatsiya paytida bug 'molekulalari suyuqlikka qaytadi.
Yopiq idishda suyuqlik va uning bug'i bir holatda bo'lishi mumkin dinamik muvozanat, suyuqlikdan chiqadigan molekulalar soni bug'dan suyuqlikka qaytgan molekulalar soniga teng bo'lganda, ya'ni bug'lanish va kondensatsiya tezligi bir xil bo'lganda. Bunday tizim deyiladi ikki fazali . Suyuqligi bilan muvozanatda bo'lgan bug' deyiladi boy.
Bir soniyada suyuqlikning sirt birligidan chiqariladigan molekulalar soni suyuqlik haroratiga bog'liq. Bug'dan suyuqlikka qaytadigan molekulalar soni bug' molekulalarining kontsentratsiyasiga va shunga bog'liq o'rtacha tezlik bug'ning harorati bilan belgilanadigan ularning termal harakati. Bundan kelib chiqadiki, ma'lum bir modda uchun suyuqlik va uning bug'lari muvozanatidagi bug' molekulalarining kontsentratsiyasi ularning muvozanat harorati bilan belgilanadi. Haroratning oshishi bilan bug'lanish va kondensatsiya jarayonlari o'rtasida dinamik muvozanatning o'rnatilishi bug' molekulalarining yuqori konsentratsiyasida sodir bo'ladi. Gazning (bug'ning) bosimi uning kontsentratsiyasi va harorati bilan aniqlanganligi sababli, biz xulosa qilishimiz mumkin: bosim toʻyingan bugʻ p Berilgan moddaning 0 i faqat uning haroratiga bog'liq va hajmga bog'liq emas. Demak, tekislikdagi real gazlarning izotermlari ( p, V) ikki fazali tizimga mos keladigan gorizontal qismlarni o'z ichiga oladi (3.4.1-rasm).
Haroratning ko'tarilishi bilan to'yingan bug 'bosimi va uning zichligi ortadi, suyuqlikning zichligi esa issiqlik kengayish tufayli kamayadi. Kritik haroratga teng haroratda T kr berilgan modda uchun bug 'va suyuqlik zichligi bir xil bo'ladi. Da T > T kr, suyuqlik va uning to'yingan bug'lari orasidagi jismoniy farqlar yo'qoladi.
Agar to'yinmagan bug 'da izotermik siqilgan bo'lsa T < T cr, keyin uning bosimi to'yingan bug'ning bosimiga teng bo'lguncha ortadi. Hajmining yanada kamayishi bilan idishning pastki qismida suyuqlik hosil bo'ladi va suyuqlik va uning to'yingan bug'lari o'rtasida dinamik muvozanat o'rnatiladi. Hajmining pasayishi bilan bug'ning ortib borayotgan qismi kondensatsiyalanadi va uning bosimi o'zgarishsiz qoladi (izotermiyadagi gorizontal qism). Barcha bug 'suyuqlikka aylanganda, suyuqlikning past siqilishi tufayli bosim hajmining yanada pasayishi bilan keskin ortadi.
Ikki fazali hududni aylanib o'tib, gaz holatidan suyuq holatga o'tish mumkin. Buning uchun siz tanqidiy nuqtani chetlab o'tib, jarayonni yakunlashingiz kerak K. Ushbu turdagi mumkin bo'lgan jarayonlardan biri 1-rasmda siniq chiziq bilan ko'rsatilgan ABC.
DA atmosfera havosi ba'zilarida suv bug'i doimo mavjud qisman bosim p, bu odatda to'yingan bug' bosimidan kamroq p 0 . Munosabat p / p 0 , foiz sifatida ifodalangan, deyiladi nisbiy namlik havo.
| |
To'yinmagan bug'ni holat tenglamasi yordamida nazariy jihatdan tavsiflash mumkin ideal gaz haqiqiy gazlar uchun odatiy cheklovlar ostida: bug 'bosimi juda yuqori bo'lmasligi kerak (amalda p≤ (10 6 –10 7) Pa) va uning harorati har bir modda uchun belgilangan qiymatdan yuqori. Ideal gaz qonunlari har bir harorat uchun to'yingan bug'ga taxminan qo'llanilishi mumkin T bosim p 0 to'yingan bug 'bilan aniqlanadi muvozanat egri chizig'ip 0 (T) ma'lum bir modda uchun.
Bosim p To'yingan bug'ning 0 darajasi harorat oshishi bilan juda tez ortadi T. Giyohvandlik p 0 (T) ideal gaz qonunlaridan olinishi mumkin emas. Molekulalarning doimiy konsentratsiyasida gazning bosimi haroratga to'g'ridan-to'g'ri proportsional ravishda ortadi. To'yingan bug'da harorat oshishi bilan molekulyar harakatning o'rtacha kinetik energiyasi emas, balki ularning konsentratsiyasi ham ortadi. Shuning uchun to'yingan bug'ning bosimi molekulalarning doimiy konsentratsiyasida ideal gaz bosimiga qaraganda haroratning oshishi bilan tezroq ortadi.
Bug'lanish nafaqat sirtdan, balki suyuqlikning asosiy qismida ham sodir bo'lishi mumkin. Suyuqliklar har doim mayda gaz pufakchalarini o'z ichiga oladi. Agar suyuqlikning to'yingan bug' bosimi tashqi bosimga teng yoki undan katta bo'lsa (ya'ni, pufakchalardagi gaz bosimi), suyuqlik pufakchalarga bug'lanadi. Bug 'bilan to'ldirilgan pufakchalar kengayadi va yuzaga suzib chiqadi. Bu jarayon deyiladi qaynash . Shunday qilib, suyuqlikning qaynashi uning bosimi bo'lgan haroratda boshlanadi to'yingan bug'lar tashqi bosimga teng bo'ladi.
Xususan, normada atmosfera bosimi suv 100°C da qaynaydi. Bu shuni anglatadiki, bu haroratda suvning to'yingan bug 'bosimi 1 atm. Tog'larga ko'tarilganda atmosfera bosimi pasayadi va shuning uchun suvning qaynash nuqtasi pasayadi (har 300 metr balandlikda taxminan 1 ° C). 7 km balandlikda bosim taxminan 0,4 atmni tashkil qiladi va qaynash nuqtasi 70 ° C ga tushadi.
Germetik yopilgan idishda suyuqlik qaynay olmaydi, chunki har bir harorat qiymatida suyuqlik va uning to'yingan bug'i o'rtasida muvozanat o'rnatiladi. Muvozanat egri chizig'i bo'ylab p 0 (T) turli bosimlarda suyuqlikning qaynash temperaturasini aniqlash mumkin.
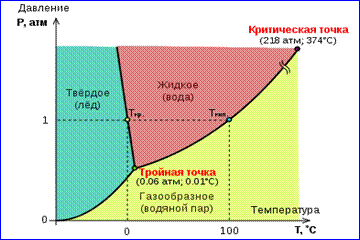
1-rasmda ko'rsatilgan haqiqiy gaz izotermalari rasmida bug'lanish va kondensatsiya jarayonlari, ya'ni moddaning gazsimon va suyuq fazalari orasidagi fazaviy o'tish tasvirlangan. Aslida, bu rasm to'liq emas, chunki har qanday modda gazsimon va suyuq holatdan qattiq holatga o'tishi mumkin. Belgilangan haroratda T bir moddaning ikki fazasi o'rtasidagi termodinamik muvozanat faqat tizimdagi ma'lum bir bosimdagina mumkin. Muvozanat bosimining haroratga bog'liqligi deyiladi fazaviy muvozanat egri chizig'i . Bunga misol qilib muvozanat egri chizig'ini keltirish mumkin p 0 (T) toʻyingan bugʻ va suyuqlik. Agar berilgan moddaning turli fazalari orasidagi muvozanat egri chiziqlari tekislikda chizilgan bo'lsa ( p, T), keyin ular bu tekislikni materiya bir hil holatda mavjud bo'lgan alohida hududlarga ajratadilar agregatsiya holati- qattiq, suyuq yoki gazsimon (2-rasm). Koordinatalar tizimida tasvirlangan ( p, T) muvozanat egri chiziqlari deyiladi faza diagrammasi .
Egri chiziq 0 T, qattiq va gazsimon fazalar orasidagi muvozanatga mos keladigan, deyiladi sublimatsiya egri chizig'i. Egri chiziq TK suyuqlik va bug' orasidagi muvozanat deyiladi bug'lanish egri chizig'i, da uzilib qoladi tanqidiy nuqta K. Egri chiziq TM o'rtasidagi muvozanat qattiq va u suyuqlik deb ataladi erish egri chizig'i.
Muvozanat egri chiziqlari bir nuqtada yaqinlashadi T, bunda barcha uch faza muvozanatda birga yashashi mumkin. Bu nuqta deyiladi uch nuqta.
Ko'p moddalar uchun bosim p uchlik nuqtada tr 1 atm ≈ 10 5 Pa dan kam. Bunday moddalar atmosfera bosimida qizdirilganda eriydi. Masalan, uch nuqta suv (3-rasm) koordinatalariga ega T tr = 273,16 K, p tr \u003d 6.02 10 2 Pa va Kelvinning mutlaq harorat shkalasini kalibrlash uchun mos yozuvlar sifatida ishlatiladi.
 Biroq, bundaylar ham bor Suvning 3 fazali diagrammasi
Biroq, bundaylar ham bor Suvning 3 fazali diagrammasi
mavjud bo'lgan moddalar p tr
1 atm dan oshadi. Shunday qilib, uchun
karbonat angidrid (CO 2) bosimi
p tr = 5,11 atm va harorat
T tr = 216,5 K. Shuning uchun atmosferada
bosim, qattiq karbonat angidrid mumkin
faqat past haroratlarda va suyuq holatda mavjud p= 1 atm u umuman mavjud emas. Qattiq holatda karbonat angidrid 173 K yoki -80 ° C haroratda atmosfera bosimida bug'lari bilan muvozanatda bo'ladi. Bu keng qo'llaniladigan "quruq muz" bo'lib, u hech qachon erimaydi, lekin faqat bug'lanadi (sublimes).






