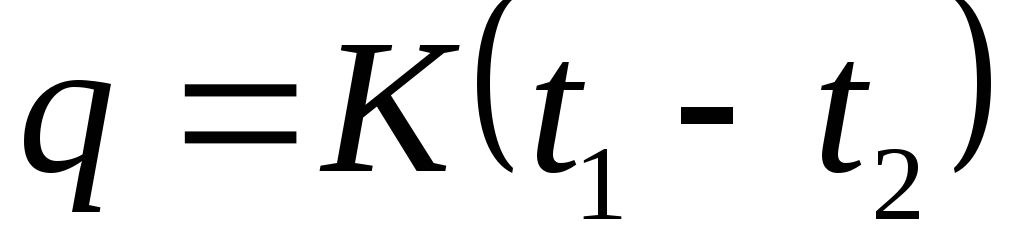Doimiy bosimda qanday gaz jarayoni sodir bo'ladi. Issiqlik quvvati. Ideal gaz bilan termodinamik jarayonlar
Ideal gazlarning asosiy termodinamik xossalari
Termodinamik jarayonlarni o'rganishda holat tenglamasidan foydalaniladi
va termodinamikaning birinchi qonunining matematik ifodasi
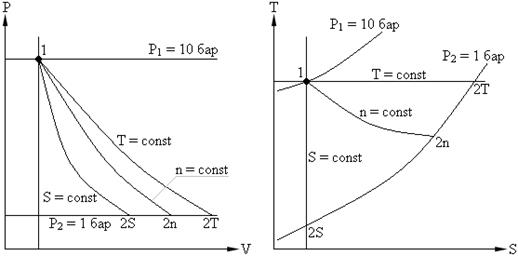
Ideal gazlarning termodinamik jarayonlarini o'rganishda, umumiy holatda, jarayon egri chizig'ining tenglamasini aniqlash kerak. PV , PT , VT diagramma, termodinamik parametrlar orasidagi bog'lanishni o'rnating va quyidagi miqdorlarni aniqlang:
- o'zgartirish ichki energiya ishchi organ
![]()
(formula nafaqat uchun amal qiladi V = const, balki har qanday jarayon uchun)
− tashqi (termodinamik) xos ishni aniqlash
va mavjud maxsus ish
termodinamik jarayonda ishtirok etadigan issiqlik miqdori
Jarayonning issiqlik sig'imi qayerda
- termodinamik jarayonda entalpiyaning o'zgarishi
(formula nafaqat uchun amal qiladi p = const, lekin har qanday jarayonda ham)
- bu jarayonda ichki energiyani o'zgartirishga sarflanadigan issiqlik ulushi:
bu jarayonda foydali ishga aylantirilgan issiqlik ulushi
Umumiy holda, uchta termodinamik parametrning istalgan ikkitasi ( P , V , T) o'zboshimchalik bilan o'zgartirilishi mumkin. Amaliyot uchun quyidagi jarayonlar katta qiziqish uyg'otadi:
Jarayonlar doimiy hajm (V = const) izoxorikdir.
Doimiy bosimda ( P = const) izobarikdir.
Da doimiy harorat (T = const) izotermikdir.
Jarayon dq =0 (ishchi suyuqlikning atrof-muhit bilan issiqlik almashinuvisiz oqishi) adiabatik jarayondir.
Muayyan sharoitlarda barcha asosiy jarayonlarga nisbatan umumlashtiruvchi deb hisoblanishi mumkin bo'lgan politropik jarayon.
Kelajakda biz termodinamikaning 1-qonunini va unga kiritilgan miqdorlarni 1 kg massaga bog'liqligini ko'rib chiqamiz.
Jarayon doimiy hajmda
(izokorik jarayon)
Bunday jarayon ishlaydigan suyuqlik tomonidan amalga oshirilishi mumkin, masalan, uning hajmini o'zgartirmaydigan idishda joylashgan, agar issiqlik manbasidan ishchi suyuqlikka issiqlik etkazib berilsa yoki ish suyuqlikdan sovutgichga issiqlik chiqarilsa.
Izokorik jarayonda V = const va dV =0 . at holat tenglamasidan izoxorik jarayon tenglamasi olinadi V = const .
- Charlz qonuni (*)
Ya'ni, at V = const gaz bosimi mutlaq haroratga proportsionaldir. Issiqlik berilganda bosim kuchayadi va issiqlik chiqarilganda u kamayadi.
Keling, jarayonni tasvirlab beraylik V = const ichida pV , pT va VT diagrammalar.


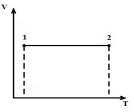
DA p V - izoxora diagrammasi 1-2 - o'qga parallel vertikal to'g'ri chiziq p . 1-2 jarayonda gazga issiqlik beriladi, bosim oshadi va natijada (*) tenglamadan harorat oshadi. Teskari jarayonda 2-1, issiqlik gazdan chiqariladi, buning natijasida gazning ichki energiyasi pasayadi va uning harorati pasayadi, ya'ni. jarayon 1-2 - isitish, 2-1 - gaz sovutish.
DA p T - izoxora diagrammasi - qiyalik bilan boshlang'ichdan chiqadigan to'g'ri chiziqlar (proporsionallik omili)
Bundan tashqari, ovoz balandligi qanchalik baland bo'lsa, izoxora shunchalik past bo'ladi.
VTda - izoxora diagrammasi - T o'qiga parallel to'g'ri chiziqlar.
Gazning izoxorik jarayondagi tashqi ishi:
chunki
Muayyan ish mavjud
![]()
Izoxorik jarayonda gazning ichki energiyasining o'zgarishi, agar
![]()
Ishchi suyuqlikka beriladigan solishtirma issiqlik, da
![]()
dan beri V = const gaz ishlamaydi dl =0 ), u holda termodinamikaning birinchi qonuni tenglamasi quyidagi ko'rinishga ega bo'ladi:
![]()
Ya'ni jarayonda V = const ishchi suyuqlikka berilgan barcha issiqlik ichki energiyani oshirishga, ya'ni gazning haroratini oshirishga sarflanadi. Gaz sovutilganda uning ichki energiyasi chiqarilgan issiqlik miqdori bilan kamayadi.
Ichki energiyani o'zgartirish uchun iste'mol qilinadigan issiqlik nisbati
Ishni bajarish uchun sarflangan issiqlik ulushi
Jarayon doimiy bosim ostida
(izobarik jarayon)
Masalan, silindrdagi bosim doimiy bo‘lib qolishi uchun ishqalanishsiz harakatlanuvchi piston ostidagi silindrda izobar jarayon sodir bo‘lishi mumkin.
Izobarik jarayon bilan p = const , dp =0
Izobar jarayon tenglamasi qachon olinadi p = const holat tenglamasidan:
– Gey-Lyusak qonuni (*)
Jarayonda p = const Gazning hajmi haroratga mutanosib bo'ladi, ya'ni gaz kengayganida harorat va shuning uchun ichki energiya ortadi va siqilganda u kamayadi.
Keling, jarayonni tasvirlab beraylik pV , pT , VT - diagrammalar.
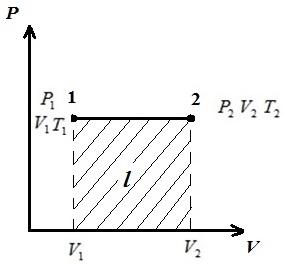
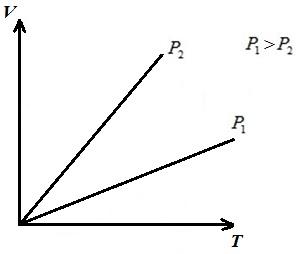

DA pV-da jarayonlar diagrammasi p = const o'qiga parallel to'g'ri chiziqlar sifatida tasvirlangan V . To'rtburchakning maydoni 12 tegishli shkalada gazning ishini beradi l. 1-2 protsessda gazga solishtirma hajm ortishi bilan issiqlik qo'shiladi va demak, (*) tenglamaga ko'ra, harorat ortadi. Teskari jarayonda 2-1, issiqlik gazdan chiqariladi, natijada gazning ichki energiyasi va harorati pasayadi, ya'ni. 1-2 jarayon isitish, 2-1 esa gazni sovutish.
DA VT- izobar diagrammasi koordinatalar boshidan chiqadigan to'g'ri chiziq bo'lib, qiyalik bilan .
DA pT- izobar diagrammasi o'qga parallel bo'lgan to'g'ri chiziqdir T .
Gazning izobarik jarayondagi ishi ( p = const )
![]()
O'shandan beri
Ya'ni, agar gazning harorati oshsa, u holda ish ijobiy bo'ladi.
Mavjud ish
chunki ,.
Gazning ichki energiyasining o'zgarishi, agar
![]()
Gaz qizdirilganda (yoki sovutilganda u tomonidan beriladigan) xabar qilingan issiqlik miqdori, agar
![]()
Ya'ni, izobarik jarayonda ishchi suyuqlikka berilgan issiqlik uning entalpiyasini oshirish uchun ketadi, ya'ni. izobarik jarayonda to'liq differentsial hisoblanadi.
Termodinamikaning birinchi qonuni tenglamasi shaklga ega
![]()
Izobarik jarayonda ichki energiyani o'zgartirish uchun sarflangan issiqlik ulushi,
![]()
qayerda k adiabatik indeks hisoblanadi.
Ishni bajarish uchun sarflangan issiqlik ulushi p = const ,
![]()
MKTda, n erkinlik darajalari soni.
Monatomik gaz uchun n =3 undan keyin ph=0,6, ps=0,4, ya'ni gazga berilgan issiqlikning 40% tashqi ishlarni bajarishga, 60% esa tananing ichki energiyasini o'zgartirishga ketadi.
Ikki atomli gaz uchun n =5 undan keyin ph=0,715, ps=0,285, ya'ni gazga berilgan issiqlikning ≈28,5% tashqi ishlarni bajarishga, 71,5% esa ichki energiyani o'zgartirishga ketadi.
Uch atomli gaz uchun n =6 undan keyin ph=0,75, ps=0,25, ya'ni issiqlikning 25% (bug 'dvigateli) tashqi ishlarni bajarish uchun ketadi.
Jarayon doimiy haroratda
(izotermik jarayon)
Bunday termodinamik jarayon pistonli mashinaning silindrida sodir bo'lishi mumkin, agar ishchi suyuqlikka issiqlik berilsa, mashinaning pistoni harakatlanib, hajmni shunchalik oshirib, ishchi suyuqlikning harorati doimiy bo'lib qolsa.
Da izotermik jarayon T = const , dT =0.
Holat tenglamasidan
- Boyl-Mariot qonuni.
Shuning uchun doimiy haroratdagi jarayonda gaz bosimi hajmga teskari proportsionaldir, ya'ni. Izotermik kengayish bilan bosim pasayadi va siqilish bilan u ortadi.
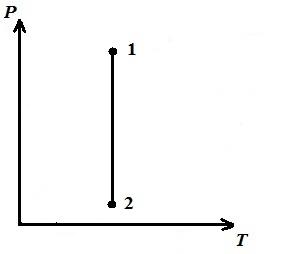
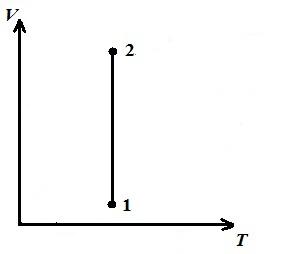
Biz izotermik jarayonni tasvirlaymiz pV , pT , VT − diagrammalar.
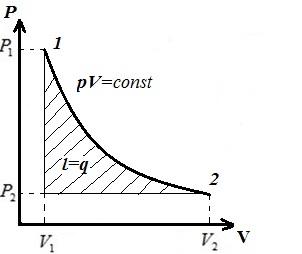
DA pV- diagramma - izotermik jarayon teng tomonli giperbola bilan ifodalanadi va harorat qanchalik yuqori bo'lsa, izoterma shunchalik yuqori bo'ladi.
DA pT − diagramma - izotermlar - to'g'ri, o'qga parallel p .
DA VT − diagramma - to'g'ri chiziqlar, o'qga parallel V .
dT =0, keyin
Ya'ni U = const , i = const - ichki energiya va entalpiya o'zgarmaydi.
Termodinamikaning birinchi qonuni tenglamasi ( T = const)
Ya'ni, izotermik jarayonda gazga berilgan barcha issiqlik kengayish ishiga sarflanadi. Teskari jarayonda, siqilish jarayonida, issiqlik teng gazdan chiqariladi tashqi ish siqilish.
Izotermik jarayondagi o'ziga xos ish
Maxsus bir martalik ish
Oxirgi ikkita tenglamadan kelib chiqadiki, ideal gaz uchun izotermik jarayonda mavjud ish jarayonning ishiga teng.
1-2 jarayonda gazga berilgan issiqlik,
Termodinamikaning 1-qonuni
Bundan kelib chiqadiki, qachon T = const l = l 0= q , bular. ish, mavjud ish va tizim tomonidan qabul qilingan issiqlik miqdori teng.
Chunki izotermik jarayonda dT =0, q = l = ba'zi yakuniy qiymat, keyin dan
![]()
Biz buni izotermik jarayonda olamiz C =∞. Shuning uchun izotermik jarayonda gazga berilgan issiqlik miqdorini aniqlash uchun o'ziga xos issiqlik imkonsiz.
Ichki energiyani o'zgartirish uchun iste'mol qilinadigan issiqlik nisbati T = const
va ishni bajarish uchun sarflangan issiqlik ulushi,
Atrof muhit bilan issiqlik almashinuvisiz jarayon
(adiabatik jarayon)
Adiabatik jarayonda ishchi suyuqlikning atrof-muhit bilan energiya almashinuvi faqat ish shaklida sodir bo'ladi. Ishchi suyuqlikdan issiqlik izolyatsiya qilingan deb taxmin qilinadi muhit, ya'ni. u va atrof-muhit o'rtasida issiqlik almashinuvi yo'q;
q =0, va natijada dq =0
Keyin termodinamikaning birinchi qonuni tenglamasi shaklni oladi
Shunday qilib, adiabatik jarayonda ichki energiya va ishning o'zgarishi kattalik jihatidan ekvivalent va ishorasi bo'yicha qarama-qarshidir.
Shuning uchun, ish adiabatik jarayon kengayish gazning ichki energiyasining pasayishi tufayli yuzaga keladi va natijada gazning harorati pasayadi. Adiyabatik siqilish ishi butunlay ichki energiyani oshirishga ketadi, ya'ni. uning haroratini oshirish uchun.
Ideal gaz uchun adiabatik tenglamani olamiz. Termodinamikaning birinchi qonunidan
da dq =0 olamiz ( du = Rezyume dT )
Issiqlik quvvati , qayerda
Holat tenglamasini differensiallash pV = RT olamiz
O'rnini bosish RdT ushbudan boshlab: ushbugacha (*)
yoki bo'lish pV ,
Integratsiyalash k = const , olamiz
![]()
Oxirgi tenglama Puasson tenglamasi deb ataladi va uchun adiabatik tenglama hisoblanadi.
Bu Puasson tenglamasidan kelib chiqadi
ya'ni adiabatik kengayish vaqtida bosim pasayadi, siqish paytida esa ortadi.
Biz izoxorik jarayonni ifodalaymiz pV , pT va VT - diagrammalar
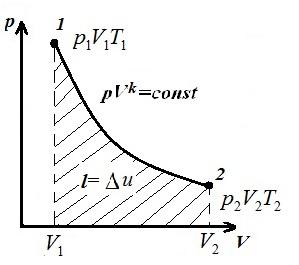
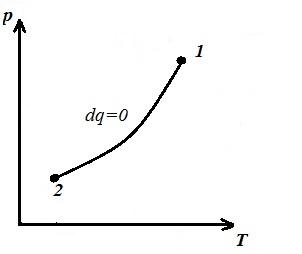
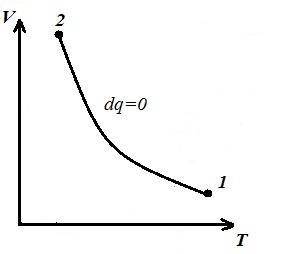
Kvadrat V 1 12 V 2 adiabatik ostida 1-2 bo'yicha pV – diagramma ish beradi l gazning ichki energiyasining o'zgarishiga teng
Adiabatik tenglamani Boyl-Mariot qonuni bilan solishtirish ( T = const ) deb xulosa qilishimiz mumkin, chunki k >1, keyin, adiabat bo'ylab kengayganda, bosim izoterm bo'ylab ko'ra kuchliroq tushadi, ya'ni. ichida pV – adiabatik diagramma izotermadan kattaroqdir, ya'ni. adiabat - koordinata o'qlarini kesib o'tmaydigan, teng bo'lmagan giperbola.
Biz adiabatik tenglamani olamiz pT va VT − diagrammalar. Adiabatik jarayonda barcha uchta parametr o'zgaradi ( p , V , T ).
O'rtasidagi munosabatni olamiz T va V . 1 va 2 nuqtalar uchun holat tenglamalari
buning uchun ikkinchi tenglama birinchisiga bo'linadi
Puasson adiabatik tenglamasidan bosim nisbatini almashtirish
yoki TVk -1= const dagi adiabatik tenglama VT - diagramma.
Adiabatik tenglamadagi hajmlar nisbatini (*) (3) ga almashtirish (Puasson)
yoki − adiabatik tenglama pT - diagramma. Bu tenglamalar, degan faraz ostida olinadi k = const .
da adiabatik jarayonda ishlang Rezyume = const
Harorat o'rtasidagi munosabatni hisobga olgan holda T va V
![]()
orasidagi nisbatni hisobga olgan holda T va p

Ichki energiyaning o'zgarishi u=- l.
Mavjud ish, shuni hisobga olgan holda
![]() ,
,
Bular. mavjud ish k adiabatik jarayonning ishi bir necha barobar ko'p l .
φ va ψ topolmaymiz.
Politropik jarayon
Politropik jarayon - doimiy issiqlik sig'imida sodir bo'ladigan har qanday ixtiyoriy jarayon, ya'ni.
Keyin termodinamikaning 1-qonunining tenglamasi shaklni oladi
![]() (*)
(1)
(*)
(1)
Shunday qilib, agar C = const va Rezyume = const , u holda politropik jarayonda ichki energiya va ish orasidagi issiqlikning miqdoriy taqsimoti doimiy bo'lib qoladi (masalan, 1:2).
Ishchi suyuqlikning ichki energiyasini o'zgartirish uchun sarflangan issiqlik nisbati
![]()
Tashqi ishlarga sarflangan issiqlik ulushi,
![]()
Politropik jarayon tenglamasini olamiz. Buning uchun termodinamikaning 1-qonunining tenglamasidan foydalanamiz (*)
Bu yerdan, (*) va (**) dan
Ikkinchi tenglamani (4) birinchi (3) ga bo'lish
Biz politropik ko'rsatkich deb ataladigan miqdorni kiritamiz. Keyin,
Ushbu ifodani birlashtirib, biz olamiz
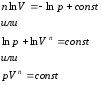
Bu tenglama politropik tenglamadir pV − diagramma. Potlitrop indeksi n muayyan jarayon uchun doimiy bo'lib, -∞ dan +∞ gacha o'zgarishi mumkin.
Holat tenglamasidan foydalanib, politropik tenglamani olishimiz mumkin VT va pT- diagrammalar.
Kimdan ![]() - politropik tenglama VT -
diagramma.
- politropik tenglama VT -
diagramma.
Kimdan ![]()
− politropik tenglama pT - diagramma.
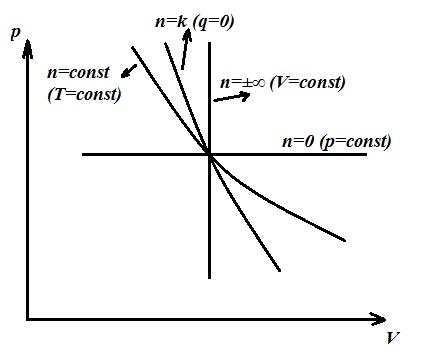
Politropik jarayon umumlashtiruvchi, asosiy jarayonlar (izoxorik, izotermik, adiabatik) politropik jarayonning alohida holatlari bo'lib, ularning har biri o'z qiymatiga ega. n . Shunday qilib, har bir izoxorik jarayon uchun n =±∞, izobarik n =0, izotermik n =1, adiabatik n = k .
Politropik va adiabatik tenglamalar shakl jihatidan bir xil bo'lgani uchun va faqat kattaligi bilan farqlanadi. n(oʻrniga politropik koʻrsatkich k − adiabatik ko'rsatkich), biz yozishimiz mumkin
politropik jarayonning ishlashi
![]()
politropik jarayonning bir martalik ishi
Gazning issiqlik sig'imi , qaerdan
![]()
Bundan tashqari, qarab n jarayonning issiqlik sig'imi musbat, manfiy, nolga teng va -∞ dan +∞ gacha o'zgarishi mumkin.
C jarayonlarida<0 всегда l> q bular. kengaytirish ishini bajarish uchun, berilgan issiqlikdan tashqari, gazning ichki energiyasining bir qismi sarflanadi.
Politropik jarayonning ichki energiyasining o'zgarishi
![]()
Politropik jarayonda gazga beriladigan issiqlik
![]()
Ishchi suyuqlikning entalpiyasini o'zgartirish
![]()
Termodinamikaning ikkinchi qonuni
Termodinamikaning birinchi qonuni energiyani konvertatsiya qilish jarayonlarini miqdoriy nuqtai nazardan tavsiflaydi, ya'ni. u issiqlikni ishga, ishni esa issiqlikka aylantirish mumkinligini, bu o'zgarishlar mumkin bo'lgan sharoitlarni o'rnatmasdan turib, da'vo qiladi. Shunday qilib, u faqat energiyaning turli shakllarining ekvivalentligini o'rnatadi.
Termodinamikaning ikkinchi qonuni jarayonning yo'nalishi va shartlarini belgilaydi
Termodinamikaning birinchi qonuni sifatida ikkinchi qonun eksperimental ma'lumotlardan olingan.
Tajriba shuni ko'rsatadiki, issiqlikni foydali ishga aylantirish faqat issiqlik isitiladigan jismdan sovuqqa o'tganda sodir bo'lishi mumkin, ya'ni. issiqlik qabul qiluvchi va issiqlik qabul qiluvchi o'rtasida harorat farqi mavjud bo'lganda. Issiqlik o'tkazishning tabiiy yo'nalishini faqat ishning narxi (masalan, muzlatgichlarda) hisobiga teskari tomonga o'zgartirish mumkin.
Termodinamikaning 2-qonuniga ko'ra
Issiqlikning sovuq jismlardan qizigan jismlarga o'z-o'zidan o'tishi mumkin bo'lmagan jarayon.
Issiqlik uzatishdan olingan barcha issiqlik ishlay olmaydi, lekin uning faqat bir qismi. Issiqlikning bir qismi issiqlik qabul qiluvchiga o'tishi kerak.
Shunday qilib, kompensatsiyasiz, har qanday manbaning issiqligini to'liq ishga aylantiradigan qurilma yaratish va chaqirdi ikkinchi turdagi abadiy harakat mashinasi, mumkin emas!
Qaytariladigan va qaytarilmas jarayonlar
Har qanday termodinamik tizim uchun ikkita holatni tasavvur qilish mumkin, ular orasida ikkita jarayon sodir bo'ladi (1-rasm): biri birinchi holatdan ikkinchi holatga, ikkinchisi esa aksincha, ikkinchi holatdan birinchi holatga o'tadi.
Birinchi jarayon deyiladi bevosita jarayon, ikkinchisi teskari.
Agar to'g'ridan-to'g'ri jarayon teskari jarayon bo'lsa va termodinamik tizim o'zining dastlabki holatiga qaytsa, u holda bunday jarayonlar deb hisoblanadi. qaytariladigan.
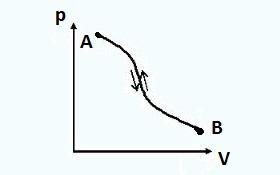
Qaytariladigan jarayonlarda teskari jarayondagi tizim to'g'ridan-to'g'ri jarayondagi kabi muvozanat holatlaridan o'tadi. Bunday holda, na muhitda, na tizimning o'zida hech qanday qoldiq ta'sirlar (parametrlarning o'zgarishi, bajarilgan ishlar va boshqalar) mavjud emas. To'g'ridan-to'g'ri jarayon orqali AB , va keyin teskari BA tizimning yakuniy holati dastlabki holat bilan bir xil bo'ladi.
Rasmda mexanik ravishda qaytariladigan jarayonni o'rnatish ko'rsatilgan. O'rnatish silindr 1, piston 2, stol 3 va qumdan iborat. Piston ostida tsilindrda stol ustidagi qum bosimi ostida bo'lgan gaz mavjud.
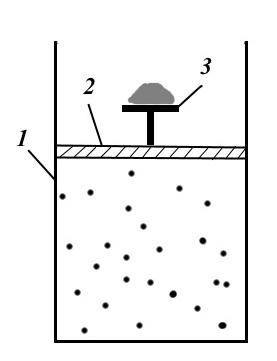
Qaytarilishi mumkin bo'lgan jarayonni yaratish uchun bir-biridan keyin qum donini cheksiz sekin olib tashlash kerak. Shunda jarayon izotermik bo'ladi va bosim tashqi bosimga teng bo'ladi va tizim doimo muvozanat holatida bo'ladi. Agar jarayon teskari yo'nalishda amalga oshirilsa, ya'ni. cheksiz sekin qum donalari 3-jadvalga tashlang, keyin tizim ketma-ket bir xil muvozanat holatlaridan o'tadi va asl holatiga qaytadi (agar ishqalanish bo'lmasa).
Kengaytirilganda, teskari jarayonda ishchi organ maksimal ishni ishlab chiqaradi.
Qisqacha nazariy qism
Moddaning birlik miqdori tomonidan qabul qilingan dq issiqlikning harorat dt o'zgarishiga nisbati solishtirma issiqlik deyiladi.
(1.1)Issiqlik miqdori dq jarayonning tabiatiga bog'liq bo'lganligi sababli, CX sistemaning issiqlik sig'imi ham jarayonning shartlariga bog'liq.
Issiqlik sig'imi, moddaning miqdoriga qarab, massa - C, hajm - C "va molyar µC bo'lishi mumkin. Ularning o'zaro bog'liqligi:
V = const va P = const da ideal moddaning issiqlik sig'imlarining fizik ma'nosi shaklning differentsial termodinamik munosabatlarini ko'rib chiqishdan kelib chiqadi:
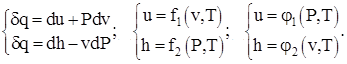 (1.3)
(1.3)
Tegishli o'zgarishlardan so'ng, ideal gazning xususiyatlarini hisobga olgan holda, biz quyidagilarni olamiz:
(1.4)Bu shuni ko'rsatadiki, ichki energiya va entalpiyadagi o'zgarishlar quyidagicha aniqlanadi:
(1.5)bular. jarayonning tabiatidan qat'i nazar.
CP va CV o'rtasidagi munosabatlar:
Gazlarning molekulyar-kinetik nazariyasiga ko'ra, V = Const da molyar issiqlik sig'imi ularning Joul ekvivalentida ifodalangan erkinlik darajalari soniga proportsionaldir va bir mol gaz uchun mkSV = 3 × 4,19 = 12,5 J/ (mol×K). Keyin, Mayer qonuniga muvofiq, µCP = 5 × 4,19 = 20,8 J / (mol × K), bu gazning atomligi va ularning erkinlik darajasiga qarab molyar issiqlik sig'imlarining qiymatlarini ifodalashga imkon beradi. quyidagi shakl:
№ 1.1-jadval.
Berilgan holat parametrlari (P, v, T) uchun (4.1) tenglama bilan aniqlangan issiqlik sig'imi to'g'ri deb ataladi va uni quyidagicha ifodalash mumkin:
CX = CX0 + DCX,(1.7)
Bu erda SX0 gazning zaryadsizlangan holatidagi issiqlik sig'imi (P " 0 da) va faqat haroratga bog'liq, DSX esa issiqlik sig'imining bosim va hajmga bog'liqligini aniqlaydi.
T1 dan T2 gacha bo'lgan harorat oralig'ida o'rtacha issiqlik sig'imi CXm quyidagicha ifodalanadi:
 (1.8)
(1.8)
Agar biz chegaralardan birini qabul qilsak, masalan, T1 = 273,15 K, u holda biz t1 = 0 ° C dan t2 = x ° C gacha bo'lgan harorat oralig'ida gazlarning o'rtacha issiqlik sig'imlarini hisoblashimiz va ularning qiymatlarini jadval shaklida taqdim etishimiz mumkin. shakl, Ilovaga qarang, jadvallar № 2 - № 4.
(4.8) tenglama bo'yicha va issiqlik sig'imi ma'lumotlaridan foydalangan holda tizimga o'tkaziladigan issiqlik miqdori, jarayonga qarab (4.2) ni hisobga olgan holda 2 - 4-sonli jadvallar quyidagi formulalar bilan hisoblanadi:
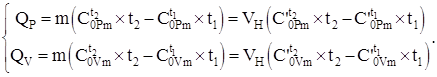 (1.9)
(1.9)
Issiqlik miqdorini taxminiy hisoblash uchun unchalik emas yuqori haroratlar C = Const va keyin (1.2) - (1.4) va 4.1-jadvalning qiymatlarini hisobga olgan holda (1.14) tenglamalarni olishimiz mumkin. quyidagicha ko'rinadi:
 (1.15)
(1.15)
Vazifa raqami 1-1. t1 = 1500 °C haroratda va P = 760 mmHg bosimda V = 15 m3 hajmga ega havo izobar tarzda t2 = 250 ° S haroratgacha sovutiladi. Olingan issiqlik QP ni aniqlang, agar: a) issiqlik sig'imi doimiyligini hisobga olsak, b) mCP = 6,949 + + 0,000576 × t formulasidan foydalansangiz.
Vazifa raqami 1-2. Havo oqimi havo kanaliga o'rnatilgan elektr isitgich yordamida o'lchanadi. Isitgichdan oldin va keyin havo harorati ikkita termometr yordamida o'lchanadi. 0,75 kVt quvvatga ega elektr isitgich yoqilganda, havo harorati T1 \u003d 288 K va T2 \u003d 291,1 K isitgich orqasidagi havo harorati soatlik G kg / soat havo oqimini aniqlang. Isitgichning orqasidagi havo oqimi tezligini ham aniqlang, agar uning bosimi (biz tomonidan o'zgarmagan holda qabul qilingan) P = 870 mmHg va havo kanalining diametri d = 90 mm bo'lsa.
Vazifa raqami 1-3. Sof kislorodli atmosferada uglerodning to'liq yonishi natijasida idishda P = 6,04 bar bosim va T1 = 1673 K haroratda karbonat angidrid CO2 hosil bo'ldi. CO2 soviganida qancha issiqlik ajralib chiqadi. T2 = 293 K haroratga. Shuningdek, idishda bir vaqtning o'zida qanday bosim o'rnatilishini va uning harorati 10 ° C bo'lsa, yonishdan oldin kislorod idishida qanday bosim borligini aniqlang. Idishning hajmi o'zgarmagan holda olinadi va 5 litrga teng.
Vazifa raqami 1-4. Tarkibi t(CO2) = 14,5% bo'lgan gaz aralashmasining 1 Nm3 qismini isitish uchun zarur bo'lgan issiqlik miqdorini toping; t(O2) = 6,5%; t (N2) = 79,0% 200 dan 1200 ° C gacha P = Const va issiqlik sig'imining haroratga chiziqli bo'lmagan bog'liqligi.
Misol. P1 = 3 bar bosimi va t1 = 25 ° S haroratda 6 m3 hajmdagi havo P = Const dan t2 = 130 ° C gacha bo'lgan jarayonda isitiladi. C \u003d Const va C \u003d f (T) ni hisobga olgan holda, berilgan issiqlik miqdorini aniqlang.
QP \u003d m × CP × (t2 - t1) \u003d VH × C "P × (t2 - t1);
QP \u003d m × (CPm × t2 - CPm × t1) \u003d VH × (C "Pm × t2 - C" Pm × t1).
m = (P1 × V1 × µ) / (R × T1) = (3 × 105 × 6 × 2,896 × 10-2) / (8,314 × 298,15) = 21,03 kg.
VN = (R1 × V1 × TN) / (RN × T1) = (3 × 105 × 6 × 273,15) / (101325 Pa × 298,15) = 16,28 nm3.
QP = 21,03 × (29,33 / 2,896 × 10-2) × (130 - 25) = 16,28 × (29,33 / 2,24 × 10-2) × (130 - 25) = 2236, 4 kJ.
QP = 21,03 kg × (1,0079 × 130 - 1,0042 × 25) = 16,28 × (1,3026 × 130 - 1,298 × 25) = 2227,5 kJ.
Tafovut 0,40%.
Vazifa raqami 1-5. Hajmi V = 0,5 m5 bo'lgan yopiq idishda P = 6 bar va T = 800 K da karbonat angidrid mavjud. Agar undan 100 kkal ayirilsa, gaz bosimi qanday o'zgaradi? C = f(T) qaramlikni chiziqli deb qabul qiling.
Vazifa raqami 1-6. Hajmi 90 litr bo'lgan idishda 8 bar bosim va 303 K haroratda havo mavjud. V = Const da bosimini 16 barga oshirish uchun havoga berilishi kerak bo'lgan issiqlik miqdorini aniqlang. C = f(T) bog'liqligini chiziqli bo'lmagan deb qabul qiling. Javobingizni kkalda bering.
Vazifa raqami 1-7. t1 = 100 °C dan t2 = 500 °C gacha bo'lgan doimiy ortiqcha bosim PM = 2 barda 2 m3 havoni isitish uchun qanday issiqlik miqdori sarflanishi kerak? havoda qancha ish bajariladi? Barometrdagi havo bosimi 760 mmHg ga teng qabul qilinadi.
Vazifa raqami 1-8. T1 = 313 K dan T2 = 1023 K gacha bo'lgan izobarik isitishda bir hil gaz l = 184 kJ / kg ishlaydi. Bu qanday gaz ekanligini, unga qancha issiqlik etkazilganligini va bu holda uning bosimi qanday o'zgarganligini aniqlang.
Vazifa raqami 1-9. O'zgarmas bosimda issiqlik ta'minoti jarayonida 0,9 nm3 azotning harorati T1 = 288 K dan T2 = 1873 K gacha ko'tariladi. Azot entalpiyasidagi o'zgarishlarni va ichki energiyani oshirishga sarflangan issiqlik ulushini aniqlang.
Vazifa raqami 1-10. Harakatlanuvchi pistonli silindr T1 = 318 K va P1 = 776 mmHg da VH = 0,3 nm3 miqdorida kislorodni o'z ichiga oladi. P = Const da kislorodga ma'lum miqdorda issiqlik beriladi va keyin u V = Const da dastlabki haroratga (318 K) sovutiladi. Agar izoxorik sovutish oxirida kislorod bosimi P3 = 0,588 bar bo'lishi ma'lum bo'lsa, har ikkala jarayon uchun kiritilgan issiqlik miqdori, entalpiya o'zgarishi, ichki energiya va bajarilgan ishni aniqlang. P-V va T-S koordinatalarida gaz holatlarini chizing.
Ideal gaz bilan termodinamik jarayonlar.
Qisqacha nazariy qism
Termodinamik jarayon deganda transport vositasining atrof-muhit bilan o'zaro ta'siri tushuniladi, buning natijasida transport vositasi ma'lum bir boshlang'ich holatdan ma'lum yakuniy holatga o'tadi.
Agar jarayon davom etayotgan avtomobil dastlabki holatiga qaytarilishi mumkin bo'lsa tashqi muhit hech qanday o'zgarish sodir bo'lmaydi, jarayon teskari deyiladi. Agar tashqi muhitdagi o'zgarishlarsiz avtomobilning dastlabki holati qaytarilmas bo'lsa, u holda jarayon qaytarilmas deb ataladi.
Holat diagrammalarida faqat qaytar jarayonlarni grafik tarzda tasvirlash mumkin, chunki ularda har bir nuqta muvozanat holatini ifodalaydi.
Termodinamikaning birinchi qonuni (formulalar (2.1) - (2.3)) bilan ifodalangan energiyani saqlash printsipi oxir-oqibatda TS energiya zaxirasining (ichki energiya) o'zgarishini energiya bilan bog'laydigan energiya balansiga olib keladi. jarayon ish yoki issiqlik shaklida tugallanganda tizim chegaralarini o'tadi.
Muayyan sharoitlarda barcha jarayonlar uchun umumlashtiriladigan va doimiy issiqlik sig'imi bilan tavsiflangan jarayonlar guruhiga politropik deyiladi.
Barcha jarayonlar uchun umumiy tadqiqot usuli belgilanadi, bu quyidagicha:
jarayonning tenglamasi olinadi;
avtomobil holatining asosiy parametrlari o'rtasidagi munosabatni o'rnatadi;
jarayonning issiqlik sig'imi aniqlanadi;
· Holat funksiyalarining o‘zgarishi aniqlanadi: ichki energiya, entalpiya, entropiya;
jarayon funktsiyalari hisoblab chiqiladi: issiqlik va ish;
· P – V va T – S koordinatalarida termodinamik jarayonlarning grafik talqini berilgan.
Ko'rib chiqilayotgan jarayonlar teskari deb hisoblanadi.
1 - 5 bandlar bo'yicha asosiy nisbatlar 2.1 - 2.3-sonli jadvallarda keltirilgan.
№ 2.1-jadval
№ 2.2-jadval
№ 2.3-jadval
Politropik jarayondagi issiqlik sig'imi:
Quyidagi rasmda P-V va T-S koordinatalarida politropik jarayonlar ko'rsatilgan.

Misol. Hajmi V = 0,01 m3, P1 = 10 bar va T1 = 298 K bo'lgan havo harakatlanuvchi pistonli silindrda P2 = 1 bar bosimgacha kengayadi. Yakuniy hajmni, haroratni, kengayish ishini, issiqlik kiritishini, kengayish sodir bo'lganda ichki energiyaning o'zgarishini, entalpiya va entropiyani aniqlang: 1. izotermik; 2. adiabatik tarzda; 3. politropik indeks n = 1,3 bo'lgan politropik. Jarayonni P - V va T - S koordinatalarida tasvirlang.
Izotermik kengayish.
Kengaytirish oxiridagi hajm:
V2 = V1 × (P1/P2) = 0,01 × (10/1) = 0,1 m3.
Kengaytma ishlari:
L = P1 × V1 × ln (P1/P2) = 106 × 0,01 × ln (10/1) = 23 kJ.
QT = L = 23 kJ.
T1 = T2 = 298 K bo'lgani uchun Dh = 0 va Du = 0 bo'ladi.
Entropiya o'zgarishi:
DS \u003d Q / T \u003d 23/298 \u003d 0,07718 kJ / K.
adiabatik kengayish.
Tsilindrdagi gazning massasi:
m = (P1 × V1 × m) / R × T1 = (106 × 0,01 × 2,896 × 10-2) / (8,314 × 298 K) = 0,117 kg.
Yakuniy hajm:
V2 = V1 × (P1/P2) 1/k = 0,01 × (10/1) 1/1,4 = 0,0518 m3.
Jarayon oxirida havo harorati:
T2 = T1 × (P2/P1) (k - 1) / k = 298 × (1/10) (1,4 - 1) /1,4 = 154,35 K.
Kengayish paytida gazning ishlashi:
L \u003d (P1 × V1 - P2 × V2) / (k - 1) \u003d (106 × 0,01 - 105 × 0,0518) / (1,4 - 1) \u003d 12 kJ.
Entalpiya:
Dh \u003d CP × (T2 - T1) \u003d 1,0189 × (154,35 - 298) \u003d - 146,36 kJ / kg;
DH \u003d m × Dh \u003d 0,117 × (- 146,36) \u003d - 17,12 kJ.
Ichki energiya:
Du \u003d CV × (T2 - T1) \u003d 0,7317 × (154,35 - 298) \u003d - 105,11 kJ / kg;
DU \u003d m × Du \u003d 0,117 × (- 105,11) \u003d - 12,30 kJ.
Jarayondagi haroratning sezilarli o'zgarishi (298 - 154,35 = 146,65 K) tufayli holat funktsiyalarining o'zgarishini aniqlashda biz issiqlik sig'imining C = f (T) haroratiga bog'liqligini qo'llaymiz (qarang: 3-jadval. Ilova).
n = 1,3 bo'lgan politropik kengaytma.
Yakuniy hajm:
V2 = V1 × (P1/P2) 1/n = 0,01 × (10/1) 1/1,3 = 0,0588 m3.
Yakuniy harorat:
T2 = T1 × (V1/V2) n – 1 = 298 × (0,01/0,0588) 1,3 – 1 = 175,15 K.
Kengayish paytida gazning ishlashi:
L \u003d (P1 × V1 - P2 × V2) / (n - 1) \u003d (106 × 0,01 - 105 × 0,0588) / (1,3 - 1) \u003d 13,7 kJ.
Berilgan issiqlik miqdori:
qP = CV × [(n – k) /(n – 1)] × (T2 – T1) = 0,7317 × [(1,3 – 1,4) /(1,3 – 1)] × (175 ,15 – – 298) = 29,96 kJ/kg;
QP = m × qP = 0,117 × 29,96 = 3,51 kJ.
Jarayonning o'zgarishi quyidagicha edi:
Entalpiya:
Dh \u003d CP × (T2 - T1) \u003d 1,0189 × (175,15 - 298) \u003d - 125,17 kJ / kg;
DH = m × Dh = 0,117 × (–125,17) = – 14,64 kJ.
Ichki energiya:
Du \u003d CV × (T2 - T1) \u003d 0,7317 × (175,15 - 298) \u003d - 89,89 kJ / kg;
DU = m × Du = 0,117 × (–89,89) = – 10,52 kJ.
Mustaqil hal qilish uchun vazifalar.
Vazifa raqami 2-1. V = 25 m3 hajmli yopiq xonada P1 = 730 mmHg bosim va T1 = 283 K haroratda havo mavjud. Issiqlik ta'minoti natijasida bosim P2 = 2,3 barga ko'tarildi. Berilgan QV issiqlik miqdori, ichki energiya DU va entalpiya DH o‘zgarishini aniqlang.
Vazifa raqami 2-2.6. kg azot izobarik kengayish jarayonida LP = 343 kJ ishni bajaradi. Azotning ichki energiyasidagi o'zgarishlarni aniqlang, agar boshlang'ich harorati uning T1 = 373 K ga teng.
Vazifa raqami 2-3. Uglerod oksidi PM = 3,92 bar ortiqcha bosim ostida va V = 5 m3 hajmni egallaydi, barometrik bosim esa RB = 755 mmHg ga teng. Agar uglerod oksidi T1 = 573 K dan T2 = 373 K gacha izobar tarzda sovutilsa, ichki energiyaning o'zgarishini va sarflangan ish hajmini aniqlang.
Vazifa raqami 2-4. Agar bosim P = 9,8 bar bo'lsa, 373 K dan 1173 K gacha izobarik isitish vaqtida 20 nm3 kislorodning ichki energiyasi va entalpiyasi qanday o'zgaradi. Gaz qanday ish bajaradi?
Vazifa No 2-5,0,6 nm3 havo izobarik issiqlik ta'minoti bilan ishlaydi LP = 15,68 kJ. T2 harorati va havo hajmini V aniqlang, agar dastlabki holatda uning harorati va bosimi mos ravishda P1 = 4,42 bar va T1 = 293 K bo'lsa.
Vazifa raqami 2-6. T1 = 353 K haroratda kislorod va 320 mmHg ga teng bo'lgan bosim PB T = Constda ortiqcha bosim PM = 12 bargacha siqiladi. Barometrik bosim RB = 745 mmHg bo'lsa, kislorod hajmi necha marta kamayadi?
Vazifa raqami 2-7. 10 kg kislorod T = 423 K = Const da boshlang'ich bosimdan R1 = 14,7 barda kengayadi va ish LT = 2969,4 kJ hosil qiladi. Kengayish oxiridagi bosimni aniqlang va jarayonni P - V va T - S koordinatalarida tasvirlang.
Vazifa raqami 2-8. Harakatlanuvchi pistonli silindr P1 = 1,47 bar bosimida 3,5 m3 azotni o'z ichiga oladi. Izotermik siqish paytida 461 kJ issiqlik chiqariladi. Siqilish oxirida azotning P2 bosimi va V2 hajmini aniqlang.
Vazifa raqami 2-9. T1 = 573 K va P1 = 1,98 barda 0,4 kg havo izotermik ravishda V2 = 1,68 m3 / kg gacha kengayadi, so'ngra izobar tarzda siqiladi va nihoyat, izoxorik isitish orqali yana dastlabki holatiga qaytadi. Har bir jarayon uchun DH, DS, DU, shuningdek issiqlik va ish L ni aniqlang. Shuningdek, barcha nuqtalar uchun parametrlarni (P, v, T) aniqlang va jarayonlarni P - V va T - S koordinatalarida tasvirlang.
Vazifa raqami 2-10. 0,3 Nm3 havo P1 = 7,35 bar, T1 = 573K boshlang'ich holatidan P2, V2 oxirgi holatiga izotermik tarzda siqiladi. Agar izotermik siqish paytida 167,6 kJ issiqlik chiqarilganligi ma'lum bo'lsa, P2 va V2 qiymatlarini aniqlang. Havoning ichki energiyasi va entalpiyasining o'zgarishini ham aniqlang.
Vazifa raqami 2-11. 1. Nm3 havo boshlang'ich holati 1 (P1 = 6 atm, t1 = 300 ° C) dan V2 = 3V3 bo'lgan holatga adiabatik tarzda kengayadi; keyin u o'ziga xos hajmning V3 = V1 boshlang'ich qiymatiga izotermik tarzda siqiladi. 1, 2 va 3 nuqtalarning parametrlarini (P, v, T) va gazning umumiy ishini aniqlang. Jarayonni P - V va T - S koordinatalarida ifodalang.
Vazifa raqami 2-12. 3 kg havoni adiabatik siqish uchun sarflangan ish (- 471) kJ. Havoning dastlabki holati T1 = 288 K va P1 = 1 bar parametrlari bilan tavsiflanadi. Yakuniy haroratni va ichki energiyaning o'zgarishini aniqlang.
Vazifa raqami 2-13. 1. kg havo bosimi P1 = 4 bar va harorat T1 = 373 K P2 = 1 bar bosimiga kengayadi. Agar kengayish sodir bo'lsa, yakuniy haroratni, issiqlik miqdorini va bajarilgan ishni aniqlang: a) izoxorik, b) izotermik, c) adiabatik va d) ko'rsatkich n = 1,2 bo'lgan politropik. Jarayonni P - V va T - S koordinatalarida tasvirlang.
Muammo №2-14. 100 litr hajmli silindr P1 = 50 bar bosim va T1 = 293 K haroratda havoni o'z ichiga oladi. Atrof-muhit bosimi P2 = 1 bar. Izoterm bo'ylab va adiabatik ravishda atrof-muhit bosimiga kengayganida havo bilan bajarilishi mumkin bo'lgan foydali ishni, shuningdek, adiabatik kengayishdan keyin shardagi oxirgi havo haroratini aniqlang.
Vazifa raqami 2-15. T1 = 290 K haroratda 1 kg havo boshlang'ich hajmning 1/5 qismi bo'lgan hajmgacha adiabatik tarzda siqiladi va keyin izotermik ravishda boshlang'ich hajmgacha kengayadi. Har ikkala jarayon natijasida havo bajargan ishni aniqlang. Jarayonni P - V va T - S koordinatalarida tasvirlang.
Muammo №2-16. 1 kilomol gazning politropik kengayishi bilan uning hajmi 20% ga oshdi va mutlaq harorat 12% ga kamaydi. Politropik indeksni aniqlang, ishning qiymati lP kJ/mol, agar T1 = 490 K bo'lsa.
Muammo №2-17. Politropik jarayonda siqish jarayonida 1 kg havoga 50 kJ/kg issiqlik beriladi. Jarayon davomida havo harorati 100 K ga oshsa, politrop ko'rsatkichni, ichki energiyaning o'zgarishini va siqilish ishini aniqlang.
Muammo raqami 2-18. Dastlabki holatda 1 kg azot P1 = 25 bar va T1 = 973 K parametrlariga ega. Politropik kengayishdan keyin (n = 1,18), azot bosimi P2 = 105 N / m2 ga teng bo'ladi. Jarayondagi DU, DN ni, shuningdek issiqlik miqdori qP va lP kengayish ishini aniqlang.
1. Doimiy hajmda sodir bo'ladigan jarayon ___ izoxorik ________ deyiladi.
2. Doimiy bosimda sodir bo'ladigan jarayon ___ izobarik ______ deyiladi.
3. Doimiy haroratda kechadigan jarayon ___ izotermik ___ deyiladi.
4. Tashqi muhit bilan issiqlik almashinuvisiz davom etadigan jarayon _______________adiabatik ___________________________ deyiladi.
5. Tizimning ichki energiyasini o'zgartirish uchun sarflangan issiqlik ulushi doimiy bo'lib qoladigan umumlashtiruvchi termodinamik jarayon _________politrop______________ deyiladi.
6. Jismning haroratini bir kelvin yoki Selsiy gradusiga o‘zgartirish uchun unga yetkazilishi kerak bo‘lgan issiqlik miqdori ____ issiqlik sig‘imi _______ deyiladi.
7. Issiqlik dvigatelining sikli uchun bir siklda bajarilgan ishning issiqlik kiritish miqdoriga nisbati ______ tsikl samaradorligi ______ ga teng.
8. O'zgarmas bosimda qaynash nuqtasiga qadar qizdirilgan 1 kg suyuqlikni quruq to'yingan bug'ga aylantirish uchun zarur bo'lgan issiqlik miqdori ________________ bug'lanish issiqligi ____________ deyiladi.
9. Harorat gradienti ishtirokida uzluksiz muhitda issiqlik uzatishning molekulyar usuli ____________ issiqlik o'tkazuvchanligi ____________________________ deyiladi.
10. Issiqlik o'tkazuvchanligi va konvektsiyaning qo'shma harakati bilan amalga oshiriladigan issiqlik almashinuvi ___________ konvektiv issiqlik uzatish _____________________ deb ataladi.
11. Vaqt birligida har qanday sirt orqali uzatiladigan issiqlik miqdori ____________ issiqlik oqimi __________ deyiladi.
12. U o'tadigan sirtning birlik maydoniga to'g'ri keladigan issiqlik oqimi _____ issiqlik oqimi_zichligi __________________________ deyiladi.
13. Termodinamik tizim holatining parametrlari
15. Atrof-muhit va modda va energiya bilan almashinadigan tizim deyiladi
|
1) ochiq |
3) adiabatik |
|
2) yopiq |
4) yopiq |
16. Atrof-muhit bilan energiya almashadigan, lekin materiyaga ega bo'lmagan tizim deyiladi
18. Ideal gazning ixtiyoriy miqdori uchun holat tenglamasi shaklga ega
Javob variantlarida quyidagi belgilar qabul qilinadi:
p - bosim
v- o'ziga xos hajm
m - gazning massasi
T - termodinamik harorat
t - Selsiy bo'yicha harorat
M - gazning kilomol soni
R- gaz doimiysi
Universal gaz konstantasi
19. O'zaro transformatsiya termomexanik tizimlarda sodir bo'ladi
20. Atrof-muhit bilan issiqlik almashinuvi bo'lmagan jarayon deyiladi
21. Doimiy haroratda sodir bo'ladigan jarayon deyiladi
|
1) izoxorik |
4) adiabatik |
|
2) izobarik |
5) izentropik |
|
3) izotermik |
22. Doimiy hajmda sodir bo'ladigan jarayon deyiladi
24. Gazning solishtirma issiqlik sig'imiga eng katta ta'sir ko'rsatadigan omil
25. Shartli yoqilg'i deyiladi
1) muayyan foydalanish shartlariga eng mos keladigan yoqilg'i
2) o'rtacha sifatli ko'mir
3) 29,31 MJ / kg past kaloriyali yoqilg'i
4) 35,0 MJ/kg kaloriyaliligi past bo'lgan yoqilg'i
26. Rasmlarda o'rnatish sxemalari ko'rsatilgan
1) a) bug' quvvati; b) gaz turbinasi; c) bug 'kompressorli sovutgich
2) a) bug 'kompressorli sovutgich; b) gaz turbinasi; c) bug' quvvati
3) a) absorbsion sovutgich; b) gaz turbinasi; c) bug' quvvati
4) a) gaz turbinasi; b) bug 'kompressorli sovutgich; c) bug' quvvati
27. Issiqlik pompasi
1) issiqlik ta'minoti (isitish) maqsadlarida ishlatiladigan sovutgich mashinasi
2) suyuqlikni quyish uchun ishlatiladigan har qanday dizayndagi nasos
sovutish suvi
3) issiqlikni "issiq" manbadan "sovuq" ga o'tkazish uchun qurilma
4) haroratni bitta issiqlik manbasidan o'tkazish uchun qurilma
28. Issiqlik uzatishda issiqlik oqimining zichligi formula bo'yicha hisoblanadi
|
1)
|
3)
|
|
2)
|
4)
|
Berilgan javob variantlarida quyidagi belgilar qo'llaniladi:
 -issiqlik o'tkazuvchanlik koeffitsienti
-issiqlik o'tkazuvchanlik koeffitsienti
 -issiqlik uzatish koeffitsienti
-issiqlik uzatish koeffitsienti
 - issiqlik uzatish koeffitsienti
- issiqlik uzatish koeffitsienti
 - devor qalinligi
- devor qalinligi
 va
va  – issiqlik tashuvchilarning harorati
– issiqlik tashuvchilarning harorati
 va
va  Bu devor sirtlarining haroratlari
Bu devor sirtlarining haroratlari
|
Javoblarni moslashtiring |
29. Diagrammalarda ko'rsatilgan Otto siklida
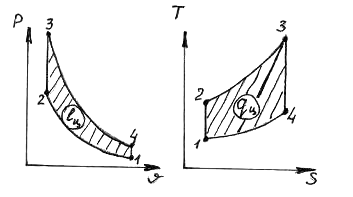
notalash jarayonlari
1) 1-2 A) izoxorik issiqlik ta'minoti
2) 2-3 B) izobarik issiqlik ta'minoti
3) 3-4 V) izoxorik issiqlikni olib tashlash
4) 4-1 D) izobarik issiqlikni olib tashlash
D) izotermik issiqlik ta'minoti
E) izotermik issiqlikni olib tashlash
G) adiabatik kengayish
H) adiabatik siqilish
1.___z___; 2.___a___; 3.__f___; 4.___da___