Entropiya qanday o'zgaradi? Termodinamik entropiya. dumaloq jarayon. Karno sikli
Ko'pgina kimyoviy jarayonlarda bir vaqtning o'zida ikkita hodisa sodir bo'ladi: energiyaning uzatilishi va zarrachalarning bir-biriga nisbatan tartibli joylashuvining o'zgarishi. Barcha zarralar (molekulalar, atomlar, ionlar) tasodifiy harakat qiladi, shuning uchun tizim ko'proq tartiblangan holatdan kamroq tartiblangan holatga o'tishga intiladi. Tizimning buzilishi (tartibsizlik, tartibsizlik) miqdoriy o'lchovidir entropiya S . Misol uchun, agar gaz balloni bo'sh idishga ulangan bo'lsa, u holda silindrdan chiqadigan gaz idishning butun hajmiga taqsimlanadi. Tizim ko'proq tartiblangan holatdan kamroq tartiblangan holatga o'tadi, ya'ni entropiya oshadi (DS > 0).
Fizika tushunchasi fizikadan tashqarida tez-tez qo'llanilishi dargumon - va shuning uchun ko'pincha uning haqiqiy ma'nosidan chetga chiqadi - entropiya sifatida. Kontseptsiya juda tor ma'noga ega. Buning aniq ta'rifi jismoniy miqdor yilning ikkinchi yarmida avstriyalik fizik Lyudvig Boltsman tomonidan qilingan. U suyuqlikning, ya'ni gaz yoki suyuqlikning mikroskopik xatti-harakatlariga e'tibor qaratdi. Atomlar yoki molekulalarning tartibsiz harakati issiqlik sifatida tushunilgan, bu uning ta'rifi uchun hal qiluvchi ahamiyatga ega edi.
DA yopiq tizim Ruxsat etilgan hajm va qat'iy zarrachalar soni bilan, Boltsman ta'kidladi, entropiya tizimdagi mikrobosqichlar sonining logarifmiga proportsionaldir. Mikrostatlarda u suyuqlik ichiga o'ralgan suyuqlikning molekulalarini yoki atomlarini stacking qilishning barcha imkoniyatlarini tushundi. Uning formulasi entropiyani molekulalar va atomlarning "tartibga solish erkinligi" o'lchovi sifatida belgilaydi: agar qabul qilinadigan mikrostatlar soni ko'paysa, entropiya ortadi. Suyuqlik zarralari qanday hosil bo'lishi uchun kamroq imkoniyatlar mavjud, kamroq entropiya.
Tizimning tartibli holatdan kamroq tartiblangan holatga o'tishida entropiya doimo ortadi (DS > 0): moddaning kristallik holatidan suyuqlikka va suyuqlikdan gazsimon holatga o'tishi bilan, ortishi bilan. haroratda, erish va dissotsiatsiya bilan kristalli modda va hokazo.
Tizimning kamroq tartiblangan holatdan ko'proq tartiblangan holatga o'tishida tizimning entropiyasi pasayadi (DS)< 0), например при конденсации, кристаллизации, понижении температуры и т.д.
Boltsman formulasi ko'pincha entropiya "tartibsizlik" ga ekvivalent deb talqin qilinadi. Biroq, bu soddalashtirilgan rasm osongina chalg'itadi. Vanna ko'piki bunga misol bo'la oladi: pufakchalar yorilib, suv yuzasi silliq bo'lganda, xafagarchilik pasayganga o'xshaydi. Ammo entropiya bunday emas! Darhaqiqat, u hatto ortadi, chunki ko'pik yorilishidan keyin suyuqlik molekulalari uchun mumkin bo'lgan joy endi vesikulalarning tashqi membranalari bilan cheklanmaydi, shuning uchun yutilgan mikrostatlar soni ko'paydi.
Entropiya nima
Boltsmanning ta'rifi bizga atamaning bir tomonini tushunishga imkon beradi, lekin entropiyaning yana bir makroskopik jihati ham bor, uni nemis fizigi Rudolf Klauzius bir necha yil oldin kashf etgan. Bug 'dvigatel ixtiro qilindi, klassik issiqlik dvigateli. Issiqlik dvigatellari harorat farqini aylantiradi mexanik ish. Keyin fiziklar ushbu mashinalarni boshqaradigan tamoyillarni tushunishga harakat qilishdi. Tadqiqotchilar issiqlik energiyasining faqat bir necha foizini mexanik energiyaga aylantirish mumkinligini aniqladilar.
Termodinamikada entropiyaning o'zgarishi issiqlik bilan quyidagi ifoda bilan bog'liq:
dS = dQ/T yoki DS=DH / T
Moddalarning entropiyalari, shuningdek ularning hosil bo'lish entalpiyalari standart shartlar deb ataladi. standart entropiya 1 mol belgilangan S 0 298 , bu J / (K mol) da o'lchanadigan mos yozuvlar qiymati (2-ilova).
Masalan, standart entropiya
Qolganlari qandaydir tarzda yo'qoldi - sababini tushunmasdan. Termodinamika nazariyasi, aftidan, energiyaning turli valentliklarini hisobga oladigan va issiqlik energiyasini mexanik energiyaga aylantirish imkoniyatini cheklaydigan fizik tushunchaga ega emas edi. Eritma entropiya shaklini oldi. Klauzius bu atamani termodinamik o'zgaruvchi sifatida kiritdi va uni energiyadan foydalanish imkoniyatini cheklaydigan xususiyatning makroskopik o'lchovi sifatida belgiladi.
Klauziusning fikricha, tizim entropiyasining o'zgarishi berilgan issiqlik va haroratga bog'liq. Issiqlik bilan bir qatorda, entropiya doimo uzatiladi, shuning uchun uning kelib chiqishi. Bundan tashqari, Klauzius yopiq tizimlardagi entropiya, energiyadan farqli o'laroq, saqlanish omili emas degan xulosaga keldi. Bu fizikadagi termodinamikaning ikkinchi yirik momenti edi.
muz……………..S 0 298 = 39,7 J/(K mol);
suv…………….S 0 298 = 70,08 J/(K mol);
suv bug'i ... ..S 0 298 \u003d 188,72 J / (K mol),
bular. entropiya oshadi - moddaning buzilishi darajasi gazsimon holat Ko'proq.
Grafit uchun S 0 298 = 5,74 J / (K mol), olmos uchun S 0 298 = 2,36 J / (K mol), chunki amorf tuzilishga ega moddalar kristalliga qaraganda ko'proq entropiyaga ega.
"Yopiq tizimda entropiya hech qachon kamaymaydi." Shuning uchun entropiya doimo oshadi yoki doimiy bo'lib qoladi. Bu yopiq tsikl fizikasiga vaqt jadvalini kiritadi, chunki termodinamik jarayonlar yopiq tizimlarda ortib borayotgan entropiya bilan qaytarib bo'lmaydi.
Laboratoriya ishi nazariyasi
Agar entropiya doimiy bo'lib qolsa, jarayon teskari bo'lar edi. Ammo bu faqat nazariy jihatdan mumkin. Barcha real jarayonlar qaytarilmasdir. Boltsmanning so'zlariga ko'ra, mumkin bo'lgan mikrostatlar soni har qanday vaqtda ortib borishini ham aytish mumkin. Ushbu mikroskopik talqin Klauziusning termodinamik-makroskopik talqinini kengaytiradi. Nihoyat entropiya issiqlik dvigatellarida energiyaning yo'qolishi sirini hal qildi. Issiqlik energiyasining bir qismi nihoyat mexanik foydalanishdan chiqariladi va yana chiqariladi, chunki yopiq tizimlarda entropiya kamaymasligi kerak.
Entropiya S 0 298, J / (K mol) molekulalarning murakkablashishi bilan o'sadi, masalan:
Kimyoviy reaktsiyalar jarayonida entropiya ham o'zgaradi, shuning uchun gazsimon moddalar molekulalari sonining ko'payishi bilan tizimning entropiyasi oshadi va kamayishi bilan u kamayadi.
Jarayonlar natijasida tizim entropiyasining o'zgarishi tenglama bilan aniqlanadi:
Termodinamika haqida umumiy ma'lumot
Klauzius va Boltsmanning natijalaridan beri entropiya fizikaning boshqa sohalariga ham o'tdi. Hatto fizikadan tashqarida ham ular hech bo'lmaganda matematik tushuncha sifatida hujumga uchragan. Ushbu o'lcham bilan u telefon uzatishda ma'lumotlarning yo'qolishini tavsifladi.
Karno issiqlik dvigatelining ideal sikli
Entropiya kimyo va biologiyada ham rol o'ynaydi: ba'zilarida ochiq tizimlar entropiya chiqarilsa, yangi tuzilmalar paydo bo'lishi mumkin. Bu energiya issiqlik energiyasiga aylanadigan dissipativ tizimlar bo'lishi kerak. Ushbu strukturaviy shakllanish nazariyasi belgiyalik fizik-kimyogari Ilya Prigojindan kelib chiqqan. Bugungi kunga kelib, kontseptsiyaning jismoniy sohasiga yangi jihatlar qo'shilgan asar nashr etildi.
∆S 0 = ∑ ∆S 0 davomi. - ∑ DS 0 ref.
Masalan: reaksiyada
C (grafit) + CO 2 (g) \u003d 2CO (g); DS 0 298 = 87,8 J/K
Tenglamaning chap tomonida 1 mol gazsimon modda CO 2 (g) va o'ngda - 2 mol gazsimon modda 2CO (g), ya'ni tizim hajmi ortadi va entropiya ortadi ( DS > 0).
Entropiyaning oshishi bilan (DS > 0) reaktsiyalar ham sodir bo'ladi:
![]()
Nima uchun issiqlik dvigatellarining samaradorligi cheklangan? Rudolf Klauzius bu topishmoqni entropiya tushunchasini kiritish orqali hal qildi. Fizik izotermik va izentropik sharoitlarda kengayish va qisqarish almashinadigan ideallashtirilgan issiqlik dvigatelining aylana jarayonini ko'rib chiqdi. Termodinamikaning ikkinchi asosiy to'plamida energiyaning saqlanishini o'zaro bog'lash, samaradorlik uchun quyidagi tengsizlik Karno deb ataladigan jarayonga olib keladi.
Shunday qilib, issiqlik dvigatelining maksimal erishish mumkin bo'lgan samaradorligi termodinamik qonunlar bilan cheklangan. Misol uchun, agar mashina 100 dan 200 daraja Selsiyda ishlayotgan bo'lsa, maksimal erishish mumkin bo'lgan samaradorlik taxminan 21 foizni tashkil qiladi. Energiyani tejash va termodinamikaning ikkinchi asosiy to'plamidan ikkita qo'shimcha foydali tushunchani matematik tarzda olish mumkin: ishni bajarayotganda issiqlik faqat sovuqdan issiq tanaga o'tishi mumkin - muzlatgichlar va issiqlik nasoslari quvvat manbaiga muhtoj.
2 H 2 O (g) \u003d 2 H 2 (g) + O 2 (g)
2 H 2 O 2 (g) \u003d 2 H 2 O (g) + O 2 (g)
CaCO 3 (c) \u003d CaO (c) + CO 2 (g), DS 0 298 \u003d 160,48 J / K
Ammiak hosil bo'lish reaktsiyasida
N 2 (g) + 3 H 2 (g) \u003d 2 NH 3 (g); DS 0 298 \u003d - 103,1 J / K
Tizim hajmi kamayadi va shuning uchun entropiya ham kamayadi (DS< 0).
Entropiyaning pasayishi bilan (DS< 0) протекают реакции:
3 H 2 (g) + N 2 (g) \u003d 2 NH 3 (g)
2 H 2 (g) + O 2 (g) \u003d 2 H 2 O (g)
Ikkinchidan, isitiladigan tank bilan hech qanday ish qilish mumkin emas doimiy harorat. Shu maqsadda suv omborlari orasidagi issiqlik oqimi doimo zarur. turli haroratlar. Entropiya atamasi yunoncha so'zlardan Rudolf Klauziusning yangi shakllanishi bo'lib, taxminan "konversiya mazmuni" deb tarjima qilingan.
Formulada aytilishicha, entropiya har doim issiqlik bilan birga o'tkaziladi. Boltsman entropiyasining ta'rifi issiqlikni atomlar yoki molekulalarning tartibsiz harakati sifatida tushunishga asoslanadi. Mikrostatlar bloklangan suyuqlikning molekulalari yoki atomlarini qanday joylashtirish imkoniyatidir. Entropiya - bu juda keng. Termodinamik tizimning har qanday muvozanat holatiga yagona entropiya qiymati berilishi mumkin. DA statistik fizika entropiya - bu tizim erisha oladigan fazalar maydonining o'lchovidir.
O'rtasidagi reaktsiyalarda qattiq moddalar va gazsimon moddalar miqdori o'zgarmaydigan jarayonlarda entropiya amalda o'zgarmaydi va uning o'zgarishi molekulalarning tuzilishi yoki kristall panjaraning tuzilishi bilan belgilanadi, masalan:
C (grafit) + O 2 (g) \u003d CO 2 (g), DS 0 298 \u003d 2,9 J / K
Al (c) + Sb (c) \u003d AlSb (c), DS 0 298 \u003d - 5,01 J / K
№1 misol. Jarayon uchun entropiya o'zgarishini hisoblang va tushuntiring
Klassik termodinamika doirasida entropiya o'lchovidir. Bu entropiya o'zgarishi issiqlik kiritilganda ijobiy, issiqlik chiqarilganda salbiy bo'ladi. Klauzius, shuningdek, tengsizlik bilan izolyatsiya qilingan holatda qaytarilmas jarayonlar orqali issiqlik o'tkazilmagan entropiyani ko'paytirishni tasvirlab berdi.
"Entropiya" atamasining tarixi
![]()
Tenglama termodinamikaning ikkinchi asosiy to'plamining shaklidir. Rasmda ko'rsatilgan adiabatik tizimdagi jarayon bilan, bu erda faqat boshlang'ich holat va yakuniy holat ko'rsatilishi mumkin, bu shunday emas. Biroq, ideal gaz uchun entropiya farqini hisoblash mumkin oddiy tarzda Misollar bo'limida tasvirlanganidek, qaytariladigan izotermik siljish jarayoni orqali. Energiyadan tashqari, entropiya eng muhim tushuncha bo'lib, rivojlanishni yaxshiroq tushunish va takrorlash uchun ushbu fanning boshlang'ich nuqtasiga borish foydalidir.
2SO 2 (g) + O 2 (g) \u003d 2SO 2 (g)
Yechim.
DS 0 \u003d 2 S 0 SO 3 (g) - (2 S 0 SO2 (g) + S 0 O 2 (g)) \u003d 2 256,23 - (2 248,1 + 205,04) \u003d - 188 ,78 J/K .
DS dan beri< 0, энтропия уменьшается вследствии уменьшения объема системы, т.е. уменьшения числа молей газообразных веществ (в левой части 3 моль газообразных веществ, в правой – 2 моль).
№2 misol. Jarayon uchun entropiya o'zgarishini hisoblang va tushuntiring:
Mashina o'z vazifasini bajara oldi, lekin juda ko'p yoqilg'i sarfladi. Bu vaqtda energiya va issiqlik o'rtasidagi bog'liqlik butunlay noaniq edi va Yuliy Mayer uni 130 yildan ko'proq vaqt o'tgach ham nashr etishga majbur bo'ldi. Otasining tegirmondagi ishidan ilhomlanib, Karno bug 'dvigatelini tsiklik jarayonda tasvirlab berdi, bunda issiqlik issiq manbadan sovuq rozetkaga oqadi va shu bilan ish bajaradi.
Karno o'zining asl asarida issiqlik har doim issiqroqdan sovuqroq jismga oqib o'tadigan o'ziga xos moddadir, chunki suv doimo pastga qarab harakat qiladi, degan fikrni bildirgan. Va xuddi tushgan suv kabi, issiqlik hali ham ishlashi mumkin, gradient qanchalik baland bo'lsa, xususan, mashina issiqlik bilan ta'minlanganidan ko'ra ko'proq ish qila olmaydi. Karnot keyinchalik o'zini tuzatdi va Mayer, Joul va Tomsondan o'n yil oldin issiqlik va energiyaning tengligini allaqachon tan olgan edi. Bu orada u o'z vaqtidan oldinda edi, lekin, afsuski, u yosh vafot etdi va uning mehnati bir qarashda e'tiborsiz qoldi.
Yechim. Keling, ilovadan yozamiz. 2 qiymat standart entropiyalar moddalar
Gess qonunining xulosasiga ko'ra,
DS 0 \u003d (2 S 0 CuO (c) + S 0 SO 2 (g)) - (S 0 Cu2S (c) + 2 S 0 O 2 (g)) \u003d (2 42,64 + 248,1) - (119,24) + 205.04) = 9.1 J/K.
Entropiya biroz oshadi, bu O 2 (g) molekulasi bilan solishtirganda SO 2 (g) molekulasi tuzilishining murakkablashishi bilan bog'liq.
№3 misol. Jarayon uchun entropiya o'zgarishini aniqlang:
Faqat Klausius harorat farqi - manba va lavabo - issiqlik almashtirgichning samaradorligi bilan bog'liqligini va bu samaradorlikni boshqa issiqlik dvigatelidan oshirib bo'lmasligini aniqladi, chunki issiqlik sovuqdan issiq tanaga o'z-o'zidan oqib o'tadi. Tabiatda bunday jarayonning mumkin emasligi endi Klauzius deb ataladi, u tomonidan aylanma jarayon bilan tuzilgan.
Hech qanday velosiped mashinasi yo'q, uning yagona ta'siri issiqlikni sovutgichdan issiqroq suv omboriga o'tkazishdir. Oddiy qilib aytganda, asosiy da'vo harorat farqlari tabiatda o'z-o'zidan ko'payishi mumkin emasligini ta'kidlaydi. Klauzius bu bilan taklif talab qilishi mumkin edi.
C (grafit) + O 2 (g) \u003d CO 2 (g)
Yechim: Keling, ilovadan yozamiz. 2 standart entropiya qiymati
DS 0 \u003d S 0 CO2 (g) - (S 0 C (g) + S 0 O2 (g)) \u003d 213,68 - (5,74 + 205,04) \u003d 2,9 J / K.
DS > 0 boʻlgani uchun reaksiya jarayonida entropiya biroz ortadi. Tizim hajmi o'zgarmaydi, lekin O 2 molekulasi bilan solishtirganda CO 2 molekulasining tuzilishi murakkabligi tufayli entropiya ortadi.
Termodinamikaning holat funksiyasi sifatida
Har qanday dumaloq jarayon uchun. Ekvivalentlik belgisi faqat qaytariladigan jarayonlarga tegishli. Ushbu Klauzius teoremasi bilan o'lcham aniq. Klauzius bu miqdorni entropiya deb atadi va vaqt o'tishi bilan asosiy jumlani to'g'ridan-to'g'ri entropiya bilan shakllantirish odatiy holga aylandi, bu esa hech qanday tarzda chuqurroq tushunishga olib kelmaydi. Faqat bir necha o'n yillar o'tgach, uning statistik mexanikasi bilan entropiyaning tushuntirishi tizimning erishish mumkin bo'lgan mikroholatlarining o'lchovi sifatida topilishi mumkin edi. Issiqlik atomlar va molekulalar bo'ylab tasodifiy taqsimlanadi, energiyani taqsimlaydi va issiqdan sovuqqa o'tadi, chunki orqaga qaytish juda dargumon.
Gibbs energiyasi
O'z-o'zidan, ya'ni. tashqaridan energiya sarflamasdan, tizim faqat kamroq barqaror holatdan barqarorroq holatga o'tishi mumkin.
DA kimyoviy jarayonlar bir vaqtning o'zida ikkita omil:
Tizimning eng kam ichki energiyaga ega bo'lgan holatga o'tish tendentsiyasi, bu tizimning entalpiyasini kamaytiradi ( ∆H → min);
Tizimning yanada tartibsiz holatga o'tish tendentsiyasi, bu entropiyani oshiradi ( ∆S → maks).
Tizim energiyasining o'zgarishi deyiladi entalpiya omili , u reaksiyaning issiqlik effekti bo'yicha miqdoriy jihatdan ifodalanadi DH. U bog'lanish va zarrachalarni kattalashtirish tendentsiyasini aks ettiradi.
Tizimdagi entropiyaning ortishi deyiladi entropiya omili , u energiya birliklarida (J) miqdoriy jihatdan ifodalanadi va quyidagicha hisoblanadi T D.S. U zarrachalarning tasodifiy joylashishiga, moddalarning oddiyroq zarrachalarga parchalanishiga moyilligini aks ettiradi.
Bu ikki qarama-qarshi tendentsiyaning doimiy T va P da sodir bo'ladigan jarayonlarga umumiy ta'siri , izobar-izotermik potentsialning o'zgarishi bilan aks ettiriladi yoki erkin energiya Gibbs DG va tenglama bilan ifodalanadi:
∆G = ∆H – T ∆S
Doimiy bosim va haroratda (izobarik-izotermik jarayon) reaktsiyalar o'z-o'zidan Gibbs energiyasini kamaytirish yo'nalishi bo'yicha boradi.
Gibbs energiyasining o'zgarishi tabiatiga ko'ra, jarayonni amalga oshirishning asosiy imkoniyati yoki mumkin emasligi haqida hukm chiqarish mumkin.
Agar a DG< 0 , reaktsiya o'z-o'zidan davom etishi mumkin oldinga yo'nalish. Entalpiya omilining kamayishi va entropiya omilining ortishi qanchalik ko'p bo'lsa, tizimning reaktsiyani davom ettirish tendentsiyasi shunchalik kuchli bo'ladi. Tizimning dastlabki holatidagi Gibbs energiyasi oxirgi holatdagidan kattaroqdir.
Agar Gibbs energiyasi bo'lsa ∆G > 0, reaksiya oldinga yo'nalishda o'z-o'zidan keta olmaydi.
Agar a ∆G=0, sistema kimyoviy muvozanat holatida, entalpiya va entropiya omillari teng. (DH=T DS). Qaysi harorat ∆G = 0, deyiladi reaksiya boshlanishi harorati : T = ∆H/∆S. Bu haroratda ham oldinga, ham teskari reaktsiyalar teng darajada bo'ladi. O'z-o'zidan reaktsiyaning mumkinligi (yoki mumkin emasligi). turli nisbatlar DH va DS qiymatlari jadvalda keltirilgan.
№1 misol.
Cu 2 S (c) + 2 O 2 (g) \u003d 2 CuO (c) + SO 2 (g)
Uning paydo bo'lish ehtimolini belgilang standart shartlar ichida yopiq tizim.
Yechim: Gibbsning erkin energiya o'zgarishi kimyoviy reaksiya standart sharoitlarda (T \u003d 298 K, P \u003d 101325 Pa) DG 0 \u003d DH 0 - T DS 0 tenglamasi bilan hisoblanadi.
Kimyoviy reaksiyaning issiqlik ta'siri DH 0 = - 545,5 kJ (yuqoridagi hisob-kitobga qarang). Kimyoviy reaksiyadagi entropiya o'zgarishi DS 0 = -9,1 J/K (yuqoridagi hisob-kitobga qarang).
DG 0 ni hisoblashda shuni hisobga olish kerakki, DH 0 kJ da, DS 0 esa J / K da ifodalanadi, buning uchun DS 0 ni 10 -3 ga ko'paytirish kerak.
Kimyoviy reaksiyada Gibbs erkin energiya o'zgarishi
DG 0 \u003d DH 0 - T DS 0 \u003d - 545,5 - \u003d -548,21 kJ.
DG 0 dan beri< 0, следовательно, в стандартных условиях самопроизвольное протекание данной химической реакции в прямом направлении возможно.
№2 misol.∆H 0 va ∆S 0 qiymatlariga asoslanib, reaksiyaning ∆G 0 ni hisoblang.
MgCO 3 (c) \u003d MgO (c) + CO 2 (g)
Yopiq tizimda standart sharoitlarda uning oqimining imkoniyatini ko'rsating. Kaltsiy karbonat qaysi haroratda parchalana boshlaydi?
Yechim: Biz 1 va 2-ilovalardan standart etalpiyalarning qiymatlarini yozamiz ∆H0 f, kJ/mol va entropiya S 0, J/(K mol):
Entalpiya va entropiyaning o'zgarishini hisoblang
∆H0= (∆H0 f, MgO(c) + ∆H0 f, CO 2 (g)) - ∆H0 f, MgSO 3 (k) \u003d [-601,24 + (-393,5)] - (-1096,21) \u003d 101,46 kJ;
DS 0 \u003d - S 0 MgSO 3 (k) \u003d - 112,13 \u003d 128,41 J / K.
DG 0 \u003d DH 0 - T DS 0 \u003d 101,46 - 298 128,41 10 -3 \u003d 63,19 kJ.
DG 0 > 0 bo'lganligi sababli, standart sharoitlarda bu reaktsiyaning borishi mumkin emas. DH > 0 va DS > 0 boʻlgani uchun reaksiya yetarlicha yuqori haroratda oʻz-oʻzidan borishi mumkin degan xulosaga kelish mumkin.
Magniy karbonatning parchalanishi boshlanadigan haroratni hisoblang:
T \u003d DH 0 / DS 0 \u003d 101,46 / (128,41 10 -3) \u003d 790,12 K (517,12 0 S).
790,12 K haroratda ham to'g'ri, ham teskari reaktsiyalar bir xil ehtimolga ega. 790,12 K dan yuqori haroratlarda to'g'ridan-to'g'ri reaksiya davom etadi, ya'ni magniy karbonatning parchalanishi sodir bo'ladi.
§6 Entropiya
Odatda, tizimning bir holatdan ikkinchi holatga o‘tishi bilan bog‘liq har qanday jarayon shunday kechadiki, bu jarayonni teskari yo‘nalishda amalga oshirishning iloji yo‘q, shuning uchun tizim bir xil oraliq holatlardan o‘tib, atrofdagi jismlarda hech qanday o‘zgarishsiz o‘tadi. Buning sababi, energiyaning bir qismi jarayonda, masalan, ishqalanish, nurlanish va boshqalar tufayli. Tabiatdagi deyarli barcha jarayonlar qaytarilmasdir. Har qanday jarayonda energiyaning bir qismi yo'qoladi. Energiyaning tarqalishini tavsiflash uchun entropiya tushunchasi kiritiladi. ( Entropiya qiymati xarakterlanadi tizimning termal holati va tananing ushbu holatini amalga oshirish ehtimolini aniqlaydi. Berilgan holat qanchalik ko'p bo'lsa, entropiya shunchalik katta bo'ladi.) Barcha tabiiy jarayonlar entropiyaning ortishi bilan birga keladi. Entropiya faqat yopiq tizimda, ya'ni bu tizimdan tashqaridagi jismlar bilan energiya almashinuvi bo'lmagan tizimda sodir bo'ladigan ideallashtirilgan qaytariladigan jarayondagina doimiy bo'lib qoladi.
Entropiya va uning termodinamik ma'nosi:
Entropiya- bu tizim holatining shunday funktsiyasi bo'lib, uning qaytariladigan jarayonda cheksiz kichik o'zgarishi bu jarayonda kiritilgan cheksiz kichik issiqlik miqdorining u kiritilgan haroratga nisbatiga tengdir.
Yakuniy qaytariladigan jarayonda entropiya o'zgarishini quyidagi formula yordamida hisoblash mumkin:
![]()
bu yerda integral tizimning 1-boshlang'ich holatidan 2- yakuniy holatga qadar olinadi.
Entropiya davlat funktsiyasi bo'lganligi sababli, u holda integralning xossasiuning hisoblanayotgan kontur (yo'l) shaklidan mustaqilligidir, shuning uchun integral faqat tizimning boshlang'ich va oxirgi holatlari bilan belgilanadi.
- Har qanday teskari jarayonda entropiya o'zgarishi 0 ga teng
(1)
- Buni termodinamika isbotlaydiSorqaga qaytarilmas sikl hosil qiluvchi tizim kuchayadi
Δ S> 0 (2)
(1) va (2) iboralar faqat yopiq tizimlar uchun amal qiladi, agar tizim bilan issiqlik almashsa tashqi muhit, keyin uningShar qanday tarzda o'zini tutishi mumkin.
(1) va (2) munosabatlarni Klauzius tengsizligi sifatida ifodalash mumkin
∆S ≥ 0
bular. yopiq tizimning entropiyasi ortishi (qaytarib bo'lmaydigan jarayonlarda) yoki doimiy bo'lib qolishi mumkin (qaytariladigan jarayonlarda).
Agar tizim 1-holatdan 2-holatga muvozanatli o'tishni amalga oshirsa, u holda entropiya o'zgaradi
![]()
qayerda dU va dAmuayyan jarayon uchun yozilgan. Ushbu formulaga ko'ra, DSqo'shimcha konstantagacha aniqlanadi. jismoniy ma'no entropiyaning o'ziga emas, balki entropiyalarning farqiga ega. Ideal gaz jarayonlarida entropiyaning o'zgarishi topilsin.
![]()
bular. entropiya o'zgarishiS Δ S 1→2 Ideal gazning 1-holatdan 2-holatga oʻtishi jarayonida jarayonning turiga bogʻliq emas.
Chunki adiabatik jarayon uchun dQ = 0, keyin ∆ S= 0 => S= const , ya'ni adiabatik teskari jarayon doimiy entropiyada boradi. Shuning uchun u izentropik deyiladi.
Da izotermik jarayon (T= const; T 1 = T 2 : )
![]()
Izokorik jarayonda (V= const; V 1 = V 2 ; )
![]()
Entropiya additivlik xususiyatiga ega: sistemaning entropiyasi tizimga kiritilgan jismlarning entropiyalari yig'indisiga teng.S = S 1 + S 2 + S 3 + ... Molekulalarning issiqlik harakati va boshqa harakat shakllari o'rtasidagi sifat jihatidan farq uning tasodifiyligi, tartibsizligidir. Shuning uchun termal harakatni tavsiflash uchun molekulyar buzilish darajasining miqdoriy o'lchovini kiritish kerak. Agar tananing har qanday ma'lum makroskopik holatini parametrlarning ma'lum o'rtacha qiymatlari bilan ko'rib chiqsak, bu molekulalarning hajmning turli qismlarida va hajmida taqsimlanishida bir-biridan farq qiladigan yaqin mikroholatlarning uzluksiz o'zgarishidan boshqa narsadir. molekulalar o'rtasida taqsimlangan energiya. Ushbu doimiy o'zgaruvchan mikrostatlar soni butun tizimning makroskopik holatining buzilish darajasini tavsiflaydi,wberilgan mikroholatning termodinamik ehtimolligi deyiladi. Termodinamik ehtimollikwtizim holatlari - makroskopik tizimning ma'lum bir holatini amalga oshirish usullari soni yoki ma'lum bir mikroholatni amalga oshiradigan mikroholatlar soni (w≥ 1 va matematik ehtimollik ≤ 1 ).
Biz hodisaning kutilmaganligining o'lchovi sifatida uning ehtimolligining minus belgisi bilan olingan logarifmini olishga kelishib oldik: holatning kutilmaganligi = ga teng.-
Boltsmanning fikricha, entropiyaStizimlar va termodinamik ehtimollik quyidagicha bog'langan:
S=
qayerda - Boltsman doimiysi (![]() ). Shunday qilib, entropiya ma'lum bir mikroholatni amalga oshirish mumkin bo'lgan holatlar sonining logarifmi bilan aniqlanadi. Entropiyani t/d tizimining holati ehtimolining o'lchovi sifatida ko'rish mumkin. Boltsman formulasi entropiyaga quyidagi statistik talqinni berishga imkon beradi. Entropiya - bu tizim buzilishining o'lchovidir. Haqiqatan ham, bundan ko'proq raqam mikroholatlar berilgan mikroholatni amalga oshirsa, entropiya shunchalik ko'p bo'ladi. Tizimning muvozanat holatida - tizimning eng ehtimoliy holati - mikroholatlar soni maksimal, entropiya ham maksimal.
). Shunday qilib, entropiya ma'lum bir mikroholatni amalga oshirish mumkin bo'lgan holatlar sonining logarifmi bilan aniqlanadi. Entropiyani t/d tizimining holati ehtimolining o'lchovi sifatida ko'rish mumkin. Boltsman formulasi entropiyaga quyidagi statistik talqinni berishga imkon beradi. Entropiya - bu tizim buzilishining o'lchovidir. Haqiqatan ham, bundan ko'proq raqam mikroholatlar berilgan mikroholatni amalga oshirsa, entropiya shunchalik ko'p bo'ladi. Tizimning muvozanat holatida - tizimning eng ehtimoliy holati - mikroholatlar soni maksimal, entropiya ham maksimal.
Chunki real jarayonlar qaytarib bo'lmaydigan bo'lsa, u holda yopiq tizimdagi barcha jarayonlar uning entropiyasining oshishiga olib keladi - entropiyani oshirish printsipi. Entropiyani statistik talqin qilishda bu yopiq tizimdagi jarayonlar mikroholatlar sonini ko'paytirish yo'nalishi bo'yicha, boshqacha aytganda, kamroq ehtimolli holatlardan ko'proq ehtimoli bo'lgan holatlarga, holatning ehtimolligi maksimal darajaga yetguncha borishini anglatadi.
§7 Termodinamikaning ikkinchi qonuni
Energiyaning saqlanish va energiyaning o'zgarishi qonunini ifodalovchi termodinamikaning birinchi qonuni t/d jarayonlar oqimining yo'nalishini belgilashga imkon bermaydi. Bundan tashqari, bir-biriga zid bo'lmagan jarayonlar to'plamini tasavvur qilish mumkinIm / d ning boshlanishi, unda energiya saqlanadi, lekin tabiatda ular amalga oshirilmaydi. Ikkinchi boshlanishning mumkin bo'lgan formulalari t/d:
1) qaytarilmas jarayonlarda yopiq tizim entropiyasining ortishi qonuni: yopiq tizimdagi har qanday qaytarilmas jarayon shunday sodir bo'ladiki, tizim entropiyasi D ortadi.S≥ 0 (qaytmas jarayon) 2) DS≥ 0 (SQaytariladigan uchun = 0 va DSQaytarib bo'lmaydigan jarayon uchun ≥ 0)
Yopiq tizimda sodir bo'ladigan jarayonlarda entropiya kamaymaydi.
2) Boltsman formulasidan S =, shuning uchun entropiyaning ortishi tizimning kamroq ehtimolli holatdan ehtimoliyroq holatga o'tishini anglatadi.
3) Kelvinga ko'ra: dumaloq jarayon mumkin emas, uning yagona natijasi isitgichdan olingan issiqlikni unga ekvivalent ishga aylantirishdir.
4) Klauziusning fikriga ko'ra: dumaloq jarayon mumkin emas, uning yagona natijasi issiqlikni kamroq isitiladigan jismdan ko'proq isitiladigan jismga o'tkazishdir.
0 K dagi t/d tizimlarini tavsiflash uchun Nernst-Plank teoremasi (t/d ning uchinchi qonuni) qo'llaniladi: harorat 0 K ga yaqinlashganda muvozanatdagi barcha jismlarning entropiyasi nolga intiladi.
Teoremadan Nernst-Plank bunga ergashadiC p= C v = 0 da 0 Kimga
§8 Issiqlik va sovutish mashinalari.
Karno sikli va uning samaradorligi
Kelvinga ko'ra t / d ikkinchi qonunining formulasidan kelib chiqadiki, ikkinchi turdagi abadiy harakat mashinasi mumkin emas. (Doimiy harakatlanuvchi mashina - vaqti-vaqti bilan ishlaydigan dvigatel bo'lib, u bitta issiqlik manbasini sovutish orqali ishlaydi.)
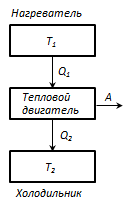 Termostat- bu haroratni o'zgartirmasdan jismlar bilan issiqlik almashinuvi mumkin bo'lgan t / d tizimi.
Termostat- bu haroratni o'zgartirmasdan jismlar bilan issiqlik almashinuvi mumkin bo'lgan t / d tizimi.
Issiqlik dvigatelining ishlash printsipi: haroratli termostatdan T 1 - isitgich, har bir tsiklda issiqlik miqdori olinadiQ 1 , va haroratli termostat T 2 (T 2 < T 1) - muzlatgich, bir tsiklda o'tkaziladigan issiqlik miqdoriQ 2 , ish paytida LEKIN = Q 1 - Q 2
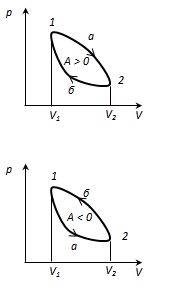 Doiraviy jarayon yoki tsikl sistemaning bir qator holatlardan o'tib, dastlabki holatiga qaytishi jarayonidir. Holat diagrammasida sikl yopiq egri chiziq bilan ifodalanadi. Tsikl amalga oshirildi ideal gaz, kengayish (1-2) va qisqarish (2-1) jarayonlariga bo'linishi mumkin, kengayish ishi ijobiydir LEKIN 1-2 > 0, chunkiV 2
>
V 1
, siqish ishi salbiy LEKIN 1-2 < 0, т.к.
V 2
<
V 1
. Shuning uchun gazning bir tsiklda bajargan ishi yopiq 1-2-1 egri chizig'i bilan qoplangan maydon bilan aniqlanadi. Agar tsiklda ijobiy ish bajarilsa (soat yo'nalishi bo'yicha aylanish), u holda tsikl to'g'ridan-to'g'ri deyiladi, agar u teskari tsikl bo'lsa (tsikl soat miliga teskari yo'nalishda sodir bo'ladi).
Doiraviy jarayon yoki tsikl sistemaning bir qator holatlardan o'tib, dastlabki holatiga qaytishi jarayonidir. Holat diagrammasida sikl yopiq egri chiziq bilan ifodalanadi. Tsikl amalga oshirildi ideal gaz, kengayish (1-2) va qisqarish (2-1) jarayonlariga bo'linishi mumkin, kengayish ishi ijobiydir LEKIN 1-2 > 0, chunkiV 2
>
V 1
, siqish ishi salbiy LEKIN 1-2 < 0, т.к.
V 2
<
V 1
. Shuning uchun gazning bir tsiklda bajargan ishi yopiq 1-2-1 egri chizig'i bilan qoplangan maydon bilan aniqlanadi. Agar tsiklda ijobiy ish bajarilsa (soat yo'nalishi bo'yicha aylanish), u holda tsikl to'g'ridan-to'g'ri deyiladi, agar u teskari tsikl bo'lsa (tsikl soat miliga teskari yo'nalishda sodir bo'ladi).
to'g'ridan-to'g'ri aylanish issiqlik dvigatellarida qo'llaniladi - tashqaridan olingan issiqlik tufayli ishlarni bajaradigan davriy ishlaydigan dvigatellar. Teskari tsikl ishlatiladi sovutish mashinalari- vaqti-vaqti bilan ishlaydigan qurilmalar, ularda ish tufayli tashqi kuchlar issiqlik yuqori haroratli jismga o'tkaziladi.
Dumaloq jarayon natijasida tizim asl holatiga qaytadi va natijada to'liq o'zgaradi. ichki energiya nolga teng. KeyinІ dumaloq jarayon uchun t/d ni boshlang
Q= Δ U+ A= A,
Ya'ni, tsiklda bajarilgan ish tashqaridan olingan issiqlik miqdoriga teng, lekin
Q= Q 1 - Q 2
Q 1 - miqdor tizim tomonidan qabul qilingan issiqlik,
Q 2 - miqdor tizim tomonidan chiqariladigan issiqlik.
Issiqlik samaradorligi dumaloq jarayon uchun tizim bajargan ishning tizimga berilgan issiqlik miqdoriga nisbatiga teng:
![]()
ē = 1 uchun shartQ 2 = 0, ya'ni. issiqlik dvigatelida bitta issiqlik manbai bo'lishi kerakQ 1 , lekin bu t/d ning ikkinchi qonuniga zid keladi.
Issiqlik dvigatelida sodir bo'ladigan teskari jarayon sovutish mashinasida qo'llaniladi.
 Harorat bilan termostatdan T 2 issiqlik miqdori olinadiQ 2
va harorat bilan termostatga uzatiladiT 1
, issiqlik miqdoriQ 1
.
Harorat bilan termostatdan T 2 issiqlik miqdori olinadiQ 2
va harorat bilan termostatga uzatiladiT 1
, issiqlik miqdoriQ 1
.
Q= Q 2 - Q 1 < 0, следовательно A< 0.
Ish qilmasdan, kamroq isitiladigan tanadan issiqlikni olib, uni issiqroqqa berish mumkin emas.
t/d ning ikkinchi qonuniga asoslanib, Karno teoremani chiqardi.
Karno teoremasi: isitish moslamalari harorati bir xil bo'lgan barcha davriy ishlaydigan issiqlik dvigatellari ( T 1) va muzlatgichlar ( T 2), eng yuqori samaradorlik. qaytariladigan mashinalarga ega. K.P.D. teng uchun qaytib mashinalari T 1 va T 2 teng va ishchi suyuqlikning tabiatiga bog'liq emas.
Ishchi jism - dumaloq jarayonni bajaradigan va boshqa jismlar bilan energiya almashinadigan jism.
Karno sikli 2 ta izoterm va 2 ta adiabatdan tashkil topgan eng tejamkor teskari sikldir.
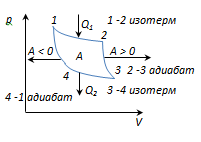 1-2-izotermik kengayish da T 1 isitgich; gazga issiqlik beriladiQ 1
va ish bajariladi
1-2-izotermik kengayish da T 1 isitgich; gazga issiqlik beriladiQ 1
va ish bajariladi![]()
2-3 - adibat. kengaytirish, gaz ishlaydiA 2-3 >0 tashqi jismlar ustida.
3-4 izotermik siqilish da T 2 ta muzlatgich; issiqlik olinadiQ 2
va ish bajariladi![]() ;
;
4-1-adiabatik siqilish, gaz ustida ish bajariladi A 4-1 <0 внешними телами.
Izotermik jarayondaU= const, shuning uchun Q 1 = A 12
![]() 1
1
Adiabatik kengayish bilanQ 2-3 = 0, va gaz ishlaydi A 23 ichki energiya bilan amalga oshiriladi A 23 = - U
![]()
Issiqlik miqdoriQ 2 , izotermik siqilish vaqtida gaz tomonidan sovutgichga berilgan siqilish ishiga teng LEKIN 3-4
![]() 2
2
Adiabatik siqilish ishi
![]()
Aylanma jarayonda bajarilgan ish
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
va 1-2-3-4-1 egri chizig'ining maydoniga teng.
Issiqlik samaradorligi Karno sikli
![]()
2-3 va 3-4 jarayonlar uchun adiabatik tenglamadan olamiz
Keyin ![]()
![]()
bular. samaradorlik Carnot aylanishi faqat isitgich va sovutgichning harorati bilan belgilanadi. Samaradorlikni oshirish uchun farqni oshirish kerak T 1 - T 2 .
******************************************************* ******************************************************






