Barcha elementlar atomining elektron konfiguratsiyasi. Atomning elektron qobiqlari. Bohr atom modellari
Atomdagi elektronning mumkin bo'lgan holatlarini bilish, Klechkovskiy qoidasi, Pauli printsipi va Xund qoidasi atomning elektron konfiguratsiyasini ko'rib chiqish imkonini beradi. Buning uchun elektron formulalar qo'llaniladi.
Elektron formula asosiyni ko'rsatib, atomdagi elektronning holatini bildiradi kvant soni, uning holatini tavsiflovchi va harf - orbital kvant soni. Berilgan holatda qancha elektron borligini ko'rsatadigan raqam elektron bulutining shaklini ko'rsatadigan harfning yuqori qismining o'ng tomoniga yoziladi.
Vodorod atomi uchun (n \u003d 1, l \u003d 0, m \u003d 0) elektron formula quyidagicha bo'ladi: 1s 1. Keyingi geliy elementining ikkala elektroni ham n, l, m ning bir xil qiymatlari bilan tavsiflanadi va faqat spinlarda farqlanadi. Geliy atomining elektron formulasi ls 2 dir. Geliy atomining elektron qobig'i to'liq va juda barqaror. Geliy olijanob gazdir.
2-davr elementlari uchun (n = 2, l = 0 yoki l = 1) birinchi navbatda 2s holati, keyin esa ikkinchi energiya darajasining p-pastki darajasi to'ldiriladi.
Litiy atomining elektron formulasi: ls 2 2s 1. 2s 1 elektron atom yadrosi bilan kamroq bog'langan (6-rasm), shuning uchun lityum atomi uni osonlikcha berishi mumkin (siz esingizda bo'lsa, bu jarayon oksidlanish deb ataladi), Li + ioniga aylanadi.
Guruch. 6.
1s va 2s elektron bulutlarining yadrodan o'tuvchi tekislik bilan kesmalari
Beriliy atomida to'rtinchi elektron ham 2s holatini egallaydi: ls 2 2s 2. Beriliy atomining ikkita tashqi elektroni osongina ajraladi - bu holda Be Be 2+ kationiga oksidlanadi.
Bor atomi 2p holatda elektronga ega: ls 2 2s 2 2p 1 . Keyinchalik, uglerod, azot, kislorod va ftor atomlarida (Xund qoidasiga ko'ra) 2p pastki sathi to'ldiriladi, bu asil gaz neonida tugaydi: ls 2 2s 2 2p 6 .
Agar ma'lum bir pastki darajadagi elektronlar kvant hujayralarini birma-bir egallashini ta'kidlamoqchi bo'lsak, elektron formulada pastki sathning belgilanishi indeks bilan birga keladi. Masalan, uglerod atomining elektron formulasi
![]()
3-davr elementlari uchun 3s-holat (n = 3, l = 0) va 3p-pastki daraja (n = 3, l - 1) mos ravishda to'ldiriladi. 3d-kichik daraja (n = 3, l = 2) erkin qoladi:
Ba'zan elektronlarning atomlarda taqsimlanishini tasvirlaydigan diagrammalarda faqat har bir energiya darajasidagi elektronlar soni ko'rsatiladi, ya'ni ular atomlarning qisqartirilgan elektron formulalarini yozadilar. kimyoviy elementlar, yuqoridagi to'liq elektron formulalardan farqli o'laroq, masalan:
Katta davrlar elementlari (4 va 5) uchun Klechkovskiy qoidasiga muvofiq tashqi elektron qatlamning dastlabki ikkita elektroni 4s (n = 4, l = 0) va 5s holatlarini (n = 5, l = 0) egallaydi. ) mos ravishda. 0):
Har bir katta davrning uchinchi elementidan boshlab, keyingi o'nta elektron mos ravishda oldingi 3d va 4d pastki darajalariga kiradi (yon kichik guruhlarning elementlari uchun):
Qoidaga ko'ra, oldingi d-kichik daraja to'ldirilganda, tashqi (mos ravishda 4p- va 5p) p-kichik daraja to'ldirila boshlaydi:
Katta davrlarning elementlari uchun - 6 va to'liq bo'lmagan 7 - energiya darajalari va pastki darajalar elektronlar bilan, qoida tariqasida, quyidagicha to'ldiriladi: birinchi ikkita elektron tashqi s-kichik darajaga kiradi, masalan:
keyingi elektron (La va Ac uchun) - oldingi d-kichik darajaga:
Keyin keyingi 14 ta elektron uchinchi energiya darajasiga tashqaridan lantanidlar va aktinidlar uchun mos ravishda 4f va 5f pastki darajalariga kiradi:
Keyin ikkinchi tashqi energiya darajasi (d-pastki daraja) yon kichik guruhlarning elementlari uchun yana qurila boshlaydi:
Faqat d-kichik daraja o'nta elektron bilan to'liq to'ldirilgandan so'ng, tashqi p-kichik daraja yana to'ldiriladi:
Xulosa qilib aytganda, biz yana bir bor D.I.Mendeleyev jadvalining davrlari bo'yicha elementlar atomlarining elektron konfiguratsiyasini ko'rsatishning turli usullarini ko'rib chiqamiz.
1-davrning elementlari - vodorod va geliyni ko'rib chiqing.

Atomlarning elektron formulalari energiya darajalari va pastki darajalar bo'yicha elektronlarning taqsimlanishini ko'rsatadi.
Atomlarning grafik elektron formulalari elektronlarning faqat darajalar va pastki darajalar bo'yicha emas, balki taqsimlanishini ham ko'rsatadi kvant hujayralari (atom orbitallari).

Geliy atomida birinchi elektron qatlam tugallanadi - unda 2 ta elektron mavjud.
Vodorod va geliy s-elementlar bo'lib, bu atomlarning ls-pastki darajasi elektronlar bilan to'ldirilgan.
2-davrning barcha elementlari uchun birinchi elektron qatlam to'ldiriladi va elektronlar eng kam energiya printsipiga (birinchi S-, keyin esa p) va Pauli va Hund qoidalariga muvofiq 2s- va 2p-holatlarini to'ldiradi. 2-jadval).
Neon atomida ikkinchi elektron qatlam tugallangan - unda 8 ta elektron mavjud.
jadval 2
2-davr elementlari atomlarining elektron qobiqlarining tuzilishi

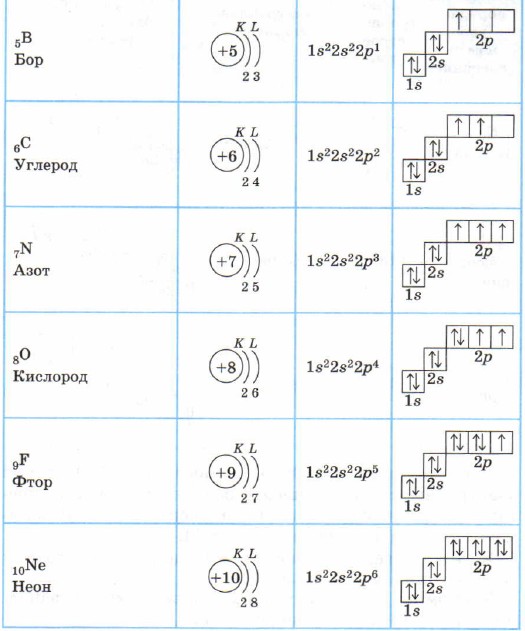
Litiy Li, berilliy Be - s-elementlar.
Bor B, uglerod C, azot N, kislorod O, ftor F, neon Ne p-elementlar bo'lib, bu atomlarning p-pastki sathi elektronlar bilan to'ldirilgan.
3-davr elementlarining atomlari uchun birinchi va ikkinchi elektron qatlamlar tugallanadi, shuning uchun uchinchi elektron qatlam to'ldiriladi, bunda elektronlar 3s, 3p va 3d holatlarini egallashi mumkin (3-jadval).
3-jadval
3-davr elementlari atomlarining elektron qavatlarining tuzilishi
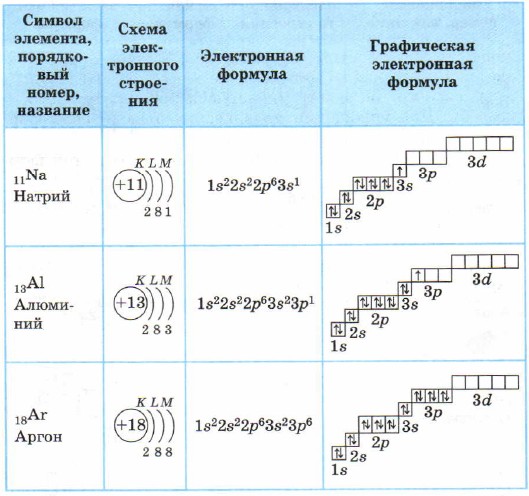
Magniy atomida 3s pastki darajasi tugallanadi. Natriy Na va magniy Mg s-elementlardir.
Alyuminiy va undan keyingi elementlar uchun 3p pastki darajasi elektronlar bilan to'ldiriladi.
Argon atomidagi tashqi qatlamda (uchinchi elektron qatlam) 8 ta elektron mavjud. Tashqi qatlam sifatida u to'liq, lekin jami uchinchi elektron qatlamda, siz allaqachon bilganingizdek, 18 ta elektron bo'lishi mumkin, ya'ni 3-davr elementlari bo'sh 3d holatiga ega.
Alyuminiy Al dan argon Argacha bo'lgan barcha elementlar p-elementlardir.
s- va p-elementlar Davriy tizimda asosiy kichik guruhlarni tashkil qiladi.
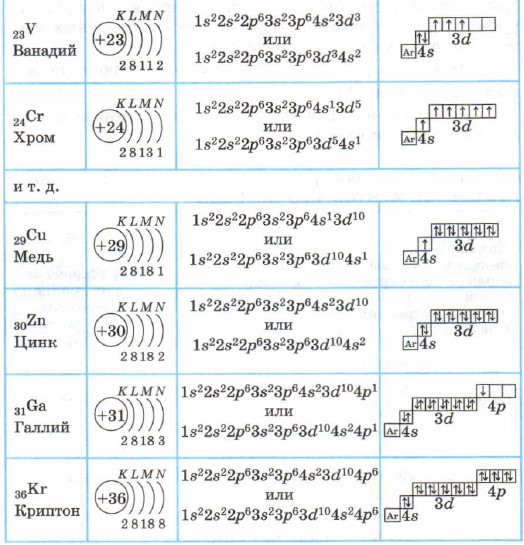
4-davr elementlarining atomlari - kaliy va kaltsiy - to'rtinchi energiya darajasiga ega, 48-kichik daraja to'ldirilgan (4-jadval), chunki Klechkovskiy qoidasiga ko'ra, u 3d-pastki darajaga qaraganda kamroq energiyaga ega.
4-jadval
4-davr elementlari atomlarining elektron qobiqlarining tuzilishi
![]()
4-davr elementlari atomlarining grafik elektron formulalarini soddalashtirish uchun:
Kaliy K va kaltsiy Ca asosiy kichik guruhlarga kiritilgan s-elementlardir. Skandiy Sc dan sink Zn gacha bo'lgan atomlarda 3d pastki sath elektronlar bilan to'ldiriladi. Bu 3D elementlar. Ular ikkilamchi kichik guruhlarga kiradi, ularning oldingi tashqi elektron qatlami to'ldiriladi, ular o'tish elementlari deb ataladi.
Xrom va mis atomlarining elektron qobiqlarining tuzilishiga e'tibor bering. Ularda bitta elektronning 4s-dan 3d-kichik darajaga qadar "muvaffaqiyatsizligi" yuzaga keladi, bu 3d 5 va 3d 10 elektron konfiguratsiyalarining katta energiya barqarorligi bilan izohlanadi:
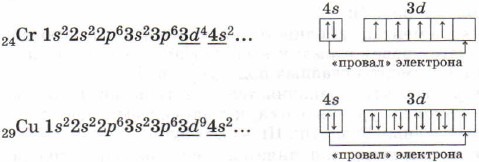
Rux atomida uchinchi energiya darajasi tugallangan, unda barcha pastki darajalar to'ldirilgan - 3s, 3p va 3d, jami 18 ta elektron mavjud.
Sinkdan keyingi elementlarda to'rtinchi energiya darajasi, 4p pastki darajasi to'ldirishda davom etadi.
Galliy Ga dan kripton Kr gacha bo'lgan elementlar p-elementlardir.
Kripton atomining tashqi qatlami (to'rtinchi) Kr to'liq va 8 ta elektronga ega. Ammo to'rtinchi elektron qatlamda, siz bilganingizdek, 32 ta elektron bo'lishi mumkin; kripton atomining 4d va 4f holatlari hali ham band bo'lmagan.
5-davr elementlari uchun, Klechkovskiy qoidasiga muvofiq, pastki darajalar quyidagi tartibda to'ldiriladi: 5s ⇒ 4d ⇒ 5p. Shuningdek, 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag elektronlarning "muvaffaqiyatsizligi" bilan bog'liq istisnolar mavjud.
6 va 7-davrlarda f-elementlar paydo bo'ladi, ya'ni tashqi uchinchi energiya darajasining 4f- va 5f-kichik darajalari mos ravishda to'ldiriladigan elementlar.
4f elementlari lantanidlar deb ataladi.
5f-elementlar aktinidlar deyiladi.
6-davr elementlarining atomlarida elektron pastki sathlarni to'ldirish tartibi: 55 Cs va 56 Ba - bs-elementlar; 57 La ...6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - 4f elementlari; 72 Hf - 80 Hg - 5d elementlar; 81 Tl - 86 Rn - br elementlar. Ammo bu erda ham energiyaning pastki darajalarini to'ldirish tartibi "buzilgan" elementlar mavjud, bu, masalan, yarim va to'liq to'ldirilgan f-kichik darajalarning ko'proq energiya barqarorligi bilan bog'liq, ya'ni nf 7 va nf 14 .
Atomning qaysi pastki darajasi oxirgi elektronlar bilan to'ldirilganligiga qarab, siz allaqachon tushunganingizdek, barcha elementlar to'rtga bo'linadi. elektron oila yoki blok (7-rasm):

Guruch. 7.
Davriy tizimning (jadvalning) elementlar bloklariga bo'linishi
- s-elementlar; atomning tashqi sathining s-kichik darajasi elektronlar bilan to'ldirilgan; s-elementlarga vodorod, geliy va I va II guruhlarning asosiy kichik guruhlari elementlari kiradi;
- p-elementlar; atomning tashqi sathining p-pastki darajasi elektronlar bilan to'ldirilgan; p-elementlar III-VIII guruhlarning asosiy kichik guruhlari elementlarini o'z ichiga oladi;
- d-elementlar; atomning tashqi oldingi sathining d-pastki darajasi elektronlar bilan to'ldirilgan; d-elementlarga I-VIII guruhlarning ikkilamchi kichik guruhlari elementlari, ya'ni s- va p-elementlar orasida joylashgan katta davrlarning interkalyar o'n yilliklari elementlari kiradi. Ular, shuningdek, o'tish elementlari deb ataladi;
- f-elementlar; atomning uchinchi tashqi sathining f-kichik darajasi elektronlar bilan to'ldirilgan; bularga lantanidlar va aktinidlar kiradi.
3-§ bo'yicha savollar va topshiriqlar
- Quyidagi kimyoviy elementlar atomlarining elektron struktura diagrammalarini, elektron formulalarini va grafik elektron formulalarini tuzing:
- a) kaltsiy;
b) temir;
c) sirkoniy;
d) niobiy;
e) gafniy;
e) oltin. - №110 elementning elektron formulasini mos gaz belgisidan foydalanib yozing.
- Elektronning "pastkiligi" nima? Ushbu hodisa kuzatiladigan elementlarga misollar keltiring, ularning elektron formulalarini yozing.
- Kimyoviy elementning muayyan elektron oilaga tegishliligi qanday aniqlanadi?
- Oltingugurt atomining elektron va grafik elektron formulalarini solishtiring. Nima Qo'shimcha ma'lumot oxirgi formulani o'z ichiga oladi?
Ushbu darsda siz atomning elektron qobiqlari, Borning atom modellari nima ekanligini bilib olasiz. Siz tuzilmani takrorlaysiz atom yadrosi, keyin atomning elektron qobiqlarini o'rganishda zamonaviy qarashlarni ko'rib chiqishga o'ting, elektron darajalar va pastki darajalarning shartli tasvirlari. Borning atom modellarini ham ko'rib chiqasiz.
Mavzu: D. I. Mendeleyevning davriy qonuni va kimyoviy elementlarning davriy tizimi
Dars: Atomning elektron qobiqlari. Bohr atom modellari
1. N. Borning postulatlari
Atom yadrosi protonlar - musbat zaryadlangan zarralar va neytronlar - zaryadga ega bo'lmagan zarralardan iborat. Ushbu darsda biz atomning elektron qobig'ining tuzilishini ko'rib chiqamiz.
Guruch. 1. Atomning sayyoraviy modeli
1913 yilda daniyalik fizigi Nils Bor atom tuzilishi bo'yicha tuzilishiga o'xshashligini aytdi. quyosh sistemasi. Atomning ichida, shuningdek, quyosh tizimining ichida, quyosh massiv yadro bo'lib, unda atomning butun massasi to'plangan. Va bu yadro atrofida, xuddi quyosh atrofidagi sayyoralar kabi, elektronlar aylanadi. 1-rasm. Elektronning massasi proton yoki neytrondan 1832 marta kichikdir. Nils Borning modeli uning ustozi Ernest Ruterfordning modeliga asoslangan edi.
Nils Bor atomdagi elektronlar tasodifiy emas, balki ma'lum orbitalarda harakatlanishini taklif qildi. U ikkita mulohaza qo'ygan, ya'ni isbotsiz qabul qilingan.
Nils Borning postulatlari.
1. Atomda orbitalar mavjud bo'lib, ularda elektron energiya chiqarmaydi. Bu orbitalar statsionar deyiladi.
2. Elektron bir turg‘un orbitadan ikkinchisiga o‘tgandagina nurlanish sodir bo‘ladi.
2. Atomning elektron qavatining tuzilishi
Ga ko'ra kvant nazariyasi atom tuzilishi, atomdagi barcha elektronlar energiya darajalari yoki orbitalar bo'ylab harakatlanadi. Bu darajalar quyi darajalardan iborat. O'z navbatida, pastki darajalar atom orbitallaridan iborat. Agar atomning elektron qobig'i yadro ustida joylashgan uy deb hisoblasak, bunday tuzilmani tasavvur qilish oson. Uy ko'p qavatlardan iborat - darajalar. Har bir darajadagi pastki darajalar mavjud - bu kvartiralar. Kvartiralarda atom orbitallari, ya'ni xonalar mavjud. Biz elektronning orbitallardagi o'ziga xos joylashishini emas, balki uning atom orbitallarida bo'lish ehtimolini aniqlashimiz mumkin.
Darajalar.
Bor modelidagi elektron orbitalar butun sonlar bilan belgilanadi: 1, 2, 3, 4, ... va hokazo n gacha yoki lotin harflari bilan alifbo tartibida K, L, M, N, O P, Q harflari bilan boshlanadi. Yadroga eng yaqin darajadan boshlab. Keyinchalik bunday orbitalarni - darajalar deb ataymiz.
Pastki darajalar.
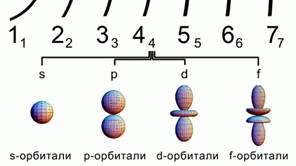
Guruch. 2. Atom orbitallarining shakllari
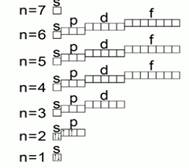
Darajalar o'z navbatida pastki darajalardan iborat. Har bir darajadagi pastki darajalar soni daraja soniga teng. Pastki darajalarning nomlari bor.
Har bir darajadagi 1-chi daraja S deb nomlanadi,
Har bir darajadagi 2-chi daraja P deb ataladi,
Har bir darajadagi 3-chi daraja d deyiladi,
Har bir darajaning 4-chi pastki darajasi f deyiladi
Orbitallar turli shakllarda bo'ladi.
s - sharsimon orbital, p-orbital sakkiz hajmli shaklga ega. d va f orbitallari bundan ham ko'p murakkab shakl. 2-rasm.
Bu raqamlarning barchasi hududni belgilaydi katta ehtimol bilan atomdagi elektronlarni topish.
Atomning to'lqin modeli bunday emas jismoniy model, va tez orada mavhum yoki matematik model atomning tuzilishi, undagi elektronlarning joylashishi.
S - elementlar.
Bular tashqi sathda faqat s-elektronlarni o'z ichiga olgan elementlardir.
Agar bular p - elektronlar bo'lsa, unda bu p - element.
Energiya darajasi yadrodan qanchalik uzoqda joylashgan bo'lsa, u shunchalik ko'p elektronlarni sig'dira oladi, chunki har bir keyingi energiya darajasida ko'proq pastki darajalar mavjud. Shunday qilib, har bir N daraja n2 pastki darajaga ega bo'lishi mumkin. Shuning uchun elektronlar 2n2 ni sig'dira oladi. Nima uchun biz n2 ni 2 ga ko'paytirdik? Chunki har bir atom orbitalida 2 tadan ortiq elektron bo'lishi mumkin emas.
Har bir darajadagi elektronlarning eng ko'p soni 1-jadvalda keltirilgan.
Guruch. 3. Orbital diagrammasi
Elektronlarni atom darajalarida, pastki sathlarda va orbitallarda joylashtirishni o'rganish uchun bizga bu ma'lumotlarning barchasi kerak.
3. Kvant diagrammasi
Elektron darajalar va pastki darajalarning shartli tasviri mavjud. Bu orbital yoki kvant diagrammasi. Bunday diagrammada orbitallar shartli ravishda kvadrat shaklida, elektronlar esa strelkalar shaklida tasvirlangan. Guruch. 3. Agar bitta katakda ikkita o'q bo'lsa, u holda ular turli yo'nalishlarga qaratilgan o'qlar bilan ko'rsatiladi. Elektronlarning bu xossasi spin deyiladi.
Barcha atom orbitallarini elektronlar bilan to'ldirganingizdan so'ng, elementning "elektron pasportini" yoki uning elektron formulasini yozishingiz kerak. Buning uchun siz har bir energiya darajasini 1, 2, 3, ... raqamlari bilan, pastki darajani s, p, d harflari bilan belgilashingiz kerak ...
Quvvat sifatida ma'lum bir pastki darajadagi elektronlar sonini oling.
4. Azot atomining elektron tuzilishi
№1 misol.

Guruch. 4. Azotning elektron formulasi
Atom raqami 7 bo'lgan kimyoviy elementning elektron formulasini yozing.
Bunday elementning atomida 7 ta elektron bo'lishi kerak. Pastki 1 lardan boshlab orbitallarni elektronlar bilan to'ldiramiz.
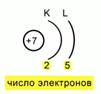
Guruch. 5. Atomdagi elektronlarning joylashishi diagrammasi
Quyidagi elektron konfiguratsiya olinadi: 1s22s22p3.4-rasm.
Shundan so'ng, siz energiya darajasi bo'yicha elektronlarning joylashishini tuzatishingiz kerak. Buning uchun siz yadroni sxematik tarzda tasvirlashingiz, uning zaryadini ko'rsatishingiz va raqamni aniqlashingiz kerak energiya darajalari. Eslatib o'taman, azotda ulardan faqat 2 tasi bor.2 ta yoy chizamiz va shu yoylar ostiga ularda joylashgan elektronlar sonini yozamiz. Keyin biz atomda elektron tartibga solishning shunday sxemasini olamiz. 5-rasm.
5. Argon atomining elektron tuzilishi
№2 misol.
Atom raqami 18 bo'lgan kimyoviy elementning elektron formulasini yozing.
Birinchi holatda bo'lgani kabi, biz elektronlarni atom orbitallarida joylashtiramiz. 1s22s22p63s23p6. Bu argon elementi. 6-rasm. Yunon tilidan "harakatsiz" deb tarjima qilingan. U bu nomni oldi, chunki u hech qanday kimyoviy element bilan o'zaro ta'sir qilmaydi.
Tugallangan tashqi elektron qavatli elementlar.
Asil yoki inert gazlar kichik guruhiga kiritilgan. Ularning inertligi atom tuzilishi bilan bog'liq. Bu gazlar to'liq tashqi energiya qobig'iga ega - ns2np6. Inert gazlar monotomik molekula hosil qiladi. Tabiatdagi barcha boshqa gazlar faqat ikki atomli molekulaga ega. Masalan, O2, H2.Toʻldirilgan elektron qobiqli kimyoviy elementlarning barqarorligi sababi hali aniq emas. Ammo kimyogarlar buni oddiygina tabiat qonuni sifatida qabul qilishadi. Boshqa barcha elementlar tashqi qobig'ini to'ldirishga moyil bo'ladi.
6. Elektron orbitallarni belgilash etimologiyasi
Nima uchun ma'lum darajalarning pastki darajalari ma'lum harflar bilan nomlanganligini bilish qiziq. Ingliz alifbosi. Har bir atom energiya chiqaradi. Bu energiya atomlarning emissiya spektrlarida aniqlanishi mumkin. Atomlarning turli emissiya spektrlari mavjud turli xil. Ularning chiziqlari boshqacha. Shunday qilib, eng tor o'tkir chiziqlar s harfi deb ataldi. Kimdan Inglizcha so'z"to'p".
s - pastki daraja "o'tkir" chiziq nomi bilan ataladi
p - pastki daraja "asosiy" qator nomi bilan ataladi
d - pastki daraja "diffuz", "loyqa" (diffuz) chiziq nomi bilan ataladi
f - pastki daraja "fundamental" chiziq nomi bilan ataladi
7. Inert gazlar haqida ba'zi ma'lumotlar


Kimyoviy inertligi tufayli asil gazlar uzoq vaqt davomida kimyoda ma'lum emas edi. Faqat 1892 yilda birinchi inert gaz argoni olingan. Uni D. Rayleigh qabul qildi. U buni azot bilan tajribalar paytida oldi. D.Reylining ta'kidlashicha, agar azot havodan olinadigan bo'lsa, u holda bu azot gazi turli xil kimyoviy tajribalarda azot olingandan ko'ra kattaroq massaga ega bo'ladi. Agar havodan 1 litr azot olinsa, u holda uning massasi 1,2572 g, azotli birikmalarning parchalanishidan olingan bo`lsa, massasi 1,2505 g bo`ladi.Bunday farq qayerdan kelib chiqadi? Ko'pgina olimlar shunchaki tajriba o'tkazdilar deb o'ylashdi va shu tarzda olingan havoni tortishni to'xtatdilar. D. Rayleigh do'sti V. Ramsay bilan. Ular ko'plab tajribalar o'tkazdilar va havodan olingan azot gazining tarkibida vodoroddan 20 marta og'irroq bo'lgan boshqa gaz borligini tasdiqladilar. Argon birinchi marta shunday izolyatsiya qilingan. XX asrning 60-yillarigacha inert gazlarning birorta ham birikmasi olinmagan. Endi ular inert gazlarning ftor va kislorod bilan birikmalarini sun'iy ravishda olishni o'rgandilar. Agar siz oddiy akkor lampochkani qismlarga ajratsangiz, u holda siz argon gaziga duch kelasiz. Ammo buni qilmaslik kerak, chunki siz jarohat olishingiz mumkin.
Darsni yakunlash.
Ushbu darsda siz atomning elektron qobiqlari, Borning atom modellari nima ekanligini bilib oldingiz. Siz atom yadrosining tuzilishini takrorladingiz, atomning elektron qobiqlarini o'rganishda zamonaviy qarashlarni, elektron sathlar va pastki darajalarning shartli tasvirlarini ko'rib chiqdingiz. Borning atom modellari ko'rib chiqildi. Yadro tuzilishini 11-sinfda kimyo darslarida batafsil ko'rib chiqamiz.
1. Rudzitis G. E. Noorganik va organik kimyo. 8-sinf: darslik ta'lim muassasalari: asosiy daraja / G. E. Rudzitis, F. G. Feldman. M.: Ma'rifat. 2011 176 bet: kasal.
2. Popel P. P. Kimyo: 8-sinf: umumiy ta'lim muassasalari uchun darslik / P. P. Popel, L. S. Krivlya. - K .: "Akademiya" axborot markazi, 2008.-240 b.: kasal.
3. Gabrielyan O. S. Kimyo. 9-sinf Darslik. Nashriyotchi: Drofa.: 2001 yil. 224s.
1. Chemport. ru.
1. No 4-6 (138-bet) Rudzitis G. E. Noorganik va organik kimyo. 8-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G. E. Rudzitis, F. G. Feldman. M.: Ma'rifat. 2011 176 bet: kasal.
2. Atomlarning tuzilishiga asoslanib, kimyoviy elementlar xossalarining davriyligi sababini tushuntiring.
3. Inert gazlarning kashf etilishi tarixi haqida qisqacha ma’ruza tayyorlang.
Atom yadrosi protonlar - musbat zaryadlangan zarralar va neytronlar - zaryadga ega bo'lmagan zarralardan iborat. Ushbu darsda biz atomning elektron qobig'ining tuzilishini ko'rib chiqamiz.
Guruch. 1. Atomning sayyoraviy modeli
1913-yilda daniyalik fizigi Nils Bor atom tuzilishi jihatidan Quyosh sistemasining tuzilishiga oʻxshash degan fikrni ilgari surdi. Atomning ichida, shuningdek, quyosh tizimining ichida, quyosh massiv yadro bo'lib, unda atomning butun massasi to'plangan. Va bu yadro atrofida, xuddi quyosh atrofidagi sayyoralar kabi, elektronlar aylanadi. 1-rasm. Elektronning massasi proton yoki neytrondan 1832 marta kichikdir. Nils Borning modeli uning ustozi Ernest Ruterfordning modeliga asoslangan edi.
Nils Bor atomdagi elektronlar tasodifiy emas, balki ma'lum orbitalarda harakatlanishini taklif qildi. U ikkita mulohaza qo'ygan, ya'ni isbotsiz qabul qilingan.
Nils Borning postulatlari.
1. Atomda orbitalar mavjud bo'lib, ularda elektron energiya chiqarmaydi. Bu orbitalar statsionar deyiladi.
2. Elektron bir turg‘un orbitadan ikkinchisiga o‘tgandagina nurlanish sodir bo‘ladi.
Atom tuzilishining kvant nazariyasiga ko'ra, atomdagi barcha elektronlar energiya sathi yoki orbita bo'ylab harakatlanadi. Bu darajalar quyi darajalardan iborat. O'z navbatida, pastki darajalar atom orbitallaridan iborat. Agar atomning elektron qobig'i yadro ustida joylashgan uy deb hisoblasak, bunday tuzilmani tasavvur qilish oson. Uy ko'p qavatlardan iborat - darajalar. Har bir darajadagi pastki darajalar mavjud - bu kvartiralar. Kvartiralarda atom orbitallari mavjud, ya'ni. xonalar. Biz elektronning orbitallardagi o'ziga xos joylashishini emas, balki uning atom orbitallarida bo'lish ehtimolini aniqlashimiz mumkin.
Darajalar.
Bor modelidagi elektron orbitalar butun sonlar bilan belgilanadi: 1, 2, 3, 4, ... va hokazo. n, yoki lotin harflarida alifbo tartibida K, L, M, N, O P, Q harflari bilan boshlanadi. Yadroga eng yaqin darajadan boshlab. Keyinchalik bunday orbitalarni - darajalar deb ataymiz.
Pastki darajalar.

Guruch. 2. Atom orbitallarining shakllari
Darajalar o'z navbatida pastki darajalardan iborat. Har bir darajadagi pastki darajalar soni daraja soniga teng. Pastki darajalarning nomlari bor.
Har bir darajadagi 1-chi daraja S deb nomlanadi,
Har bir darajadagi 2-chi daraja P deb ataladi,
Har bir darajadagi 3-chi daraja d deyiladi,
Har bir darajaning 4-chi pastki darajasi f deyiladi
Orbitallar turli shakllarda bo'ladi.
s-orbital sharsimon, p-orbital sakkiz hajmli shaklga ega.d f-orbitallar esa undan ham murakkabroq. 2-rasm.
Bu raqamlarning barchasi atomda elektronlarni topishning eng katta ehtimoli bo'lgan hududni belgilaydi.
Atomning to'lqin modeli fizik model emas, balki atom tuzilishining, undagi elektronlarning joylashishining mavhum yoki matematik modelidir.
S - elementlar.
Bular tashqi sathda faqat s-elektronlarni o'z ichiga olgan elementlardir.
Agar bular p - elektronlar bo'lsa, unda bu p - element.
Energiya darajasi yadrodan qanchalik uzoqda joylashgan bo'lsa, u shunchalik ko'p elektronlarni sig'dira oladi, chunki har bir keyingi energiya darajasida ko'proq pastki darajalar mavjud. Demak, har bir n sathda n 2 ta orbital bo'lishi mumkin. Shuning uchun elektronlar 2n 2 ni sig'dira oladi. Nima uchun n 2 ni 2 ga ko'paytirdik? Chunki har bir atom orbitalida 2 tadan ortiq elektron bo'lishi mumkin emas.
Har bir darajadagi elektronlarning eng ko'p soni 1-jadvalda keltirilgan.

Guruch. 3. Orbital diagrammasi
Elektronlarni atom darajalarida, pastki sathlarda va orbitallarda joylashtirishni o'rganish uchun bizga bu ma'lumotlarning barchasi kerak.
Elektron darajalar va pastki darajalarning shartli tasviri mavjud. Bu orbital yoki kvant diagrammasi. Bunday diagrammada orbitallar shartli ravishda kvadrat shaklida, elektronlar esa strelkalar shaklida tasvirlangan. Guruch. 3. Agar bitta katakda ikkita o'q bo'lsa, u holda ular turli yo'nalishlarga qaratilgan o'qlar bilan ko'rsatiladi. Elektronlarning bu xossasi deyiladi aylanish.
Barcha atom orbitallarini elektronlar bilan to'ldirganingizdan so'ng, elementning "elektron pasportini" yoki uning elektron formulasini yozishingiz kerak. Buning uchun siz har bir energiya darajasini 1, 2, 3, ... raqamlari bilan, pastki darajani s, p, d harflari bilan belgilashingiz kerak ...
Quvvat sifatida ma'lum bir pastki darajadagi elektronlar sonini oling.
№1 misol.

Guruch. 4. Azotning elektron formulasi
Atom raqami 7 bo'lgan kimyoviy elementning elektron formulasini yozing.
Bunday elementning atomida 7 ta elektron bo'lishi kerak. Pastki 1 lardan boshlab orbitallarni elektronlar bilan to'ldiramiz.

Guruch. 5. Atomdagi elektronlarning joylashishi diagrammasi
Quyidagi elektron konfiguratsiya olinadi: 1s 2 2s 2 2p 3. 4-rasm.
Shundan so'ng, siz energiya darajasi bo'yicha elektronlarning joylashishini tuzatishingiz kerak. Buning uchun siz yadroni sxematik tarzda tasvirlashingiz, uning zaryadini ko'rsatishingiz va energiya darajalarining sonini aniqlashingiz kerak. Eslatib o'taman, azotda ulardan faqat 2 tasi bor.2 ta yoy chizamiz va shu yoylar ostiga ularda joylashgan elektronlar sonini yozamiz. Keyin biz atomda elektron tartibga solishning shunday sxemasini olamiz. 5-rasm.
№2 misol.
Atom raqami 18 bo'lgan kimyoviy elementning elektron formulasini yozing.
Birinchi holatda bo'lgani kabi, biz elektronlarni atom orbitallarida joylashtiramiz. 1s 2 2s 2 2p 6 3s 2 3p 6 . Bu argon elementi. 6-rasm. Yunon tilidan "harakatsiz" deb tarjima qilingan. U bu nomni oldi, chunki u hech qanday kimyoviy element bilan o'zaro ta'sir qilmaydi.
Tugallangan tashqi elektron qavatli elementlar.
Asil yoki inert gazlar kichik guruhiga kiritilgan. Ularning inertligi atom tuzilishi bilan bog'liq. Bu gazlar to'liq tashqi energiya qobig'iga ega - ns 2np 6. Inert gazlar monotomik molekula hosil qiladi. Tabiatdagi barcha boshqa gazlar faqat ikki atomli molekulaga ega. Masalan, O 2, H 2. To'ldirilgan elektron qobig'i bo'lgan kimyoviy elementlarning barqarorligining sababi hali aniq emas. Ammo kimyogarlar buni oddiygina tabiat qonuni sifatida qabul qilishadi. Boshqa barcha elementlar tashqi qobig'ini to'ldirishga moyil bo'ladi.
Nima uchun ma'lum darajalarning pastki darajalari ingliz alifbosining ma'lum harflari bilan nomlanganligini bilish qiziq. Har bir atom energiya chiqaradi. Bu energiya atomlarning emissiya spektrlarida aniqlanishi mumkin. Atomlarning turli emissiya spektrlari har xil shaklga ega. Ularning chiziqlari boshqacha. Shunday qilib, eng tor o'tkir chiziqlar s harfi deb ataldi. Inglizcha "ball" so'zidan.
s- "o'tkir" chiziq nomi bilan atalgan pastki daraja
p- pastki daraja "asosiy" qator nomi bilan ataladi
d- pastki daraja "diffuz", "loyqa" (diffuz) chiziq nomi bilan ataladi
f- pastki sath “fundamental” qator nomi bilan atalgan


Kimyoviy inertligi tufayli asil gazlar uzoq vaqt davomida kimyoda ma'lum emas edi. Faqat 1892 yilda birinchi inert gaz argoni olingan. Uni D. Rayleigh qabul qildi. U buni azot bilan tajribalar paytida oldi. D.Reylining ta'kidlashicha, agar azot havodan olinadigan bo'lsa, u holda bu azot gazi turli xil kimyoviy tajribalarda azot olingandan ko'ra kattaroq massaga ega bo'ladi. Agar havodan 1 litr azot olinsa, u holda uning massasi 1,2572 g, azotli birikmalarning parchalanishidan olingan bo`lsa, massasi 1,2505 g bo`ladi.Bunday farq qayerdan kelib chiqadi? Ko'pgina olimlar shunchaki tajriba o'tkazdilar deb o'ylashdi va shu tarzda olingan havoni tortishni to'xtatdilar. D. Rayleigh do'sti V. Ramsay bilan. Ular ko'plab tajribalar o'tkazdilar va havodan olingan azot gazining tarkibida vodoroddan 20 marta og'irroq bo'lgan boshqa gaz borligini tasdiqladilar. Argon birinchi marta shunday izolyatsiya qilingan. XX asrning 60-yillarigacha inert gazlarning birorta ham birikmasi olinmagan. Endi ular inert gazlarning ftor va kislorod bilan birikmalarini sun'iy ravishda olishni o'rgandilar. Agar siz oddiy akkor lampochkani qismlarga ajratsangiz, u holda siz argon gaziga duch kelasiz. Ammo buni qilmaslik kerak, chunki siz jarohat olishingiz mumkin.
Darsni yakunlash.
Ushbu darsda siz atomning elektron qobiqlari, Borning atom modellari nima ekanligini bilib oldingiz. Siz atom yadrosining tuzilishini takrorladingiz, atomning elektron qobiqlarini o'rganishda zamonaviy qarashlarni, elektron sathlar va pastki darajalarning shartli tasvirlarini ko'rib chiqdingiz. Borning atom modellari ko'rib chiqildi. Biz 11-sinfda kimyo darslarini batafsil ko'rib chiqamiz.
1. Rudzitis G.E. Noorganik va organik kimyo. 8-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G. E. Rudzitis, F.G. Feldman. M.: Ma'rifat. 2011 176 bet: kasal.
2. Popel P.P.Kimyo: 8-sinf: umumiy ta'lim muassasalari uchun darslik / P.P. Popel, L.S. Krivlya. -K.: IC "Akademiya", 2008.-240 b.: kasal.
3. Gabrielyan O.S. Kimyo. 9-sinf Darslik. Nashriyotchi: Drofa.: 2001 yil. 224s.
1. No 4-6 (138-bet) Rudzitis G.E. Noorganik va organik kimyo. 8-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G. E. Rudzitis, F.G. Feldman. M.: Ma'rifat. 2011 176 bet: kasal.
2. Atomlarning tuzilishiga asoslanib, kimyoviy elementlar xossalarining davriyligi sababini tushuntiring.
3. Inert gazlarning kashf etilishi tarixi haqida qisqacha ma’ruza tayyorlang.






