Qaysi moddalar doimiy erish nuqtasiga ega. Erish
ESSE
"Eriyotgan jismlar"
Amalga oshirilgan:
Prisyazhnyuk Olga 9-A
Tekshirildi:
Nevzorova Tatyana Igorevna
Kirish
1) Issiqlik miqdorini hisoblash
2) eritish
3) erishning solishtirma issiqligi
4) Metalllarning erishi
5) Suvning erish va qaynash nuqtasi
6) eriydi
7) Erish haqida qiziqarli
Bilimlardan boshqa kontekstlarda, tegishli sharoitlarda foydalanish
Ko'pgina hodisalarda moddaning va ayniqsa suvning xususiyatlari muhim rol o'ynaydi. Bu erda, masalan, suvning meteorologik aylanishi va tirik organizmlarning bug'lanishini eslatib o'tish kerak. Aysberglar toza suvdan iborat, shuning uchun ular ichimlik suvi manbalari hisoblanadi. Lekin ishlab chiqarish ham toza suv dengizlardagi sho'r suvdan olish nazariy va texnik jihatdan qiyin emas va ichimlik suvi kam, lekin boy energiya manbalariga ega mamlakatlarda tez-tez qo'llaniladigan protsedura hisoblanadi. Yagona muammo - iqtisodiy barqarorlik.
Xulosa (xulosalar)
Kirish
Agregat holat - materiyaning ma'lum sifat xususiyatlari bilan tavsiflangan holati: hajm va shaklni saqlab turish qobiliyati yoki qobiliyatsizligi, uzoq va qisqa masofali tartibning mavjudligi yoki yo'qligi va boshqalar. Agregat holatining o'zgarishi keskin o'zgarish bilan birga bo'lishi mumkin erkin energiya, entropiya, zichlik va boshqa asosiy jismoniy xususiyatlar.
Internetda siz erish va bug'lanish haqida ko'plab sahifalarni topasiz. Albatta, yana ko'p narsalar bor. Ammo ba'zi savollar har doimgidek javobsiz qolmoqda. Nima uchun ba'zi moddalarning erish nuqtasi juda past, boshqalari esa yuqori erish nuqtasiga ega?
- Erish va bug'lanish jarayonida qanday jarayonlar sodir bo'ladi?
- Xo'sh, nega matolarda bunday bor? turli nuqtalar qaynayaptimi?
Erish jarayonida qanday jarayonlar sodir bo'ladi?
Nima uchun ba'zi moddalar erimaydi yoki qaynamaydi, lekin avvalroq parchalanadi? . Ushbu sahifada qaynatish va bug'lanish atamalari xuddi shu tarzda qo'llaniladi. Qo'shimcha ma'lumotni ushbu sahifada topishingiz mumkin.
Birinchi qadam: qattiq qanday yaratilgan
Har bir qattiq jism mayda zarrachalardan iborat. Zarrachalar o'rtasida ularni ushlab turadigan kuchlar mavjud. Ular har doim elektrostatikdir. Zarrachalarning tabiati va kuchlarning kuchi juda ko'p. To'liq to'plamni mening "Bindings" sahifasida topishingiz mumkin. Bu erda qisqacha xulosa.Agregatsiyaning uchta asosiy holati mavjud: qattiq, suyuq va gaz. Ba'zida plazmani agregatsiya holati sifatida tasniflash unchalik to'g'ri emas. Agregatsiyaning boshqa holatlari ham mavjud, masalan, suyuq kristallar yoki Bose-Eynshteyn kondensati.
Agregat holatidagi o'zgarishlar termodinamik jarayonlar fazali o'tishlar deb ataladi. Quyidagi navlar ajralib turadi: qattiqdan suyuqlikka - eritish; suyuqlikdan gaz holatiga - bug'lanish va qaynatish; qattiqdan gaz holatiga - sublimatsiya; gazsimon holatdan suyuq yoki qattiq holatga - kondensatsiya. O'ziga xos xususiyat - plazma holatiga o'tishning keskin chegarasining yo'qligi.
Ikkinchi qadam: qattiq jism erish nuqtasidan pastroq qizdirilganda nima bo'ladi?
Agar moddani isitish orqali qizdirilsa, eng kichik zarralar bu energiyani o'zlashtiradi. Ularning aytishicha, ularning ichki energiyasi o'sib bormoqda. Ichki energiya uch xil bo'lishi mumkin: tebranish energiyasi, aylanish energiyasi va elektron energiyasi. Elektron energiyasi erish va qaynash uchun ahamiyatsiz. Ustiga yetib boruvchi elektronlar yuqori daraja energiya, u erda faqat bir muddat qoling va keyin asl darajaga qayting. Energiya chiqariladi va qattiq moddani tark etadi. Bu erda fosfor va floresans kabi hodisalar sodir bo'ladi.
Fizikada turli holatlarni tavsiflash uchun termodinamik fazaning kengroq tushunchasi qo'llaniladi. Bir fazadan ikkinchi fazaga o'tishni tavsiflovchi hodisalar tanqidiy hodisalar deyiladi.
Qattiq: hajm va shaklni saqlash qobiliyati bilan tavsiflangan holat. Qattiq jismning atomlari muvozanat holati atrofida faqat kichik tebranishlar hosil qiladi. Uzoq muddatli va qisqa masofali buyurtma mavjud.
Keling, vibratsiyani ko'rib chiqaylik, shunday emasmi? va aylanish kuchi biroz yaqinroq. Kichik zarralar ma'lum bir tarzda harakat qiladi. Ushbu harakatlar uchun ba'zi imkoniyatlar hozir sanab o'tilgan. Cho'zish. 2 ta bog'langan atom bog'lanish o'qi bo'ylab tebranadi, shuning uchun bog' vaqti-vaqti bilan qisqaradi va uzunroq bo'ladi. Faqat molekulalar cho'zuvchi tebranishlarni amalga oshirishi mumkin, chunki ular faqat zarracha ichida bog'lanishga ega. Bükme tebranishi. 3 ta bog'langan atom tebranadi, shunda ikki bog' orasidagi burchak davriy ravishda kichikroq va kattaroq bo'ladi. Kamida 3 atomli molekulalar egilish tebranishlariga olib kelishi mumkin. Kattaroq va murakkab molekulalar murakkab murakkab tebranishlarni amalga oshirishi mumkin. Oddiy misol - ammiak molekulasining inversiyasi. Butun zarracha o'zining og'irlik markazi atrofida aylanishi mumkin. Molekulaning bir qismi bitta aloqa atrofida aylanishi mumkin.
- Zarrachaning markaziy joylashuvi atrofidagi tebranishlari.
- Ya'ni, ion yoki molekula mayatnik kabi oldinga va orqaga tebranadi.
- Birinchi bosqichdagi eng kichik zarralarning har biri bunday tebranishlarni amalga oshirishi mumkin.
Suyuqlik: siqilish qobiliyati past bo'lgan moddaning holati, ya'ni u hajmni yaxshi saqlaydi, lekin shaklini saqlay olmaydi. Suyuqlik osongina joylashtirilgan idishning shaklini oladi. Suyuqlikning atomlari yoki molekulalari muvozanat holati yaqinida tebranadi, boshqa atomlar tomonidan qulflanadi va ko'pincha boshqa bo'sh joylarga o'tadi. Faqat qisqa muddatli buyurtma mavjud.
Past haroratlarda zarralar faqat sekin, past amplitudali tebranishlarni olib yuradi va sekin aylanadi. Qattiq jism qizdirilsa, tebranishlar va aylanishlar tezlashadi va tebranishlar amplitudada ortadi. Shuning uchun eng kichik zarralar issiqlik issiqligini o'zlashtiradi va uni harakat energiyasiga aylantiradi.
Uchinchi qadam: Erish jarayonida qanday jarayonlar sodir bo'ladi?
Eng kichik zarrachalar cheksiz miqdorda issiqlikni o'zlashtira oladimi? Oldingi ikki paragrafda biz qattiq jismdagi eng kichik zarrachalarning ikkita xususiyatini ko'rdik. Ular orasida elektrostatik attraktorlar ishlaydi. Ular ma'lum bir bog'lanish energiyasiga olib keladi. Bu haroratga bog'liq emas. Boshqa tomondan, kinetik energiya zarrachalar tarkibida mavjud. Bu harorat qanchalik baland bo'lsa.
Gaz: hajmi va shaklini saqlab qolish qobiliyatiga ega bo'lmagan, yaxshi siqilish bilan tavsiflangan holat. Gaz unga berilgan butun hajmni egallashga intiladi. Gazning atomlari yoki molekulalari nisbatan erkin harakat qiladi, ular orasidagi masofa ularning o'lchamidan ancha katta.
Boshqa holatlar: Chuqur sovutganda, ba'zi moddalar (hozir hammasi emas) o'ta o'tkazuvchan yoki o'ta suyuqlik holatiga o'tadi. Bu holatlar, albatta, alohida termodinamik fazalardir, lekin ularni universal emasligi sababli materiyaning yangi agregat holatlari deb atashga loyiq emas. Muayyan sharoitlarda qattiq va suyuqlik va hatto gazlarning xossalarini ko'rsatadigan pastalar, jellar, suspenziyalar, aerozollar va boshqalar kabi bir hil bo'lmagan moddalar, odatda, har qanday o'ziga xos xususiyatlarga emas, balki dispers materiallarga kiradi. jamlangan holatlar moddalar.
Agar qattiq jism qizdirilsa, uning eng kichik zarrachalarining kinetik energiyasi ortadi. Bir nuqtada u bog'lanish energiyasidan kattaroqdir. Tasavvur qilish mumkinki, zarralar orasidagi jozibador kuchlar endi termal tebranishlardan kelib chiqadigan kuchlarga bardosh bera olmaydi. Endi zarralar bir-biridan mustaqil ravishda harakat qiladi va bu suyuqlikning o'ziga xos xususiyatidir. Qattiq eriydi.
Nima uchun suyuqliklar suyuq?
Suyuqlikda zarrachalar endi elektrostatik tortishish kuchlari bilan birga ushlab turilmaydi. Qizil o'q siz qachon sodir bo'lishini ko'rsatadi. qattiq past bosimda isitiladi. Bu jarayon sublimatsiya deb ataladi. Buni tushunish oson, chunki argument chizig'i oddiy. Bog'lanish energiyasi juda past, jozibali kuchlar zarralarni bir-biriga bog'lab turish uchun juda zaif, shuning uchun ular bir-biridan uzoqlashadi. Biroq, agar siz faqat maktab kitoblari haqidagi ma'lumotlarni bilmasangiz, bu erda qarama-qarshilikni topasiz va o'zingizga savol berasiz.
Erish
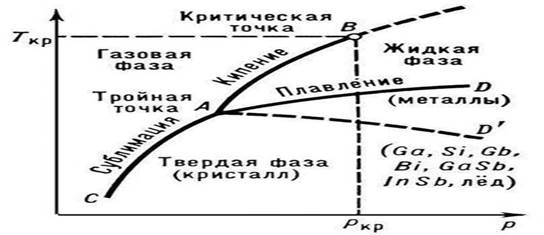
Guruch. 1. Sof moddaning holati (diagramma)
Guruch. 2. Kristal jismning erish harorati
Guruch. 3. Erish nuqtasi ishqoriy metallar
Erish - moddaning kristall (qattiq) holatdan suyuqlikka o'tishi; issiqlikning yutilishi bilan sodir bo'ladi (birinchi tartibdagi fazaga o'tish). Sof moddalar P.ining asosiy xarakteristikalari erish nuqtasi (Tmelt) va P. jarayonini amalga oshirish uchun zarur boʻlgan issiqlik (Qmeltning erish issiqligi).
Suyuqlikda zarrachalar deyarli har doim bir-biridan ajralmaydi, ular hali ham qattiq jismdagidek yaqin turadi. Nega ular o'zlarini gazda bo'lgandek suratga olishmaydi? Boshqacha qilib aytganda, nima uchun qattiq eritma paytida darhol gaz holatiga o'tmaydi?
Bosim asosiy rol o'ynaydi
Ular buni past bosim ostida qilishadi. Faqat yuqori bosimda ular suyuqlikka aylanadi. Qattiq zarrachalarning to'g'ridan-to'g'ri gaz holatiga kirishiga to'sqinlik qiladigan bosimmi? Suyuqliklar mavjudligining sababi bosimmi?
P.ning harorati tashqi bosim p ga bogʻliq; sof moddaning holat diagrammasida bu bog'liqlik erish egri chizig'i bilan tasvirlangan (1-rasmda qattiq va suyuq fazalar, AD yoki AD "birgalikda yashash egri chizig'i). Qotishmalar va qattiq eritmalarning erishi sodir bo'ladi. qoida, harorat oralig'ida (doimiy Tmelt bilan evtektikalar bundan mustasno) Qotishma P.ining boshlanishi va oxiri haroratining ma'lum bosimdagi tarkibiga bog'liqligi holat diagrammalarida maxsus chiziqlar bilan tasvirlangan ( likvidus va solidus egri chiziqlariga qarang. Ikkilik tizimlar). qattiq kristall holatdan izotrop suyuqlikka bosqichma-bosqich (ma'lum bir harorat oralig'ida) sodir bo'ladi, har bir bosqich ma'lum bir halokat bosqichini tavsiflaydi. kristall tuzilishi.
Keling, bosimning rolini batafsil ko'rib chiqaylik. Ichkaridagi zarralar qo'shnilar bilan o'ralgan. ular bilan o'ralgan va jalb qilingan. Sirtdagi zarralar bir nechta qo'shnilarga ega. O'ngdagi rasmga qarang. Bu suyuqlikning bir qismini ko'rsatadi, lekin qattiq moddalardagi nisbatlar asosan bir xil.
Tasvirdagi zarralar sharsimon, lekin turli shakldagi molekulalar yoki ionlar uchun nisbatlar bir xil. Birinchidan, ichidagi zarrachaga qarang. U barcha yo'nalishlarda boshqa zarralar bilan o'ralgan. Zarracha va uning barcha qo'shnilari o'rtasida attraktorlar mavjud. Bu birinchi bosqichda batafsil tavsiflangan Coulomb kuchlari. Tabiiyki, ular suyuqlikda ham, qattiq holatda ham mavjud bo'lib, ular hali ham erishdan oldingi kabi kuchli. Ular rasmda qora chiziqlar bilan ifodalangan. Bir zarracha ta'kidlangan, uning 7 ta qo'shnisi bor, ular Coulomb kuchlari ta'sirida.
Muayyan haroratning mavjudligi P. toʻgʻrining muhim belgisidir kristall tuzilishi qattiq jismlar. Shu asosda ularni qattiq Tm ga ega bo'lmagan amorf qattiq jismlardan oson ajratish mumkin. Amorf qattiq moddalar asta-sekin suyuqlik holatiga o'tadi, harorat oshishi bilan yumshaydi (qarang Amorf holat ). Sof metallar orasida volfram eng yuqori haroratga ega (3410 ° C), simob esa eng past haroratga ega (-38,9 ° C). Ayniqsa, o'tga chidamli birikmalarga quyidagilar kiradi: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C) va boshqalar. Qoida tariqasida, yuqori bo'lgan moddalar uchun. Tm Qm ning yuqori qiymatlari bilan tavsiflanadi. Tarkibida mavjud bo'lgan aralashmalar kristalli moddalar oh, ularning Tm ni tushiring. Bu amalda past Tmelt bilan qotishmalarni olish uchun ishlatiladi (masalan, Tmelt = 68 ° C bilan yog'och qotishma qarang) va sovutish aralashmalari.
Ulardan biri allaqachon undan uzoqlashgan edi. Agar u uzoqroq harakat qilsa, u birinchi zarracha muhitini butunlay tark etadi. Ammo u hali ham suyuqlikda, chunki u boshqa zarrachaga yaqinlashadi va ular o'rtasida qisqa vaqt davomida aloqa paydo bo'ladi. Suyuqlik ichidagi zarralar ularni tark eta olmaydi, chunki ular bir qo'shni zarradan zo'rg'a harakatlanadilar, boshqasi tomonidan tortiladi.
Suyuqlik yuzasida zarrachalar bo'lsa, vaziyat boshqacha. Rasmda ikkita shunday zarracha ko'rsatilgan. Ular faqat suyuqlik ichida qo'shnilari bor va faqat ular uchun Coulomb kuchlari. Tashqi tomondan, qo'shnilar deyarli yo'q. Havo yoki boshqa gaz bor. Suyuqlik bilan solishtirganda u juda past zichlikka ega, shuning uchun u birlik hajmida juda kam zarralarni o'z ichiga oladi. Siz sirtdagi zarrachalarni diqqat bilan ko'rib chiqishingiz kerakligini bilib olasiz. Javobning kaliti bor.
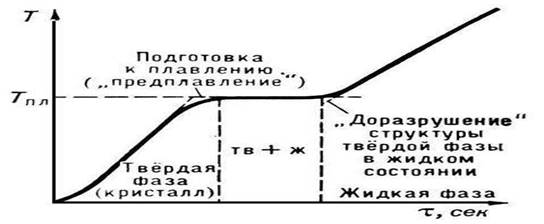
P. kristall modda Tpl ga yetganda boshlanadi. P.ning boshidan to uning tugaguniga qadar moddaga issiqlik oʻtishiga qaramay, moddaning harorati doimiy va Tmeltga teng boʻlib qoladi (2-rasm). Oddiy sharoitlarda kristallni T > Tmelt ga qizdirish mumkin emas (qarang: Haddan tashqari qizib ketish), kristallanish jarayonida eritmaning sezilarli darajada sovishi nisbatan osonlik bilan amalga oshiriladi.
Ko'proq yoki kamroq energiyaga ega bo'lgan zarralar
Suyuqlikdagi zarrachalarning energiya taqsimoti. Biz har doim zarrachalar issiqlik tebranishlari tufayli ma'lum energiyaga ega ekanligini aytdik va bir tomchi suyuqlikdagi barcha zarralar bir xil energiyaga ega deb o'ylash mumkin. Ulardan ba'zilari yuqori energiyaga ega, boshqalari esa pastroq. Bu zarrachalar to'qnashishini hisobga olsak, tushunish oson. Ularning to'qnashuv tezligi va yo'nalishiga qarab energiya bir zarradan ikkinchisiga o'tadi. Uchrashuvlar juda tasodifiy bo'lgani uchun, g'oliblar ham bor, ularning energiyasi zarbadan zarbaga ko'tariladi, shuningdek, yutqazganlar ham bor.
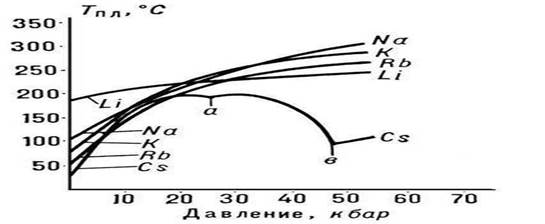
Tm ning p bosimga bog'liqligi tabiati P.dagi hajmli o'zgarishlar (DVm) yo'nalishi bilan belgilanadi (Klapeyron-Klauzius tenglamasiga qarang). Koʻp hollarda moddaning P.si ularning hajmining ortishi (odatda bir necha foiz) bilan kechadi. Agar shunday bo'lsa, unda bosimning oshishi Tm ning oshishiga olib keladi (3-rasm). Biroq, ba'zi moddalarda (suv, bir qator metallar va metallidlar, 1-rasmga qarang), P. vaqtida hajmning pasayishi sodir bo'ladi. Bu moddalarning P. harorati bosim ortishi bilan pasayadi.
Zarrachalar energiyasini bittada taqsimlash. Ikkala taqsimot ham bir oz farq qiladi. Zarrachalar bug'lanadi. Pastki qismdagi qizil chiziqning o'ng tomonidagi maydon. Shuning uchun, 20 ° C da kamroq zarralar bug'lanish uchun zarur bo'lgan energiyaga ega. 50 ° C da bo'lishi mumkin va bu haroratda bug'lanish yanada barqaror bo'ladi. G'oliblar bilan nima sodir bo'ladi? Ularning energiyasi shunchalik kattaki, ular qo'shnilarining Coulomb kuchlarini engib o'tishlari mumkin. Qo'shnilar juda kam bo'lgani uchun ular barcha qo'shnilarning jozibadorligini engib o'tish imkoniyatiga ega.
Va ularning energiyasi juda katta bo'lgani uchun, ular nafaqat bu diqqatga sazovor joylarni qisqa vaqt ichida engib o'tishlari mumkin, balki ularni yana, lekin abadiy qo'lga olishlari mumkin. Bu bir necha yuqori energiya zarralari suyuqlik tomchilarini qoldiradi. Ular iloji boricha uzoqroqqa harakat qilishadi va hech qachon o'z tomchilariga qaytmaydilar. Yuqorida tavsiflangan hodisani hamma biladi.
P. moddaning fizik xossalarining oʻzgarishi bilan kechadi: entropiyaning ortishi, bu moddaning kristall tuzilishining buzilishini aks ettiradi; issiqlik quvvatining oshishi elektr qarshilik[istisno ba'zi yarim metallar (Bi, Sb) va yarim o'tkazgichlar (Ge), in suyuqlik holati yuqori elektr o'tkazuvchanligi bilan. P. vaqtida siljish qarshiligi deyarli nolga tushadi (koʻndalang elastik toʻlqinlar eritmada tarqala olmaydi, Suyuqlikka qarang), tovushning tarqalish tezligi (boʻylama toʻlqinlar) va boshqalar kamayadi.
Bir tomchi suv nima uchun tushishini endigina bilib oldingiz. Issiqlik energiyasi sirtdagi ba'zi zarralar tomchilarni qoldirish uchun etarlicha katta. Biz faqat bug'lanish haqida gapirganimiz sababli, siz tezda tozalashingiz mumkin, chunki bu haroratga bog'liq. To'g'ridan-to'g'ri erish nuqtasi ustida bir tomchi qoldirish uchun etarli energiyaga ega bo'lgan bir nechta zarralar bo'ladi. Harorat qanchalik baland bo'lsa, zarrachalarning o'rtacha energiyasi shunchalik yuqori bo'ladi va ko'proq zarrachalar sirtdan chiqish uchun zarur bo'lgan energiyaga ega bo'ladi.
Yopiq tizimlar ular ko'proq aniqlik keltiradi
Natijada, tomchi tezroq bug'lanadi. Quyidagi rasm buni ko'rsatadi. Yana bir bor biz kundalik tajribalarni tushuntira oldik. Ochiq tizim - bu moddalar va energiya almashinuvi tizimi muhit. Masalan, bir tomchi suv ochiq tizim. qarshi, yopiq tizimlar va yopiq tizimlar. Mineral suv shishasining namunasi yaxshi misol yopiq tizim. Taxminan uchdan bir qismi suyuqlik bilan to'ldirilgan. Keraksiz murakkab argumentni keltirib chiqarmaslik uchun uni mineral suv yoki benzin kabi aralashma emas, balki suv kabi toza suyuqlik bilan to'ldirish kerak.
Molekulyar va kinetik koʻrinishlarga koʻra P. quyidagicha amalga oshiriladi. Kristal jismga issiqlik ta'sir qilganda, uning atomlarining tebranish energiyasi (tebranish amplitudasi) ortadi, bu tana haroratining oshishiga olib keladi va kristallda turli xil nuqsonlarning paydo bo'lishiga yordam beradi (kristal panjarasining to'ldirilmagan tugunlari). - bo'sh ish o'rinlari; uning tugunlari orasiga o'rnatilgan atomlar tomonidan panjara davriyligini buzish va boshqalar., Kristallardagi nuqsonlar bo'limiga qarang). Molekulyar kristallarda molekulalar sferik shaklga ega bo'lmasa, molekulalar o'qlarining o'zaro yo'nalishining qisman buzilishi sodir bo'lishi mumkin. Nosozliklar sonining bosqichma-bosqich o'sishi va ularning birlashishi oldindan erish bosqichini tavsiflaydi. Tmelt darajasiga erishilganda, kristallda nuqsonlarning kritik kontsentratsiyasi hosil bo'ladi va kristallanish boshlanadi; kristall panjara oson harakatlanuvchi submikroskopik hududlarga bo'linadi. P. vaqtida beriladigan issiqlik tanani isitish uchun emas, balki atomlararo bogʻlanishlarni uzish va kristallardagi uzoq masofali tartibni buzish uchun ishlatiladi (qarang. Uzoq masofadagi tartib va qisqa masofali tartib). Submikroskopik hududlarning o'zida esa, atomlarning joylashishidagi qisqa masofali tartib erish nuqtasida sezilarli darajada o'zgarmaydi (Tmeltdagi eritmaning koordinatsion soni ko'p hollarda kristalniki bilan bir xil bo'lib qoladi). Bu bug'lanish issiqliklariga nisbatan Qm termoyadroviy issiqliklarining past qiymatlarini va ularning P davrida moddalarning bir qator fizik xususiyatlarining nisbatan kichik o'zgarishini tushuntiradi.
Piroliz jarayoni tabiatda (er yuzasida qor va muzning pirolizi, uning chuqurligidagi foydali qazilmalarning minerallashuvi va boshqalar) va texnologiyada (metall va qotishmalar ishlab chiqarish, qolipga quyish va boshqalar) muhim rol oʻynaydi. .
Erishishning o'ziga xos issiqligi
Maxsus termoyadroviy issiqlik (shuningdek: termoyadroviy entalpiya; kristallanishning solishtirma issiqligining ekvivalent tushunchasi ham mavjud) - muvozanatli izobarik-izotermik jarayonda kristall moddaning massasining bir birligiga berilishi kerak bo'lgan issiqlik miqdori. uni qattiq (kristalli) holatdan suyuqlikka o'tkazish (moddaning kristallanishi paytida chiqarilgan issiqlik miqdori). Erish issiqligi - maxsus holat issiqlik fazali o'tish mehribonman. Erishishning solishtirma issiqligini (J/kg) va molyar (J/mol) farqlang.
Erishishning solishtirma issiqligi harf bilan belgilanadi
(Yunoncha lambda harfi) solishtirma erish issiqligini hisoblash formulasi: , - erishning solishtirma issiqligi, - erish paytida olingan (yoki kristallanish jarayonida ajralib chiqadigan) issiqlik miqdori, - erish (kristallanish) moddaning massasi. .
Metalllarning erishi
Metalllarni eritishda ma'lum qoidalarga rioya qilish kerak. Aytaylik, ular qo'rg'oshin va ruxni eritadi. Qo'rg'oshin tezda eriydi, erish nuqtasi 327 °; boshqa tomondan, sink uzoq vaqt davomida qattiq qoladi, chunki uning erish nuqtasi 419 ° dan yuqori. Bunday haddan tashqari issiqlik bilan nima sodir bo'ladi? U iridescent rangli plyonka bilan qoplana boshlaydi, so'ngra uning yuzasi erimaydigan kukun qatlami ostida yashirinadi. Qo'rg'oshin haddan tashqari qizib ketishdan yonib ketgan, havodagi kislorod bilan qo'shilib oksidlangan. Bu jarayon, siz bilganingizdek, oddiy haroratda sodir bo'ladi, lekin qizdirilganda u tezroq ketadi. Shunday qilib, sink eriy boshlagunga qadar, juda kam metall qo'rg'oshin qoladi. Qotishma kutilganidek butunlay boshqacha tarkibga aylanadi va katta miqdordagi qo'rg'oshin chiqindilar shaklida yo'qoladi. Biz avvalo o'tga chidamliroq ruxni eritib, keyin unga qo'rg'oshin qo'yishimiz kerakligi aniq. Xuddi shu narsa, agar sink mis yoki guruch bilan qotishma bo'lsa, birinchi navbatda sinkni isitadi. Mis erishi bilan sink yonib ketadi. Bu shuni anglatadiki, siz har doim yuqori erish nuqtasi bilan metallni eritishingiz kerak.
Ammo bu g'azabdan qochib qutula olmaydi. To'g'ri qizdirilgan qotishma uzoq vaqt davomida olovda saqlansa, bug'lar natijasida suyuq metall yuzasida yana plyonka hosil bo'ladi. Ko'proq eriydigan metall yana oksidga aylanishi va vilkaning tarkibi o'zgarishi aniq; Bu shuni anglatadiki, metallni keraksiz uzoq vaqt davomida qizdirib bo'lmaydi. Shuning uchun ular metallning chiqindilarini kamaytirishga, uni ixcham massaga joylashtirishga har tomonlama harakat qilishadi; kichik bo'laklar, talaşlar, talaşlar birinchi navbatda "qadoqlanadi", ko'proq yoki kamroq bir xil o'lchamdagi bo'laklar eritiladi, ular etarli haroratda isitiladi va metall yuzasi havo bilan aloqa qilishdan himoyalangan. Shu maqsadda usta boraksni olishi yoki oddiygina metall yuzasini kul qatlami bilan qoplashi mumkin, u doimo tepada suzadi (kichikligi tufayli). solishtirma og'irlik) va metallni quyishda zarar ko'rmaydi. Metall qotib qolganda, ehtimol yosh hunarmandlarga tanish bo'lgan yana bir hodisa paydo bo'ladi. Metall, qattiqlashadi, hajmi kamayadi va bu pasayish ichki, hali qotib qolmagan metall zarralari tufayli sodir bo'ladi. Quyma yuzasida yoki uning ichida qisqarish bo'shlig'i deb ataladigan ko'proq yoki kamroq ahamiyatga ega huni shaklidagi depressiya hosil bo'ladi. Odatda, qolip quyma joylarida qisqarish teshiklari hosil bo'ladigan tarzda amalga oshiriladi, ular keyinchalik olib tashlanadi va mahsulotning o'zini iloji boricha himoya qilishga harakat qiladi. Siqilish teshiklari to'qimalarni buzishi va ba'zan uni yaroqsiz holga keltirishi aniq. Eritgandan so'ng, metall biroz qiziydi, shuning uchun u nozikroq va issiqroq bo'ladi va shuning uchun qolipning tafsilotlarini yaxshiroq to'ldiradi va sovuqroq mog'or bilan aloqa qilishdan erta muzlamaydi.
Qotishmalarning erish nuqtasi odatda qotishma tarkibidagi eng o'tga chidamli metallarning erish nuqtasidan past bo'lganligi sababli, ba'zan buning aksini qilish foydali bo'ladi: birinchi navbatda ko'proq eriydigan metallni eritib, keyin esa o'tga chidamli. Biroq, bu faqat kuchli oksidlanmagan metallar uchun yoki bu metallar haddan tashqari oksidlanishdan himoyalangan bo'lishi sharti bilan joizdir. Bu narsaning o'zi uchun zarur bo'lganidan ko'ra ko'proq metallni olish kerak, shunda u nafaqat qolipni, balki qoraqarag'ali kanalni ham to'ldiradi. Avvalo kerakli miqdordagi metallni hisoblashingiz kerakligi aniq.
Suvning erish va qaynash nuqtasi
Tirik tabiat uchun suvning eng hayratlanarli va baxtiyor xususiyati uning "normal" sharoitda suyuqlik bo'lish qobiliyatidir. Suvga juda o'xshash birikmalarning molekulalari (masalan, H2S yoki H2Se molekulalari) ancha og'irroq, lekin bir xil sharoitlarda gaz hosil qiladi. Shunday qilib, suv davriy jadval qonunlariga ziddek tuyuladi, siz bilganingizdek, moddalarning qachon, qayerda va qanday xossalari yaqin bo'lishini bashorat qiladi. Bizning holatda, jadvaldan kelib chiqadiki, xususiyatlar vodorod birikmalari bir xil vertikal ustunlarda joylashgan elementlar (gidridlar deb ataladi) atomlar massasining ortishi bilan monoton ravishda o'zgarishi kerak. Kislorod ushbu jadvalning oltinchi guruhining elementidir. Xuddi shu guruhga oltingugurt S (atom og'irligi 32), selen Se (atom og'irligi 79), tellur Te (atom og'irligi 128) va polloniy Po (atom og'irligi 209) kiradi. Binobarin, bu elementlarning gidridlarining xossalari og'ir elementlardan engilroqlarga o'tishda monoton tarzda o'zgarishi kerak, ya'ni. H2Po → H2Te → H2Se → H2S → H2O ketma-ketlikda. Bu sodir bo'ladi, lekin faqat birinchi to'rtta gidrid bilan. Masalan, elementlarning atom og'irligi ortishi bilan qaynash va erish nuqtalari ko'tariladi. Rasmda xochlar bu gidridlarning qaynash nuqtalarini, aylanalar esa erish nuqtalarini belgilaydi.

Ko'rinib turibdiki, atom og'irligi kamayishi bilan haroratlar juda chiziqli ravishda pasayadi. Gidridlarning suyuq fazasining mavjud bo'lish maydoni tobora "sovuq" bo'lib boradi va agar H2O kislorod gidridi oltinchi guruhdagi qo'shnilariga o'xshash oddiy birikma bo'lsa, suyuq suv - 80 ° C dan -95 ° C gacha. Ko'proq yuqori haroratlarda H2O har doim gaz bo'ladi. Yaxshiyamki, biz va er yuzidagi barcha hayot uchun suv anomaldir, u davriy naqshni tan olmaydi, lekin o'z qonunlariga amal qiladi.
Bu juda oddiy tushuntirilgan - suv molekulalarining aksariyati vodorod aloqalari bilan bog'langan. Aynan shu bog'lanishlar suvni H2S, H2Se va H2Te suyuq gidridlaridan ajratib turadi. Agar ular bo'lmasa, suv allaqachon minus 95 ° C da qaynaydi. Vodorod aloqalarining energiyasi ancha yuqori va ular faqat ancha yuqori bo'lganida uzilishi mumkin yuqori harorat. Hatto ichida gazsimon holat katta raqam H2O molekulalari (H2O)2 dimerlarga birlashib, vodorod aloqalarini saqlab qoladi. To'liq vodorod aloqalari faqat 600 ° C suv bug'ining haroratida yo'qoladi.
Eslatib o'tamiz, qaynash qaynayotgan suyuqlik ichida bug 'pufakchalari paydo bo'lishidan iborat. Oddiy bosimda toza suv 100 "S da qaynaydi. Agar issiqlik erkin sirt orqali berilsa, sirt bug'lanish jarayoni tezlashadi, lekin qaynash uchun xarakterli hajmli bug'lanish sodir bo'lmaydi. Qaynatish tashqi bosimni pasaytirish orqali ham amalga oshirilishi mumkin. bosim, chunki bu holda tashqi bosimga teng bosim bug'iga pastroq haroratda erishiladi.Ustki qismida juda baland tog' bosim va shunga mos ravishda qaynash nuqtasi shunchalik pastki, suv ovqat pishirish uchun yaroqsiz bo'lib qoladi - kerakli suv haroratiga erishilmaydi. Etarlicha yuqori bosim bilan suvni qo'rg'oshin (327 ° C) eritish uchun etarli darajada isitish mumkin va hali ham qaynamaydi.
Juda katta erish nuqtalariga qo'shimcha ravishda (va oxirgi jarayon bunday oddiy suyuqlik uchun juda ko'p termoyadroviy issiqlikni talab qiladi), suvning mavjudligi anomaldir - bu haroratlar bir-biridan yuz daraja farq qiladi - juda katta diapazon. suv kabi past molekulyar suyuqlik uchun. Gipotermiya va suvning haddan tashqari qizib ketishining ruxsat etilgan qiymatlari chegaralari juda katta - ehtiyotkorlik bilan isitish yoki sovutish bilan suv -40 ° C dan +200 ° C gacha suyuqlik bo'lib qoladi. Bu suvning suyuq holatda qolishi mumkin bo'lgan harorat oralig'ini 240 ° C gacha kengaytiradi.
Muz qizdirilganda birinchi navbatda uning harorati ko'tariladi, lekin suv va muz aralashmasi hosil bo'lgan paytdan boshlab, barcha muz eriguncha harorat o'zgarmaydi. Bu erish muzga beriladigan issiqlik birinchi navbatda faqat kristallarni yo'q qilishga sarflanishi bilan izohlanadi. Muzning erish harorati barcha kristallar vayron bo'lgunga qadar o'zgarishsiz qoladi (qarang. Yashirin sintez issiqligi).
eriydi
Eritmalar - ma'lum chegaralardagi haroratlarda moddalarning suyuq erigan holati tanqidiy nuqta erish nuqtasi va erish nuqtasiga yaqinroq joylashgan. Eritmalarning tabiati tabiatan turiga qarab belgilanadi kimyoviy bog'lanishlar erigan moddadagi elementlar.
Eritmalar metallurgiya, shishasozlik va texnologiyaning boshqa sohalarida keng qo'llaniladi. Eritmalar odatda murakkab tarkibga ega va turli o'zaro ta'sir qiluvchi komponentlarni o'z ichiga oladi (faza diagrammasiga qarang).
Eritmalar bor
1. Metall (Metallar (nomi lotincha metallum — shaxta, shaxtadan olingan) — yuqori issiqlik va elektr oʻtkazuvchanlik, musbat harorat qarshilik koeffitsienti, yuqori egiluvchanlik va metall yorqinligi kabi xarakterli metall xossalarga ega boʻlgan elementlar guruhi);
2. Ion (Ion (qadimgi yunoncha ἰόn — yugurish) — atom yoki molekulaga bir yoki bir necha elektronning yoʻqolishi yoki qoʻshilishi natijasida hosil boʻlgan monoatomik yoki koʻp atomli elektr zaryadli zarracha. Ionlanish (ionlarning hosil boʻlish jarayoni) yuqori haroratlarda, ta'sir ostida sodir bo'ladi elektr maydoni);
3.Yarimo'tkazgich bilan kovalent aloqalar atomlar orasidagi (Yarim o'tkazgichlar - o'ziga xos o'tkazuvchanligi bo'yicha o'tkazgichlar va dielektriklar o'rtasida oraliq pozitsiyani egallagan va o'tkazgichlardan o'ziga xos o'tkazuvchanlikning aralashmalar kontsentratsiyasiga, haroratga kuchli bog'liqligi bilan farq qiladigan materiallar. har xil turlari radiatsiya. Ushbu materiallarning asosiy xususiyati harorat oshishi bilan elektr o'tkazuvchanligini oshirishdir);
4. Van der Vaals bog'lari bilan organik eritmalar;
5. Yuqori polimer (Polimerlar (yun. pō- - ko'p; mĭros - qism) - kimyoviy yoki uzoq koordinatsiya yo'li bilan uzun makromolekulalar bilan bog'langan, "monomer birliklar" deb ataladigan, turli atomlar guruhining takroriy takrorlanishi natijasida olingan noorganik va organik, amorf va kristalli moddalar. obligatsiyalar)
Turi bo'yicha eriydi kimyoviy birikmalar lar bor:
1. Tuz;
2.Oksid;
3. Oksid-silikat (shlak) va boshqalar.
Maxsus xususiyatlarga ega eriydi:
1.Eutektik
Eritish haqida qiziqarli
Muz donalari va yulduzlar.
Bir parcha kiriting toza muz issiq xonaga kiring va uning erishini tomosha qiling. Monolit va bir hil bo'lib ko'ringan muz ko'plab mayda donalarga - alohida kristallarga bo'linishi tezda aniq bo'ladi. Muz hajmida ular tasodifiy joylashgan. Menga emas qiziqarli rasm muz sirtdan erib ketganda ko'rish mumkin.
Chiroqqa silliq muz bo'lagini keltiring va eriy boshlaguncha kuting. Eritma ichki donalarga tegsa, u erda juda nozik naqshlar paydo bo'la boshlaydi. Kuchli kattalashtiruvchi oyna yordamida ular olti burchakli qor parchalari shakliga ega ekanligini ko'rishingiz mumkin. Aslida, bu suv bilan to'ldirilgan erigan depressiyalardir. Ularning nurlarining shakli va yo'nalishi muz monokristallarining yo'nalishiga mos keladi. Ushbu naqshlarni 1855 yilda kashf etgan va tavsiflagan ingliz fizigi sharafiga "Tindal yulduzlari" deb ataladi. Qor parchalariga o'xshash "Tindal yulduzlari" aslida erigan muz yuzasida suv bilan to'ldirilgan, taxminan 1,5 mm bo'lgan chuqurliklardir. Ularning markazida erigan muz va erigan suv hajmining farqi tufayli paydo bo'lgan havo pufakchalari ko'rinadi.
BILASIZMI?
Yog'och qotishmasi deb ataladigan metall mavjud bo'lib, uni hatto iliq suvda ham (+68 daraja Selsiy) osongina eritib yuborish mumkin. Shunday qilib, bir stakan shakarni aralashtirganda, bu qotishmadan tayyorlangan metall qoshiq shakardan tezroq eriydi!
Eng o'tga chidamli modda, tantal karbid TaCO-88 3990 ° S haroratda eriydi.
1987 yilda nemis tadqiqotchilari suvni suyuq holatda ushlab turganda -700C gacha sovutishga muvaffaq bo'lishdi.
Ba'zan, yo'laklardagi qor tezroq erishi uchun ularga tuz sepiladi. Muzning erishi muzlash nuqtasi havo haroratidan past bo'lgan suvdagi tuz eritmasi hosil bo'lganligi sababli sodir bo'ladi. Yechim faqat yo'lakdan oqib chiqadi.
Qizig'i shundaki, oyoqlar ho'l yulka ustida ko'proq sovuqlashadi, chunki sho'r suv eritmasining harorati toza qornikidan past bo'ladi.
Agar choynakdan choyni ikkita krujkaga quysangiz: shakar bilan va shakarsiz, keyin shakar bilan krujkadagi choy sovuqroq bo'ladi, chunki. shakarning erishi (uning kristall panjarasini yo'q qilish) ham energiya sarflaydi.
Qattiq sovuqlarda muzning silliqligini tiklash uchun maydon sug'oriladi issiq suv.. Issiq suv muzning yupqa ustki qatlamini eritadi, unchalik tez muzlamaydi, tarqalish uchun vaqt topadi va muz yuzasi juda silliq bo'ladi.
Xulosa (xulosalar)
Erish - moddaning undan o'tishi qattiq holat suyuqlikka.
Qizdirilganda moddaning harorati ko'tariladi va zarrachalarning issiqlik harakati tezligi ortadi, tananing ichki energiyasi esa ortadi.
Qattiq jismning harorati erish nuqtasiga yetganda, kristall panjara qattiq parchalana boshlaydi. Shunday qilib, qattiq jismga o'tkaziladigan isitgich energiyasining asosiy qismi moddaning zarralari orasidagi bog'lanishlarni kamaytirishga, ya'ni kristall panjarani yo'q qilishga sarflanadi. Bunday holda, zarralar orasidagi o'zaro ta'sir energiyasi ortadi.
Eritilgan modda katta ta'minotga ega ichki energiya qattiq holatdan ko'ra. Eritish issiqligining qolgan qismi tananing erishi paytida uning hajmini o'zgartirish uchun ishlarni bajarishga sarflanadi.
Eritilganda, ko'pchilikning hajmi kristall jismlar ortadi (3-6% ga), qattiqlashganda esa kamayadi. Ammo shunday moddalar borki, ular eritilganda hajmi kamayadi, qattiqlashganda esa ko'payadi. Bularga, masalan, suv va quyma temir, kremniy va boshqalar kiradi. . Shuning uchun muz suv yuzasida, qattiq quyma temir esa o'z erishida suzadi.
Amorf deb ataladigan qattiq moddalar (qahrabo, qatron, shisha) o'ziga xos erish nuqtasiga ega emas.
Bir moddani eritish uchun zarur bo'lgan issiqlik miqdori eritishning solishtirma issiqligining moddaning massasiga ko'paytmasiga teng.
Eritishning o'ziga xos issiqligi 1 kg moddani qattiq holatdan suyuq holatga to'liq aylantirish uchun qancha issiqlik kerakligini ko'rsatadi, erish tezligida olinadi.
SIda eritishning solishtirma issiqligining birligi 1J/kg.
Erish jarayonida kristallning harorati doimiy bo'lib qoladi. Bu harorat erish nuqtasi deb ataladi. Har bir moddaning o'ziga xos erish nuqtasi mavjud.
Berilgan moddaning erish nuqtasi atmosfera bosimiga bog'liq.
Foydalanilgan adabiyotlar ro'yxati
1) "Vikipediya" elektron bepul ensiklopediyasidan olingan ma'lumotlar
http://ru.wikipedia.org/wiki/Main_page
2) "Klass! Qiziqqanlar uchun fizika" sayti http://class-fizika.narod.ru/8_11.htm
3) Sayt " Jismoniy xususiyatlar suv"
http://all-about-water.ru/boiling-temperature.php
4) "Metallar va konstruktsiyalar" veb-sayti
http://metaloconstruction.ru/osnovy-plavleniya-metallov/
Bunday narsa yo'q qattiq tana, bu kerak bo'lganda haroratning oshishiga qarshilik ko'rsatadi. Ertami-kechmi qattiq bo'lak suyuqlikka aylanadi; to'g'ri, ba'zi hollarda biz erish nuqtasiga erisha olmaymiz - kimyoviy parchalanish sodir bo'lishi mumkin.
Harorat ko'tarilgach, molekulalar tezroq va tezroq harakat qiladi. Nihoyat, "kuchli" silkitilgan "molekulalar o'rtasida tartibni saqlash imkonsiz bo'lib qolgan bir lahza keladi. Qattiq tana eriydi. Volfram eng yuqori erish nuqtasiga ega: 3380 ° S. Oltin 1063 ° C da, temir 1539 ° S da eriydi. Biroq, eruvchi metallar ham bor.Simob, ma'lumki, -39 ° C haroratda allaqachon eriydi. Organik moddalar yuqori erish nuqtalariga ega emas.Naftalin 80 ° C da, toluol - 94,5 ° S da eriydi.
Tananing erish nuqtasini o'lchash umuman qiyin emas, ayniqsa u oddiy termometr bilan o'lchanadigan harorat oralig'ida eriydi. Eriyotgan tanani ko'z bilan kuzatib borish umuman shart emas. Termometrning simob ustuniga qarash kifoya. Erish boshlanmaguncha tana harorati ko'tariladi (4.5-rasm). Erish boshlanishi bilan haroratning ko'tarilishi to'xtaydi va erish jarayoni tugagunga qadar harorat o'zgarishsiz qoladi.
Suyuqlikning bug'ga aylanishi kabi, qattiq jismning suyuqlikka aylanishi ham issiqlikni talab qiladi. Buning uchun zarur bo'lgan issiqlik deyiladi yashirin issiqlik erish. Misol uchun, bir kilogramm muzni eritish uchun 80 kkal kerak bo'ladi.
Muz yuqori termoyadroviy issiqlikka ega jismlardan biridir. Muzning erishi, masalan, qo'rg'oshinning bir xil massasini eritishdan ko'ra 10 barobar ko'proq energiya talab qiladi. Albatta gaplashamiz erishning o'zi haqida, biz bu erda qo'rg'oshin erishi boshlanishidan oldin uni + 327 ° C ga qadar qizdirish kerakligini aytmaymiz. Muz erishining yuqori issiqligi tufayli qor erishi sekinlashadi. Tasavvur qiling-a, erish issiqligi 10 baravar kam bo'ladi. Keyin bahorgi toshqinlar har yili tasavvur qilib bo'lmaydigan ofatlarni olib kelardi.
Shunday qilib, muzning birlashishi issiqligi juda katta, lekin u bilan solishtirganda ham kichikdir o'ziga xos issiqlik 540 kkal / kg bug'lanish (etti baravar kam). Biroq, bu farq juda tabiiy. Suyuqlikni bug'ga aylantirganda, biz molekulalarni bir-biridan yirtib tashlashimiz kerak va erish paytida biz faqat molekulalarning joylashishidagi tartibni buzishimiz kerak, ularni deyarli bir xil masofada qoldiramiz. Ikkinchi holatda kamroq ish talab qilinishi aniq.
Muayyan erish nuqtasining mavjudligi kristall moddalarning muhim xususiyatidir. Aynan shu asosda ularni amorf yoki ko'zoynak deb ataladigan boshqa qattiq jismlardan osongina ajratish mumkin. Ko'zoynaklar noorganik va organik moddalar orasida uchraydi. Deraza oynalari odatda natriy va kaltsiy silikatlaridan tayyorlanadi; ko'pincha organik shisha stol ustiga qo'yiladi (u plexiglass deb ham ataladi).
Amorf moddalar, kristallardan farqli o'laroq, aniq erish nuqtasiga ega emas. Shisha erimaydi, lekin yumshaydi. Isitilganda, shisha bo'lagi birinchi navbatda qattiqdan yumshoq bo'ladi, uni osongina egish yoki cho'zish mumkin; yuqori haroratda bo'lak o'z tortishish kuchi ta'sirida shaklini o'zgartira boshlaydi. U qizdirilganda, shishaning qalin yopishqoq massasi u yotadigan idishning shaklini oladi. Bu massa dastlab qalin, asal kabi, keyin smetana kabi, va nihoyat, u deyarli suv kabi past yopishqoq suyuqlikka aylanadi. Bizning barcha xohishimiz bilan biz bu erda qattiq jismning suyuqlikka o'tishi uchun ma'lum bir haroratni ko'rsata olmaymiz. Buning sabablari shisha tuzilishi va kristall jismlarning tuzilishi o'rtasidagi tub farqda yotadi. Yuqorida aytib o'tilganidek, atomlar amorf jismlar tasodifiy tartibga solingan. Tuzilishi bo'yicha ko'zoynaklar suyuqlikka o'xshaydi.Hatto qattiq shishada ham molekulalar tasodifiy joylashtirilgan. Bu shuni anglatadiki, shisha haroratining oshishi faqat uning molekulalarining tebranish diapazonini oshiradi va ularga asta-sekin ko'proq va ko'proq harakat erkinligini beradi. Shuning uchun shisha asta-sekin yumshaydi va o'tkir "qattiq" - "suyuqlik" o'tishni ko'rsatmaydi, bu molekulalarning qat'iy tartibda joylashishidan tasodifiy tartibga o'tishga xosdir.
Qaynatish egri chizig'i haqida gap ketganda, biz suyuqlik va bug 'beqaror holatda bo'lsa ham, begona hududlarda yashashi mumkinligini aytdik - bug' o'ta sovutilishi va qaynash egri chizig'ining chap tomoniga o'tkazilishi, suyuqlik qizib ketishi va o'ngga tortilishi mumkin. bu egri chiziqdan.
Suyuqlik bilan kristall holatida shunga o'xshash hodisalar mumkinmi? Ma'lum bo'lishicha, bu erda o'xshatish to'liq emas.
Agar siz kristallni qizdirsangiz, u erish nuqtasida eriy boshlaydi. Kristalni haddan tashqari qizdirib bo'lmaydi. Aksincha, suyuqlikni sovutish orqali, agar ma'lum choralar ko'rilsa, erish nuqtasini nisbatan osonlik bilan "o'tish" mumkin. Ba'zi suyuqliklarda katta subsovutishlarga erishish mumkin. Hatto shunday suyuqliklar ham borki, ularni o'ta sovutish oson, lekin kristallanishi qiyin. Bunday suyuqlik sovigan sari u tobora yopishqoq bo'lib, nihoyat kristallanmasdan qotib qoladi. Bunday shisha.
Bundan tashqari, suvni sovutishingiz mumkin. Tuman tomchilari qattiq sovuqlarda ham muzlamasligi mumkin. Agar moddaning kristali, urug'i o'ta sovutilgan suyuqlikka tashlansa, darhol kristallanish boshlanadi.
Nihoyat, ko'p hollarda kechiktirilgan kristallanish silkinish yoki boshqa yo'llar bilan boshlanishi mumkin tasodifiy hodisalar. Masalan, kristalli glitserin birinchi marta tashish paytida olinganligi ma'lum temir yo'l. Ko'zoynak uzoq vaqt turgandan so'ng kristallanishni boshlashi mumkin (texnologiyada aytilganidek, devitrifiya yoki "yiqilish").






