Entalpiyani hisoblash. Entalpiya. jismoniy xususiyatlar
Kimyoviy reaksiyalar paytidagi entalpiya oʻzgarishlarini oʻrganadigan kimyo boʻlimi va fazali transformatsiyalar termokimyo deb ataladi. Entalpiyani aniqlash uchun ishlatiladigan eksperimental usul kalorimetriya deb ataladi.
KIMYOVIY REAKSIYADA ENTALPİYA O'ZGARISHI
Ko'pgina kimyoviy reaktsiyalar entalpiyaning o'zgarishi bilan birga keladi. Demak, reaksiya mahsulotlarining umumiy entalpiyasi reaktivlarning umumiy entalpiyasidan farq qiladi. Entalpiyaning o'zgarishi munosabat bilan aniqlanadi
bu yerda reaksiyaga kirishuvchi moddalarning entalpiyasi va mahsulotlarning entalpiyasi. Miqdor ba'zan reaktsiya issiqligi deb ataladi.
Agar mahsulotlarning entalpiyasi reaksiyaga kirishuvchi moddalar entalpiyasidan kichik bo'lsa, reaksiya ekzotermik deb ataladi (5.4-rasm). Reaksiya paytida entalpiyaning pasayishi salbiy qiymatga to'g'ri keladi. Ekzotermik reaksiya jarayonida yo'qolgan energiya birinchi navbatda reaksiya aralashmasiga kiradi. Natijada, reaksiya aralashmasining harorati ko'tariladi. Keyin bu energiya atrof-muhitga o'tadi va nihoyat, reaktsiya to'liq tugagach, reaktsiya aralashmasining harorati yana pasayadi.
Agar mahsulotlarning entalpiyasi reaktivlarning entalpiyasidan katta bo'lsa, reaktsiya endotermik deyiladi. Reaksiya vaqtida entalpiyaning ortishi ijobiy AH qiymatiga to'g'ri keladi. Reaksiya jarayonida yutilgan energiya birinchi navbatda reaksiya aralashmasidan olinadi. Natijada reaksiya aralashmasining harorati pasayadi. Hozirgi vaqtda atrof-muhit harorati reaksiya aralashmasidan yuqori bo'lganligi sababli, issiqlik energiyasi muhitdan reaksiya aralashmasiga o'tadi va oxir-oqibat, reaktsiya tugagach, reaktsiya aralashmasining harorati yana ko'tariladi.
Moddaning hosil bo'lishining standart entalpiyasi (issiqligi). oddiy moddalardan standart sharoitda 1 mol kimyoviy birikma hosil boʻlish reaksiyasining issiqlik effektidir: T=289 K, P=1 atm=101325 Pa.
Shakllanish issiqliklari oddiy moddalar nolga teng.
n i, n j - stoxiometrik koeffitsientlar reaksiya tenglamasida mos keladigan moddalar oldida.
Moddalarning yonishning standart entalpiyalariga (issiqliklariga) ko'ra
Moddaning yonishining standart entalpiyasi (issiqligi). standart sharoitda 1 mol kimyoviy birikmaning toʻliq yonishi reaksiyasining issiqlik effektidir.
![]()
Yuqori oksidlarning (shu jumladan CO 2 va H 2 O) yonish issiqliklari nolga teng deb hisoblanadi.
Termodinamikaning ikkinchi qonuni o'z-o'zidan sodir bo'ladigan jarayonning imkoniyati, yo'nalishi va chuqurligini belgilaydi.
Spontan jarayon - hech qanday tashqi ta'sirlarsiz davom etuvchi va tizimni muvozanat holatiga yaqinlashtiradigan jarayon.
Termodinamik jihatdan qaytariladigan jarayon - tizimda va muhitda o'zgarishsiz oldinga va teskari yo'nalishda davom etadigan jarayon, ya'ni. boshlang'ich holatdan yakuniy holatga o'tish davrida barcha oraliq holatlar muvozanatda bo'ladi.
Muvozanatsiz oraliq holatlar mavjud bo'lganda, jarayon ko'rib chiqiladitermodinamik jihatdan qaytarilmas.
Tabiatda minimal energiyaga ega tizimlar barqarordir. Keyin faqat ekzotermik jarayonlar o'z-o'zidan bo'lishi kerak. Ammo bu unday emas. Bu jarayonning o'z-o'zidan ketishining yana bir mezoni - entropiya (S) mavjudligini anglatadi.
Entropiya -tizimdagi energiya buzilishining o'lchovi, tartibsizlik o'lchovi, issiqlik shaklida tarqaladigan va ishga aylanmaydigan energiya o'lchovi.
Termodinamikaning ikkinchi qonuni (termodinamikaning ikkinchi qonuni):
Jarayonlar o'z-o'zidan sodir bo'lib, tizim va atrof-muhitning umumiy entropiyasining oshishiga olib keladi
Δ S tizim + Δ S muhitlar ≥ 0 yoki Δ S ≥ 0
Entropiyaning fizik ma'nosi:
entropiya - 1 gradus uchun 1 mol moddaning ajraladigan energiya miqdori.
S 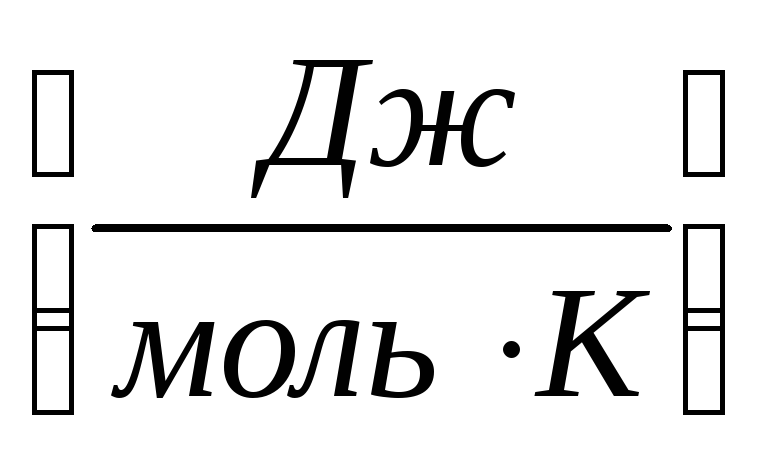
Entropiya keng ko'lamli funktsiyadir. Entropiya massaga mutanosibdir, u 1 mol yoki 1 gramm moddaga tegishli. Bu shuni anglatadiki, tizimning entropiyasi uning tarkibiy qismlarining entropiyalari yig'indisiga teng:
S= 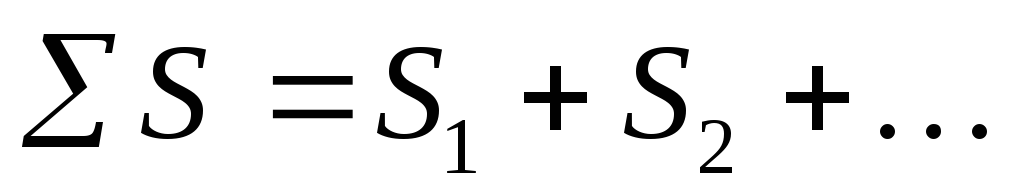
Entropiya tizim holatining funktsiyasidir. Bu shuni anglatadiki  xarakterlaydi tizimi, jarayon emas. Uning o'zgarishi faqat tizimning dastlabki va yakuniy holatiga bog'liq va o'tish yo'liga bog'liq emas:
xarakterlaydi tizimi, jarayon emas. Uning o'zgarishi faqat tizimning dastlabki va yakuniy holatiga bog'liq va o'tish yo'liga bog'liq emas:
Kimyoviy reaktsiya uchun entropiya o'zgarishi: 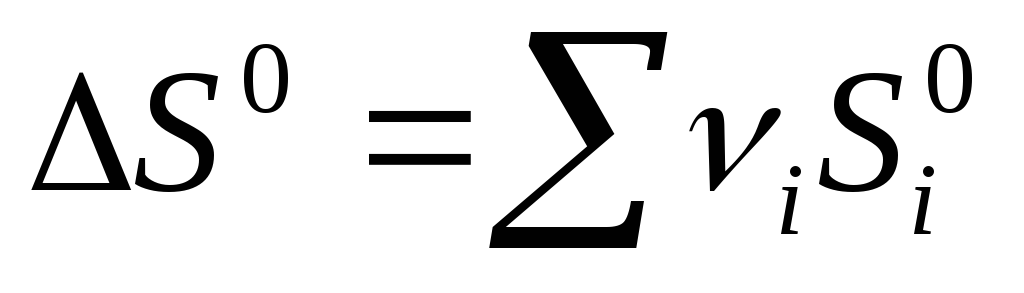 mahsulot -
mahsulot - 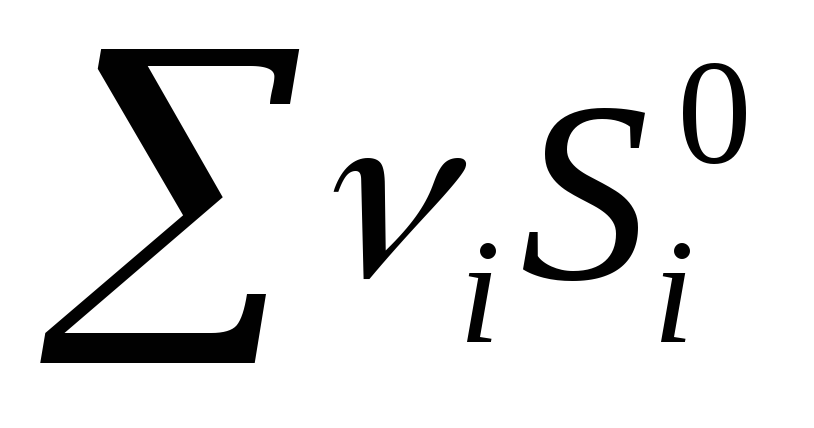 ref
ref
Entropiyaning ehtimollik ma'nosi
Har qanday termodinamik tizim uchun makroholat va mikroholat farqlanadi. Tizimning makroholati makroparametrlar (T, P, V, U va boshqalar) bilan tavsiflanadi. Shu bilan birga, tizim cheksiz miqdordagi mikrozarralardan iborat. Mikroholat - bu alohida molekulalarning joylashishi va energiyasi bu daqiqa vaqt.
Tizimning bir makroskopik holati bir nechta turli mikroholatlar tomonidan amalga oshirilishi mumkin. Har bir mikroholat uchun tizimning ushbu mikroholatda bo'lish ehtimoli (P) mavjud. Shuning uchun termodinamikadagi barcha jarayonlar ehtimollik yoki statistik xususiyatga ega bo'lib, bu tizimning kamroq ehtimollik holatidan ehtimoliy holatga o'tishini belgilaydi.
1896 yilda Boltsmann entropiyaning termodinamik ehtimollik bilan logarifmik bog'liqlik bilan bog'liqligini ta'kidladi.
S = klnV Boltsman tenglamasi
k– Boltsman doimiysi: k= 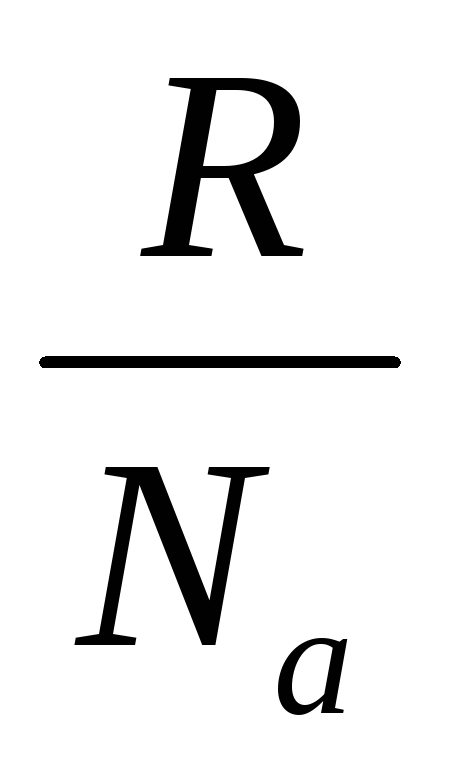 = 1,38∙10 -23 J / daraja;
= 1,38∙10 -23 J / daraja;
W - mikroholatlar soni, ular yordamida bu makrostatni amalga oshirish mumkin: W=1/R;
P - tizimning ushbu mikroholatda bo'lish ehtimoli.
Tizimdagi tartib ortishi bilan ushbu holatni amalga oshirish uchun ishlatilishi mumkin bo'lgan mikroholatlar soni kamayadi va entropiya kamayadi.
Modda gazsimon holatdan suyuq holatga, keyin esa kristall holatga o'tganda entropiya kamayadi. Boltsman tenglamasiga ko'ra, entropiya faqat bitta holatda nolga teng bo'lishi mumkin.
1911 yilda Plank deb nomlanuvchi postulatni ishlab chiqdi termodinamikaning uchinchi qonuni:
sof moddaning (nuqson va aralashmalarsiz) ideal tarzda tuzilgan kristalining mutlaq nolga teng entropiyasi nolga teng.
Ushbu qonun entropiya uchun mos yozuvlar nolni belgilaydi, bu esa uning mutlaq qiymatini hisoblash imkonini beradi, chunki
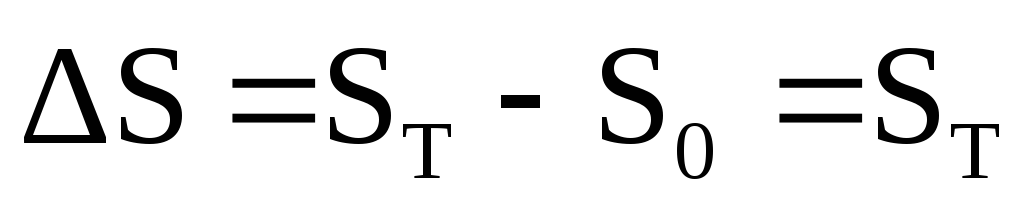
Izolyatsiya qilingan sistemada (U,V=const) entropiya o'z-o'zidan sodir bo'ladigan jarayonda ortadi. Muvozanat holatida entropiya maksimal va doimiydir.
Yopiq va ochiq tizim jarayonning o'z-o'zidan oqimining mezoni - bu qisqartirish Gibbs energiyasi ( G ).
H - entalpiya
T - harorat
S - entropiya
Gibbs energiyasidan foydalanib, termodinamikaning ikkinchi qonunini quyidagicha ifodalash mumkin:
Tizimdagi doimiy harorat va bosim sharoitida faqat Gibbs energiyasining pasayishiga olib keladigan jarayonlar o'z-o'zidan ketadi. Muvozanat holatida Gibbs energiyasi nolga teng.
∆G≤0 (p, T=const)
∆G da<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 teskari yo'nalishda
∆G=0 reaksiya muvozanatda.
Gibbs energiyasining o'zgarishi bilan berilgan
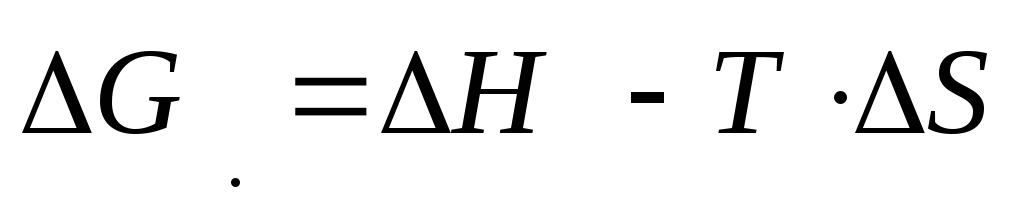
Birinchi atama deyiladi entalpiya omili, ikkinchisi - entropiya omili. Gibbs energiyasining kamayishi va demak, jarayonning o'z-o'zidan ketishiga ∆H ning kamayishi (issiqlik ajralib chiqadigan jarayonlar) va entropiyaning oshishi (tizimdagi tartibsizlikning kuchayishi bilan bog'liq jarayonlar) yordam beradi.
Gibbs standart energiyasi kimyoviy reaksiya jadval ma'lumotlari yordamida formula bo'yicha hisoblanadi:
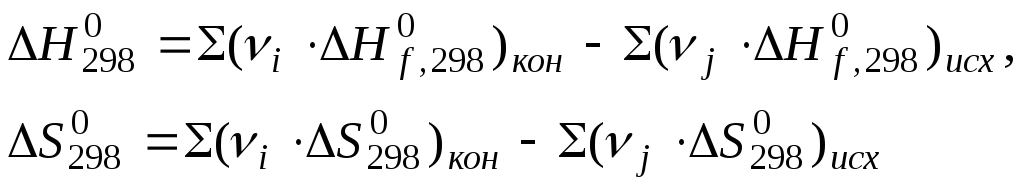
Ekzergonik jarayonlar - kimyoviy reaktsiyalar, buning natijasida Gibbs energiyasi kamayadi va tizim ishlaydi.
Energonik jarayonlar - kimyoviy reaksiyalar, buning natijasida Gibbs energiyasi ortadi va tizimda ish bajariladi.
Masalan, qondagi glyukozaning oksidlanishi ekzergonik jarayondir, chunki u kamayishi bilan birga keladi. Gibbs energiyasi va bu reaktsiya natijasida organizmda turli xil ishlarni bajarish mumkin.
2-ilova: O'z-o'zini nazorat qilish uchun savollar
Kimyoviy termodinamika nimani o'rganadi?
Davlat parametrlari nima?
Intensiv va keng ko'lamli parametrlar o'rtasidagi farq nima?
Qanday funktsiyani holat funksiyasi deb atash mumkin?
Ta'riflar bering ichki energiya, issiqlik, ish.
Termodinamik tizimlarning qanday turlarini bilasiz? Farqi nimada?
Termodinamik jarayonlarning qanday turlari mavjud?
Termodinamikaning birinchi qonunini ayting.
Entalpiya, moddaning hosil bo'lishining standart entalpiyasi, moddaning yonishning standart entalpiyasi atamalarini aniqlang.
Reaksiyaning standart entalpiyasi nimaga teng? Uni hisoblashning qanday usullari ma'lum?
Gess qonunini tuzing.
Termodinamikaning ikkinchi qonunini ayting. U nimani bashorat qiladi?
Termodinamik ma'noda qaytar va qaytmas jarayonlar.
Entropiya tushunchasiga ta'rif bering.
Gibbs energiyasi. Izolyatsiya qilingan va spontan jarayonlarning yo'nalishini prognozlash yopiq tizimlar; entalpiya va entropiya omillarining roli.
Termodinamik muvozanat sharoitlari.
Moddaning hosil bo'lishining standart Gibbs energiyasi qanday? standart energiya Moddaning Gibbs biologik oksidlanishi, reaksiyaning standart Gibbs energiyasi?
Organizmda sodir bo'ladigan ekzergonik va endergonik jarayonlar tushunchasini, energiya konjugatsiya tamoyilini tushuntiring.
3-ilova: amaliyot testi
Termodinamik tadqiqotlar:
a) issiqlik va energiya munosabatlari;
b) kimyoviy jarayonlarning tezligi;
v) kimyoviy birikmalarning asosiy sinflarining xossalari;
Entropiya - bu ...
b) ishni bajarish qobiliyati;
v) tizimdagi tartibsizlik o'lchovi;
3) Termodinamikaning birinchi qonuni quyidagicha tavsiflanadi:
a) termodinamik sistemaning entropiyasi;
b) ichki energiya, issiqlik va ish o'rtasidagi munosabat;
v) moddalarning dinamik qovushqoqligi.
4) Jarayonlar o'z-o'zidan davom etadi va quyidagilar bilan birga keladi:
a) energiyaning pasayishi;
b) entropiyaning kamayishi;
c) entropiyaning ortishi.
5) Yopiq tizim quyidagilar bilan tavsiflanadi:
a) materiya va energiya almashinuvining etishmasligi;
b) energiya almashinuvining yo'qligi;
c) metabolizmning yo'qligi;
Javoblar: 1a, 2c, 3b, 4c, 5c
4-ilova: Vaziyat vazifalari
Reaksiyaning issiqlik effektini hisoblang
Entalpiya
yoki du + pdv = di - vdp.
dq = di - vdp
dq p = di. (86)
Har qanday jarayonda entalpiyaning o'zgarishi faqat tananing boshlang'ich va oxirgi holatlari bilan belgilanadi va jarayonning xususiyatiga bog'liq emas.
Entropiya holat funktsiyasidir, shuning uchun uning termodinamik jarayondagi o'zgarishi faqat holat parametrlarining boshlang'ich va yakuniy qiymatlari bilan belgilanadi. Asosiy termodinamik jarayonlarda entropiya o'zgarishi:
izoxorikda
izobarda
vizotermik
adiabatikada
politropikda
MEHNAT ORGANINING ICHKI ENERGIYASI, Jismoniy ma'nosi va o'lchovliligi.
Ichki energiya- bu tananing yoki jismlar tizimidagi barcha energiya.Bu energiya yig'indisi sifatida ifodalanishi mumkin ba'zi turlari energiyalar: molekulalarning kinetik energiyasi, shu jumladan translatsiya energiyasi va aylanish harakati molekulalar va tebranish harakati molekuladagi atomlar; elektron energiya; yadro ichidagi energiya; molekula yadrosi va elektronlar o'rtasidagi o'zaro ta'sir energiyalari; potentsial energiya yoki har qanday tashqi kuchlar sohasidagi molekulalarning pozitsiyasining energiyasi; elektromagnit nurlanish energiyasi.
Tananing umumiy ichki energiyasi odatda belgilanadi U (J), va o'ziga xos ichki energiya u (J/kg).
Ichki energiya:
Ichki qayerda kinetik energiya molekulalar, molekulalarning ichki potentsial energiyasi, integratsiya doimiysi.
Texnik termodinamikada faqat ichki energiyaning kinetik va potentsial komponentlari o'zgargan jarayonlar ko'rib chiqiladi.
Cheksiz kichik holatdagi har qanday jarayon uchun ideal gazning ichki energiyasining o'zgarishi (1 kg uchun)
Issiqlik hisob-kitoblarida odatda uning mutlaq qiymatini emas, balki ichki energiyaning o'zgarishini bilish talab qilinadi; shuning uchun mos yozuvlar nuqtasi (0 K yoki 0 0 C) uchun yakuniy natija() ahamiyati yo'q.
o'rtacha massa issiqlik sig'imi qayerda doimiy hajm ichida
Shunday qilib, har qanday jarayon uchun ideal gazning ichki energiyasining o'zgarishi doimiy hajmdagi o'rtacha issiqlik sig'imi va gazning harorat farqi ko'paytmasiga teng.
JARAYONLAR ORQALIK VA QAYTIB MUMKIN. MUVOZANAT VA MUVOZANAT EMAS
Termodinamik jarayon - bu ishchi suyuqlikning energiya bilan o'zaro ta'siri natijasida yuzaga keladigan jism holatining ketma-ket o'zgarishi. muhit.
Qaytariladigan va qaytarilmaydigan termodinamik jarayon tushunchalari sistemaning muvozanati bilan chambarchas bog'liq. Atrof-muhit bilan issiqlik almashinuvi bo'lmagan shunday termodinamik tizimni ko'rib chiqaylik (adiabatik termodinamik tizim). Bunday tizimda sodir bo'ladigan termodinamik jarayonlar, agar tizimga atrof-muhitning qo'shimcha issiqlik ta'sirisiz to'g'ridan-to'g'ri va teskari jarayonlarda tizim o'zining dastlabki holatiga qaytsa, teskari deyiladi. Agar teskari jarayonda tizim asl holatiga qaytolmasa yoki bu issiqlik ta'minotini talab qilsa, unda bunday jarayon qaytarilmas deb ataladi.
Bosim va haroratning har bir o'zgarishi bilan jarayon faqat termodinamik tizimning bir nuqtasidan nuqtasigacha bo'lgan butun jarayon davomida bosim doimiy bo'lsa va har bir nuqtadagi harorat atrof-muhit haroratiga teng bo'lsa yoki ularning farqi cheksiz kichik bo'lsa, teskari bo'lishi mumkin. .
qaytariladigan termodinamik jarayonlar ideal yoki nazariy holatdir. Barcha real jarayonlar qaytarilmasdir, chunki amalda kvazistatik shartni bajarish qiyin. Bundan tashqari, jarayonlarning qaytarilmasligi ishchi suyuqlikda ichki ishqalanish va texnik jihozlarda sirt ishqalanishi (ko'krakdagi oqim, piston sirtining silindr devoriga ishqalanishi va boshqalar) tufayli yuzaga keladi. Ishqalanishni engish uchun har doim jarayon davomida issiqlikka aylanadigan mexanik ishlarning bir qismini sarflash kerak.
ISHLAB CHIQARISH ORTANI ISSIQLIK IMKONI
issiqlik sig'imi Har qanday miqdoriy birlikning haroratini 1 ° C ga oshirish uchun tanaga (gazga) berilishi kerak bo'lgan issiqlik miqdorini ayting.
Yuqorida sanab o'tilgan issiqlik quvvatlarining qiymatlarini aniqlash uchun ulardan birining qiymatini bilish kifoya. Molyar issiqlik sig'imi, keyin massa issiqlik sig'imi qiymatiga ega bo'lish eng qulaydir:
va hajmli issiqlik sig'imi:
Volumetrik va massa issiqlik sig'imlari o'zaro bog'liqlik bilan bog'liq:
normal sharoitda gaz zichligi qayerda.
Gazning issiqlik sig'imi uning haroratiga bog'liq. Shu asosda ajratib turadi o'rtacha va haqiqiy issiqlik sig'imi.
Agar q- dan gaz harorati o'zgarganda gaz miqdori birligiga bildirilgan (yoki undan olingan) issiqlik miqdori t1 oldin t2 keyin
O'zida aks ettiradi o'rtacha issiqlik quvvati ichida. Bu nisbatning chegarasi, harorat farqi nolga moyil bo'lganda, deyiladi haqiqiy issiqlik sig'imi.
IZOHORIK GAZ JARAYONI
Izoxorik jarayon- gazning doimiy hajmida aloqa qilish yoki issiqlikni olib tashlash jarayoni (v= const).
Doimiy hajmda gaz bosimi mutlaq haroratlarga to'g'ridan-to'g'ri mutanosib ravishda o'zgaradi:
Gazning tashqi ishi v= const nolga teng l=0.
issiqlik miqdori yoki gazning ichki energiyasining o'zgarishi:
Izokorik jarayon pv - diagramma to'g'ri vertikal chiziq bilan ko'rsatiladi - izoxora. Ijobiy issiqlik miqdori bilan chiziq pastdan yuqoriga o'tadi.
Entropiya o'zgarishi:
IZOBARIK GAZ JARAYONI.
Izobarik jarayon - doimiy bosim ostida aloqa qilish yoki issiqlikni olib tashlash jarayoni (R = const)
Jarayon egri chizig'i izobar deb ataladi.
Chunki izobarik jarayonda dp=0 u holda tizimda hech qanday texnik ish bajarilmaydi va tanani 1-holatdan 2-holatga o'tkazish uchun zarur bo'lgan issiqlik miqdori quyidagicha aniqlanadi:
Demak, izobarik termodinamik jarayonda tanaga berilgan (olib tashlangan) issiqlik miqdori bu jarayonda entalpiyaning o‘zgarishiga mutanosib bo‘ladi.Bu xulosa, sistema termodinamik muvozanatda bo‘lishi sharti bilan, qaytar va qaytmas jarayonlar uchun ham amal qiladi. jarayonning boshlanishi va oxiri.
Qaytariladigan jarayon uchun:
izobarik jarayon pv- diagramma to'g'ri gorizontal chiziq sifatida ko'rsatiladi. Jarayonga issiqlik qo'shilsa, chiziq chapdan o'ngga cho'ziladi.
Bunday jarayonda mexanik ish:
Maxsus bir martalik (foydali) tashqi ish:
Maxsus ichki energiyaning o'zgarishi:
Ideal gazning holat tenglamasidan izobar jarayon uchun quyidagi munosabatni olish mumkin:
Shunday qilib, izobarik jarayonda ideal gazning hajmi ga proportsionaldir mutlaq harorat. Gaz kengayganida harorat ko'tariladi, siqilganda esa pasayadi.
Izobarik jarayonda entropiyaning o'zgarishini quyidagicha hisoblash mumkin:
ADIABATIK GAZ JARAYONI.
Issiqlikni etkazib berish va olib tashlashsiz davom etadigan jarayon, ya'ni. muhit bilan issiqlik almashinuvi bo'lmasa, adiabatik, bu jarayonning egri chizig'i esa adiabatik deb ataladi. Jarayon shartlari: dq=0 , q=0.
Chunki dq=0, keyin termodinamikaning birinchi qonuniga ko'ra:
Shunday qilib, adiabatik termodinamik jarayonda ishchi organ tomonidan bajariladigan mexanik ish tananing ichki energiyasining kamayishiga teng, texnik ish esa entalpiyaning o'zgarishi (kamayishi) bilan proporsionaldir. Qaytariladigan diabatik jarayonda termodinamik tananing entropiyasi o'zgarmaydi: S = Const.
Koordinatalar sistemasidagi adiabatik tenglama pv- Ideal gaz uchun doimiy issiqlik sig'imidagi () diagrammalar: adiabatik ko'rsatkich bu erda
Jarayonning boshlang'ich va yakuniy parametrlari orasidagi bog'liqliklar: orasida R va v ,
orasida T va v
orasida R va T
1 kg gazning ishi quyidagi formulalar bilan topiladi
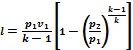
Gazning ichki energiyasining o'zgarishi va adiabatik jarayonning ishi kattaligi bo'yicha teng va ishorasi bo'yicha qarama-qarshidir. .
Adiabatik jarayonda ideal gazning ichki energiyasining o'zgarishini tenglama bilan ham ifodalash mumkin
Termodinamikaning ikkinchi qonuni
Termodinamikaning ikkinchi qonuni tabiatdagi o'z-o'zidan sodir bo'ladigan issiqlik jarayonlari oqimining yo'nalishini belgilaydi va issiqlikni ishga aylantirish shartlarini belgilaydi. Qonunda aytilishicha, tabiatdagi issiqlik o'z-o'zidan faqat issiqroq jismlardan kamroq issiqqa o'tadi.
Termodinamikaning ikkinchi qonuniga muvofiq, har qanday issiqlik dvigatelida issiqlikni ishga aylantirish uchun ikkita jismga ega bo'lish kerak. turli haroratlar. Issiqroq tana ish uchun issiqlik manbai bo'ladi, kamroq isitiladigan tana issiqlik qabul qiluvchi bo'ladi. Bunday holda, issiqlik dvigatelining samaradorligi har doim birlikdan kamroq bo'ladi.
Dinamikaning ikkinchi qonunini matematik tarzda ifodalash mumkin:
Qayerda dS- tizim entropiyasining cheksiz kichik o'sishi;
dQ- issiqlik manbasidan tizim tomonidan qabul qilingan issiqlikning cheksiz miqdori;
T- issiqlik manbasining mutlaq harorati.
Tengsizlik belgisi qaytarilmas jarayonlarga mos keladi va qaytariladigan jarayonlarga teng. Demak, cheksiz kichik teskari jarayon uchun termodinamikaning ikkinchi qonuni uchun analitik ifoda shaklni oladi.
va beri termodinamikaning birinchi qonuniga ko'ra
dQ=dU+pdV
TdS=dU+pdV.
Karno sikli va uning xossalari.
Karno sikli. Ikki izoterm va ikkita adiabadan iborat. Bu sikl ikkita issiqlik manbasi: isitgich va muzlatgich ishtirokida ideal issiqlik dvigatelida ishlaydigan suyuqlik tomonidan amalga oshiriladigan yopiq jarayondir.
Karno sikli pv-diagramma
1-2 va 3-4 jarayonlar izotermik, 2-3 va 4-1 jarayonlar esa adiabatik. Tsikldagi ishchi suyuqlikning boshlang'ich harorati isitgichning haroratiga teng deb hisoblanadi T1. 1-holatdan 2-holatga izotermik kengayish jarayonida ishchi suyuqlik isitgichdan issiqlik miqdorini oladi. q 1 haroratda T1. 2-3 bo'limda ishchi suyuqlik adiabatik ravishda kengayadi. Shu bilan birga, ishchi suyuqlikning harorati dan kamayadi T1 oldin T2 dan bosim tushadi p2 oldin p 3. 3-4 izoterm bo'ylab siqilganida, issiqlik miqdori ishchi suyuqlikdan sovutgichga chiqariladi. q2 haroratda T2.Keyinchalik adiabatik siqilish4-1 dan ishchi suyuqlik haroratining oshishiga olib keladi T2 oldin T1, va ishchi suyuqlik asl holatiga qaytadi.
Umumiy tsikl ishi l c grafik jihatdan 12341 maydon bilan ifodalangan.
Termal aylanish samaradorligi:
Karno siklining ishi
Issiqlik samaradorligi tsikl:
Doimiy hajmdagi issiqlik ta'minoti bilan tsikl ikkita adiabat va ikkita izoxoradan iborat
Tsikl xususiyatlari:
Siqish nisbati
Bosim nisbati
Berilgan issiqlik miqdori:
Chiqarilgan issiqlik miqdori:
Velosiped ishi
Issiqlik samaradorligi tsikl:
Doimiy bosim ostida issiqlik ta'minoti bilan ishlaydigan tsikl ikkita adiabadan, bitta izobar va bitta izoxoradan iborat.
Tsikl xususiyatlari:
Siqish nisbati
Oldindan kengayish darajasi.
Berilgan issiqlik miqdori:
Chiqarilgan issiqlik miqdori:
Velosiped ishi
Issiqlik samaradorligi tsikl:
Kombinatsiyalangan issiqlik ta'minoti bilan tsikl ikkita adiaba, ikkita izoxora va bitta izobardan iborat
Tsikl xususiyatlari
Berilgan issiqlik miqdori
Olib tashlangan issiqlik miqdori
Issiqlik samaradorligi tsikl
Suv bug'lari jadvallari.
o'ta qizdirilgan bug ' yoki ularning xossalari bo'yicha to'yingan bug'dan sezilarli darajada farqlanadi ideal gazlar. Bug'larning holati uchun tenglamalar juda murakkab va hisoblash amaliyotida qo'llanilmaydi. Amaliy maqsadlarda eksperimental va nazariy ma'lumotlar asosida tuzilgan jadval va diagrammalardan foydalaniladi. Jadvallar o'ta qizib ketgan va yuqori darajada aniqlik bilan tuzilgan to'yingan bug'lar 1000 0 S haroratgacha va 98,0 MPa bosimga ega.
Jadvallarda to'yingan bug ' to'yingan haroratlar, bosimlar, qiymatlar aniq hajmlar, suyuq va quruq bug'ning entalpiyasi va entropiyasi, bug'lanish issiqligi. Haddan tashqari qizdirilgan bug 'jadvallarida asosiy parametrlarning qiymatlari turli bosim va haroratlar uchun berilgan: o'ziga xos hajm, entalpiya va entropiya.
i - suv bug'ining sdiagrammasi.
buyuk hurmat hisoblanadi diagramma shundan iboratki, texnik ish va jarayonlarga jalb qilingan issiqlik miqdori maydonlar emas, balki chiziq segmentlari bilan ifodalanadi. Qurilish paytida is-diagrammalar y o'qi bo'ylab chizilgan maxsus entalpiya juft va abscissa bo'ylab o'ziga xos entropiya. Koordinatalarning kelib chiqishi suvning uch nuqtadagi holati sifatida qabul qilinadi, bu erda , .
Suv bug'lari jadvallari ma'lumotlaridan foydalanib, suyuqlik va bug'ning chegaraviy egri diagrammada bir-biriga yaqinlashib, chizilgan. tanqidiy nuqta K. suyuqlikning chegara egri chizig'i kelib chiqishini tark etadi, chunki. bu nuqtada entropiya va entalpiya nolga teng qabul qilinadi. Suvning holati tegishli izobarlarda nuqtalar bilan belgilanadi. Nam bug 'hududidagi izobar chiziqlar suyuqlik chegarasi egri chizig'idan chiqadigan to'g'ri qiyshaygan chiziqlardir. Izobarik jarayonda:
Nishab diagrammaning har bir nuqtasida izobarning abscissa o'qiga qiyaligi son jihatdan berilgan holatning mutlaq haroratiga teng. Chunki nam bug 'sohasida izobar izotermga to'g'ri keladi, keyin oxirgi tenglamaga ko'ra, nam bug'ning izobari to'g'ri chiziqlardir:
Va bu to'g'ri chiziqning tenglamasi. Haddan tashqari qizib ketgan bug 'hududida izobarlar pastga yo'naltirilgan qavariq bilan egrilikka ega. Nam bug 'sohasida doimiy bug'ning quruqligi (x = const) chiziqlari panjarasi qo'llaniladi, ular K kritik nuqtada yaqinlashadi.
Nam bug 'hududidagi izotermlar izobarlar bilan mos tushadi. Haddan tashqari qizib ketgan bug 'sohasida ular bir-biridan ajralib turadi: izobarlar yuqoriga ko'tariladi va izotermlar yuqoriga qarab konveksli egri chiziqlardir. Diagrammaga izoxoralar panjarasi qo'llaniladi, ular izobarlarga nisbatan ancha tik ko'tariladigan egri shaklga ega. Qaytariladigan adiabatik jarayon vertikal to'g'ri chiziq bilan ifodalanadi. Izobar ostidagi maydon uch nuqta bug + muz aralashmasi holatini tasvirlaydi.
Suv bug'ining adiabatik jarayoni. Tasvirni qayta ishlash p–V , i-S va T–S diagrammalar.
Adiabatik jarayon issiqlik ta'minoti va olib tashlanishisiz sodir bo'ladi va teskari jarayonda ishchi suyuqlikning entropiyasi saqlanib qoladi. doimiy qiymat: s=const. Shuning uchun, on hisoblanadi va Ts- adiabatik diagrammalar vertikal to'g'ri chiziqlar bilan tasvirlangan: rasm. a va b
Adiyabatik kengayish jarayonida bug'ning bosimi va harorati pasayadi; qizib ketgan bug 'quruq, keyin esa aylanadi nam bug '. Entropiyaning doimiylik shartlaridan, agar dastlabki va yakuniy holatlarning bir parametri ma'lum bo'lsa, bug'ning yakuniy parametrlarini aniqlash mumkin.
Ustida pv- diagrammada teskari adiabatik jarayon ma'lum bir egri chiziq bilan tasvirlangan (v-rasm).
Adiabatik jarayondagi o'ziga xos ish quyidagi tenglamadan aniqlanadi:
Maxsus ichki energiyaning o'zgarishi:
Kompressorda ko'p bosqichli siqish.
Yuqori bosimli gaz ishlab chiqarish uchun ko'p bosqichli kompressorlardan foydalaniladi
bunda gazni siqish politropik ravishda har bir siqilishdan keyin uning oraliq sovutilishi bilan ketma-ket bog'langan bir nechta tsilindrlarda amalga oshiriladi.
Bir nechta tsilindrlarda gazni siqishdan foydalanish ularning har birida bosim nisbatini pasaytiradi va hajmli samaradorlikni oshiradi. kompressor. Bundan tashqari, har bir bosqichdan keyin gazni oraliq sovutish silindrdagi pistonning moylash sharoitlarini yaxshilaydi va kompressor haydovchisi uchun energiya sarfini kamaytiradi.
uch bosqichli kompressorning ideal indikator diagrammasi, bu erda 0-1 birinchi bosqichga assimilyatsiya chizig'i;
1-2 - birinchi bosqichda politropik siqish jarayoni; 2-a - birinchi bosqichdan birinchi sovutgichgacha bo'lgan inyeksiya liniyasi; a-3 - ikkinchi bosqichga assimilyatsiya liniyasi; 3-4 - ikkinchi bosqichda politropik siqish jarayoni; 4-c - ikkinchi bosqichdan ikkinchi sovutgichga tushirish liniyasi; c-5 - uchinchi bosqichga assimilyatsiya liniyasi; 5-6 - uchinchi bosqichda politropik siqish jarayoni; 6-c - uchinchi bosqichdan tankga yoki ishlab chiqarishga qarshi quyish liniyasi. 2-3, 4-5 segmentlarda jarayonda gaz hajmining pasayishi tasvirlangan doimiy bosim birinchi va ikkinchi sovutgichlarda sovutishdan. Barcha sovutgichlarda ishchi suyuqlikni sovutish dastlabki T 1 ga teng bo'lgan bir xil haroratda amalga oshiriladi, shuning uchun 1, 3 va 5 nuqtalarda gaz harorati bir xil va 1 - 7 izotermasida yotadi.
Barcha bosqichlardagi bosim nisbati odatda bir xil qabul qilinadi:
Barcha bosqichlarda bir xil bosim nisbati bilan, boshlang'ich haroratlarning tengligi va politropik ko'rsatkichlarning tengligi, kompressorning alohida bosqichlarida oxirgi gaz harorati bir-biriga teng: l k \u003d 3l 1
Xuddi shu gazni siqish sharoitida alohida bosqichlarda gazdan chiqarilgan issiqlik miqdori bir-biriga teng:
Izobarik sovutish jarayonida har qanday sovutgichdagi gazdan chiqarilgan issiqlik quyidagi formula bo'yicha topiladi:
DA Ts- Chizmalarda adiabatik siqilish jarayonlari 1-2, 3-4, 5-6 to'g'ri chiziqlar bilan, sovutish jarayonlari esa 2-3, 4-5, 6-7 egri chiziqlar bilan ko'rsatilgan.
Politropik siqish jarayonlari 1-2, 3-4, 5-6 egri chiziqlar bilan, sovutgichlarda sovutish jarayonlari - 2-3, 4-5, 6-7 chiziqlar bilan ko'rsatilgan.
Yonish bilan ICE davri V=const
Rasmda doimiy hajmda tez yonadigan yoqilg'i bilan ishlaydigan dvigatelning indikator diagrammasi ko'rsatilgan. Yoqilg'i sifatida benzin, yorug'lik yoki generator gazi, spirtli ichimliklar va boshqalar ishlatiladi.
Piston chap o'lik holatdan o'ta o'ngga harakat qilganda, yonuvchi aralashma assimilyatsiya klapanidan so'riladi. Bu jarayon assimilyatsiya chizig'i deb ataladigan 0-1 egri bilan tasvirlangan, bu termodinamik jarayon emas, chunki. unda asosiy parametrlar o'zgarmaydi, faqat silindrdagi aralashmaning massasi va hajmi o'zgaradi. Piston orqaga qaytganda, assimilyatsiya valfi yopiladi va yonuvchi aralash siqiladi. Siqish chizig'i deb ataladigan 1-2 egri tomonidan tasvirlangan. 2-nuqtada yonuvchi aralashma elektr uchqunidan alangalanadi. Yonuvchan aralashmaning yonishi deyarli bir zumda sodir bo'ladi, ya'ni. deyarli doimiy hajmda. Bu jarayon 2-3 egri chiziq bilan tasvirlangan. Yoqilg'i yonishi natijasida gaz harorati keskin ko'tariladi va bosim oshadi (3-band). Keyin yonish mahsulotlari kengayadi. Piston to'g'ri o'lik holatiga o'tadi va gazlar foydali ish qiladi. Ko'rsatkich diagrammasida kengayish jarayoni kengayish chizig'i deb ataladigan 3-4 egri chiziq bilan tasvirlangan. 4-bandda egzoz valfi ochiladi va silindrdagi bosim deyarli tashqi bosimga tushadi. Pistonning o'ngdan chapga keyingi harakati bilan yonish mahsulotlari atmosfera bosimidan bir oz yuqori bosim ostida egzoz valfi orqali silindrdan chiqariladi. U 4-0 egri shaklida tasvirlangan va egzoz chizig'i deb ataladi. Bunday ish jarayoni pistonning to'rtta zarbasida yoki milning ikki aylanishida yakunlanadi. Bunday dvigatellar to'rt taktli deb ataladi.
Doimiy hajmdagi issiqlik ta'minoti bilan tsikl ikkita adiabat va ikkita izoxoradan iborat
Tsiklning xususiyatlari quyidagilardan iborat:
- siqish nisbati
- bosimning ko'tarilish darajasi
Berilgan issiqlik miqdori:
Chiqarilgan issiqlik miqdori:
Velosiped ishi
Issiqlik samaradorligi tsikl:
Yonish bilan ICE davri p=const
Doimiy hajmda issiqlik etkazib berish davrlarini o'rganish shuni ko'rsatdiki, ushbu tsikl bo'yicha ishlaydigan dvigatelning samaradorligini oshirish uchun yuqori siqish nisbatlarini qo'llash kerak. Yuqori siqilishdagi havo shunday yuqori haroratga egaki, silindrga etkazib beriladigan yoqilg'i o'z-o'zidan yondirgichlarsiz yonadi. Havo va yoqilg'ining alohida siqilishi har qanday suyuq og'ir va arzon yoqilg'idan foydalanishga imkon beradi - moy, mazut, qatronlar, ko'mir moylari.
Bu afzallik doimiy bosim ostida yoqilg'ining asta-sekin yonishi bilan ishlaydigan dvigatellarga ega. Ularda havo dvigatel tsilindrida siqiladi va suyuq yoqilg'i kompressordan siqilgan havo bilan püskürtülür.
Doimiy bosimda yoqilg'ining asta-sekin yonishi bilan ideal vosita aylanishi, ya'ni. doimiy bosimda issiqlik ta'minoti bilan tsikl quyidagicha amalga oshiriladi.
Dastlabki parametrlarga ega gazsimon ishlaydigan suyuqlik p 1, v 1, T 1 adiabatik 1-2 bo'ylab qisqaradi; keyin 2-3 izobar bo'ylab tanaga ma'lum miqdorda issiqlik beriladi q 1. 3-banddan boshlab ishchi organ adiabatik 3-4 bo'ylab kengayadi. 4-1 izoxoraga ko'ra, ishchi suyuqlik asl holatiga qaytadi, issiqlik esa issiqlik qabul qiluvchiga chiqariladi. q2.
Tsikl xususiyatlari:
Issiqlik quvvati nisbati
qayerda k adiabatik indeks hisoblanadi.
"Sovutish koeffitsienti" tushunchasi
Ishlash koeffitsienti ishning energiya samaradorligini tavsiflovchi o'lchovsiz qiymat (odatda birdan kattaroq). sovutish mashinasi; amalga oshirish uchun vaqt birligi uchun sarflangan energiya (ish) miqdoriga sovutish quvvati nisbati teng sovutish aylanishi. U mashina ishlaydigan sovutish davrining turiga, uning asosiy elementlarining mukammalligiga qarab belgilanadi va xuddi shu mashina uchun uning ishlashining harorat sharoitlariga bog'liq.
Teskari Karno siklida ishlaydigan ideal sovutgichning ishlash koeffitsienti:
qayerda T min va Tmax mos ravishda past va yuqori harorat tsiklda.
Havo sovutgichining sovutish koeffitsienti (rasm),
qayerda T1 va T2 mos ravishda adiabatik siqilishning boshi va oxiri temperaturalari;
T3 va T4 ekspanderdagi adiabatik kengayishning boshi va oxiri haroratlari.
Bug'ni qayta isitish
Bug 'turbinasi qurilmasining ishlashini o'rganish shuni ko'rsatadiki, dastlabki bosimning oshishi va oxirgi bosimning pasayishi uning oshishiga olib keladi. sikl samaradorligi. Biroq, dastlabki bosimning bir marta ortishi bug'ning oxirgi namligini oshiradi. Kengayish ortishi oxirida bug 'namligini kamaytirish uchun boshlang'ich harorati uning. Turbinaning chiqishida bug'ning quruqlik darajasini oshirish usullaridan biri uning ikkilamchi qizib ketishi hisoblanadi. Boshlang'ich bosim va haroratga ega bo'lgan qozondan o'ta qizib ketgan bug 'bir necha bosqichdan iborat birinchi turbinali silindrga kiradi va u erda ma'lum bir bosimgacha adiabatik ravishda kengayadi. p1. Olingan bug 'maxsus o'ta qizdirgichga chiqariladi, u erda doimiy bosim ostida ikkilamchi qizib ketishga duchor bo'ladi. Keyin u yana turbinaga qaytariladi, u erda bug 'kondenser bosimigacha kengayishda davom etadi.
1-nuqta bug'ning dastlabki holatiga mos keladi; 2-band - ikkilamchi qizib ketishdan keyin turbinadan keyingi bug'ning yakuniy holati. Qayta isitishning kiritilishi natijasida quruqlikning yakuniy darajasi dan ortadi x2 oldin x 1. Bundan tashqari, bug'ning ikkilamchi qizib ketishi ma'lum iqtisodiy samara beradi (2-3%), agar qo'shimcha tsikldagi o'rtacha issiqlik ta'minoti harorati 7-2-2 '-6-7 bilan tsikldagi o'rtacha issiqlik ta'minoti haroratidan yuqori bo'lsa. bitta qizib ketish va ta'sir ko'proq bo'ladi, oraliq qizib ketishning boshlang'ich va oxirgi nuqtalarida harorat qanchalik baland bo'lsa. Kritik va o'ta kritikga yaqin bosimlarda ba'zan ikki yoki undan ortiq oraliq qizib ketish qo'llaniladi. Keyin tsiklning termal samaradorligi
Birinchi va ikkinchi turbina tsilindrlarida adiabatik issiqlik tushishi qayerda;
- qozonga va birinchi super isitgichga beriladigan issiqlik miqdori;
Ikkinchi super isitgichga berilgan issiqlik miqdori.
Maxsus bug 'iste'moli
Entalpiya
Termodinamik jismning entalpiyasi ichki energiya u va mahsulot pv yig'indisidir.
Bu munosabatni farqlab, biz quyidagilarni olamiz: di = du + pdv + vdp ,
yoki du + pdv = di - vdp.
Termodinamikaning birinchi qonuniga asoslanib, dq = du + pdv, oxirgi munosabat quyidagicha qayta yoziladi:
dq = di - vdp yoki dq = dh + dl t,
Bu erda dl t - texnik ish differensial (dl t = - vdp).
Olingan tenglama, shuningdek, entalpiya va texnik ish tushunchalaridan foydalangan holda termodinamikaning birinchi qonunining ikkinchi formulasi hisoblanadi.
i qiymatini avval kiritilgan p, v, T va bilan birga termodinamik jism holatining parametri sifatida ham ko'rib chiqish mumkin. jismoniy ma'no i tenglama asosida tushuntirish mumkin dq = di - vdp, bu jarayon uchun p =const quyidagicha yoziladi:
dq p = di. (86)
Bundan kelib chiqadiki, di doimiy bosim jarayonida termodinamik jismga beriladigan issiqlikning elementar miqdoridir.
BOB 3. Termodinamik potensiallar
§ 3.2. Entalpiya
Termodinamikada ishlash. Belgilarning termodinamik qoidasi. Issiqlik izolyatsiyalangan korpuslar. Davlat funktsiyalari.
Termodinamik potensiallar.
Izoxorik va izobar jarayonlar. Issiqlik tarkibi yoki entalpiya.
Yopiq tizimlar muvozanatining mezoni sifatida maksimal entropiyadan foydalanishni birinchi marta J.Gibbs 1875-1878 yillardagi termodinamik ishlarida taklif qilgan.Bundan tashqari, termodinamik muvozanat holatini qat'iy mantiqiy ko'rib chiqishni kiritish bilan bir qatorda, u ham taklif qilgan. mexanikadan ma'lum bo'lgan usulni umumlashtiruvchi amaliy matematik hisoblar usullari potentsiallar . O'rganish biz davom etmoqdamiz.
Vujudga qo'llaniladigan tashqi kuchlar uni ishlab chiqarishi mumkin ish , bu mexanikaning umumiy qoidalariga muvofiq kuch vektori va siljishning skalyar mahsuloti sifatida aniqlanadi. Termodinamikada biz barcha ish faqat uning hajmini o'zgartirishga va, demak, faqat ichki energiyasini o'zgartirishga ketadigan holatga qiziqamiz (qarang: formula (2.5.8)). Jismning umumiy energiyasini - uning kinetik yoki umuman potentsial energiyasini o'zgartirish uchun sarflangan ish, yuqorida aytib o'tilganidek, termodinamikada hisobga olinmaydi.
Termodinamikada u qabul qilinadi belgi qoidasi , unga ko'ra bajarilgan ishlar ijobiy hisoblanadi tashqi kuchlar tana ustida - ya'ni tananing ichki energiyasi oshganda. Agar tana o'zining ichki energiyasi tufayli atrof-muhitga ishlasa, u holda bu ish salbiy hisoblanadi. Xuddi shunday, tanaga tashqaridan olingan issiqlik ijobiy, berilgan issiqlik esa salbiy hisoblanadi.
Bosim - bu sirtning birlik maydoniga ta'sir qiluvchi kuch. Keyin oz miqdordagi ish uchun d R , sirt elementini harakatlantirish orqali amalga oshiriladi dσ qisqa masofa uchun dr yozilishi mumkin:
Tanani siqish paytida dV < 0, так что d R > 0.
Agar tana issiqlik izolyatsiyalangan , keyin energiyaning butun o'zgarishi unda ishlab chiqarilgan energiya bilan bog'liq mexanik ish. Umumiy holda, ish bilan bir qatorda, tana energiyani bevosita aloqa qiluvchi jismlardan to'g'ridan-to'g'ri uzatish yoki tanamiz bilan bevosita aloqada bo'lmagan jismlardan nurlanish almashinuvi orqali oladi (yoki beradi). Ichki energiya o'zgarishining bu qismi deyiladi issiqlik miqdori dQ . Shunday qilib, tana energiyasining o'zgarishini quyidagicha yozish mumkin:
Yuqorida ichki energiyaning umumiy differensialligi uchun (2.5.8) munosabat olingan:
Boshqacha qilib aytganda, entropiyaning empirik, fenomenologik ta'rifining ekvivalentligi kamaytirilgan issiqlik va uning kvant-mexanik, ehtimollik talqini.
Boshlang'ich ishlar d R va issiqlik miqdori dQ tananing cheksiz o'zgarishi bilan olingan, umuman emas to'liq farqlar . Faqat miqdor d R + dQ , ya'ni. ichki energiyaning o'zgarishi dU , har doim to'liq farq bor. Boshqacha qilib aytadigan bo'lsak, tananing energiyasini qat'iy ravishda mexanik va issiqlikka bo'lish mumkin emas. Bunday bo'linish zarurati faqat mavjud energiya miqdorini o'zgartirish usullarini aniqlashda paydo bo'ladi. Nisbat natijada issiqlik va ish miqdori aniqlanmagan faqat asosiy va final tana holati va butunlay yo'lga bog'liq. o'tish, ya'ni. jarayonning tabiati. Bu xususiyat bir xil holatda boshlanadigan va tugaydigan yopiq jarayonlarda (sikllarda) eng aniq ko'rinadi. Bu erda ichki energiyaning o'zgarishi nolga teng bo'lib, tana issiqlikni qabul qilishi yoki berishi yoki ishlashi mumkin.
Yopiq siklda o'zgarishi nolga teng bo'lgan funktsiyalar (ya'ni, uning differentsiali to'liq ), deyiladi davlat funktsiyalari yoki potentsiallar . Mexanikada bu kontseptsiyadan olingan bo'lsa, yagona potentsial Gamilton funktsiyasi - kinetik va potentsial energiyalar yig'indisi. Mexaniklardan ko'ra ko'proq termodinamik o'zgaruvchilar mavjud bo'lgani uchun - termodinamikada erkinlik darajasi ko'proq - u holda bir nechta potentsial bo'lishi mumkin. Tabiiyki, termodinamikada ular deyiladi termodinamik potensiallar . Ichki energiya uchun umumiy differensiallik shakliga asoslanib, buni ko'rish mumkin U hisoblanadi termodinamik potentsial o'zgaruvchilar haqida S va V .
Bir muddat hisob-kitoblarni soddalashtirish uchun biz haqiqiy jismlar har xil turdagi zarralardan iborat ekanligidan chetga chiqamiz. Keyin ichki energiya bog'liq bo'lgan termodinamik o'zgaruvchilar faqat bo'ladi to'rtta . Bu hajm V , bosim P , harorat T va entropiya S . Ularning har qanday juftligi ulardan mustaqil bo'ladi (e'tibor bering, agar biz kompozitsiyani hisobga olsak, unda uchta mustaqil o'zgaruvchi bo'ladi). Shuning uchun, ikkita mos keladigan o'zgaruvchining qiymatlarida ba'zi termodinamik potentsialni bilib, potentsiallarning xususiyatlaridan foydalanib, qolgan ikkita o'zgaruvchining va boshqa barcha potentsiallarning qiymatlarini (qisman hosilalar orqali) hisoblash mumkin. Bu fakt termodinamik potentsiallarni topish va amaliyotda, amaliy hisob-kitoblarda foydalanish metodologiyasini belgilaydi.
Masalan, matematik potentsial bo'lgan holat funksiyasini topamiz (shuning uchun nomi salohiyat ) o'zgaruvchilarga nisbatan S va P . Yuqorida ma'lum bo'ldiki, organizm tomonidan qabul qilingan issiqlik miqdori jarayonning shartlariga bog'liq. Amalda doimiy hajmli jarayonlar ( izoxorik , yopiq hajmda amalga oshiriladi) yoki doimiy bosimli jarayonlar ( izobarik Masalan, atmosfera bilan aloqa qiladigan qurilmalarda amalga oshiriladi). Agar jarayon izoxorik bo'lsa, u holda tanada yo'q mexanik ish ( dV =0 ), va munosabatdan ko'rinib turibdiki, olingan barcha issiqlik energiyani o'zgartirishga ketadi: dQ = dU . VdP
Bundan darhol kelib chiqadiki, jarayon doimiy bosim ostida amalga oshiriladi R va entropiya S , olingan issiqlik miqdori dH to'liq farq bor . Shuning uchun funktsiyaning o'zi H - entalpiya - o'zgaruvchilarga nisbatan istalgan termodinamik potentsialdir R va S .
Entalpiyalar va ichki energiyalarning mutlaq qiymatlarini termodinamik usullar bilan topish mumkin emas, faqat ularning o'zgarishini aniqlash mumkin. Shu bilan birga, kimyoviy reaksiyaga kirishuvchi tizimlarning termodinamik hisob-kitoblarida yagona sanoq sistemasidan foydalanish qulay. Bunday holda, entalpiya va ichki energiya munosabatlari bilan bog'liq bo'lganligi sababli, faqat bitta entalpiya uchun mos yozuvlar tizimini kiritish kifoya. Bundan tashqari, reaksiyaga kirishuvchi moddalarning fizik holatiga va XP ning paydo bo'lish shartlariga bog'liq bo'lgan kimyoviy reaksiyalarning issiqlik effektlarini solishtirish va tizimlashtirish uchun moddaning standart holati tushunchasi kiritilgan. Xalqaro toza va amaliy kimyo ittifoqining (IUPAC) termodinamika komissiyasining tavsiyasiga binoan 1975 y. standart holat quyidagicha aniqlanadi:
“Gazlar uchun standart holat 1 fizik atmosfera (101325 Pa) bosimdagi faraziy ideal gaz holatidir. Suyuqliklar uchun va qattiq moddalar standart holat - 1 fizik atmosfera bosimidagi sof suyuqlik yoki mos ravishda sof kristalli moddaning holati. Eritmalardagi moddalar uchun bir molyar eritmaning (1 kg erituvchida 1 mol modda) entalpiyasi cheksiz suyultirilganda eritmaning entalpiyasiga teng bo'ladigan gipotetik holat standart holat deb hisoblanadi. Moddalarning standart holatdagi xossalari 0 ustki belgisi bilan belgilanadi. (Sof modda - bir xil tuzilish zarralaridan (atomlar, molekulalar va boshqalar) tashkil topgan moddadir).
Bu ta'rif gaz va erigan moddaning gipotetik holatlariga taalluqlidir, chunki real sharoitda gazlarning holatlari idealdan ko'p yoki kamroq darajada, eritmalarning holatlari esa ideal eritmadan farq qiladi. Shuning uchun standart holatlardagi moddalarning termodinamik xossalarini real sharoitlarda qo`llashda bu xossalarning realdan chetlanishiga tuzatishlar kiritiladi. Agar bu og'ishlar kichik bo'lsa, unda tuzatishlar o'tkazib yuborilishi mumkin.
Qo'llanmalarda termodinamik miqdorlar odatda standart sharoitlarda beriladi: bosim R 0 =101325Pa va harorat T 0 =0K yoki T 0 \u003d 298,15K (25 0 C). Moddalarning umumiy entalpiyalari jadvallarini yaratishda ularning haroratdagi standart holati T 0 =0K yoki T 0 = 298,15K.
Moddalar, qaysiki toza kimyoviy elementlar eng barqaror bosqichda holati da R 0 \u003d 101325 Pa va entalpiyalarning mos yozuvlar nuqtasi harorati T 0, qiymatni oling entalpiya nolga teng: . (Masalan, tarkibidagi moddalar uchun gazsimon holat: C (grafit) va metallar (qattiq kristallar) uchun O 2, N 2, H 2, Cl 2, F 2 va boshqalar.
Uchun kimyoviy birikmalar (CO 2, H 2 O va boshqalar) va sof kimyoviy elementlar bo'lgan moddalar uchun eng barqaror holatda emas(O, N va boshqalar) entalpiya da R 0 =101325Pa va T 0 nolga teng emas: .






