Termal entropiya. Entropiya. Termodinamikaning ikkinchi qonuni. Issiqlik va sovutish mashinalari. Karno sikli va uning samaradorligi
Termodinamikaning asosiy jarayonlari:
· izoxorik, doimiy hajmda oqadigan;
· izobarik, da oqadi doimiy bosim;
· izotermik, da sodir bo'ladi doimiy harorat;
· adiabatik, bu bilan issiqlik almashinuvi sodir bo'ladi muhit yo'qolgan.
Izoxorik jarayon
Agar teskari mexanik jarayon, masalan, mayatnik harakati yoki bilyard to'plarining to'qnashuvi tasvirga tushirilsa va keyin takrorlansa, tasvir juda ishonarli ko'rinadi. Shu bilan birga, entropiyaning ko'tarilishi bilan birga bo'lgan qaytarib bo'lmaydigan jarayonlar shuni ko'rsatadiki, uchqunning yonishi, tirnoqning zanglashi bunday ko'rinishda mumkin emas. Shunday qilib, entropiya o'tmishni kelajakdan ajratish imkonini beradi.
Entropiya miqdorini ko'rsatadigan qurilma mavjud emas. Shu bilan birga, entropiya yoki uning o'zgarishini hisoblash mumkin. Bu erda bizda bir mol metan bo'lsa va u ikki mol kislorod bilan reaksiyaga kirishsa, biz bir mol karbonat angidrid va ikki mol suv hosil qilamiz. Ushbu videoda biz bu reaktsiya o'z-o'zidan paydo bo'ladimi degan savolga javob bermoqchimiz. Va oxirgi klipda biz bu savolga javob berish uchun Gibbsning erkin energiyasiga yoki aniqrog'i, Gibbs erkin energiyasining o'zgarishiga murojaat qilishimiz kerakligini bilib oldik.
Izoxorik jarayonda holat V= const.
Ideal gaz holati tenglamasidan ( pV = RT) quyidagicha:
p/ T = R/V= const,
ya'ni gaz bosimi unga to'g'ridan-to'g'ri proportsionaldir mutlaq harorat:
p2 / p1 = T2/T 1 .
Izoxorik jarayonda entropiyaning o'zgarishi quyidagi formula bilan aniqlanadi:
Va erkin energiyaning o'zgarishi reaktsiya entalpiyasining o'zgarishiga, u sodir bo'ladigan haroratga teng bo'ladi va hamma narsa entropiya o'zgarishiga ko'paytiriladi. Va agar u noldan kam bo'lsa, unda o'z-o'zidan reaktsiya paydo bo'ladi. Biz buni bir necha kliplar oldin qilganmiz. Siz faqat ushbu mahsulotlarning har biridan kelib chiqqan haroratni ko'rishingiz mumkin. Agar 2 oylik bo'lsa, suv uni 2 ga ko'paytiradi. Shunday qilib, biz ushbu mahsulotlardan issiqlik hosil qildik, biz boshqa reaktivlardan ham xuddi shunday olib tashlaymiz. Va bu bizda ekzotermik reaktsiya borligini ko'rsatadi.
Tenglamaning bu tomoni kamroq energiyani o'z ichiga oladi - biz qandaydir tarzda bu haqda o'ylashimiz mumkin - bu tomondan. Shuning uchun ozgina energiya chiqarilishi kerak. Chiqariladigan energiya bilan bir qatorda yozishimga ruxsat bering. Shuning uchun bu ekzotermik reaksiya. Ammo bizning savolimiz: o'z-o'zidanmi? Bu o'z-o'zidan yoki yo'qligini bilish uchun biz deltalarimizni topishimiz kerak. Va deltalarni topishga yordam berish uchun vaqt o'tishi bilan biz ushbu molekulalarning har biri uchun standart molyar entropiyani ko'rib chiqdik. Bu erda standart nol belgisini qo'shishdir - standart molyar entropiya - va "standart" 298 daraja Kelvinni bildiradi.
s 2 -s 1 = Δ s = Rezyume ln( p2/p 1 ) = Rezyume ln( T2/T 1 )
izobarik jarayon
Izobar jarayon - doimiy bosim ostida sodir bo'ladigan jarayon. p= const.
Ideal gazning holat tenglamasidan quyidagicha:
V/T = R/p= const.
Entropiyaning o'zgarishi quyidagicha bo'ladi:
s 2 – s 1 = Δ s = cp ln( T 2 / T 1 ).
Aslida, Kelvin darajalari haqida gapirishga hojat yo'q. Bu 298 Kelvin, Kelvin haqida gapirganda, bu erda "daraja" so'zini ishlatishingiz shart emas. Demak, bu 298 kelvin, ya'ni 25 daraja Selsiy, shuning uchun xona harorati. Shuning uchun u standart harorat deb hisoblanadi. Shunday qilib, agar bizda 1 mol metan bo'lsa, bizda 186 joul Kelvin entropiyasi bor. Shunday qilib, bu reaksiyaning entropiyasining umumiy o'zgarishi umumiy farqdir standart entropiya mahsulotlar va reaktivlarning umumiy standart entropiyasi.
Izotermik jarayon
Da izotermik jarayon ishchi suyuqlikning harorati doimiy bo'lib qoladi T= const, shuning uchun:
pV = RT= const
Entropiyaning o'zgarishi quyidagicha:
s 2 -s 1 = Δ s = R ln( p1/p 2 ) = R ln( V2/V 1 ).
adiabatik jarayon
Adiabatik jarayon - bu atrof-muhit bilan issiqlik almashinuvisiz sodir bo'ladigan gaz holatining o'zgarishi ( Q = 0).
Entalpiya bilan ham xuddi shunday qildik. Va biz buni allaqachon ko'rganimiz sababli, bu raqam bu raqamga yaqin, ammo bu juda ko'p. Toza suv ancha past - bu toza suvning entropiyasi. U kislorod gaziga qaraganda ancha past entropiyaga ega. Suyuqlik hosil bo'lganligi sababli, juda kam holatlar mavjud. Barcha suyuqlik idishning tubiga tushadi, go'yo u shakllanib, kengayadi. Boshqacha qilib aytganda, bitta gaz suyuqlikdan ancha yuqori entropiyaga ega bo'ladi. Bunga qarab, mahsulotimiz reaktivlarga qaraganda pastroq entropiyaga ega bo'lishini allaqachon ko'rishimiz mumkin.
Egri chiziqli tenglama adiabatik jarayon(adiabatika) ichida p-V diagramma quyidagicha ko'rinadi:
pV k= const.
Ushbu ifodada k deyiladi adiabatik ko'rsatkich(Puasson nisbati ham deyiladi).
Entropiyaning o'zgarishi quyidagicha:
Δ S = S 2 – S 1 = 0, bular.S 2 = S 1 .
Va, ehtimol, salbiy raqam bo'ladi. Endi bu birliklar sizga mantiqiy bo'lmasligi mumkin va siz haqiqatan ham ular an'anaviy birliklar ekanligini bilasiz. Lekin aytishimiz mumkinki, hay, bu qiyinlashmoqda. Va qandaydir ma'no bor, chunki bir tonna gaz bor. Bizda 3 ta alohida molekula bor, 1 tasi bu yerda va 2 ta kislorod molekulasi. Va yana biz 3 ta molekulaga boramiz, lekin endi suv aniq. Va bu, mening fikrimcha, entropiyani yo'qotishda mantiqiy. Suyuqlik, birinchi navbatda, bo'lishi mumkin bo'lgan bir nechta shartlar mavjud.
Ammo keling, bu reaktsiya o'z-o'zidan paydo bo'ladimi, bilib olaylik. Bunchalik aniq bo'lishimiz shart emas. Biz xona haroratida yoki 298 daraja Kelvindamiz deb taxmin qilamiz. Bu entropiya o'zgarishidan 25 daraja Selsiyga teng. Bu minus bo'ladi. Endi biz aytishimiz mumkinki, minus 242, biz uni u erga qo'yishni xohlaymiz. Lekin biz juda, juda, juda ehtiyot bo'lishimiz kerak. Va agar biz hamma narsani yozganimizdan keyin kilojoulda yozmoqchi bo'lsak, keling, kilojoulda yozamiz.
Fazali o'tishlar
Qaytariladigan fazali o'tishda harorat doimiy bo'lib qoladi va issiqlik fazali o'tish doimiy bosimda H fp, shuning uchun entropiyaning o'zgarishi:
 .
.
Erish va qaynatish jarayonida issiqlik so'riladi, shuning uchun bu jarayonlarda entropiya oshadi: S tv< S va< S d) Bunda muhit entropiyasi qiymatga kamayadi S f.p. , shuning uchun koinot entropiyasining o'zgarishi izolyatsiya qilingan tizimda qaytariladigan jarayon uchun kutilganidek 0 ga teng.
Shunday qilib, bizning Gibbs bo'sh energiyamiz bu erda minus 890 kilojoul minus 290 bo'ladi, ulardan minus bu erda va yana bir minus ortiqcha ortiqcha. Va bu mantiqiy - entropiya Gibbs energiyasini yanada ijobiy qiladi. Biz bilganimizdek, biz uni 0 dan pastga tushirmoqchi bo'lganimizda, u o'z-o'zidan kurashadi. Ammo keling, haqiqiy entalpiya, uning ekzotermik tabiatidan oshib ketishi mumkinligini bilib olaylik. Bu mumkin ko'rinadi, chunki biz kasrni bu bilan ko'paytiramiz va biz kamroq olamiz. Bu bizning entropiya o'zgarishi vaqtlari 298, harorat minus.
Va bu tushuncha bo'ladi - u erda minus qo'yadi - va plyus 72 bo'ladi. Bu standart haroratda entropiya. Biz allaqachon ko'rishimiz mumkinki, entalpiya musbat harorat atamasi entropiya o'zgarishiga qaraganda ancha salbiy sondir. Shunday qilib, bu safar g'olib. Garchi biz bu reaktsiyada entropiyani yo'qotsak ham, u shunchalik ko'p energiya chiqaradiki, u o'z-o'zidan bo'ladi. Bu, albatta, 0 dan kam, shuning uchun o'z-o'zidan reaktsiya bo'ladi. Ko'rib turganimizdek, bu Gibbs bo'sh energiya muammolari unchalik qiyin emas.
Termodinamikaning ikkinchi qonuni va "Koinotning issiqlik o'limi"
Klauzius termodinamikaning ikkinchi qonunini ko'rib chiqib, yopiq tizim sifatida koinotning entropiyasi maksimal darajaga intiladi va oxir-oqibat koinotdagi barcha makroskopik jarayonlar tugaydi, degan xulosaga keldi. Koinotning bu holati "termal o'lim" deb ataladi - global betartiblik, unda boshqa jarayon mumkin emas. Boshqa tomondan, Boltsmann koinotning hozirgi holati ulkan tebranish, degan fikrni bildirdi, bu koinot ko'pincha termodinamik muvozanat ("termal o'lim") holatida ekanligini anglatadi.
Siz shunchaki o'lchamlarni topishingiz kerak. Biz faqat barcha mahsulotlarning hosil bo'lish haroratiga qaraymiz, biz reagentlarni chiqaramiz va, albatta, imkoniyatlarni kutamiz. Va keyin, entropiya o'zgarishini topish uchun biz ham xuddi shunday qilamiz. Biz mahsulotlarning standart massa-molyar entropiyasini koeffitsientlar bo'yicha ko'rib chiqishimiz kerak, reaktivlarni olib tashlashimiz kerak va keyin uni bu erda almashtirishimiz kerak, shundan so'ng biz aslida oldik. erkin energiya Gibbs. Va bu holatda u salbiy edi. Endi biz ko'proq narsada bo'lgan vaziyatni tasavvur qilishimiz mumkin yuqori harorat.
Landauning fikriga ko'ra, bu qarama-qarshilikni hal qilishning kaliti umumiy nisbiylik sohasida yotadi: Olam o'zgaruvchan tortishish maydonidagi tizim bo'lgani uchun, entropiyaning o'sishi qonuni unga taalluqli emas.
Termodinamikaning ikkinchi qonuni (Klauziusning formulasida) koinot yopiq tizim degan farazga asoslanganligi sababli, bu qonunni boshqa turdagi tanqidlar ham mumkin. Zamonaviy jismoniy tushunchalarga ko'ra, biz faqat koinotning kuzatiladigan qismi haqida gapirishimiz mumkin. Bu bosqichda insoniyat koinot borligini isbotlash imkoniyatiga ega emas yopiq tizim, yoki aksincha.
Keyin birdan qiziqarli narsalar paydo bo'ladi. Shunday qilib, bu ijobiy atama bundan oshib ketadi va, ehtimol, juda, juda, juda, juda yuqori haroratga o'z-o'zidan javob bo'lmaydi. Va bu haqda boshqacha o'ylang. Ajraladigan haroratni hosil qiluvchi reaktsiya - chiqarilgan issiqlik - o'rtada allaqachon katta miqdorda issiqlik mavjud bo'lganda unchalik katta emas. kinetik energiya. Agar harorat etarlicha yuqori bo'lsa, bu reaktsiya o'z-o'zidan bo'lmaydi, chunki entropiya ehtimoli oshib ketadi.
Siz Internetda hamma narsani ko'rishingiz va o'z-o'zidan biror narsani o'rganishingiz mumkin. Ushbu qiymatlarning ikkita yoki uchtasini bir vaqtning o'zida o'zgartirish bilan, gaz jarayoni. Ideal gaz - bu fizik gazning modeli bo'lib, unda quyidagi taxminlar amalga oshiriladi. Haqiqiy gazlar xossalari bo'yicha xona haroratida va normalda ideal gazdan farq qilmaydi atmosfera bosimi. Farqlar juda past haroratlarda va atmosfera bosimidan yuzlab marta yuqori bosimlarda muhimdir.
Entropiyani o'lchash
Haqiqiy tajribalarda tizimning entropiyasini o'lchash juda qiyin. O'lchash usullari entropiyani termodinamik aniqlashga asoslangan va juda aniq kaloriyametriyani talab qiladi.
Oddiylik uchun biz o'rganamiz mexanik tizim, uning termodinamik holatlari uning hajmi orqali aniqlanadi V va bosim P. Muayyan holatning entropiyasini o'lchash uchun biz birinchi navbatda issiqlik sig'imini o'lchashimiz kerak doimiy hajm va bosim (belgilangan REZYUME va C P mos ravishda) dastlabki holat va kerakli holat o'rtasidagi muvaffaqiyatli holatlar to'plami uchun.
Bunday sharoitda uchta izomer, izotermik va izobarik bajarilishi mumkin. Izolyatsiya qonunlari ideal gaz modeli talablariga javob beradigan haqiqiy gazlarga nisbatan qo'llaniladi. Qonun birinchi marta britaniyalik Robert Boyl va fransuz Edme Marriot tomonidan kiritilgan. Izotermik jarayonda ma'lum miqdordagi gazning bosimi va hajmining mahsuloti doimiy qiymat. P-diagrammadagi jarayon grafigi izoterm deb ataladigan egri chiziqdir.
Qonun fransuz Jak Sharl tomonidan qabul qilingan. Izolyatsiya jarayonida bosimning haroratga nisbati doimiy bo'lib qoladi. P-diagrammadagi jarayon grafigi izoxora deb ataladigan to'g'ri chiziqdir. Animatsiya ikkita doimiy bosim jarayoni va ikkita doimiy hajm jarayonini o'z ichiga olgan tsiklni ko'rsatadi. To'rtburchakning gorizontal tomonlari to'g'ri chiziqlar - tasvirlar va vertikal tomonlari - to'g'ri chiziqlar - isochori. Gazlarning izokratik jarayondagi harakati shisha va gaz ballonlarini to'g'ridan-to'g'ri quyosh nurida qoldirishni taqiqlashni osongina tushuntiradi.
Issiqlik sig'imlari entropiya bilan bog'liq S va harorat bilan T formula bo'yicha:

subscript qayerda X doimiy hajm va bosimga ishora qiladi. Entropiya o'zgarishini olish uchun biz integratsiya qilishimiz mumkin:
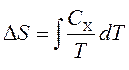
Qonun fransuz Jozef Gauss-Lyusak tomonidan chiqarilgan. O'zgartirilgan jarayonda hajmning haroratga nisbati doimiy bo'lib qoladi. P-diagrammadagi jarayon grafigi to'g'ri chiziq bo'lib, u tasvir deb ataladi. Boyl-Marriott, Charlz va Gey-Lyusak qonunlari faqat ideal gazdir. Ideal gaz modeli molekulalarning hajmi va o'zaro ta'sirini hisobga olmaydi.
Juda past haroratlarda haqiqiy gazlar suyultiriladi va ideal gaz qonunlari endi ularga taalluqli emas. Energiyaning qaytarilmas tarqalishining o'lchovi sifatida Klauzius entropiya atamasini kiritdi. Entropiya tizim holatining funktsiyasidir, ya'ni har bir holatda to'liq aniqlangan entropiya qiymatini solishtirish mumkin.
Shunday qilib, biz har qanday holatning entropiya qiymatini olishimiz mumkin ( P,V) dastlabki holatga nisbatan ( P 0 ,V 0). Aniq formula bizning oraliq holatlarni tanlashimizga bog'liq. Misol uchun, agar dastlabki holat yakuniy holat bilan bir xil bosimga ega bo'lsa, u holda
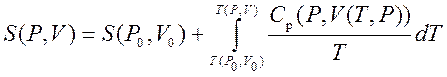 .
.
Masalan, qaytar jarayonlar uchun uning o'zgarishi quyidagicha ifodalanadi. entropiyaning o'zgarishi turli jarayonlar tizimlarda. Entropiya - bu ehtimollik yoki tartibsizlikning o'lchovidir jismoniy tizim. U mavjud bo'lgan tizimning tarkibiy elementlarining mumkin bo'lgan konfiguratsiyasi yoki joylashuvi sonini ifodalaydi umumiy shakl, shakli va jismoniy xususiyatlari, o'zgarmaydi.
Entropiya o'sishining jismoniy ma'nosi shundan iboratki, izolyatsiya qilingan zarrachali tizim zarracha harakatining eng kichik tartibidagi holatga o'tishi kerak. Bu tizim yoki termodinamik muvozanatning eng oddiy holati bo'lib, unda zarrachalarning harakati xaotikdir. Izolyatsiya qilingan tizimlarda energiyani aylantirish jarayonlarining qaytarilmas yo'nalishi ertami-kechmi energiyaning barcha turlarini issiqlikka aylantirishga olib keladi. U tarqoq bo'ladi va tizimning barcha elementlari orasida teng taqsimlanadi. Maksimal entropiya to'liq termodinamik muvozanatni anglatadi, atomlar va molekulalarning siljishi to'xtamaydi, tizimning ikkala qismi va atrof-muhit o'rtasida energiya almashinuvining uzilishi - statistik yoki termodinamik xaos mavjud.
Bundan tashqari, agar birinchi va oxirgi holatlar orasidagi yo'l har qanday birinchi darajali fazali o'tish orqali bo'lsa, yashirin issiqlik o'tish bilan bog'liqligini ham hisobga olish kerak.
Dastlabki holatning entropiyasi mustaqil ravishda aniqlanishi kerak. Ideal holda, tizim gaz shaklida mavjud bo'lgan juda yuqori haroratdagi holat sifatida dastlabki holat tanlanadi. Bu holatdagi entropiya klassik ideal gaznikiga o'xshaydi, shuningdek, molekulyar aylanishlar va tebranishlarning hissasi spektroskopik tarzda aniqlanishi mumkin.
Agar koinot yopiq bo'lsa, u issiq o'limni kutmoqda. Qadimgi yunonlar bu tartibsizlikdan kelib chiqqan deb da'vo qiladilar va klassik termodinamika faraziga ko'ra, u erga qaytadi. Agar koinot faqat xaosga aylangan bo'lsa, u qanday qilib paydo bo'lishi va hozirgi tuzilgan holatiga erishgan bo'lishi mumkin?
Klassik termodinamika, koinotning statsionar tabiati haqida hech kim savol bermagan davrda shakllangan. O'sha paytda termodinamika qonunlarining yagona soyasi Darvinning evolyutsiya nazariyasidan tashqariga tashlangan edi. Uning so‘zlariga ko‘ra, o‘simlik va hayvonot dunyosining rivojlanish jarayoni doimiy murakkablashuv, uyushganlik va tartibning o‘sishi bilan tavsiflanadi. Tirik tabiat termodinamik muvozanat va tartibsizlikka qarshi turadi. Shubhasiz, jonsiz va tirik tabiatning rivojlanish qonuniyatlari bir-biriga ziddir.
Nazariya laboratoriya ishi
Nazariy ma'lumotlar
Ushbu ishda fazaviy o'tish haroratini - qalayning erish nuqtasini o'lchash kerak, bu bizga entropiya o'sishini aniqlash imkonini beradi.
Chunki qaytar jarayonlar uchun entropiya ortishi d S=d Q/T, va tizimning holatdan o'tish davrida entropiyaning o'zgarishi a holatga b
 ,
,
u holda qalayning qizdirilishi va erishi paytidagi entropiyaning o'zgarishi eritish nuqtasiga qizdirilganda va qalayning erishi paytidagi entropiyaning o'zgarishi yig'indisi sifatida aniqlanadi:
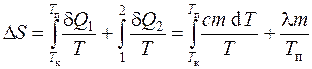 yoki
yoki
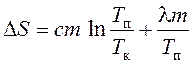 , (10)
, (10)
qaerda d Q haroratda tizimga uzatiladigan cheksiz kichik issiqlik miqdori T;
d Q 1 va d Q 2 - isitish vaqtida va eritish paytida qalay tomonidan qabul qilingan cheksiz miqdorda issiqlik;
T k - boshlang'ich (xona) harorati;
T n - erish harorati;
l \u003d 59 10 -3 J / kg - o'ziga xos issiqlik erish;
c = 0,23 10 -3 J/(kg K) – o'ziga xos issiqlik,
m = 0,20 kg qalayning massasi.
Termodinamikaning ikkinchi qonunining ba'zi formulalari
1. O'z-o'zidan qolgan har bir tizim o'rtacha maksimal ehtimollik bilan davlat yo'nalishi bo'yicha o'zgaradi (G. Lyuis).
2. Maksimal entropiyaga ega bo'lgan holat uchun eng barqaror holat izolyatsiya qilingan tizim(E. Fermi).
3. Har qanday real jarayon jarayonida unda ishtirok etuvchi tizimlarning har birini o`zining dastlabki holatiga qaytarish uchun vositalarni taqdim etib bo`lmaydi (H.Lyuis).
4. Har bir shaxs yoki kimyoviy jarayon tabiatda shunday boradiki, bu jarayonda ishtirok etuvchi barcha jismlar entropiyasi yig'indisi ortadi (M. Plank).
5. Issiqlikni sovuqroq jismdan issiqroq jismga o'z-o'zidan o'tkazish mumkin emas.
6. Axborotni qabul qilish - entropiyaning pasayishi (G. Lyuis).
7. Entropiya - vaqt o'qi* (A. Eddington).
Kimyoviy reaksiyalarda entropiyaning o'zgarishi
Undagi bir mol moddaning entropiyasi standart holat tegishli haroratda standart molyar entropiya deyiladi. Standart molyar entropiya S "belgisi bilan belgilanadi va JK-1 mol-1 o'lchamiga ega. 5.12-jadvalda 25 ° S haroratda bir qator elementlar va birikmalarning standart molyar entropiyalari ko'rsatilgan. E'tibor bering, standart molyar entropiya gazlar, qoida tariqasida, entropiyaga nisbatan ancha katta qiymatlarga ega qattiq moddalar. Har qanday belgilangan miqdordagi moddaning entropiyasi quyidagi ketma-ketlikda ortadi:
Qattiq = Suyuq = Gaz
Standart molyar entropiyalar ba'zan mutlaq entropiyalar deb ataladi. Ular uning erkin elementlaridan birikma hosil bo'lishi bilan birga keladigan entropiya o'zgarishlari emas. Shuni ham ta'kidlash kerakki, erkin elementlarning standart molyar entropiyalari (shaklida oddiy moddalar) nolga teng emas.
Termodinamikaning uchinchi qonuni mutlaq nol (O K) haroratda ideal ion kristalining entropiyasi nolga teng ekanligini ta’kidlaydi.
5.12-jadval. Standart molyar entropiyalar S°(298 K) (J/(K mol))
Standart molyar entropiyaning o'zgarishi kimyoviy reaksiya tenglama bilan aniqlanadi
Shuni ta'kidlash kerakki, ko'rib chiqilayotgan misolda entropiyaning o'zgarishi manfiy bo'lib chiqadi. Agar ko'rib chiqilayotgan reaksiya tenglamasiga ko'ra, gazsimon reaktivlarning umumiy miqdori 1,5 mol, gazsimon mahsulotlarning umumiy miqdori esa atigi 1 mol ekanligini hisobga olsak, buni kutish mumkin. Shunday qilib, reaktsiya natijasida gazlarning umumiy miqdori kamayadi. Shu bilan birga, biz yonish reaktsiyalari ekzotermik reaktsiyalar ekanligini bilamiz. Binobarin, ularning oqimining natijasi energiyaning tarqalishidir va bu bizni entropiyaning kamayishini emas, balki ko'payishini kutishga majbur qiladi. Bundan tashqari, shuni hisobga olish kerakki, vodorod gazining 25 ° C haroratda yonishi, dastlabki boshlash natijasida yuzaga kelgan, keyin o'z-o'zidan va katta intensivlik bilan davom etadi. Ammo termodinamikaning ikkinchi qonuni talab qilganidek, bu reaksiyadagi entropiya o‘zgarishi bu holatda ijobiy bo‘lishi kerak emasmi? Ma'lum bo'lishicha - yo'q yoki hech bo'lmaganda shart emas. Termodinamikaning ikkinchi qonuni o'z-o'zidan sodir bo'ladigan jarayon natijasida tizim va uning muhitining umumiy entropiyasining oshishini talab qiladi. Yuqorida hisoblangan entropiya o'zgarishi faqat ko'rib chiqilayotgan kimyoviy tizimni tavsiflaydi, u reaktivlar va vodorod gazining 25 ° C da yonishida ishtirok etadigan mahsulotlardan iborat. Ammo bu tizimning muhiti uchun entropiya o'zgarishini qanday hisoblash mumkin?






